Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 5, стр. 358-372
Ингибирование реакций эритроцитов на осмотический, аммонийный и окислительный стресс в условиях гипоксии
И. В. Миндукшев a, *, Ю. С. Судницына a, Е. А. Скверчинская a, А. Ю. Андреева a, И. А. Добрылко a, Е. Ю. Сенченкова a, А. И. Кривченко a, С. П. Гамбарян a
a Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, просп. Тореза, 44, Россия
* E-mail: iv_mindukshev@mail.ru
Поступила в редакцию 20.04.2019
После доработки 14.05.2019
Принята к публикации 16.05.2019
Аннотация
Гипоксические условия, помимо транспорта кислорода и углекислого газа, могут влиять и на другие функции эритроцитов, такие как ионная и метаболическая регуляция, развитие окислительного стресса, транспорт нитритов, аммиака, мочевины и других соединений. Используя методы лазерной дифракции, спектрометрии и проточной цитометрии, мы провели сравнительные исследования физиологически значимых реакций эритроцитов низших позвоночных и человека (регуляторное уменьшение объема, транспорт аммиака/аммония, ответ на окислительный стресс) в условиях нормоксии и гипоксии. В ответ на гипоосмотическую нагрузку эритроциты низших позвоночных после первичного набухания восстанавливают объем, инициируя реакцию регуляторного уменьшения объема (RVD). Мы показали, что в условиях гипоксии в эритроцитах Carassius carassius (золотой карась) и Rana temporaria (травяная лягушка) ингибируется реакция RVD, которая восстанавливается реоксигенацией. Транспорт аммиака/аммония в эритроцитах человека обусловлен функциональной взаимосвязью анионного (AE1) и аммонийного (RhAG) транспортеров. Показано, что гипоксия ингибирует лизис эритроцитов в аммонийной среде. Перевод гемоглобина из R- в T-форму в условиях гипоксии восстанавливает скорость гемолиза. Окислительный стресс приводит к ингибированию эстеразной активности, окислению гемоглобина (Hb) до ферри-форм (Fe(III) и Fe(IV)), экстернализации фосфатидилсерина, кластеризации AE1 и образованию микрочастиц, содержащих окисленные формы гемоглобина. В условиях окислительного стресса гипоксия предотвращает развитие гибели клеток по апоптозному сценарию, ингибируя экстернализацию фосфатидилсерина, кластеризацию AE1 и образование микрочастиц. Полученные результаты указывают на то, что конформация Hb играет важную роль в процессах регуляции объема эритроцитов уже у низших позвоночных. В эритроцитах человека конформация Hb определяет процессы транспорта CO2$\left( {{\text{HCO}}_{3}^{ - }} \right)$ и NH3$\left( {{\text{NH}}_{4}^{ + }} \right)$ посредством регуляции активности AE1. Гипоксические условия предотвращают гибель эритроцитов, предохраняя их от последствий окислительного стресса. Таким образом, гипоксические условия могут улучшать состояние эритроцитов при хранении крови, не нарушая энергетику эритроцитов, предотвращая образование микрочастиц и гемолиз.
ВВЕДЕНИЕ
Эритроциты играют ключевую роль в системном транспорте кислорода и углекислого газа за счет функционирования структурно-связанных белков, гемоглобина (Hb), анионного транспортера AE1 (белок полосы 3) и карбоангидразы (CAII) в условиях реализации эффектов Бора и Халдейна [1, 2]. Эритроциты реагируют на гипоксические условия посредством кислородзависимой регуляции метаболизма, которая включает конкурентное связывание дезоксигемоглобина (дезокси-Hb) и комплекса гликолитических ферментов с N-концевым цитозольным доменом анионного транспортера (cdAE1, cdb3) [3–6]. Такая реакция на гипоксию способствует формированию концепции аллостерической модуляции, раскрывающей механизм переключения метаболизма в эритроцитах при изменении кислородного режима. Высокая насыщенность кислородом приводит к ингибированию гликолиза (путь Эмбдена–Мейергофа) и активацию пентозофосфатного пути (синтез антиоксиданта NADP-Н) и наоборот [7–9]. Несмотря на значительные достижения в понимании регуляции метаболизма, ряд механизмов адаптации к гипоксии остается неисследованным как в эволюционном, так и клеточно-биологическом аспекте.
В отличие от эритроцитов человека и млекопитающих, эритроциты низших позвоночных содержат митохондрии и ядро, и выявленная регуляция метаболизма в полной мере не проявляется на этом уровне эволюции [10]. Эритроциты низших позвоночных, в отличие от эритроцитов млекопитающих, способны активно восстанавливать объем в реакциях регуляторного изменения объема (регуляторное снижение объема RVD и регуляторное увеличение объема RVI) [11, 12]. Активность транспортных путей ионной регуляции объема клеток модулируется различными физиологическими стимулами, среди которых наиболее существенными являются гормоны стресса и парциальное давление кислорода [13]. В эритроцитах низших позвоночных обнаружены кислородзависимые реакции объемной регуляции [10, 14], но всестороннего понимания механизмов такой зависимости нет.
Эритроциты, помимо функции транспорта кислорода, принимают участие в переносе других веществ (нитритов, фосфатов, хлоридов) и регуляции их содержания в крови [15–19]. Ранее мы показали активное участие эритроцитов в транспорте аммиака/аммония, обусловленное сопряженным функционированием анионного (AE1) и аммонийного (RhAG) транспортеров, что позволяет эритроцитам поддерживать физиологическую концентрацию аммиака/аммония в крови [20, 21]. Однако неясно, влияет ли изменение конформации Hb на транспортную функцию AE1, в том числе на взаимодействие с аммонийным транспортером эритроцитов RhAG.
Окислительный стресс (ОС) является основным фактором, индуцирующим трансформацию и последующую элиминацию эритроцитов [22–24]. Можно предположить, что в гипоксических условиях ОС должен развиваться интенсивнее в связи с переключением пентозофосфатного пути на гликолиз [5, 24] и торможением синтеза NADPН, необходимого для восстановления метгемоглобин-редуктазой окисленного Hb [25]. Однако возможно существование альтернативных механизмов влияния гипоксии на развитие ОС в эритроцитах.
В данной работе с помощью методов лазерной дифракции, спектрометрии и проточной цитометрии проведены сравнительные исследования физиологически значимых реакций эритроцитов низших позвоночных и человека (регуляторное уменьшение объема, транспорт аммиака/аммония, ответ на ОС) в условиях нормоксии и гипоксии. Мы показали, что в эритроцитах низших позвоночных гипоксические условия предотвращают реакцию RVD, а в эритроцитах человека ингибируется транспорт аммиака/аммония и образование микрочастиц при ОС.
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментах использованы следующие реактивы (конечная концентрация в клеточной суспензии или в рабочей среде): BCECF-AM, 5 мкМ (Molecular Рrobes); кальцеин-AM, 0.1 мкМ (Molecular Рrobes); аннексин-V-FITC, 0.1 мкг/мл (Biolegend); эозин-5-малеимид, 0.05 мг/мл (Molecular Рrobes); трет-бутилгидропероксид, 1.5 мМ (Sigma–Aldrich); нигерицин, 20 мкМ (Sigma–Aldrich), нитропруссид натрия (sodium nitroferri-cyanide (III) dihydrate, SNP), 10 мкМ, (Sigma–Aldrich).
Для эритроцитов Carassius carassius использовали среду следующего состава (в мМ): NaCl, 128; KCl, 3; CaCl2, 1.5; MgCl2, 1.5; HEPES, 15; D-глюкоза, 2.2 (рН 7.8, осмолярность 260 мОсм/л) [26]. Для эритроцитов Rana temporaria (в мМ): NaCl, 102; KCl, 3; MgCl2, 1.5; HEPES, 10; D-глюкоза, 2.2 (рН 7.6, осмолярность 220 мОсм/л) [27].
Для работы с эритроцитами человека были использованы: среда №1 (в мМ: NaCl, 140; KCl, 5; Hepes, 10; MgCl2, 2; D-глюкоза, 5; EGTA, 2; рН 7.4, осмолярность 300 мОсм/л) и среда № 2 (в мМ: NH4Cl, 140; KCl, 5; HEPES, 10; MgCl2, 2; D‑глюкоза, 5; pH 7.4, осмолярность 300 мОсм/л) при аммонийной нагрузке. Осмолярность среды контролировали осмометром Osmomat 030 (Gonotec, Германия).
Подготовка суспензии эритроцитов. Использовали взрослых особей золотого карася C. carassius, (n = 12) и травяной лягушки R. temporaria, (n = 10) обоих полов. Кровь отбирали из хвостовой вены (С. carassius) или пункцией сердца (R. temporaria) гепаринизированным шприцем. Далее кровь разбавляли соответствующей средой и проводили троекратную отмывку центрифугированием (центрифуга CM-50, Elmi, Латвия; 500 g, 5 мин).
В исследовании влияния конформации Hb на транспорт аммония/аммиака и образование микрочастиц эритроцитов человека использовали кровь здоровых доноров после подписания ими добровольного согласия. Проведение всех процедур одобрено этическим комитетом ИЭФБ РАН (протокол № 15 от 21.11.2017) и соответствовало Хельсинкской декларации. Цельную венозную кровь центрифугировали (350 g, 3 мин), отбирали эритроциты и промывали изотоническим буфером (среда № 1).
Основные параметры крови и суспензии эритроцитов (концентрация эритроцитов – RBC и средний объем эритроцитов – MCV) определяли с помощью гематологического анализатора Medonic-M20 (Boule Medical A.B., Швеция).
Исследование объемных характеристик эритроцитов. Изменение объема клеток (MCV) и начальной скорости увеличения их объема (Vi) оценивали методом лазерной дифракции на анализаторе частиц LaSca-TM (БиоМедСистем, РФ) [28–30]. Для исследования изменения начальной скорости увеличения объема клеток (Vi), использовали данные регистрации прямого светорассеяния в диапазоне угла 1°. Динамику изменения объема клеток оценивали с использованием алгоритма определения размеров частиц [30]. Изменение объема клеток дополнительно регистрировали с помощью проточного цитофлуориметра Navios (Beckman Coulter, США; прибор ЦКП ИЭФБ РАН) в экспериментах по исследованию pHi по данным прямого светорассеяния (параметр FS INT LIN). Для контроля определения абсолютных значений среднего объема клеток в качестве вводного значения для расчета использовали данные гематологического анализатора (Medonic-M20).
Спектрометрия. Спектр гемоглобинов регистрировали с помощью сканирующего спектрофотометра СПЕКС ССП-715-М (ООО “Спектроскопические системы”), диапазон от 400 до 700 нм, шаг длины волны 0.1 нм (щель 0.8), режим термостатирования кюветы. Отмытые эритроциты (106 кл/мл) вносили в изотонический буфер (среда №1, 25°С, 37°С) и регистрировали спектры Hb цельных клеток. Свободный гемоглобин получали при лизисе клеток в гипоосмотической среде.
Связывание лигандов гемоглобином. Для получения спектров окси-Hb использовали эритроциты (106 кл/мл) в условиях нормоксии, затем, для вытеснения кислорода, суспензию барботировали аргоном (15 мин), запечатывали кювету герметизирующей пленкой (Parafilm-M) и снимали спектры в условиях гипоксии (дезокси-Hb). Для получения спектра NO-Hb в гипоксическую суспензию вносили донор NO – нитропруссид натрия (SNP), 10 мкМ.
Гипоксия. Гипоксию создавали дегазированием суспензии аргоном в течение 15 мин. Содержание кислорода контролировали с помощью кислородного датчика mini-Oksik 3 (“Аналитика-Сервис”) в гипоксической камере (Billups Rothenberg), спектры Hb контролировали в диапазоне сканирования 300–700 нм. Во время измерения спектров кювету запечатывали герметизирующей пленкой для сохранения гипоксических условий.
Количественная оценка форм гемоглобина. Количественную оценку трансформированных форм Hb проводили на основании спектров после лизиса клеток. Процентное содержание форм гемоглобина рассчитывали с использованием значений оптической плотности анализируемого раствора при четырех длинах волн (560, 577, 630, 700 нм). Расчет проводили в соответствии с методом Benesch и соавт. [31].
Измерение внутриклеточного pH (pHi). Клетки нагружали флуорофором BCECF-AM в соответствии с протоколом производителя. Отмытые клетки (106 кл/мл) инкубировали c BCECF-AM (5 мкМ, 30 мин, 37°С, 300 об/мин). Далее 3 раза отмывали средой № 1 и хранили при 4°С (для предотвращения выхода красителя из эритроцитов) до проведения эксперимента. Флуоресценцию измеряли методом проточной цитофлуориметрии. Флуоресценцию BCECF возбуждали при 488 нм, регистрировали на FL1 (530/40 нм) и FL3 (613/20 нм). Изменение pHi оценивали по параметру RATIO FL1/FL3. Эксперименты проводили при 25°С. Параметр RATIO (FL1/FL3) отражает динамику изменений pHi независимо от возможного выхода красителя из клетки, фотообесцвечивания и изменений клеточного объема. Для калибровки значений внутриклеточного pH использовали “нигерициновый метод”. Эритроциты, предварительно окрашенные 5 мкМ BCECF-AM, вносили в изотонический калиевый буфер (KCl, 140; HEPES, 10; MgCl2, 1.5, D-глюкоза, 5; EGTA), содержащий 20 мкМ нигерицина (pH: 7.0, 7.2, 7.4, 7.6, 7.8, 25°С), инкубировали в течение 5 мин для установления равновесия [K+]in = [K+]out, после чего измеряли флуоресценцию флуорофора и строили калибровочную кривую зависимости флуоресценции от рН [32–36].
Определение экстернализации фосфатидилсерина на поверхности эритроцита. Аннексин-V является Ca2+-зависимым красителем, поэтому для аннексинового теста в среду №1 вместо EGТА добавляли кальций (2 мМ). Эритроциты (0.5 × 109 кл/л) инкубировали с аннексином-V (0.1 мкг/мл, 15 мин, 25°С), флуоресценцию регистрировали на канале FL1.
Исследование эстеразной активности. Эстеразную активность клеток оценивали по интенсивности флуоресценции кальцеина. Эритроциты (0.5 × 109 кл/л) инкубировали с кальцеином (0.1 мкМ, 60 мин, 37°С), флуоресценцию регистрировали на канале FL1.
Исследование кластеризации белка полосы 3. Участие цитоскелета в трансформации эритроцитов при ОС оценивали с использованием эозин-5-малеимида, EMA. Эритроциты (0.5 × 109 кл/л) инкубировали с ЕМА в среде №1 (1.5 мМ, 60 мин, 37°С), затем проводили анализ на проточном цитометре (FL1).
Анализ данных. Данные проточной цитометрии анализировали с использованием программ Flowing Software Perttu Terho и Cytometry List Mode Data Aquisition&Analysis Software.
Время гемолиза (Them), скорость гемолиза (Vhem) и начальную скорость увеличения объема клеток (Vi) рассчитывали с использованием оригинальной программы лазерного анализатора LaSca-TM – LaSca_32.exe.
Статистический анализ. Во всех экспериментах данные представлены как среднее ± стандартная ошибка. Статистическую значимость результатов определяли с помощью tкритерия Стьюдента. Различия между группами считали статистически значимыми при p < 0.05. В каждой серии экспериментов использовали не менее шести доноров.
РЕЗУЛЬТАТЫ
Регуляторное снижение объема эритроцитов низших позвоночных ингибируется в условиях гипоксии. Регуляция объема – неотъемлемое свойство ядерных клеток. Снижение осмолярности среды приводит к компенсаторному увеличению объема клеток за счет входа воды, которое обусловлено необходимостью выравнивания осмотического давления. После фазы увеличения объема активируются специфические ионные транспортеры, обеспечивающие восстановление исходного объема клеток (регуляторное снижение объема эритроцитов, RVD) [10, 37]. В эритроцитах позвоночных, за исключением птиц, реакция RVD осуществляется путем выхода из клетки К+ и Cl– через K+-Cl–-котранспортер [37], общим свойством которого является активация при гипоосмотическом увеличении объема и зависимость от концентрации кислорода [10]. В эритроцитах позвоночных деоксигенация ингибирует транспорт ионов через котранспортер. Подобная зависимость транспорта ионов от концентрации кислорода в среде предполагает возможность изменения характера протекания осмотических реакций клеток в условиях гипоксии. Неизвестно, является ли подобное свойство общим для позвоночных. Путь передачи сигнала об изменениях концентрации кислорода в среде на мембранные каналы эритроцитов недостаточно исследован. Наиболее вероятным кандидатом на роль переключателя метаболизма и транспорта ионов в эритроцитах млекопитающих при гипоксии считается мембраносвязанный гемоглобин, роль которого в регуляции осмотических реакций низших позвоночных недостаточно изучена [8].
В связи с этим в первой части нашей работы изучена реакция RVD эритроцитов R. temporaria и C. carassius при различных режимах (нормоксия, гипоксия и реоксигенация).
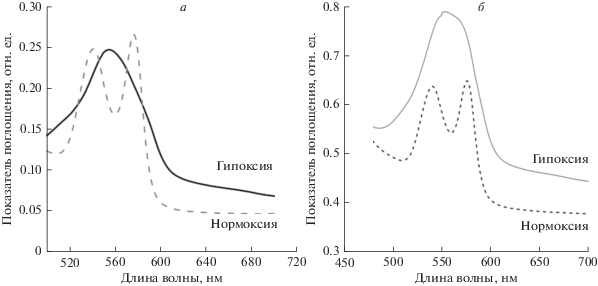
Для контроля состояния Hb определены спектры конформаций Hb R. temporaria (рис. 1а) и C. carassius (рис. 1б).
Рис. 1.
Спектры конформаций Hb эритроцитов R. temporaria (а) и C. carassius (б). а – Cпектр Hb эритроцитов R. temporaria в условиях нормоксии (окси-Hb) и гипоксии (дезокси-Hb); б – спектр Hb эритроцитов C. carassius в условиях нормоксии (окси-Hb) и гипоксии (дезокси-Hb).
Снижение осмолярности среды с 260 мOсм/л (физиологическая осмолярность) до 113 мOсм/л (гипоосмотический шок) инициировало увеличение объема оксигенированных эритроцитов C. carassius на 29%. После 5 мин инкубации клетки начинали восстанавливать свой исходный объем, осуществляя компенсаторное снижение объема, RVD (<1% различий), которое завершилось в течение 125 мин (рис. 2а). Разбавление инкубационной среды дистиллированной водой вызывало статистически значимое увеличение объема деоксигенированных клеток, аналогично эритроцитам, находящимся в условиях нормоксии. Однако дальнейшего изменения объема деоксигенированных клеток не происходило. В течение экспериментального периода объем эритроцитов оставался увеличенным, клетки не проявляли реакцию RVD. Естественное насыщение Hb кислородом (реоксигенация) инициировало процесс восстановления объема эритроцитов C. carassius. При этом динамика реакции RVD у реоксигенированных клеток была аналогичной эритроцитам, находящимся в условиях нормоксии.
Рис. 2.
RVD эритроцитов золотого карася и травяной лягушки ингибируется в условиях гипоксии. а – Запись кинетики изменения объема эритроцитов C. carassius в различных кислородных режимах (репрезентативный эксперимент). б – Процентное соотношение форм Hb в условиях нормоксии и гипоксии в эритроцитах C. carassius, полученное в результате обработки спектров. в – Кинетика изменения объема эритроцитов R. temporaria в различных кислородных режимах. г – Процентное соотношение форм Hb в условиях нормоксии и гипоксии в эритроцитах R. temporaria, полученное в результате обработки спектров. Измерение объема проводились на лазерном анализаторе микрочастиц по изменению интенсивности светорассеяния в 1°. Снижение сигнала соответствует уменьшению объема эритроцитов.
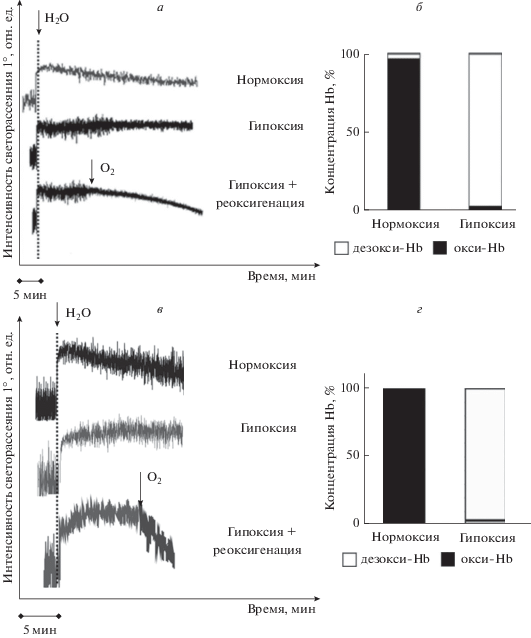
Вне зависимости от присутствия кислорода в среде эритроциты R. temporaria реагировали на снижение осмолярности среды (с 220 до 95 мOсм/л) быстрым увеличением объема до 122 ± 2% от контроля, принятого за 100%. Затем объем оксигенированных клеток снижался до 116.0 ± 7.4%. Полное восстановление объема эритроцитов наблюдалось спустя 1.5 ч. Подобная двухфазная реакция клеток в ответ на гипоосмотический шок – увеличение объема и постепенный возврат к исходным значениям – соответствует типичному протеканию реакции RVD. В условиях гипоксии фаза снижения объема клеток отсутствовала, объем эритроцитов R. temporaria оставался увеличенным. Реоксигенация суспензий инициировала реакцию RVD, в результате чего исходный объем эритроцитов полностью восстанавливался.
Аналогичные результаты получены на эритроцитах других представителей костистых рыб (карп и радужная форель) [12, 38]. Восстановление объема у гипоксических клеток было неполным, а насыщение суспензий кислородом приводило к инициации RVD. В настоящей работе динамика возврата эритроцитов C. carassius и R. temporaria к исходному объему совпадала. Таким образом, зависимость объемной регуляции от кислорода в среде, вероятно, является общим свойством эритроцитов низших позвоночных.
Деоксигемоглобин ингибирует транспорт аммония/аммиака в эритроцитах человека. Конформационное состояние Hb изменяется в зависимости от связываемого лиганда. Различают T- и R-формы Hb, при этом R-форма (лигандированный Hb, например, окси-Hb) практически не связывается с мембраной, однако при изменении конформации на T-форму (дезокси-Hb) Hb связывается с мембраной с высокой аффинностью через сайт прикрепления на cdAE1 [3, 4, 39]. Связывание Hb с cdAE1 предположительно снижает активность эритроцитарного анионного обменника [8]. Взаимодействие дезокси-Hb с cdAE1, по-видимому, меняет конформацию всего AE1, вытесняя ряд ферментов из 22–24 концевых остатков cdAE1 [3]. В результате конкуренции между Hb и гликолитическими ферментами за сайт связывания на cdAE1 энергетический метаболизм переключается между гликолитическим и пентозофосфатным путями [3, 5]. Это указывает на возможность регуляции гемоглобином свойств эритроцита посредством лиганд-зависимого взаимодействия с AE1 [3].
Таким образом, несмотря на имеющиеся данные о взаимодействии cdAE1 и дезокси-Hb, физиологическая роль данного процесса изучена не в полной мере. Остается неясным, влияет ли изменение конформации Hb на транспортную функцию AE1, в том числе на взаимодействие с аммонийным транспортером RhAG.
Ранее нами была показана функциональная взаимосвязь AE1 и RhAG [20, 21], что позволило применить тест на аммонийную нагрузку эритроцитов для оценки функции AE1. С этой целью оценивали параметры лизиса эритроцитов в изотонической аммонийной среде (среда № 2) [20], косвенно характеризующие транспорт аммиака/аммония (NH3/${\text{NH}}_{4}^{ + }$), осуществляемый сопряженным функционированием анионного AE1 и аммонийного RhAG транспортеров эритроцитов. В условиях гипоксии лигандирование гемоглобина NO способно переводить Hb из T- в R-форму [40]. В данной работе в гипоксических условиях Hb переводили из T-формы (связывающая cdAE1) в R-форму (не связывающая cdAE1) донором NO – SNP, 10 мкМ. Этот прием позволил оценить влияние конформации Hb (T- и R-формы) на функцию AE1 в условиях гипоксии.
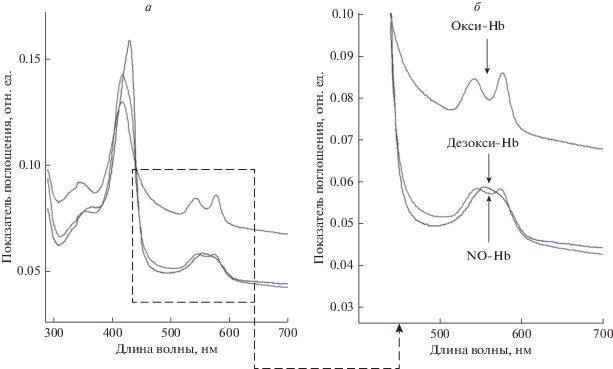
Предварительно проведен контроль состояний Hb спектроскопическим методом (рис. 3).
Рис. 3.
Спектры Hb эритроцитов человека. Эритроциты человека (106 кл/мл) вносили в изотонический буфер (среда № 1), снимали спектры Hb цельных клеток в условиях нормоксии (окси-Hb), затем суспензию барботировали аргоном (2 мин), закрывали кювету герметизирующей пленкой и снимали спектры в условиях гипоксии (дезокси-Hb). Для получения спектра NO-Hb, в эритроциты в условиях гипоксии вносили донор NO – нитропруссид натрия SNP, 10 мкМ.
Влияние гипоксических условий на гемолиз в аммонийной среде (аммонийный стресс) оценивали методами лазерной дифракции (рис. 4) и проточной цитометрии (рис. 5).
Рис. 4.
Гемолиз в изотонической аммонийной среде (140 мМ NH4Cl) ингибируется в гипоксических условиях (репрезентативный эксперимент на LaSca-TM, лазерная дифракция). Исследование проводили методом лазерной дифракции на Lasca-TM. Эритроциты (106 кл/мл) помещали в изотоническую аммонийную среду (среда № 2, pH 7.4). Опыт повторяли для трех конформаций Hb: в условиях нормоксии (окси-Hb, R-форма Hb), в условиях гипоксии (дезокси-Hb, T-форма Hb), в условиях гипоксии с добавлением SNP (NO-Hb, R-форма Hb).
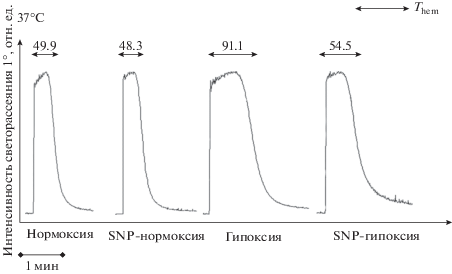
Рис. 5.
Гемолиз в изотонической аммонийной среде ингибируется в гипоксических условиях (метод проточной цитометрии). Исследование проводили на проточном цитометре в режиме TIME. Эритроциты (2 × 106 кл/мл), инкубированные с 5 мкМ BCECF-AM 30 мин, помещали в изотонический буфер (среда № 1, pH 7.4) – контроль, в изотоническую аммонийную среду (среда № 2, pH 7.4) – 140 мМ NH4Cl. Опыт повторяли для трех конформаций Hb: в условиях нормоксии (окси-Hb, R-форма Hb), в условиях гипоксии (дезокси-Hb, T-форма Hb), в условиях гипоксии с добавлением донора NO – SNP (NO-Hb, R-форма Hb). а – Изменение интенсивности прямого светорассеяния, отражающее изменение объема клеток; б – соотношение интенсивностей флуоресценции FL1/FL3, отражающее изменение pHi. а, б – Репрезентативный эксперимент на проточном цитометре; в, г – оцифровка данных приведенного эксперимента с помощью Cytometry List Mode Data Aquisition&Analysis Software; а, в – данные прямого светорассеяния отражающие изменение объема клеток; б, г – соотношение интенсивностей флуоресценции FL1/FL3, отражающее изменение pHi.
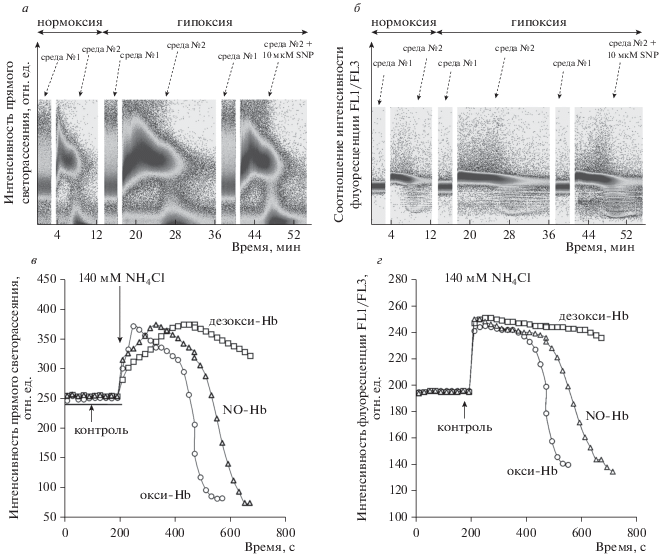
Скорость начального увеличения объема (Vi) эритроцитов, содержащих дезокси-Hb, была в 2.23 ± 0.25 (n = 8, p < 0.05) раза ниже, чем у эритроцитов, содержащих окси-Hb. При этом время гемолиза клеток в условиях гипоксии (эритроциты с дезокси-Hb) увеличивалось статистически значимо (в 2.31 ± 0.17 раза, n = 8, p < 0.05).
Образование NO-производных Hb не влияло существенно на кинетику гемолиза в условиях нормоксии, Vi, и время лизиса сохранялись на уровне контрольных значений. Перевод Hb в R-форму (NO-Hb) при гипоксии возвращал Vi на уровень, близкий к контролю (окси-Hb), при этом время гемолиза уменьшалось статистически значимо (в 1.25 ± 0.18 раза, n = 8, p < 0.05) (рис. 4).
Данные, полученные методом проточной цитометрии (рис. 5a, 5в), коррелировали с данными, полученными методом лазерной дифракции (рис. 4). Максимальное значение внутриклеточного pH эритроцитов составляло: при нормоксии – 7.35 ± 0.01 (n = 8), при гипоксии – 7.51 ± 0.02 (n = 8, p < 0.05) и при гипоксии с SNP – 7.40 ± 0.02 (n = 8, p < 0.05) (рис. 5б, 5г).
Таким образом, было выявлено, что транспорт NH3/${\text{NH}}_{4}^{ + }$ ингибировался в гипоксических условиях, в то время как изменение формы Hb с T- на R-форму в условиях гипоксии возвращало показатели кинетики транспорта NH3/${\text{NH}}_{4}^{ + }$ на уровень, близкий к контролю. Vi достоверно снижалась, а время лизиса клеток, содержащих дезокси-Hb, повышалось по сравнению с эритроцитами, содержащими окси-Hb. При этом в условиях гипоксии максимальный pHi в аммонийной среде достигал более высоких значений, чем в условиях нормоксии, что указывает на ингибирование одной из основных функций AE1 – контроля и поддержания внутриклеточного pH [33]. Перевод Hb из T-формы в R-форму с помощью NO-донора в условиях гипоксии приводил к возвращению параметров на уровень, близкий к контролю (рис. 4, 5). Полученные результаты указывают на ингибирование функции AE1 при взаимодействии дезокси-Hb с cdAE1 [8], приводящее к ингибированию транспорта NH3/${\text{NH}}_{4}^{ + }$ в эритроциты человека.
Индуцированное окислительным стрессом образование микрочастиц эритроцитов ингибируется в условиях гипоксии. ОС – один из важных факторов, ограничивающих срок хранения эритроцитов [24, 41]. ОС приводит к окислению Hb, образованию АФК, последующему окислению белков, липидов и полиненасыщенных жирных кислот. Эти факторы наравне с накоплением метаболитов приводят к нарушению деформируемости (из-за нарушения структуры и целостности мембраны и цитоскелета) и липидной асимметрии мембраны (выход фосфатидилсерина на поверхность мембраны), а также к образованию микрочастиц и последующему гемолизу [24]. В данной части работы мы сравнили развитие ОС в условиях нормоксии (окси-Hb) и гипоксии (дезокси-Hb).
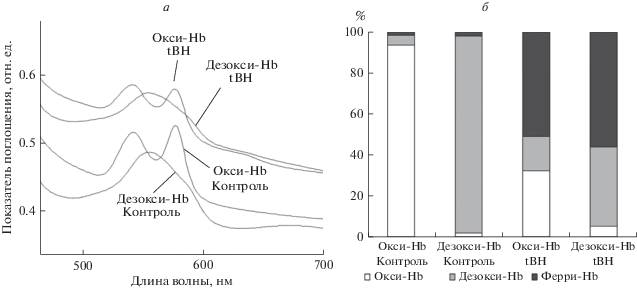
Предварительно был проведен спектральный анализ форм Hb в условиях нормоксии и гипоксии (окси-Hb, дезокси-Hb) и при ОС, индуцированном трет-бутил-гидропероксидом (tBH, 1.5 мМ) (окси-Hb – tBH, дезокси-Hb – tBH) (рис. 6а). В результате расчета содержания ферри-форм Hb (Fe(III), Fe(IV)) по методу Benesch и соавт. [31] было выявлено, что процент образования ферри-Hb при ОС в условиях нормоксии составляет 50.7 ± 13.9, n = 7 (окси-Hb – tBH) и в условиях гипоксии – 57.2 ± 12.6, n = 7 (дезокси-Hb – tBH) (рис. 6б).
Рис. 6.
Спектры Hb эритроцитов человека (а) и процентное содержание форм Hb (б) в условиях ОС. а – Эритроциты человека (1 × 106 кл/мл) вносили в изотонический буфер (среда № 1), снимали спектры Hb цельных клеток в условиях нормоксии (окси-Hb, контроль), затем суспензию барботировали аргоном (15 мин) и снимали спектры в условиях гипоксии (дезокси-Hb, контроль). Для получения спектра окси-Hb в условиях ОС, использовали эритроциты, обработанные 1.5 мМ tBH 3 ч. Для получения спектра дезокси-Hb в условиях ОС использовали эритроциты, содержащие дезокси-Hb, обработанные 1.5 мМ tBH в течение 3 ч; б – в условиях ОС выявлено равное процентное содержание ферри-форм Hb (рассчитано по методу Benesch и соавт. [29]), p < 0.4.
Развитие индуцированного ОС при действии tBH на эритроциты зависит как от концентрации пероксида, так и от концентрации эритроцитов. Воздействие tBH (1.5 мM) на суспензию эритроцитов (0.5 × 109 кл/мл) в условиях нормоксии (окси-Hb) приводило к: а) увеличению объема; б) окислению Hb до метгемоглобина MetHb (Fe(III)) (~50%) и гемихрома HbChr (Fe(IV)) (~35%); в) экстернализации фосфатидилсерина (процент аннексин-V-позитивных клеток ~60%); г) кластеризации полосы 3 (увеличение флуоресценции ЕМА) и д) образованию микрочастиц (0.4–0.9 мкм), содержащих окисленные формы Hb. Наибольший выход микрочастиц (30–60%) и трансформацию эритроцитов наблюдали через 24 ч после воздействия tBH (1.5 мM) в условиях нормоксии (рис. 7, контроль; рис. 8, контроль).
Рис. 7.
Гипоксические условия ингибируют образование микрочастиц эритроцитов при окислительном стрессе. Суспензию эритроцитов (0.5 × 109 кл/мл) инкубировали с 1.5 мМ tBH в течение 3, 6 и 24 ч. Показаны точечные диаграммы (dot-plots) для проб через 3, 6, 24 ч (данные репрезентативного эксперимента на проточном цитометре). *MPs – микрочастицы.
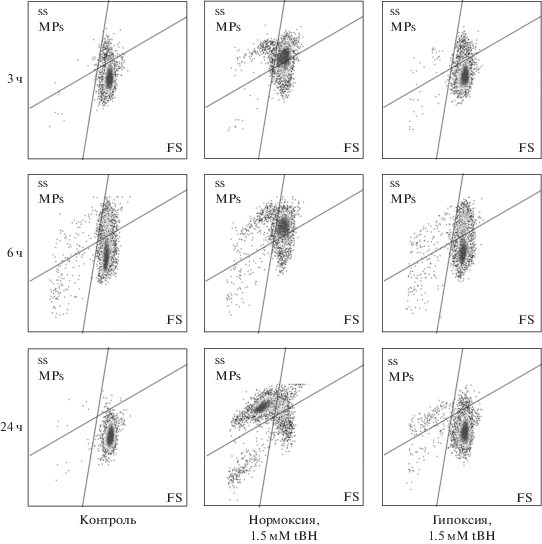
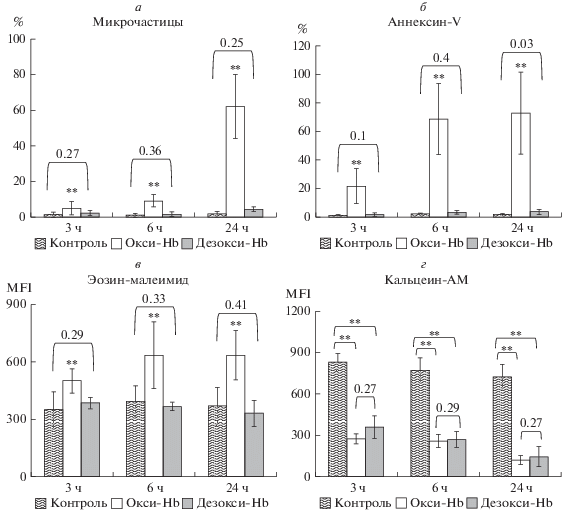
Рис. 8.
Маркерные события, предшествующие и/или приводящие к образованию микрочастиц, ингибируются в гипоксических условиях. Суспензию эритроцитов (0.5 × 109 кл/мл) инкубировали с 1.5 мМ tBH в условиях нормоксии (окси-tBH) и гипоксии (дезокси-tBH). В качестве контроля использовали интактные клетки. а – Образование микрочастиц эритроцитов при ОС значительно ингибировалось в условиях гипоксии; б – % аннексин-V-положительных клеток при окислительном стрессе в условиях нормоксии выше, чем при гипоксии; в – кластеризация AE1 при ОС в условиях нормоксии выше, чем при гипоксии; г – сходное ингибирование эстеразной активности в условиях окислительного стресса при гипоксии и нормоксии. ** p < 0.01 (t-критерий Стьюдента).
Таким образом, ОС вызывает структурные изменения эритроцитов с маркерными признаками апоптоз-подобного сценария клеточной гибели: ингибирование эстеразной активности, экстернализация фосфатидилсерина, образование микрочастиц (рис. 7, контроль; рис. 8, контроль).
Далее мы проверили, как влияют гипоксические условия (дезокси-Hb) на эти маркеры. Уже через 3 ч после добавления tBH (1.5 мМ) в суспензию эритроцитов (RBC 0.5 × 109 кл/мл) выявлено: а) уменьшение образования микрочастиц при гипоксии (процент образования микрочастиц): окси-Hb 7.55 ± 1.37, дезокси-Hb 2.81 ± 1.22, p < 0.04, n = 15 (рис. 8а); б) значительное уменьшение экстернализации фосфатидилсерина при гипоксии (% аннексин-V-позитивных клеток): окси-Hb 66.8 ± 18.2, дезокси-Hb 2.8 ± 1.2, p < 0.0001, n = 13 (рис. 2б); в) кластеризация AE1 при нормоксии и ее снижение при гипоксии (флуоресценция ЕМА): окси-Hb 609.2 ± 87.4, дезокси-Hb 320.1 ± 15.4, p < < 0.01, n = 12 (рис. 8в). В то же время ингибирование эстеразной активности при действии пероксида (кальцеин-AM) не зависело от состояния Hb: контроль 2687 ± 197, окси-Hb 1190 ± 247, дезокси-Hb 1102 ± 281 (рис. 2г).
Полученные результаты свидетельствуют о том, что индуцированная tBH трансформация эритроцитов и последующее образование микрочастиц ингибируются в условиях гипоксии.
Наши данные и работы других авторов [3, 4] указывают на то, что ингибирующий эффект гипоксических условий на ОС может быть связан с конкуренцией форм Hb за сайт связывания цитоплазматического домена анионного транспортера AE1. Нами показано, что формирование комплекса дезокси-Hb-cdAE1 может ингибировать кластеризацию AE1, индуцируемую окисленными формами Нb (Fe(IV)) и приводящую к образованию микрочастиц. Полученные результаты дополняют данные работ [3, 4, 23, 24, 42, 43] и указывают на то, что гипоксические (анаэробные) условия могут являться благоприятным фактором при хранении препаратов крови (концентраты эритроцитов), так как при этом не нарушается энергетика эритроцитов и предотвращается кластеризация AE1, образование микрочастиц и последующий гемолиз.
ОБСУЖДЕНИЕ
Понимание системных механизмов адаптации к гипоксии представляет сложную задачу, актуальную для большого количества исследователей и клиницистов. Эритроциты осуществляют основную функцию транспорта кислорода и должны рассматриваться как один из основных элементов адаптационной системы. Количество эритроцитов и их статус неизбежно рассматриваются как основной фактор устойчивости организма к гипоксии [44]. Гипоксические условия могут влиять на другие функции эритроцитов, не связанные с транспортом кислорода и углекислого газа, которые важны, в частности, для ионной и метаболической регуляции, развития ОС и транспорта таких соединений, как нитриты, аммиак, мочевина.
Среди возможных участников регуляции кислородзависимых процессов в эритроцитах значительное внимание уделяется гемоглобину. Известно, что эритроциты реагируют на гипоксию кислородзависимой регуляцией метаболизма, которая включает конкурентное связывание дезокси-Hb и ключевых гликолитических ферментов (фосфофруктокиназа – PFK, альдолаза – ALDO, глицеральдегид-3-фосфат-дегидрогеназа – GAPDH) с сайтом связывания cdAE1. Эти ферменты функционально ингибируются анионным транспортером AE1 при высоком насыщении кислородом, что приводит к гликолитической блокаде и сдвигу к NADPН-продуцирующему пентозофосфатному пути [7, 24, 45]. Однако роль конформации Hb в кислородзависимых изменениях объемной регуляции эритроцитов низших позвоночных остается неясной. Известно, что в эритроцитах человека сродство дезокси-Hb с мембраной эритроцита в 8 раз выше, чем у окси-Hb [46]. Эксперименты на трансгенных мышах свидетельствуют о том, что связывание дезокси-Hb с клеточной мембраной регулирует переключение метаболизма клеток на гликолиз при гипоксии [4, 44]. Показано также, что дефицит кислорода влияет на структурную организацию цитоскелета эритроцитов как человека, так и рыб [8, 23]. Вероятно, в эритроцитах низших позвоночных связывание Hb с мембраной эритроцита также играет роль переключателя активности мембранных транспортеров. В пользу данной гипотезы говорит высокая скорость инициации реакции RVD как у C. carassius, так и у R. temporaria при при реоксигенации эритроцитов, содержавшихся в условиях гипоксии. Известно, что цикл оксигенация–деоксигенация Hb – практически мгновенный процесс, в то время как иные возможные пути регуляции, к примеру, изменения в уровне экспрессии генов при дефиците кислорода, требуют более продолжительных периодов времени [47]. Таким образом, полученные результаты указывают на то, что конформация Hb играет важную роль в процессах регуляции клеточного объема уже у низших позвоночных.
Ранее [20, 21] мы показали, что эритроциты способны осуществлять импорт NH3/${\text{NH}}_{4}^{ + }$, предположительно предотвращая токсические эффекты при физических нагрузках и патологии, в состоянии гипераммониемии, т.е. при концентрации NH3/${\text{NH}}_{4}^{ + }$ в крови более 60 мкМ. Так как незаряженная молекула аммиака крайне цитотоксична, мы предположили, что сопряженное функционирование RhAG и AE1 может играть важную роль в сохранении оптимального уровня NH3/${\text{NH}}_{4}^{ + }$ в крови, обеспечивая захват и депонирование NH3/${\text{NH}}_{4}^{ + }$ внутри эритроцитов [21]. Тем не менее структурная и физиологическая роль взаимодействия RhAG и AE1-транспортеров в эритроцитах изучена не в полной мере. Нами исследовано влияние гипоксических условий (связывание cdAE1 дезокси-Hb) на транспорт NH3/${\text{NH}}_{4}^{ + }$ в эритроцитах человека. Установлено, что в гипоксических условиях транспорт NH3/${\text{NH}}_{4}^{ + }$ подавлен по сравнению с условиями нормоксии. Образование связи cdAE1-дезокси-Hb приводило к изменению регуляции внутриклеточного pH (рис. 5б, 5г), к ограничению транспортной функции AE1, что согласуется с данными [8, 44], и, как следствие, к ингибированию сопряженного транспорта, осуществляемого аммонийным RhAG и анионным AE1-транспортерами (рис. 5а, 5в). Эти данные указывают на важность синергизма процессов транспорта CO2 и NH3. Таким образом, нами установлено, что конформация Hb определяет процессы транспорта CO2 (${\text{HCO}}_{3}^{ - }$) и NH3 (${\text{NH}}_{4}^{ + }$) посредством регуляции активности AE1.
Окислительный стресс напрямую связан с проблемами хранения компонентов крови [24]. При долговременном хранении концентратов эритроцитов в аэробных условиях увеличивается образование окисленных форм Hb (мет-Hb, гемихром), что может приводить к различным осложнениям у реципиентов при переливании крови [41]. В нашей модели ОС процент окисления Hb до ферри-форм (рис. 7) и ингибирование эстеразной активности (рис. 8г) при нормоксии и гипоксии практически не различались. Полученные результаты указывают на то, что гипоксические условия не влияют на первичное окислительное действие tBH. Тем удивительней, что в гипоксических условиях замедлена как экстернализация фосфатидилсерина и гибель клеток по апоптозному сценарию (рис. 8б), так и образование микрочастиц (рис. 8а), обусловленное кластеризацией анионного транспортера AE1 (рис. 8в). Можно предположить, что ингибирующий эффект гипоксии связан с конкуренцией форм Hb за сайт связывания цитоплазматического домена анионного транспортера AE1 (cdAE1). Связанная структура дезокси-Hb-cdAE1 может ингибировать кластеризацию AE1, индуцируемую окисленными формами гемоглобина Fe(IV) и Fe(V) и приводящую к образованию микрочастиц. Полученные результаты указывают на то, что гипоксические условия могут благоприятно влиять на хранение крови. Действительно, группой Yoshida предложен и запатентован [24] метод массовой деоксигенации концентратов эритроцитов и показано, что при анаэробном хранении эритроцитов гемолиз ниже, чем в аэробных условиях, а также лучше сохраняется морфология клеток, снижена осмотическая резистентность и подавлено образование микрочастиц [23]. Метаболомные исследования частично подтвердили положительное влияние гипоксии на сохранение уровня ATP и 2,3-ДФГ, несмотря на уменьшение уровня восстановленного глутатиона (снижение синтеза NADPH при блокаде пентозофосфатного пути).
При хранении эритроцитов в гипоксических условиях увеличено восстановление нитрита до нитрата, которое ассоциировано с образованием мет-Hb [23]. Обсуждается способность эритроцитов продуцировать NO в условиях гипоксии (нитрит-редуктазная активность Hb в дезокси-форме). Активно продвигается гипотеза, согласно которой эритроциты являются одним из важнейших элементов транспортировки NO внутри организма [19]. Однако проведенные нами ранее исследования показали, что эритроциты способны только захватывать NO (с последующим образованием нитритов и нитратов), но ни при каких физиологических условиях (гипоксия, гипоксия–нормоксия) не способны продуцировать NO [48].
ЗАКЛЮЧЕНИЕ
Таким образом, полученные нами данные позволяют рассматривать эритроциты как сенсоры кислорода в системе крови. Изучение новых функций, связанных с окислительным стрессом, транспортом аммонийных форм, ионной регуляцией может оказаться ключевым для понимания того, что изменение функциональных характеристик эритроцитов может кардинально изменить общесистемный ответ на гипоксические условия и выявить еще неизвестные адаптационные механизмы.
Исследования методом проточной цитометрии выполнены на базе ЦКП ИЭФБ РАН. Работа поддержана средствами государственного бюджета по госзаданию (№ г.р. АААА-А18-118012290371-3.).
Список литературы
Mohandas N., Gallagher P.G. 2008. Red cell membrane: Past, present, and future. Blood. 112, 3939–3948.
Lux S.E. 4th. 2016. Anatomy of the red cell membrane skeleton: Unanswered questions. Blood. 127 (2), 187–199.
Chu H., Breite A., Ciraolo P., Franco R.S., Low P.S. 2008. Characterization of the deoxyhemoglobin binding site on human erythrocyte band 3: Implications for O2 regulation of erythrocyte properties. Blood. 111 (2), 932–938.
Chu H., McKenna M.M., Krump N.A., Zheng S., Mendelsohn L., Thein S.L., Garrett L.J., Bodine D.M., Low P.S. 2016. Reversible binding of hemoglobin to band 3 constitutes the molecular switch that mediates O2 regulation of erythrocyte properties. Blood. 128 (23), 2708–2716.
Welbourn E.M., Wilson M.T., Yusof A., Metodiev M.V., Cooper C.E. 2017. The mechanism of formation, structure and physiological relevance of covalent hemoglobin attachment to the erythrocyte membrane. Free Radic. Biol. Med. 103, 95–106.
Stefanovic M., Puchulu-Campanella E., Kodippili G., Low P.S. 2013. Oxygen regulates the band 3-ankyrin bridge in the human erythrocyte membrane. Biochem. J. 449 (1), 143–150.
D’Alessandro A., Nemkov T., Sun K., Liu H., Song A., Monte A.A., Subudhi A.W., Lovering A.T., Dvorkin D., Julian C.G., Kevil C.G., Kolluru G.K., Shiva S., Gladwin M.T., Xia Y., Hansen K.C., Roach R.C. 2016. AltitudeOmics: Red blood cell metabolic adaptation to high altitude hypoxia. J. Proteome Res. 15 (10), 3883–3895.
Barvitenko N.N., Adragna N.C., Weber R.E. 2005. Erythrocyte signal transduction pathways, their oxygenation dependence and functional significance. Cell. Physiol. Biochem. 15 (1–4), 1–18.
Campanella M.E., Chu H., Low P.S. 2005. Assembly and regulation of a glycolytic enzyme complex on the human erythrocyte membrane. Proc. Natl. Acad. Sci. USA. 102, 2402–2407.
Gibson J.S., Cossins A.R., Ellory J.C. 2000. Oxygen-sensitive membrane transporters in vertebrate red cells. J. Exp. Biol. 203, 1395–1407.
Andreyeva A.Y., Soldatov A.A., Mukhanov V.S. 2017. The influence of acute hypoxia on the functional and morphological state of the black scorpionfish red blood cells. In Vitro Cell. Dev. Biol.-Animal. 53, 312–319.
Jensen F. 1995. Regulatory volume decrease in carp red blood cells: Mechanisms and oxygenation-dependency of volume-activated potassium and amino acid transport. J. Exp. Biol. 198, 155–165.
Nikinmaa M., Jensen F.B. 1992. Inhibition of adrenergic proton extrusion in rainbow trout red cells by nitrite-induced methaemoglobinaemia. J. Comp. Physiol. B. 162, 424–429.
Andreyeva A.Y., Skverchinskaya E.A., Gambaryan S., Soldatov A.A., Mindukshev I.V. 2018. Hypoxia inhibits the regulatory volume decrease in red blood cells of common frog (Rana temporaria). Comp. Biochem. Physiol. A Mol. Integr. Physiol. 219–220, 44–47.
Vitturi D.A., Teng X., Toledo J.C., Matalon S., Lancaster J.R. Jr., Patel R.P. 2009. Regulation of nitrite transport in red blood cells by hemoglobin oxygen fractional saturation. Am. J. Physiol. Heart Circ. Physiol. 296 (5), H1398–H407.
Helms C., Kim-Shapiro D.B. 2013. Hemoglobin-mediated nitric oxide signaling. Free Radic. Biol. Med. 61, 464–472.
Brahm J. 2013. The permeability of red blood cells to chloride, urea and water. J. Exper. Biol. 216, 2238–2246.
Schnell K.F., Besl E., von der Mosel R. 1981. Phosphate transport in human red blood cells: Concentration dependence and pH dependence of the unidirectional phosphate flux at equilibrium conditions. J. Membr. Biol. 61 (3), 173–192.
Kim-Shapiro D.B., Gladwin M.T. 2014. Mechanisms of nitrite bioactivation. Nitric Oxide. 38, 58–68.
Судницына Ю.С., Скверчинская Е.А., Добрылко И.А., Никитина Е.Р., Кривченко А.И., Гамбарян С.П., Миндукшев И.В. 2016. Функциональная взаимосвязь аммонийного (RhAG) и анионного (AE1) транспортеров эритроцитов человека. Биол. мембраны. 33 (5), 363–373.
Судницына Ю.С., Гамбарян С.П., Кривченко А.И., Миндукшев И.В. 2018. Импорт аммиака/аммония в эритроциты человека. Биол. мембраны. 35 (4), 398–402.
D’Alessandro A., Kriebardis A.G., Rinalducci S., Antonelou M.H., Hansen K.C., Papassideri I.S., Zolla L. 2015. An update on red blood cell storage lesions, as gleaned through biochemistry and omics technologies. Transfusion. 55 (1), 205–219.
Zolla L., D’alessandro A., Rinalducci S., D’amici G.M., Pupella S., Vaglio S., Grazzini G. 2015. Classic and alternative red blood cell storage strategies: Seven years of “-omics” investigations. Blood Transfus. 13 (1), 21–31.
Yoshida T., Prudent M., D’Alessandro A. 2019. Red blood cell storage lesion: Causes and potential clinical consequences. Blood Transfus. 17 (1), 27–52.
Arashiki N., Kimata N., Manno S., Mohandas N., Takakuwa Yu. 2013. Membrane peroxidation and methemoglobin formation are both necessary for Band 3 clustering: Mechanistic insights into human erythrocyte senescence. Biochemistry. 52, 5760–5769.
Tiihonen K., Nikinmaa M. 1991. Short communication: Substrate utilization by carp (Cyprinus carpio) erythrocytes. J. Exp. Biol. 161, 509–514.
Agalakova N.I., Lapin A.V., Gusev G.P. 1997. Temperature effects on ion transport across the erythrocyte membrane of the frog Rana temporaria. Comp. Biochem. Physiol. A. 117 (3), 411–418.
Zinchenko V.P., Lee V.V., Berezhnov A.V., Mindukshev I.V., Jenkins R.O., Goncharov N.V. 2007. Application of a low-angle light scattering technique to cell volume and cell signaling studies on Ehrlich ascite tumor cells. Spectroscopy. 20, 45–55.
Mindukshev I.V., Krivoshlyk V.V., Ermolaeva E.E., Dobrylko I.A., Senchenkov E.V., Goncharov N.V., Jenkins R.O., Krivchenko A.I. 2007. Necrotic and apoptotic volume changes of red blood cells investigated by low-angle light scattering technique. J. Spectroscopy. 21, 105–120.
Миндукшев И.В., Кривошлык В.В., Добрылко И.А., Гончаров Н.В., Вивуланец Е.В., Кузнецов С.В., Кривченко А.И. 2010. Нарушение деформационных и транспортных характеристик эритроцитов при развитии у них апоптоза. Биол. мембраны. 27 (1), 28–38.
Benesch R.E., Benesch R., Yung S. 1973. Equations for the spectrophotometric analysis of hemoglobin mixtures. Anal. Biochem. 55 (1), 245–248.
Tsien R.Y. 1989. Fluorescent indicators of ion concentrations. Meth. Cell Biol. 30, 127–156.
Swietach P., Tiffert T., Mauritz J.M, Seear R., Esposito A., Kaminski C.F., Lew V.L., Vaughan-Jones R.D. 2010. Hydrogen ion dynamics in human red blood cells. J. Physiol. 588 (Pt 24), 4995–5014.
Bree K. Grillo-Hill, Bradley A. Webb, Diane L. Barber. 2014. Ratiometric Imaging of pH Probes. In: Quantitative Imaging in Cell Biology. 123. Eds. Waters J.C., Wittmann T. Burlington: Acad. Press, p. 429–448.
Musgrove E.A., Hedley D.W. 1990. Measurement of Intracellular pH. In: Methods in cell biology. Eds. Darzynkiewicz Z., Crissman H.A. San Diego: Acad. Press, p. 59–69.
Alonso A., Arrazola A., Garciandia A., Esparza N., Gómez-Alamillo C., Díez J. 1993. Erythrocyte anion exchanger activity and intracellular pH in essential hypertension. Hypertension. 22 (3), 348–356.
Adragna N.C., Di Fulvio M., Lauf P.K. 2004. Regulation of K-Cl cotransport: From function to genes. J. Membr. Biol. 201 (3), 109–137.
Garcia-Romeu F., Cossins A.R., Motais R. 1991. Cell volume regulation by trout erythrocytes: Characteristics of the transport systems activated by hypotonic swelling. J. Physiol. 440, 547–567.
Mihailescu M.R., Russu I.M. 2001. A signature of the T → R transition in human hemoglobin. Proc. Natl. Acad. Sci. USA. 98 (7), 3773–3777.
Stepuro T.L., Zinchuk V.V. 2006. Nitric oxide effect on the hemoglobin-oxygen affinity. J. Physiol. Pharmacol. 57 (1), 29–38.
Almac E., Bezemer R., Hilarius-Stokman P.M., Goedhart P., de Korte D., Verhoeven A.J., Ince C. 2014. Red blood cell storage increases hypoxia-induced nitric oxide bioavailability and methemoglobin formation in vitro and in vivo. Transfusion. 54 (12), 3178–3185.
Navarrete-Opazo A., Mitchell G.S. 2014. Therapeutic potential of intermittent hypoxia: A matter of dose. Am. J. Physiol. Regul. Integr. Comp. Physiol. 307 (10), R1181–R1197.
Tang F., Feng L., Li R., Wang W., Liu H., Yang Q., Ge R.L. 2018. Inhibition of Suicidal Erythrocyte Death by Chronic Hypoxia. High Alt. Med. Biol. https://doi.org/10.1089/ham.2017.0159
D’Alessandro A., Culp-Hill R., Reisz J.A., Anderson M., Fu X., Nemkov T., Gehrke S., Zheng C., Kanias T., Guo Y., Page G., Gladwin M.T., Kleinman S., Lanteri M., Stone M., Busch M., Zimring J.C. 2019. Recipient Epidemiology and Donor Evaluation Study-III (REDS‑III). Heterogeneity of blood processing and storage additives in different centers impacts stored red blood cell metabolism as much as storage time: Lessons from REDS-III-Omics. Transfusion. 59 (1), 89–100.
Rinalducci S., Marrocco C., Zolla L. 2015. Thiol-based regulation of glyceraldehyde-3-phosphate dehydrogenase in blood bank-stored red blood cells: A strategy to counteract oxidative stress. Transfusion. 55 (3), 499–506.
Walder J.A., Chatterjee R., Steck T.L., Low P.S., Musso G.F., Kaiser E.T., Rogers P.H., Arnone A. 1984. The interaction of hemoglobin with the cytoplasmic domain of Band 3 of the human erythrocyte membrane. J. Biol. Chem. 259, 10238–10246.
Berenbrink M., Völkel S., Koldkjaer P., Heisler N., Nikinmaa M. 2006. Two different oxygen sensors regulate oxygen-sensitive K+ transport in crucian carp red blood cells. J. Physiol. 575 (Pt 1), 37–48.
Gambaryan S., Subramanian H., Kehrer L., Mindukshev I., Sudnitsyna J., Reiss C., Rukoyatkina N., Friebe A., Sharina I., Martin E., Walter U. 2016. Erythrocytes do not activate purified and platelet soluble guanylate cyclases even in conditions favourable for NO synthesis. Cell. Commun. Signal. 14 (1), 16.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


