Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 6, стр. 417-427
Математическая модель переноса электронов и формирования активных форм кислорода в митохондриальном комплексе II
Н. И. Маркевич a, *, М. Х. Галимова a, Л. Н. Маркевич b
a Институт теоретической и экспериментальной биофизики РАН
142290 Московская обл., Пущино, ул. Институтская, 3, Россия
b Институт биофизики клетки РАН
142290 Московская обл., Пущино, ул. Институтская, 3, Россия
* E-mail: markevich.nick@gmail.com
Поступила в редакцию 11.04.2019
После доработки 08.05.2019
Принята к публикации 09.05.2019
Аннотация
Основная цель работы состояла в проведении количественного анализа кинетики образования активных форм кислорода (АФК) комплексом II дыхательной цепи митохондрий. Для этого была разработана математическая модель, которая будет использоваться при моделировании и экспериментальных исследованиях изменений в митохондриях, связанных с АФК-индуцируемой активацией сигнальных путей гибели клеток (апоптоз, некроз, некроптоз). На основе анализа опубликованных экспериментальных данных разработана кинетическая схема переноса электронов от сукцината на кофермент Q через ряд редокс-центров, локализованных в субкомплексах A, B, C, D комплекса II. Математическая модель, соответствующая кинетической схеме, представляет собой систему из 17 обыкновенных дифференциальных уравнений и описывает как концентрацию окисленных и восстановленных состояний различных переносчиков электронов, так и потоки электронов в комплексе II, приводящие к формированию АФК, супероксида (${\text{O}}_{2}^{{ \bullet - }}$) и гидропероксида (Н2О2). Результаты анализа математической модели показывают, что колоколообразная кинетика формирования АФК, наблюдаемая экспериментально в микромолярном диапазоне концентрации сукцината (от нескольких десятков до сотен микромолей сукцината) в присутствии ингибиторов комплекса III присуща только двум потенциально возможным генераторам АФК – восстановленному флавинадениндинуклеотиду (FADH2) и флавинадениндинуклеотид радикалу (FADH∙). При этом кинетика формирования АФК Fe-S-редокс-центрами комплекса II, также как и убихинон-связывающим центром, близка к сигмоидальной и, по-видимому, эти редокс-центры вносят незначительный вклад в общее производство АФК комплексом II при ингибировании комплекса III.
ВВЕДЕНИЕ
Дыхательный комплекс II внутренней мембраны митохондрий (ММ) служит связующим звеном между циклом трикарбоновых кислот (ЦТК) и электрон-транспортной цепью (ЭТЦ). Комплекс II, как часть ЦТК, окисляет сукцинат до фумарата (сукцинатдегидрогеназная (СДГ) активность комплекса II), далее электроны, произведенные этой реакцией, переносятся через цепь Fe-S-редокс-центров к пулу убихинона внутренней ММ (сукцинат-кофермент Q-редуктазная (СКР) активность комплекса II), обеспечивая таким образом убихинол (QH2) для дыхательной цепи в процессе окислительного фосфорилирования.
Комплекс II только недавно был признан важным регулятором гибели клеток [1, 2]. Дисфункция комплекса II может приводить к онкогенезу или апоптозу и некрозу/некроптозу в зависимости от физиологических условий или более точно от того, какая из активностей комплекса II, СДГ или СКР, нарушается. В частности, обнаружено [3], что СКР активность комплекса II может быть нарушена без влияния на СДГ-активность этого комплекса. Такая конфигурация комплекса II, т.е. ингибирование активности СКР при неизменной активности СДГ может приводить к сильному увеличению генерации активных форм кислорода (АФК), супероксида $\left( {{\text{O}}_{2}^{{ \bullet - }}} \right)$ и гидропероксида (Н2О2), этим комплексом, окислительному стрессу, и индуцировать активацию путей гибели клеток через открывание пор высокой проницаемости во внутренней MM, т.е. активировать процессы апоптоза или некроза/некроптоза [2].
Долгое время главными производителями АФК в дыхательной цепи считались комплексы I и III, а комплекс II производит пренебрежимо малое количество АФК по сравнению с этими комплексами [4, 5]. Однако ситуация кардинально изменилась после того, как обнаружили, что при ингибировании комплекса III комплекс II может производить ${\text{O}}_{2}^{{ \bullet - }}$/Н2О2 в значительных количествах, сравнимых и даже превышающих АФК в комплексах I и III, но только в микромолярном диапазоне концентраций сукцината, субстрата комплекса II, от приблизительно 50 до 500 мкM в экспериментах как на субмитохондриальных частицах (СМЧ), так и интактных митохондриях [6, 7].
Оказалось, что скорость образования ${\text{O}}_{2}^{{ \bullet - }}$/Н2О2, имеет колоколообразную зависимость от концентрации сукцината, характерную для реакций с субстратным угнетением, и очень мала при насыщающих концентрациях сукцината 2–5 мМ, которые обычно используют в экспериментах по измерению АФК в комплексе II. Для иллюстрации этого факта и большей наглядности цели нашей теоретической работы в Приложении приведен рисунок (рис. 1П) с экспериментально наблюдаемой немонотонной зависимостью скорости генерации АФК комплексом II от концентрации сукцината в СМЧ и интактных митохондриях, взятый из работы [6]. Использование высоких концентраций сукцината в ранних экспериментах по измерению генерации АФК комплексом II тем более удивительно, что оценочная концентрация сукцината в клетках на порядок меньше и лежит в диапазоне 0.2–0.5 мМ [8]. Таким образом, можно сказать, что именно использование высоких концентраций сукцината в экспериментах по измерению скорости формирования ${\text{O}}_{2}^{{ \bullet - }}$/Н2О2 в комплексе II долгое время было причиной недооценки комплекса II как источника АФК в клетке. При этом необходимо отметить, что каталитическая активность СДГ растет монотонно с увеличением концентрации сукцината, также как и скорости окисления сукцината и восстановления кофермента Q до QH2 по закону, близкому к гиперболической кинетике.
Рис. 1.
Кинетическая схема переноса электронов от сукцината к коферменту Q в комплексе II. Пояснения в тексте.

Таким образом, одной из целей данной работы была попытка объяснить механизм наблюдаемой экспериментально немонотонной зависимости скорости продукции ${\text{O}}_{2}^{{ \bullet - }}$/Н2О2 комплексом II от концентрации сукцината, при том что СДГ-активность мононотонно растет при тех же условиях.
Другой важной целью работы был тот факт, что в настоящее время отсутствует общепринятое мнение о том, какие из потенциально возможных редокс-центров комплекса II реально формируют ${\text{O}}_{2}^{{ \bullet - }}$ или Н2О2. Одни [7] настаивают на том, что только восстановленный флавинадениндинуклеотид (FADH2) и, возможно, флавинсемихинон-радикал (FADH·) формируют ${\text{O}}_{2}^{{ \bullet - }}$/Н2О2 в комплексе II. С другой стороны, Виноградов и соавт. [6] считают, что только [3Fe-4S]-кластер ближе всего подходит на роль редокс-центра, формирующего ${\text{O}}_{2}^{{ \bullet - }}$, судя по экспериментально наблюдаемым значениям мидпоинт редокс-потенциала гипотетического донора электронов для ${\text{O}}_{2}^{{ \bullet - }}$ около +40 мВ. Третьи авторы [9] полагают, что основным поставщиком АФК в комплексе II является семихинон- радикал Q•– в убихинон-связывающем центре. Поэтому, нами также ставилась задача попытаться идентифицировать редокс-центры, ответственные за экспериментально наблюдаемое немонотонное производство ${\text{O}}_{2}^{{ \bullet - }}$/Н2О2 в комплексе II.
МЕТОДЫ И МОДЕЛИ
Кинетическая схема транспорта электронов в комплексе II. На рис. 1 представлена кинетическая схема переноса электронов от сукцината на кофермент Q в комплексе II, которая основана на анализе многочисленных опубликованных экспериментальных данных.
Путь электронов на этой схеме можно кратко описать следующим образом. После получения двух электронов от сукцината, связанного с FAD, и восстановления в реакциях (1–3) FADH2 отдает первый электрон кластеру [2Fe-2S] (реакция (6) на рис. 1) с образованием радикала FADH•. Затем первый электрон через цепочку переносчиков в реакциях (7–10) переносится на убихинон Q, связанный с комплексом II (CII.Q сайт), что приводит к формированию семихинон-аниона (CII.Q•–), который может быть донором электронов для супероксид радикала (${\text{O}}_{2}^{{ \bullet - }}$), (реакция (22)). Второй электрон от радикала FADH∙ переносится в реакциях (12–15) на семихинон-радикал CII.QH• с последующим образованием QH2 в реакциях (16, 17). Потенциально возможными генераторами АФК в соответствующих реакциях считаются: 1) FADH2 в реакциях (18, 19), 2) FADH•-радикал в реакции (20), 3) восстановленный [3Fe-4S]–-кластер в реакции (21), 4) семихинон-анион (CII.Q•–) в реакции (22). При этом FADH2 может формировать как гидропероксид H2O2 за счет двухэлектронного переноса в реакции (18), так и супероксид ${\text{O}}_{2}^{{ \bullet - }}$ в реакции (19).
Детальная схема химических уравнений. Детально система химических уравнений, соответствующих переносу электронов на рис. 1, представлена в табл. 1, а значения констант скорости для каждой реакции приведены в табл. 2.
Таблица 1.
Реакции и уравнения скорости переноса электронов в комплексе II
| № | Реакция | Уравнение скорости |
|---|---|---|
| Окисление сукцината до фумарата и восстановление флавинадениндинуклеотида | ||
| 1 | FAD + suc = FAD.suc | V1 = k1 ⋅ ( FAD ⋅ suc – FAD.suc/K1) |
| 2 | FAD.suc = FADH2.fum | V2 = k2 ⋅ ( FAD.suc – FADH2.fum/K2) |
| 3 | FADH2.fum = FADH2 + fum | V3 = k3 ⋅ ( FADH2.fum – FADH2 ⋅ fum/K3) |
| 4 | FAD + fum = FAD.fum | V4 = k4 ⋅ ( FAD ⋅ fum – FAD.fum/K4) |
| 5 | FADH2 + suc = FADH2.suc | V5 = k5 ⋅ ( FADH2 ⋅ suc – FADH2.suc/K5) |
| Перенос первого электрона | ||
| 6 | FADH2 + [2Fe-2S] = FADH• + [2Fe-2S]– + H+ | V6 = k6 ⋅ ( FADH2 ⋅ [2Fe-2S] – FADH• ⋅ [2Fe-2S]– ⋅ H+/K6) |
| 7 | [2Fe-2S]– + [4Fe-4S] = [2Fe-2S] + [4Fe-4S]– | V7 = k7 ⋅ ([2Fe-2S]– ⋅ [4Fe-4S] – [2Fe-2S] ⋅ [4Fe-4S]–/K7) |
| 8 | [4Fe-4S]– + [3Fe-4S] = [4Fe-4S] + [3Fe-4S]– | V8 = k8 ⋅ ([4Fe-4S]– ⋅ [3Fe-4S] – [4Fe-4S] ⋅ [3Fe-4S]–/K8) |
| 9 | CII + Q = CII.Q | V9 = k9 ⋅ ( CII ⋅ Q – CII.Q/ K9) |
| 10 | CII.Q + [3Fe-4S]– = CII.Q•– + [3Fe-4S] | V10 = k10 ⋅ (CII.Q ⋅ [3Fe-4S]– – CII.Q•– ⋅ [3Fe-4S]/K10) |
| 11 | CII.Q•– + H+ = CII.QH• | V11 = k11 ⋅ (CII.Q•– ⋅ H+ – CII.QH•/K11) |
| Перенос второго электрона | ||
| 12 | FADH• + [2Fe-2S] = FAD + [2Fe-2S]– + H+ | V12 = k12 ⋅ (FADH• ⋅ [2Fe-2S] – FAD ⋅ [2Fe-2S]– ⋅ H+/K12) |
| 13 | [2Fe-2S]– + [4Fe-4S] = [2Fe-2S] + [4Fe-4S]– | V13 = k13 ⋅ ([2Fe-2S]– ⋅ [4Fe-4S] – [2Fe-2S] ⋅ [4Fe-4S]–/K13) |
| 14 | [4Fe-4S]– + [3Fe-4S] = [4Fe-4S] + [3Fe-4S]– | V14 = k14 ⋅ ([4Fe-4S]– ⋅ [3Fe-4S] – [4Fe-4S] ⋅ [3Fe-4S]–/K14) |
| 15 | CII.QH• + [3Fe-4S]- = CII.QH– + [3Fe-4S] | V15 = k15 ⋅ (CII.QH• ⋅ [3Fe-4S]– – CII.QH– ⋅ [3Fe-4S]/K15) |
| 16 | CII.QH– + H+ = CII.QH2 | V16 = k16 ⋅ (CII.QH– ⋅ H+ – CII.QH2/K16) |
| 17 | CII.QH2 = CII + QH2 | V17 = k17 ⋅ (CII.QH2 – CII ⋅ QH2/K17) |
| Генерация перекиси водорода (H2O2) в комплексе II | ||
| 18 | FADH2 + O2 = FAD + H2O2 | V18 = k18 ⋅ (FADH2 ⋅ O2 – FAD ⋅ H2O2/K18) |
| Генерация сепероксид аниона (${\mathbf{O}}_{{\mathbf{2}}}^{{{\mathbf{ \bullet - }}}}$) в комплексе II | ||
| 19 | FADH2 + O2 = FADH• + ${\text{O}}_{2}^{{ \bullet - }}$ + H+ | V19 = k19 ⋅ (FADH2 ⋅ O2 – FADH⋅ ⋅ ${\text{O}}_{2}^{{ \bullet - }}$ ⋅ H+/K19) |
| 20 | FADH• + O2 = FAD + ${\text{O}}_{2}^{{ \bullet - }}$ + H+ | V20 = k20 ⋅ (FADH• ⋅ O2 – FAD ⋅ ${\text{O}}_{2}^{{ \bullet - }}$ ⋅ H+/K20) |
| 21 | [3Fe-4S]– + O2 = [3Fe-4S] + ${\text{O}}_{2}^{{ \bullet - }}$ | V21 = k21 ⋅ ([3Fe-4S]– ⋅ O2 – [3Fe-4S] ⋅ ${\text{O}}_{2}^{{ \bullet - }}$/K21) |
| 22 | CII.Q•– + O2 = CII.Q + ${\text{O}}_{2}^{{ \bullet - }}$ | V22 = k22 ⋅ (CII.Q•– ⋅ O2 – CII.Q ⋅ ${\text{O}}_{2}^{{ \bullet - }}$/K22) |
| Сопутствующие реакции в матриксе и внутренней мембране митохондрий | ||
| Дисмутация супероксид-аниона в митохондриальном матриксе | ||
| 23 | 2${\text{O}}_{2}^{{ \bullet - }}$ + 2H+ → O2 + H2O2 | V23 = Vmax23 ⋅ ${\text{O}}_{2}^{{ \bullet - }}$/(Km23 + ${\text{O}}_{2}^{{ \bullet - }}$) |
| Удаление пероксида водорода (H2O2) в митохондриальном матриксе | ||
| 24 | H2O2 → | V24 = k24 ⋅ H2O2 |
| Окисление убихинола (QH2) во внутренней мембране митохондрий | ||
| 25 | QH2 → Q + 2H+ | V25 = k25 ⋅ QH2 |
Таблица 2.
Значения параметров в модели
| Реакция № |
Среднеточечный редокс-потенциал Eм = E(мВ) | Константа равновесия K | Константа скорости в прямом направлении k | Другие сопутствующие параметры | Ссылка |
|---|---|---|---|---|---|
| Окисление сукцината до фумарата и восстановление флавинадениндинуклеотида | |||||
| 1 | 0.1 мкМ–1 | 0.1 мкМ–1 с–1 | [10]б | ||
| 2 | 4 × 10–4г | 1 × 103 с–1 | |||
| 3 | 50 мкМ | 5 × 104 с–1 | [10]б | ||
| 4 | 0.004 мкМ–1 | 1 мкМ–1 с–1 | [10]б | ||
| 5 | 6.25 × 10–3 мкМ–1 | 1 мкМ–1 с–1 | [10]б | ||
| Перенос первого электрона | |||||
| 6 | E(FADH•/FADH2) = –31 E([2Fe-2S]) = 0 | 3.456 | 104 мкМ–1 с–1 | pH 7 pH 7.4 |
[11]а [12]а |
| 7 | E([2Fe-2S]) = 0 E([4Fe-4S]) = –260 |
3.04 × 10–5 | 104 мкМ–1 с–1 | pH 7.4 | [12]а |
| 8 | E([4Fe-4S]) = –260 E([3Fe-4S]) = 60 |
3.6 × 105 | 104 мкМ–1 с–1 | pH 7.4 | [12]а [13]а |
| 9 | 3.33 мкМ–1 | 10 мкМ–1 с–1 | [14]б | ||
| 10 | E([3Fe-4S]) = 60 E(Q/Q•–) = –160 |
1.5 × 10–4 | 7.2 × 103 с–1 | pH 7.4 | [13]а [15]а [16]в |
| 11 | 0.079 мкМ–1д | 103 мкМ–1 с–1 | pH 7 | [15]б | |
| Перенос второго электрона | |||||
| 12 | E(FAD/FADH•) = –127 E([2Fe-2S]) = 0 |
166.77 | 104 мкМ–1 с–1 | pH 7 pH 7.4 |
[11]а [12]а |
| 13 | E([2Fe-2S]) = 0 E([4Fe-4S]) = –260 |
3.04 × 10–5 | 104 мкМ–1 с–1 | pH 7.4 | [12]а |
| 14 | E([4Fe-4S]) = –260 E([3Fe-4S]) = 60 |
3.6 × 105 | 104 мкМ–1 с–1 | pH 7.4 | [12]а [13]а |
| 15 | E([3Fe-4S]) = 60 E(QH•/QH–) = 240 |
1339.4 | 7.2 × 103 с–1 | pH 7.4 | [13]а [15]а [16]в |
| 16 | 6.31 × 104 | 103 мкМ–1 с–1 | pH 7 | [15]б | |
| 17 | 0.9 мкМ | 103 с–1 | [14]б | ||
| Генерация перекиси водорода (H2O2) в комплексе II | |||||
| 18 | E(O2/Н2O2) = 690 E(FAD/FADH2) = –79 |
5.2 × 1026 | 0.01 мкМ–1 с–1 | pH 7 | [11]а |
| Генерация супероксид-аниона (${\mathbf{O}}_{{\mathbf{2}}}^{{{\mathbf{ \bullet }} - }}$) в комплексе II | |||||
| 19 | E(O2/${\text{O}}_{2}^{{ \bullet - }}$) = –160 E(FADH•/FADH2) = –31 |
6 × 10–3 | 0.01 мкМ–1 с–1 | pH 7 | [17]а [11]а |
| 20 | E(O2/${\text{O}}_{2}^{{ \bullet - }}$) = –160 E(FAD/FADH∙) = –127 |
0.267 | 0.1 мкМ–1 с–1 | pH 7 pH 7.4 |
[17]а [11]а |
| 21 | E(O2/${\text{O}}_{2}^{{ \bullet - }}$) = –160 E([3Fe-4S]) = 60 |
1.5 × 10–4 | 2 × 10–3 мкМ–1 с–1 | pH 7 pH 7.4 |
[17]а [13]а |
| 22 | E(O2/${\text{O}}_{2}^{{ \bullet - }}$) = –160 E(Q/Q•–) = –160 |
1 | 0.05 мкМ–1 с–1 | [17]а [15]а |
|
| Сопутствующие реакции в матриксе и внутренней мембране митохондрий | |||||
| Дисмутация супероксид-аниона в митохондриальном матриксе | |||||
| 23 | Vmax23 = 5.6 × 104 мМ/се Km23 = 50 мкM |
[18]г | |||
| Удаление перекиси водорода (H2O2) в митохондриальном матриксе | |||||
| 24 | 30 с–1 | [19]в | |||
| Окисление убихинола (QH2) во внутренней мембране митохондрий | |||||
| 25 | 10 с–1 | ||||
a Ссылка для мидпоинт редокс-потенциала Eм. б Ссылка для константы равновесия K. в Ссылка для константы скорости прямой реакции k. г Используемое значение K2 вычисляется из соотношения K1 ⋅ K2 ⋅ K3 = exp(2F(E(FAD/FADH2) – E(fum/suc))/RT) = 0.002 в соответствии с термодинамическим циклом, где мидпоинт редокс-потенциалы E(FAD/FADH2) = –79 мВ [11] (pH 7.0) и E(fum/suc) = 0 мВ [6] (pH 7.0), соответственно, и F, R и T имеют обычное значение. д Используемое значение константы равновесия К соответствует значению рКдисс=4.9 для пары QH•/Q•–, взятое из [15]. К11 = 104.9 М–1 = 0.079 мкМ–1). е Используемое значение взято из [18], которое было вычислено из экспериментальных данных по Mn-SOD-активности в митохондриях сердечных клеток [20]. Примечание. Пул переносчиков электронов. Согласно [21] содержание комплекса II в митохондриях сердца составляет 0.209 нмоль комплекс II/мг митохондриального белка. Ранее мы [18] показали, что 1 нмоль/мг белка соответствует 273 мкМ при нормировке на митохондриальный объем. При перерасчете на концентрацию во внутренней ММ (объемная часть которой от целой митохондрии Wmm = 0.24), это составляет 235 мкМ. Это значит, что общая концентрация всех редокс-центров, локализованных в комплексе II, т.е. [FAD], [2Fe-2S], [4Fe-4S], [3Fe-4S] также составляет 235 мкМ. Общая концентрация кофермента Q принята, как и в [18], равной 4541 мкМ.
Математическая модель. На основе кинетической модели, представленной на рис. 1 и в табл. 1 и 2, с использованием закона действующих масс для химических реакций разработана математическая модель переноса электронов в комплексе II, представляющая собой систему из 17 обыкновенных дифференциальных уравнений, которая описывает как концентрацию переносчиков электронов в различных, окисленном и восстановленном, состояниях, так и скорости потока электронов в различных реакциях и, в частности, в реакциях формирования АФК. Правые части системы дифференциальных уравнений представлены в Приложении к статье. Все численные расчеты модели проводились с использованием программы DBSolve Optimum, разработанной в Институте системной биологии, Москва, Россия, и доступной на вебсайте http://insysbio.ru.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Главной особенностью условий экспериментов [6, 7], в которых наблюдалась высокая скорость генерации АФК в комплексе II при невысоких субмиллимолярных концентрациях сукцината (50–500 мкМ), было использование ингибиторов комплекса III как на интактных митохондриях, так и на СМЧ, чтобы исключить поток АФК от комплекса III. Ингибитор комплекса I, ротенон, также использовали, чтобы исключить влияние комплекса I, но как показали результаты анализа математической модели, основное влияние на кинетику генерации АФК комплексом II оказывает ингибирование комплекса III. Ингибирование комплекса III в рамках математической модели означает ингибирование окисления убихинола QH2. В табл. 1 и 2 эта скорость превращения QH2 в Q записана под номером 25. Для простоты она представлена необратимой реакцией.
На рис. 2 показан пример стационарных зависимостей скоростей образования QH2 (а) и АФК (б) различными редокс-центрами комплекса II от концентрации сукцината при различных значениях константы скорости k25, характеризующей скорость окисления QH2 во внутренней ММ, т.е. фактически характеризующей активность комплекса III, в котором в основном происходит окисление QH2. Как показывают результаты численного компьютерного анализа математической модели, СКР-активность комплекса II сильно падает при уменьшении k25 (рис. 2а), т.е. уменьшении окисления QH2 или, другими словами, ингибировании комплекса III. Это легко понять, если учесть, что сильное падение окисленного пула убихинона, Q, приводит к сильному уменьшению скорости реакции (9), т.е. связыванию Q с комплексом II в убихинон-связывающем центре, и, как следствие, сильному уменьшению всех скоростей в нижней части комплекса II, включая скорость образования QH2 (v17). Необходимо отметить, что этот эффект аналогичен прямому ингибированию убихинон-связывающего центра Атпенином А5, который используется для изучения влияния ингибирования убихинон-связывающего центра на активность генерации АФК комплексом II [7].
Рис. 2.
Стационарные зависимости скорости образования убихинола QH2 (а) и суммарной скорости генерации АФК различными редокс-центрами (б) комплекса II от концентрации сукцината при различной степени ингибирования окисления убихинола в митохондриальной мембране. Пояснения в тексте.
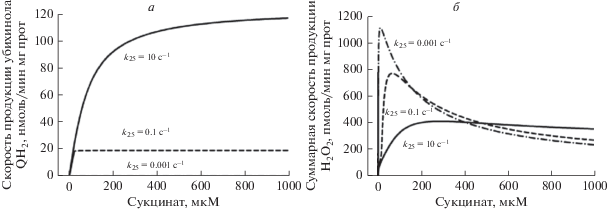
Рис. 2б показывает, что скорость генерации АФК сильно увеличивается при уменьшении скорости окисления QH2, т.е. моделировании уменьшения активности комплекса III (или ингибировании убихинон-связывающего центра). Важно отметить, что при уменьшении k25 происходит как увеличение пика скорости образования АФК, так и сдвиг пика в сторону малых значений концентрации сукцината. Этим, кстати, можно объяснить различное расположение пика в работах [6] и [7], 50 и 400 мкМ сукцината, соответственно, т.е. различной степенью ингибирования комплекса III (окисления QH2). Следует подчеркнуть, что на рис. 2б представлена суммарная скорость производства АФК в форме Н2О2 различными редокс-центрами комплекса II, хотя в чистом виде Н2О2 может производить только сайт FADH2 со скоростью v18 (рис. 1 и табл. 1), а остальные сайты только в форме супероксида (скорости v19–v22). Просто здесь учтено, что супероксид очень быстро со скоростью v23 (табл. 1) дисмутирует в гидропероксид Н2О2, концентрацию которого измеряют в эксперименте. Каталитические константы скорости производства АФК различными сайтами неизвестны, они подбирались в некоторой степени условно для того, чтобы объяснить экспериментально наблюдаемые зависимости производства АФК комплексом II [6]. Как показывает сравнение теоретических результатов изучения зависимости скорости генерации Н2О2 комплексом II от концентрации сукцината при малой скорости окисления QH2, v25, (рис. 2б, k25 = 0.001 c–1) с экспериментально наблюдаемыми (см. Приложение) при ингибировании комплекса III, модель хорошо количественно объясняет экспериментальные данные. Это относится как к максимальным значениям скорости генерации Н2О2 (около 1 нмоль/мин мг белка как в модели, так и в эксперименте), так и концентрации сукцината, при которой наблюдаются пиковые значения скорости образования Н2О2 (около 50 мкМ в модели и эксперименте).
Необходимо подчеркнуть главное качественное различие в кинетике восстановления убихинона и генерации АФК комплексом II: кинетика восстановления убихинона близка к гиперболической (рис. 2а), в то время как скорость генерации АФК имеет немонотонную зависимость от концентрации сукцината (рис. 2б), что полностью соответствует экспериментальным наблюдениям.
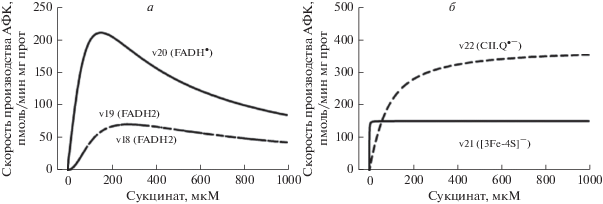
Для более детального представления о вкладе различных редокс-центров комплекса II в суммарную скорость генерации АФК на рис. 3а и 3б показаны отдельные скорости генерации АФК при ингибировании окисления QH2 во внутренней ММ, подразумевающего ингибирование комплекса III, моделирующего условия экспериментов по регистрации АФК, производимых комплексом II [6, 7]. В этом случае стационарная скорость восстановления QH2 (СКР-активность) также близка к нулю, как и все скорости (9–11, 15–17) в нижней части комплекса II в силу отсутствия субстрата Q (нет окисления QH2, значит, и нет Q). Видно, что расчетные скорости объясняют наблюдаемые экспериментально немонотонные зависимости скорости генерации АФК от сукцината только в случае FADH2 и FADH•-редокс центров (рис. 3а). При этом скорость генерации АФК кластером [3Fe-4S]– в реакции (21) является монотонной (рис. 3б), а семихинон-анионом (CII.Q•–) в реакции (22) вообще близка к нулю, что соответствует близкой к нулевой скорости восстановления убихинона в нижней части комплекса II.
Рис. 3.
Стационарные зависимости скорости генерации АФК различными редокс-центрами комплекса II (указаны на рисунке) от концентрации сукцината при полном ингибирования окисления убихинола в митохондриальной мембране. а – FADH2 и FADH∙; б – [3Fe-4S]-кластер и семихинон-радикал Q∙– в убихинон-связывающем центре (сайт CII. Q∙–) сайты генерации АФК. Пояснения в тексте.

Таким образом, из анализа рис. 3 следуют два вывода. Основной вклад в генерацию АФК комплексом II при ингибировании комплекса III вносят FADH2 и FADH•-редокс-центры, концентрация которых высока при активности СКР, близкой к нулю, т.е., когда FAD находится в основном в восстановленном состоянии при малых концентрациях сукцината. И второй вывод, что хотя кластер [3Fe-4S] также в основном находится в восстановленном состоянии при этих условиях (нулевой активности СКР), но в силу гиперболической кинетики скорости генерации АФК этим кластером его реальный вклад в экспериментально наблюдаемую генерацию АФК комплексом II, по-видимому, незначителен.
Скорости генерации H2O2 и ${\text{O}}_{2}^{{ \bullet - }}$ редокс-центром FADH2 на рис. 3а, v18 и v19, совпадают, потому что при расчетах для простоты каталитические константы k18 и k19 приняты одинаковыми. Главное количественное отличие в кинетике скоростей v18 и v19 от v20 состоит в том, что пиковое значение в зависимости v20 от концентрации сукцината наблюдается при меньших значениях концентрации сукцината (20–30 мкМ), чем скоростей v18 и v19 (около 50 мкМ). Это дает основание предполагать, что основной вклад в экспериментально наблюдаемый пик около 50 мкМ сукцината [6] дает все-таки FADH2. Этот вывод совпадает с выводом авторов, наблюдавших немонотонную зависимость в скорости генерации АФК от концентрации сукцината на интактных митохондриях [7], которые склоняются к мнению, что только FADH2 является донором электронов для АФК в комплексе II.
На рис. 4а и 4б представлены одноименные скорости генерации АФК различными редокс-центрами в отсутствие ингибирования окисления QH2, т.е. при нормальных физиологических условиях. К сожалению, не опубликованы результаты детального экспериментального анализа генерации АФК комплексом II в отсутствие ингибиторов комплексов I и III, поскольку при нормальных физиологических условиях суммарная скорость генерации АФК комплексами I и III значительно превышает эту скорость в комплексе II. Поэтому, эта часть модельных расчетов носит скорее предсказательный характер в отличие от стационарных скоростей, представленных на рис. 3, которые нацелены на объяснение экспериментальных данных по кинетике формирования АФК в комплексе II в условиях ингибирования комплекса III. Расчеты предсказывают, что в отсутствие ингибирования комплекса III должно происходить сильное падение скорости генерации АФК редокс-центрами FADH2 и FADH•, зависимость которой от концентрации сукцината остается немонотонной со сдвигом в сторону высоких концентраций сукцината, и сильное увеличение скорости генерации супероксида семихинон-анионом (CII.Q•–) в реакции (22), кинетика которой близка к гиперболической. В этом случае CII.Q•–) дает основной вклад в формирование АФК в комплексе II, так что суммарная скорость производства АФК от концентрации сукцината имеет зависимость, близкую к гиперболической (рис. 2, k25 = 10 c–1). Эти предсказания могут быть проверены экспериментально путем частичного блокирования комплекса III, позволяющего отследить изменения в кинетике генерации АФК по мере ингибирования комплекса III, которые должны соответствовать модельным расчетам при различных значениях k25, представленных на рис. 2.
Рис. 4.
Стационарные зависимости скорости генерации АФК различными редокс-центрами комплекса II (указаны на рисунке) от концентрации сукцината в отсутствие ингибирования окисления убихинола в митохондриальной мембране. а – FADH2 и FADH•; б – [3Fe-4S]-кластер и семихинон-радикал Q•– в убихинон-связывающем центре (сайт CII. Q•–) сайты генерации АФК. Пояснения в тексте.
ЗАКЛЮЧЕНИЕ
1. Теоретический анализ кинетики транспорта электронов в комплексе II предсказывает, что наблюдаемые экспериментально немонотонные зависимости генерации АФК, полученные при ингибировании комплекса III [6, 7], могут объясняться их формированием только в FAD-центрах, FADH2 и FADH∙, что согласуется с предположением, высказанным ранее Брандом и соавт. [7] на основе их собственных экспериментальных исследований.
2. Значительное участие кластера [3Fe–4S] в формировании АФК, как предполагают Виноградов и соавт. [6], маловероятно, поскольку, согласно теоретическим результатам, полученным в данной работе, зависимость скорости формирования АФК этим кластером от концентрации сукцината близка к гиперболической, что противоречит экспериментально наблюдаемой немонотонной зависимости суммарной скорости генерации АФК комплексом II от концентрации сукцината. Однако это противоречие в кинетике и термодинамике, а гипотетический донор электронов для АФК, как показано [6], имеет среднеточечный потенциал, близкий по значению к кластеру [3Fe-4S], требует дальнейших исследований.
3. В отсутствие угнетения комплекса III, основным генератором АФК предполагается семихинон-анион, связанный с комплексом II (CII.Q•–), как показано ранее [9]. Вывод Бранда и соавт. [7] о полном неучастии редокс-центра CII.Q•– в формировании АФК на основе собственных экспериментальных данных с использованием Атпенина А5, блокатора убихинон-связывающего центра в комплексе II, неправомерен, поскольку Атпенин А5 применялся на фоне блокатора комплекса III, т.е. при условии, что весь убихинон находится в восстановлнной форме QH2. В этом случае скорость связывания окисленного убихинона, Q, с убихинон-связывающим центром близка к нулю просто в силу того, что близка к нулю концентрация Q, независимо от присутствия Атпенина А5. Таким образом, вопрос об участии семихинон-аниона, связанного с комплексом II (CII.Q•–), в формировании АФК остается открытым.
ПРИЛОЖЕНИЕ
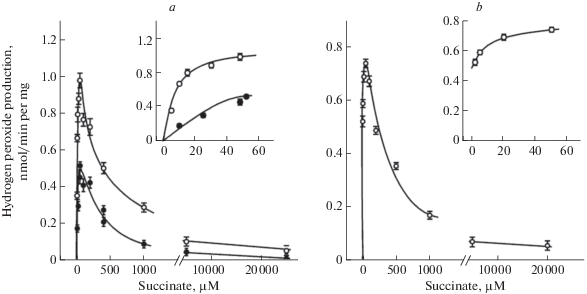
Пример экспериментальных данных по немонотонной зависимости производства АФК комплексом II от концентрации сукцината, взятых из работы Виноградова и соавт. [6]. На рис. 1П приведен пример экспериментальных данных, полученных при регистрации АФК, генерируемых комплексом II, в работе Виноградова и соавт. (разрешение на копирование рисунка Fig. 2 получено от издательства Elsevier, номер лицензионного соглашения 4 586 521 111 772 от 12 Мая, 2019 г. на имя Н.И. Маркевича, размещено на сайте: https://s100.copyright.com/ CustomerAdmin/PLF.jsp?ref=a08b9807-c5c0-4b57-8e56-53eeb22a7841). Пояснения для кривых даны в подписи к рисунку. Важно, что скорость производства АФК (Н2О2) измеряли в присутствии блокаторов как комплекса I (10 мкМ ротенона), так и комплекса III (1.6 мкМ миксотиазола).
Рис. 1П.
Зависимость общей сукцинат-поддерживаемой скорости продукции Н2О2 от концентрации сукцината. a – Митохондрии интактные (⚫) или с нарушенной проницаемостью мембраны (⚪). b – Субмитохондриальные частицы. Вставки на рисунках – возрастающие участки кривых при малых концентрациях сукцината. В экспериментах использовали 10 мкМ ротенона и 1.6 мкМ миксотиазола.
Математическая модель
Ниже представлены правые части системы дифференциальных уравнений, составляющих математическую модель, исследуемую в статье. В этом виде правые части представлены в программе DBSolve Optimum, которую использовали при всех вычислениях.
d(X[i])/dt = F[i], (i = 1, 17), где выражения для различных переменных X[i] и правых частей F[i] представлены ниже:
для FAD
d(FAD)/dt = –v1 – v4 + v12 + v18 + v20;
для FAD_suc
d(FAD_suc)/dt = v1 – v2;
Для FADH2_fum
d(FADH2_fum)/dt = v2 – v3;
Для FADH2
d(FADH2)/dt = v3 – v5 – v6 – v18 – v19;
для FAD_fum
d(FAD_fum)/dt = v4;
Для H2O2
d(H2O2)/dt = v18*Wimb/Wmx + v23 – v24;
Для [2Fe-2S]
d([2Fe-2S])/dt = –v6 + v7 – v12 + v13;
для FADH•
d(FADH•)/dt = v6 – v12 + v19 – v20;
для [4Fe-4S]
d([4Fe-4S])/dt = –v7 + v8 – v13 + v14;
для [3Fe-4S]
d([3Fe-4S])/dt = –v8 + v10 – v14 + v15 + v21;
Для Q
d(Q)/dt = –v9 + v25;
для C2
d(C2)/dt = –v9 + v17;
для C2_Q
d(C2_Q)/dt = v9 – v10 + v22;
для C2_Q•–
d(C2_Q•–)/dt = –v11 + v10 – v22;
для C2_QH•
d(C2_QH•)/dt = v11 – v15;
для C2_QH–
d(C2_QH–)/dt = –v16 + v15;
для ${\text{O}}_{2}^{{ \bullet - }}$
d(${\text{O}}_{2}^{{ \bullet - }}$)/dt = (v19 + v20 + v21 + v22) * Wimb/Wmx – – 2*v23.
Используемые здесь выражения для скоростей vj (j = 1, 25) представлены в табл. 1, а значения всех параметров в табл. 2 основного текста статьи.
Стационарные решения в модели расчитывались при условии
F[i] = d(X[i])/dt = 0;
Кроме того, в модели учитывалось постоянство во времени общей концентрации в мембране как самого комплекса II, так и пулов различных редокс-центров.
Законы сохранения и значения концентраций (в мкМ) пулов различных редокс-центров
Общая концентрация FAD-центров в различных состояниях:
Pool [1] = FAD + FADH2 + FADH• + FADH2_suc + + FAD_suc + FADH2_fum + FAD_fum;
Общая концентрация убихинон-связывающих центров, С2, в различных состояниях:
Pool [2] = C2_QH2 + C2 + C2_Q + C2_Q•– + + C2_QH• + C2_QH─ ;
Общая концентрация пула убихинона в различных состояниях:
Pool [3] = QH2 + Q + C2_Q + C2_Q•– + + C2_QH• + C2_QH ─ + C2_QH2;
Общая концентрация [2Fe-2S]-кластеров в различных, окисленном и восстановленном, состояниях:
Pool [4] = [2Fe-2S]– + [2Fe-2S];
Общая концентрация [3Fe-4S] кластеров в различных, окисленном и восстановленном, состояниях:
Pool [5] = [3Fe-4S]– + [3Fe-4S];
Общая концентрация [4Fe-4S] кластеров в различных, окисленном и восстановленном, состояниях:
Pool [6] = [4Fe-4S]– + [3Fe-4S];
Значения концентраций пулов всех редокс-центров комплекса II приняты равными концентрации комплекса II, т.е. 235 мкМ.
Pool [1] = Pool [2] = Pool [4] = Pool [5] = Pool [6] = = 235; Pool [3] = 4541;
Тогда выражения для концентрации всех зависимых переменных, входящих в систему дифференциадьных уравнений, легко вычисляются из значений пулов различных переменных и представлены ниже.
Выражения для зависимых переменных
FADH2_suc = –FAD-FAD_suc – FADH2_fum – FADH2 – FAD_fum – FADH• + Pool [1];
C2_QH2 = –C2 – C2_Q – C2_Q•– – C2_QH• – – C2_QH─ + Pool [2];
QH2 = –Q – C2_Q – C2_Q•– – C2_QH• – ‒ C2_QH─ – C2_QH2 + Pool [3];
[2Fe-2S]– = –[2Fe-2S] + Pool [4];
[3Fe-4S]– = –[3Fe-4S] + Pool [5];
[4Fe-4S]– = –[3Fe-4S] + Pool [6].
Список литературы
Grimm S. 2013. Respiratory chain complex II as general sensor for apoptosis. Biochim. Biophys. Acta. 1827, 565–572.
Hwang M.-S., Rohlena J., Dong L.-F., Neuzil J., Grimm S. 2014. Powerhouse down: Complex II dissociation in the respiratory chain. Mitochondrion. 19, 20–28.
Lemarie A., Huc L., Pazarentzos E., Mahul-Mellier A.-L., Grimm S. 2011. Specific disintegration of complex II succinate:ubiquinone oxidoreductase links pH changes to oxidative stress for apoptosis induction. Cell Death Differentiation. 18, 338–349.
Turrens J.F. 2003. Mitochondrial formation of reactive oxygen species. J. Physiol. 552 (2), 335–344.
Murphy M. 2009. How mitochondria produce reactive oxygen species. Biochem. J. 417, 1–13.
Grivennikova V.G., Kozlovsky V.S., Vinogradov A.D. 2017. Respiratory complex II: ROS production and the kinetics of ubiquinone reduction. Biochim. Biophys. Acta. 1858 (2), 109–117.
Quinlan C.L., Orr A.L., Perevoshchikova I.V., Treberg J.R., Ackrell B.A., Brand M.D. 2012. Mitochondrial complex II can generate reactive oxygen species at high rates in both the forward and reverse reactions. J. Biol. Chem. 287, 27 255–27 264.
Starkov A.A. 2008. The role of mitochondria in reactive oxygen species metabolism and signaling. Ann. NY Acad. Sci. 1147, 37–52.
Bonke E., Zwicker K., Dröse S. 2015. Manganese ions induce H2O2 generation at the ubiquinone binding site of mitochondrial complex II. Arch. Biochem. Biophys. 580, 75–83.
Kotlyar A.B., Vinogradov A.D. 1984. Interaction of the membrane-bound succinate dehydrogenase with substrate and competitive inhibitors. Biochim. Biophys. Acta. 784 (1), 24–34.
Ohnishi T., King T.E., Salerno J.C., Blum H., Bowyer J.R., Maida T. 1981. Thermodynamic and electron paramagnetic resonance characterization of flavin in succinate dehydrogenase. J. Biol. Chem. 256 (11), 5577–5582.
Ohnishi T., Salerno J.C. 1976. Thermodynamic and EPR characteristics of two ferredoxin-type iron-sulfur centers in the succinate-ubiquinone reductase segment of the respiratory chain. J. Biol. Chem. 251 (7), 2094–2104.
Ohnishi T., Lim J., Winter D.B., King T.E. 1976. Thermodynamic and EPR characteristics of a HiPIP-type iron-sulfur center in the succinate dehydrogenase of the respiratory chain. J. Biol. Chem. 251 (7), 2105–2109.
Hägerhäll C. 1997. Succinate: Quinone oxidoreductases. Variations on a conserved theme. Biochim. Biophys. Acta. 1320 (2), 107–141.
Rich P.R. 1984. Electron and proton transfers through quinones and cytochro me bc complexes. Biochim. Biophys. Acta. 768 (1), 53–79.
Anderson R.F., Shinde S.S., Hille R., Rothery R.A., Weiner J.H., Rajagukguk S., Maklashina E., Cecchini G. 2014. Electron-transfer pathways in the heme and quinone-binding domain of complex II (succinate dehydrogenase). Biochemistry. 53 (10), 1637–1646.
Murphy M.P. 2009. How mitoch ondria produce reactive oxygen species. Biochem. J. 417 (1), 1–13.
Markevich N.I., Hoek J.B. 2015. Computational modeling analysis of mitochondrial superoxide production under varying substrate conditions and upon inhibition of different segments of the electron transport chain. Biochim. Biophys. Acta. 1847 (6–7), 656–679.
Markevich N.I., Hoek J.B. 2014. Computational modeling analysis of acute and chronic ethanol-induced oxidative stress. Math. Biol. Bioinformat. 9 (1), 63–88.
Jin Z.Q., Zhou H.Z., Cecchini G., Gray M.O., Karliner J.S. 2005. MnSOD in mouse heart: Acute responses ischemic preconditioning and ischemia-reperfusion injury. Am. J. Physiol. Heart. Circ. Physiol. 288 (6), H2986–2994.
Wojtovich A.P., Nehrke K.W., Brookes P.S. 2010. The mitochondrial complex II and ATP-sensitive potassium channel interaction: Quantitation of the channel in heart mitochondria. Acta Biochim. Pol. 57 (4), 431–434.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


