Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 6, стр. 450-456
Изменение содержания воспалительных оксилипинов в слезной жидкости при периоперационном синдроме сухого глаза
Д. В. Чистяков a, *, Н. В. Азбукина b, А. А. Астахова a, С. В. Горяинов c, В. В. Чистяков c, В. В. Тюлина a, О. С. Ганчарова a, В. Е. Бакшеева a, А. А. Замятнин мл. a, d, П. П. Филиппов a, М. Г. Сергеева a, И. И. Сенин a, Е. Ю. Зерний a, d, **
a Московский государственный университет им. М.В. Ломоносова,
НИИ физико-химической биологии им. А.Н. Белозерского
119991 Москва, Ленинские горы, 1, стр. 40, Россия
b Московский государственный университет им. М.В. Ломоносова,
факультет биоинженерии и биоинформатики
119991 Москва, Ленинские горы, 1, стр. 73, Россия
c Российский университет дружбы народов
117198 Москва, ул. Миклухо-Маклая, 6, Россия
d Институт молекулярной медицины, Первый Московский государственный медицинский университет
имени И.М. Сеченова
119991 Москва, ул. Трубецкая, 8, Россия
* E-mail: chistyakof@gmail.com
** E-mail: zerni@belozersky.msu.ru
Поступила в редакцию 16.04.2019
После доработки 15.05.2019
Принята к публикации 16.05.2019
Аннотация
С использованием разработанных нами ранее экспериментальной модели периоперационного синдрома сухого глаза (ПССГ) животных (кроликов) и методики количественного масс-спектрометрического определения оксилипинов показано, что развитие эрозий роговицы в условиях общей анестезии ассоциировано с изменениями содержания в слезной жидкости воспалительных метаболитов – производных линолевой (ЛК), альфа-линоленовой (АЛК) и арахидоновой (АК) жирных кислот. Наиболее существенный рост демонстрируют метаболиты ЛК и АЛК, в то время как содержание производных АК (за исключением 12-HETE) практически не меняется, что указывает на ключевую роль каскадов ЛК и АЛК в развитии воспалительного ответа при ПССГ. Увеличение концентрации оксилипинов, образующихся в результате неферментативного окисления ЛК (9-KODE) или ее процессинга под действием цитохромов (12,13-EpOME) в условиях окислительного стресса, свидетельствует о существенном вкладе последнего в механизм развития ПССГ. Подавляющее большинство метаболитов ЛК (13-HODE и 9-HODE), АЛК (9-HOTrE и 13-HOTrE) и АК (12-HETE), содержание которых в слезе меняется при ПССГ, образуется в результате действия ферментов семейства липоксигеназ, в то время как концентрация продуктов активности циклооксигеназ остается практически неизменной. Полученные данные позволяют предположить низкий терапевтический потенциал ингибиторов циклооксигеназ (таких как нестероидные противовоспалительные препараты) и высокий терапевтический потенциал антиоксидантов и ингибиторов липоксигеназ в отношении ПССГ, что должно учитываться при разработке перспективной комплексной терапии этого широко распространенного социально значимого заболевания.
ВВЕДЕНИЕ
Синдром сухого глаза (ССГ) – широко распространенное многофакторное заболевание, при котором выявляется комплекс признаков клинически выраженного роговично-конъюнктивального ксероза. ССГ характеризуется развитием эрозивных повреждений эпителия роговицы и отличается наличием выраженного болевого синдрома [1–3]. Считается, что ключевыми патогенетическими факторами ССГ являются окислительный стресс клеток роговицы, а также воспаление, охватывающее эту ткань и окружающие ткани глаза [3–6]. Эти процессы индуцируются в условиях уменьшения объема и/или изменения состава секретируемой слезной жидкости, которая в отсутствие кровеносных сосудов обеспечивает питание и увлажнение роговицы, способствует ее заживлению и регулирует локальные воспалительные реакции [1, 3, 7].
Одной из форм ССГ, частота встречаемости которой в последние годы существенно возрастает, является периоперационный синдром сухого глаза (ПССГ). Это ятрогенное заболевание является осложнением длительной общей анестезии при проведении любых инвазивных процедур и затрагивает до 44% всех хирургических пациентов [7–9]. Развитие повреждений роговицы при ПССГ ассоциировано с нарушениями правильной биомеханики глаза в процессе анестезии, а также с угнетающим эффектом анестетика на слезные железы. Низкая скорость заживления повреждений роговицы при ПССГ может приводить к возникновению выраженной воспалительной реакции, развитию необратимых изменений в роговичном эпителии и, как следствие, к ухудшению зрения вплоть до его потери. Поскольку общее количество и продолжительность хирургических вмешательств, проводимых в различных областях медицины, с каждым годом неуклонно растут, актуальной и востребованной задачей является поиск подходов к предотвращению периоперационных повреждений роговицы и ускорению их регенерации [7].
На сегодняшний день первичная терапия ССГ включает использование увлажняющих глазных капель и мазей, которые, как правило, обеспечивают лишь временное облегчение симптомов и не влияют на патогенетические процессы, лежащие в основе различных форм этого заболевания [3, 4]. Эффективным способом лечения ССГ является применение противовоспалительных препаратов, таких как кортикостероиды и циклоспорин А, а также антибиотиков. Однако использование подобной терапии имеет целый ряд ограничений: длительное применение кортикостероидов может вызывать повышение внутриглазного давления и индуцировать катаракту, инстилляции циклоспорина вызывают локальные реакции в глазу, а интраокулярное применение антибиотиков (тетрациклин, азитромицин) имеет множество побочных эффектов [10, 11]. С учетом этого особую актуальность приобретает разработка более специфических противовоспалительных препаратов для лечения ССГ. Подходом к решению этой задачи может быть выявление характерных паттернов содержания в слезной жидкости молекул, отвечающих за развитие воспалительных процессов, таких как цитокины [3, 12], а также оксилипины – продукты метаболизма жирных кислот [13, 14]. Оксилипины – локально действующие биоактивные сигнальные липиды, которые регулируют различные аспекты воспаления и связаны с целым рядом офтальмологических патологий [15, 16]. Оксилипины образуются в результате ферментативного окисления линолевой, α-линоленовой и арахидоновой полиненасыщенных жирных кислот по цитохром Р450-оксидазному, липоксигеназному и циклооксигеназному путям (рис. 1) и запускают как про-, так и противовоспалительные процессы [17]. Поскольку воспаление является доказанным патогенетическим фактором ССГ [18], включая ПССГ [3], провоспалительные сигналы в клетках тканей, формирующих поверхность глаза, могут включать активацию ферментативных путей биосинтеза оксилипинов, что должно приводить к изменению их уровней в слезе. Действительно, предыдущие исследования выявили присутствие подобных соединений в слезной жидкости, причем их концентрация менялась у пациентов с некоторыми разновидностями ССГ [16, 19, 20]. Однако исследование изменений паттерна воспалительных оксилипинов слезной жидкости при ПССГ ранее не проводилось. Между тем, решение этой важной задачи позволит установить специфические сигнальные пути развития воспалительного ответа при этом заболевании, селективное таргетирование которых может рассматриваться в качестве перспективной специфической терапии ПССГ.
Рис. 1.
Схема биосинтеза оксилипинов – производных линолевой, альфа-линоленовой и арахидоновой кислот – с участием ферментов групп цитохром Р450-оксидаз (CYP), липоксигеназ (LOX) и циклооксигеназ (COX).

Недавно нами была создана модель ПССГ животных (кроликов) [3, 5, 12], которая воспроизводит повреждения роговицы в условиях длительной общей анестезии, характерные для хирургических пациентов [9]. С использованием гистологических методов показано, что в результате 6-часовой общей анестезии у животных развивается истончение или полная потеря (денудация) эпителия роговицы (строма не затрагивается) за счет десквамации эпителиоцитов, а также их гибели путем некроза или апоптоза и отделения от базальной мембраны. Выявленные повреждения не распространяются на строму роговицы, т.е. развиваются именно как эрозии этой ткани, что соответствует клинической картине ПССГ у людей. Самопроизвольная регенерация описанных симптомов наблюдается лишь на 30 день послеоперационного периода. Примечательно, что у животных выявляется также ухудшение качества слезной пленки и изменение ее биохимических свойств, в частности, снижение антиоксидантного статуса и изменение содержания цитокинов. Эти наблюдения свидетельствуют о наличии окислительного стресса и воспаления, которые в значительной степени обуславливают развитие патологического процесса при ПССГ [3].
В настоящей работе с использованием вышеописанной модели ПССГ, а также разработанной ранее методики масс-спектрометрического определения оксилипинов [21, 22], нами выявлены изменения содержания воспалительных оксилипинов – производных линолевой (ЛК), альфа-линоленовой (АЛК) и арахидоновой (АК) полиненасыщенных жирных кислот – в образцах слезы животных в процессе их пребывания в условиях общей анестезии и в послеоперационный период. Полученные данные подтверждают, что ПССГ сопровождается окислительным стрессом и локальным воспалительным ответом, указывают на механизм развития последнего, а также впервые позволяют предположить специфические методы терапии этого широко распространенного заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования выполнялись с использованием шести пигментированных кроликов-самцов породы Советская Шиншилла (возраст 6 месяцев, вес 2,3-3 кг), приобретенных на сертифицированной ферме (“Крол-Инфо”, Московская область). Перед проведением экспериментов животных содержали в течение 7 дней в индивидуальных клетках в условиях 12-часового цикла темнота/свет при 22–25°С и влажности 50–60% со свободным доступом к пище и воде. Индукцию ПССГ у кроликов проводили в соответствии с методикой, описанной в предыдущих работах [3, 5, 12]. Животных фиксировали в удерживающем устройстве и производили повторные внутримышечные инъекции анестезирующего препарата, содержащего 50 мг/мл тилетамина и 50 мг/мл золазепама, для достижения непрерывного наркотического сна продолжительностью 6 ч. Отбор слезной жидкости животных осуществляли с использованием тест-полосок Ширмера до проведения анестезии, сразу после выхода животного из наркоза (через 6 ч), а также на 1-, 3- и 7-е сутки послеоперационного периода, в течение которого животных содержали в стандартных условиях, описанных выше. Для минимизации вклада потенциальных внутрисуточных колебаний липидомного состава слезы отбор проб (за исключением образцов, получаемых на 6-й ч после введения животного в условия анестезии) осуществляли натощак в одно и то же время дня (10 ч утра). Эксперименты с животными проводили в соответствии с рекомендациями 8-го издания “Guide for the Care and Use of Laboratory Animals” of the National Research Council и “Statement for the Use of Animals in Ophthalmic and Visual Research” of The Association for Research in Vision and Ophthalmology (ARVO). Протокол исследования был утвержден комитетом по биоэтике НИИ физико-химической биологии имени А.Н. Белозерского МГУ.
Масс-спектрометрический анализ оксилипинов слезной жидкости проводили согласно методике, описанной ранее [15]. Липидные компоненты слезы элюировали метанолом (1 мл метанола на 15 мм полоски Ширмера) и выделяли методом твердофазной экстракции на колонках Oasis PRIME HBL 3cc (Waters) согласно рекомендациям производителя. Анализ проводили с использованием тройного квадрупольного масс-спектрометра Shimadzu 8040, оборудованного системой ультра HPLC Nexera, с использованием колонки Phenomenex C8 (2.1 × 150 мм × 2.6 мкм); регистрацию липидов осуществляли методом мониторинга множественных реакций. Количественное определение липидов проводили с помощью дейтерированных стандартов tetranor-PGEM-d6, 6-keto PGF1α-d4, TXB2-d4, PGF2α-d4, PGE2-d4, PGD2-d4, LTC4-d5, LTB4-d4, 5(S)-HETE-d8, 12(S)-HETE-d8, 15(S)-HETE-d8, PAF C16-d4, OEA-d4, PGA2-d4 (Cayman Chemical). Обработку спектров осуществляли с помощью программного обеспечения Shimadzu lipid mediator method package Ver. 2. Достоверность различий между группами с уровнем значимости не менее 95% оценивали с помощью параметрического t-критерия Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Масс-спектрометрический анализ оксилипинов проводили в образцах слезной жидкости, полученных сразу после выхода экспериментальных животных из наркоза, а также на 1, 3 и 7 сутки послеоперационного периода. В качестве контроля использовали образцы слезы, собранные до введения животных в условия общей анестезии. Всего в препаратах слезной жидкости кроликов было идентифицировано 17 метаболитов полиненасыщенных жирных кислот ЛК, АЛК и АК (рис. 1).
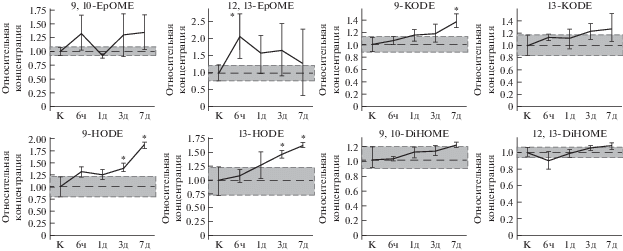
Наиболее выраженные изменения наблюдались к 7-м суткам послеоперационного периода и включали преимущественно повышение концентрации метаболитов ЛК (рис. 2). В частности, существенный рост демонстрировали 13-HODE и 9-HODE, синтезирующиеся под действием липоксигеназ, а также 9-KODE, образующийся за счет неферментативного окисления производных ЛК [13]. Последнее свидетельствует о развитии окислительного стресса клеток вовлеченных тканей глаза, с чем согласуется тот факт, что в острой фазе ответа (сразу после выхода из анестезии и на 1-е сутки послеоперационного периода) происходило также увеличение концентрации 12,13-EpOME – метаболита ЛК, образующегося под действием цитохромов в результате окислительного стресса. При этом содержание оксилипинов 9,10-EpOME, 12,13-DiHOME и 9,10-DiHOME – других производных ЛК, образование которых также катализируется ферментами семейства цитохромов [13], – не изменилось.
Рис. 2.
Динамика изменения концентрации производных ЛК в слезной жидкости животных с повреждениями роговицы в условиях общей анестезии (модель ПССГ) по отношению к концентрации соответствующих производных в слезной жидкости контрольных животных (К), принятой за единицу; ч – часы, д – дни. * – Статистически значимые отличия от контрольных образцов (р < 0.05).
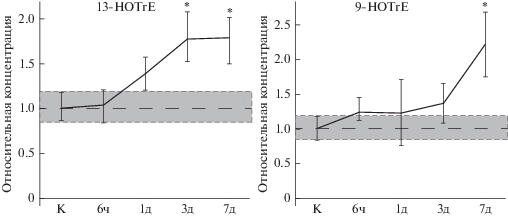
Помимо метаболитов ЛК в слезе детектировалось увеличение концентрации некоторых продуктов ферментативного процессинга АЛК, включая 9-HOTrE и 13-HOTrE (рис. 3). Указанные соединения являются продуктами реакций, катализируемых соответственно 5-липоксигеназой и 15-липоксигеназой.
Рис. 3.
Динамика изменения концентрации производных АЛК в слезной жидкости животных с повреждениями роговицы в условиях общей анестезии (модель ПССГ) по отношению к концентрации соответствующих производных в слезной жидкости контрольных животных (К), принятой за единицу; ч – часы, д – дни. * – Статистически значимые отличия от контрольных образцов (р < 0.05).
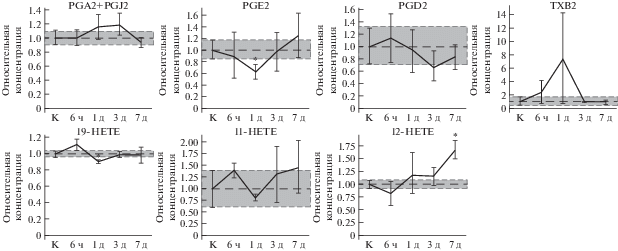
Статистически достоверных изменений концентрации производных АК, таких как простагландин D2, тромбоксан B2, простагландины А2 и J2 (продукты действия циклооксигеназ), а также 11-HETE (неферментативное окисление АК) в слезе обнаружить не удалось (рис. 4). Тем не менее, к 7-м суткам послеоперационного периода наблюдался рост концентрации 12-HETE – метаболита АК, образующегося в результате функционирования 12-липоксигеназы. Кроме того, в острой фазе (на первый день после анестезии) наблюдалось снижение концентрации 19-HETE и PGE2 – продуктов действия ферментов семейства цитохромов и циклооксигеназ, соответственно [14].
Рис. 4.
Динамика изменения концентрации производных АК в слезной жидкости животных с повреждениями роговицы в условиях общей анестезии (модель ПССГ) по отношению к концентрации соответствующих производных в слезной жидкости контрольных животных (К), принятой за единицу; ч – часы, д – дни. * – Статистически значимые отличия от контрольных образцов (р < 0.05).
Таким образом, с использованием экспериментальной модели ПССГ у животных (кроликов) впервые показано, что развитие повреждения роговицы в условиях общей анестезии сопровождается выраженными изменениями содержания производных жирных кислот в слезной жидкости. Наиболее существенный рост демонстрируют метаболиты ЛК и АЛК, в то время как содержание липидов каскада АК практически не меняется. Сделанные наблюдения указывают на важную роль каскадов ЛК и АЛК в развитии воспалительного ответа при ПССГ. Необходимо отметить, что в слезе экспериментальных животных происходит накопление метаболитов ЛК, образующихся в результате неферментативного окисления или процессинга под действием цитохромов в условиях окислительного стресса. Полученные данные согласуются с зафиксированным ранее увеличением уровня перекисного окисления липидов роговицы, а также снижением антиоксидантной активности слезы при ПССГ [3] и свидетельствуют о важной роли окислительного стресса в механизме развития этого заболевания. Установлено, что подавляющее большинство воспалительных метаболитов ЛК, АЛК и АК, содержание которых меняется в слезной жидкости животных с ПССГ, образуется в результате действия ферментов семейства липоксигеназ, в то время как содержание продуктов активности циклооксигеназ практически не меняется. Полученные данные позволяют предположить низкий терапевтический потенциал нестероидных противовоспалительных препаратов (мишенями которых являются циклооксигеназы) в отношении воспалительного компонента ПССГ. В то же время можно ожидать высокую эффективность антиоксидантов [3] и селективных ингибиторов липоксигеназ (таких, как, например, ингибиторы 5-липоксигеназы [23]) в качестве препаратов, подавляющих развитие ПССГ, что должно учитываться при разработке комплексной терапии этого заболевания.
Работа выполнена при финансовой поддержке Российского научного фонда, грант № 16-15-00255 (постановка модели ПССГ кроликов; получение и обработка образцов слезной жидкости кроликов; идентификация и количественное определение метаболитов ЛК, АЛК и АК в слезной жидкости кроликов методом масс-спектрометрии; анализ полученных данных). Разработка методики масс-спектрометрического определения метаболитов ЛК, АЛК и АК в слезной жидкости кроликов осуществлялась при поддержке программы РУДН “5-100”.
Список литературы
The definition and classification of dry eye disease: Report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop (2007). Ocul. Surf. 5, 75–92.
Fiscella R.G. 2011. Understanding dry eye disease: A managed care perspective. Am. J. Manag. Care. 17 Suppl 16, S432–439.
Zernii E.Y., Gancharova O.S., Baksheeva V.E., Golovastova M.O., Kabanova E.I., Savchenko M.S., Tiulina V.V., Sotnikova L.F., Zamyatnin A.A.,Jr., Philippov P.P., Senin II. 2017. Mitochondria-targeted antioxidant SkQ1 prevents anesthesia-induced dry eye syndrome. Oxid. Med. Cell. Longev. 2017, 9281519.
Zernii E.Y., Baksheeva V.E., Yani E.V., Philippov P.P., Senin II. 2019. Therapeutic proteins for treatment of corneal epithelial defects. Curr. Med. Chem. 26, 517–545.
Zernii E.Y., Golovastova M.O., Baksheeva V.E., Kabanova E.I., Ishutina I.E., Gancharova O.S., Gusev A.E., Savchenko M.S., Loboda A.P., Sotnikova L.F., Zamyatnin A.A., Jr., Philippov P.P., Senin II. 2016. Alterations in tear biochemistry associated with postanesthetic chronic dry eye syndrome. Biochemistry (Mosc.) 81, 1549–1557.
Lai C.T., Yao W.C., Lin S.Y., Liu H.Y., Chang H.W., Hu F.R., Chen W.L. 2015. Changes of ocular surface and the inflammatory response in a rabbit model of short-term exposure keratopathy. Plos One. 10 (9), e0137186.
Baksheeva V.E., Gancharova O.S., Tiulina V.V., Iomdina E.N., Zamyatnin A.A., Jr., Philippov P.P., Zernii E.Y., Senin II. 2018. Iatrogenic damage of eye tissues: Current problems and possible solutions. Biochemistry. (Mosc.) 83, 1563–1574.
Malafa M.M., Coleman J.E., Bowman R.W., Rohrich R.J. 2016. Perioperative corneal abrasion: Updated guidelines for prevention and management. Plastic Reconstructive Surgery. 137, 790e–798e.
Batra Y.K., Bali I.M. 1977. Corneal abrasions during general anesthesia. Anesth. Analg. 56, 363–365.
Messmer E.M. 2015. The pathophysiology, diagnosis, and treatment of dry eye disease. Deutsches Arzteblatt Internat. 112, (5) 71–81.
Skalicky S.E., Petsoglou C., Gurbaxani A., Fraser C.L., McCluskey P. 2013. New agents for treating dry eye syndrome. Curr. Allergy Asthma Repts. 13, 322–328.
Zernii E. Y., Gancharova O. S., Ishutina I. E., Bak-sheeva V.E., Golovastova M.O., Kabanova E.I., Savchenko M.S., Serebryakova M.V., Sotnikova L.F., Zamyatnin A.A., Jr., Philippov P.P., Senin, II. 2016. Mechanisms of perioperative corneal abrasions: Alterations in tear film proteome. Biochemistry (Moscow), Supplement Series B: Biomedical Chemistry, 11, 186–193.
Gabbs M., Leng S., Devassy J.G., Monirujjaman M., Aukema H.M. 2015. Advances in our understanding of oxylipins derived from dietary PUFAs. Adv. Nutr. 6, 513–540.
Сергеева М.Г., Варфоломеева А.Т. 2006. Каскад арахидоновой кислоты. М.: Народное образование.
Чистяков Д.В., Азбукина Н.В., Горяинов С.В., Чистяков В.В., Ганчарова О.С., Тюлина В.В., Бакшеева В.Е., Иомдина Е.Н., Филиппов П.П., Сергеева М.Г., Сенин И.И., Зерний Е.Ю. 2019. Воспалительные метаболиты арахидоновой кислоты в слёзной жидкости при индуцированном ультрафиолетовым излучением повреждении роговицы. Биомедицинская химия, 65 (1), 33-40.
Ambaw Y.A., Chao C., Ji S., Raida M., Torta F., Wenk M.R., Tong L. 2018. Tear eicosanoids in healthy people and ocular surface disease. Sci. Rep. 8, 11296.
Dennis E.A., Norris P.C. 2015. Eicosanoid storm in infection and inflammation. Nat. Rev. Immunol. 15, 511–523.
Craig J.P., Nichols K.K., Akpek E.K., Caffery B., Dua H.S., Joo C.K., Liu Z.G., Nelson J.D., Ni-chols J.J., Tsubota K., Stapleton F. 2017. TFOS DEWS II definition and classification report. Ocular Surface 15, 276–283.
Shim J., Park C., Lee H.S., Park M.S., Lim H.T., Chauhan S., Dana R., Lee H., Lee H.K. 2012. Change in prostaglandin expression levels and synthesizing activities in dry eye disease. Ophthalmology. 119, 2211–2219.
Mieyal P.A., Dunn M.W., Schwartzman M.L. 2001. Detection of endogenous 12-hydroxyeicosatrienoic acid in human tear film. Investigative Ophthalmol. Visual Sci. 42, 328–332.
Chistyakov D.V., Azbukina N.V., Astakhova A.A., Goriainov S.V., Chistyakov V.V., Sergeeva M.G. 2018. Sex-mediated differences in LPS induced alterations of TNFalpha, IL-10 expression, and prostaglandin synthesis in primary astrocytes. Int. J. Mol. Sci. 19 (9), E2793. https://doi.org/10.3390/ijms19092793
Chistyakov D.V., Grabeklis S., Goriainov S.V., Chistyakov V.V., Sergeeva M.G., Reiser G. 2018. Astrocytes synthesize primary and cyclopentenone prostaglandins that are negative regulators of their proliferation. Biochem. Biophys. Res. Commun. 500, 204–210.
Andoh T., Sakai K., Urashima M., Kitazawa K., Honma A., Kuraishi Y. 2012. Involvement of leukotriene B4 in itching in a mouse model of ocular allergy. Exp. Eye Res. 98, 97–103.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


