Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 6, стр. 439-449
Влияние экзогенного ATP на функциональные ответы гранулоцитов костного мозга мыши
Д. А. Серов a, *, М. Е. Асташев a, И. В. Тихонова a, В. Г. Сафронова a
a Институт биофизики клетки Российской академии наук – обособленное подразделение
Федерального государственного бюджетного учреждения науки Федеральный исследовательский центр
“Пущинский научный центр биологических исследований Российской академии наук”
142290 Московская обл., Пущино,
Институтская ул., 3, Россия
* E-mail: dmitriy_serov_91@mail.ru
Поступила в редакцию 17.04.2019
После доработки 17.07.2019
Принята к публикации 18.07.2019
Аннотация
Внеклеточный ATP – мощный воспалительный медиатор и регулятор активности нейтрофильных гранулоцитов (нейтрофилов) в очаге воспаления, роль которого в регуляции функционально интактных гранулоцитов костного мозга не изучена. Исследовано влияние ATP на динамику изменения концентрации ионов кальция ([Ca2+]i) в цитоплазме, генерацию активных форм кислорода (АФК) и адгезию гранулоцитов. Изменение [Ca2+]i оценивали методом флуоресцентной видеомикроскопии с использованием Fura-2 АМ. Поиск клеток с кальциевой активностью проводили с помощью разработанной нами автоматизированной процедуры. АФК регистрировали с использованием метода люминол-зависимой хемилюминесценции. Адгезию оценивали в стандартном адгезионном тесте. В популяции гранулоцитов мыши идентифицированы клетки, отвечавшие генерацией кальциевых спайков на 10 мкМ ATP (35.2 ± 4.0%). Автоматизированный поиск позволил выделить четыре субпопуляции клеток: без кальциевой активности (53.1 ± 8.2%), отвечавших на ATP (23.4 ± ± 4.9%), на добавку раствора Хенкса (16.9 ± 2.5%), на ATP и раствор Хенкса (6.7 ± 1.5%). ATP значительно усиливал адгезию гранулоцитов. Апираза, гидролизующая эндогенный ATP, не вызывала значительных изменений адгезии. ATP не влиял на дыхательный взрыв, индуцированный бактериальным пептидом N-формил-MLF (fMLF). Ответ на fMLF значительно усиливался под действием апиразы, в присутствии цитохалазина D данный эффект не наблюдался. Таким образом, экзогенный ATP усиливал генерацию кальциевых спайков в популяции гранулоцитов костного мозга мыши и их адгезионные свойства. Вероятно, частичное подавляющее действие эндогенного ATP на дыхательный взрыв обусловлено механизмом, вовлекающим цитоскелет.
ВВЕДЕНИЕ
Нейтрофильные гранулоциты (нейтрофилы) являются ключевыми эффекторами врожденного иммунитета, они играют важную роль в инактивации патогенов. Нейтрофилы выполняют многочисленные функции, включая фагоцитоз, дегрануляцию, генерацию активных форм кислорода (АФК) [1], а также участвуют в функционировании адаптивного иммунитета [2]. Известно, что даже у одного вида животных состояние нейтрофилов зависит от их локализации [3]. Гранулоциты костного мозга отличаются от гранулоцитов из очага острого воспаления, активированных in vivo, интактным статусом.
Внеклеточный ATP, высвобождаемый при инфекции, механическом повреждении тканей, апоптозе или некрозе клеток, является одним из ключевых активаторов иммунных клеток [4, 5]. В ряде случаев сами нейтрофилы могут быть источником ATP, который высвобождается через поры, образованные коннексином 43, в частности, при стимуляции бактериальным пептидом N-формил-Met-Leu-Phe (fMLF) [6]. Секретируемый ATP усиливал миграцию и активируемый fMLF дыхательный взрыв нейтрофилов мыши, выделенных из очага острого воспаления [7]. Его действие на гранулоциты костного мозга не исследовано.
Нейтрофилы человека экспрессируют широкий спектр пуриновых рецепторов, чувствительных к ATP: P2X1, P2X5, P2X7, P2Y2, P2Y6, P2Y11 [8–12]. На нейтрофилах мыши локализованы рецепторы P2X1, P2X7 и P2Y2 [9, 10, 13]. Рецептор P2X7 обнаружен на гранулоцитах костного мозга мыши, P2X1 и P2Y2 – на нейтрофилах из очага воспаления. Рецепторы семейства P2X представляют собой тримерные лиганд-управляемые катионные каналы, рецепторы семейства P2Y – семидоменные трансмембранные рецепторы, ассоциированные с G-белками [8]. Активация рецепторов семейств P2X и P2Y приводит к увеличению концентрации кальция в цитоплазме, запуску внутриклеточных сигнальных каскадов, регулирующих функциональные ответы гранулоцитов: хемотаксис, адгезию, продукцию АФК [7, 13, 14]. Цитоплазматический кальций является универсальным вторичным мессенджером, регулирующим β2-интегрин-зависимую адгезию нейтрофилов [15], сборку NADPH-оксидазы и генерацию АФК [16]. Концентрация ионов кальция ([Ca2+]i) в цитоплазме служит важной характеристикой функциональной активности нейтрофилов. Экспрессия рецепторов P2X2 и P2Y2 на нейтрофильных гранулоцитах костного мозга и их участие в регуляции функциональных ответов на ATP не исследованы.
В работах, посвященных влиянию ATP на функции нейтрофилов из очага воспаления, не учитывали неоднородность популяции нейтрофилов [7, 10]. Однако накапливаются факты, показывающие фенотипическую гетерогенность и функциональную многосторонность популяции нейтрофилов [17]. Получены экспериментальные данные, указывающие на неоднородность экспрессии поверхностных маркеров в популяции нейтрофилов (например, CD16, CD11b) и продукции АФК в ответ на fMLF [18]. Описаны нейтрофилы нормальной плотности с классической провоспалительной активностью и нейтрофилы пониженной плотности, проявляющие иммуносупрессирующие свойства [19, 20]. Ранее мы обнаружили неоднородность популяции гранулоцитов из очага острого воспаления по чувствительности к никотину: только 30% клеток отвечали на никотин генерацией кальциевых спайков [21]. Вопрос о неоднородности популяции нейтрофильных гранулоцитов по чувствительности к другим биологически активным веществам, в частности к ATP, на сегодняшний день остается открытым. В настоящей работе исследовано влияние ATP на функциональные ответы гранулоцитов в популяции в целом, оценена неоднородность популяции по динамике изменения [Ca2+]i. в ответ на ATP. Рассмотрены такие функциональные ответы, связанные с изменением [Ca2+]i, как генерация АФК и адгезия.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы. В работе использовали аденозин-5'-трифосфат (ATP), бактериальный пептид N-фомил-MLF (fMLF), ATP-дифосфогидролазу ([EC 3.6.1.5], апираза), цитохалазин D, 5-амино-2,3-дигидро-1,4-фталазиндион (люминол), перколл (все Sigma Aldrich, США); двухволновой кальций-чувствительный зонд Fura-2 AM (Thermo Fisher Scientific, США), культуральную среду RPMI 1640 (Gibco, Thermo Fisher Scientific, США), антитела (клон RB6-8C5) к рецептору Ly-6G/Ly-6C (Gr-1), меченные фикоэритрином (PE) (BioLegend, США), бисбензидин H 33258 (2-[2-(4-гидроксифенил)-6-бензимидазол]-6-(1-метил-l4-пиперазил)-бензимидазол) (Merck/Millipore, Германия), краситель Романовского-Гимза (Минимед-Р, Россия), этанол, изопропанол (Эпифань, Тульская обл., Россия).
Животные. В исследовании использованы мыши-самцы линии BALB/c массой 22–30 г. Животные были приобретены в питомнике лабораторных животных “ПУЩИНО” (ФИБХ РАН, Пущино, Россия). Все эксперименты проведены в соответствии с протоколами, одобренными комитетом по этике Института биофизики клетки РАН (No.12306, 2006). Животные были адаптированы к конвенциональным условиям и получали питье и корм accesso libero.
Изоляция гранулоцитов. Гранулоциты костного мозга выделяли методом центрифугирования в градиенте плотности перколла по стандартной методике [21]. Выделенные клетки промывали и ресуспендировали в среде Хенкса (мМ): 138 NaCl, 6 KCl, 1 MgSO4, 1 Na2HPO4, 5 NaHCO3, 5.5 глюкоза, 10 HEPES, pH 7.3. Клетки хранили при 4°С в течение 1 ч перед началом эксперимента. Нейтрофильные гранулоциты идентифицировали по окрашиванию антителом к Gr-1, меченным PE, и форме ядра, которое окрашивали с помощью бисбензидина H 33258. Доля сегментоядерных Gr-1+ клеток составляла более 80%. Выживаемость клеток, оцениваемая по окраске трипановым синим, составляла 98–100%.
Оценка концентрации ионов кальция в цитоплазме гранулоцитов. Влияние ATP на динамику концентрации свободного кальция в цитоплазме определяли по следующему протоколу: клетки (106 клеток/мл) наносили на круглое покровное стекло (диаметр 25 мм) в капле полного сбалансированного солевого раствора Хенкса объемом 100 мкл и инкубировали во влажной камере в течение 20 мин при 37°С для прикрепления. Клетки окрашивали 5 мкМ Fura-2 AM в течение 45 мин при 37°C в присутствии апиразы (1 ед. акт. мл–1) для удаления эндогенного АТР.
Непосредственно перед измерением стекло с клетками помещали в камеру для покровных стекол (Warner Instruments, США), трижды промывали 1 мл раствора Хенкса. Регистрировали флуоресценцию клеток в поле зрения при возбуждающих длинах волн 340 (F340) и 380 (F380) нм с помощью флуоресцентной имиджинг-системы, собранной Асташевым М.Е. [22]. Измерения проводили при постоянном протоке солевой среды и термостатировании при 37°С, что обеспечивалось подогревом предметного столика с камерой для покровных стекол и подаваемых растворов. В каждом эксперименте оценивали [Ca2+]i без воздействий (базовый уровень) в течение 1 мин после добавки раствора Хенкса (контроль, 1 мин) или 10 мкМ ATP (2 мин).
Запись и первичную обработку данных проводили с помощью программного обеспечения WinFluorXE (J. Demster, Strathclyde Electrophysiology Software, Великобритания), дальнейшую обработку – с помощью программы ImageJ (NIH, США). Изменение [Ca2+]i оценивали по отношению F340/F380. Для автоматического поиска клеток с кальциевыми спайками использовали программу, основанную на расчете статистических моментов третьего (асимметрия, As) и четвертого (эксцесс, Ex) порядков для распределения значений F340/F380 по частоте встречаемости в записи от каждой отдельной клетки [23].
Кальциевые спайки представляют собой транзиентные сигналы: кратковременное увеличение исследуемого параметра (F340/F380) с последующим восстановлением до исходного уровня. В астрофизике для поиска транзиентых сигналов применяется подход, основанный на рассмотрении последовательности измерений динамической характеристики в виде набора индивидуальных независимых измерений. В этом случае проводят анализ формы распределения значений исследуемого параметра по частоте встречаемости путем вычисления статистических характеристик распределения – моментов [24]. Формула для вычисления момента n-го порядка μn имеет вид:
где $\bar {x}$– среднее арифметическое ряда данных, N – количество изменений.Второй момент μ2 – это среднеквадратическое отклонение, применяемое как мера размаха ряда данных. Моменты более высоких порядков также имеют геометрический смысл для описания формы распределения. Третий момент μ3 позволяет вычислить безразмерную величину асимметрии (As) распределения:
Величина As показывает степень асимметричности формы распределения. При наличии транзиентных сигналов в экспериментальной записи величина As будет принимать положительные значения, при отсутствии – колебаться около нуля [25].
Четвертый момент μ4 позволяет оценить безразмерную величину эксцесса (Ex). Величина Ex характеризует островершинность или плосковершинность распределения [24, 26]. В случае появления транзиентных сигналов данная величина принимает положительные значения, при отсутствии транзиентных сигналов – варьирует около нуля.
Величины As и Ex рассчитывали по указанным формулам. В каждом образце анализировали не менее 500 клеток. Для каждой клетки в автоматическом режиме строили временнóй ряд F340/F380 и вычисляли значения As и Ex для всех вариантов эксперимента: As0, Ex0 (база), As1, Ex1 (добавка раствора Хенкса) и As2, Ex2 (добавка 10 мкМ ATP). Строили двумерные гистограммы распределения клеток в системах координат: As0Ex0, As1Ex1, As2Ex2. В каждом эксперименте выделяли область, соответствующую клеткам с транзиентными кальциевыми ответами, и подсчитывали количество клеток, попадающих в выделенную область, оценивая таким способом долю активных клеток (рис. 2а, 2б). Для оценки неоднородности популяции по доле клеток с характерной активностью строили двумерные диаграммы распределения в системе координат As1As2 в каждом эксперименте, затем данные усредняли по всем экспериментам (рис. 2в, 2г). Для каждого из экспериментальных условий проведено пять независимых измерений, каждое из которых выполнено на клетках отдельного животного.
Адгезионная проба. Адгезионная проба выполнена по протоколу, описанному ранее [21]. Суспензию гранулоцитов (по 3 × 105 клеток) добавляли в лунки 96-луночного планшета (Corning, США), содержащие раствор Хенкса с добавлением 1 мМ Ca2+. В определенные лунки предварительно добавляли 10 мкМ ATP или апиразу (1 ед. акт. мл–1). После фиксации 96% этанолом, окрашивания красителем Романовского-Гимза и лизиса изопропанолом измеряли светопоглощение образцов при длине волны 492 нм (OD492) на микропланшетном фотометре Infinity F50 (Tecan, Австрия). Значения OD492 в каждом образце нормировали по значениям OD492, полученным на контрольных клетках. Проведено шесть независимых измерений, каждое из которых выполнено на клетках отдельного животного.
Оценка продукции АФК. Продукцию АФК гранулоцитами оценивали методом люминол-зависимой хемилюминесценции (ХЛ) по стандартной методике [21]. Для каждого измерения готовили 12 образцов: рабочий объем 200 мкл, 2 × 105 клеток в среде Хенкса, содержащей 1 мМ Ca2+ и 0.35 мМ люминол. Образцы инкубировали в присутствии 10 мкМ ATP или апиразы (1 ед. акт. мл–1) или апиразы (1 ед. акт. мл–1) в сочетании с 5 мкМ цитохалазином D в течение 20 мин при 37°C. Контролем служили клетки, инкубируемые без добавок. ХЛ регистрировали на приборе ХЕМИЛЮМ-12, разработанном Санталовым Б.Ф. (ИБК РАН, Пущино). После регистрации базового уровня ХЛ инициировали респираторный взрыв 5 мкМ fMLF. Образование АФК оценивали по максимальному и интегральному значениям интенсивности ХЛ (интенсивность и продукция АФК соответственно). Продукцию АФК рассчитывали за 50 с после стимуляции fMLF. Эффект исследуемого вещества рассчитывали как отношение параметра, полученного от клеток, обработанных исследуемым агентом, к параметру контрольных клеток, принятому за 100%.
Статистическая обработка результатов. Результаты обрабатывали с помощью программы SigmaPlot (Systat Software, Cranes Software International Ltd.). Экспериментальные данные представлены в виде среднего значения со стандартной ошибкой. Статистическую значимость различий оценивали по критерию Вилкоксона.
РЕЗУЛЬТАТЫ
Са2-активность
В популяции гранулоцитов до воздействий присутствовали клетки со спонтанной кальциевой активностью (рис. 1а) и без нее (рис. 1б). Распределение значений F340/F380 в клетках без исходной кальциевой активности имело вид симметричных пиков и характеризовалось величинами As ≤ 0.6 и Ex ≈ 0 (рис. 1г). Клетки, генерирующие кальциевые спайки, характеризовались распределениями F340/F380 со значениями As > > 0.6 и Ex > 0. Распределения F340/F380 активных клеток были шире по сравнению с распределениями неактивных клеток и имели форму множественных пиков (рис. 1в). Таким образом, по значениям As, отражающим форму распределения F340/F380, можно оценивать наличие кальциевых спайков в каждой отдельной клетке. Часть клеток отвечала генерацией Ca2+-спайка на добавление раствора Хенкса и/или реагировала на последующую аппликацию 10 мкМ ATP (рис. 1д). Ответы клеток не были синхронными и происходили с лаг-периодом, длительность которого варьировала. В популяции присутствовали клетки, не отвечающие на добавку ATP (рис. 1е).
Рис. 1.
Кальциевая активность в популяции гранулоцитов костного мозга мыши и ее анализ. Примеры записей F340/F380 клеток со спонтанной кальциевой активностью (а) и без нее (б). Примеры распределений значений F340/F380 по частоте встречаемости для активных (в) и неактивных (г) клеток. Примеры записей F340/F380 одиночных клеток, ответивших (д) или не ответивших (е) кальциевыми спайками на 10 мкМ ATP (момент добавки отмечен стрелкой). В блоках в, г, д, е указаны значения асимметрии (As) и эксцесса (Ex) для распределения значений F340/F380 по частоте встречаемости.
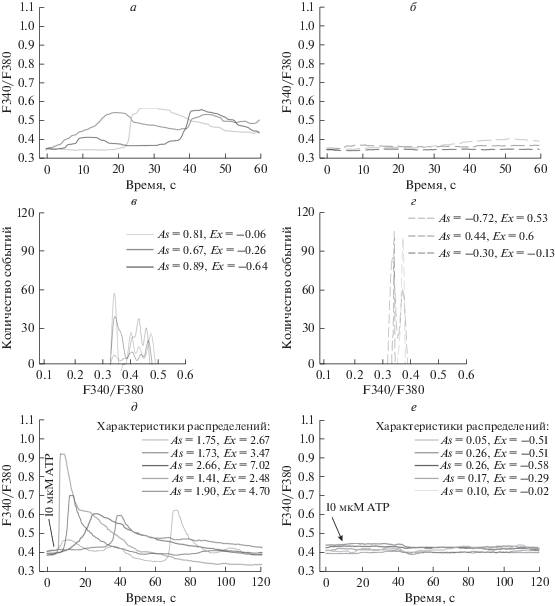
Во всех экспериментальных условиях распределение клеток в координатах As и Ex имело подковообразную форму (пример на рис. 2а). Клетки, не проявлявшие Са2+-мобилизующей активности, находились в основании “подковы”, характеризовались значениями Ex и As, близкими к 0. Отрицательные значения As со значениями Ex > 10 характерны для клеток с непрерывным монотонным увеличением [Са2+]i (“натекающие” клетки). При дальнейшем анализе указанные клетки не учитывались (рис. 2а). Клетки, ответившие на 10 мкМ ATP кальциевыми спайками, идентифицировали по значениям As > 0.6 и Ex > 0. Статистический анализ показал, что до каких-либо воздействий кальциевая активность присутствует в среднем у 17.1 ± 2.7% клеток (рис. 2б). На добавку раствора Хенкса реагировали 23.0 ± 2.5% гранулоцитов. Доля гранулоцитов, ответивших на 10 мкМ ATP, составляла 35.2 ± 4.0%, что было статистически выше количества активных клеток при базовых условиях или при добавке раствора Хенкса (n = 5, p < 0.05). Полученные данные указывают на присутствие субпопуляции гранулоцитов с высокой чувствительностью к ATP.
Рис. 2.
Анализ гетерогенности популяции гранулоцитов костного мозга мыши. а – Двумерная гистограмма распределения клеток по асимметрии As2 и эксцессу Ex2, рассчитанных для распределений F340/F380 клеток в одной из анализируемых популяций в присутствии 10 мкМ ATP. На гистограмме отображены параметры клеток после подачи 10 мкМ ATP. Выделенная сплошной линией область – клетки с характеристиками As > 0.6 и Ex > 0. Выделенная пунктиром область – клетки с характеристиками As ≤ 0 и Ex > 10, N – количество клеток, попавших в выделенные области. б – Среднее значение доли клеток с кальциевыми спайками в популяции при базовых условиях (1), после добавки раствора Хенкса (2) или в присутствии 10 мкМ ATP (3), p < 0.05, n = 5. в – Двумерная гистограмма распределения клеток в системе координат As1 (подача раствора Хенкса) и As2 (10 мкМ ATP): слева внизу (As1 ≤ 0.6, As2 ≤ 0.6) – неактивные клетки; справа снизу (As1 > 0.6, As2 ≤ 0.6) – клетки, ответившие кальциевыми спайками только на добавку раствора Хенкса; слева сверху (As1 ≤ 0.6, As2 > 0.6) – клетки, ответившие только на 10 мкМ ATP; справа сверху (As1 > 0.6, As2 > 0.6) – клетки, ответившие на обе добавки. N – количество клеток в каждой из четвертей (всего 634 клетки). г – Диаграмма, отражающая усредненное соотношение гранулоцитов костного мозга мыши по чувствительности к 10 мкМ ATP и/или механическому воздействию (добавка раствора Хенска). В каждом образце анализировали не менее 500 клеток.
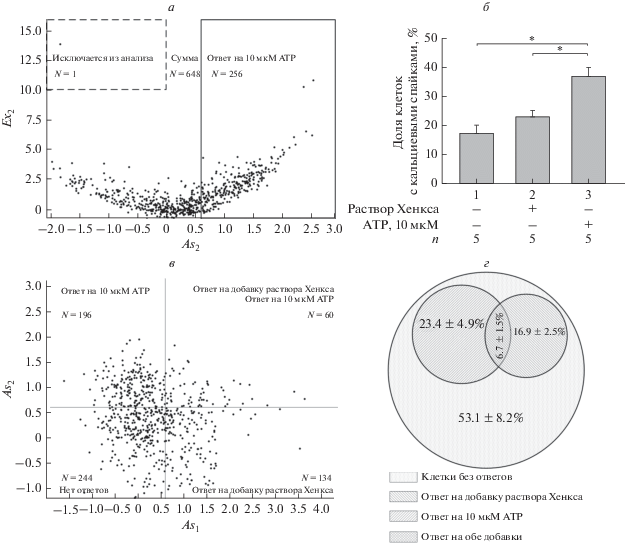
Далее мы проанализировали полученные данные в координатах As1As2, т.е. для каждой клетки были сопоставлены значения асимметрии после добавки раствора Хенкса без ATP и в его присутствии (рис. 2в). Были выделены четыре субпопуляции клеток: 1) без Ca2+-активности в ходе всего эксперимента; 2) генерирующие Ca2+-спайки в ответ на добавку раствора Хенкса (механическое воздействие); 3) генерирующие Ca2+-спайки в ответ на 10 мкМ ATP; 4) генерирующие Ca2+-спайки в ответ на ATP и добавку раствора Хенкса. Оказалось, что к первой группе относится 53.1 ± 8.2% клеток, ко второй – 16.9 ± 2.5%, к третьей – 23.4 ± 4.9%, к четвертой – 6.7 ± 1.5% (рис. 2г). Таким образом, популяция гранулоцитов костного мозга неоднородна по способности клеток генерировать кальциевые спайки в ответ на ATP.
Функциональные ответы
Далее мы исследовали влияние ATP на функции, в которых участвует Ca2+-сигнализация: адгезия и дыхательный взрыв [15, 16]. Мы оценивали эффект ATP на популяцию изолированных гранулоцитов костного мозга в целом. Известно, что гранулоциты разных фенотипов в популяции могут проявлять себя специфическим образом в функциональных ответах [27, 28]. Однако изучение реакций отдельных групп клеток требует дополнительных процедур механического разделения, что не входило в задачи данной работы.
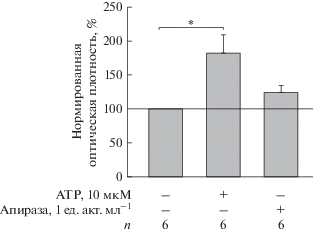
Гранулоциты реагировали на 10 мкМ ATP усилением адгезии практически в 2 раза по сравнению с контрольными клетками (рис. 3). Апираза (1 ед. акт. мл–1) не оказывала значительного влияния на адгезию, что указывает на отсутствие влияния эндогенного ATP на адгезию гранулоцитов, тогда как экзогенный ATP может значительно модифицировать адгезионные свойства гранулоцитов.
Рис. 3.
Влияние ATP на адгезию гранулоцитов костного мозга. ATP вносили в конечной концентрации 10 мкМ, апиразу – 1 ед. акт. мл–1. Эффект исследуемого вещества рассчитывали как отношение параметра, полученного от клеток, обработанных данным агентом, к параметру контрольных клеток, принятому за 100%. *p < 0.05, n = 6.
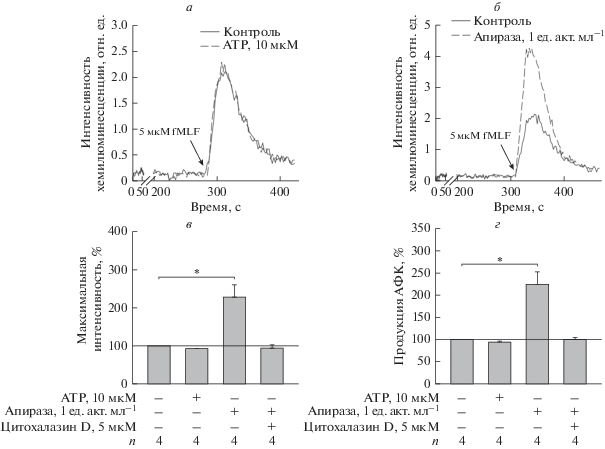
Добавление 10 мкМ ATP не влияло на базовый уровень генерации АФК гранулоцитами и не инициировало респираторный взрыв. Респираторный взрыв, инициированный 5 мкМ fMLF, не изменялся при действии 10 мкМ ATP (рис. 4а). Предварительная инкубация клеток с апиразой (1 ед. акт. мл–1) статистически значимо увеличивала амплитуду ответа и продукцию АФК в ответ на 5 мкМ fLMF (рис. 4б). При совместном действии апиразы и 5 мкМ цитохалазина D ответ на 5 мкМ fMLF не изменялся по сравнению с ответом контрольных клеток (рис. 4в, 4г), что указывает на участие актинового цитоскелета в регуляции эндогенным ATP продукции АФК гранулоцитами.
Рис. 4.
Влияние ATP на вызванный fMLF дыхательный взрыв гранулоцитов костного мозга мыши. Дыхательный взрыв инициировали 5 мкМ fMLF (отмечено стрелкой). Пробы предварительно инкубировали без добавок (контроль) или с 10 мкМ ATP, или с апиразой (1 ед. акт. мл–1), или с 5 мкМ цитохалазином D в течение 20 мин во влажной камере при 37°С. Приведены примеры экспериментальных записей люминол-зависимой хемилюминесценции в ответ на fMLF в контроле и после инкубации с ATP (a) или апиразой (б) в течение 20 мин, момент добавки fMLF показан стрелкой. в – Действие ATP, апиразы и цитохалазина D на максимальную интенсивность люминол-зависимой хемилюминесценции, вызванной fMLF. г – Действие ATP, апиразы и цитохалазина D на продукцию АФК в течение 50 с после добавки fMLF. Эффект исследуемого вещества рассчитывали как отношение параметра, полученного от клеток, обработанных данным агентом, к параметру контрольных клеток, принятому за 100%. *p < 0.05, n = 6.
ОБСУЖДЕНИЕ
Согласно результатам работы, ATP участвует в регуляции активности гранулоцитов костного мозга: экзогенный ATP вызывает генерацию кальциевых спайков в 35.2 ± 4.0% клеток и в 2 раза усиливает адгезивные свойства; эндогенный ATP, вероятно, регулирует интенсивность дыхательного взрыва по механизму, вовлекающему цитоскелет (рис. 5).
Рис. 5.
Схематическое представление компонентов ATP-зависимых сигнальных путей в гранулоцитах костного мозга.
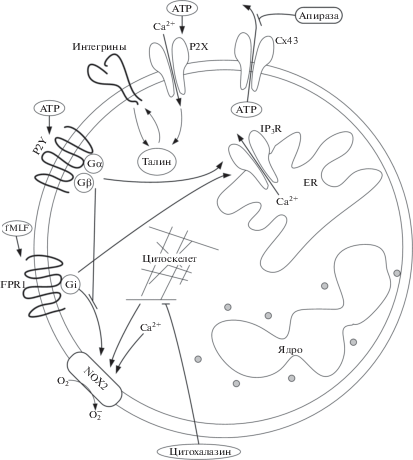
В популяции гранулоцитов содержатся клетки с разной чувствительностью к ATP. Неоднородность клеток по чувствительности к ATP проявлялась не только в наличии или отсутствии кальциевого ответа, но отражалась на временны́х характеристиках ответов (рис. 1д). Часть клеток отвечала на ATP c незначительной задержкой после подачи стимула, другая часть – с задержкой около минуты. Кальциевые ответы в течение первых секунд после добавки ATP, вероятно, вызваны активацией ионотропных рецепторов семейства P2X [9]. Кальциевые спайки, возникшие с задержкой после добавки ATP, возможно, обусловлены активацией метаботропных рецепторов семейства P2Y либо внутриклеточного сигнального каскада, запускаемого входом кальция через рецепторы семейства P2X [8]. Предположение основано на экспериментальном определении экспрессии рецепторов семейств P2X и P2Y в гранулоцитах [7–10, 28]. Разнородность гранулоцитов по чувствительности к ATP, возможно, объясняется присутствием в популяции клеток с разным набором и уровнями экспрессии рецепторов семейств P2X и/или P2Y. Также могут играть роль другие факторы, в частности, экспрессия поверхностных маркеров зрелости [7, 19]. Идентификация типов рецепторов, регулирующих функциональные ответы гранулоцитов мыши, требует дальнейших исследований.
Мы впервые применили автоматизированный алгоритм поиска клеток с кальциевыми спайками в популяции на основе анализа статистических моментов третьего и четвертого порядков. Данный подход снижает время, затрачиваемое на обработку данных, и исключает субъективную интерпретацию анализируемых сигналов, что зачастую происходит при выборе клеток вручную.
Обнаруженная нами группа гранулоцитов, отвечающая кальциевыми спайками на добавку раствора Хенкса, вероятно, обладает высокой чувствительностью к напряжению сдвига, что усиливает адгезию нейтрофилов к эндотелию и эндотелиальной трансмиграции [30]. Напряжение сдвига вызывает увеличение экспрессии CD11b/CD18 на нейтрофилах человека и изменение их морфологии, а также усиливает эффект фактора активации тромбоцитов на указанные параметры [31].
Нами впервые обнаружено усиление адгезии гранулоцитов костного мозга мыши в ответ на ATP (рис. 3). Полученный результат согласуется с данными, полученными на изолированных нейтрофилах человека [8, 32]. Показано, что в нейтрофилах мыши действие ATP может быть опосредовано рецепторами P2X1 [13]. Усиление адгезии гранулоцитов в ответ на ATP, вероятно, связано с увеличением доли клеток с кальциевыми спайками (рис. 1 и 2), так как известно, что кальциевая сигнализация регулирует функционирование интегринов и адгезию клеток [33].
Нами показано, что 10 мкМ ATP не модифицировал вызванную fMLF продукцию АФК гранулоцитами костного мозга мыши (рис. 4). Однако обнаружено усиление продукции АФК нейтрофилами периферической крови человека под действием ATP [7]. Авторы оценивали продукцию АФК по изменению мембранного потенциала митохондрий. Расхождение наших результатов с этими данными может объясняться различиями в исследуемых объектах и в методике оценки продукции АФК. Показано также, что ATP вызывает генерацию кальциевых спайков в нейтрофилах человека, но не индуцирует заметного усиления активности NADPH-оксидазы [14], что согласуется с нашими результатами. Противоречие между увеличением [Са2+]i под влиянием АТР и отсутствием эффекта АТР на уровень продукции АФК частично можно объяснить тем, что нейтрофилы несут на своей поверхности эктоапиразы CD39 и CD73, которые гидролизуют ATP до AMP и AMP до аденозина соответственно [34, 35]. Таким образом, внесение ATP может привести к активации не только рецепторов семейств P2X или P2Y, но и рецепторов аденозина (AR) [36]. Аденозин распознается рецепторами A2B и A3, активация которых снижает продукцию АФК нейтрофилами [36, 37]. При этом полного ингибирования дыхательного взрыва не происходит, потому что на мембране нейтрофилов экспрессирована F0F1-ATP-синтаза, катализирующая синтез ATP de novo [38]. Отсутствие эффекта экзогенного ATP на респираторный взрыв гранулоцитов может объясняться балансом регуляторного действия рецепторов АТР и аденозина на активность NADPH-оксидазы [5]. Нельзя исключить также влияние адгезии на дыхательный взрыв [39]. Обнаружено, что адгезия нейтрофилов человека, праймированных липополисахаридом, к необработанной поверхности ингибировала дыхательный ответ на 1 мкМ fMLF [40]. Вероятно, полученные результаты также объясняются ингибирующим влиянием адгезии на генерацию АФК гранулоцитами костного мозга мыши при действии ATP.
Апираза усиливала ответ гранулоцитов на fMLF (рис. 4), что может указывать на роль эндогенного ATP в отрицательной регуляции продукции АФК гранулоцитами мыши. Показано, что стимуляция нейтрофилов fMLF приводит к секреции эндогенного ATP через поры, образованные коннексином 43 [6, 7]. Цитохалазин D блокировал эффект апиразы на респираторный взрыв (рис. 4), что указывает на совместное функционирование пуриновых рецепторов и цитоскелета в регуляции продукции АФК гранулоцитами костного мозга. Взаимосвязь с цитоскелетом свойственна рецепторам, сопряженным с G-белками [41]. Наличие лаг-периода в кальциевых ответах (рис. 1) свидетельствует в пользу участия ассоциированных с G-белками рецепторов P2Y1 и/или запуска внутриклеточных сигнальных каскадов ионами Са2+, поступившими в клетку через рецепторы P2X. Ранее было показано, что актиновый цитоскелет гранулоцитов костного мозга мыши участвует в регуляции продукции АФК, активируемой через низкоаффинные рецепторы формилпептидов mFPR2 и RhoA/ROCK-сигнальный путь [42], поэтому блокирование действия апиразы цитохалазином D, возможно, частично обусловлено его влиянием на сигнализацию mFPR2.
ЗАКЛЮЧЕНИЕ
ATP влияет на кальциевые ответы, адгезию и респираторный взрыв гранулоцитов костного мозга мыши. Выявлена неоднородность популяции клеток по чувствительности к ATP, которая проявлялась, в частности, в генерации кальциевых спайков. Экзогенный ATP усиливал адгезию гранулоцитов и не влиял на fMLF-индуцированную продукцию АФК. Эндогенный ATP, вероятно, действует как отрицательный регулятор активности NADPH-оксидазы.
Авторы благодарят Е.А. Вульфиус за обсуждение статьи и конструктивную критику, Б.Ф. Санталова за разработку и техническую поддержку прибора ХЕМИЛЮМ-12, А.А. Гриневича за разработку программного обеспечения для анализа данных по хемилюминесценции, М.В. Васильчикову и М.А. Грабарскую за техническую помощь при проведении экспериментов.
Исследование выполнено при финансовой поддержке РФФИ № 17-00-00058 в рамках проекта № 17-00-00064 (КОМФИ).
Список литературы
Gretchen S., Selders G.S., Fetz A.E., Radic M.Z., Bowlin G.L. 2017. An overview of the role of neutrophils in innate immunity, inflammation and host-biomaterial integration. Regen. Biomater. 4 (1), 55–68.
Rosales C., Lowell C.A., Schnoor M., Uribe-Querol E. 2017. Neutrophils: Their role in innate and adaptive immunity. J. Immunol. Res. 2017, 9748345. doi 10.1155/ 2017/9748345
Itou T., Collins L.V., Thorén F.B., Dahlgren C., Karlsson A. 2006. Changes in activation states of murine polymorphonuclear leukocytes (PMN) during inflammation: A comparison of bone marrow and peritoneal exudate PMN. Clin. Vaccine Immunol. 13 (5), 575–583.
Cekic C., Linden J. 2016. Purinergic regulation of the immune system. Nat. Rev. Immunol. 16 (3), 177–192.
Wang X., Chen D. 2018. Purinergic regulation of neutrophil function. Front. Immunol. 9, 399. doi 10.3389/ fimmu.2018.00399
Eltzschig H.K., Eckle T., Mager A., Kuper N., Karcher C., Weissmuller T., Boengler K., Schulz R., Robson S.C., Colgan S.P. 2006. ATP release from activated neutrophils occurs via connexin 43 and modulates adenosine-dependent endothelial cell function. Circ. Res. 99 (10), 1100–1108.
Bao Y., Ledderose C., Graf A.F., Brix B., Birsak T., Lee A., Zhang J., Junger W.G. 2015. mTOR and differential activation of mitochondria orchestrate neutrophil chemotaxis. J. Cell. Biol. 210 (7), 1153–1164.
Wang X., Qin W., Xu X., Xiong Y., Zhang Y., Zhang H., Sun B. 2017. Endotoxin induced autocrine ATP signaling inhibits neutrophil chemotaxis through enhancing myosin light chain phosphorylation. Proc. Natl. Acad. Sci. USA. 114, 4483–4488.
Karmakar M., Katsnelson M.A., Dubyak G.R., Pearlman E. 2016. Neutrophil P2X7 receptors mediate NLRP3 inflammasome-dependent IL-1beta secretion in response to ATP. Nat. Commun. 7, 10555. doi 10.1038/ ncomms10555
Chen Y., Corriden R., Inoue Y., Yip L., Hashiguchi N., Zinkernagel A., Nizet V., Insel P.A., Junger W.G. 2006. ATP release guides neutrophil chemotaxis via P2Y2 and A3 receptors. Science. 314 (5806), 1792–1795.
Sil P., Hayes C.P., Reaves B.J., Breen P., Quinn S., Sokolove J., Rada B. 2017. P2Y6 receptor antagonist MRS2578 inhibits neutrophil activation and aggregated neutrophil extracellular trap formation induced by gout-associated monosodium urate crystals. J. Immunol. 198, 428–442.
Vaughan K.R., Stokes L., Prince L.R., Marriott H.M., Meis S., Kassack M.U., Bingle C.D., Sabroe I., Surprenant A., Whyte M.K. 2007. Inhibition of neutrophil apoptosis by ATP is mediated by the P2Y11 receptor. J. Immunol. 179, 8544–8553.
Darbousset R., Delierneux C., Mezouar S., Hego A., Lecut C., Guillaumat I., Riederer M.A., Evans R.J., Dignat-George F., Panicot-Dubois L., Oury C., Dubois C. 2014. P2X1 expressed on polymorphonuclear neutrophils and platelets is required for thrombosis in mice. Blood. 124, 2575–2585.
Brasen J.C., Lars Folke Olsen L.F., Hallett M.B. 2011. Extracellular ATP induces spikes in cytosolic free Ca2+ but not in NADPH oxidase activity in neutrophils. Biochim. Biophys. Acta. 1813, 1446–1452.
Schaff U.Y., Yamayoshi I., Tse T., Griffin D., Kibathi L., Simon S.I. 2008. Calcium flux in neutrophils synchronizes β2 integrin adhesive and signaling events that guide inflammatory recruitment. Ann. Biomed. Eng. 36 (4), 632–646.
Brechard S., Tschirhart E.J. 2008. Regulation of superoxide production in neutrophils: Role of calcium influx. J. Leukoc. Biol. 84 (5), 1223–1237.
Silvestre-Roig C., Hidalgo A., Soehnlein O. 2016. Neutrophil heterogeneity: Implications for homeostasis and pathogenesis. Blood. 127 (18), 2173–2181.
Pillay J., Ramakers B.P., Kamp V.M., Loi A.L.T., Lam S.W., Hietbrink F., Leenen L.P., Toolb A.T., Pickkers P., Koenderman L. 2010. Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J. Leukoc. Biol. 88 (1), 211–220.
Grieshaber-Bouyer R., Nigrovic P.A. 2019. Neutrophil heterogeneity as therapeutic opportunity in immune-mediated disease. Front. Immunol. 10, 346. doi 10.3389/fimmu.2019.00346
Rosales C. 2018. Neutrophil: A cell with many roles in inflammation or several cell types? Front. Physiol. 20 (9), 113.
Safronova V.G., Vulfius C.A., Shelukhina I.V., Mal’tseva V.N., Berezhnov A.V., Fedotova E.I., Miftahova R.G., Kryukova E.V., Grinevich A.A., Tsetlin V.I. 2016. Nicotinic receptor involvement in regulation of functions of mouse neutrophils from inflammatory site. Immunobiology. 221 (7), 761–772.
Асташев М.Е. 2017. Open-source установка для микрофлуоресцентного Са2+-анализа. В кн.: Международная конференция “Рецепторы и внутриклеточная сигнализация”. Ред. Зинченко В.П., Бережнов А.В. Пущино, с. 395–400.
Асташев М.Е. Серов Д.А., Тихонова И.В., Вуль-фиус Е.А., Сафронова В.Г. 2019. Анализ распределения клеточной популяции с помощью статистических моментов высокого порядка. Цитометрический подход. В кн.: Международная конференция “Рецепторы и внутриклеточная сигнализация”. Ред. Зинченко В.П., Бережнов А.В. Пущино, с. 395–400.
Šimberová S., Suk T. 2013. Analysis of dynamic processes by statistical moments of high orders. Progress in pattern recognition, image analysis, computer vision, and applications. Conf. Proc. p. 33–40.
Козбань А.И. 2006. Прикладная математическая статистика. Для инженеров и научных работников. М.: Физматлит. 816 с.
Айвазян С.А., Енюков И.С., Мешалкин Л.Д. 1983. Прикладная статистика: основы моделирования и первичная обработка данных. М.: Финансы и статистика. 471 с.
Leliefeld P.H.C., Pillay J., Vrisekoop N., Heeres M., Tak T., Kox M., Rooijakkers S.H.M., Kuijpers T.W., Pickkers P., Leenen L.P.H., Koenderman L. 2018. Differential antibacterial control by neutrophil subsets. Blood Adv. 2, 1344–1455.
Uhl B., Vadlau Y., Zuchtriegel G., Nekolla K., Sharaf K., Gaertner F., Massberg S., Krombach F., Reichel C.A. 2016. Aged neutrophils contribute to the first line of defense in the acute inflammatory response. Blood. 128, 2327–2337.
Alkayed F., Kashimata M., Koyama N., Hayashi T., Tamura Y., Azuma Y. 2012. P2Y11 purinoceptor mediates the ATP-enhanced chemotactic response of rat neutrophils. J. Pharmacol. Sci. 120, 288–295.
Cinamon G., Shinder V., Shamri R., Alon R. 2004. Chemoattractant signals and β2 integrin occupancy at apical endothelial contacts combine with shear stress signals to promote transendothelial neutrophil migration. J. Immunol. 173 (12), 7282–7291.
Mitchell M.J., Lin K.S., King M.R. 2014. Fluid shear stress increases neutrophil activation via platelet-activating factor. Biophys. J. 106 (10), 2243–2253.
Freyer D.R., Boxer L.A., Axtell R.A., Todd R.F. 3rd. 1988. Stimulation of human neutrophil adhesive properties by adenine nucleotides. J. Immunol. 141 (2), 580–586.
Sjaastad M.D., Nelson W.J. 1997. Integrin-mediated calcium signaling and regulation of cell adhesion by intracellular calcium. Bioessays. 19 (1), 47–55.
Corriden R., Chen Y., Inoue Y., Beldi G., Robson S.C., Insel P.A., Junger W.G. 2008. Ecto-nucleoside triphosphate diphosphohydrolase 1 (E-NTPDase1/CD39) regulates neutrophil chemotaxis by hydrolyzing released ATP to adenosine. J. Biol. Chem. 283, 28 480–28 486.
Lennon P.F., Taylor C.T., Stahl G.L., Colgan S.P. 1998. Neutrophil-derived 5'-adenosine monophosphate promotes endothelial barrier function via CD73-mediated conversion to adenosine and endothelial A2B receptor activation. J. Exp. Med. 188, 1433–1443.
Barletta K.E., Cagnina R.E., Burdick M.D., Linden J., Mehrad B. 2012. Adenosine A(2B) receptor deficiency promotes host defenses against gram-negative bacterial pneumonia. Am. J. Respir. Crit. Care Med. 186 (10), 1044–1450.
van der Hoeven D., Wan T.C., Auchampach J.A. 2008. Activation of the A3 adenosine receptor suppresses superoxide production and chemotaxis of mouse bone marrow neutrophils. Mol. Pharmacol. 74 (3), 685–696.
Gao J., Zhang T., Kang Z., Ting W., Xu L., Yin D. 2017. The F0F1 ATP synthase regulates human neutrophil migration through cytoplasmic proton extrusion coupled with ATP generation. Mol. Immunol. 90, 219–226.
Zhao T., Benard V., Bohl B.P., Bokoch G.M. 2003. The molecular basis for adhesion-mediated suppression of reactive oxygen species generation by human neutrophils. J. Clin. Invest. 112 (11), 1732–1740.
Sanui T., Takeshita M., Fukuda T., Tanaka U., Alshargabi R., Aida Y., Nishimura F. 2017. Adhesion attenuates respiratory burst induced by different modes of triggering in resting or LPS-primed neutrophils. Immunobiology. 222 (89), 865–871.
Schappi J.M., Krbanjevic A., Rasenick M.M. 2014. Tubulin, actin and heterotrimeric G proteins: Coordination of signaling and structure. Biochim. Biophys. Acta. 1838 (2), 674–681.
Filina J.V., Gabdoulkhakova A.G., Safronova V.G. 2014. RhoA/ROCK downregulates FPR2-mediated NADPH oxidase activation in mouse bone marrow granulocytes. Cell Signal. 26 (10), 2138–2346.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


