Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 6, стр. 383-388
Влияние β-GPA на маркеры анаболических и катаболических сигнальных путей в m. soleus крысы на начальной стадии гравитационной разгрузки
Н. А. Вильчинская a, Е. П. Мочалова a, И. И. Парамонова a, С. П. Белова a, Т. М. Мирзоев a, *, Б. С. Шенкман a
a Государственный научный центр Российской Федерации –
Институт медико-биологических проблем Российской академии наук
123007 Москва,
Хорошевское шоссе, 76А, Россия
* E-mail: tmirzoev@yandex.ru
Поступила в редакцию 05.04.2019
После доработки 16.07.2019
Принята к публикации 17.07.2019
Аннотация
Молекулярные механизмы, инициирующие развитие атрофических изменений в постуральной мышце млекопитающих, не определены. Поскольку инактивация скелетной мышцы может приводить к изменению баланса внутримышечных макроэргов, мы предположили, что АМР-активируемая протеинкиназа (AMPK) может играть важную роль в регулировке анаболических и катаболических сигнальных путей в постуральной мышце на начальном этапе функциональной разгрузки. В качестве модулятора баланса макроэргических соединений может выступать бета-гуанидинопропионовая кислота (β-GPA), применение которой способствует уменьшению содержания внутриклеточных макроэргических фосфатов. Цель исследования состояла в оценке сигнальных путей синтеза и распада белка в m. soleus крысы после 1-суточной функциональной разгрузки на фоне предварительной обработки животных инъекциями β-GPA. В эксперименте использовали самцов крыс Вистар, которые были разделены на следующие группы: 1) виварный контроль (C), 2) виварный контроль + β-GPA (С+GPA), 3) 1-суточное антиортостатическое вывешивание (HU), 4) 1-суточное антиортостатическое вывешивание + β-GPA (HU + GPA). β-GPA вводили ежедневно посредством внутрибрюшинных инъекций (400 мг/кг). Содержание ключевых сигнальных белков (AMPK, ACC, p70S6K, 4E-BP1, FOXO3) определяли методом гель-электрофореза с последующим иммуноблоттингом. Экспрессию мРНК убиквитин-лигаз (MuRF-1 и MAFbx) оценивали с помощью ПЦР в реальном времени. В группе с 1-суточной функциональной разгрузкой и предварительной обработкой β-GPA наблюдалось предотвращение снижения фосфорилирования AMPK, ACC и 4E-BP1, а повышенный уровень фосфорилирования p70S6K снижался до контрольных значений. При этом фосфорилирование AKT и FOXO3, а также уровень экспрессии MuRF-1 и MAFbx в группе “HU + GPA” не имели отличий от группы “HU”. Анализируя полученные данные, можно сделать вывод о том, что активность AMPK может играть важную роль в модуляции анаболического mTORC1-сигналинга в камбаловидной мышце крысы на раннем этапе моделируемой микрогравитации.
ВВЕДЕНИЕ
Хорошо известно, что реальная или моделируемая микрогравитация приводит к значительной атрофии скелетных мышц млекопитающих, при этом наиболее глубокие изменения наблюдаются в антигравитационной камбаловидной мышце (m. soleus) [1]. Однако молекулярные механизмы, которые могут инициировать развитие атрофических изменений в постуральной мышце, остаются неопределенными. Поскольку вызванная функциональной разгрузкой инактивация скелетной мышцы приводит к изменению уровня внутримышечных макроэргов [2, 3], мы предположили, что ключевой энергетический сенсор – АМР-активируемая протеинкиназа (AMPK) – может играть важную триггерную роль в развитии атрофических процессов в мышце. Известно, что активированная AMPK может блокировать анаболические сигнальные пути и одновременно активировать протеолитические процессы в скелетной мышце [4–6]. Так, показано, что AMPK способна ингибировать протеинкиназу mTORC1 (мишень рапамицина у млекопитающих, комплекс 1) – ключевой регулятор синтеза белка в клетке [7]. Главными субстратами mTORC1 являются рибосомальная киназа p70 (p70s6k) и белок, связывающий инициаторный фактор 4E (4E-BP1) [8]. Также показано, что активированная AMPK может ингибировать активность протеинкиназы B (AKT) и инициировать FOXO-зависимую экспрессию мышечно-специфичных убиквитин-лигаз MuRF1 и MAFbx [9, 10]. При этом бета-гуанидинопропионовая кислота (β-GPA) может конкурентно ингибировать проникновение креатина в клетку [11, 12], приводя к уменьшению внутриклеточных макроэргических фосфатов и последующей активации AMPK [12, 13]. Также показано, что в скелетной мышце хроническое действие β-GPA реализуется посредством AMPK-зависимых сигнальных механизмов [14]. В связи с этим цель исследования состояла в оценке сигнальных путей синтеза и распада белка в m. soleus крысы после 1-суточной функциональной разгрузки на фоне предварительных инъекций β-GPA животным.
МАТЕРИАЛЫ И МЕТОДЫ
Организация эксперимента. Использовали самцов крыс Вистар массой 190–210 г, которые были случайным образом разделены на следующие группы (n = 8/группа): 1) виварный контроль + + физраствор в течение 7 дней (C); 2) виварный контроль + β-GPA в течение 7 дней (С+ GPA); 3) физраствор в течение 6 дней до 1-суточного антиортостатического вывешивания и в день вывешивания (HU); 4) β-GPA в течение 6 дней до 1-суточного антиортостатического вывешивания и в день вывешивания (HU + GPA); β-GPA (400 мг/кг) или эквивалентную дозу физраствора вводили ежедневно посредством внутрибрюшинных инъекций. Животных содержали в условиях вивария на стандартном корме и воде ad libitum. В исследовании использовали стандартную модель антиортостатического вывешивания, позволяющую имитировать эффекты микрогравитации [15]. Эвтаназию животных проводили посредством внутрибрюшинного введения 10% раствора авертина (10 мл/кг). Все процедуры с животными были одобрены Комиссией по биомедицинской этике ГНЦ РФ – ИМБП РАН (протокол № 447 от 28 марта 2017 г.).
Вестерн-блотинг. На криостате Leica (Германия) при –20°С замороженную мышечную ткань нарезали (80 срезов толщиной 20 мкм) в пробирки. Затем в пробирки с образцами добавляли охлажденный лизирующий буфер RIPA Lysis Buffer System (sc-24948, Santa Cruz Biotechnology, США) с добавлением 5 мМ EDTA, 1 мМ Na3VO4, 1 мМ DTT, 1 мМ PMSF, 1 мМ апротинина, 1 мМ лейпептина, 1 мМ пепстатина А и коктейля ингибиторов фосфатаз (40 мкл/мл) (Phosphatase Inhibitor Cocktail B, sc-45045, Santa Cruz Biotechnology, США) из расчета 130 мкл буфера на одну пробу. Затем проводили гомогенизацию и центрифугирование (в течение 15 мин при температуре +4°С и 12 000 об/мин). После этого отбирали надосадочную жидкость и определяли концентрацию белка на спектрофотометре UV-2450 (Shimadzu, Япония) методом Брэдфорда, измеряя поглощение на длине волны 595 нм. Концентрация белка в пробах рассчитывалась по калибровочной кривой. Гомогенаты, полученные из мышечной ткани каждого животного, анализировали по-отдельности. Гель-электрофорез проводили в 10% разделяющем полиакриламидном геле в мини-системе Bio-Rad (США) в течение 1 ч при силе тока 17 мА на один гель. Перенос белков на нитроцеллюлозную мембрану (Bio-Rad, США) осуществляли в системе mini Trans-Blot (Bio-Rad) в течение 2 ч при температуре +4°С и постоянном напряжении 100 В. Для проверки равной загрузки белка на все дорожки нитроцеллюлозную мембрану окрашивали Ponceau S. После этого мембрану отмывали от Ponceau S и блокировали в 4% растворе сухого молока в PBST (PBS + 0.1% Tween 20) при комнатной температуре в течение 1 ч. Затем инкубировали (в течение 15 ч при +4°С) с первичными антителами против P-AMPK (Thr 172) (1 : 500; Santa Cruz Biotechnology, США, #33 524), t-AMPK (1 : 500, Cell Signalling Techno-logy, США, #2532); P-ACC (Ser 79, 1 : 1000, Cell Signalling Technology, #3661), t-ACC (1 : 2000, Cell Signalling Technology, # 3662), P-p70s6k (Thr 389) (1 : 2000, sc-11759, Santa-Cruz), p70s6k (#9202, 1 : 1000, Cell Signaling), P-4E-BP-1 (Thr37/46) (1 : 1000, #2855, Cell Signaling), 4E-BP-1 (1 : 1000, #9452, Cell Signaling), P-AKT (S473) (1 : 1000, #4058, Cell Signaling), AKT (1 : 1000, # 2920, Cell Signaling), P-FOXO3 (S253) (1 : 1000, sc-11351, Santa Cruz), а также моноклональными антителами Anti-GAPDH (G041, abm, Канада) в разведении 1 : 3000. После этого отмывали мембраны в PBST 5 раз по 5 мин. Затем мембраны инкубировали в течение 1 ч с биотинилированными вторичными анти-кроличьими антителами козы (sc-2004, Santa Cruz) в разведении 1 : 1000. Для выявления GAPDH использовали вторичные анти-мышиные антитела козы в разведении 1 : 20 000 (#1 706 516, Bio-Rad). Далее проводили отмывку в PBST (5 раз по 5 мин). Сначала выявлялась фосфорилированная форма целевого белка, затем проводили стриппирование мембраны, после чего выявлялась полная форма белка. Для стриппирования мембран использовали специальный коммерческий буфер RestoreTM Westren Blot Stripping Buffer (#21 059, Thermo Scientific, США). Белковые полосы выявляли на мембране с помощью ClarityTM Western ECL Substrate (#1 705 061, Bio-Rad). Белковые полосы анализировали с использованием блот-сканера C-DiGit (LI-COR Biotechnology, США) и соответствующей программы Image Studio Digits. Сигнал от белковых полос нормировали по референсному белку GAPDH. Вестерн-блоттинг проводили не менее 2 раз.
ПЦР в реальном времени. РНК из мышечной ткани выделяли на микроколонках RNeasy Micro Kit (Qiagen) согласно инструкции производителя. Все образцы РНК были обработаны протеиназой K и ДНКазой I. В обратной транскрипции использовали водный раствор 0.5 мкг РНК, олиго(dT)15, гексануклеотиды d(N)6, обратную транскриптазу MMLV. Обратную транскрипцию проводили при 37°C в течение 60 мин согласно стандартному протоколу. Полученные образцы кДНК хранили при –84°С для проведения ОТ-ПЦР в реальном времени с использованием интеркалирующего красителя SYBR Green I. Данные ОТ-ПЦР анализировали при помощи программы REST (Relative expression software tool) 2009 v.2.0.12 (QIAGEN). Данные, полученные с помощью ПЦР в реальном времени, анализировали с помощью метода 2–ΔΔСt (метод Ливака). В качестве референсных генов использовали гены GAPDH и β-актина, экспрессия которых в m. soleus в условиях эксперимента была постоянной. праймеров, Для проведения ПЦР использовали следующие праймеры: MuRF1 (5'-GCCAATTTGGTGCTTTTTGT-3'; 5'-AAATTCAGTCCTCTCCCCGT-3'), MAFbx (5'-CTACGATGTTGCAGCCAAGA-3'; 5'-GGCAGTCGAGAAGTCCAGTC-3'), β-актин (5'-TCATGAAGTGTGACGTTGACATCC-3'; 5'-GTAAAACGCAGCTCAGTAACAGTC-3'), GAPDH (5'-ACGGCAAGTTCAACGGCACAGTCAA-3'; 5'-GCTTTCCAGAGGGGCCATCCACA-3').
Статистический анализ. Полученные данные анализировали с использованием таких программ, как REST 2009 v.2.0.12 и Microsoft Excel. Данные по содержанию белков представлены в виде средних значений ± стандартная ошибка среднего значения. Данные по экспрессии генов представлены в виде медиан с указанием максимума, минимума и интерквартильной широты (0.25–0.75). Статистическую значимость различий между группами определяли посредством дисперсионного анализа с последующим применением критерия Тьюки для множественных сравнений. Значимыми считали отличия при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
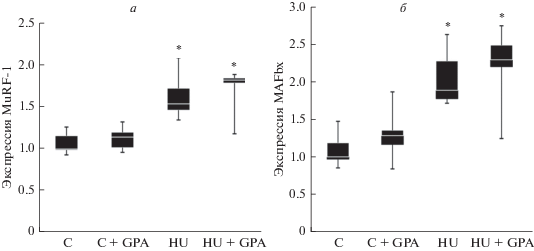
Предварительные инъекции β-GPA не вызывали у контрольных животных (группа “С + GPA”) каких-либо изменений в статусе фосфорилирования AMPK, ацетил-КоА-карбоксилазы (ACC), киназы рибосомного белка S6 (p70S6K), белка, связывающего фактор инициации трансляции 4E (4E-BP1), протеинкиназы B (AKT) и транскрипционного фактора FOXO3 по сравнению с контрольной группой (С). Экспрессия мРНК убиквитин-лигаз MuRF-1 и MAFbx в группе “С + GPA” также не отличалась от контрольных значений. Односуточная функциональная разгрузка задних конечностей без предварительной обработки β-GPA привела к статистически значимому (p < < 0.05) снижению фосфорилирования AMPK (Thr172) на 40% и ACC (Ser79) на 34% (рис. 1), 4E-BP1 (Thr37/46) на 40% (рис. 2б), AKT (Ser473) на 70% и FOXO3 (Ser253) на 64% (рис. 3) и одновременному увеличению фосфорилирования p70S6K (Thr389) (рис. 2а) на 179%, а также к усилению экспрессии мРНК MuRF-1 и MAFbx в 1.5 и 2 раза, соответственно, (рис. 4) по сравнению с виварным контролем. Однако в группе с 1-суточной функциональной разгрузкой и предварительной обработкой β-GPA не наблюдалось снижение фосфорилирования AMPK, ACC (рис. 1) и 4E-BP1 (рис. 2б), а уровень фосфорилирования p70S6K вернулся к контрольным значениям (рис. 2а). При этом фосфорилирование AKT и FOXO3 (рис. 3), а также уровень экспрессии MuRF-1 и MAFbx (рис. 4) в группе “HU + GPA” был таким же, как в группе “HU”.
Рис. 1.
Статус фосфорилирования AMPK (Thr172) (a) и ACC (Ser79) (б) в камбаловидной мышце крысы, % от контрольной группы (C). * – Статистически значимые отличия от контрольной группы (С).
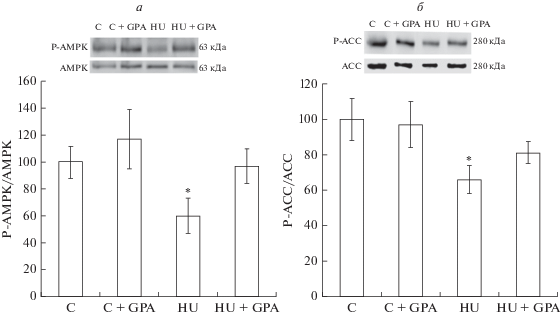
Рис. 2.
Статус фосфорилирования p70S6K (Thr389) (a) и 4E-BP1 (Thr37/46) (б) в камбаловидной мышце крысы, % от контрольной группы (C). * – Статистически значимое отличие от контрольной группы (С).
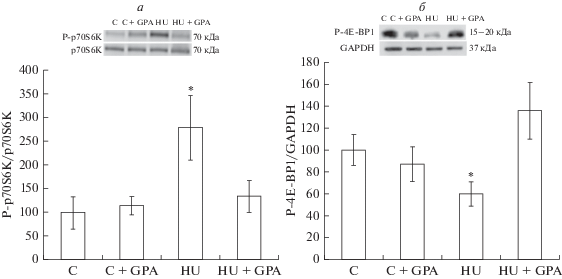
Рис. 3.
Содержание фосфорилированных форм AKT (Ser473) (а) и FOXO3 (Ser253) (б) в камбаловидной мышце крысы, % от контрольной группы (C). * – Статистически значимое отличие от контрольной группы (С).
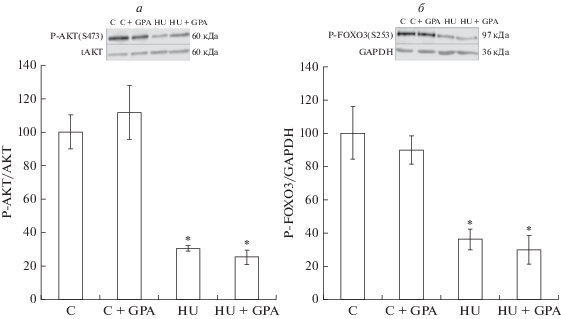
Рис. 4.
Уровень экспрессии мРНК убиквитин-лигаз MuRF-1 (a) и MAFbx (б) в камбаловидной мышце крысы; отличие в число раз относительно контрольной группы (C). * – Статистически значимое отличие от контрольной группы (С).
Результаты определения статуса фосфорилирования AMPK, ACC, p70S6k и 4E-BP1 в m. soleus крысы на ранних стадиях функциональной разгрузки хорошо согласуются с ранее опубликованными данными, полученными как в нашей лаборатории [16, 17], так и другими авторами [18]. Снижение уровня фосфорилирования FOXO3 и увеличение экспрессии MuRF-1 и MAFbx после 1-суточного антиортостатического вывешивания также полностью соответствует ранее полученным данным [19]. Ранее нами было показано, что предобработка крыс веществом AICAR (активатор AMPK) предотвращала снижение фосфорилирования AMPK в m. soleus после 24-часовой гравитационной разгрузки, при этом также предотвращалось увеличение фосфорилирования p70S6K [20]. Новизна полученных в данном исследовании результатов состоит в том, что впервые оценен эффект β-GPA на анаболические и катаболические маркеры в m.soleus крысы на раннем сроке функциональной разгрузки. При введении β-GPA Снижение содержания АТР и увеличение АМР могло привести к закономерному повышению активности AMPK на фоне функциональной разгрузки, что подтверждалось соответствующим увеличением содержания фосфорилированных форм основного субстрата AMPK – фермента ACC. Учитывая важную роль АСС в регуляции белкового метаболизма, логично предположить, что активация AMPK во время разгрузки под действием β-GPA могла способствовать предотвращению повышения фосфорилирования одного из маркеров активности протеинкиназы mTORC1 – белка p70S6K (рис. 5). Результаты определения экспрессии убиквитин-лигаз в группе “HU + GPA” полностью согласуются с ранее полученными в нашей лаборатории данными об уровне экспрессии MuRF-1 и MAFbx после введения соединения AICAR (активатор AMPK) с последующей функциональной разгрузкой в течение 24 ч (неопубликованные данные).
Рис. 5.
Гипотетическая схема регуляции анаболического пути mTORC1/p70S6K посредством AMPK в m. soleus крысы в условиях 24-часовой функциональной разгрузки (а) и при введении животным β-GPA (б).
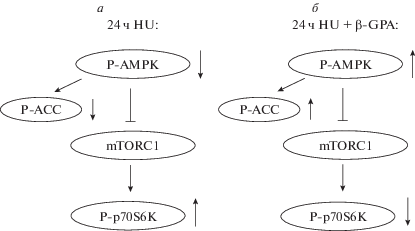
Таким образом, AMPK может играть важную роль в модуляции анаболического mTORC1-сигналинга в камбаловидной мышце крысы на раннем этапе моделируемой микрогравитации.
Исследование поддержано грантом Российского научного фонда (проект № 17-75-20 152).
Список литературы
Fitts R. H., Riley D. R., Widrick J. 2000. Physiology of a microgravity environment invited review: Microgravity and skeletal muscle. J. Appl. Physiol. 89, 823–839.
Ohira Y., Saito K., Wakatsuki T., Yasui W., Suetsugu T., Nakamura K., Tanaka H., Asakura T. 1994. Responses of beta-adrenoceptor in rat soleus to phosphorus compound levels and/or unloading. Am. J. Physiol. 266, 1257–1262.
Wakatsuki T., Ohira Y., Yasui W., Nakamura K., Asakura T., Ohno H., Yamamoto M. 1994. Responses of contractile properties in rat soleus to high-energy phosphates and/or unloading. Jpn. J. Physiol. 44, 193–204.
Hardie D.G. 2011. AMP-activated protein kinase: An energy sensor that regulates all aspects of cell function. Genes Dev. 25, 1895–1908.
Carling D. 2017. AMPK signalling in health and disease. Curr. Opin. Cell. Biol. 45, 31–37.
Thomson D.M. 2018. The role of AMPK in the regulation of skeletal muscle size, hypertrophy, and regeneration. Int. J. Mol. Sci. 19 (10). pii: E3125. https://doi.org/10.3390/ijms19103125
Bodine S.C., Stitt T.N., Gonzalez M., Kline W.O., Stover G.L., Bauerlein R., Zlotchenko E., Scrimgeour A., Lawrence J.C., Glass D.J., Yancopoulos G.D. 2001. Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo. Nat. Cell Biol. 3, 1014–1019.
Glass D.J. 2003. Signalling pathways that mediate skeletal muscle hypertrophy and atrophy. Nat. Cell Biol. 5, 87–90.
Krawiec B.J., Nystrom G.J., Frost R.A., Jefferson L.S., Lang C.H. 2007. AMP-activated protein kinase agonists increase mRNA content of the muscle-specific ubiquitin ligases MAFbx and MuRF1 in C2C12 cells. Am. J. Physiol. Enocrinol. Metab. 292, 1555–1567,
Nakashima K., Yakabe Y. 2007. AMPK activation stimulates myofibrillar protein degradation and expression of atrophy-related ubiquitin ligases by increasing FOXO transcription factors in C2C12 myotubes. Biosci. Biotechnol. Biochem. 71, 1650–1656.
Mahanna D.A., Fitch C.D., Fischer V.W. 1980. Effects of beta-guanidinopropionic acid on murine skeletal muscle. Exp. Neurol. 68, 114–121.
Oudman I., Clark J.F., Brewster L.M. 2013. The effect of the creatine analogue beta-guanidinopropionic acid on energy metabolism: a systematic review. PLoS One. 8, e52879.
Williams D.B., Sutherland L.N., Bomhof M.R., Basaraba S.A.U., Thrush A.B., Dyck D.J., Field C.J., Wright D.C. 2009. Muscle-specific differences in the response of mitochondrial proteins to β-GPA feeding: An evaluation of potential mechanisms. Am. J. Physiol. Endocrinol. Metab. 296, 1400–1408.
Zong H., Ren J.M., Young L.H., Pypaert M., Mu J., Birnbaum M.J., Shulman G.I. AMP kinase is required for mitochondrial biogenesis in skeletal muscle in response to chronic energy deprivation. 2002. Proc. Natl. Acad. Sci. USA. 99, 15983–15987.
Morey-Holton E., Globus R. 2002. Hindlimb unloading rodent model: technical aspects. J. Appl. Physiol. 92, 1367–1377.
Mirzoev T., Tyganov S., Vilchinskaya N., Lomonosova Y., Shenkman B. 2016. Key markers of mTORC1-dependent and mTORC1-Independent signaling pathways regulating rrotein synthesis in rat soleus muscle during early stages of hindlimb unloading. Cell. Physiol. Biochem. 39, 1011–1020.
Vilchinskaya N.A., Mochalova E.P., Nemirovskaya T.L., Mirzoev T.M., Turtikova O.V., Shenkman B.S. 2017. Rapid decline in MyHC I (beta) mRNA expression in rat soleus during hindlimb unloading is associated with AMPK dephosphorylation. J. Physiol. 595, 7123–7134.
Chibalin A.V., Benziane B., Zakyrjanova G.F., Kravtsova V.V., Krivoi I.I. 2018. Early endplate remodeling and skeletal muscle signaling events following rat hindlimb suspension. J. Cell. Physiol. 233, 6329–6336.
Mochalova E.P., Belova S.P., Shenkman B.S., Nemirovskaya T.L. 2018. The role of transcription factors FoxO3 and myogenin in the regulation of E3-ligases MuRF-1 and MAFbx expression in rat soleus at the early stage of disuse atrophy. Biol. Membrany. 35, 443–447.
Vilchinskaya N.A., Mochalova E.P., Belova S.P., Shenkman B.S. 2016. Dephosphorylation of AMP-activated protein kinase in a postural muscle: a key signaling event on the first day of functional unloading. Biophysics. 61, 1019–1061.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


