Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 6, стр. 389-399
Участие эндоканнабиноидных рецепторов в регуляции спонтанной синаптической активности моторных синапсов мыши
А. Е. Гайдуков a, *, И. З. Джалагония b, Е. О. Тарасова a, О. П. Балезина a
a Московский государственный университет имени М.В. Ломоносова,
биологический факультет
119234 Москва, Ленинские горы, 1, стр. 12, Россия
b Институт высшей нервной деятельности и нейрофизиологии РАН
117485 Москва, ул. Бутлерова, 5A, Россия
* E-mail: gaydukov@gmail.com
Поступила в редакцию 11.04.2019
После доработки 13.06.2019
Принята к публикации 13.06.2019
Аннотация
В моторных синапсах диафрагмы мыши с помощью внутриклеточного микроэлектродного отведении миниатюрных потенциалов концевой пластинки (МПКП) исследованы механизмы изменений спонтанной секреции ацетилхолина (АХ) при воздействии на нервно-мышечный препарат экзогенных агонистов и антагонистов эндоканнабиноидных рецепторов. На фоне действия антагониста/обратного агониста рецепторов CВ1-типа АМ-251 (1 мкМ) на протяжении 60 мин не обнаружено статистически значимых изменений мембранного потенциала мышечных волокон, а также частоты и амплитудно-временны́х параметров МПКП. Активация CB-рецепторов экзогенным агонистом WIN 55,212-2 (WIN) (20 мкМ) в течение 1 ч не вызывала статистически значимых изменений амплитуды МПКП. Однако под действием WIN в течение 30–60 мин частота МПКП увеличивалась более чем на 50% по сравнению с контролем. Блокирование рецепторов СВ1 с помощью АМ-251 (1 мкМ) предотвращало WIN-индуцированный прирост частоты МПКП. Ингибитор протеинкиназы А H-89 (1 мкМ) не предотвращал потенцирование секреции АХ при активации CB-рецепторов WIN. На фоне действия ингибитора фосфолипазы С U73 122 (5 мкМ), который не влиял на амплитудно-временны́е характеристики и частоту МПКП сам по себе, WIN утрачивал способность увеличивать частоту МПКП. Блокатор протеинкиназы С хелеритрин (4 мкМ) или рианодин в концентрации 5 мкМ, блокирующей рианодиновые рецепторы (РиР), также предотвращали WIN-индуцируемый прирост частоты МПКП. Таким образом, впервые в моторных синапсах мыши обнаружен запускаемый активацией пресинаптических CB1-рецепторов сигнальный каскад с участием фосфолипазы С, протеинкиназы С и депонированного Ca2+, приводящий к увеличению частоты спонтанной квантовой секреции АХ. Это позволяет предполагать наличие СВ1-рецепторов на пресинаптической мембране моторных нервных терминалей мыши и возможность активации этих рецепторов эндоканнабиноидами для потенцирования спонтанной секреции АХ.
ВВЕДЕНИЕ
Эндоканнабиноиды – продукты внутриклеточного расщепления мембранных липидов клеток с помощью специальных ферментов. Возможность образования двух наиболее известных эндоканнабиноидов – анандамида и 2-арахидонилглицерола – описана у многих типов нейронов ЦНС, глиальных и других клеток, включая мышечные [1–4]. Эти ретроградно действующие сигнальные молекулы влияют преимущественно на эндоканнабиноидные рецепторы, представляющие собой мембранные G-белок-сцепленные метаботропные рецепторы двух типов – CB1 и CB2 [5–7]. В настоящее время достаточно подробно описаны условия активации эндоканнабиноидной системы и последствия ретроградного рецепторного действия эндоканнабиноидов в синапсах ЦНС в покое и при их активности [2, 8–11]. В скелетной мускулатуре экспрессируются не только эндоканнабиноидные рецепторы СВ1 и СВ2, но и ферменты, ответственные за синтез и деградацию эндоканнабиноидов [1, 3, 4, 12]. Поэтому мышцы причисляют к периферическим органам, содержащим эндоканнабиноидную систему с присущей ей паракринной регуляторной активностью, осуществляемой с участием СВ-рецепторов как самих мышечных волокон [13, 14], так, возможно, и моторных синапсов [15]. Однако данные о способности эндоканнабиноидной системы влиять на параметры нервно-мышечной передачи в периферических моторных синапсах остаются весьма скудными и противоречивыми [15, 16]. В связи с этим целью данной работы был анализ последствий острого воздействия экзогенных агонистов и антагонистов эндоканнабиноидных рецепторов на параметры спонтанной синаптической активности моторных синапсов мыши.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Эксперименты проводили на изолированных нервно-мышечных препаратах диафрагмальной мышцы (m. diaphragma – n. phrenicus) взрослых (7–8 недель, вес 25–30 г) самцов мышей линии BALB/c, полученных из лаборатории экспериментальных животных Биологического факультета МГУ. Содержание животных и экспериментальные процедуры осуществлялось в соответствии с директивой 86/609/EEC по обращению человека с лабораторными животными, корм и вода предоставлялись ad libitum. Экспериментальный протокол был одобрен комиссией по биоэтике Биологического факультета МГУ. Мышей умерщвляли посредством быстрого обезглавливания.
Электрофизиология. Изолированный нервно-мышечный препарат левой половины диафрагмы помещали в экспериментальную камеру объемом 3 мл. Проводили непрерывную перфузию камеры с препаратом оксигенированным (95% O2, 5% CO2) раствором Лайли (pH 7.2–7.4), содержащим (мМ): 135 NaCl, 4 KCl, 0.9 NaH2PO4, 2 CaCl2, 1 MgCl2, 16.3 NaHCO3, 11 глюкоза. Скорость перфузии составляла 0.3–0.5 мл/мин. Сигналы регистрировали при фиксированной температуре 26 ± 0.1°С, обеспечиваемой встроенными в систему перфузии PPS (Scientifica, Великобритания) контроллером и нагревателем, датчик обратной связи помещали в экспериментальную камеру непосредственно рядом с нервно-мышечным препаратом. Внутриклеточную регистрацию спонтанных МПКП осуществляли с помощью стеклянных микроэлектродов, заполненных 2.5 М КCl (сопротивление кончика микроэлектрода составляло 15–25 МОм). Сигналы регистрировали, используя усилитель Axoclamp-900А (Molecular Devices, США) в режиме I-Сlamp с использованием встроенного фильтра (3 кГц) и записывали их с помощью 16-разрядного аналого-цифрового преобразователя Digidata-1440A (Molecular Devices, США) с интерфейсом Сlampex 10 (пакет pCLAMP 10) на жесткий диск компьютера для последующего анализа в программе MiniAnalysis (Synaptosoft, США). В ходе экспериментов регулярно проводили балансировку моста (для компенсации электродного потенциала) и нейтрализацию емкости микроэлектродов. Критериями удачного введения микроэлектрода в зону концевой пластинки под визуальным контролем (объектив PLN10X/0.25 (Olympus, Япония)) служил стабильный мембранный потенциал (МП) и значение времени нарастания МПКП на участке 10–90% амплитуды < 1 мс. При снижении МП от исходного более чем на 5 мВ в ходе регистрации – она прекращалась, и сигналы от данного синапса не включались в выборку для дальнейшего анализа. В каждом синапсе МПКП регистрировали в течение 180 с. В контроле регистрировали МПКП от 5 и более разных синапсов, после чего автоматическую перфузионную систему переключали на подачу раствора, содержащего исследуемые вещества, и далее регистрировали спонтанную активность разных синапсов на протяжении 1–2 ч. В каждой серии экспериментов использовали не менее трех нервно-мышечных препаратов.
Анализ данных и статистика. Оценивали МП мышечных волокон, временнóй ход МПКП (время нарастания и время полуспада), их амплитуду и частоту. Для нивелирования изменения движущей силы сдвига потенциала при изменениях МП стандартизировали значение амплитуд МПКП к МП –80 мВ [17]. Статистический анализ проводили с использованием программы GraphPad Prism 6.0. Нормальность распределения значений параметров МПКП оценивали с помощью критерия Д’Агостино-Пирсона. Статистическую значимость различий между выборками оценивали при помощи t-критерия Стьюдента или однофакторного дисперсионного анализа с апостериорным тестом Холм–Сидака (в случае нормального распределения), в случае распределения, отличного от нормального в одной из выборок, использовали критерий Манна–Уитни или Краскелла–Уоллеса с апостериорным тестом Данна. Уровень статистической значимости отличий между выборками составлял 0.05 (n – количество исследованных синапсов).
Материалы. В экспериментах использовали: антагонист/обратный агонист рецепторов CB1 – AM-251; агонист СВ-рецепторов – WIN 55,212-2; ингибитор протеинкиназы А – H-89; ингибитор фосфолипазы С – U73122; ингибитор протеинкиназы С – хелеритрин; блокатор рианодиновых рецепторов – рианодин (все – Tocris Bioscience, Великобритания). Для приготовления стоковых растворов АМ-251, WIN 55,212-2 и U73122 в качестве растворителя использовали диметилсульфоксид (Хеликон, Россия), растворителем для стоковых растворов остальных веществ служила деионизированная H2O. Финальные концентрации растворителей в экспериментальных рабочих растворах не превышали 0.01% (v/v) и не оказывали самостоятельного действия на параметры спонтанной активности в моторных синапсах мыши.
РЕЗУЛЬТАТЫ
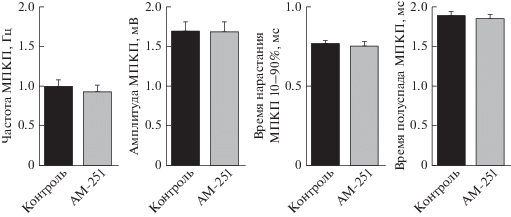
В первой серии мы исследовали изменения параметров МПКП под действием антагониста/обратного агониста СВ1-рецепторов – АМ-251. На протяжении 1 ч перфузии нервно-мышечного препарата раствором, содержащим АМ-251 (1 мкМ), среднее значение МП мышечных волокон составило –75.4 ± 1.4 мВ (n = 28), что не отличалось статистически значимо от значений в контроле – –72.5 ± 1.4 мВ (n = 27, p > 0.05). Амплитуда, временнóй ход и частота МПКП на фоне блокирования СВ1-рецепторов также не изменялись по сравнению с контролем (рис. 1). Таким образом, блокирование СВ1-рецепторов в нервно-мышечных синапсах мыши в покое, когда наличествует только спонтанная синаптическая секреция АХ, не вызывает изменений параметров этой секреции (рис. 1). Это позволяет предполагать, что в отсутствие вызванного выброса АХ и/или мышечного сокращения в моторных синапсах не происходит тонической активации СВ1-рецепторов эндоканнабиноидами, что согласуется с данными, полученными на моторных синапсах лягушки [18], либо тоническая активация происходит, но не отражается на характеристиках спонтанной секреции в моторных синапсах мыши.
Рис. 1.
Частота и амплитудно-временны́е характеристики МПКП в контроле (n = 28) и при блокировании СB1-рецепторов 1 мкМ AM-251 (n = 27).
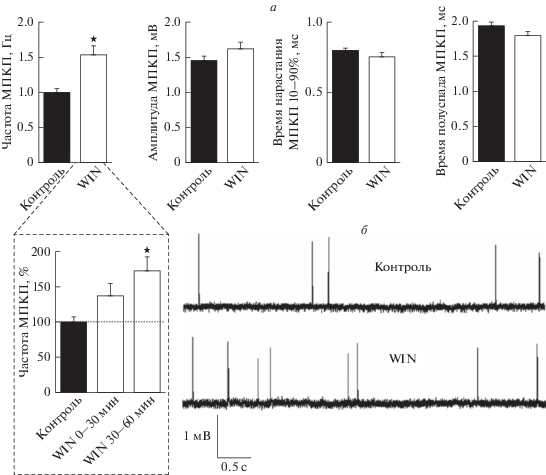
Далее изучали влияние неcелективного агониста CB-рецепторов обоих типов – WIN 55,212-2 (WIN) – на спонтанную активность диафрагмальных синапсов. Мы использовали WIN в концентрации 20 мкМ, которая обеспечивает практически максимальную активацию G-белков, связанных с СВ-рецепторами [19], и находится в пределах диапазона концентраций (10–25 мкМ), используемых при изучении эндоканнабиноидной модуляции синаптической активности как в синапсах ЦНС [20], так и в нервно-мышечных синапсах [15, 18, 21]. Значение МП мышечных волокон на фоне действия WIN в течение 1 ч не изменилось по сравнению с контролем (–70.4 ± ± 1.4 мВ (n = 38)) и составило –73.2 ± 1.6 мВ (n = 38, p > 0.05). Мы обнаружили, что cредняя амплитуда МПКП незначительно возрастает от 1.44 ± 0.08 мВ в контроле до 1.62 ± 0.11 мВ на фоне действия WIN (p > 0.05). Время нарастания и время полуспада МПКП не изменились при стимуляции СB-рецепторов (рис. 2а). Единственным параметром МПКП, значительно изменившимся при действии агониста эндоканнабиноидных рецепторов, оказалась частота МПКП. Ее значение увеличилось от 0.98 ± 0.07 Гц в контроле до 1.53 ± ± 0.13 Гц на фоне WIN (p < 0.05), т.е. более чем на 50% по сравнению с контролем (рис. 2а, 2б). Анализ развития прироста частоты МПКП показал некоторое, хотя и статистически незначимое, увеличение спонтанной секреции уже в первые 30 мин присутствия 20 мкМ WIN в растворе, перфузирующем нервно-мышечные препараты. В период с 30-й по 60-ю мин возрастание частоты МПКП становится статистически значимым по отношению к контролю (рис. 2а).
Рис. 2.
Возрастание частоты спонтанной секреции АХ при активации СB-рецепторов WIN (20 мкМ): а – частота и амплитудно-временны́е характеристики МПКП в контроле (n = 38) и при действии WIN (n = 38). На врезке – развитие во времени возрастания частоты МПКП при действии WIN в течение 0–30 мин (n = 18) и 30–60 мин (n = 20). Средние значения частоты МПКП нормализованы к контролю (принят за 100%). б – Репрезентативные МПКП в контроле и на фоне действия WIN. ★ – p < 0.05 по сравнению с контролем.
Как известно, изменение частоты спонтанной секреции квантов АХ есть результат пресинаптической активности нервных терминалей. Поэтому увеличение частоты МПКП на фоне действия агониста CB-рецепторов позволяет предполагать активацию под его влиянием пресинаптических эндоканнабиноидных рецепторов и процессов, регулирующих режим спонтанной секреции квантов АХ. Для подтверждения рецепторного пресинаптического действия WIN в следующей серии экспериментов оценивали потенцирующие эффекты WIN на частоту МПКП на фоне антагониста СВ1-рецепторов АМ-251 (1 мкМ).
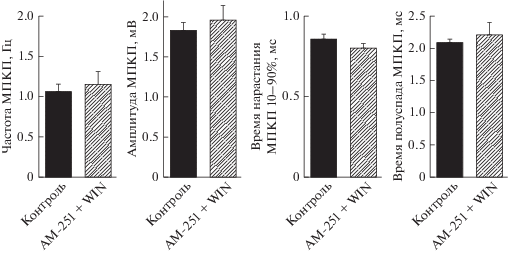
Мы установили, что АМ-251, не влияя на МП мышечных волокон, временнóй ход и амплитуду МПКП, эффективно предотвращал прирост частоты спонтанной квантовой секреции АХ синапсов, вызываемый WIN (рис. 3). Средняя частота МПКП составила 1.06 ± 0.10 Гц в контроле (n = 26) и 1.15 ± 0.11 Гц на фоне действия WIN в присутствии АМ-251 (n = 23, p > 0.05). Отсутствие статистически значимого повышения частоты МПКП при действии WIN на фоне заблокированных АМ-251 СB1-рецепторов является аргументом в пользу того, что моторные синапсы мыши содержат пресинаптические эндоканнабиноидные рецепторы CВ1. Хотя не исключена возможность присутствия CB2-рецепторов в моторных синапсах мыши и их активации WIN, однако их активность, вероятнее всего, не направлена на регуляцию частоты спонтанного выброса АХ и затрагивает другие параметры синаптической передачи [15]. Совокупность полученных данных позволяет предположить, что именно CB1-рецепторы при их стимуляции опосредуют возрастание частоты спонтанной секреции АХ. В таком случае важно выяснить, какой сигнальный каскад, запускаемый активацией СB1-рецепторов, может участвовать в увеличении частоты МПКП.
Рис. 3.
Частота и амплитудно-временны́е характеристики МПКП в контроле (n = 26) и при действии WIN (20 мкМ) в присутствии 1 мкМ AM-251 (n = 23).
Описана активация аденилатциклазы и протеинкиназы А (PKА) при стимуляции CВ1-рецепторов в определенных синапсах ЦНС [22, 23]. Для выяснения возможной роли PKA при активации эндоканнабиноидных рецепторов в моторных синапсах мыши в следующей серии экспериментов использовали ингибитор РКА – Н-89 (1 мкМ). Сам H-89 в течение 1 ч не вызвал статистически значимых изменений МП, амплитудно-временны́х характеристик МПКП и их частоты по сравнению с контролем (рис. 4а). При этом такое ингибирование PKA не предотвращало потенцирование частоты спонтанной секреции АХ, вызываемое WIN. Значение средней частоты МПКП, составившее 0.92 ± 0.09 Гц в контроле (n = 24) и 0.88 ± 0.08 Гц при действии Н-89 (n = 17), существенно возросло при добавлении 20 мкМ WIN на фоне H-89 до 1.52 ± 0.15 Гц (n = 19, p < 0.05) (рис. 4а). Такое увеличение частоты МПКП практически не отличалось от прироста в серии экспериментов с воздействием на моторные синапсы одного WIN (рис. 2).
Рис. 4.
Увеличение частоты МПКП при стимуляции СB-рецепторов WIN (20 мкМ) не зависит от активности PKA в моторных синапсах, но связано с активацией PLC: а – Частота и амплитудно-временны́е характеристики МПКП в контроле (n = 24), под действием ингибитора PKA H-89 (1 мкМ) (n = 17) и при действии WIN в присутствии H-89 (n = 19). б – Частота и амплитудно-временны́е характеристики МПКП в контроле (n = 23), под действием ингибитора PLC U73122 (5 мкМ) (n = 15) и при действии WIN в присутствии U73122 (n = 21). ★ – p <0.05 по сравнению с контролем.
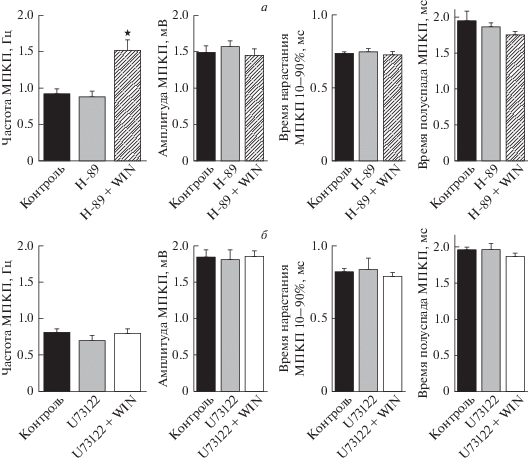
Следующим шагом стало исследование возможного участия фосфоинозитольного каскада реакций в потенцировании спонтанной секреции под действием WIN. Описана также принципиальная возможность активации этого сигнального пути при действии WIN на СВ1-рецепторы [24–26]. Мы использовали выключение этого каскада в самом начале, ингибируя фосфолипазу С (PLC) с помощью U73122 (5 мкМ). Действие U73122 на нервно-мышечный препарат в течение 50 мин не вызвало значимых изменений МП, амплитудно-временны́х характеристик МПКП и их частоты по сравнению с контролем (рис. 4б), что соответствовало полученным нами ранее данным [27]. В отличие от блокирования активности PKA, ингибирование PLC эффективно предотвращало потенцирование частоты спонтанной секреции АХ, вызываемое WIN. Средняя частота МПКП, составлявшая 0.80 ± 0.06 Гц в контроле (n = 23), не увеличилась под действием WIN в присутствии U73122 в течение 1 ч – ее значение при этом составило 0.80 ± 0.07 Гц (n = 21, p > 0.05) (рис. 4б). Результаты данной серии экспериментов свидетельствуют о том, что в моторных синапсах мыши именно фосфоинозитольный каскад, запускаемый при активации пресинаптических СВ1-рецепторов, опосредует потенцирование спонтанной секреции АХ.
Встал вопрос – какая часть фосфоинозитольного каскада опосредует прирост частоты МПКП? Это мог быть как инозитолтрифосфат (IP3), который, действуя на свои рецепторы в мембране эндоплазматического ретикулума, вызывает выброс депонированного Ca2+ и может увеличивать таким образом внутритерминальную концентрацию Ca2+. Это могла быть и протеинкиназа С (PKC), целый спектр изоформ которой обнаружен в моторных синапсах млекопитающих [28, 29]. Эти изоформы активируются ионами кальция и/или диацилглицерином, и способны оказывать разнообразные модулирующие воздействия на синаптическую передачу, действуя на различные мишени в синапсах, в число которых входят белки машинерии экзоцитоза [30–32] и ионные каналы [33–35]. Для проверки вовлечения PKC в процесс усиления спонтанной секреции мы исследовали, способен ли WIN проявить свое потенцирующее действие на частоту МПКП в условиях, когда активность пресинаптической PKC предварительно заблокирована хелеритрином. Хелеретрин ингибирует многие изоформы PKC на уровне субстрат-связывающего сайта каталитической субъединицы и широко используется в физиологических экспериментах, считаясь “классическим” блокатором PKC [36].
Cам хелеритрин (4 мкМ) не вызывал изменений значений МП, частоты, амплитуды и временнóго хода МПКП по сравнению с контролем (рис. 5а). Как и при ингибировании PLC, предварительное блокирование PKC в значительной степени предотвращало прирост частоты МПКП под действием WIN. В контроле и под действием только хелеритрина частота МПКП составляла 0.82 ± 0.11 Гц (n = 17) и 0.88 ± 0.09 Гц (n = 15, p > 0.05) соответственно. Под действием WIN на фоне хелеритрина среднее значение частоты МПКП возросло до 0.96 ± 0.07 Гц (n = 15), однако этот прирост не был статистически значимым (p > 0.05) (рис. 5а). Таким образом, мы установили, что активность пресинаптической PKC необходима для усиления спонтанной секреции при активации CВ1-рецепторов.
Рис. 5.
Увеличение частоты МПКП при стимуляции СB-рецепторов WIN (20 мкМ) опосредуется PKC и РиР: а – частота и амплитудно-временны́е характеристики МПКП в контроле (n = 17), под действием ингибитора PKС хелеритрина (4 мкМ) (n = 15) и при действии WIN в присутствии хелеритрина (n = 15). б – Частота и амплитудно-временны́е характеристики МПКП в контроле (n = 22), под действием рианодина в блокирующей РиР концентрации 5 мкМ (n = 15) и при действии WIN в присутствии рианодина (n = 21).
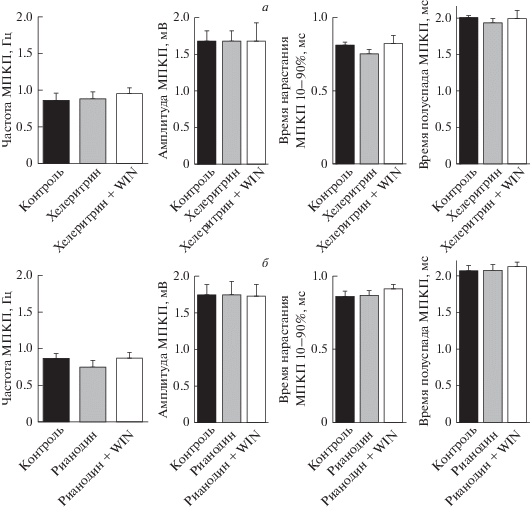
Фосфоинозитольный сигнальный каскад, запускаемый при активации PLC, предполагает увеличение внутритерминальной концентрации IP3 и активацию IP3-рецепторов пресинаптических Ca2+-депо, что приводит к выбросу депонированного Ca2+ в терминалях. Нельзя исключать и параллельную активацию рианодиновых рецепторов (РиР) ионами кальция, выбрасываемыми из депо через IP3-рецепторы. Такое сочетанное влияние на секрецию АХ со стороны IP3- и рианодин-чувствительных Ca2+-депо может происходить в моторных синапсах [21, 37]. В связи с этим мы исследовали, участвуют ли РиР в выбросе депонированного Ca2+ и сигнальном каскаде, приводящем к усилению спонтанной секреции под действием WIN в моторных нервных терминалях мыши. Предварительная блокада РиР рианодином (5 мкМ) сама по себе не изменяла значение МП мышечных волокон и параметров МПКП. Среднее значение частоты МПКП составило 0.87 ± 0.06 Гц (n = 22) в контроле и 0.75 ± 0.09 Гц при действии рианодина (n = 15, p > 0.05) (рис. 5б). При этом блокирование РиР полностью предотвращало возрастание частоты спонтанной секреции под действием WIN: в этих условиях среднее значение частоты МПКП составило 0.87 ± 0.08 Гц (n = 21, p > 0.05) (рис. 5б). Из полученных данных следует, что выброс ионов кальция из Ca2+-депо необходим для реализации эффекта активации эндоканнабиноидных рецепторов в моторных синапсах мыши, заключающемся в PLC/PKC/РиР/Ca2+-зависимом облегчении спонтанной секреции АХ.
ОБСУЖДЕНИЕ
Эксперименты с использованием антагониста/обратного агониста СВ1-рецепторов выявили отсутствие в покое изменений параметров спонтанной квантовой секреции АХ, которые могли бы иметь место в случае тонического воздействия со стороны ретроградно действующих эндоканнабиноидов на СB1-рецепторы. Такие результаты позволяют говорить о том, что для проявления активности эндоканнабиноидов требуется, видимо, сократительная и/или электрическая активность мышечных волокон и самих синапсов как обязательных условий для функционирования эндоканнабиноидной системы, обеспечивающих ретроградную сигнализацию. Подобные условия описаны в синапсах ЦНС, где образование эндоканнабиноидов требует интенсивной синаптической активности [2, 5, 8, 9]. Вместе с тем, в пользу присутствия регуляторных воздействий эндоканнабиноидов в моторных синапсах мыши свидетельствует обнаруженный нами факт изменений частоты МПКП под действием WIN – экзогенного агониста СВ-рецепторов.
Нами впервые показано, что под действием экзогенного агониста СВ-рецепторов они включаются в регуляцию квантовой секреции АХ, причем в направлении потенцирования передачи, что выражается в увеличении частоты спонтанных МПКП. Облегчающее действие стимуляции эндоканнабиноидных рецепторов на спонтанную секрецию АХ в исследованных нами моторных синапсах мыши выглядит достаточно неожиданным, учитывая, что и в центральных, и в моторных синапсах холоднокровных активация эндоканнабиноидной системы приводит к торможению синаптической передачи, в частности, спонтанной активности синапсов [18, 38, 39]. Вместе с тем, в самой первой работе, выполненной на моторных синапсах крысы, также обнаружено возрастание частоты МПКП (наряду с увеличением их амплитуды) под действием фитоканнабиноида Δ-9-тетрагидроканнабинола [16]. При этом в работе, посвященной изучению регуляции секреции АХ при стимуляции CB-рецепторов в диафрагмальных синапсах мыши, описано увеличение амплитуды МПКП и размеров синаптических везикул при отсутствии сдвигов частоты МПКП. Однако проявление таких эффектов требовало более длительного воздействия WIN: изменения квантовой секреции АХ регистрировались спустя 2 ч тонической стимуляции СB-рецепторов [15]. Различия между приведенными данными и полученными нами результатами могут быть следствием различий в условиях экспериментов, в частности, временны́х режимов аппликации агонистов и антагонистов для анализа последствий воздействия на эндоканнабиноидные рецепторы, в результате чего не исключена возможность вовлечения дополнительных рецепторов и/или факторов, которые могут усложнять разнообразные эффекты работы эндоканнабиноидной системы в синапсах [5, 26, 40].
В нашей работе впервые удалось установить, что краткосрочная пресинаптическая активность WIN, сопровождающаяся приростом частоты МПКП, связана с активацией пресинаптических СВ1-рецепторов, так как предотвращается селективным обратным агонистом этих рецепторов. Считается, что одним из основных путей реализации синаптических эффектов ретроградно действующих эндоканнабиноидов служит торможение аденилатциклазы за счет Gi-белка [2, 5, 41]. Однако полученные нами результаты свидетельствуют в пользу того, что СB1-опосредованная сигнализация в моторных синапсах мыши отличается от сигнализации в большинстве синапсов ЦНС и задействует иные каскады реакций и вторичные посредники. Полученные нами данные позволяют предполагать следующую последовательность этапов внутриклеточной сигнализации, запускаемую активацией CB1-рецепторов и приводящую в конечном итоге к увеличению частоты МПКП в моторных синапсах (рис. 6).
Рис. 6.
Схема внутриклеточной сигнализации, запускаемой в нервных терминалях моторных синапсов мыши активацией пресинаптических эндоканнабиноидных рецепторов СВ1-типа, и приводящей к увеличению спонтанной квантовой секреции ацетилхолина (АХ). СВ1-опосредованный сигнальный каскад реализуется за счет активации фосфолипазы С (PLC) с последующим участием протеинкиназы С (PKC) и рианодиновых рецепторов.
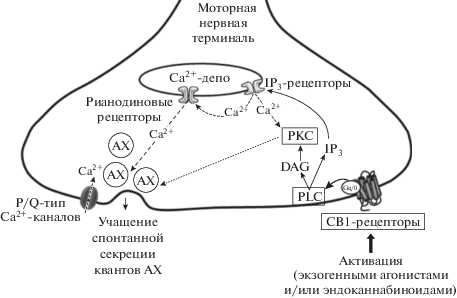
Мы показали, что индуцированный активацией CB1-рецепторов прирост частоты МПКП обусловлен запуском сигнального каскада с участием PLC, но не PKA. Впервые установлено, что участниками такого сигнального каскада также являются PKC, РиР и выброс депонированного Ca2+, совокупное действие которых обеспечивает стойкое увеличение частоты спонтанной секреции АХ в моторных нервных терминалях. Возможность модулировать частоту и другие параметры миниатюрных постсинаптических потенциалов за счет активации пресинаптической PLC, выброса депонированного Ca2+, а также PKC описана и при других рецепторных воздействиях, в частности, в синапсах ЦНС при активации пресинаптических метаботропных рецепторов [42, 43]. Что касается моторных синапсов, то возможное участие PLC в пресинаптической регуляции Ca2+-зависимой спонтанной секреции АХ также наблюдали при определенных воздействиях [44].
Считается, что возрастание частоты спонтанной секреции отражает увеличение вероятности выброса одиночных квантов медиатора [45, 46]. Увеличение этого параметра квантовой секреции АХ может также приводить к облегчению и вызванной секреции АХ. Однако вопрос – как стимуляция пресинаптических CB-рецепторов отразится на характере мультиквантового вызванного выброса АХ – остается пока открытым. Вместе с тем, обнаруженный нами феномен – учащение спонтанной секреции АХ в моторных синапсах млекопитающих при стимуляции эндоканнабиноидных рецепторов – имеет, на наш взгляд, собственную научную значимость, учитывая результаты последних лет, убедительно показавшие, что спонтанная секреция одиночных квантов медиатора – это особый режим работы синапса, которому может быть присуща самостоятельная, отличная от вызванной активности функциональная роль, паттерн активации и способы регуляции, зачастую не совпадающие с модулированием вызванной секреции АХ [43, 46–48]. Не исключено, что впервые обнаруженный нами контроль именно частоты спонтанной секреции со стороны эндоканнабиноидной системы связан с проявлением специфической регуляторной активности эндоканнабиноидов в отношении моторных синапсов. Избирательный тонический контроль спонтанной активности (частоты миниатюрных возбуждающих постсинаптических потенциалов) с участием эндоканнабиноидов описан недавно и в созревающих синапсах ЦНС [49].
Нельзя исключить, что в других условиях, в частности, при интенсивной активности моторных синапсов в сочетании с сокращениями мышцы, а также в сочетании с активностью других регуляторных контуров, возможны иные проявления модулирующих воздействий на синаптическую передачу со стороны эндоканнабиноидов и их пресинаптических рецепторов.
В заключение отметим, что в настоящее время установлена роль мышечных СВ-рецепторов в регуляции электромеханического сопряжения, транспорта глюкозы, энергозатрат и других процессов, сопровождающих мышечную активность [13]. Что касается СВ-рецепторов периферических синапсов, то и наши, и опубликованные данные [15] свидетельствуют об их присутствии на моторных нервных терминалях и способности регулировать параметры квантовой секреции АХ. Можно предполагать, что роль таких рецепторов в случае их активации эндоканнабиноидами заключается в коррекции или поддержании синаптической передачи на уровне, необходимом для адекватного запуска и работы мышцы в ответ на интенсивные нагрузки. Однако эти представления нуждаются в дальнейшем экспериментальном подтверждении.
Работа поддержана грантом РФФИ 19-04-00616а.
Список литературы
Crespillo A., Suárez J., Bermúdez-Silva F., Rivera P., Vida M., Alonso M., Palomino A., Lucena M., Serrano A., Pérez-Martín M., Macias M., Fernández-Llébrez P., Rodríguez de Fonseca F. 2011. Expression of the cannabinoid system in muscle: Effects of a high-fat diet and CB1 receptor blockade. Biochem. J. 433, 175–185.
Castillo P., Younts T., Chávez A., Hashimotodani Y. 2012. Endocannabinoid signaling and synaptic function. Neuron. 76, 70–81.
Oláh T., Bodnár D., Tóth A., Vincze J., Fodor J., Reischl B., Kovács A., Ruzsnavszky O., Dienes B., Szentesi P., Friedrich O., Csernoch L. 2016. Cannabinoid signalling inhibits sarcoplasmic Ca2+ release and regulates excitation-contraction coupling in mammalian skeletal muscle. J. Physiol. 594, 7381–7398.
Hutchins-Wiese H.L., Li Y., Hannon K., Watkins B.A. 2012. Hind limb suspension and long-chain omega-3 PUFA increase mRNA endocannabinoid system levels in skeletal muscle. J. Nutr. Biochem. 23, 986–993.
Zou S., Kumar U. 2018. Cannabinoid receptors and the endocannabinoid system: Signaling and function in the central nervous system. Int. J. Mol. Sci. 19, 833.
Howlett A., Barth F., Bonner T., Cabral G., Casellas P., Devane W., Felder C., Herkenham M., Mackie K., Martin B., Mechoulam R., Pertwee R. 2002. International union of pharmacology. XXVII. Classification of cannabinoid receptors. Pharmacol. Rev. 54, 161–202.
Pertwee R., Howlett A., Abood M., Alexander S., Di Marzo V., Elphick M., Greasley P., Hansen H., Kunos G., Mackie K., Mechoulam R., Ross R. 2010. International union of basic and clinical pharmacology. LXXIX. Cannabinoid receptors and their ligands: Beyond CB1 and CB2. Pharmacol. Rev. 62, 588–631.
Araque A., Castillo P., Manzoni O., Tonini R. 2017. Synaptic functions of endocannabinoid signaling in health and disease Neuropharmacology. 124, 13–24.
Freund T., Katona I., Piomelli D. 2003. Role of endogenous cannabinoids in synaptic signaling. Physiol. Rev. 83, 1017–1066.
Hillard C. 2015. The endocannabinoid signaling system in the CNS. Int. Rev Neurobiology. 125, 1–47.
Sugaya Y., Kano M. 2018. Control of excessive neural circuit excitability and prevention of epileptic seizures by endocannabinoid signaling. Cell. Mol. Life Sci. 75, 2793–2811.
Cavuoto P., McAinch A., Hatzinikolas G., Janovská A., Game P., Wittert G. 2007. The expression of receptors for endocannabinoids in human and rodent skeletal muscle. Biochem. Biophys. Res. Commun. 364, 105–110.
Maccarrone M., Bab I., Bíró T., Cabral G., Dey S., Di Marzo V., Konje J., Kunos G., Mechoulam R., Pacher P., Sharkey K., Zimmer A. 2015. Endocannabinoid signaling at the periphery: 50 years after THC. Trends Pharmacol. Sci. 36, 277–296.
Heyman E., Gamelin F.-X., Aucouturier J., Di Marzo V. 2012. The role of the endocannabinoid system in skeletal muscle and metabolic adaptations to exercise: Potential implications for the treatment of obesity. Obes. Rev. 13, 1110–1124.
Morsch M., Protti D., Cheng D., Braet F., Chung R., Reddel S., Phillips W. 2018. Cannabinoid-induced increase of quantal size and enhanced neuromuscular transmission. Sci. Rep. 8, 4685.
Hoekman T., Dettbarn W., Klausner H. 1976. Actions of delta9-tetrahydrocannabinol on neuromuscular transmission in the rat diaphragm. Neuropharmacology. 15, 315–319.
Gaydukov A., Bogacheva P., Balezina O. 2016. Calcitonin gene-related peptide increases acetylcholine quantal size in neuromuscular junctions of mice. Neurosci. Lett. 628, 17–23.
Sanchez-Pastor E., Trujillo X., Huerta M., Andrade F. 2007. Effects of cannabinoids on synaptic transmission in the frog neuromuscular junction. J. Pharmacol. Exp. Ther. 321, 439–445.
Childers S. 2006. Activation of G-proteins in brain by endogenous and exogenous cannabinoids AAPS J. 8, E112–E117.
Soni N., Kohlmeier K. 2016. Endocannabinoid CB1 receptor-mediated rises in Ca2+ and depolarization-induced suppression of inhibition within the laterodorsal tegmental nucleus. Brain Struct. Funct. 221, 1255–1277.
Silveira P., Silveira N., Morini V. de C., Kushmerick C., Naves L. 2010. Opposing effects of cannabinoids and vanilloids on evoked quantal release at the frog neuromuscular junction. Neurosci. Lett. 473, 97–101.
Maneuf Y., Brotchie J. 1997. Paradoxical action of the cannabinoid WIN 55,212-2 in stimulated and basal cyclic AMP accumulation in rat globus pallidus slices. Br. J. Pharmacol. 120, 1397–1398.
Glass M., Felder C. 1997. Concurrent stimulation of cannabinoid CB1 and dopamine D2 receptors augments cAMP accumulation in striatal neurons: Evidence for a Gs linkage to the CB1 receptor. J. Neurosci. 17, 5327–5333.
Lauckner J., Hille B., Mackie K. 2005. The cannabinoid agonist WIN55,212-2 increases intracellular calcium via CB1 receptor coupling to Gq/11 G proteins. Proc. Natl. Acad. Sci. USA. 102, 19144–19149.
Diez-Alarcia R., Ibarra-Lecue I., Lopez-Cardona Á., Meana J., Gutierrez-Adán A., Callado L., Agirregoitia E., Urigüen L. 2016. Biased agonism of three different cannabinoid receptor agonists in mouse brain cortex. Front. Pharmacol. 7, 415.
Turu G., Hunyady L. 2010. Signal transduction of the CB1 cannabinoid receptor. J. Mol. Endocrinol. 44, 75–85.
Gaydukov A., Akutin I., Bogacheva P., Balezina O. 2018. Changes in the parameters of quantal acetylcholine release after activation of PAR1-type thrombin receptors at the mouse neuromuscular junctions. Biochem. (Moscow), Suppl. Ser. A, Membr. Cell Biol. 12, 33–42.
Besalduch N., Tomàs M., Santafé M., Garcia N., Tomàs J., Lanuza M. 2010. Synaptic activity-related classical protein kinase C isoform localization in the adult rat neuromuscular synapse. J. Comp. Neurol. 518, 211–228.
Lanuza M., Santafé M., Garcia N., Besalduch N., Tomàs M., Obis T., Priego M., Nelson P., Tomàs J. 2014. Protein kinase C isoforms at the neuromuscular junction: Localization and specific roles in neurotransmission and development. J. Anat. 224, 61–73.
Morgan A., Burgoyne R., Barclay J., Craig T., Prescott G., Ciufo L., Evans G., Graham M. 2005. Regulation of exocytosis by protein kinase C. Biochem. Soc. Trans. 33, 1341–1344.
Hurtado E., Cilleros V., Nadal L., Simó A., Obis T., Garcia N., Santafé M., Tomàs M., Halievski K., Jordan C., Lanuza M., Tomàs J. 2017. Muscle contraction regulates BDNF/TrkB signaling to modulate synaptic function through presynaptic cPKCα and cPKCβI. Front. Mol. Neurosci. 10, 147.
Simó A, Cilleros-Mañé V., Just-Borràs L., Hurtado E., Nadal L., Tomàs M., Garcia N., Lanuza M., Tomàs J. 2019. nPKCε mediates SNAP-25 phosphorylation of Ser-187 in basal conditions and after synaptic activity at the neuromuscular junction. Mol. Neurobiol. https://doi.org/10.1007/s12035-018-1462-5
Arenson M., Evans S. 2001. Activation of protein kinase C increases acetylcholine release from frog motor nerves by a direct action on L-type Ca2+ channels and apparently not by depolarisation of the terminal. Neuroscience. 104, 1157–1164.
Urbano F., Depetris R., Uchitel O. 2001. Coupling of L-type calcium channels to neurotransmitter release at mouse motor nerve terminals Pflügers Arch. Eur. J. Physiol. 441, 824–831.
Gaydukov A., Marchenkova A., Balezina O. 2012. Facilitation of neurotransmitter release in mouse motor synapses in different modes of protein kinase C activation. Bull. Exp. Biol. Med. 153, 415–418.
Herbert J., Augereau J., Gleye J., Maffrand J. 1990. Chelerythrine is a potent and specific inhibitor of protein kinase C. Biochem. Biophys. Res. Commun. 172, 993–999.
Pagani M., Reisin R., Uchitel O. 2006. Calcium signaling pathways mediating synaptic potentiation triggered by amyotrophic lateral sclerosis IgG in motor nerve terminals. J. Neurosci. 26, 2661–2672.
Yamasaki M., Hashimoto K., Kano M. 2006. Miniature synaptic events elicited by presynaptic Ca2+ rise are selectively suppressed by cannabinoid receptor activation in cerebellar Purkinje cells. J. Neurosci. 26, 86–95.
Newman Z., Malik P., Wu T.-Y., Ochoa C., Watsa N., Lindgren C. 2007. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur. J. Neurosci. 25, 1619–1630.
Accorsi-Mendonça D., Almado C., Dagostin A., Machado B., Leão R. 2008. Inhibition of spontaneous neurotransmission in the nucleus of solitary tract of the rat by the cannabinoid agonist WIN 55212-2 is not via CB1 or CB2 receptors. Brain Res. 1200, 1–9.
Ohno-Shosaku T., Kano M. 2014. Endocannabinoid-mediated retrograde modulation of synaptic transmission. Curr. Opin. Neurobiol. 29, 1–8.
Kelm M., Criswell H., Breese G. 2011. Ethanol-enhanced GABA release: A focus on G protein-coupled receptors Brain Res. Rev. 65, 113–123.
Williams C., Smith S. 2018. Calcium dependence of spontaneous neurotransmitter release J. Neurosci. Res. 96, 335–347.
Liou J.-C., Kang K.-H., Chang L.-S., Ho S.-Y. 2006. Mechanism of β-bungarotoxin in facilitating spontaneous transmitter release at neuromuscular synapse. Neuropharmacology. 51, 671–680.
Kaeser P., Regehr W. 2014. Molecular mechanisms for synchronous, asynchronous, and spontaneous neurotransmitter release. Annu. Rev. Physiol. 76, 333–363.
Kavalali E. 2015. The mechanisms and functions of spontaneous neurotransmitter release. Nat. Rev. Neurosci. 16, 5–16.
Curry R., Peng K., Lu Y. 2018. Neurotransmitter- and release-mode-specific modulation of inhibitory transmission by group I metabotropic glutamate receptors in central auditory neurons of the mouse. J. Neurosci. 38, 8187–8199.
Kavalali E. 2019. Neuronal Ca 2+ signalling at rest and during spontaneous neurotransmission J. Physiol. https://doi.org/10.1113/JP276541
Gonzalez-Islas C., Garcia-Bereguiain M., Wenner P. 2012. Tonic and transient endocannabinoid regulation of AMPAergic miniature postsynaptic currents and homeostatic plasticity in embryonic motor networks. J. Neurosci. 32, 13 597–13 607.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


