Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 1, стр. 61-68
Роль HDAC класса IIa в экспрессии Е3-лигаз ATROGIN-1/MAFbx и MuRF1 при функциональной разгрузке мышц
С. П. Белова a, *, Е. П. Мочалова a, Т. Л. Немировская a
a Государственный научный центр Российской Федерации –
Институт медико-биологических проблем РАН
123007 Москва, Россия
* E-mail: swetbell@mail.ru
Поступила в редакцию 20.04.2019
После доработки 09.07.2019
Принята к публикации 10.07.2019
Аннотация
Изучена роль гистондеацетилаз 4/5 (HDAC4/5) в активации миогенина и Е3-лигаз (MuRF1 и MAFbx) при функциональной разгрузке m. soleus. С этой целью при вывешивании крыс использовали трихостатин A – ингибитор гистондеацетилаз. Крыс Вистар (24 трехмесячных самца) разделяли на три группы (по восемь в каждой). Одна группа служила контролем (С), вторую (HS) и третью группы вывешивали в течение 3 дней (крысам группы 3 при вывешивании вводили трихостатин в дозе 0.6 мг/кг массы тела в сутки внутрибрюшинно (HSТ)). Крыс забивали сверхдозой нембутала (75 мг/кг веса), и m. soleus немедленно замораживали в жидком азоте. В группе HSТ обнаружено существенное снижение содержание белка HDAC4 в ядерной фракции (в отличие от группы HS) и его увеличение в цитоплазматической (относительно контроля (p < 0.05)). Введение трихостатина А предотвратило изменение содержания HDAC5 в ядре (относительно группы C), тогда как в группе HS содержание HDAC5 было существенно снижено (p < 0.05). Таким образом, препарат предотвратил действие функциональной разгрузки на ядерную локализацию HDAC 4/5. Уровень транскрипционного фактора миогенина в группе крыс HST не отличался от значений в контроле, тогда в группе HS значительно его превышал (p < 0.05). Экспрессия мРНК Е3-лигазы atrogin-1/MAFbx у крыс HST была такой же, как в контроле, и существенно возрастала в группе HS (p < 0.05). Экспрессия мРНК Е3-лигазы MuRF1 в обеих вывешенных группах была повышена по сравнению с контролем (вне зависимости от введения препарата). Вывод: HDAC4/5 регулируют экспрессию миогенина и экспрессию Е3-лигазы atrogin-1/MAFbx. Ингибирование HDAC4/5 не влияет на регуляцию экспрессии Е3-лигазы MuRF1.
ВВЕДЕНИЕ
В работе изучена роль гистондеацетилаз 4/5 (HDAC4/5) в активировании транскрипционного фактора миогенина и экспрессии Е3-лигаз (atrogin-1/MAFbx и MuRF1) на ранних сроках функциональной разгрузки m. soleus у крыс. Экспрессия ключевых E3-убиквитинлигаз определяет интенсивность работы убиквитин-протеасомного пути и, следовательно, развитие атрофии скелетных мышц [1]. Наиболее часто исследовали участие фосфорилирования/дефосфорилирования транскрипционнного фактора FOXO в регуляции экспрессии генов Е3-убиквитинлигаз при разгрузке мышц. Обычно при этом анализируют сигнальный путь Akt/mTOR/p70S6k, при супрессии которого во время разгрузки фактор FOXO может дефосфорилироваться, проникать в ядро и запускать экспрессию Е3-лигаз [2, 3]. Однако мы нередко сталкивались со случаями, когда экспрессия Е3-лигаз была высокой и не соответствовала при этом активности сигнального пути Akt-FOXO [4, 5], что указывало на возможное участие других механизмов, активирующих работу генов Е3-лигаз в мышце. В последнее время стали появляться работы, в которых исследовали возможность взаимодействия гистондеацетилаз (HDAC) с различными транскрипционными факторами [6–8]. В дополнение к регуляции транскрипции генов посредством ацетилирования гистонов, гистонацетилтрансферазы (HAT) и HDAC влияют на экспрессию генов путем изменения статуса ацетилирования и функции транскрипционных факторов. Мы проверили возможность участия HDAC4/5 в активации экспрессии Е3-лигаз при функциональной разгрузке m. soleus. С этой целью крысам при вывешивании в течение 3 суток вводили трихостатин А (специфический ингибитор гистондеацетилаз класса IIa). Выявление механизмов, инициирующих синтез основных мышечных E3-лигаз, может существенно расширить представление о фундаментальных механизмах развития атрофических процессов в мышце, и послужить основой для разработки подходов к фармакологической коррекции негативных последствий функциональной разгрузки мышц.
МАТЕРИАЛЫ И МЕТОДЫ
Крысы линии Вистар (24 самца массой 180–200 г) были случайным образом разделены на три группы по восемь животных в каждой: интактный контроль (С), трехсуточное вывешивание с введением плацебо (HS), и трехсуточное вывешивание (HSТ) с введением ингибитора гистондеацетилаз класса IIa трихостатина А (в дозе 0.6 мг/кг массы тела в сутки внутрибрюшинно в течение 3 дней). Животные других групп получали инъекции физраствора. Аналогичную концентрацию препарата использовали ранее [9]. Вывешивание задних конечностей крыс делали по стандартной методике Ильина–Новикова [10] в модификации Morey-Holton [11]. Пищу и воду животные получали ad libitum. Через 3 дня крыс забивали сверхдозой нембутала (75 мг/кг веса), m. soleus извлекали, немедленно замораживали в жидком азоте и хранили при –85°С.
Обработка биоматериала. Электрофорез в полиакриламидном геле (ПААГ) в денатурирующих условиях (додецилсульфат натрия, SDS) с последующим вестерн-блотингом. Делали срезы каждого образца m. soleus толщиной 20 мкм (10–15 мг) на микротоме-криостате фирмы Leica. Цитоплазматическую и ядерную фракцию белков выделяли с помощью набора NE-PER Nuclear and Cytoplasmic Extraction Reagents (Thermo Scientific, США). После центрифугирования часть супернатанта отбирали для определения концентрации общего белка с помощью реактива Брэдфорд (Bio-Rad Laboratories, США). Пробы для нанесения разводили в двухкратном буфере для SDS-электрофореза белков по Лэммли (5.4 мМ Tрис-HCl (pH 6.8), 4% SDS, 20% глицерин, 10% β-меркаптоэтанол, 0.02% бромфеноловый синий). Электрофорез проводили в 10% разделяющем ПААГ (0.2% метилбисакриламид, 0.1% SDS, 375 мМ трис-HCl (pH 8.8), 0.05% персульфат аммония, 0.1% ТЕМЕД) и в 5% концентрирующем ПААГ (0.2% метилбисакриламид, 0.1% SDS, 125 мМ трис-HCl (pH 6.8), 0.05% персульфат аммония, 0.1% ТЕМЕД). Электрофорез проводили в трис-глициновом буфере (192 мМ трис-глицин (pH 8.6), 0.1% SDS). Образцы каждой группы наносили из расчета 20 мкг общего белка в каждой пробе на дорожку и нормировали по уровню GAPDH в той же пробе. Электрофорез проводили при силе тока 15 мА в мини-системе (“Bio-Rad Laboratories”) при комнатной температуре.
Вестерн-блотинг. Электроперенос белков проводили в буфере (25 мМ трис (pH 8.3), 192 мМ глицин, 20% метанола, 0.04% SDS) на нитроцеллюлозную мембрану при 100 В при температуре 4°C в системе mini Trans-Blot (Bio-Rad Laboratories) в течение 2 ч. Электроперенос белков проводили в буфере с 0.08% SDS при 350 мA в течение 1.5 ч. После электропереноса нитроцеллюлозные мембраны инкубировали в течение 5 мин в 0.3% растворе Ponceau Red в 5% уксусной кислоте, затем отмывали в фосфатно-солевом буфере (Биолот) с 0.1% Tween 20 (PBST) до появления четких белковых полос на мембране. Этот этап проводили для контроля эффективности переноса и чтобы убедиться, в равном количестве общего белка, внесенного в каждую дорожку. Мембраны блокировали в растворе 5% сухого молока (Bio-Rad Laboratories) в PBST (1 ч при комнатной температуре), затем помещали в раствор первичных антител на ночь при +4°С.
Белковые полосы выявляли с использованием первичных антител к pAkt-437 (1 : 1000), Akt (1 : 1500), HDAC4 (1 : 500) фирмы Cell Signaling Technology (США), P-FOXO3-253 (1 : 1000), FOXO3 (1 : 000), миогенину (1 : 500) фирмы Santa Cruz (США), ламину B (1 : 1000), HDAC5 (1 : 500) фирмы Abcam (США), GapDH (1 : 10 000) фирмы ABM. Затем мембрану отмывали от первичных антител в PBST (3 раза по 5 мин на шейкере) и инкубировали в течение 1 ч с вторичными антителами против иммуноглобулинов кролика (1 : 30 000, Jackson Immuno Research, США) или вторичными антителами против иммуноглобулинов мыши (1:18000, Bio-Rad Laboratories, США). Потом мембрану отмывали от вторичных антител в PBST (3 раза по 5 мин на шейкере). Белки выявляли с помощью Clarity Western ECL Substrate (Bio-Rad Laboratories). Хемилюминесцентный сигнал детектировали с помощью сканера C-DiGit Blot Scanner (LI-COR, США). Белковые полосы анализировали с использованием Image Studio Software (LI-COR).
Исследование экспрессии генов. Для проведения ПЦР в реальном времени и оценки количества мРНК из образцов мышечной ткани крыс экспериментальных групп выделяли РНК. Для выделения суммарной РНК из скелетных мышц использовали методику выделения РНК на микроколонках RNeasy Micro (Qiagen, Германия). Образцы m. soleus крысы нарезали на микротоме при толщине срезов 20 мкм. Нарезанную ткань в количестве 4–6 мг помещали в пробирку с 300 мкл лизирующего буфера RLT в который добавляли 10 мкл β-меркаптоэтанола. Гомогенат перемешивался в течение 1 мин на Microspin FV-2400 (Biosan, Латвия). Затем к гомогенату добавляли 589 мкл воды, очищенной от РНКазы, и 11 мкл раствора протеиназы К (18.7 мг/мл) (Синтол, Россия). Далее раствор инкубировали в течение 15 мин при 55°С, а затем центрифугировали при комнатной температуре в течение 3 мин при 10 000 g. Супернатант переносили в новую пробирку с 450 мкл 96–100% этилового спирта, смесь перемешивали пипетированием. Лизат переносили на колонку в пробирке и центрифугировали в течение 15 с при ≥ 8000g. Колонку промывали 350 мкл буфера RW1 центрифугированием (15 с при ≥ 8000 g). На колонку наносили 80 мкл раствора ДНКазы I и выдерживали в течение 20 мин. Затем колонку последовательно промывали буферами RW1, RPE, 80% этанолом. Для элюции колонку переносили в чистую пробирку и наносили 30 мкл воды и центрифугировали (1 мин при 10 000 g). Пробирку с водным раствором РНК немедленно помещали в лед, а затем хранили в криостате (–85°С).
Определение содержания мРНК. Поглощение раствора мРНК определяли при помощи спектрофотометра UV 2450 (SHIMADZU, Япония). Снимались показания в диапазоне от 200 до 320 нм. Пробу перед измерением разводили в 21 раз в TE-буфере (10 мМ трис, 1 мМ EDTA, pH 8.0). Чистоту образцов оценивали по соотношению показателей поглощения при различных длинах волн.
Конструирование праймеров. Праймеры подбирали с помощью программы Primer3 v.0.4.0, находящейся в свободном доступе (http://frodo.wi. mit.edu/primer3/).
Используемые в работе праймеры: 5'-CTACGATGTTGCAGCCAAGA-3' и 5'-GGCAGTCGAGAAGTCCAGTC-3' для MAFbx; 5'-GCCAATTTGGTGCTTTTTGT-3' и 5'-AAATTCAGTCCTCTCCCCGT-3' для MuRF1; 5'-ACGGCAAGTTCAACGGCACA-GTCAA-3' и 5'-GCTTTCCAGAGGGGC-CATCCACA-3' для GAPDH; 5'-TCATGAAGTG-TGACGTTGACATCC-3' и 5'-GTAAAA-CGCAGCTCAGTAACAGTC-3' для β-актина; 5'-ACTCCCTTACGTCCATCGTG-3' и 5'-CAGGACAGCCCCACTTAAAA-3' для миогенина.
Все праймеры были синтезированы фирмой Синтол (Россия).
Обратная транскрипция. Для проведения обратной транскрипции использовали реагенты фирмы Синтол. Для подготовки кДНК водный раствор, содержащий 1 мкг суммарной РНК, 30 мкМ случайных гексануклеотидов и 17.4 мкМ олиго-d(T)15, инкубировали в течение 3 мин при 70°С и немедленно переносили на лед. Далее к смеси добавляли 11.5 мкл мастер-микса (1.3 мМ dNTP, 0.02 ед./мкл ингибитора РНКазы, 6 ед./мкл M-MLV-ревертазы, 4 мкл 5× буфера для M-MLV-ревертазы, Синтол). После этого пробы помещали в амплификатор (iQ5 Multicolor Real-Time PCR Detection System, Bio-Rad Laboratories) для проведения обратной транскрипции: 10 мин при 25°С, 60 мин при 37°С, 5 мин при 95°С, 30 мин при 4°С. После проведения реакции образцы, содержащие кДНК, хранили при –25°С.
ПЦР в реальном времени. Для проведения ПЦР в реальном времени смешивали 2 мкл кДНК, 2 мкл смеси праймеров с концентрацией каждого 10 мкМ и 21 мкл мастер-микса (0.3 мМ dNTP, 3 мМ MgCl2, 2.5 мкл 10× ПЦР-буфера Б (pH 8.8), 0.06 ед./мкл Taq-ДНК-полимеразы, Синтол). Реакцию проводили по протоколу: 95°С – 3 мин; 40 циклов: 95°С – 15 с, 60°С – 15 с, 72°С – 20 с, затем 65°С –5 с и 15°С – 10 мин.
Анализ и статистическая обработка данных. Белковые полосы анализировали с использованием Image Studio Software (LI-COR). Хемилюминесцентный сигнал полосы контрольной группы на мембране принимали за 100%, а сигнал полос других групп сравнивали с сигналом полос контрольной группы, расположенных на одной и той же мембране.
Данные, полученные с помощью ПЦР в реальном времени, анализировали с использованием метода 2–ΔΔСt (метод Ливака). В качестве референсных использовали гены GAPDH и β-актина, экспрессия которых постоянна в m. soleus в условиях эксперимента.
Статистическую обработку данных проводили с помощью программ REST 2009 v.2.0.12 и OpenOffice.org Calc, находящихся в свободном доступе. REST 2009 v.2.0.12 позволяет анализировать данные по нескольким референсным генам, что снижает вероятность ошибки. Статистическую значимость отличий между группами определяли с помощью U-критерия Манна-Уитни. U-критерий был выбран, поскольку количество повторов в выборках не превышало 10. В тексте и на гистограммах результаты анализа экспрессии генов представлены в виде медианы и интерквартильной широты, результаты анализа относительного содержания белков с помощью вестерн-блотинга представлены в виде среднего и ошибки среднего.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мы впервые исследовали работу HDAC4/5 на ранних сроках функциональной разгрузки мышц и, в частности, их роль в активации экспрессии Е3-лигаз. Известно, что существенная экспрессия Е3-лигаз наблюдается уже на первые сутки разгрузки мышц, и к третьим суткам достигает своего пика [12]. Известно, что животные с нокаутом генов atrogin-1/MAFbx и MuRF1 устойчивы к снижению мышечной массы [13] Экспрессия этих Е3-лигаз может регулироваться несколькими путями. Ранее мы исследовали работу сигнального каскада PI3K/Akt, который регулирует фосфорилирование транскрипционного фактора FOXO3, контролирующего экспрессию этих Е3-лигаз. Неизвестно, может ли сигнальный каскад HDAC4/5 контролировать их экспрессию, например, через активацию транскрипционного фактора миогенина при функциональной разгрузке мышц или через ацетилирование сайтов FOXO3 [14]. Мы исследовали такую возможность.
Обнаружено, что в группе животных с введением трихостатина уровень HDAC4/5 достоверно отличался от уровня у животных, вывешенных без ингибитора HDAC (рис. 1, 2). Это показывает, что действие ингибитора на обе HDAC было специфическим. Известно, что трихостатин А несколько сильнее ингибирует HDAC4, чем HDAC5 [15].
Рис. 1.
Изменение относительного содержания HDAC4 в ядре (а) и цитоплазме (б) при введении трихостатина на фоне 3-суточной функциональной разгрузки m. soleus крысы. С – контроль, HS – вывешивание, HST – вывешивание с введением трихостатина. * – Статистически значимое отличие от контроля, p < 0.01, # – Статистически значимое отличие от вывешивания, p < 0.01.
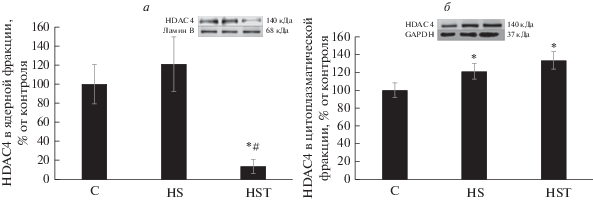
Рис. 2.
Изменение относительного содержания HDAC5 в ядре при введении трихостатина на фоне 3-суточной функциональной разгрузки m. soleus крысы. С – контроль, HS – вывешивание, HST – вывешивание с введением трихостатина. * – Статистически значимое отличие от контроля, p < 0.01.
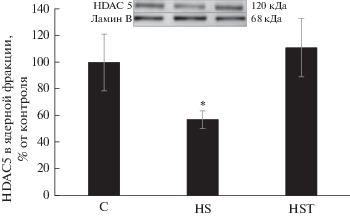
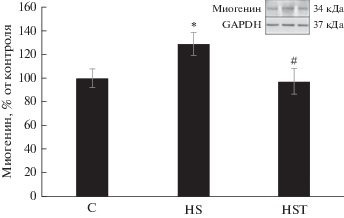
Ранее Yoshihara и соавт. (2016) обнаружили увеличение уровня HDAC4 в цитоплазматической и ядерной фракциях мышцы при 10-дневной иммобилизации конечности крысы [16]. Эти данные согласуются с результатами, полученными в нашем эксперименте, так как в цитоплазматической фракции обеих вывешенных групп (HS и HST) содержание HDAC4 также было существенно выше, чем в контрольной группе (рис. 1б). В ядерной фракции уровень HDAC4 в группы HS лишь незначительно превышал контрольный, тогда как введение трихостатина А резко снизило содержание HDAC4 в ядре (p < 0.05, рис. 1a). Ранее было показано, что сумоилирование HDAC4 может быть связано с его ядерным импортом [17]. Постулируется, что кальций/кальмодулин-зависимая протеинкиназа (CaMK), которые индуцируют ядерный экспорт, предотвращают модификацию SUMO-1 HDAC4 [17]. Кроме того, модификация зависит от интактного сигнала ядерной локализации и катализируется белком RanBP2 комплекса ядерных пор (NPC), фактором, недавно идентифицированным как лигаза SUMO E3. Обнаружено, что сумоилирование HDAC4 происходит в NPC и сопряжено с ее ядерным импортом. Отмечается, что SUMO-зависимую модификацию HDAC4 и ее значение in vivo только предстоит исследовать [17]. Введение трихостатина А предотвратило изменение содержания HDAC5 в ядре (относительно контрольной группы C), тогда как у крыс группы HS ее содержание было существенно снижено ((p < 0.05), рис. 2). Du Bois P. и соавт. показали [7], что PKD1 создает в HDAC5 мотивы распознавания фосфо-14-3-3, которые рекрутируют белки 14-3-3, что в конечном итоге приводит к ядерному экспорту HDAC5 и активации экспрессии MuRF1. Возможно, что в нашем случае мог быть задействован механизм транспорта HDAC5, описанный ранее [17]. Итак, мы видим, что ингибирование HDAC4/5 трихостатином А по-разному влияет на содержание HDAC4/5 в ядерной фракции по сравнению с содержанием в m. soleus животных, вывешенных без препарата. Возможные механизмы ядерного экспорта и импорта этих HDAC приведены выше, однако триггерные механизмы, регулирующие эти изменения при функциональной разгрузке, до сих пор неизвестны. Регуляция структуры хроматина N-концевым ацетилированием гистонов – ключевой механизм контроля генной экспрессии. Ранее было показано, что HDAC, которые служат для возврата хроматина в его конденсированное состояние, играют критическую роль в репрессии транскрипции [18–20]. Детальные механизмы активации HDAC4/5 экспрессии Е3-лигаз предстоит только исследовать, но Moresi и соавт. (2010) обнаружили, что в скелетных мышцах мышей, лишенных HDAC4/5, резко снижена экспрессия MuRF1 и atrogin-1/MAFbx [21]. Интересно, что в нашем эксперименте уровень мРНК Е3-лигаз (MuRF1 и atrogin-1/MAFbx) в группе HS был существенно выше, чем в контрольной группе (рис. 3). Однако содержание транскриптов atrogin-1/MAFbx в группе HST, не отличалось существенно от контрольного уровня (рис. 3б), тогда как содержание MuRF1 в m. soleus крыс этой группы было существенно увеличено, как и в группе HS (p < 0.05). Итак, ингибирование HDAC4 и 5 в m. soleus in vivo в группах с вывешиванием привело к отсутствию повышения экспрессии только atrogin-1/MAFbx, но не MuRF1. Ранее показано, что сигнальный путь HDAC4-миогенин может участвовать в увеличении экспрессии Е3-лигаз MuRF1 и atrogin-1/MAFbx при денервации мышц животных с различными генными модификациями [21–23]. Мы впервые обнаружили, что при трехдневной разгрузке m. soleus ингибирование HDAC4/5 играет существенную роль в регуляции экспрессии Е3-лигазы atrogin-1/ MAFbx, но не MuRF1. Однако результаты определения экспрессии Е3-лигаз при денервации животных с генной модификацией и при вывешивании несколько различаются. Показано, что при денервации HDAC4/5 контролируют экспрессию обеих Е3-лигаз, тогда как при вывешивании в большей степени – atrogin-1/MAFbx. Миогенин – мышечно-специфический транскрипционный фактор, вовлеченный в координацию множества функций. Повышение экспрессии миогенина наблюдается и при длительной иммобилизации конечности [16]. Moresi и соавт. обнаружили, что у мышей, лишенных HDAC4/5, экспрессия миогенина не повышается при денервации m. soleus [21]. В свою очередь, у мышей с нокаутом гена MuRF1 экспрессия HDAC4 и миогенина снижалась при денервации мышцы [23]. С этими результатами согласуется полученное нами существенное повышение уровня миогенина только в группе животных в вывешиванием без ингибитора (HS, рис. 4). Ранее показали, что миогенин способен прямо взаимодействовать с промоторами генов MuRF1 и atrogin-1/MAFbx и индуцировать экспрессию их генов [21, 22]. Однако в группе животных, которым вводили ингибитор HDAC4/5, уровень миогенина был таким же, как в контрольной группе (p < 0.05), а экспрессия Е3-лигазы MuRF1 в ней была высокой. Можно заключить, что ингибирование HDAC4/5 влияет на экспрессию миогенина у крыс при вывешивании, и миогенин, по-видимому, контролирует экспрессию atrogin-1/MAFbx. Можно предположить, что в нашем случае миогенин, вероятно, не играет заметной роли в контроле экспрессии гена MuRF1 (рис. 3а, 4). В работе [23] обращается внимание на то, что экспрессия MuRF1 может регулироваться несколькими сигнальными путями, а не только HDAC4/5-миогенин. Например, PI3K/Akt/mTORC1/FOXO. Сообщается также, что транскрипционный фактор FOXO3 может взаимодействовать как с промотором гена atrogin-1/ MAFbx [24–26], так и с промотором гена MuRF1 [26] и активировать их экспрессию. Опубликована схема, показывающая как с помощью HDAC класса IIa возможно осуществлять деацетилирование и активацию FOXO [27]. Для проверки возможного влияния FOXO3a на экспрессию Е3-лигаз мы определили также уровень его фосфорилирования, и обнаружили существенное его снижение только в группе HS относительно контроля (–42%, p < 0.05), но не в группе HST (–14%). Итак, мы видим, что HDAC4/5 контролируют уровень миогенина и P-FOXO3a у крыс, подвергнутых трехдневной разгрузке. В свою очередь, контролировать экспрессию atrogin-1/MAFbx при трехдневной разгрузке могли как миогенин, так и FOXO3a. Идентификация транскрипционных факторов, способствующих увеличению экспрессии MuRF1 в группе HST, требует дальнейшего исследования. Известно, что ингибирование Akt способствует проникновению FOXO в ядро, стимуляции экспрессии MuRF1 и развитию атрофии мышц [28]. Фосфорилирование FOXO3a мешает этому процессу [2, 3]. Уровень pAkt у крыс обеих групп с вывешиванием был статистически значимо ниже, чем в контроле (на 69% в группе HS и 65% в HST, p <0.05), что в нашем случае свидетельствует о регуляции фосфорилирования FOXO3a несигнальным каскадом PI3K/Akt/mTORC1. Известна также возможность прямого фосфорилирования FOXO3 с помощью AMPK [29]. Вероятно, экспрессию двух основных Е3-лигаз запускают транскрипционные факторы, активируемые разными сигнальными каскадами.
Рис. 3.
Изменение экспрессии мРНК MuRF1 (а) и MAFbx (б) при введении трихостатина на фоне 3-суточной разгрузки m. soleus крысы. В качестве референсных генов использованы GAPDH и β-актин. С – контроль, HS – вывешивание, HST – вывешивание с введением трихостатина. * – Статистически значимое отличие от контроля, p < 0.05.
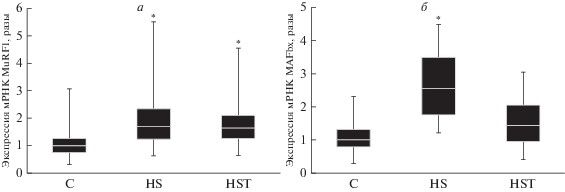
Рис. 4.
Изменение относительного содержания миогенина при введении трихостатина на фоне 3-суточной функциональной разгрузки m. soleus крысы. С – контроль, HS – вывешивание, HST – вывешивание с введением трихостатина. * – Статистически значимое отличие от контроля, p < 0.01; # – Статистически значимое отличие от вывешивания, p < 0.01.
Таким образом, в работе показано, что ингибирование HDAC4/5 предотвращает увеличение экспрессии миогенина и atrogin-1/MAFbx, а также снижение фосфорилирования FOXO3a, которые происходят при трехдневной функциональной разгрузке мышц. Ингибирование HDAC4/5 не влияет на регуляцию экспрессии Е3-лигазы MuRF1.
Работа выполнена на средства РНФ № 18-15-00062.
Список литературы
Glass D.J. 2001. Identification of ubiquitin ligases required for skeletal muscle atrophy. Science. 294 (5547), 1704–1708.
Brocca L., Toniolo L., Reggiani C., Bottinelli R., Sandri M., Pellegrino M.A. 2017. FoxO-dependent atrogenes vary among catabolic conditions and play a key role in muscle atrophy induced by hindlimb suspension. J. Physiol. 595 (4), 1143–1158
Khalil R. 2018. Ubiquitin-proteasome pathway and muscle atrophy. Adv. Exp. Med. Biol. 1088, 235–248.
Belova S.P., Shenkman B.S., Kostrominova T.Y., Nemirovskaya T.L. 2017. Paradoxical effect of IKKβ inhibition on the expression of E3 ubiquitin ligases and unloading-induced skeletal muscle atrophy. Physiol. Rep. 5 (16), e13291
Lomonosova Y.N., Shenkman B.S., Nemirovskaya T.L. 2012. Attenuation of unloading-induced rat soleus atrophy with the heat-shock protein inducer 17-(allylamino)-17-demethoxygeldanamycin. FASEB J. 26 (10), 4295–4301.
Senf S.M., Sandesara P.B., Reed S.A., Judge A.R. 2011. p300 Acetyltransferase activity differentially regulates the localization and activity of the FOXO homologues in skeletal muscle. Am. J. Physiol. Cell. Physiol. 300, C1490–1501.
Du Bois P., Pablo Tortola C., Lodka D., Kny M., Schmidt F., Song K., Schmidt S., Bassel-Duby R., Olson EN., Fielitz J. 2015. Angiotensin II induces skeletal muscle atrophy by activating TFEB-mediated MuRF1 expression. Circ Res. 117 (5), 424–436.
Walsha M.E.,Van Remmen H. 2016. Emerging roles for histone deacetylases in age-related muscle atrophy. Nutrition Healthy Aging. 4 (1), 17–30
Dupré-Aucouturier S., Castells J., Freyssenet D., Desplanches D. 2015. Trichostatin A, a histone deacetylase inhibitor, modulates unloaded-induced skeletal muscle atrophy. J. Appl. Physiol. 119 (4), 342–351.
Novikov V.E., Ilyin E.A. 1981. Age-related reactions of rat bones to their unloading. Aviat. Space Environ. Med. 52 (9), 551–553.
Morey-Holton E., Globus R. 2002. Hindlimb unloading rodent model: technical aspects. J. Appl. Physiol. 92, 1367–1377
Kachaeva E.V., Shenkman B.S. 2012. Various jobs of proteolytic enzymes in skeletal muscle during unloading: facts and speculations. J. Biomed. Biotechnol. 2012, 1–15.
Bodine S.C., Latres E., Baumhueter S., Lai V.K., Nunez L., Clarke B.A., Poueymirou W.T., Panaro F.J., Na E., Dharmarajan K., Pan Z.Q., Valenzuela D.M., DeChiara T.M., Stitt T.N., Yancopoulos G.D., Glass D.J. 2001. Identification of ubiquitin ligases required for skeletal muscle atrophy. Identification of ubiquitin ligases required for skeletal muscle atrophy. Science. 294 (5547), 1704–1708.
Bertaggia E., Coletto L., Sandri M. 2012. Posttranslational modifications control FoxO3 activity during denervation. Am. J. Physiol. Cell. Physiol. 302, 587–596.
Marek L., Hamacher A., Hansen F.K., Kuna K., Gohlke H., Kassack M.U., Kurz T. 2013. Histone deacetylase (HDAC) inhibitors with a novel connecting unit linker region reveal a selectivity profile for HDAC4 and HDAC5 with improved activity against chemoresistant cancer cells. J. Med. Chem. 56 (2), 427–436.
Yoshihara T., Machida S., Kurosaka Y., Kakigi R., Sugiura T., Naito H. 2016. Immobilization induces nuclear accumulation of HDAC4 in rat skeletal muscle. J. Physiol. Sci. 66 (4), 337–343.
Kirsh O., Seeler J.S., Pichler A., Gast A., Muller S., Miska E., Mathieu M., Harel-Bellan A, Kouzarides T., Melchior F., Dejean A. 2002. The SUMO E3 ligase RanBP2 promotes modification of the HDAC4 deacetylase. EMBO J. 21 (11), 2682–2691.
Kuo M.H., Allis C.D. 1998. Roles of histone acetyltransferases and deacetylases in gene regulation. BioEssays. 20, 615–626.
Miska E.A., Karlsson C., Langley E., Nielsen S.J., Pines J., Kouzarides T. 1999. HDAC4 deacetylase associates with and represses the MEF2 transcription factor. EMBO J. 18, 5099–5107.
McKinsey T.A., Zhang C.L., Lu J., Olson E.N. 2000. Signal-dependent nuclear export of a histone deacetylase regulates muscle differentiation. Nature. 408, 106–111.
Moresi V., Williams A.H., Meadows E., Flynn J.M., Potthoff M.J., McAnally J., Shelton J.M., Backs J., Klein W.H., Richardson J.A., Bassel-Duby R., Olson E.N. 2010. Myogenin and class II HDACs control neurogenic muscle atrophy by inducing E3 ubiquitin ligases. Cell. 143 (1), 35–45.
Bricceno K.V., Sampognaro P.J., Van Meerbeke J.P., Sumner C.J., Fischbeck K.H., Burnett B.G. 2012. Histone deacetylase inhibition suppresses myogenin-dependent atrogene activation in spinal muscular atrophy mice. Hum. Mol. Genet. 21 (20), 4448–4459.
Furlow J.D., Watson M.L., Waddell D.S., Neff E.S., Baehr L.M., Ross A.P., Bodine S.C. 2013. Altered gene expression patterns in muscle ring finger 1 null mice during denervation- and dexamethasone-induced muscle atrophy. Physiol. Genomics. 45 (23), 1168–1185.
Sandri M., Sandri C., Gilbert A., Skurk C., Calabria E., Picard A., Walsh K., Schiaffino S., Lecker S.H., Goldberg A.L. 2004. Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy. Cell. 117, 399–412.
Clavel S., Siffroi-Fernandez S., Coldefy A.S., Boulukos K., Pisani D.F., Dérijard B. 2010. Regulation of the intracellular localization of Foxo3a by stress-activated protein kinase signaling pathways in skeletal muscle cells. Mol. Cell Biol. 30 (2), 470–480.
Bodine S.C., Baehr L.M. 2014. Skeletal muscle atrophy and the E3 ubiquitin ligases MuRF1 and MAFbx/atrogin-1. Am. J. Physiol. Endocrinol. Metab. 307 (6), 469–484.
Mihaylova M.M., Vasquez D.S., Ravnskjaer K., Denechaud P.D., Yu R.T., Alvarez J.G., Downes M., Evans R.M., Montminy M., Shaw R.J. 2011. Class IIa histone deacetylases are hormone-activated regulators of FOXO and mammalian glucose homeostasis. Cell. 145, 607–621.
Kuo T., Lew M.J., Mayba O., Harris C.A., Speed T.P., Wang J.C. 2012. Genomewide analysis of glucocorticoid receptor-binding sites in myotubes identifies gene networks modulating insulin signaling. Proc. Natl. Acad. Sci. USA. 109, 11160–11165.
Greer E.L., Oskoui P.R., Banko M.R., Maniar J.M., Gygi M.P., Gygi S.P., Brunet A. 2007. The energy sensor amp-activated protein kinase directly regulates the mammalian FOXO3 transcription factor. J. Biol. Chem. 282, 30 107–30 119.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


