Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 1, стр. 69-75
Снижение токсичности цисплатина путем его конъюгации с арабиногалактаном
Т. Н. Замай a, *, А. К. Старков b, О. С. Коловская a, c, А. С. Кичкайло a, c, Е. В. Инжеваткин c, Г. С. Замай a, c, Н. М. Титова d, С. С. Замай c, Ю. С. Пац a
a Красноярский государственный медицинский университет
им. проф. В.Ф. Войно-Ясенецкого
660022 Красноярск, Россия
b Институт химии и химических технологий СО РАН
660036 Красноярск, Академгородок, Россия
c Федеральный исследовательский центр “Красноярский научный центр” СО РАН
660036
, Красноярск, Академгородок, Россия
d Сибирский федеральный университет
660041 Красноярск, Россия
* E-mail: tzamay@yandex.ru
Поступила в редакцию 12.04.2019
После доработки 11.06.2019
Принята к публикации 27.06.2019
Аннотация
Цисплатин – эффективный противоопухолевый препарат, используемый для терапии различных видов рака. Основным недостатком препарата является его высокая токсичность. Для снижения токсического эффекта цисплатина использовали его конъюгацию с арабиногалактаном, способным образовывать растворимые глобулы и связывать плохо растворимые фармакологические препараты путем встраивания их внутрь сфероидальной глобулы. В работе сравнивался биологический эффект и механизм действия цисплатина и его комплекса с арабиногалактаном (АГ-Pt) на рост асцитной карциномы Эрлиха in vivo. Показано, что конъюгаты арабиногалактана с цисплатином обладают хорошим противоопухолевым эффектом, несмотря на то, что доза цисплатина в составе конъюгатов была ниже в 10 раз по сравнению со стандартной дозой. При этом у конъюгатов арабиногалактана с цисплатином практически отсутствует токсический эффект. Установлено, что механизм противоопухолевого эффекта цисплатина и его конъюгатов с арабиногалактаном обусловлен индукцией апоптоза в опухолевых клетках. Предполагается, что снижение токсичности и увеличение эффективности конъюгатов цисплатина с арабиногалактаном по сравнению с чистым цисплатином связано с более эффективным его накоплением в опухолевых клетках.
ВВЕДЕНИЕ
Цисплатин – комплексное соединение двухвалентной платины, использующееся в онкологии в качестве эффективного противоопухолевого препарата [1, 2] для лечения различных видов рака. Цисплатин особенно эффективен для лечения заболевания на ранней стадии [3]. Однако применение этого препарата ограничено в силу его высокой токсичности, вызывающей нарушения функции почек, анафилактические реакции, лейкопению, тромбоцитопению, анемию и нейропатии, поскольку он не обладает специфичностью в отношении только опухолевых клеток и распределяется во всех биологических жидкостях и тканях организма равномерно [4].
Перспективным способом снижения токсичности и повышения биодоступности цисплатина является его модификация, в результате которой происходит диспергирование цисплатина в матрице арабиногалактана. Арабиногалактан – высокогидрофильный полисахарид, экстрагируемый из лиственницы сибирской, он легко биодеградирует и выводится из организма, имеет низкую полидисперсность и аккумулируется в опухолевых тканях, обладает гепатопротекторными, иммуномодулирующими и мембранотропными свойствами. Кроме того, в силу своих физико-химических свойств он способен образовывать растворимые глобулы и связывать плохо растворимые фармакологические препараты путем встраивания их внутрь сфероидальной глобулы. У цисплатина в составе конъюгатов с арабиногалактаном увеличивается время полураспада и повышается стабильность [5]. Выдвинуто предположение, что в комплексе с арабиногалактаном токсические эффекты цисплатина могут быть снижены при сохранении его противоопухолевых свойств.
В работе сравнивался биологический эффект цисплатина и его комплекса с арабиногалактаном (АГ-Pt) на рост асцитной карциномы Эрлиха in vivo и изучался механизм действия этих препаратов на опухолевые клетки.
МАТЕРИАЛЫ И МЕТОДЫ
Препарат, представляющий собой комплекс арабиногалактана с цисплатином, синтезирован по методике [6].
Исследования противоопухолевого эффекта комплекса проведены на мышах-самцах аутбредного стока ICR, полученных из питомника ГНЦ ВБ “ВЕКТОР” (п. Кольцово Новосибирской обл.), массой 27–35 г с внутрибрюшинно трансплантированной асцитной карциномой Эрлиха (3 млн клеток). Противоопухолевую терапию проводили цисплатином и комплексом арабиногалактана с цисплатином (АГ-Pt), доля цисплатина в котором составляла 10% [6]. Введение препаратов проводили на 3, 5, 7, 9 и 11-е сутки развития опухоли. Мышам первой группы (контроль) вводили по 200 мкл физиологического раствора и 200 мкл 5% раствора глюкозы. Мышам второй группы вводили раствор цисплатина в дозе 20 мг/кг и равный объем 5% раствора глюкозы, мышам третьей группы – комплекс арабиногалактана с цисплатином (АГ-Pt) в дозе 20 мг/кг и равный объем 5% раствора глюкозы.
Асцитные клетки выделяли у мышей на 5, 9 и 13-е сутки развития опухоли. Количество изолированных из брюшной полости асцитных клеток подсчитывали в камере Горяева. Содержание ионов водорода в асцитных клетках определяли с помощью флуоресцеинизотиоцианата (ФИ) [7]. Микровязкость липидного бислоя мембран асцитных клеток оценивали с помощью метода, основанного на образовании эксимеров (возбужденных димеров) пирена [8]. Все измерения проводили на спектрофлуориметре Aminco Bowman Series 2, Thermo Spectronic (USA) при 25°С. Содержание апоптотических и некротических клеток определяли методом флуоресцентной микроскопии [9].
Статистическую обработку данных проводили с помощью программы STATISTICA 7.0. Проверку гипотезы о статистической достоверности различий выборок проводили с помощью непараметрического критерия Манна–Уитни. Статистически значимыми считали различия при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Цисплатин представляет собой эффективный противоопухолевый препарат, недостатком которого является его токсический эффект. В наших исследованиях терапия асцитной карциномы Эрлиха цисплатином в течение 2 недель привела к гибели 3 животных из 15. При лечении комплексом цисплатина с арабиногалактаном (АГ-Pt) такого эффекта не наблюдалось. Масса животных (без опухоли) к концу эксперимента во всех группах была приблизительно одинаковой (контроль – 25.5 ± 2.1 г; в группе животных с введением цисплатина – 28.5 ± 4.0 г; в группе животных с введением комплекса (АГ-Pt) – 25.2 ± 2.3 г).
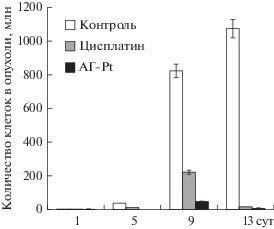
Исследование противоопухолевого эффекта препаратов показало, что к 13-м сутки развития опухоли число асцитных клеток в карциноме в группе животных, которым вводили цисплатин и комплекс (АГ-Pt), оказалось гораздо ниже, чем в контроле. При этом выяснилось, что комплекс (АГ-Pt) обладал более выраженной способностью подавлять рост асцитной карциномы Эрлиха, чем чистый цисплатин (рис. 1).
Рис. 1.
Динамика развития опухоли в условиях противоопухолевой терапии. 5-е сут (контроль, n = 14; терапия цисплатином, n = 14; терапия комплексом (АГ-Pt), n = 15), 9-е сут (контроль, n = 12; терапия цисплатином, n = 15; терапия комплексом (АГ-Pt), n = 13), 13-е сут (контроль, n = 14; терапия цисплатином, n = 10; терапия комплексом (АГ-Pt), n = 10).
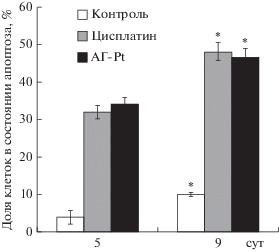
Известно, что цисплатин проявляет свой противоопухолевый эффект, индуцируя в опухолевых клетках апоптоз и подавляя пролиферацию [3, 4]. Для определения пути гибели асцитных клеток при терапии комплексом (АГ-Pt) оценивали долю асцитных клеток в состоянии апоптоза и некроза. Исследования качественного состава клеточной популяции в карциноме Эрлиха в условиях подавления ее роста цисплатином и производным арабиногалактана (АГ-Pt) показало, что на 5-е сутки под влиянием цисплатина и комплекса (АГ-Pt) количество апоптотических клеток увеличилось в несколько раз, а на 9-е сутки доля асцитных клеток в состоянии апоптоза увеличилась в еще большей степени (рис. 2). При этом доля клеток в состоянии некроза существенно не изменилась. Таким образом, механизмы действия цисплатина и его комплекса с арабиноглактаном оказались схожими.
Рис. 2.
Доля апоптотических клеток в опухоли в процессе развития опухоли. 5-е сут (контроль, n = 15; терапия цисплатином, n = 15; терапия комплексом (АГ-Pt), n = 15), 9-е сут (контроль, n = 15; терапия цисплатином, n = 13; терапия комплексом (АГ-Pt), n = 13.
Одним из факторов, индуцирующих апоптоз опухолевых клеток под влиянием цисплатина, является окислительный стресс [3, 4]. Для выяснения механизма индукции апоптоза в наших исследованиях под влиянием цисплатина и его конъюгатов определяли физико-химические параметры асцитных клеток. Известно, что активные формы кислорода (АФК), содержание которых в условиях окислительного стресса увеличивается, вызывают перекисное окисление липидов, приводящее к увеличению микровязкости биологических мембран. Следовательно, параметры микровязкости мембран могут служить одним из показателей уровня окислительного стресса. В наших исследованиях вязкость мембран оценивалась по параметрам относительной микровязкости в зоне липидного бислоя. Результаты исследований показали, что микровязкость в зоне липидного бислоя в асцитных клетках контрольной группы животных, начиная с 9-х по 13-е сутки развития опухоли, снижалась (текучесть мембраны увеличивалась) (табл. 1), а в условиях терапии цисплатином и комплексом (АГ-Pt) оставалась на прежнем уровне. Следовательно, можно предположить, что развитие окислительного стресса в опухолевых клетках под влиянием противоопухолевых препаратов не было настолько значительным, чтобы вызвать физико-химические изменения в мембранах. Повышение текучести мембран в асцитных клетках контрольной группы свидетельствовало, скорее всего, о том, что асцитные клетки в этот период находились в состоянии повышенной пролиферативной активности, что подтверждается высокой скоростью роста асцитной карциномы в этот период (рис. 1).
Таблица 1.
Влияние цисплатина и комплекса (АГ-Pt) на относительную микровязкость (Jэ/Jм, отн. ед.) липидного бислоя в асцитных клетках карциномы Эрлиха в процессе ее развития
| Экспериментальная модель | Продолжительность роста опухоли, сут | ||
|---|---|---|---|
| 5 | 9 | 13 | |
| Контроль | 0.35 ± 0.03 (n = 14) |
0.35 ± 0.02 (n = 12) |
0.93 ± 0.08* (n = 14) |
| Терапия цисплатином | 0.34 ± 0.02 (n = 14) |
0.37 ± 0.03 (n = 15) |
0.35 ± 0.02 (n = 10) |
| Терапия АГ-Pt | 0.33 ± 0.01 (n = 15) |
0.36 ± 0.02 (n = 13) |
0.38 ± 0.02 (n = 10) |
Общим свойством всех трансформированных клеток, кроме генетической вариабельности, является увеличение в них рН, которое всегда сопровождает активный рост опухоли [10] и неопластическую трансформацию [11]. Причиной увеличения рН в опухолевых клетках считается активация Na+/H+-обменника плазматической мембраны, выводящего H+ из клетки [12]. Причем индукция Na+/H+-обмена, реализуемая под влиянием различных факторов, происходит одинаково и всегда ведет к повышению pH [13]. Такое внутриклеточное увеличение pH – ключевое событие в онкогенной трансформации и необходимо для развития и поддержания опухолевого фенотипа [14].
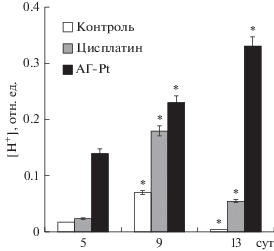
Апоптоз, наоборот, сопровождается повышением в клетке уровня ионов водорода [15]. Поэтому для определения механизма стимуляции процессов апоптоза под влиянием противоопухолевых препаратов цисплатина и его комплекса (АГ-Pt) исследовали содержание ионов водорода в асцитных клетках. Результаты исследований показали, что увеличение в асцитных клетках содержания ионов водорода сопровождалось повышением доли клеток в состоянии апоптоза. Так, уровень ионов водорода в асцитных клетках в условиях терапии комплексом (АГ-Pt) в процессе роста опухоли постепенно повышался (рис. 3), что, по-видимому, и стало одной из причин подавления роста асцитной карциномы. В группе мышей, которым вводили цисплатин, уровень ионов водорода относительно контроля на протяжении всего роста опухоли был выше. В асцитных клетках контрольной группы, которым не проводили терапию, уровень ионов водорода на протяжении всего роста опухоли был сниженным, что являлось, по-видимому, одним из факторов стимуляции роста опухоли.
Рис. 3.
Изменение содержания ионов водорода в асцитных клетках в процессе развития опухоли. 5-е сут (контроль, n = 15; терапия цисплатином, n = 15; терапия комплексом (АГ-Pt), n = 15), 9-е сут (контроль, n = 15; терапия цисплатином, n = 13; терапия комплексом (АГ-Pt), n = 13), 13-е сут (контроль, n = 15; терапия цисплатином, n = 13; терапия комплексом (АГ-Pt), n = 13).
Таким образом, исследования показали, что цисплатин и его комплекс с арабиногалактаном обладают хорошо выраженным противоопухолевым эффектом. Механизм противоопухолевого эффекта этих препаратов заключается в стимуляции в опухолевых клетках процессов апоптоза. Можно предположить, что различия в степени токсичности этих препаратов обусловлены тем, что цисплатин попадает не только в опухоль, но и в здоровые органы и ткани, чем вызывает гибель нормальных клеток. Цисплатин в составе конъюгатов с арабиногалактаном входит более адресно, в клетки с асиалогликопротеиновыми рецепторами, в основном, в опухолевые клетки и гепатоциты.
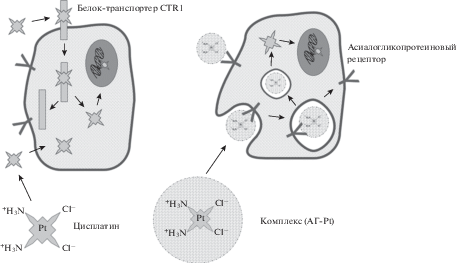
Основная часть свободного цисплатина при попадании в кровь сразу связывается с белками плазмы крови (альбумином и трансферином), в результате чего этот препарат инактивируется и не попадает в опухолевую ткань. Несвязавшийся с белками плазмы крови цисплатин может поступать в клетки двумя путями: 1) путем простой диффузии и 2) с помощью АТР-зависимого белка-транспортера CTR1 [15] (рис. 4). Очевидно, что для снижения токсичности цисплатина необходимо уменьшить его связывание с белками плазмы и увеличить его накопление в опухолевой ткани, т.е. осуществить его адресную доставку.
Поиск компонентов для создания систем адресной доставки – сложная задача, поскольку все составляющие элементы системы адресной доставки должны быть биоразлагаемыми, нетоксичными, ограничивать взаимодействие лекарственного препарата со здоровыми тканями, адресно доставлять его в опухолевые ткани и переносить в опухолевые клетки. В качестве таких компонентов обычно используют искусственные и натуральные полимеры. Арабиногалактан в отличие от других полимеров однороден, имеет низкую молекулярную массу, хорошо растворяется в воде и способен образовывать конъюгаты с лекарственными препаратами, увеличивая их эффективность. Арабиногалактан можно использовать для доставки диагностических и терапевтических средств к тем клеткам, которые имеют на своей поверхности асиалогликопротеиновые рецепторы, лигандом для которых являются углеводы. Связывание углеводов с рецепторами индуцирует эндоцитоз, в результате которого лекарственный препарат оказывается внутри клетки. Эффективность использования арабиногалактана для адресной доставки обусловлена его способностью к рецептор-опосредованному эндоцитозу (рис. 4). Таким образом, эффективность доставки цисплатина в опухолевые клетки в составе его конъюгата с арабиногалактаном становится существенно выше. По-видимому, этим и объясняется более низкий токсический эффект комплекса (АГ-Pt) по сравнению с чистым цисплатином.
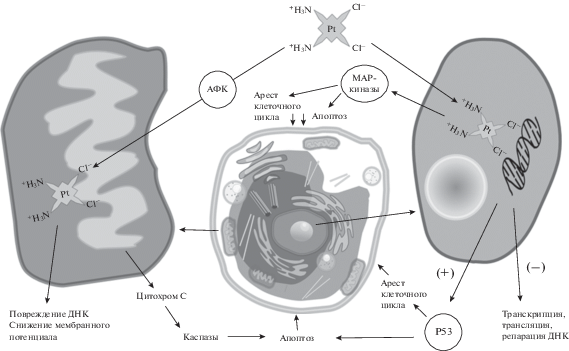
В клетке цисплатин связывается с белками цитоскелета, РНК, пептидами и белками. Основной мишенью для проявления цисплатином противоопухолевого эффекта является ДНК (рис. 5). Однако только около 1% цисплатина, входящего в клетки, связывается с ДНК [16]. ДНК-аддукты цисплатина ингибируют репликацию и/или транскрипцию и активируют несколько сигнальных путей, вызывающих апоптоз [17]. Под влиянием цисплатина активируются проапоптотические гены PUMA, индуцирующие р53-зависимый путь апоптоза [18]; каспазы [19]; белок, активирующий р53 (PIDD) [20]; семейство MAP-киназ [6]. Активация этих белков вызывает апоптоз клеток. Кроме того, цисплатин нарушает процессы репарации ДНК, ингибируя: 1) белки эксцизионной репарации нуклеотидов (NER), 2) белки репарации ошибочно спаренных нуклеотидов (MMR) и 3) ДНК-зависимую протеинкиназу.
Другим механизмом действия цисплатина является вызываемый им окислительный стресс, приводящий к увеличению уровня активных форм кислорода (АФК) и гидроксил-радикалов [21]. Увеличение уровня АФК активирует проапоптотические белки Bak1 и потенциал-зависимый анионный канал (VDAC1) [22]. Цисплатин снижает содержание восстановленного глутатиона GSH, ведет к окислению SH-групп в митохондриальных белках, что обуславливает вход кальция в митохондрии и, как следствие, падение митохондриального мембранного потенциала [23], вызывает высвобождение цитохрома С из митохондрий, активирующего образование комплекса (Apaf-1) и каспаз 9 и 3 [24]. Кроме того, цисплатин повреждает митохондриальную ДНК [25], тем самым способствуя снижению энергообмена клетки в целом. Через фосфорилирование киназ Chk1 и Chk2 цисплатин вызывает остановку клеточного цикла в фазе G2 [26].
В работе исследован механизм действия нового противоопухолевого препарата на основе цисплатина. Показано, что оба препарата – цисплатин и его комплекс с арабиногалактаном обладают ярко выраженным противоопухолевым эффектом, однако противоопухолевый эффект комплекса арабиногалактана с цисплатином выше, а токсичность по сравнению со стандартным препаратом цисплатином ниже, в то время как механизм действия обоих препаратов в целом схож. Таким образом, в работе был представлен новый перспективный противоопухолевый препарат на основе стандартного препарата цисплатина, обладающего большей эффективностью и меньшей токсичностью.
Список литературы
Смышляева Е.А, Колпакова Н.А. 2004. Способность цисплатина поглощаться опухолями и тканями. Современные наукоемкие технологии. 3, 90–91.
Go R., Adjeri A. 1999. Review of the comparative pharmacology and clinical activity of cisplatin and carboplatinю. J. Clin. Oncol. 17, 409–415.
Wang D., Lippard S.J. 2005. Cellular processing of platinum anticancer drugs. Nature Reviews. 4, 307–320.
Dasari S., Tchounwou P.B. 2014. Cisplatin in cancer therapy: Molecular mechanisms of action. Eur. J. Pharmacol. 5, 364–378.
Pinhassi R.I., Assaraf Y.G., Farber S., Stark M., Ickowicz D., Drori S., Domb A.J., Livney Y.D. 2010. Arabinogalactan-folic acid-drug conjugate for targeted delivery and target-activated release of anticancer drugs to folate receptor-overexpressing cells. Biomacromolecules. 11, 294–303.
Старков А.К., Когай Б.Е. Способ получения Pt-производного арабиногалактана. Патент РФ № 2 406 508 от 20 декабря 2010.
Gore M.G. 2000. Spectrophotometry and spectrofluorimetry. Practical Approach. New York: Oxford University Press Inc. 368 p.
Бордюшков Ю.Н., Горошинская И.А., Фран-циянц Е.М., Ткачева Г.Н., Горло Е.И., Нескубина И.В. 2000. Структурно-функциональные свойства мембран лимфоцитов и эритроцитов под воздействием переменного магнитного поля. Вопросы мед. химии. 1, 72–80.
Izumov D.S., Avetisyan A.V., Pletjushkina O.Yu. 2004. “Wages of Fear”: transient threefold decrease in intracellular ATP level imposes apoptosis. Biochim. Biophys.Acta. 1658, 141–147.
Shrode L.D., Tapper H., Grinstein S. 1997. Role of intracellular pH in proliferation, transformation, and apoptosis. J. Bioenerg. Biomembr. 29 (4), 393–399.
Reshkin S.J., Bellizzi A., Caldeira S., Albarani V., Malanchi I., Poignee M., Alunni-Fabbroni M., Casavola V., Tommasino M. 2000. Na+/H+ exchanger-dependent intracellular alkalinization is an early event in malignant transformation and plays an essential role in the development of subsequent transformation-associated phenotypes. FASEB J. 14, 2185–2197.
Noel J., Pouyssegur J. 1995. Hormonal regulation, pharmacology, and membrane sorting of vertebrate Na+/H+ exchanger isoforms. Am. J. Physiol. 268, 283–296.
Gillies R.J., Martinez-Zaguilan R., Martinez G.M., Serrano R., Perona R. 1990. Tumorigenic 3T3 cells maintain an alkaline intracellular pH under physiological conditions. Proc. Natl. Acad. Sci. USA. 87, 7414–7418.
Harguindey S., Orive G., Pedraz J.L., Paradiso A., Reshkin S.J. 2005. The role of pH dynamics and the Na+/H+ antiporter in the etiopatogenesis and treatment of cancer. Two faces of the same coin – one single nature. Biochim. Biophys. Acta. 1756, 1–24.
Yang Z.Z., Zou A.P. 2003. Homocysteine enhances TIMP-1 expression and cell proliferation associated with NADH oxidase in rat mesangial cells. Kidney Int. 3, 1012–1020.
Fuertes M.A., Alonso C., Pérez J.M. 2003. Biochemical modulation of Cisplatin mechanisms of action: enhancement of antitumor activity and circumvention of drug resistance. Chem. Rev. 103, 645−662.
Yen H.C., Tang Y.C., Chen F.Y., Chen S.W., Majima H.J. 2005. Enhancement of cisplatin-induced apoptosis and caspase 3 activation by depletion of mitochondrial DNA in a human osteosarcoma cell line. Ann. N. Y. Acad. Sci. 1042, 516−522.
Jeffers J.R., Parganas E., Lee Y. 2003. Puma is an essential mediator of p53-dependent and -independent apoptosis pathways. Cancer Cell. 4, 321−328.
Salvesen G.S., Dixit V.M. 1997. Caspases: Intracellular signaling by proteolysis. Cell. 91, 443−446.
Lin Y., Ma W., Benchimol S. 2000. Pidd, a new death-domaincontaining protein, is induced by p53 and promotes apoptosis. Nat Genet. 26, 122−127.
Masuda H., Tanaka T., Takahama U. 1994. Cisplatin generates superoxide anion by interaction with DNA in a cell-free system. Biochem. Biophys. Res. Commun. 203, 1175−1180.
Sharaf el dein O., Gallerne C., Brenner C., Lemaire C. 2012. Increased expression of VDAC1 sensitizes carcinoma cells to apoptosis induced by DNA cross-linking agents. Biochem. Pharmacol. 83, 1172−1182.
Saad S.Y., Najjar T.A., Alashari M. 2004. Role of non-selective adenosine receptor blockade and phosphodiesterase inhibition in cisplatin-induced nephrogonadal toxicity in rats. Clin. Exp. Pharmacol. Physiol. 31, 862−867.
Petrovic M., Todorovic D. 2014. Apoptosis and cell cycle. Racionalna terapija. 6, 21−32.
Kohno K., Wang K.Y., Takahashi M. 2015. Mitochondrial transcription factor A and mitochondrial genome as molecular targets for cisplatin-based cancer chemotherapy. Int. J. Mol. Sci. 16, 19836−19850.
Jamieson E.R., Lippard S.J. 1999. Structure, recognition and processing of cisplatin-DNA adducts. Chem. Rev. 99, 2467−2498.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии