Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 1, стр. 45-52
Изменение конформации резистентной и чувствительной к кардиотоническим стероидам α1-Na+,K+-ATP-азы из почек при связывании уабаина, дигоксина и маринобуфагенина
А. М. Тверской a, В. А. Локтева b, С. Н. Орлов a, c, d, О. Д. Лопина a, *
a Московский государственный университет им. М.В. Ломоносова,
биологический факультет
119234 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова,
физический факультет
119234 Москва, Россия
c Национальный исследовательский Томский государственный университет
634050
, Томск, Россия
d Сибирский государственный медицинский университет
634050 Томск, Россия
* E-mail: od_lopina@mail.ru
Поступила в редакцию 11.04.2019
После доработки 17.05.2019
Принята к публикации 28.05.2019
Аннотация
Известно, что сродство α1-субъединицы Na+,K+-ATP-азы к кардиотоническим стероидам (КТС) у грызунов примерно в 1000 раз меньше, чем у других млекопитающих. В клетках грызунов экспрессируется α1-резистентная (α1R) к действию КТС изоформа Na+,K+-ATP-азы, в то время как в клетках других млекопитающих – α1-чувствительная (sensitive) (α1S) изоформа. Ранее установлено, что добавление уабаина в концентрациях, полностью ингибирующих α1-изоформу Na+,K+-ATP-азы, приводит к смерти эндотелиальных и гладкомышечных клеток человека (α1S-Na+,K+-ATP-аза), но не крысы (α1R-Na+,K+-ATP-аза). Ключевую роль в процессе выживания и смерти клеток играют конформационные переходы, которые происходят при связывании КТС с ферментом. В данной работе был проведен анализ продуктов трипсинолиза α1-субъединицы в двух основных конформациях Na+,K+-ATP-азы (Е1 и Е2-P) для доказательства существования различий в конформации α1R- и α1S-субъединиц Na+,K+-ATP-азы, которые индуцируются связыванием трех КТС: двух карденолидов (уабаин, дигоксин) и одного буфадиенолида (маринобуфагенин). Обработка трипсином α1S-Na+,K+-ATP-азы из почек свиньи в конформации Е1 приводит к существенному снижению количества α1S-субъединицы, появлению фрагментов с молекулярной массой 40, 35, 23 и 19 кДа. При преинкубации этого фермента с 1 мМ уабаина и дигоксина также наблюдается снижение количества α1S-субъединицы, увеличение количества полипептидного фрагмента с молекулярной массой около 40 кДа и существенное возрастание количества белка с молекулярной массой 35.5 кДа, который не обнаруживается после преинкубации фермента с маринобуфагенином (1 мМ). В отсутствие КТС трипсинолиз α1S-Na+,K+-ATP-азы в конформации Е2-Р приводит к уменьшению количества α1-субъединицы, увеличению количества продуктов протеолиза с молекулярной массой 40 кДа и 35.5 кДа. Преинкубация фермента в этой конформации с любым из исследуемых КТС вызывает появление большого количества дополнительного фрагмента с молекулярной массой 45 кДа. Преинкубация α1R-Na+,K+-ATP-азы из почек крысы с любым из исследованных КТС не изменяет набора продуктов протеолиза и их молекулярной массы в случае пребывания фермента в обеих конформациях (Е1 и Е2-Р). Предполагается, что структура центра связывания КТС и конформационный ответ на их связывание с Na+,K+-ATP-азой в значительной степени определяются первичной структурой ее α1-субъединицы.
ВВЕДЕНИЕ
Na+,K+-ATP-аза – ATP-аза Р-типа, осуществляющая обмен трех ионов внутриклеточного натрия на два иона внеклеточного калия против электрохимического градиента. В состав фермента входят как минимум два типа субъединиц: каталитическая α- и регуляторная β-субъединица с молекулярными массами ~100 кДа и ~55–65 кДа соответственно. В ходе катализа фермент пребывает в двух основных конформациях (Е1 и Е2), которые обладают разным сродством к ионам натрия и калия. Для Е1-конформации характерно более высокое сродство к Na+, для Е2 – к K+. Процесс катализа сопряжен с переносом концевой фосфорильной группы ATP на консервативный остаток аспарагиновой кислоты активного центра фермента в конформации Е1 (с образованием Е1-Р) с последующим переходом в конформацию Е2-Р и дефосфорилированием фермента, индуцированным связыванием фермента с внеклеточным K+. Эти процессы сопряжены с переносом катионов через мембрану [1, 2].
Каталитическая α-субъединица Na+,K+-ATP-азы представлена четырьмя изоформами (α1–α4). α1-изоформа экспрессируется во всех типах клеток, экспрессия остальных изоформ тканеспецифична [3]. В почках млекопитающих обнаружена только α1-изоформа. Изоформы α-субъединицы различаются по сродству к АТР, ионам-активаторам и специфическому ингибитору – уабаину, принадлежащему к классу кардиотонических стероидов (КТС) [4]. В клетках грызунов экспрессируется резистентная к КТС α1-изоформа (α1R) Na+,K+-ATP-азы, сродство которой к этим ингибиторам снижено в 1000 раз по сравнению с α1-чувствительной (sensitive) изоформой Na+,K+-ATP-азы (α1S), обнаруженной в клетках других млекопитающих. Это различие обусловлено заменой в α1S-Na+,K+-ATP-азе двух аминокислотных остатков: глутамина и аспарагина в позициях 111 и 122 на остатки аргинина и аспарагиновой кислоты в α1R-Na+,K+-ATP-азе [5].
Среди КТС, в состав которых входит стероидное ядро и лактоновое кольцо в 17-м положении, выделяют две основных группы: карденолиды, которые содержат 5-ти членный лактон, и буфадиенолиды, содержащие 6-ти членный лактон. Большинство карденолидов в 3-м положении стероидного ядра содержат остатки сахаров, буфадиенолиды часто представляют собой агликоны [4]. Карденолиды в значительных количествах содержатся в растениях, тогда как буфадиенолиды – у земноводных (в основном в слизи тропических жаб). Недавно было обнаружено, что в небольших количествах КТС синтезируются в организмах млекопитающих, включая человека [6, 7].
КТС не только ингибируют Na+,K+-ATP-азу, но, связавшись с ферментом, индуцируют различные сигнальные пути за счет связывания с Na+,K+-ATP-азой белков-партнеров. Таким путем (независимо от ингибирования фермента) уабаин вызывает смерть эпителиальных клеток почек собаки (линия C7-MDCK) [8, 9]. Это сопровождается фосфорилированием р38 MAPK [8]. Однако у грызунов уабаин не вызывает смерти клеток в концентрациях, которые полностью подавляют активность Na+,K+-ATP-азы, при этом активируется другая MAPK - ERK½. Экспрессия в клетках грызунов только α1-чувствительной изоформы Na+,K+-ATP-азы приводит к смерти клеток под действием уабаина. Эти данные позволили предположить, что особенности в аминокислотной последовательности α1S- и α1R-изоформ Na+,K+-ATP-азы определяют различия в конформациях фермента и, соответственно, приводят к связыванию с ними различных белков, индуцируя в клетках грызунов и других млекопитающих различные сигнальные каскады, один из которых приводит к смерти клеток, а другой, напротив, к их выживанию [10]. До настоящего времени в литературе не описано различий в конформации α1S- и α1R-изоформ Na+,K+-ATP-азы при связывании с КТС.
Протеолиз является широко используемым методом анализа общей структуры и конформации белков. В случае Na+,K+-ATP-азы для этих целей часто используют трипсин, поскольку он расщепляет только α-субъединицу фермента, не затрагивая ее β-субъединицу [11]. Поэтому после обработки фермента трипсином обнаруживаются только пептидные фрагменты α-субъединицы.
Классическая картина трипсинолиза α-субъединицы была описана Питером Йоргенсеном (Peter Jørgensen) [12]. В конформации Е1 трипсин осуществляет быстрый протеолиз пептидной связи перед Lys30 и более медленный перед Arg262. В результате происходит накопление большого протеолитического фрагмента с молекулярной массой около 77 кДа и минорных фрагментов. При трипсинолизе α-субъединицы Na+,K+-ATP-азы в конформации E2 трипсин обеспечивает накопление полипептидов с молекулярной массой 58 и 41 кДа. При длительном протеолизе (30–60 мин) обеих конформаций фермента наблюдается накопление фрагментов с молекулярной массой 44, 37, 23 и 15 кДа [13–15]. Эти эксперименты были проведены на препаратах Na+,K+-ATP-азы из почек кролика, собаки и свиньи при соотношении трипсин/Na+,K+-ATP-аза = 1/25 или 1/20.
Цель настоящей работы заключается в доказательстве существования различий в конформации чувствительной и резистентной α1R- и α1S-Na+,K+-ATP-азы, которые индуцируются связыванием трех КТС: двух кардиенолидов (уабаин, дигоксин) и одного буфадиенолида (маринобуфагенин). В качестве метода исследования мы использовали ограниченный протеолиз α1-субъединицы Na+,K+-ATP-азы, поскольку известно, что изменение конформации может сопровождаться экспозицией или маскировкой участков протеолиза, доступных трипсину [13].
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы. Трипсин бычий и ингибитор трипсина из плодов сои были куплены у фирмы ПанЭко (Россия). Остальные реактивы были поставлены компанией Sigma (США), ThermoScientific (США), Bio-Rad (США).
Выделение фермента. Na+,K+-ATP-азу из наружного медуллярного слоя почек свиньи и почек крысы получали в соответствии с методами, описанными ранее [16, 17]. Конечный осадок ресуспендировали в растворе, содержащем 25 мМ имидазола (рН 7.5), 1 мМ EDTA, 0.25 М сахарозы, до концентрации белка 5–10 мг/мл, после чего суспензию разливали в пробирки по 20–50 мкл и хранили в замороженном состоянии при –80°С.
Определение концентрации белка. Концентрацию белка определяли по методу Лоури и соавторов [18]. Для растворения мембранных белков вместо воды добавляли 0.1% раствор дезоксихолата натрия. В качестве стандарта использовали коммерческий раствор бычьего сывороточного альбумина в концентрации 2 мг/мл (ThermoScientific, США).
Определение активности Na+,K+-ATP-азы. Активность Na+,K+-ATP-азы в полученных препаратах определяли по методу Ратбуна и Бетлах [19], измеряя накопление неорганического фосфата в среде следующего состава: 130 мМ NaCl, 20 мМ KCl, 3 мМ MgCl2, 3 мМ ATP, 30 мМ имидазола (рН 7.4). Концентрация белка составляла 1–5 мкг/мл. Реакцию начинали внесением АТР в пробу. Более подробно этот метод описан нами ранее [20].
Трипсинолиз. Трипсинолизу подвергали Na+,K+-ATP-азу из почек свиньи и почек крысы, которую предварительно переводили в Е1 или Е2-Р конформацию. Для этого фермент разводили в 20 раз в буфере А (Е1-конформация) или буфере Б (Е2-Р- конформация). Состав буфера А: 10 мМ NaCl, 30 мМ имидазола, 1 мМ EDTA (рН 7.4); состав буфера Б: 30 мМ имидазола, 1 мМ EDTA, 3 мМ MgCl2, 3 мМ Pi/Трис (рН 7.4). Далее фермент преинкубировали 10 мин при температуре 37°С с 1 мМ уабаина, дигоксина или маринобуфагенина. Трипсинолиз проводили в течение 5 или 10 мин при температуре 37°С. Соотношение трипсин/Na+,K+-ATP-аза (w/w) составляло 1/10. Протеолиз останавливали добавлением ингибитора трипсина из соевых бобов в 2-х кратном избытке по отношению к трипсину (w/w). Затем проводили анализ триптических фрагментов методом электрофореза в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (SDS).
Электрофорез в полиакриламидном геле. Электрофорез проводили в 6% концентрирующем и в 12% разделяющем ПААГ в присутствии SDS по методу Лэммли [21]. Белки на геле окрашивали Кумасси G-250. Образцы готовили на 4-х кратном буфере, содержащем 250 мМ Трис-HCl (рН 6.8), 8% SDS, 40% сахарозу и бромфеноловый синий, затем прогревали в течение 15 мин при 50°С. Электрофорез проводили при силе тока: 25мА на одно стекло в концентрирующем геле и 50мА на одно стекло в разделяющем геле. Полученные гели сканировали и обрабатывали (денситометрировали фрагменты протеолиза) с помощью программного пакета TotalLab TL120.
Статистические различия. Статистические различия определяли с помощью метода однофакторного дисперсионного анализа (One Way ANOVA), различия считали статистически значимыми при р < 0.01.
РЕЗУЛЬТАТЫ
Препараты Na+,K+-ATP-азы, использованные в нашей работе, были получены из медуллярного слоя почек свиньи и крысы. Активность препаратов Na+,K+-ATP-азы из почек свиньи и крысы составляла 1800–2000 и 500–800 мкмоль Фн/(мг белка в ч) соответственно при 37°C. Эта активность полностью ингибировалась высокими концентрациями уабаина (1 мМ для фермента из почек свиньи и 5 мМ для фермента из почек крысы).
На гелях, полученных после проведения электрофореза в ПААГ в присутствии SDS, препаратов из почек свиньи и крысы обнаруживается белковая полоса с подвижностью, соответствующей белку молекулярной массой около 100 кДа (рис. 1а, 3а) и размытая полоса, соответствующая белку с молекулярной массой 55–65 кДа. Белок с молекулярной массой 100 кДа, обнаруженный в обоих препаратах, при иммуноблоттинге окрашивался специфическими антителами против α1-субъединицы (не показано). Это позволяет нам идентифицировать эти белки как α- и β-субъединицы Na+,K+-ATP-азы. В препарате Na+,K+-ATP-азы из почек свиньи обнаруживаются и другие белки, общее содержание которых, рассчитанное по интенсивности окрашивания Кумасси G-250, не превышало 15%.
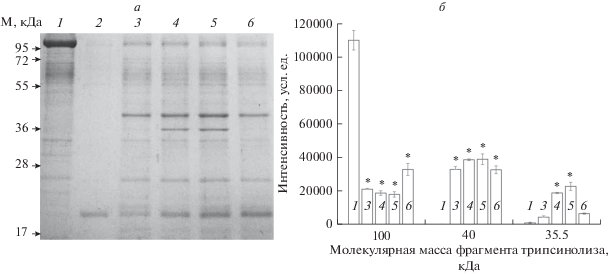
Рис. 1.
Результаты трипсинолиза α1S-Na+,K+-ATP-азы из почек свиньи в конформации Е1 в присутствии КТС (1 мМ). Время трипсинолиза 5 мин при 37°С. Соотношение Na+,K+-ATP-аза/трипсин 10/1. а – Результаты разделения препарата белков и протеолитических фрагментов α1S-Na+,K+-ATP-азы методом электрофореза в ПААГ в присутствии SDS. На дорожки нанесены: 1 – исходный препарат Na+,K+-ATP-азы (7.7 мкг); 2 – трипсин и ингибитор трипсина; 3 – Na+,K+-ATP-аза и трипсин; 4 – комплекс Na+,K+-ATP-аза–уабаин и трипсин; 5 – комплекс Na+,K+-ATP-аза–дигоксин и трипсин; 6 – комплекс Na+,K+-ATP-аза–маринобуфагенин и трипсин. б – Интенсивность окрашивания белковых полос, соответствующих α1-субъединице Na+,K+-ATP-азы и ее пептидных фрагментов с молекулярной массой 40 и 35.5 кДа. Представлены результаты трех экспериментов, показаны стандартные отклонения; * – p < 0.01.
В препарате из почек крысы присутствовал также белок с молекулярной массой около 130 кДа. Наши попытки удалить его из препарата путем внесения модификаций в процедуру выделения не привели к успеху. Мы проанализировали белки этой полосы с использованием метода хромато-масс-спектрометрии (LC/MS) и обнаружили пептидные фрагменты трех белков: α-субъединицы Na+,K+-ATP-азы, аланиламинопептидазы и мембранной аланиламинопептидазы. При обработке фермента трипсином количество белка в этой полосе уменьшалось незначительно (рис. 3), таким образом, его протеолиз не изменял общую картину трипсинолиза α-субъединицы.
В нашей работе соотношение трипсин/Na+,K+-ATP-аза (w/w) составляло 1/10, а время инкубации с трипсином – 5 мин. Это обусловлено тем, что связывание КТС значительно увеличивает скорость трипсинолиза [17].
На рис. 1 представлены данные электрофоретического анализа продуктов трипсинолиза, полученных из α1S-субъединицы Na+,K+-ATP-азы почек свиньи в конформации Е1 (соотношение трипсин/Na+,K+-ATP-аза 1/10, 5 мин при 37°С). Видно, что интенсивность окрашивания α1S-Na+,K+-ATP-азы (~100 кДа) после протеолиза существенно снижается (дорожки 1 и 3). При этом образуется пептидный фрагмент с молекулярной массой около 40 кДа и небольшое количество пептидного фрагмента с молекулярной массой 35.5 кДа. В небольших количествах появляются еще два пептидных фрагмента с молекулярными массами около 23 и 19 кДа, которые отсутствовали в препарате фермента до протеолиза.
Преинкубация фермента из почек свиньи с уабаином и дигоксином в концентрациях, полностью ингибирующих Na+,K+-ATP-азу (1 мМ), приводит к существенному и практически одинаковому снижению количества α1S-субъединицы Na+,K+-ATP-азы и увеличению количества полипептидного фрагмента с молекулярной массой около 40 кДа. В то же время в результате преинкубации Na+,K+-ATP-азы с карденолидами уабаином и дигоксином существенно возрастает количество белка с молекулярной массой 35.5 кДа. Этот белок не обнаруживается после преинкубации фермента с буфадиенолидом маринобуфагенином и последующего трипсинолиза (рис. 1а, дорожка 6). Таким образом, в присутствии карденолидов на поверхности белка экспонируется дополнительный участок расщепления полипептидной цепи трипсином, который недоступен для протеолиза, если фермент преинкубирован с маринобуфагенином. Это означает, что конформация α-субъединицы Na+,K+-ATP-азы после ее связывания с уабаином и дигоксином отличается от конформации, индуцированной связыванием маринобуфагенина.
На рис. 2 представлены результаты, полученные при электрофоретическом разделении продуктов протеолиза α1-субъединицы Na+,K+-ATP-азы из почек свиньи в конформации Е2-Р (условия трипсинолиза такие же, как на рис. 1). В результате протеолиза в отсутствие КТС наблюдается уменьшение количества α1-субъединицы, увеличивается количество продуктов протеолиза с молекулярной массой 40 кДа и 35.5 кДа. Но преинкубация с любым из исследуемых кардиотонических стероидов приводит к появлению большого количества дополнительного фрагмента с молекулярной массой 45 кДа. Это показывает, что в конформации Е2-Р связывание любого из кардиотонических стероидов обеспечивает одинаковое изменение конформации α1-субъединицы фермента.
Рис. 2.
Результаты трипсинолиза α1S-Na+,K+-ATP-азы из почек свиньи в конформации Е2-Р в присутствии КТС (1 мМ). Время трипсинолиза 5 мин при 37°С. Соотношение Na+,K+-ATP-азы/трипсин 10/1. а – Результаты разделения препарата белков и протеолитических фрагментов α1S-Na+,K+-ATP-азы методом электрофореза в ПААГ в присутствии SDS. На дорожки нанесены: 1 – трипсин и ингибитор трипсина; 2 – исходный препарат Na+,K+-ATP-азы (7.7 мкг); 3 – Na+,K+-ATP-аза и трипсин; 4 – комплекс Na+,K+-ATP-аза–уабаин и трипсин; 5 – комплекс Na+,K+-ATP-аза–дигоксин и трипсин; 6 – комплекс Na+,K+-ATP-аза–маринобуфагенин и трипсин. б – Интенсивность окрашивания белковых полос, соответствующих α1-субъединице Na+,K+-ATP-азы и ее пептидных фрагментов с молекулярной массой 45 и 40 кДа. Представлены результаты трех экспериментов, показаны стандартные отклонения; * – p < 0.01.
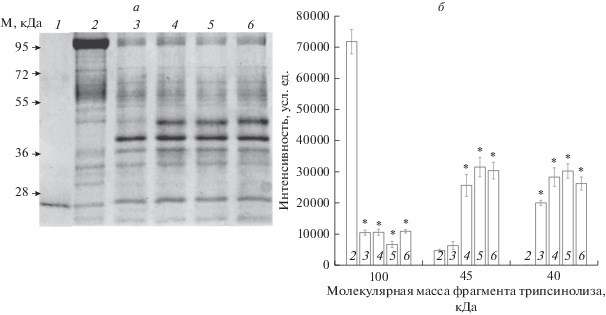
Рис. 3.
Результаты трипсинолиза α1R-Na+,K+-ATP-азы из почек крысы в конформации Е1 (а) и в конформации Е2-Р (б) в присутствии КТС. Время трипсинолиза 5 мин при 37°С. Соотношение Na+,K+-ATP-аза/трипсин 10/1. Результаты разделения препарата белков и протеолитических фрагментов α1R-Na+,K+-ATP-азы методом электрофореза в ПААГ в присутствии SDS. На дорожки нанесены: 1 – трипсин и ингибитор трипсина; 2 – исходный препарат Na+,K+-ATP-азы (7.7 мкг); 3 – Na+,K+-ATP-аза и трипсин; 4 – комплекс Na+,K+-ATP-аза–уабаин и трипсин; 5 – комплекс Na+,K+-ATP-аза–дигоксин и трипсин; 6 – комплекс Na+,K+-ATP-аза–маринобуфагенин и трипсин; 7 – комплекс Na+,K+-ATP-аза–уабаин и трипсин. Концентрация кардиотонических стероидов при преинкубации α1R-Na+,K+-ATP-азы с уабаином, дигоксином и маринобуфагенином на дорожках 4–6 – 1 мМ, на дорожке 7 – 10 мМ.
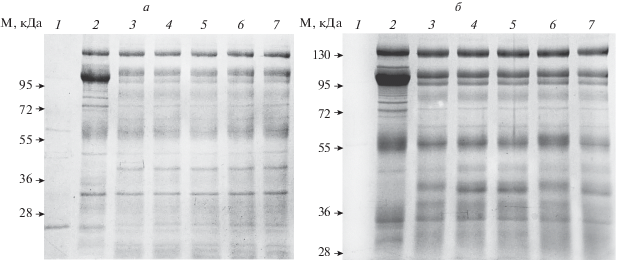
При протеолизе α1R- Na+,K+-ATP-азы из почек крысы в конформации Е1 и Е2-Р мы наблюдали образование фрагментов с молекулярными массами 40 кДа и не обнаружили появления фрагментов с молекулярной массой 35.5 кДа. Преинкубация фермента с любым кардиотоническим стероидом не изменяла набора продуктов протеолиза и их молекулярной массы в случае пребывания фермента в обеих конформациях (рис. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами данные по протеолизу α1R-Na+,K+-ATP-азы из почек свиньи отличаются от данных, полученных ранее другими авторами: мы обнаружили, что под действием трипсина α-субъединица расщепляется с получением в основном фрагмента с молекулярной массой 40 кДа и небольших количеств пептидных фрагментов с молекулярной массой 35.5 кД, 23 и 19 кДа (причем в количественном отношении преобладает фрагмент с молекулярной массой около 40 кДа). Другие авторы сообщают о получении фрагментов с молекулярными массами 44, 37, 23 и 15 кДа. Однако различия в 3–4 кДа в величине молекулярных масс белков, определенных по электрофоретической подвижности, находятся в пределах ошибки самого метода. Поэтому можно полагать, что получены те же самые полипептиды, о которых сообщали другие авторы [13–15]. Доказать, что наши результаты не отличаются от результатов предшественников, можно лишь путем определения N-концевой последовательности этих пептидов, однако это не являлось целью нашего исследования. Более того, эти авторы не идентифицировали указанные фрагменты таким способом.
В результате нашей работы установлено, что при протеолизе Na+,K+-ATP-азы из почек свиньи в конформации Е1 (но не Е2-P) образуется статистически значимое количество пептида с молекулярной массой около 35.5 кДа только в том случае, если с ферментом связаны карденолиды уабаин или дигоксин, но не буфадиенолид маринобуфагенин. В присутствии маринобуфагенина этот фрагмент при трипсинолизе вообще не образуется. Это позволяет считать, что маринобуфагенин при связывании с Na+,K+-ATP-азой (по крайней мере, в Е1-конформации) обеспечивает создание конформации, отличной от таковой, что создается в присутствие уабаина и дигоксина. Это согласуется с другими нашими данными, полученными на клеточной культуре MDCK [22]. Ранее мы показали, что уабаин индуцирует смерть клеток эпителия почек при значительно более низкой концентрации, чем маринобуфагенин. Возможно, это обусловлено тем, что маринобуфагенин, связываясь с Na+,K+-ATP-азой не способен создавать конформацию необходимую для связывания с белком-партнером, который индуцирует сигнальный каскад, приводящий к гибели клетки.
Также нами установлено отсутствие различий в продуктах протеолиза, полученных после трипсинолиза комплекса Na+,K+-ATP-азы из почек крысы со всеми тремя исследованными КТС, как в конформации Е1, так и в конформации Е2-P. Эти данные показывают, что α1S- и α1R-изоформы фермента различаются не только по их чувствительности к КТС, но и по их способности переходить вследствие связывания КТС в конформацию, которая характерна для Na+,K+-ATP-азы из почек свиньи и, по-видимому, необходима для связывания нужного белка-партнера. Именно по этой причине α1S- и α1R-изоформы Na+,K+-ATP-азы после их связывания с КТС способны, по-видимому, инициировать различные сигнальные каскады.
Исследование выполнено при финансовой поддержке гранта РФФИ № 18-34-00308.
Список литературы
Skou J.C., Esmann N. 1992. The Na,K-ATPase. J. Bioenerg. Biomembr. 24, 249–261.
Clausen M.V., Hilbers F., Poulsen H. 2017. The structure and function of the Na,K-ATPase isoforms in health and disease. Front. Physiol. 8, 371.
Blanco G., Mercer R.W. 1998. Isozymes of the Na-K-ATPase: Heterogeneity in structure, diversity in function. Am. J. Physiol. Physiol. 275, F633–F650.
El-Seedi H.R., Khalifa S.A.M., Taher E.A., Farag M.A., Saeed A., Gamal M., Hegazy M.E.F., Youssef D., Musharraf S.G., Alajlani M.M., Xiao J., Efferth T. 2019. Cardenolides: Insights from chemical structure and pharmacological utility. Pharmacol. Res. 141, 123–175.
Lingrel J.B., Argüello J.M., Huysse J., Kuntzweiler T.A. 1997. Cation and cardiac glycoside binding sites of the Na,K-ATPase. Ann. N.Y. Acad. Sci. 834, 194–206.
Bagrov A.Y., Shapiro J.I., Fedorova O.V. 2009. Endogenous cardiotonic steroids: Physiology, pharmacology, and novel therapeutic targets. Pharmacol. Rev. 61, 9–38.
Schoner W., Scheiner-Bobis G. 2007. Endogenous and exogenous cardiac glycosides: Their roles in hypertension, salt metabolism, and cell growth. Am. J. Physiol. Physiol. 293, C509–C536.
Akimova O.A., Lopina O.D., Rubtsov A.M., Hamet P., Orlov S.N. 2010. Investigation of mechanism of p38 MAPK activation in renal epithelial cell from distal tubules triggered by cardiotonic steroids. Biochem. 75, 971–978.
Akimova O.A., Pchejetski D., Hamet P., Orlov S.N. 2006. Modest intracellular acidification suppresses death signaling in ouabain-treated cells. Pflugers Arch. Eur. J. Physiol. 451 (4), 569–578.
Akimova O.A., Tverskoi A.M., Smolyaninova L.V., Mongin A.A., Lopina O.D., La J., Dulin N.O., Orlov S.N. 2015. Critical role of the α1-Na+,K+-ATPase subunit in insensitivity of rodent cells to cytotoxic action of ouabain. Apoptosis. 20, 1200–1210.
Giotta G.J. 1975. Native (Na+ + K+) dependent adenosine triphosphatase has two trypsin sensitive sites. J. Biol. Chem. 250, 5159–5164.
Jørgensen P.L., Collins J.H. 1986. Tryptic and chymotryptic cleavage sites in sequence of alpha-subunit of (Na+ + K+)-ATPase from outer medulla of mammalian kidney. Biochim. Biophys. Acta. 860, 570–576.
Dergousova E.A., Poluektov Y.M., Klimanova E.A., Petrushanko I.Y., Mitkevich V.A., Makarov A.A., Lopina O.D. 2018. Glutathionylation of Na,K-ATPase alpha-subunit alters enzyme conformation and sensitivity to trypsinolysis. Biochem. 83, 969–981.
Jorgensen P.L. 1977. Purification and characterization of (Na+ + K+)-ATPase. VI. Differential tryptic modification of catalytic functions of the purified enzyme in presence of NaCl and KCl. Biochim. Biophys. Acta. 466, 97–108.
Jørgensen P.L., Andersen J.P. 1988. Structural basis for E1-E2 conformational transitions in Na, K-pump and Ca-pump proteins. J. Membr. Biol. 103 (2), 95–120.
Jørgensen P.L. 1988. Purification of Na+,K+-ATPase: Enzyme sources, preparative problems, and preparation from mammalian kidney. Methods Enzymol. 156, 29–43.
Akayama M., Nakada H., Omori K., Masaki R., Taketani S., Tashiro Y. 1986. The (Na+, K+)ATPase of rat kidney: Purification, biosynthesis, and processing. Cell Struct. Funct. 11, 259–271.
Lowry O.H., Rosebrough N.J., Farr L., Randall R.J. 1951. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193, 265–275.
Rathbun W.B., Betlach M.V. 1969. Estimation of enzymically produced orthophosphate in the presence of cysteine and adenosine triphosphate. Anal. Biochem. 28, 436–445.
Klimanova E.A., Petrushanko I.Y., Mitkevich V.A., Anashkina A.A., Orlov S.N., Makarov A.A., Lopina O.D. 2015. Binding of ouabain and marinobufagenin leads to different structural changes in Na,K-ATPase and depends on the enzyme conformation FEBS Lett. 589, 2668–2674.
Laemmli U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227, 680–685.
Akimova O.A., Bagrov A.Y., Lopina O.D., Kamernitsky A.V., Tremblay J., Hamet P., Orlov S.N. 2005. Cardiotonic steroids differentially affect intracellular Na+ and [Na+]i/[K+]i-independent signaling in C7-MDCK cells. J. Biol. Chem. 280, 832–839.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


