Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 1, стр. 22-33
Визуализация, свойства и функции ГАМКергических нейронов гиппокампа, содержащих проницаемые для кальция каинатные и AMPA-рецепторы
В. П. Зинченко a, *, С. Г. Гайдин a, И. Ю. Теплов a, А. М. Косенков a, А. И. Сергеев a, Л. П. Долгачева a, С. Т. Тулеуханов b
a Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”
142290 Московская обл, Пущино, Россия
b Казахский национальный университет имени аль-Фараби
050040 г. Алматы, Казахстан
* E-mail: vpz@mail.ru
Поступила в редакцию 15.05.2019
После доработки 25.08.2019
Принята к публикации 26.08.2019
Аннотация
Проницаемые для кальция каинатные (CP-KAR) и AMPA-рецепторы (CP-AMPAR) нейронов мозга являются активными участниками синаптической пластичности и запуска процесса секреции нейротрансмиттеров. В настоящей работе нейроны, содержащие CP-KA- и CP-АМРА-рецепторы, идентифицировали в нейроглиальной культуре гиппокампа на 14–17 день культивирования по характерному Са2+-ответу на агонист КА- и АМРА-рецепторов, домоевую кислоту (DA) и селективный агонист CP-KARs, АТРА. Показано, что DA в концентрации 300 нМ вызывала быстрый рост внутриклеточной концентрации Ca2+ в двух минорных субпопуляциях нейронов. Обе субпопуляции оказались ГАМКергическими нейронами и положительно окрашивались антителами против глутаматдекарбоксилазы 65 и 67 (GAD65/67). Ингибитор СР-АМРА-рецепторов NASPM не подавлял Са2+-ответ на DA в нейронах первой субпопуляции. Селективный агонист CP-KAR, АТРА, повышал [Ca2+]i в той же степени, что и DA лишь в первой субпопуляции ГАМКергических нейронов. Ингибитор ГАМК(А)-рецепторов, бикукуллин, не повышал амплитуду Са2+-ответа на DA в этой субпопуляции, что указывает на отсутствие CP-KARs в постсинаптической мембране, где локализованы ГАМК(А)-рецепторы. Таким образом, данную субпопуляцию ГАМКергических нейронов можно отнести к нейронам, содержащим CP-KARs, которые, вероятно, локализованы в пресинаптической мембране ГАМКергических нейронов. Повышение [Са2+]i, во второй субпопуляции, вызванное аппликацией DA, полностью подавлялось ингибитором СP-АМРАRs, NASPM. В этой же субпопуляции NASPM уменьшал амплитуду Са2+-колебаний, указывая на участие СР-АМРАRs в формировании Са2+-импульса во время синхронной кальциевой активности. На основании этого данную субпопуляцию нейронов можно отнести к ГАМКергическим нейронам, содержащим СP-АМРАRs. Большинство же нейронов в культуре клеток гиппокампа (70–85%) не окрашивались антителами против GAD65/67 и с задержкой отвечали на аппликацию DA повышением частоты кальциевых колебаний. Амплитуда этих колебаний в ответ на DA увеличивалась в присутствии NASPM в субпопуляции тормозных нейронов, содержащих СР-КАRs, указывая на их иннервацию тормозными нейронами, содержащими СР-AMRARs. Это увеличение амплитуды Са2+-колебаний в тормозных нейронах, содержащих СР-КАRs, коррелировало с уменьшением амплитуды синхронной кальциевой активности в большой (42% ± 6% нейронов) субпопуляции глутаматергических нейронов, предполагая иннервацию последних тормозными нейронами, содержащими СР-КАRs. Таким образом, ГАМКергические нейроны, содержащие CP-KA- и CP-АМРА-рецепторы, могут работать в тандеме, контролируя активность отдельных популяций нейронов.
ВВЕДЕНИЕ
Глутаматные каинатные (КА) и АМРА-рецепторы классически рассматриваются как рецепторы-каналы, деполяризующие мембрану за счет натриевой проводимости, что обеспечивает прохождение возбуждающего сигнала через нейрональные синапсы, активацию потенциал-зависимых кальциевых каналов и снятие магниевого блока с NMDA-рецепторов. Однако отдельные популяции КА- и АМРА-рецепторов обладают кальциевой проводимостью, что дает возможность участия в запуске процесса секреции нейротрансмиттеров [1].
Сведения о физиологических эффектах агонистов CP-KARs достаточно противоречивые, поскольку результат зависит от концентрации агонистов, типа и состояния нейронов. Так, активация CP-KARs может вызывать резкое усиление возбуждения в ответ на физиологические стимулы и увеличивать высвобождение глутамата [2, 3]. С другой стороны, агонисты CP-KA-рецепторов усиливают секрецию ГАМК [4–6] и подавляют синаптическую передачу. Что касается селективной экспрессии субъединиц GluK1 и GluK2, определяющих Са2+-проводимость КАR, то показано, что возбуждающие пирамидальные клетки экспрессируют главным образом GluK2-содержащие рецепторы, тогда как тормозные нейроны гиппокампа экспрессируют GluK1 [7, 8]. Причем CP-KARs, содержащие субъединицу GluK1, могут быть локализованы в пресинаптической мембране ГАМКергических нейронов [9, 10], где они стимулируют секрецию ГАМК [10–12] и, таким образом, осуществляют отрицательную обратную связь, ингибируя активность принципиальных нейронов при гипервозбуждении [5, 13]. Предполагается, что активация CP-KARs ГАМКергических нейронов может вызывать нейропротекторный эффект при ишемических повреждениях мозга и других нейродегенеративных процессах. В ряде работ показано, что, действительно, активация CP-KARs усиливает высвобождение ГАМК и увеличивает тоническое торможение пирамидальных нейронов [8, 14, 15], защищая их от повреждения при гипервозбуждении.
Исследование механизма, с помощью которого СP-KARs усиливают секрецию нейротрансмиттеров в ГАМКергических нейронах показало, что нейроны, содержащие СP-KARs, легковозбудимы, генерируют быстрый Са2+-сигнал без десенситизации при активации селективными агонистами КАRs [9, 10, 16] и не имеют ГАМК(А)-рецептор-зависимого торможения [17]. При этом CP-KARs располагаются пресинаптически на данных нейронах. Такие свойства рецептора могут обеспечить опережающую и массивную секрецию ГАМК при возбуждении.
СP-АМРАRs локализованы в определенных подтипах ГАМКергических нейронов. Так, 78% быстроразряжающихся ГАМКергических нейронов (fast spiking), содержащих парвальбумин, содержат также и СP-АМРАRs [18]. В отличие от KARs, СP-АМРARs локализованы в тормозных интернейронах постсинаптически, где способствуют генерации Са2+-импульса, который вызывает секрецию ГАМК и торможение нейронов в сети [19–23]. CP-AMPARs играют большую роль в синаптической пластичности [24]. В ряде работ показано, что после периода повышенной активности количество CP-AMPARs в синапсе возрастает [25, 26]. Последние исследования показали, что соотношение Са2+-проводящих и Са2+-непроводящих АМРА-рецепторов зависит от активности синапса. При слабой стимуляции в синапсе активируется транспорт CP-AMPARs, а при сильной стимуляции активируется транспорт AMPARs, содержащих GluA2 [27]. Встраивание и удаление CP-AMPARs в синапсе регулируется процессами фосфорилирования и дефосфорилирования C-концевого домена субъединицы GluA1. Особенно интенсивно данный процесс протекает в постнатальтный период. Показано, что на 4–5-й день постнатального периода около 78% AMPARs в синапсах проницаемы для Ca2+ [28].
Ввиду важной регуляторной роли СP-KARs и CP-AMPARs в последние годы активизировались усилия по идентификации и характеристике нейронов, экспрессирующих эти рецепторы. В настоящее время устанавливаются электрофизиологические характеристики этих рецепторов, их локализация в определенных подтипах нейронов, пресинаптическая и постсинаптическая локализация, участие рецепторов в усилении секреции ГАМК, а также выясняется роль этих рецепторов в контроле гипервозбуждения.
В настоящей работе ставились следующие задачи: визуализировать ГАМКергические нейроны, содержащие СР-КА- и СР-АМРА-рецепторы, по характерному Са2+-сигналу в ответ на агонисты соответствующих рецепторов; выявить различия в субпопуляциях ГАМКергических нейронов, содержащих СР-КА- и (или) СР-АМРА-рецепторы; установить пре- или постсинаптическую локализацию этих рецепторов в нейронах; выявить степень контроля активности СР-КА-рецепторов ГАМК(А)-рецепторами; определить популяции нейронов, иннервируемые нейронами, содержащими СР-КА и СР-АМРА-рецепторы.
МАТЕРИАЛЫ И МЕТОДЫ
Культура клеток гиппокампа. В экспериментах использовали смешанную нейроглиальную культуру клеток гиппокампа крысы, выделенного из головного мозга новорожденных (1–3 дня) крыс Sprague–Dawley в соответствии с [29, 30]. Эксперименты проводили на культуре нейронов гиппокампа на 14–17-й день культивирования. Перед экспериментом клетки загружали в течение 30 мин при 28°C флуоресцентным зондом Fura-2 AM (6 мкМ) в растворе HBSS, содержащем (мМ): 156 NaCl, 3 KCl, 2 MgSO4, 1.25 KH2PO4, 2 СаCl2, 10 глюкозу и 10 HEPES; pH 7.35. Флуоресценцию регистрировали в растворе Хенкса. Плотность клеток составляла 5000–7000/мм2.
Для измерения [Са2+]i использовали систему анализа изображений на базе инвертированного моторизованного микроскопа Leica DMI6000B, оснащенного высокоскоростной монохромной CCD-камерой HAMAMATSU C9100, системой высокоскоростной смены возбуждающих светофильтров Leica’s Ultra-Fast Filter Wheels (время переключения 10–30 мс). Использовали объектив Leica HC PL APO 20×/0.7 IMM. В качестве источника возбуждения флуоресценции использовали осветитель Leica EL6000 с ртутной лампой высокого давления HBO 103 W/2. Кальциевые сигналы нейронов регистрировали по интенсивности флуоресценции двухволнового Са2+-чувствительного зонда Fura-2. Для возбуждения и регистрации флуоресценции Fura-2 использовали набор светофильтров FU2 (Leica, Германия) с фильтрами возбуждения BP340/30 и BP387/15, светоделителем FT410 и фильтром эмиссии BP510/84. Полученные в двух различных каналах временные серии изображений обрабатывали в программе ImageJ с использованием программных модулей Time Series Analyzer и RatioPlus. Амплитуду кальциевых ответов одиночных клеток определяли из отношения интенсивности флуоресценции Fura-2 при возбуждении светом с длиной волны 340 нм к интенсивности при возбуждении 380 нм.
Иммуноцитохимическое окрашивание ГАМКергических нейронов. Для обнаружения ГАМКергических нейронов использовали иммуноцитохимический метод [30, 31]. Поскольку измерения кальция и регистрацию флуоресценции антител проводили на разных микроскопах, то для совмещения изображений на обратную сторону круглого покровного стекла с культурой клеток тонким маркером наносили измерительную сетку с шагом 2 мм. В обоих микроскопах изображение сетки совмещалось с изображением перекрестия окуляра. После регистрации кальциевого сигнала клетки фотографировали в режиме фазово-контрастной микроскопии и каждую клетку нумеровали. Затем клетки фиксировали и анализировали иммуноцитохимически с использованием антител против глутамат декарбоксилазы (GAD65/67) согласно методике описанной ранее [32, 33]. Во время этой процедуры использовали следующие растворы: фосфатно-солевой буфер (PBS), рН 7.4; 4% параформальдегид в PBS; 1% и 10% сыворотку осла в PBS. Клетки фиксировали 4% параформальдегидом в PBS в течение 20 мин и трижды промывали ледяным PBS в течение 5 мин. Для пермеабилизации клетки обрабатывали 0.1% раствором Тритона X-100 в течение 15 мин. Для блокирования неспецифических сайтов связывания антител фиксированные клетки инкубировали в 10% сыворотке осла в течение 30 мин при комнатной температуре. Затем клетки инкубировали с первичными кроличьими антителами против GAD 65/67 в течение 12 ч при 4°C (1 : 500 в 1% сыворотке осла). Фиксированные клетки затем промывали PBS (3 раза в течение 5 мин) и обрабатывали вторичными антителами осла против кролика, конъюгированными с Alexa Fluor 647 (1 : 200 в PBS) в соответствии с руководством производителя (Abcam, Великобритания). Для окрашивания ДНК в фиксированных клетках использовали ДНК-специфический флуоресцентный зонд Hoechst 33 342 [34].
Флуоресценцию антител регистрировали с помощью инвертированного конфокального микроскопа Leica TCS SP5 при возбуждении He-Ne-лазером с длиной волны возбуждения 633 нм и регистрации при 655–700 нм. Для возбуждения Hoechst 33 342 использовали лазер с длиной волны 405 нм. Регистрацию производили в диапазоне 425–500 нм. Затем с помощью программного обеспечения ImageJ сравнивали конфокальные изображения флуоресценции антител и прижизненные флуоресцентные изображения клеток, окрашенных Fura-2. Такой подход позволяет оценить изменения [Ca2+]i в GAD65/67-положительных и в GAD65/67-отрицательных нейронах.
Материалы. В работе использовали: растворы Хенкса, HEPES (MP Biomedicals, США); Fura-2/AM, бессывороточную добавку B-27, бикукуллин, домоевую кислоту, АТРА, NASPM, (Tocris Bioscience, Великобритания); бычий сывороточный альбумин, PBS, (Sigma, США). Первичные кроличьи антитела против глутаматдекарбоксилазы 65 и 67 (Abcam, Великобритания), вторичные антитела осла против антител кролика, конъюгированные с Alexa Fluor 647 (1 : 200 в PBS) были приготовлены согласно прописи (Abcam, Великобритания). Реагенты добавляли при полной замене среды c помощью специальной перфузионной системы, которая позволяет быстро заменить весь раствор в камере. Скорость записи – 1 кадр в секунду. Все эксперименты выполнены при температуре 28–30°C.
Статистический анализ. Результаты представлены как среднее ± стандартная ошибка среднего (SEM) или как репрезентативные записи кальциевых сигналов в отдельных клетках. Серия экспериментов одного дня состояла из 5–6 повторов. Каждый эксперимент с клетками одного посева повторяли 3 раза. Количество клеток, проанализированных в одном опыте, варьировало от 100 до 200. В подписях к рисункам указано: N – количество клеток, проанализированных в конкретном эксперименте, n – число независимых экспериментов. Исходный уровень сигнала в клетках обычно составлял 0.23 ± 0.07 (здесь и далее приведено среднее значение ± стандартное отклонение). Нейроны отличали от астроцитов по синхронной спонтанной активности и быстрому Са2+-ответу на деполяризацию 35 мM KCl в конце эксперимента. Анализ результатов и построение графиков проводили с помощью программы Origin 9.1.
РЕЗУЛЬТАТЫ
Чтобы визуализировать и охарактеризовать нейроны, содержащие СP-AMPARs и CP-КАRs, мы регистрировали изменения концентрации ионов Са2+ в цитозоле ([Са2+]i) во всех клетках в поле зрения микроскопа в культуре клеток гиппокампа на 14-17 DIV при действии агонистов и антагонистов этих рецепторов. Для исследования взаимодействия между популяциями клеток, в нейрональной сети индуцировали режим синхронных кальциевых колебаний (СКК). Синхронную активность нейронов вызывали снятием ГАМК(А)-зависимого торможения ингибитором ГАМК(А)-рецепторов, бикукуллином [5]. DA использовали в качестве агониста обоих рецепторов. АТРА использовали в качестве селективного агониста CP-KAR [35]. NASPM использовали в качестве селективного антагониста СP-АМРАR [36]. На рис. 1а показано, что бикукуллин вызывает синхронные осцилляции [Ca2+]i в нейронах. Кратковременная аппликация DA в концентрации 300 нМ (ЕС50 = 51 нМ) вызывала быстрое высокоамплитудное и продолжительное повышение базального уровня [Ca2+]i в минорной популяции нейронов (кривые 1, 2 на рис.1б) и через несколько секунд (15 с в данном эксперименте) увеличивала частоту СКК во всех остальных нейронах в сети (кривые 3, 4 на рис.1б). Задержка возбуждения в большинстве нейронов может означать, что популяция нейронов, реагирующих быстрым подъемом [Ca2+]i, содержит ГАМКергические нейроны, и их возбуждение тормозит остальные нейроны от возбуждения домоевой кислотой на какое-то время (15с), по прошествии которого ГАМК-зависимое торможение прекращается.
Рис. 1.
Идентификация ГАМКергических нейронов, содержащих CP-KA- и CP-AMPA-рецепторы. а – Общая схема эксперимента. Кальциевые сигналы нейронов в режиме СКК в ответ на DA (300 нМ) в контроле (б – первая добавка в растянутой временной шкале) и в присутствии 50 мкМ NASPM (в) в четырех популяциях нейронов, представленных кривыми, усредненными по семи нейронам каждой популяции. б, в – Цифрами на кривых обозначены: 1 – тормозные нейроны, содержащие CP-KARs, 2 – тормозные нейроны, содержащие CP-AМРАRs, 3, 4 – возбуждающие нейроны. г – Реакция нейронов на аппликацию агонистов КА-рецепторов: DA и ATPA вызывают повышение [Са2+]i в нейронах, в которых NASPM не ингибирует DA-индуцированный Са2+-ответ (красные кривые). Бикукуллин не увеличивает амплитуду Ca2+-сигнала на DA в этой субпопуляции нейронов (красные кривые). Для сравнения показаны Ca2+-сигналы в двух глутаматергических нейронах (зеленые кривые). Эти нейроны не отвечают на ATPA, а бикукуллин увеличивает в них амплитуду DA-индуцированного ответа. Пауза между аппликациями составляет 12 мин. N = 125, n = 3. д, е, ж – Прижизненная визуализация нейронов, содержащих СР-КА- и СР-АМРА-рецепторы; флуоресцентные изображения клеток, окрашенных Fura-2 в поле зрения микроскопа. д – Клетки в состоянии покоя, темные пятна соответствуют клеткам с низким [Ca2+]i. е – Увеличение [Ca2+]i в нейронах зарегистрировано на 545-й секунде в максимуме импульса СКК на рис. 1б (светлые нейроны). Темные клетки – астроциты. ж – Светлые клетки-нейроны, содержащие CP-KARs и СР-AMPARs. Момент регистрации кадра показан стрелочкой на рис. 1б. з, и, к – иммуноцитохимическое окрашивание клеток в культуре антителами против GAD 65/67. Слева – ядра клеток, окрашенные с помощью Hoechst 33 342; в центре – флуоресценция антител против GAD 65/67, cправа – объединенное изображение. 15% клеток окрашены антителами к GAD 65/67. 65% из них ответили на DA увеличением [Ca2+]i. Отмеченные цифрами 1, 2 клетки на рис. 1и соответствуют клеткам из семейств 1, 2 на рис. 1б.
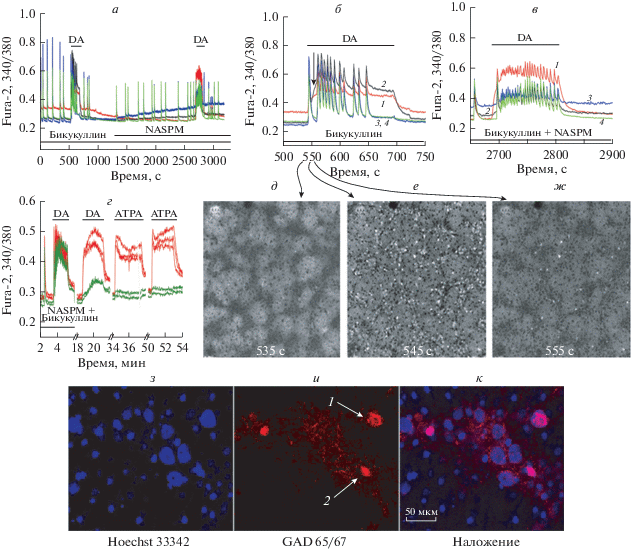
Торможение, по-видимому, реализуется через ГАМК(В)-рецепторы, поскольку ГАМК(А)-рецепторы заблокированы бикукуллином.
Для выявления нейронов, содержащих СP-АМРАRs, повторная аппликация DA проводилась на фоне ингибитора СP-АМРАRs, NASPM (рис 1а, 1в). По реакции на NASPM, популяция, ответившая на DA в контроле быстрым увеличением базального уровня [Ca2+]i, разделилась на две субпопуляции. NASPM полностью подавлял фазу быстрого повышения [Ca2+]i в ответ на DA в одной субпопуляции (черная кривая 2 на рис. 1в). На основании этого эти клетки можно отнести к нейронам, содержащим СP-АМРАRs. Ранее было показано, что данный тип рецепторов локализован в постсинаптической мембране нейронов [19, 20]. В контрольных экспериментах амплитуда кальциевых ответов на повторную аппликацию DA сохранялась (не показано) [37]. Вклад других каналов (NMDA, потенциал-зависимых Na+- и Са2+-каналов и каналов эндоплазматического ретикулума) в ответах на активацию СР-АМРАRs ГАМКергических нейронов в культуре кортикальных нейронов крысы был исследован ранее [38]. Са2+-сигнал, генерируемый СР-АМРА-рецепторами, существенно не изменялся в присутствии циклопиазоновой кислоты, антагонистов NMDA-рецепторов и блокаторов Na+- и Са2+-каналов. Присутствие ингибиторов NMDA-рецепторов не изменяло количество нейронов, ответивших на DA [39].
Ингибитор СP-АМРАRs не подавлял, а даже увеличивал Са2+-ответ на DA во второй субпопуляции нейронов (кривая 1, рис. 1в). На рис. 1г красными кривыми представлены кальциевые сигналы этой субпопуляции нейронов в ответ на последовательную аппликацию DA и селективного агониста CP-KARs, ATPA. Показано, что АТРА повышает [Ca2+]i в той же степени, что и DA, только в этой субпопуляции нейронов, обнаруживая рецептор, содержащий GluK1 субъединицу.
Ингибитор ГАМК(А)-рецепторов, бикукуллин, не повышал амплитуду Са2+-ответа на DA в этой популяции (рис. 1г), что указывает на отсутствие CP-KARs в постсинаптической мембране, где локализованы ГАМК(А)-рецепторы [17, 19]. Такая локализация CP-KARs обеспечивает отсутствие ГАМК(А)-рецептор-зависимого торможения этих рецепторов, что может способствовать высокой скорости возбуждения [17]. На основании полученных результатов можно предположить, что данная популяция нейронов содержит CP-KARs в пресинаптической мембране.
Таким образом, с помощью селективного агониста CP-KARs и антагониста СP-АМРАRs удалось показать, что популяция нейронов, ответивших повышением [Са2+]i на аппликацию DA, состоит их двух субпопуляций нейронов, одна из которых содержит CP-KARs, а другая – СP-АМРАRs.
Характерные кальциевые ответы на DA и на АТРА позволяют визуализировать нейроны, содержащие CP-KA- и CP-AMPA-рецепторы (рис. 1д, 1е, 1ж). На рисунках представлены флуоресцентные изображения клеток, окрашенных зондом на свободный кальций. Интенсивность флуоресценции пропорциональна [Ca2+]i. На рис. 1д приведены изображения клеток на 535-й секунде эксперимента. Клетки находятся в состоянии покоя, темные пятна соответствуют клеткам с низкой [Ca2+]i. На рис. 1е показано, что во всех нейронах на 545-й секунде эксперимента в максимуме импульса СКК [Ca2+]i высокая (светлые нейроны). В темных клетках, представленных преимущественно астроцитами, [Ca2+]i не повышается во время СКК. На рис. 1ж показано, что в период между импульсами, на 555-й секунде эксперимента (момент регистрации кадра показан стрелочкой на рис. 1б) остаются светлыми только нейроны, быстро реагирующие на DA повышением базального уровня [Ca2+]i. Последующее добавление АТРА визуализирует только нейроны, содержащие СР-КАRs (не показано).
Обе популяции (светлые нейроны на рис. 1ж) оказались ГАМКергическими нейронами и положительно окрашивались антителами против глутаматдекарбоксилазы 65/67 (рис. 1з, 1и, 1к). На рис. 1и стрелочкой показаны две покрашенные антителами клетки, из субпопуляций 1, 2 на рис. 1б. Большинство же нейронов в культуре клеток гиппокампа (70–80%) не окрашивались антителами и на этом основании отнесены к глутаматергическим нейронам. Эти нейроны отвечают на аппликацию DA с задержкой и лишь повышением частоты СКК (кривые 3, 4 на рис. 1б).
Система анализа изображения (нейроимиджинг) позволяет анализировать одновременно сигналы от сотен нейронов. Сравнение этих сигналов позволяет обнаружить субпопуляции определенных подтипов нейронов и установить взаимодействие не только между отдельными нейронами, но и между субпопуляциями нейронов. Для выявления мишеней, иннервируемых нейронами, содержащими CP-KARs и СР-AMRARs, мы сравнивали не только изменения базального уровня [Ca2+]i в ответ на DA, но и амплитуды кальциевых импульсов при СКК в контроле и в присутствии антагониста CP-AMPA-рецепторов, NASPM. Все нейроны уверенно разделились на четыре субпопуляции, по-разному реагирующие на ингибитор CP-AMPARs, NASPM и на аппликацию DA в присутствии NASPM.
На рис. 2 представлены усредненные кальциевые сигналы семи репрезентативных клеток каждой субпопуляции из эксперимента, показанного на рис. 1а. Амплитуду колебаний [Ca2+]i измеряли как в присутствии DA, так и после ее отмывки. Первые две субпопуляции на рис. 2 представляют ГАМКергические нейроны, которые ответили на DA быстрым увеличением базального уровня [Ca2+]i (рис. 2а и 2б). Третья и четвертая субпопуляции представляют глутаматергические нейроны (рис. 2в и 2г).
Рис. 2.
Изменение СКК и Са2+-ответов на DA в присутствии ингибитора СР-АМРАR в четырех популяциях нейронов. Приведены ответы, усредненные по 7 нейронам из каждой популяции. Схема эксперимента показана на рис. 1а. В каждом блоке приведены: реакция нейронов на DA и последующие синхронные колебания кальция после отмывки DA (слева), и синхронные колебания кальция и реакция нейронов на DA в присутствии NASPM (справа). а – В ГАМКергических нейронах, содержащих CP-KARs, амплитуда СКК после удаления DA не изменяется в присутствии NASPM. Значительное увеличение [Ca2+]i в присутствии NASPM наблюдается во время аппликации DA (справа) по сравнению с контролем (слева), что может указывать на торможение этих нейронов нейронами, содержащими CP-АМРАRs. б – NASPM-чувствительные ГАМКергические нейроны. NASPM уменьшает амплитуду СКК после удаления DA в среднем на 29 ± 3%, а также значительно снижает амплитуду колебаний кальция при аппликации DA. в – Глутаматергические нейроны, чувствительные к NASPM (42 ± 6% клеток). Амплитуда СКК после удаления DA и в ответ на DA уменьшаются в присутствии NASPM, что может указывать на ингибирование этих нейронов тормозными нейронами, содержащими CP-KARs, активность которых увеличивается в это время (см. рис. 2А). г – NASPM-нечувствительные глутаматергические нейроны. (37 ± 6% клеток). Амплитуда СКК после удаления DA и в ответ на DA не изменяется в них в присутствии NASPM, что указывает на отсутствие иннервации со стороны нейронов, содержащих CP-AMPARs или CP-KARs.
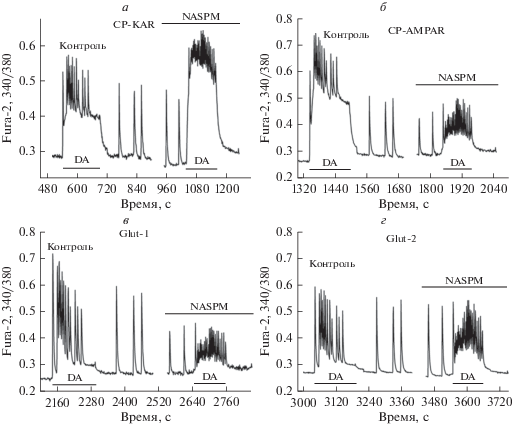
Можно видеть, что в тормозных нейронах первой группы, содержащих CP-KARs, амплитуда СКК, регистрируемая после удаления DA в контроле в среднем не изменяется и в присутствии NASPM (рис. 2а), что подтверждает отсутствие CP-AMPA-рецепторов в этих нейронах. Однако Ca2+-ответ на DA в присутствии NASPM не только сохраняется, но и значительно (в 2.5 раза) увеличивается (рис. 2а), что может указывать на иннервацию этих нейронов ГАМКергическими нейронами, содержащими CP-AMPARs. По-видимому, популяция ГАМКергических нейронов, содержащих CP-AMPARs, контролирует активность популяции ГАМКергических нейронов, содержащих CP-KARs, предохраняя их от повреждений, обусловленных быстрым, высокоамплитудным Са2+-сигналом, который развивается в этих нейронах при гипервозбуждении.
В NASPM-чувствительных тормозных нейронах второй группы (рис. 2б) амплитуда СКК, регистрируемая после удаления DA в контроле, в среднем уменьшается в присутствии NASPM, что указывает на участие CP-AMPARs в формировании импульса Ca2+ во время СКК в нейронах этой популяции. Амплитуда импульса уменьшается на 29 ± 2%. При аппликации DA в присутствии NASPM наблюдается значительное (в 3 раза) снижение амплитуды кальциевых колебаний в нейронах этой субпопуляции (рис. 2б), по-видимому, за счет полного подавления фазы увеличения базального уровня [Ca2+]i (см. рис. 1в).
В NASPM-чувствительных глутаматергических нейронах третьей группы (рис. 2в) амплитуда кальциевых сигналов во время СКA, после удаления DA, и амплитуда ответов на аппликацию DA уменьшались в присутствии NASPM. Поскольку DA не вызывала увеличения базального уровня [Са2+]i в этой субпопуляции (кривая 3 на рис. 1б), что предполагает отсутствие кальций-проводящих КА- или АМРА-рецепторов, а снижение активности глутаматергических нейронов этой популяции в присутствии NASPM коррелирует с повышением активности нейронов, содержащих CP-KARs, (рис. 2а), то можно предположить, что эффект подавления активности обусловлен иннервацией глутаматергических нейронов этой субпопуляции тормозными нейронами, содержащими CP-KARs.
В глутаматергических нейронах четвертой группы, нечувствительных к NASPM и не содержащих СР-КА- или СР-АМРА-рецепторов, амплитуда СКA не изменяется в присутствии NASPM, что подтверждает отсутствие CP-AMPA-рецепторов. Кроме того, сохранение амплитуды кальциевых колебаний, индуцированных DA в присутствии NASPM, указывает на то, что нейроны этой субпопуляции заметно не иннервируются тормозными нейронами, содержащими CP-AMRARs или CP-KARs.
Таким образом, данный эксперимент показывает, что ГАМКергические нейроны, содержащие CP-АМРАRs, иннервируют ГАМКергические нейроны, содержащие CP-КАRs, которые, в свою очередь, контролируют активность значительной популяции глутаматергических нейронов.
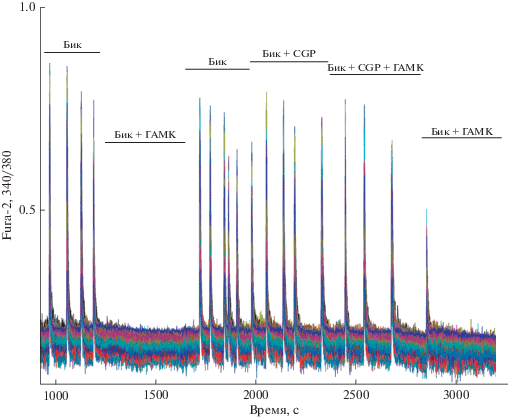
Обычно тормозное действие ГАМК осуществляется через ГАМК(А)- и ГАМК(В)-рецепторы. Поскольку в нашем случае ГАМК(А)-рецепторы заблокированы бикукуллином, то тормозное действие, по-видимому, развивается за счет взаимодействия ГАМК с ГАМК(В)-рецепторами. Ранее было показано, что за способность ГАМК подавлять СКК ответственны в основном метаботропные ГАМК(B)-рецепторы [40]. Для того чтобы показать участие ГАМК(В)-рецепторов в ингибировании СКК в присутствии ингибитора ГАМК(А)-рецепторов, мы провели следующий эксперимент. На рис. 3 показано, что СКК, индуцированные бикукуллином, подавляются ГАМК, что предполагает действие ГАМК через ГАМК(B)-рецептор; отмывка ГАМК восстанавливает колебания. Добавление ГАМК в присутствии ингибитора ГАМК(B)-рецептора, CGP 35 348, не подавляет колебания. Это подтверждает, что ингибирующее действие ГАМК в присутствии бикукуллина осуществляется через ГАМК(B)-рецептор.
Рис. 3.
ГАМК (2 мкМ) ингибирует СКК в присутствии бикукуллина (10 мкМ) и не ингибирует в присутствии ингибитора ГАМК(B)-рецептора CGP 35348 (10 мкМ) и бикукуллина.
DA всегда вызывает увеличение частоты СКК в нейронах в культуре (рис. 1), что указывает на их деполяризацию, по-видимому, из-за активации AMPA-рецепторов (средняя частота колебаний при этом увеличивается от 0.02 до 0.1 Гц). Однако в присутствии NASPM DA вызывает еще большее увеличение частоты СКК (до 0.3Гц на рис. 1в), что может указывать на иннервацию “пейсмекерных” нейронов ГАМКергическими нейронами, содержащими CP-АМРА-рецепторы.
Таким образом, в культуре клеток гиппокампа крысы на 14-17 DIV визуализированы (по характерному быстрому, высокоамплитудному Са2+-ответу на агонисты КА- и АМРА-рецепторов), два подтипа ГАМКергических нейронов, содержащих CP-KA- и СР-AMPA-рецепторы. Показано, что рецепторы могут быть локализованы в различных популяциях ГАМКергических нейронов. Эти нейроны иннервируют различные субпопуляции нейронов. Иннервация тормозных нейронов, содержащих СР-КАRs, ГАМКергическими нейронами, содержащими СP-АMPARs, может представлять собой эффективную отрицательную обратную связь для ограничения повышенной активности нейронов, содержащих СР-КARs, при которой быстрый вход Ca2+ через СР-КАRs может привести к перегрузке митохондрий кальцием и сопутствующей продукции активных форм кислорода [41].
ОБСУЖДЕНИЕ
Регистрация [Ca2+]i при действии агонистов КА- и АМРА-рецепторов позволила визуализировать нейроны, содержащие СР-КА- и СР-АМРА-рецепторы. Ранее было показано, что при развитии нейрональной сети в культуре, через несколько дней возникают СКК, которые в дальнейшем, с возрастом культуры, постепенно рассинхронизируются. Амплитуда Са2+-осцилляций уменьшается и затем СКК прекращаются. Прекращение СКК обусловлено в основном усилением ГАМКергической системы, гиперполяризующей нейроны-мишени. Ингибиторы ГАМК(А)-рецепторов и вещества, деполяризующие мембрану, индуцировали СКК в этих условиях. В отличие от АТРА, который селективно активирует вход Са2+ через СР-КА-рецепторы, DA активирует все АМРА- и КА-рецепторы. Поэтому, кроме повышения [Ca2+]i в нейронах, содержащих СР-АМРА- и КА-рецепторы, DA деполяризует нейроны, содержащие классические не проницаемые для кальция АМРА-рецепторы, что приводит к увеличению частоты СКК. Обе популяции нейронов, в которых DA повышала базальный уровень [Ca2+]i, оказались ГАМКергическими нейронами, что подтверждает известные данные об экспрессии СР-КАRs в тормозных нейронах гиппокампа [7, 8]. Повышение базального уровня [Ca2+]i в тормозных нейронах при действии DA предшествует увеличению частоты СКК в остальных нейронах, что может быть связано с активацией секреции ГАМК тормозными нейронами вследствие быстрого повышения [Са2+]i. Поскольку в этих условиях ГАМК(А)-рецепторы заблокированы бикукуллином, то тормозное действие, по-видимому, проявляется за счет взаимодействия ГАМК с ГАМК(В)-рецепторами. Ранее было показано, что за способность ГАМК подавлять СКК ответственны в основном метаботропные ГАМК(B)-рецепторы [40]. В эксперименте, представленном на рис. 3, мы подтвердили эти данные и показали, что СКК, индуцированные бикукуллином, останавливаются ГАМК, и этот эффект снимается ингибитором ГАМК(В)-рецепторов CGP 35 348.
Нейроны, экспрессирующие СР-АМРА- и СР-КА-рецепторы, представляют различные популяции тормозных нейронов. Причем СР-АМРА-рецепторы локализованы в постсинаптической [15, 17], а СР-КА-рецепторы, по-видимому, в пресинаптической мембране [9, 10, 16] этих нейронов. Таким образом, данные популяции ГАМКергических нейронов могут использовать различный механизм торможения нейронов-мишеней. В присутствии антагониста CP-AMPA-рецепторов, NASPM, изменялись как амплитуда, так и частота СКК как в контроле, так и в присутствии агониста КА-/АМРА-рецепторов, DA. Причем эти изменения были различны в разных субпопуляциях тормозных и возбуждающих нейронов. Прямое, ингибирующее действие NASPM на DA-индуцированное повышение [Са2+]i наблюдалось лишь в одной субпопуляции тормозных нейронов. В нейронах этой субпопуляции NASPM полностью подавлял повышение базального уровня [Ca2+]i под действием DA и уменьшал амплитуду СКК в отсутствии DA, указывая на участие СР-AMRARs в этих процессах. Подавление активности тормозных нейронов, содержащих СР-AMRARs, ингибитором NASPM сопровождалось увеличением активности (амплитуды Са2+-колебаний) другой субпопуляции тормозных нейронов, содержащих СР-КАRs, что указывает на иннервацию ГАМКергических нейронов, содержащих CP-KARs, тормозными нейронами, содержащими СР-AMRARs. По нашим данным и данным литературы, нейроны, содержащие CP-KARs, являются быстроотвечающими [41], а возможное отсутствие десенситизации и различное сродство CP-KARs ГАМКергических нейронов к агонистам [42] могут обеспечить селективный, высокоамплитудный и длительный Са2+-сигнал при активации глутаматом. Такие характеристики Са2+-сигнала ГАМКергических нейронов способствуют эффективному подавлению гипервозбуждения в нейрональной сети. Однако такие свойства СР-КА-рецептора делают нейроны уязвимыми к перегрузке кальцием и требуют эффективного контроля, который, по-видимому, осуществляют ГАМКергические нейроны, содержащие СР-АМРА-рецепторы. Последние, в свою очередь, могут быть защищены от повреждения при гипервозбуждении наличием кальций-связывающих белков в буферных концентрациях [31]. Известно, что быстроразряжающиеся (fast spiking) ГАМКергические нейроны, содержащие СP-АМРАRs, также содержат парвальбумин [24].
Повышение амплитуды СКК и базального уровня [Ca2+]i в тормозных нейронах, содержащих СР-КАRs, при действии DA в присутствии NASPM сопровождалось сильным подавлением активности (амплитуды СКК) в большой популяции глутаматергических нейронов, что указывает на их иннервацию тормозными нейронами, содержащими СР-КАRs. Причины отсутствия иннервации остальных принципиальных нейронов со стороны тормозных нейронов, содержащих СР-АМРА- или КА-рецепторы, нами не изучались. Таким образом, при развитии нейроглиальной культуры гиппокампа происходит самоорганизация нейрональной сети, при которой обнаруживаются взаимодействия между популяциями ГАМКергических нейронов, содержащими CP-KARs и CP-АМРАRs, и популяцией возбуждающих нейронов.
ЗАКЛЮЧЕНИЕ
При культивировании нейроглиальной культуры гиппокампа нейроны самоорганизуются в нейрональную сеть, в которой устанавливаются определенные взаимодействия между популяциями нейронов. Из полученных результатов следует, что для торможения гипервозбуждения в нейрональной сети может включаться отрицательная обратная связь, обусловленная усилением активности популяций ГАМКергических нейронов, содержащих СP-КА- и СР-АМРА-рецепторы. В отличие от Са2+-непроницаемых КА- и АМРА-рецепторов, регулирующих мембранный потенциал, функция СР-КА- и СР-АМРА-рецепторов, по-видимому, состоит в регуляции базального уровня [Ca2+]i. Усиление секреции ГАМК под действием быстрого входа ионов Са2+ через СP-КА-рецепторы обуславливает торможение большой популяции глутаматергических нейронов. Высокая начальная скорость Са2+-ответа нейронов, содержащих СP-КАRs, может определяться более легкой возбудимостью этих нейронов и отсутствием ГАМК(А)-рецепторов на пресинаптической мембране [5]. Такой механизм снятия торможения с ГАМКергических нейронов может обеспечить более быструю, опережающую (глутамат) секрецию ГАМК этими нейронами. Высокая амплитуда Са2+-сигнала и отсутствие десенситизации СP-КАRs также могут быть факторами, способствующими усилению секреции ГАМК. Таким образом, тандем двух популяций ГАМКергических нейронов, содержащих СР-КА- и СР-АМРА-рецепторы, представляет собой механизм контроля активности нейронной сети при гипервозбуждении.
Pабота выполнена пpи финанcовой поддеpжке Комитета науки МОН Pеcпублики Казаxcтан (гpант № AP05133528).
Список литературы
Chávez A.E., Singer J.H., Diamond J.S. 2006. Fast neurotransmitter release triggered by Ca influx through AMPA-type glutamate receptors. Nature. 443 (7112), 705–708.
Campbell S.L., Mathew S.S., Hablitz J.J. 2007. Pre- and postsynaptic effects of kainate on layer II/III pyramidal cells in rat neocortex. Neuropharmacology. 53 (1), 37–47.
Lauri S.E., Delany C., Bortolotto Z.A., Ornstein P.L., Collingridge G.L. 2001. Synaptic activation of a presynaptic kainate receptor facilitates AMPA receptor-mediated synaptic transmission at hippocampal mossy fibre synapses. Neuropharmacology. 41 (8), 907–915.
Xu J., Liu Y., Zhang G.Y. 2008. Neuroprotection of GluK1-containing kainate receptor activation against ischemic brain injury through decreasing tyrosine phosphorylation of N-methyl-D-aspartate receptors mediated by Src kinase. J. Biol. Chem. 283 (43), 29355–29366.
Kononov A.V., Bal’ N.V., Zinchenko V.P. 2012. Control of spontaneous synchronous Ca2+ oscillations in hippocampal neurons by GABAergic neurons containing kainate receptors without desensitization. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology. 6 (2), 215–220.
Cobb S.R., Buhl E.H., Halasy K., Paulsen O., Somogyi P. 1995. Synchronization of neuronal activity inhippocampus by individual GABAergic interneurons. Nature. 378 (6552), 75–78.
Cossart R., Esclapez M., Hirsch J.C., Bernard C., Ben-Ari Y. 1998. GluK1 kainate receptor activation in interneurons increases tonic inhibition of pyramidal cells. Nat. Neurosci. 1 (6), 470–478.
BureauI., Bischoff S., Heinemann S.F., Mulle C. 1999. Kainate receptor-mediated responses in the CA1 field of wild-type and GluR6-deficient mice. J. Neurosci. 19 (2), 653–663.
Sun H.Y., Bartley A.F., Dobrunz L.E. 2009. Calcium-permeable presynaptic kainate receptors involved in excitatory short-term facilitation onto somatostatin interneurons during natural stimulus patterns. J. Neurophysiol. 101 (2), 1043–1055.
Caiati M.D., Sivakumaran S., Cherubini E. 2010. In the developing rat hippocampus, endogenous activation of presynaptic kainate receptors reduces GABA release from mossy fiber terminals. J. Neurosci. 30 (5), 1750–1759.
Lerma J., Marques J. M. 2013. Kainate Receptors in Health and Disease. Neuron. 80 (2), 292–311.
Cossart R., Tyzio R., Dinocourt C., Esclapez M., Hirsch J.C., Ben-Ari Y., Bernard C. 2001. Presynaptic kainate receptors that enhance the release of GABA on CA1 hippocampal interneurons. Neuron. 29 (2), 497–508.
Туровская М.В., Туровский Е.А., Кононов А.В., Зинченко В. П. 2013. Кратковременная гипоксия вызывает селективную гибель ГАМКергических нейронов. Биол. vембраны. 30 (5–6), 479–490.
Christensen J.K., Paternain A.V., Selak S., Ahring P.K., Lerma J. 2004. A mosaic of functional kainate receptors in hippocampal interneurons. J. Neurosci. 24 (41), 8986–8993.
Jiang L., Xu J., Nedergaard M., Kang J. 2001. A kainate receptor increases the efficacy of GABAergic synapses. Neuron. 30 (2), 503–513.
Sakha P., Vesikansa A., Orav E., Heikkinen J., Kukko-Lukjanov T.K., Shintyapina A., Franssila S., Jokinen V., Huttunen H.J., Lauri S.E. 2016. Axonal Kainate Receptors Modulate the Strength of Efferent Connectivity by Regulating Presynaptic Differentiation. Front. Cell Neurosci. 10 (3).
Зинченко В.П., Гайдин С.Г., Теплов И.Ю, Косенков А.М. 2017. Торможение спонтанной синхронной активности нейронов гиппокампа возбуждением ГАМКергических нейронов Биологические мембраны, 34(4), 284–297.
Wang H.X., Gao W.J. 2010. Development of calcium-permeable AMPA receptors and their correlation with NMDA receptors in fast-spiking interneurons of rat prefrontal cortex. J. Physiol. 588, 2823–2838.
Bochet P., Audinat E., Lambolez B., Crepél F., Rossier J., Iino M., Tsuzuki K., Ozawa S. 1994. Subunit composition at the single-cell level explains functional properties of a glutamate-gated channel. Neuron. 12, 383–388.
Albuquerque C., Engelman H.S., Lee C. J., MacDermott A.B. 2001. Detection of neurons expressing calcium- permeable AMPA receptors using kainate-induced cobalt uptake. In: Ion Channel Localization: Methods in Pharmacology and Toxicology. Eds. Lopatin A., Nichols C.G. Humana Press, p. 297–309.
Amakhin D.V., Soboleva E.B., Ergina J.L., Malkin S.L., Chizhov A.V., Zaitsev A.V. 2018. Seizure-induced potentiation of AMPA receptor-mediated synaptic transmission in the entorhinal cortex. Front Cell Neurosci. 12, 486.
Buldakova S.L., Kim K.K., Tikhonov D.B., Magaza-nik L.G. 2007. Selective blockade of Ca2+ permeable AMPA receptors in CA1 area of rat hippocampus. Neuroscience. 144 (1), 88–99.
Chen T., Wang W., Dong Y.L., Zhang M.M., Wang J., Koga K., Liao Y.H., Li J.L., Budisantoso T., Shigemoto R., Itakura M., Huganir R.L., Li Y.Q., Zhuo M. 2014. Postsynaptic insertion of AMPA receptor onto cortical pyramidal neurons in the anterior cingulate cortex after peripheral nerve injury. Mol. Brain. 7, 76.
Asrar S., Zhou Z., Ren W., Jia Z. 2009. Ca2+ Permeable AMPA receptor induced long-term potentiation requires PI3/MAP kinases but not Ca/CaM-dependent kinase II. PLoS ONE. 4 (2), e4339.
Plant K., Pelkey K.A., Bortolotto Z.A., Morita D., Tera-shima A., McBain C.J., Collingridge G.L., Isaac J.T.R. 2006. Transient incorporation of native GluR2-lacking AMPA receptors during hippocampal long-term potentiation. Nat. Neurosci. 9, 602–604.
Yang Y., Wang X-B., Frerking M., Zhou Q. 2008. Delivery of AMPA receptors to perisynaptic sites precedes the full expression of long-term potentiation. Proc. Natl. Acad. Sci. USA. 105, 11388–11393.
Purkey A.M., Woolfrey K.M., Crosby K.C., Stich D.G., Chick W.S., Aoto J, Dell’Acqua M.L. 2018. AKAP150 palmitoylation regulates synaptic incorporation of Ca2+-permeable AMPA receptors to control LTP. Cell Rep. 25 (4), 974–987.
Lujan B., Dagostin A., von Gersdorff H. 2019. Presynaptic diversity revealed by Ca2+-permeable AMPA receptors at the calyx of held synapse. J. Neurosci. 39 (16), 2981–2994.
Dynnik V.V., Kononov A.V., Sergeev A.V., Tankanag A., Zinchenko V.P. 2015. To break or to brake neuronal network accelerated by ammonium ions? PLoS ONE. 10 (7), e0134145.
Turovskaya M.V., Turovsky E.A., Kononov A.V., Zinchenko V.P. 2014. Short-term hypoxia induces a selective death of GABAergic neurons. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology. 8 (1), 125–135.
Туровский Е.А., Зинченко В.П., Гайдин С.Г., Туровская М.В. 2017: Кальций-проводящие белки защищают ГАМКергические нейроны гиппокампа от гипоксии и ишемии in vitro. Биол. мембраны. 34 (5), 68–80.
Kapuscinski J. 1995. DAPI: A DNA-specific fluorescent probe. Biotech. Histochem. 70 (5), 220–233.
Turovskaya M.V., Gaidin S.G., Mal’tseva V.N., Zinchenko V.P., Turovsky E.A. 2019. Taxifolin protects neurons against ischemic injury in vitro via the activation of antioxidant systems and signal transduction pathways of GABAergic neurons. Mol. Cell. Neurosci. 96, 10–24.
Turovsky E.A., Turovskaya M.V., Kononov A.V., Zinchenko V.P. 2013. Short-term episodes of hypoxia induce posthypoxic hyperexcitability and selective death of GABAergic hippocampal neurons. Exp. Neurol. 250, 1–7.
Clarke V.R., Ballyk B.A., Hoo K.H., Mandelzys A., Pellizzari A., Bath C.P., Thomas J., Sharpe E.F., Davies C.H., Ornstein P.L., Schoepp D.D., Kamboj R.K., Collingridge G.L., Lodge D., Bleakman D. 1997. A hippocampal GluK1 kainate receptor regulating inhibitory synaptic transmission. Nature. 389 (6651), 599–603.
Koike M., Iino M, Ozawa S. 1997. Blocking effect of 1-naphthyl acetyl spermine on Ca2+-permeable AMPA receptors in cultured rat hippocampal neurons. Neurosci. Res. 29 (1), 27–36.
Кононов В.А., Баль Н.В., Зинченко В.П. 2011. Вариабельность кальциевых ответов нейронов гиппокампа на агонисты глутаматных рецепторов. Биол. мембраны. 28 (2), 127–136.
Fischer W., Franke H., Scheibler P., Allgaier C., Illes P. 2002. AMPA-induced Ca2+ influx in cultured rat cortical nonpyramidal neurones: pharmacological characterization using fura-2 microfluorimetry. Eur. J. Pharmacol. 438(1–2), 53–62.
Kosenkov A.M., Teplov I.Y., Sergeev A.I., Maiorov S.A., Zinchenko V.P, Gaidin S.G. 2019. Domoic acid suppresses hyperexcitation in the network due to activation of kainate receptors of GABAergic neurons Arch. Biochem. Biophys. 671, 52–61.
Mann E. O., Paulsen O. 2007. Role of GABAergic inhibition in hippocampal network oscillations. Trends Neurosci. 30 (7), 343–349
Carriedo S.G., Yin H.Z., Sensi S.L., Weiss J.H. 1998. Rapid Ca2+ entry through Ca2+-permeable AMPA/kainate channels triggers marked intracellular Ca2+ rises and consequent oxygen radical production. J. Neurosci. 18 (19), 7727–7738.
Braga M.F., Aroniadou-Anderjaska V., Xie J., Li H. 2003. Bidirectional modulation of GABA release by presynaptic glutamate receptor 5 kainate receptors in the basolateral amygdala. J. Neurosci. 23 (2), 442–452.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


