Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 3, стр. 163-174
Модификация гипоксических состояний при фотодинамической терапии
А. Б. Гапеев a, *, Т. Г. Щербатюк b, c
a Институт биофизики клетки Российской академии наук – обособленное подразделение
Федерального государственного бюджетного учреждения науки
“Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”
142290 Московская обл., Пущино, Россия
b Приволжский исследовательский медицинский университет
Министерства здравоохранения Российской Федерации
603950 Нижний Новгород, Россия
c Пущинский государственный естественно-научный институт
142290 Московская обл., Пущино, Россия
* E-mail: a_b_g@mail.ru
Поступила в редакцию 28.05.2019
После доработки 14.10.2019
Принята к публикации 29.10.2019
Аннотация
Фотодинамическая терапия (ФДТ) рассматривается как многообещающий подход к лечению злокачественных новообразований, эффект которой достигается за счет генерации активных форм кислорода при облучении фотосенсибилизатора светом. Активные формы кислорода вызывают прямое уничтожение опухолевых клеток, повреждение сосудов и активируют противоопухолевый иммунитет. Гипоксия опухолевой ткани, значительно снижающая эффективность ФДТ, является серьезным препятствием этого метода. Кроме того, потребление кислорода при ФДТ может еще больше усугубить гипоксию опухоли, что приводит к нежелательным последствиям, таким как множественная лекарственная устойчивость, ангиогенез, инвазивность опухоли и метастазирование. Целью настоящего исследования является обзор современной литературы о достижениях по преодолению или использованию опухолевой гипоксии для повышения терапевтической эффективности ФДТ. Рассмотрены стратегии снижения опухолевой гипоксии путем изменения микроокружения опухоли для улучшения оксигенации, разработки средств доставки кислорода или генерации кислорода in situ, независимой от кислорода ФДТ и ингибирования белков, связанных с гипоксией. Обобщены существующие подходы к использованию гипоксии опухоли при высвобождении лекарственных средств и биоредуктивной терапии.
ВВЕДЕНИЕ
В настоящее время онкологические заболевания занимают второе место среди причин смертности во многих странах мира [1]. Основными методами лечения злокачественных опухолей по-прежнему являются хирургическое вмешательство, радио- и химиотерапия. Эти традиционные методы лечения отличаются наличием значительных побочных эффектов, обладают тяжелой переносимостью и не гарантируют полного выздоровления. Поэтому актуальной проблемой является поиск новых, более эффективных и безопасных методов лечения онкологических заболеваний, а также способов снижения побочных эффектов традиционных методов терапии. Поиск эффективных и щадящих методов лечения онкологических заболеваний ведется по разным направлениям, одним из которых является фотодинамическая терапия (ФДТ) злокачественных новообразований (ЗНО) [2–4]. Фотодинамическая терапия отличается от традиционных методов лечения своей минимальной инвазивностью, удобством и гибкостью, эффективностью и хорошей переносимостью пациентами, что имеет важное клиническое значение [5, 6].
Анализ литературы показывает, что физические воздействия противоопухолевой направленности, будь то ФДТ [4], гипербарическая оксигенация [7], так же как и один из основных методов терапии ЗНО – радиотерапия [8], имеют общие механизмы действия, связанные с развитием свободнорадикальных реакций [9]. В связи с тем, что злокачественные клетки вырабатывают механизмы защиты от любых противоопухолевых средств, используемых при химио- и радиотерапии, крайне актуальной становится задача повышения их эффективности.
Фотодинамическая терапия рака интенсивно применяется в последние 30–40 лет во всем мире. Однако поиск новых способов повышения ее противоопухолевого действия и снижения генотоксического эффекта на нормальные клетки организма остается актуальным [4, 10, 11]. Одним из направлений кислородно-перекисной концепции онкогенеза [12] является активация в опухолевых клетках свободнорадикальных процессов, которые за счет повышения концентрации активных форм кислорода (АФК) приводят, в конечном итоге, к деструкции опухоли. Присутствие кислорода значительно увеличивает повреждение опухоли, преодолевая ее резистентность. Известно, что важной особенностью ЗНО является изменение уровня свободнорадикальных реакций, которое проявляется в повышенной антиоксидантной активности опухолевой ткани, с одной стороны, и истощении антиоксидантной системы защиты организма-опухоленосителя, с другой [13]. В связи с этим предлагается разделить противоопухолевые мероприятия на две группы [12]. Воздействия первой группы направлены на снижение в организме уровня свободнорадикального окисления (СРО), а второй, напротив, связаны с еще большей интенсификацией СРО в опухолевых клетках.
Многие солидные опухоли подвергаются острой гипоксии из-за ряда аномальных физиологических изменений в микроокружении опухоли, включая неконтролируемую пролиферацию опухолевых клеток, бесконтрольный ангиогенез, приводящий к появлению сосудистых мальформаций (патологических связей между венами и артериями) [14], дисфункцию лимфатической системы [15, 16].
В результате гипоксии опухоли терапевтическая эффективность ФДТ значительно снижается, в связи с чем преодоление гипоксии путем оксигенации опухоли было широко признано и исследовано для усиления ФДТ [17]. Кроме того, потребление кислорода при ФДТ еще больше усугубляет гипоксию опухоли, что приводит к множеству нежелательных последствий, таких как резистентность к химиотерапии, радиоустойчивость, усиление ангиогенеза, инвазивность опухоли и метастазирование [18–20].
Целью настоящего исследования является обзор современной литературы о достижениях по преодолению или использованию опухолевой гипоксии для повышения терапевтической эффективности ФДТ.
1. ИСТОРИЯ РАЗВИТИЯ ФДТ
ФДТ основана на воздействии светом определенной длины волны на опухолевую ткань, которая благодаря эффекту усиленной проницаемости и удержания макромолекулярных препаратов [21] селективно накапливает на некоторое время фотосенсибилизаторы (ФС) [22, 23]. Квант света, взаимодействуя с ФС, вызывает фотохимические реакции с образованием синглетного кислорода и свободных радикалов [24]. Основным механизмом ФДТ является повреждение клеток АФК и другими радикалами [25].
В 1900 году наблюдения двух разных исследователей привели к открытию гибели клеток под действием активированных светом химических соединений. Немецкий студент О. Рааб, изучая влияние красителя акридина на парамеции, заметил, что токсичность акридина изменяется в зависимости от действия на него света [26]. В том же году французский невролог Ж. Прайм обнаружил, что перорально вводимый эозин, используемый для лечения пациентов с эпилепсией, вызывает дерматит при облучении кожи солнечным светом [27]. Дальнейшие исследования Г. фон Таппейнера привели к появлению нового термина “Фотодинамическое действие” [28]. Первые исследования на людях были выполнены Ф. Мейером-Бетцем в 1913 году с использованием гематопорфирина, при нанесении которого на кожу ощущалась боль и наблюдалась припухлость на освещенных участках кожи [29]. С использованием производного гематопорфирина позднее было обнаружено, что это соединение накапливалось в опухолях и обладало способностью флуоресцировать [30]. Десять лет спустя было показано, что производные гематопорфирина можно использовать для лечения ЗНО у мышей: наблюдалось торможение роста глиомы в течение нескольких недель после лечения гематопорфирином [31], обнаружено полное уничтожение опухоли молочной железы у мышей с использованием гематопорфирина в сочетании с красным светом [32]. Исследование с участием 25 пациентов со злокачественными опухолями показало полный ответ на ФДТ в 98 из 113 опухолей, частичный ответ в 13 и только две опухоли оказались резистентными к ФДТ [2]. В настоящее время ФДТ используется при лечении онкологических заболеваний кожи, пищевода, легких, желчных протоков, мочевого пузыря, поджелудочной железы, нервной системы, женских репродуктивных органов, предстательной железы, опухолей головы и шеи как самостоятельный метод, так и в качестве элемента комбинированного лечения и при паллиативной помощи [4, 33–36].
2. ПРИНЦИПЫ И МЕХАНИЗМЫ ФДТ
Считается, что большинство ФС продуцируют синглетный кислород, вызывающий окислительное повреждение клеток. Реакция синглетного кислорода с мембранными липидами инициирует перекисное окисление липидов и может привести к разрушению клеточных мембран. Он может реагировать с аминокислотами, что изменяет функциональность жизненно важных белков. Синглетный кислород обладает высокой реакционной способностью, его время жизни составляет около 40 нс, а максимальный радиус действия – 20 нм [37, 38]. Этот радиус действия (меньший, чем диаметр большинства органелл) вместе с локализованной активацией ФС путем облучения только тканей-мишеней теоретически делает ФДТ достаточно специфичной и контролируемой [4].
Клеточный ответ на фотоповреждение сильно зависит от множества факторов, ключевым из которых является локализация ФС [39]. ФДТ вызывает апоптоз, некроз и аутофагию опухолевых клеток в зависимости от локализации и концентрации ФС. Эта способность активировать различные пути гибели клеток делает ФДТ эффективной в отношении устойчивых к апоптозу опухолевых клеток, являющихся основным препятствием для других методов лечения ЗНО [40].
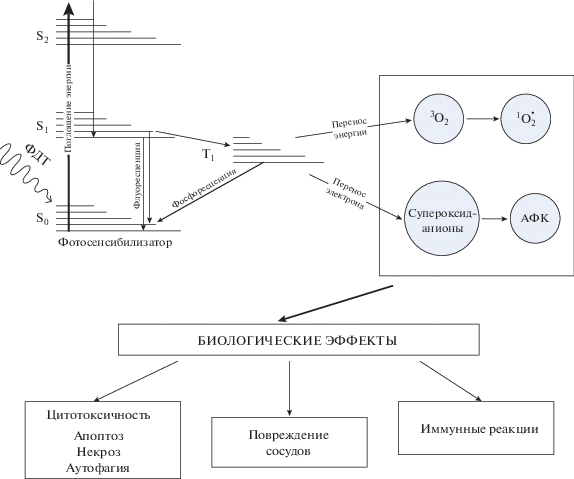
Существует три основных механизма уничтожения опухоли при ФДТ: прямое действие АФК, сосудистые эффекты, иммунные реакции (рис. 1) [41, 42]. Эффект прямого действия АФК на паренхимальные и стромальные клетки опухоли потенциально может быть ослаблен, поскольку генерация АФК зависит от концентрации кислорода. Неравномерная васкуляризация опухолевой ткани приводит к плохой доставке как кислорода, так и ФС, что является препятствием для прямого разрушения опухоли АФК. Для увеличения эффективности используют ФДТ, направленную на разрушение сосудов, снабжающих опухоль питательными веществами и кислородом [43]. Окислительный стресс, индуцируемый ФДТ, усиливает экспрессию белков теплового шока, факторов транскрипции, связанных с воспалением, и высвобождение воспалительных цитокинов [44]. Развивается острая воспалительная реакция и активируется противоопухолевый иммунитет [45]. Все это способствует уничтожению опухоли, детоксикации и регенерации тканей.
Рис. 1.
Молекула фотосенсибилизатора в основном синглетном состоянии (So) возбуждается светом при ФДТ, при этом электрон переходит на орбиту с более высокой энергией (S1). Молекула ФС может возвратиться из возбужденного в основное состояние с флуоресценцией или при внутреннем преобразовании энергии (порядка наносекунд) или за счет инверсии спина возбужденного электрона перейти в возбужденное триплетное состояние (T1). Возбужденное триплетное состояние является относительно долгоживущим (порядка микросекунд). При ФДТ первого типа молекулы ФС в триплетном состоянии могут непосредственно взаимодействовать с молекулами биологического субстрата с образованием свободных радикалов – активных окислителей биологических структур. При ФДТ второго типа ФС в возбужденном триплетном состоянии может передавать энергию триплетному молекулярному кислороду (3O2), что приводит к образованию биологически активного синглетного кислорода ($^{1}{\text{O}}_{2}^{ \bullet }$), либо переносить электрон на супероксидные анионы, что приводит к образованию различных АФК, способных напрямую повреждать биологические макромолекулы. В результате возникают биологические эффекты ФДТ, в первую очередь включающие прямую цитотоксичность: апоптоз, некроз, аутофагия. Возможны непрямые эффекты – через повреждение сосудов (модифицировано по [42]).
К сожалению, существует целый ряд недостатков, которые сдерживают активное применение ФДТ в онкологии. С развитием новых технологий, в том числе с использованием наноматериалов, пытаются усовершенствовать ФС, в частности повысить генерацию синглетного кислорода [47], снизить кожную фототоксичность [47, 48], повысить селективность по отношению к опухолевым клеткам [49, 50], увеличить глубину терапевтического воздействия на ткань [48, 51, 52] и обеспечить целевую доставку ФС [53]. Наличие гипоксических областей в опухолях оказывается одним из основных препятствий при лечении солидных опухолей [54]. Поэтому оксигенация тканей сильно влияет на эффективность ФДТ [17]. Для идеальной ФДТ фотосенсибилизатор должен обладать низкой темновой токсичностью, его доставка должна быть простой, целевой и безболезненной, для активации ФС должно использоваться излучение в ближней инфракрасной области с интенсивностью, необходимой для достаточной генерации синглетного кислорода; высокая селективность опухолей и быстрое выведение ФС из организма должны минимизировать светочувствительность кожи. Дальнейшее развитие ФДТ зависит от разработок новых улучшенных ФС, источников света и режимов облучения, новых модификаций метода в комбинации с другими терапевтическими подходами [4], что повысит эффективность ФДТ в клинической онкологии.
3. ОСНОВНЫЕ ПОДХОДЫ ПРЕОДОЛЕНИЯ ГИПОКСИИ ОПУХОЛЕЙ ПРИ ФДТ
Из-за ограниченной диффузии кислорода в глубокие слои опухолей, включая средние слои и ядро опухоли, давление кислорода в этих областях составляет менее 10 мм рт. ст., что рассматривается как гипоксия опухоли [55]. Хотя такое низкое давление кислорода является фатальным для большинства нормальных клеток, многие опухолевые клетки адаптированы к выживанию в условиях гипоксии [56]. Гипоксические области в солидных опухолях слабо поддаются воздействию ФДТ [54]. Одной из стратегий преодоления опухолевой гипоксии является улучшение оксигенации тканей перед ФДТ. Считается, что использование гипербарического кислорода повышает эффективность ФДТ [7]. Тем не менее, эффективность этой стратегии сильно зависит от используемого протокола и типа опухоли. Для преодоления вызванной ФДТ гипоксии используют более низкую интенсивность светового потока или фракционированное освещение при ФДТ, но такие подходы также не решают проблемы гипоксии [57]. Одним из интересных подходов для преодоления гипоксии является создание специализированных ФС, способных генерировать синглетный кислород в темновые периоды [46]. Доказано, что восстановление оксигенации опухолей с помощью наночастиц повышает терапевтический потенциал радио- и химиотерапии, а также ФДТ [58–60].
Области с низким содержанием кислорода уже присутствуют в опухоли до ФДТ или появляются из-за потребления кислорода при ФДТ или сосудистого коллапса [61]. Нерегулярная сосудистая сеть опухоли уменьшает поступление кислорода в опухолевую ткань. Следовательно, нормализация сосудистой сети опухоли и предотвращение сосудистой обструкции являются многообещающими подходами для улучшения оксигенации опухолевых тканей. В последние десятилетия ряд исследований посвящен созданию благоприятных условий для лечения ЗНО путем изменения микроокружения опухоли, особенно путем ангиостатического лечения [62, 63]. Показано, что антиангиогенное лечение с использованием различных ингибиторов, таких как ингибитор матричной металлопротеиназы приномастат, ингибитор циклооксигеназы-2, NS-398, ингибиторы фактора роста эндотелия сосудов (VEGF), EMAP-II и IM862, заметно усиливали противоопухолевую эффективность ФДТ [64–66]. Эти ингибиторы способны регулировать, а не разрушать сосудистую сеть опухоли, что облегчает проникновение кислорода и лекарственных средств в солидную опухоль. Продемонстрировано, что ингибиторы тирозинкиназы, акситиниб или сорафениб, обеспечивают усиление противоопухолевого эффекта ФДТ за счет подавления экспрессии рецепторов 2-го типа к фактору роста эндотелия сосудов (VEGFR-2) в сосудистой сети опухоли [67]. Установлена повышенная эффективность ФДТ благодаря введению гепарина – антикоагулянта, который используется в клинике для предотвращения внутрисосудистой коагуляции и тромбоза за счет усиления активности антитромбина III [68]. Однако усиление или восстановление кровотока под действием этих препаратов является кратковременным, что не обеспечивает необходимый приток кислорода и снижает терапевтический эффект ФДТ.
Разрабатывалась альтернативная стратегия перестройки микроокружения опухоли путем непосредственного разрушения внеклеточного матрикса гиалуронидазой, что приводило к усиленному эффекту “повышенной проницаемости и удержания” фотосенсибилизатора и насыщению опухоли кислородом [69]. Учитывая, что гиалуронан является ключевым компонентом внеклеточного матрикса, который служит гидратированным гелем для поддержки прогрессирования опухоли, вводили гиалуронидазу в солидную опухоль, чтобы разрушить гиалуронан до применения ФДТ. Разложение гиалуронана снижало давление внутритканевого кровотока и увеличивало плотность кровеносных сосудов опухоли, что заметно улучшало оксигенацию опухолевых тканей и способствовало терапевтическому эффекту ФДТ. Таким образом, изменение аномальных характеристик микроокружения опухоли может быть эффективным и надежным подходом для усиления противоопухолевого эффекта ФДТ.
Принимая во внимание способность эритроцитов транспортировать кислород в крови благодаря присутствию молекул гемоглобина, Liu et al. (2017) предложили гипотезу: “Эритроциты, используемые в качестве носителей для доставки ФС, могут транспортировать достаточное количество кислорода к опухолевым тканям, что будет способствовать преодолению существующей гипоксии в опухоли и пополнит содержание кислорода во время ФДТ” [70]. Основываясь на этой гипотезе, исследователи разработали нанокапсулы ферритина, инкапсулирующие большое количество ФС (ZnF16Pc), которые затем были конъюгированы с поверхностью эритроцитов [71]. В этой конструкции ФС постоянно находился в области с высоким содержанием кислорода, и, таким образом, скорость фотореакции, а также уровень образования синглетного кислорода были заметно выше, чем в простой смеси эритроцитов и ФС. ФДТ с участием эритроцитов продемонстрировала более высокий уровень подавления подкожно имплантированных опухолей U87MG. В целом, эритроциты, как эндогенный компонент с хорошей биосовместимостью в организме человека, обладают большими возможностями для оказания помощи при клиническом лечении ЗНО с помощью ФДТ. Молекулы гемоглобина сами по себе могут использоваться в качестве автономного переносчика кислорода для преодоления состояния гипоксии в опухолях. Синтезирован ФС второго поколения – конъюгированный с гемоглобином сополимер, который имеет мицеллярную форму для инкапсуляции фталоцианина цинка (ZnPc) [72]. Было показано, что получающиеся в результате наномицеллы генерируют больше АФК в клетках HeLa, чем мицеллы, нагруженные ФС без гемоглобина. При связывании ФС (индоцианиновый зеленый) и гемоглобина уровень производства АФК значительно возрастает по сравнению со свободным ФС [73].
Перфторуглероды, другой тип переносчиков кислорода, недавно были интегрированы с ФДТ для обеспечения непрерывной подачи кислорода. Перфторуглероды – это синтетические органические молекулы, состоящие из атомов углерода и фтора с формулой CxFy. Благодаря своей химической стабильности, низкому поверхностному натяжению и вязкости, а также уникальным липофобным и гидрофобным свойствам перфторуглероды широко используются в медицине в качестве контрастных веществ для процедур ультразвуковых исследований и магнитно-резонансной томографии, а также в качестве кровезаменителей [74]. Высокая электроотрицательность фтора обеспечивает перфторуглеродам большее по сравнению с эритроцитами сродство к кислороду [75]. Важно, что перфторуглероды также обладают хорошей биосовместимостью, не вызывают побочных эффектов in vivo и могут эффективно выводиться с мочой или через кожные поры. Обогащенные кислородом капли перфторуглеродной эмульсии были использованы для усиления ФДТ [76]. Стоит отметить, что время жизни генерированных АФК в перфторуглеродной эмульсии при ФДТ in vivo было намного больше, чем в воде или в клеточной среде. Впоследствии была синтезирована серия наномицелл с различным соотношением пентафторфенила к порфирину, и обнаружено, что производство синглетного кислорода увеличивается с ростом содержания пентафторфенила [77]. Предложен метод использования клинически адаптированного ультразвука в качестве вспомогательного инструмента для комбинированного применения ФДТ с перфторуглеродами [78]. При использовании ультразвука малой мощности в области опухоли высвобождение кислорода, растворенного в нанокаплях перфторуглеродной эмульсии, может быть значительно ускорено. Было продемонстрировано, что стратегия оксигенации, стимулируемая ультразвуком, может снизить локальную гипоксию опухоли и, таким образом, достигается значительное повышение эффективности ФДТ и радиотерапии.
Перекись водорода разлагается на воду и кислород под действием каталазы. Была предложена концепция совместной доставки каталазы и ФС для повышения эффективности ФДТ посредством производства кислорода in situ в опухолевых тканях [79–81]. Каталаза обладала сильной способностью разлагать перекись водорода в микроокружении опухоли и, таким образом, увеличивала оксигенацию опухоли, снижая опухолевую гипоксию.
В отличие от стандартной ФДТ, основанной на использовании кислорода для получения цитотоксичных АФК, ФДТ без кислорода могла бы дать большие преимущества для лечения опухолей в условиях гипоксии. Разработана разновидность пептидомиметиков, полученных из диарилэтена, которые могут генерировать АФК при освещении видимым светом без участия кислорода [82]. Пептидомиметик состоит из фотопереключаемого диарилэтенового ядра и природного пептидного антибиотика грамицидина. Обнаружено, что генерируемый ультрафиолетом пептидомиметический изомер проявляет цитотоксическую активность при освещении видимым светом, что позволяет проводить лечение опухолей с помощью такой бескислородной ФДТ.
Гипоксия является одним из основных признаков опухолевой ткани [83]. Индуцируемый гипоксией фактор-1 (HIF-1), состоящий из кислород-независимой субъединицы (HIF-1β) и регулируемой кислородом субъединицы (HIF-1α), тесно связан с гипоксией опухоли и служит большим препятствием для ФДТ [20]. Субъединица HIF-1α деградирует в нормоксических клетках, но имеет тенденцию димеризоваться с помощью HIF-1β с образованием HIF-1 и транслоцироваться в ядро в гипоксических клетках. После этого активный HIF-1 связывается с различными чувствительными к гипоксии генами, необходимыми для ангиогенеза, гликолиза и выживания опухолевых клеток. Применение ФДТ еще более усугубляет гипоксию опухоли, что стимулирует экспрессию VEGF, сосудистый рост, и тем самым может приводить к пролиферации опухолевых клеток и метастазированию. Таким образом, возможен альтернативный подход, который не связан непосредственно с гипоксией, но снимает гипоксические осложнения путем снижения уровня HIF-1 [84]. Целенаправленное снижение HIF-1α может быть перспективным методом для повышения эффективности ФДТ. Разработаны наночастицы для доставки малых интерферирующих РНК субъединицы HIF-1α в сигма-рецептор, экспрессируемый клетками рака ротовой полости человека SAS и плоскоклеточной карциномы человека SCC4, при фотосан-опосредованной ФДТ [85]. Экспрессия HIF-1α эффективно снижалась благодаря эффекту РНК-интерференции, что приводило к синергическому с ФДТ эффекту ингибирования роста опухолевых клеток. Показано, что низкомолекулярный ингибитор HIF-1α акрифлавин, инкапсулированный с фталоцианином цинка в катионных липосомах, может эффективно связываться с HIF-1α и блокировать димеризацию HIF-1α и HIF-1β, тем самым сенсибилизируя гипоксические опухолевые клетки к ФДТ [86]. Комбинированное действие акрифлавина и ФДТ приводило к 3-кратному увеличению активности каспаз 3 и 7 в условиях гипоксии. Разработан фотосенсибилизатор BODIPY, конъюгированный с ацетазоламидом, ингибитором карбоангидразы IX, связанного с гипоксией фермента, который является маркером отдаленных метастазов и плохой выживаемости онкологических больных [87]. Ингибирование карбоангидразы IX может смягчить гипоксические эффекты, вызванные ФДТ, и повысить терапевтическую эффективность.
Гипоксические состояния могут быть в значительной степени преодолены путем применения озона [88], что было показано многолетними исследованиями, проведенными под эгидой Ассоциации российских озонотерапевтов. Доказано, что озон способен улучшить кровообращение и доставку кислорода в ишемизированные ткани [89, 90], устранить хронический окислительный стресс путем активизации антиоксидантной системы [91], вызывать активацию иммунной системы [92]. Принимая во внимание, что озонотерапия может уменьшить опухолевую гипоксию, привести к менее агрессивному поведению опухоли и служить действенным адъювантом во время ФДТ, проведены исследования по разработке способа повышения противоопухолевой эффективности ФДТ. Предварительно на штамме карциномы почки крыс PA были исследованы генотоксические эффекты ФДТ для прогнозирования ответа опухоли на это воздействие [93]. Разработан способ, обеспечивающий повышение эффективности ФДТ за счет оптимизации выбора концентрации озона и режима введения озонированного физиологического раствора после сеансов ФДТ [94], и показано его слабое генотоксическое действие на ткани, не вовлеченные в опухолевый процесс [95].
Возможно, синергизм озонотерапии и ФДТ имеет большой потенциал и в клинических направлениях. Пока только в единичных исследованиях на практике сравнивается влияние озона и ФДТ [96]. Комбинированное действие озона и ФДТ на основе управления интенсивностью и направленностью окислительных процессов в организме-опухоленосителе может стать весьма перспективным при лечении ЗНО.
Несмотря на определенные успехи, достигнутые в преодолении гипоксии, в настоящее время ФДТ как отдельный противоопухолевый метод все еще не позволяет полностью элиминировать солидные опухоли. Более того, потребление большого количества кислорода и повторное применение ФДТ могут еще больше ухудшить микроокружение опухоли и привести к ряду неблагоприятных последствий, таким как устойчивость к терапии, инвазивность и метастазирование. Чтобы решить эту проблему, ФДТ нужно сочетать с другими подходами к лечению ЗНО, например, с химиотерапией.
4. ИСПОЛЬЗОВАНИЕ ФДТ-ИНДУЦИРОВАННОЙ ГИПОКСИИ В КОМБИНАЦИИ С ЧУВСТВИТЕЛЬНЫМИ К ГИПОКСИИ ПРЕПАРАТАМИ
ФДТ-индуцированная гипоксия может быть использована при совместном лечении с терапевтическими препаратами, которые активируются в условиях низкого содержания кислорода. Обострение гипоксического состояния при ФДТ может служить высокоспецифичным триггером, который обеспечивает избирательную доставку или активацию лекарственных средств непосредственно в опухоли, реализуя тем самым, противоопухолевый эффект с минимальной системной токсичностью. Имеются сведения о реагирующих на гипоксию химических компонентах, таких как нитрогруппы, хиноны, алифатические N-оксиды, ароматические N-оксиды и переходные металлы [97]. Разработаны активируемые гипоксией хитозановые наночастицы с нитроимидазольными группами для достижения селективного высвобождения лекарственного средства как при внутренних (гипоксия), так и внешних (свет) триггерах [98]. В связи с наличием фрагментов, реагирующих на гипоксию, высвобождение ФС и противоопухолевых препаратов специфически происходило в гипоксических опухолевых клетках [99, 100].
Другим привлекательным методом использования гипоксии является совместная доставка ФС и биоредуктивных пролекарств, химически модифицированных форм лекарственных средств, которые в биологических средах в результате метаболических процессов превращаются в собственно лекарства. Они могут обладать селективной токсичностью для опухолевых клеток. Разработана наноструктура для совместной доставки ФС и тирапазамина [101]. Тирапазамин, типичное биоредуктивное пролекарство, может превращаться в цитотоксические радикалы с помощью различных внутриклеточных редуктазных ферментов. В нормоксических условиях эти радикалы легко окисляются до авирулентного исходного соединения, теряя цитотоксичность. В условиях гипоксии радикалы тирапазамина вызывают сильное повреждение клеток. Основываясь на этом свойстве, гипоксия, индуцированная ФДТ в опухолях, использовалась для активации тирапазамина, обеспечивая синергический эффект в уничтожении опухолевых клеток. Наночастицы мезопористого диоксида кремния с инкапсулированными ФС и тирапазамином также продемонстрировали значимый противоопухолевый эффект при ФДТ [102]. Другие биоредуктивные пролекарства, например, TH-302, PR-104A и баноксантрон, хорошо изучены в клинических испытаниях и, как сообщается, демонстрируют сильную цитотоксичность, активируемую гипоксией [103–105]. Они редко используются совместно с ФДТ, однако их противоопухолевый потенциал в сочетании с ФДТ заслуживает особого внимания, поскольку ФДТ обладает способностью усиливать гипоксию опухолей.
ЗАКЛЮЧЕНИЕ
Фотодинамическая терапия из-за ее минимальной инвазивности, относительной простоты процедур и высокой эффективности может стать многообещающей противоопухолевой технологией. Однако гипоксия опухолевой ткани, присущая солидным опухолям сама по себе и индуцируемая ФДТ, является критической проблемой ФДТ. Рассмотренные подходы преодоления гипоксии продемонстрировали возможности для улучшения оксигенации в опухолевых тканях. Следует отметить, что ФДТ кроме опухолевой гипоксии сталкивается с множеством других проблем, таких как ограниченная глубина проникновения света, нежелательная токсичность ФС для нормальных тканей при облучении светом, специфическая доставка ФС для глубоких опухолей и др. Разрабатываемые ФС должны соответствовать требованиям биосовместимости, биоразлагаемости, простоты и управляемости. Эти проблемы требуют разработки многофункциональных носителей, которые могут синергически преодолевать системные барьеры для обеспечения максимальной противоопухолевой эффективности. Побочным эффектам, вызываемым ФДТ, таким как инвазия опухоли и метастазирование, должно быть уделено отдельное особое внимание, поскольку им принадлежит известная роль в рецидивировании. Ожидается, что подходы к преодолению гипоксии и использованию гипоксии откроют новый путь для ФДТ, расширяя ее терапевтические возможности для клинического лечения онкологических заболеваний.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-02-00667.
Список литературы
Давыдов М.И., Сельчук В.Ю., Никитаев В.Г., Нагорнов О.В., Проничев A.Н., Дмитриева В.В., Поляков Е.В., Расулов А.О., Кононец B.П., Мелихов С.А., Акимов И.С., Айдунбеков З.М., Кадашев В.И., Лаврова А.А., Голованова В.К., Пашнюк А.А. 2015. Физические методы исследований в экспертных системах диагностики онкологических заболеваний. Краткие сообщения по физике Физического ин-та им. П.Н. Лебедева РАН. 42 (8), 22–26.
Dougherty T.J., Kaufman J.E., Goldfarb A., Weishaupt K.R., Boyle D., Mittleman A. 1978. Photoradiation therapy for the treatment of malignant tumors. Cancer Res. 38, 2628–2635.
Куценюк В.В., Гамалия Н.Ф. 2003. Фотодинамическая терапия злокачественных опухолей. Онкология. 5, 69–72.
van Straten D., Mashayekhi V., de Bruijn H.S., Oliveira S., Robinson D.J. 2017. Oncologic photodynamic therapy: Basic principles, current clinical status and future directions. Cancers (Basel). 9 (2), pii E19.
Dąbrowski J.M., Arnaut L.G. 2015. Photodynamic therapy (PDT) of cancer: from local to systemic treatment. Photochem. Photobiol. Sci. 14 (10), 1765–1780.
Mehraban N., Freeman H.S. 2015. Developments in PDT sensitizers for increased selectivity and singlet oxygen production. Materials (Basel). 8 (7), 4421–4456.
Moen I., Stuhr L.E. 2012. Hyperbaric oxygen therapy and cancer – A review. Target Oncol. 7, 233–242.
Ярмоненко С.П., Вайнсон А.А. 2004. Радиобиология человека и животных. Учебное пособие. М.: Высшая школа. 549 с.
Владимиров Ю.А., Потапенко А.Я. 2006. Физико-химические основы фотобиологических процессов. М.: Дрофа. 285 с.
Барун В.В., Иванов А.П. 2012. Температурный режим биологической ткани при фотодинамической терапии. Биофизика сложных систем. 57 (1), 120–129.
Санарова Е.В., Ланцова А.В., Дмитриева М.В., Смирнова З.С., Оборотова Н.А. 2014. Фотодинамическая терапия – способ повышения селективности и эффективности лечения опухолей. Рос. биотерапевт. журн. 13, 109–118.
Лю Б.И., Шайхутдинов Е.М. 1991. Физико-химические и биокибернетические аспекты онкогенеза. Алма-Ата: Гылым. 270 с.
Козлов Ю.П. 1973. Свободные радикалы и их роль в нормальных и патологических процессах. М.: Изд-во МГУ. 175 с.
Anand S., Majeti B.K., Acevedo L.M., Murphy E.A., Mukthavaram R., Scheppke L., Huang M., Shields D.J., Lindquist J.N., Lapinski P.E., King P.D., Weis S.M., Cheresh D.A. 2010. MicroRNA-132-mediated loss of p120RasGAP activates the endothelium to facilitate pathological angiogenesis. Nat Med. 16 (8), 909–914.
Li S., Meng W., Guan Z., Guo Y., Han X. 2016. The hypoxia-related signaling pathways of vasculogenic mimicry in tumor treatment. Biomed. Pharmacother. 80, 127–135.
Dang J., He H., Chen D., Yin L. 2017. Manipulating tumor hypoxia toward enhanced photodynamic therapy (PDT). Biomater. Sci. 5 (8), 1500–1511.
Price M., Heilbrun L., Kessel D. 2013. Effects of the oxygenation level on formation of different reactive oxygen species during photodynamic therapy. Photochem. Photobiol. 89, 683–686.
Tsai Y.P., Wu K.J. 2012. Hypoxia-regulated target genes implicated in tumor metastasis. J. Biomed. Sci. 19, 102.
Liu Z.J., Semenza G.L., Zhang H.-F. 2015. Hypoxia-inducible factor 1 and breast cancer metastasis. J. Zhejiang University Science B. 16 (1), 32–43.
Zeng W., Liu P., Pan W., Singh S.R., Wei Y. 2015. Hypoxia and hypoxia inducible factors in tumor metabolism. Cancer Lett. 356 (2 Pt A), 263–267.
Maeda H., Tsukigawa K., Fang J. 2016. A retrospective 30 years after discovery of the enhanced permeability and retention effect of solid tumors: Next-generation chemotherapeutics and photodynamic therapy – problems, solutions, and prospects. Microcirculation. 23 (3), 173–182.
Узденский А.Б. 2010. Клеточно-молекулярные механизмы фотодинамической терапии. М.: Наука. 321 с.
Maeda H., Nakamura H., Fang J. 2013. The EPR effect for macromolecular drug delivery to solid tumors: Improvement of tumor uptake, lowering of systemic toxicity, and distinct tumor imaging in vivo. Adv. Drug Deliv. Rev. 65, 71–79.
Dolmans D.E., Fukumura D., Jain R.K. 2003. Photodynamic therapy for cancer. Nat. Rev. Cancer. 3, 380–387.
Bacellar I.O., Tsubone T.M., Pavani C., Baptista M.S. 2015. Photodynamic efficiency: From molecular photochemistry to cell death. Int. J. Mol. Sci. 16, 20523–20559.
Raab O. 1900. Uber die wirkung fluoreszierender stoffe auf infusorien. Zeitung Biol. 39, 524–526 (in German).
Prime J. 1900. Des Accidents Toxiques Prodult par l’Eosinate se Sodium. 2nd ed. Jouve et Boyer: Paris, France.
Von Tappeiner H.A., Jodlbauer A. 1907. Die Sensibilisierende Wirkung Fluorescierender Substanzen: Gesammelte Untersuchungen uber die Photodynamische Erscheinung. F.C.W. Vogel.: Leipzig, Germany (in German).
Meyer-Betz F. 1913. Untersuchungen uber die biologische photodynamische Wirkung des Hematoporphyrins und anderer Derivative des Blut und Galenafarbstoffs. Dtsch. Arch. Klin. 112, 476–503.
Lipson R.L., Baldes E.J., Olsen A.M. 1961. The use of a derivative of hematoporhyrin in tumor detection. J. Natl. Cancer Inst. 26, 1–11.
Diamond I., Granelli S.G., McDonagh A.F., Nielsen S., Wilson C.B., Jaenicke R. 1972. Photodynamic therapy of malignant tumours. Lancet. 2, 1175–1177.
Dougherty T.J., Grindey G.B., Fiel R., Weishaupt K.R., Boyle D.G. 1975. Photoradiation therapy. II. Cure of animal tumors with hematoporphyrin and light. J. Natl. Cancer Inst. 55, 115–121.
Agostinis P., Berg K., Cengel K.A., Foster T.H., Girotti A.W., Gollnick S.O., Hahn S.M., Hamblin M.R., Juzeniene A., Kessel D., Korbelik M., Moan J., Mroz P., Nowis D., Piette J., Wilson B.C., Golab J. 2011. Photodynamic therapy of cancer: An update. CA Cancer J. Clinicians. 61, 250–281.
He C., Liu D., Lin W. 2015. Self-assembled core-shell nanoparticles for combined chemotherapy and photodynamic therapy of resistant head and neck cancers. ACS Nano. 9 (1), 991–1003.
Шейко Е.А., Сустретов В.А., Шихлярова А.И. 2015. Фотодинамическая терапия в онкологии кожи (обзор литературы). Межд. журн. прикладных и фундаментальных исследований. 10, 658–665.
Филоненко Е.В., Серова Л.Г. 2016. Фотодинамическая терапия в клинической практике. Biomed. Photonics. 5 (2), 26–37.
Moan J., Berg K. 1991. The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen. Photochem. Photobiol. 53, 549–553.
Dysart J.S., Patterson M.S. 2005. Characterization of Photofrin photobleaching for singlet oxygen dose estimation during photodynamic therapy of MLL cells in vitro. Phys. Med. Biol. 50, 2597–2616.
Henderson B.W., Dougherty T.J. 1992. How does photodynamic therapy work? Photochem. Photobiol. 55, 145–157.
Igney F.H., Krammer P.H. 2002. Death and anti-death: Tumour resistance to apoptosis. Nat. Rev. Cancer. 2, 277–288.
Milla Sanabria L., Rodriguez M.E., Cogno I.S., Rumie Vittar N.B., Pansa M.F., Lamberti M.J., Rivarola V.A. 2013. Direct and indirect photodynamic therapy effects on the cellular and molecular components of the tumor microenvironment. Biochim. Biophys. Acta. 1835 (1), 36–45.
Brodin N.P., Guha C., Tome W.A. 2015. Photodynamic therapy and its role in combined modality anticancer treatment. Technol. Cancer Res. Treat. 14 (4), 355–368.
Krzykawska-Serda M., Dabrowski J.M., Arnaut L.G., Szczygiel M., Urbanska K., Stochel G., Elas M. 2014. The role of strong hypoxia in tumors after treatment in the outcome of bacteriochlorin-based photodynamic therapy. Free Radic. Biol. Med. 73, 239–251.
Reginato E., Wolf P., Hamblin M.R. 2014. Immune response after photodynamic therapy increases anti-cancer and anti-bacterial effects. World J. Immunol. 4, 1–11.
Shams M., Owczarczak B., Manderscheid-Kern P., Bellnier D.A., Gollnick S.O. 2015. Development of photodynamic therapy regimens that control primary tumor growth and inhibit secondary disease. Cancer Immunol. Immunother. 64, 287–297.
Turan I.S., Yildiz D., Turksoy A., Gunaydin G., Akkaya E.U. 2016. A bifunctional photosensitizer for enhanced fractional photodynamic therapy: Singlet oxygen generation in the presence and absence of light. Angew. Chem. Int. Ed. 55, 2875–2878.
Цыб А.Ф., Каплан М.А., Романко Ю.С., Попучиев В.В. 2009. Фотодинамическая терапия. М.: Медицинское информационное агентство. 212 с.
O’Connor A.E., Gallagher W.M., Byrne A.T. 2009. Porphyrin and nonporphyrin photosensitizers in oncology: Preclinical and clinical advances in photodynamic therapy. Photochem. Photobiol. 85, 1053–1074.
Ormond A.B., Freeman H.S. 2013. Dye sensitizers for photodynamic therapy. Materials. 6, 817–840.
Rehman F.U., Zhao C., Jiang H., Wang X. 2016. Biomedical applications of nano-titania in theranostics and photodynamic therapy. Biomater Sci. 4 (1), 40–54.
Меерович И.Г., Меерович Г.А., Оборотова Н.А., Барышников А.Ю. 2006. Распределение света по глубине опухолевого очага и эффективность использования терапевтического излучения при фотодинамической терапии. Рос. биотерапевт. журн. 5 (3), 93–97.
Fan W., Huang P., Chen X. 2016. Overcoming the Achilles’ heel of photodynamic therapy. Chem. Soc. Rev. 45 (23), 6488–6519.
Yoon I., Li J.Z., Shim Y.K. 2013. Advance in photosensitizers and light delivery for photodynamic therapy. Clin. Endosc. 46, 7–23.
Casas A., Di Venosa G., Hasan T., Al B. 2011. Mechanisms of resistance to photodynamic therapy. Curr. Med. Chem. 18, 2486–2515.
Bennewith K.L., Dedhar S. 2011. Targeting hypoxic tumour cells to overcome metastasis. BMC Cancer. 11, 504.
Seidi K., Jahanban-Esfahlan R., Zarghami N. 2017. Tumor rim cells: From resistance to vascular targeting agents to complete tumor ablation. Tumour Biol. 39 (3), 1010428317691001.
Middelburg T.A., de Bruijn H.S., van der Ploeg-van den Heuvel A., Neumann H.A., Robinson D.J. 2013. The effect of light fractionation with a 2-h dark interval on the efficacy of topical hexyl-aminolevulinate photodynamic therapy in normal mouse skin. Photodiagn. Photodyn. Ther. 10, 703–709.
Ge J., Lan M., Zhou B., Liu W., Guo L., Wang H., Jia Q., Niu G., Huang X., Zhou H., Meng X., Wang P., Lee C.S., Zhang W., Han X. 2014. A graphene quantum dot photodynamic therapy agent with high singlet oxygen generation. Nat. Commun. 5, 4596.
Gao S., Zhang L., Wang G., Yang K., Chen M., Tian R., Ma Q., Zhu L. 2016. Hybrid graphene/Au activatable theranostic agent for multimodalities imaging guided enhanced photothermal therapy. Biomaterials. 79, 36–45.
Jahanban-Esfahlan R., de la Guardia M., Ahmadi D., Yousefi B. 2018. Modulating tumor hypoxia by nanomedicine for effective cancer therapy. J. Cell. Physiol. 233 (3), 2019–2031.
Hockel M., Vaupel P. 2001. Tumor hypoxia: Definitions and current clinical, biologic, and molecular aspects. J. Natl. Cancer Inst. 93, 266–276.
Jiang F., Zhang X., Kalkanis S.N., Zhang Z., Yang H., Katakowski M., Hong X., Zheng X., Zhu Z., Chopp M. 2008. Combination therapy with antiangiogenic treatment and photodynamic therapy for the nude mouse bearing U87 glioblastoma. Photochem. Photobiol. 84 (1), 128–137.
Ariffin A.B., Forde P.F., Jahangeer S., Soden D.M., Hinchion J. 2014. Releasing pressure in tumors: What do we know so far and where do we go from here? A review. Cancer Res. 74 (10), 2655–2662.
Ferrario A., von Tiehl K.F., Rucker N., Schwarz M.A., Gill P.S., Gomer C.J. 2000. Antiangiogenic treatment enhances photodynamic therapy responsiveness in a mouse mammary carcinoma. Cancer Res. 60 (15), 4066–4069.
Ferrario A., Von Tiehl K., Wong S., Luna M., Gomer C.J. 2002. Cyclooxygenase-2 inhibitor treatment enhances photodynamic therapy-mediated tumor response. Cancer Res. 62 (14), 3956–3961.
Ferrario A., Chantrain C.F., von Tiehl K., Buckley S., Rucker N., Shalinsky D.R., Shimada H., DeClerck Y.A., Gomer C.J. 2004. The matrix metalloproteinase inhibitor prinomastat enhances photodynamic therapy responsiveness in a mouse tumor model. Cancer Res. 64 (7), 2328–2332.
Weiss A., van Beijnum J.R., Bonvin D., Jichlinski P., Dyson P.J., Griffioen A.W., Nowak-Sliwinska P. 2014. Low-dose angiostatic tyrosine kinase inhibitors improve photodynamic therapy for cancer: Lack of vascular normalization. J. Cell. Mol. Med. 18 (3), 480–491.
Yang L., Wei Y., Xing D., Chen Q. 2010. Increasing the efficiency of photodynamic therapy by improved light delivery and oxygen supply using an anticoagulant in a solid tumor model. Lasers Surg. Med. 42 (7), 671–679.
Gong H., Chao Y., Xiang J., Han X., Song G., Feng L., Liu J., Yang G., Chen Q., Liu Z. 2016. Hyaluronidase to enhance nanoparticle-based photodynamic tumor therapy. Nano Lett. 16 (4), 2512–2521.
Liu R., Spicer G., Chen S., Zhang H.F., Yi J., Backman V. 2017. Theoretical model for optical oximetry at the capillary level: Exploring hemoglobin oxygen saturation through backscattering of single red blood cells. J. Biomed. Opt. 22 (2), 25002.
Tang W., Zhen Z., Wang M., Wang H., Chuang Y.J., Zhang W., Wang G.D., Todd T., Cowger T., Chen H., Liu L., Li Z., Xie J. 2016. Red blood cell-facilitated photodynamic therapy for cancer treatment. Adv. Funct. Mater. 26, 1757–1768.
Wang S., Yuan F., Chen K., Chen G., Tu K., Wang H., Wang L.Q. 2015. Synthesis of hemoglobin conjugated polymeric micelle: A ZnPc carrier with oxygen self-compensating ability for photodynamic therapy. Biomacromolecules. 16 (9), 2693–2700.
Luo Z., Zheng M., Zhao P., Chen Z., Siu F., Gong P., Gao G., Sheng Z., Zheng C., Ma Y., Cai L. 2016. Self-monitoring artificial red cells with sufficient oxygen supply for enhanced photodynamic therapy. Sci. Rep. 6, 23393.
Chen J., Pan H., Lanza G.M., Wickline S.A. 2013. Perfluorocarbon nanoparticles for physiological and molecular imaging and therapy. Adv. Chronic Kidney Dis. 20 (6), 466–478.
Kaneda M.M., Caruthers S., Lanza G.M., Wickline S.A. 2009. Perfluorocarbon nanoemulsions for quantitative molecular imaging and targeted therapeutics. Ann. Biomed. Eng. 37 (10), 1922–1933.
Cheng Y., Cheng H., Jiang C., Qiu X., Wang K., Huan W., Yuan A., Wu J., Hu Y. 2015. Perfluorocarbon nanoparticles enhance reactive oxygen levels and tumour growth inhibition in photodynamic therapy. Nat. Commun. 6, 8785.
Que Y., Liu Y., Tan W., Feng C., Shi P., Li Y., Huang X. 2016. Enhancing photodynamic therapy efficacy by using fluorinated nanoplatform. Acs. Macro Lett. 5, 168–173.
Song X., Feng L., Liang C., Yang K., Liu Z. 2016. Ultrasound triggered tumor oxygenation with oxygen-shuttle nanoperfluorocarbon to overcome hypoxia-associated resistance in cancer therapies. Nano Lett. 16 (10), 6145–6153.
Tang L., Yang X., Yin Q., Cai K., Wang H., Chaudhury I., Yao C., Zhou Q., Kwon M., Hartman J.A., Dobrucki I.T., Dobrucki L.W., Borst L.B., Lezmi S., Helferich W.G., Ferguson A.L., Fan T.M., Cheng J. 2014. Investigating the optimal size of anticancer nanomedicine. Proc. Natl. Acad. Sci. USA. 111 (43), 15344–15349.
Chen H., Tian J., He W., Guo Z. 2015. H2O2-activatable and O2-evolving nanoparticles for highly efficient and selective photodynamic therapy against hypoxic tumor cells. J. Am. Chem. Soc. 137 (4), 153–1547.
Chen Q., Chen J., Liang C., Feng L., Dong Z., Song X., Song G., Liu Z. 2017. Drug-induced co-assembly of albumin/catalase as smart nano-theranostics for deep intra-tumoral penetration, hypoxia relieve, and synergistic combination therapy. J. Control Release. 263, 79–89.
Babii O., Afonin S., Berditsch M., Reißer S., Mykhailiuk P.K., Kubyshkin V.S., Steinbrecher T., Ulrich A.S., Komarov I.V. 2014. Controlling biological activity with light: Diarylethene-containing cyclic peptidomimetics. Angew. Chem. Int. Ed. 53, 3392–3395.
Parks S.K., Cormerais Y., Pouyssegur J. 2017. Hypoxia and cellular metabolism in tumour pathophysiology. J. Physiol. 595 (8), 2439–2450.
Kopecka J., Porto S., Lusa S., Gazzano E., Salzano G., Giordano A., Desiderio V., Ghigo D., Caraglia M., De Rosa G., Riganti C. 2015. Self-assembling nanoparticles encapsulating zoledronic acid revert multidrug resistance in cancer cells. Oncotarget. 6 (31), 31461–31478.
Chen W.H., Lecaros R.L., Tseng Y.C., Huang L., Hsu Y.C. 2015. Nanoparticle delivery of HIF1α siRNA combined with photodynamic therapy as a potential treatment strategy for head-and-neck cancer. Cancer Lett. 359 (1), 65–74.
Broekgaarden M., Weijer R., Krekorian M., van den Ijssel B., Kos M., Alles L.K., van Wijk A.C., Bikadi Z., Hazai E., van Gulik T.M., Heger M. 2016. Inhibition of hypoxia-inducible factor 1 with acriflavine sensitizes hypoxic tumor cells to photodynamic therapy with zinc phthalocyanine-encapsulating cationic liposomes. Nano Res. 9, 1639–1662.
Jung H.S., Han J., Shi H., Koo S., Singh H., Kim H.J., Sessler J.L., Lee J.Y., Kim J.H., Kim J.S. 2017. Overcoming the limits of hypoxia in photodynamic therapy: A carbonic anhydrase IX-targeted approach. J. Am. Chem. Soc. 139 (22), 7595–7602.
Luongo M., Brigida A.L., Mascolo L., Gaudino G. 2017. Possible therapeutic effects of ozone mixture on hypoxia in tumor development. Anticancer Res. 37 (2), 425–435.
Bocci V., Larini A., Micheli V. 2005. Restoration of normoxia by ozone therapy may control neoplastic growth: A review and a working hypothesis. J. Altern. Complement. Med. 11 (2), 257–265.
Bocci V. 2008. Does ozone really “cure” cancer? Int. J. Cancer. 123, 1222.
Мартусевич А.А., Мартусевич А.К., Перетягин С.П. 2013. Особенности действия синглетного кислорода и озона на процессы липопероксидации и антиоксидантную систему крови и тканей крыс. Рос. физиол. журн. им. И.М. Сеченова. 99 (9), 1057–1066.
Smith N.L., Wilson A.L., Gandhi J., Vatsia S., Khan S.A. 2017. Ozone therapy: An overview of pharmacodynamics, current research, and clinical utility. Med. Gas. Res. 7 (3), 212–219.
Чернигина И.А., Плеханова Е.С., Щербатюк Т.Г. 2017. Метод ДНК-комет в оценке уровня повреждения ДНК лейкоцитов крови после фотодинамической терапии. Соврем. технологии в медицине. 9, 89–95.
Щербатюк Т.Г., Плеханова Е.С., Чернигина И.А., Терентюк Г.С., Бучарская А.Б. 2017. Новая экспериментальная схема лечения опухолей на основе фотодинамической терапии. Рос. биотерапевт. журн. 15, 123.
Shcherbatyuk T.G., Chernigina I.A., Plekhanova E.S., Shakhov B.E. 2017. DNA damage after ozone-photodynamic therapy in cancer animals: Experimental research. J. Pharmacy Pharmacol. 5, 497–505.
Camacho-Alonso F., Salmeron-Lozano P., Martinez-Beneyto Y. 2017. Effects of photodynamic therapy, 2% chlorhexidine, triantibiotic mixture, propolis and ozone on root canals experimentally infected with Enterococcus faecalis: An in vitro study. Odontology. 105 (3), 338–346.
Wilson W.R., Hay M.P. 2011. Targeting hypoxia in cancer therapy. Nat. Rev. Cancer. 11 (6), 393–410.
Lin Q., Bao C., Yang Y., Liang Q., Zhang D., Cheng S., Zhu L. 2013. Highly discriminating photorelease of anticancer drugs based on hypoxia activatable phototrigger conjugated chitosan nanoparticles. Adv. Mater. 25 (14), 1981–1986.
Kim K., Lee C.S., Na K. 2016. Light-controlled reactive oxygen species (ROS)-producible polymeric micelles with simultaneous drug-release triggering and endo/lysosomal escape. Chem. Commun. (Camb.). 52 (13), 2839–2842.
Park W., Bae B.C., Na K. 2016. A highly tumor-specific light-triggerable drug carrier responds to hypoxic tumor conditions for effective tumor treatment. Biomaterials. 77, 227–234.
Liu Y., Liu Y., Bu W., Cheng C., Zuo C., Xiao Q., Sun Y., Ni D., Zhang C., Liu J., Shi J. 2015. Hypoxia induced by upconversion-based photodynamic therapy: Towards highly effective synergistic bioreductive therapy in tumors. Angew. Chem. Int. Ed. Engl. 54 (28), 8105–8109.
Chen W.H., Luo G.F., Qiu W.X., Lei Q., Liu L.H., Wang S.B., Zhang X.Z. 2017. Mesoporous silica-based versatile theranostic nanoplatform constructed by layer-by-layer assembly for excellent photodynamic/chemo therapy. Biomaterials. 117, 54–65.
Hunter F.W., Wouters B.G., Wilson W.R. 2016. Hypoxia-activated prodrugs: Paths forward in the era of personalised medicine. Br. J. Cancer. 114 (10), 1071–1077.
O’Connor L.J., Cazares-Korner C., Saha J., Evans C.N., Stratford M.R., Hammond E.M., Conway S.J. 2016. Design, synthesis and evaluation of molecularly targeted hypoxia-activated prodrugs. Nat. Protoc. 11 (4), 781–794.
Phillips R.M. 2016. Targeting the hypoxic fraction of tumours using hypoxia-activated prodrugs. Cancer Chemother. Pharmacol. 77 (3), 441–457.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


