Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 4, стр. 313-320
Функциональная экспрессия аденозиновых рецепторов в мезенхимных стромальных клетках
Е. Н. Кочкина a, А. П. Черкашин a, Н. В. Кабанова a, Е. А. Соколова a, М. Ф. Быстрова a, П. Д. Котова a, *
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Пущино, Россия
* E-mail: polinakotova88@gmail.com
Поступила в редакцию 16.01.2020
После доработки 19.03.2020
Принята к публикации 23.03.2020
Аннотация
Внеклеточный аденозин является сигнальной молекулой, которая участвует в регуляции физиологических процессов различных типов клеток, включая мезенхимные стромальные клетки (МСК). С использованием микрофотометрии и Са2+-зондов мы показали, что популяция МСК, выделенных из жировой ткани человека, содержит небольшую (5–10%) субпопуляцию аденозинергических клеток. В этих клетках функционируют А1, А2А и А2B аденозиновые рецепторы, которые сопряжены с фосфоинозитидным сигнальным каскадом. Стимуляция аденозинергических МСК аденозином инициирует мобилизацию внутриклеточного Са2+, при этом Ca2+-ответы на аденозин генерируются по принципу “все или ничего”: в малых дозах аденозин не приводит к изменению уровня внутриклеточного Са2+, но при любой концентрации, превышающей пороговую, вызывает Са2+-ответы практически идентичной формы и амплитуды. Примечательно, что длительность задержки ответа от момента аппликации аденозина уменьшается с увеличением его концентрации. Ключевые этапы генерации Ca2+-ответов на аденозин исследовали с использованием ингибиторного анализа. Полученные данные свидетельствуют о том, что аденозиновый рецептор активирует фосфолипазу С, стимулирующую продукцию IP3, который, в свою очередь, активирует IP3-рецепторы и инициирует выброс депонированного Ca2+, скорее всего зависимый от концентрации агониста. Этот первоначальный Ca2+-сигнал стимулирует масштабный выброс Ca2+ из внутриклеточных депо по механизму Са2+-индуцированного выброса Са2+, что формирует вторичный Ca2+-ответ универсальной формы и амплитуды.
ВВЕДЕНИЕ
Мезенхимные стромальные клетки (МСК) представляют собой гетерогенную клеточную популяцию, включающую мультипотентные стволовые клетки, которые способны к пролиферации и дифференцировке как минимум в костную, хрящевую и жировую ткани. Внеклеточный аденозин и распознающие его аденозиновые рецепторы вовлечены в оба эти процесса [1]. Показано, что аденозин является медиатором, стимулирующим пролиферацию МСК, выделенных из костного мозга мыши [2]. Основная же роль аденозина для МСК состоит в активации их дифференцировки в хондроциты и остеобласты [3–7], также продемонстрирована вовлеченность аденозиновых рецепторов и в их адипогенную дифференцировку [8–10].
Однако МСК стимулируют регенерацию тканей не только за счет своей способности к дифференцировке, но и благодаря секреции ряда регуляторных молекул, которые способствуют индукции ангиогенеза, уменьшению фиброза, модуляции иммунной системы и некоторых других процессов. Стимуляция физиологических функций МСК происходит, в частности, при повреждении тканей и высвобождении во внеклеточную среду большого количества ATP, который действует как сигнал опасности и приводит к активации воспалительных процессов. При этом внеклеточный ATP подвергается последовательному ферментативному гидролизу до аденозина, который, в свою очередь, может оказывать действие, противоположное вызываемым ATP, в частности стимулируя противовоспалительные эффекты [11]. Так, один из иммуносупрессивных механизмов, приводящий к подавлению чрезмерной воспалительной реакции, основан на совместной работе МСК и Т-лимфоцитов через аденозинергический путь. Аденозин активно продуцируется из внеклеточного ATP благодаря высокой экспрессии CD73 (экто-5'-нуклеотидаза, гидролизующая AMP до аденозина) на МСК и CD39 (эктонуклеозидтрифосфат-дифосфогидролаза 1, гидролизующая ATP и ADP до AMP) на Т-лимфоцитах. В свою очередь внеклеточный аденозин подавляет пролиферацию Т-лимфоцитов, что приводит к снижению иммунного ответа [12]. Таким образом, внеклеточный аденозин является важной сигнальной молекулой в физиологии МСК, однако трансдукция аденозина для этих клеток не исследована. В связи с этим данная работа посвящена анализу механизма Ca2+-сигнализации, инициируемой аденозином в МСК, выделенных из жировой ткани человека.
Ранее нами было показано, что популяция МСК функционально гетерогенна и содержит субпопуляции клеток, отличающиеся по чувствительности к агонистам различных гептаспиральных рецепторов (G-protein coupled receptors, GPCR), в том числе пуринергическим [13, 14]. Чувствительность клеток млекопитающих к внеклеточному аденозину обеспечивают аденозиновые (P1) рецепторы четырех подтипов: A1, A2A, A2B и A3 [15]. В большинстве случаев A2A- и A2B-рецепторы сопряжены с аденилатциклазой стимулирующим Gs-белком, а A1- и A3-рецепторы – ингибиторным Gi-белком [16]. Кроме того, описано сопряжение аденозиновых рецепторов с фосфолипазой С, A1- и A3-рецепторы активируют ее посредством βγ-комплекса Gi-белка, а A2B- и А3-рецепторы – α-субъединицей Gq-белка [17]. Таким образом, А1-, A2B- и А3-рецепторы могут быть непосредственно вовлечены в мобилизацию внутриклеточного Са2+ аденозином. В настоящей работе анализировали Ca2+-сигналы, инициируемые аденозином в цитоплазме МСК, а также выясняли подтипы аденозиновых рецепторов, обеспечивающих чувствительность МСК к экстраклеточному аденозину.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение клеток. В данной работе исследовали МСК из жировой ткани человека, выделение и поддержание первичной культуры которых подробно описано ранее [18]. Выделенные МСК культивировали на пластиковых чашках Петри и/или в 12-луночном планшете в среде Advance Stem (HyClone, США) с 10% Advance Stem Supplement (HyClone). При достижении 80% монослоя клетки пассировали. Клетки обрабатывали раствором Версена (Sigma, США) и 0.25% раствором трипсина, а затем рассаживали в соотношении 1 : 3. В экспериментах использовали МСК 2 – 6 пассажей.
Микрофотометрия. Клетки прикрепляли ко дну фотометрической камеры с помощью адгезивного материала Cell Tak и инкубировали при комнатной температуре (23–25°С) в присутствии мембранно-проникающего препарата Fluo-4AM (4 мкМ) и детергента Pluronic (0.02%) (оба Molecular Probes, США) в течение 30 мин, что обеспечивало загрузку клеток Са2+-зондом Fluo-4. Затем клетки отмывали внеклеточным раствором, в котором их выдерживали 40 мин при 4°С. Внеклеточный раствор содержал (мМ): NaCl – 110, KCl – 5.5, CaCl2 – 2, MgCl2 – 0.8, HEPES – 10, глюкозу – 10. В ряде случаев использовали внеклеточный раствор, содержащий 260 нМ свободного Ca2+, для получения которого вместо 2 мМ CaCl2 добавляли 0.5 мМ EGTA + 0.4 мМ CaCl2. Фотометрические эксперименты проводили с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss, Германия), оборудованного объективом Plan NeoFluar 20×/0.75 и цифровой ECCD камерой LucaR (Andor Technology, США). Флуоресценцию клеток, нагруженных Fluo-4, возбуждали на длине волны 480 ± 5 нм, эмиссию регистрировали в области 535 ± 20 нм. Изменение концентрации цитозольного Са2+ в индивидуальных клетках оценивали по относительному изменению интенсивности флуоресценции целой клетки (ΔF/F0), где ΔF = = F0 – F, F и F0 – текущая интенсивность эмиссии Fluo-4 и его эмиссия в начале регистрации соответственно. Количественный фотометрический анализ изображений осуществляли с использованием программы Imaging Workbench 6 (INDEC, США). Для скачкообразного повышения концентрации внутриклеточного Са2+ клетки инкубировали при комнатной температуре (23–25°С) в присутствии фоточувствительного Са2+-хелатора NP-EGTA AM (4 мкМ) (Molecular Probes) в течение 30 мин. Фотолиз NP-EGTA вспышкой ультрафиолетового диапазона (355 нм) инициировал импульсное высвобождение Са2+ в цитоплазме клетки. В соответствующих экспериментах клетки нагружали одновременно NP-EGTA и Fluo-4.
ОТ-ПЦР анализ. Тотальную РНК выделяли из суспензии МСК, содержащей до 106 клеток с использованием RNeasy mini kit (Qiagen, Германия). Удаление остатков геномной ДНК из выделенной РНК проводили DNase I (Ambion, США). Реакцию обратной транскрипции проводили с помощью PrimeScript reverse transcriptase (Takara, Япония) в присутствии случайных гексамерных праймеров. Полученная кДНК служила матрицей для ПЦР с ген-специфическими праймерами, комплементарными всем возможным транскрипт-вариантам генов человеческих аденозиновых рецепторов, а также генам, кодирующим маркеры МСК, включая CD73, CD90, CD105 и MCAM. Были использованы следующие последовательности ген-специфических праймеров, в скобках указан ожидаемый размер продукта: A1 5'-TCCATCTCAGCTTTCCAGG-3', 5'-TCACCACCATCTTGTACCG-3' (349 п.н.), A2A 5'-CAGAACGTCACCAACTACTTTG-3', 5'-GGTCACCAAGCCATTGTACC-3' (240 п.н.), A2B 5'-ATGCTGCTGGAGACACAGG-3', 5'-CCGTGACCAAACTTTTATACCT-3' (355 п.н.), A3 5'-AGAGATCACCCCACCAGAAAAG-3', 5'-GAGTGGTGACCCTCTTGTATC-3' (537 п.н.), CD73 5'-AAGACATGACTCTGGTGACC-3', 5'-CTGTCACAAAGCCAGGTCC-3' (266 п.н.), CD90 5'-GTCACAGTGCTCAGAGAC-3', 5'-TACAAAAAGACAGCCAGAGG-3' (344 п.н.), CD105 5'-AGCAGAGCTTTGTGCAGGTC-3', 5'-GCTGATGATGTTCAAGCGCATG-3' (317 п.н.), MCAM 5'-AGGGAAGCAGGAGATCACG-3', 5'-GGCTT-CTCTCTAGTCCCTTTG-3' (266 п.н.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
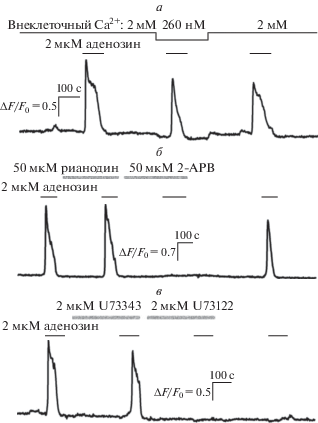
В физиологических экспериментах было установлено, что популяция МСК содержит небольшую (5–10%) субпопуляцию клеток, специфически отвечающих на аденозин мобилизацией внутриклеточного Ca2+. Для выяснения вклада в эти ответы различных источников Са2+ анализировали изменение чувствительности МСК к аденозину в условиях понижения внеклеточного Са2+ с 2 мМ до цитоплазматического уровня (260 нМ). Оказалось, что все протестированные аденозинергические МСК (n = 26) генерировали практически нормальные по амплитуде и кинетике ответы на аденозин в среде с пониженным до цитоплазматического уровня содержанием Ca2+ (рис. 1а). Это свидетельствует о том, что основной вклад в Ca2+-ответы на аденозин вносит выброс депонированного Ca2+ при незначительной роли входа Ca2+ из внеклеточной среды. В связи с этим вполне предсказуемым был эффект ингибитора фосфолипазы С U73122, который полностью и необратимо подавлял Ca2+-ответы на аденозин (n = 17) (рис. 1б). Действие U73122 в данном случае можно считать специфичным, так как его неактивный аналог U73343 в той же концентрации не влиял на способность МСК отвечать на аденозин (рис. 1б). Это свидетельствует о том, что аденозиновые рецепторы в МСК сопряжены с фосфолипазой С, которая является ключевым элементом в генерации Ca2+-ответов на аденозин. Известно, что в различных клетках высвобождение депонированного Ca2+ происходит при стимуляции рианодиновых или IP3-рецепторов, являющихся лиганд-активируемыми Ca2+-каналами эндоплазматического ретикулума [19]. Предварительная инкубация МСК с антагонистом IP3-рецепторов 2-APB приводила к обратимому подавлению ответов на аденозин, тогда как ингибитор рианодиновых рецепторов рианодин не влиял на способность клеток генерировать ответы на аденозин (n = 12) (рис. 1в). Следует отметить, что помимо IP3-рецепторов 2-APB также может блокировать вход наружного Ca2+, в частности, через ионные каналы TRPC типа [20–22]. Однако, поскольку Ca2+-ответы на аденозин практически не зависели от наружного Ca2+ (рис. 1а), возможным влиянием 2-APB на вход Ca2+ можно пренебречь и полагать, что основной мишенью этого ингибитора в случае ответов на аденозин были именно IP3-рецепторы (рис. 1в). Таким образом, представленные данные (рис. 1) свидетельствуют о том, что трансдукция аденозина в МСК протекает при участии фосфоинозитидного каскада и включает в качестве основных событий стимуляцию фосфолипазы C, продукцию IP3, активацию IP3-рецепторов и выброс Ca2+ из внутриклеточных Са2+-депо.
Рис. 1.
Вклад различных источников Са2+ в ответы МСК на аденозин. а – Репрезентативная регистрация Ca2+-ответов одиночной МСК на аденозин при варьируемом внеклеточном Са2+ (n = 26). Моменты и продолжительность аппликаций веществ обозначены горизонтальными линиями выше экспериментальной кривой. Верхняя линия иллюстрирует изменение концентрации внеклеточного Ca2+. Изменение внутриклеточного Ca2+ характеризовали относительной флуоресценцией Fluo-4 ΔF/F0, где ΔF = F – F0, F – текущая интенсивность флуоресценции, F0 средняя интенсивность флуоресценции в начальный момент регистрации. б – Ответы МСК на аденозин полностью и необратимо подавляются ингибитором фосфолипазы С U73122, но не его неактивным аналогом U73343 (n = 17). в – Антагонист IP3-рецепторов 2-APB полностью подавляет ответы МСК на аденозин, в то время как ингибитор рианодиновых рецепторов рианодин не влияет на чувствительность МСК к аденозину (n = 12).
Интересно, что форма и амплитуда Ca2+-ответов на аденозин не зависели от его концентрации (n = 21). Другими словами, аденозин в концентрациях ниже пороговой (50–500 нМ) никогда не вызывал детектируемых Ca2+-ответов, в то время как в концентрациях, превышающих пороговую, вызывал практически идентичные Ca2+-ответы (рис. 2а). Еще одной характерной чертой ответов на аденозин была их заметная задержка от момента аппликации агониста (рис. 2б), причем длительность этой задержки уменьшалась с повышением концентрации агониста (n = 11) (рис. 2в). Так, например, у клетки, представленной на рис. 2б, задержка ответа от момента аппликации аденозина в низкой концентрации 0.1 мкМ составила 106 с, тогда как при стимуляции 2 мкМ аденозина она уменьшалась до 23 с. Такие особенности Ca2+-ответов МСК ранее были описаны нами для других агонистов, включая норадреналин и ATP, в связи с этим мы предположили, что основные этапы механизма генерации ответов на аденозин идентичны уже описанным [13, 14]. На первом этапе аденозин посредством фосфоинозитидного сигнального каскада вызывает небольшой Ca2+-сигнал, амплитуда которого, вероятно, зависит от концентрации агониста. Далее при достижении этим локальным Ca2+-сигналом порогового значения он усиливается механизмом Ca2+-индуцированного выброса Ca2+ из внутриклеточных депо (Ca2+-induced Ca2+-release, CICR), который и формирует глобальный Ca2+-сигнал, амплитуда и кинетика которого уже не зависят от концентрации аденозина [13, 14].
Рис. 2.
Вклад CICR в Ca2+-ответы МСК на аденозин. а – Репрезентативные ответы одиночной МСК на аденозин в различных дозах (n = 21). б – Последовательные ответы МСК на аденозин в концентрациях 0.1 мкМ (пороговая) и 2 мкМ (насыщающая). Ответы на 0.1 и 2 мкМ аденозина отсрочены от момента аппликации на 106 и 23 с соответственно. Длительность задержки (τ) определяли как время, необходимое для достижения ответом полумаксимального значения от момента аппликации аденозина. в – Зависимость длительности задержки (τ) от концентрации аденозина, представлены средние значения времени задержки ± стандартная ошибка (n = 3–11). г – Ответ МСК на импульсное повышение концентрации внутриклеточного Ca2+, вызываемое фотолизом NP-EGTA (УФ-импульс, 355 нм, 4 с), и на аденозин (n = 5).
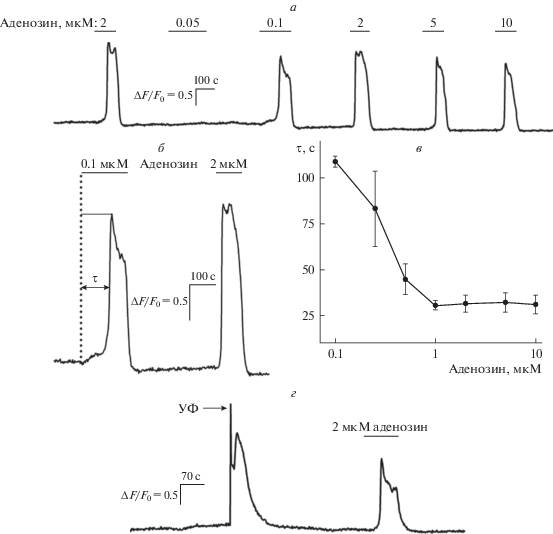
Если это предположение верно, то любой внутриклеточный Са2+-сигнал, инициируемый в цитоплазме МСК достаточно быстро и превышающий порог, должен усиливаться механизмом CICR и преобразовываться в насыщающий Ca2+-ответ, подобный ответу на аденозин. Для проверки этого предположения мы анализировали реакцию аденозинергических МСК на скачкообразное повышение внутриклеточного Ca2+. Клетки одновременно нагружали Fluo-4 и фоточувствительным Ca2+-хелатором NP-EGTA, облучение которого светом УФ-диапазона вызывает разрушение координационной сферы связывания Ca2+ и его высвобождение [23], что приводит к скачкообразному повышению уровня свободного Ca2+ в цитоплазме клетки. Вспышки света УФ-диапазона (355 нм) продолжительностью 4 с приводили к генерации в цитоплазме МСК Ca2+-ответов, по амплитуде и форме сходных с ответами на аденозин (рис. 2г) (n = 5). Из известных Ca2+-зависимых механизмов только CICR способен так усилить и придать такую форму первичному Ca2+-сигналу, вызванному фотолизом NP-EGTA; таким образом, проведенные эксперименты (рис. 2г) свидетельствуют о том, что в аденозинергических МСК именно механизм CICR ответственен за формирование Са2+-сигналов универсальной формы и амплитуды.
Для выявления подтипов аденозиновых рецепторов, обеспечивающих чувствительность МСК к экстраклеточному аденозину, нами был проведен экспрессионный анализ популяции МСК с использованием полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) и ген-специфических праймеров. Все исследованные образцы РНК, полученные от четырех доноров, содержали транскрипты А1-, А2А- и А2В-рецепторов, а также CD73, CD90, CD105 и МСАМ (рис. 3а), которые на данный момент считаются маркерами МСК. При этом транскрипты А3-рецептора не были обнаружены ни в одном из образцов. Имеющиеся в литературе данные указывают на то, что все выявленные нами подтипы аденозиновых рецепторов вовлечены в те или иные физиологические процессы МСК. Например, показано, что стимуляция А1-рецептора усиливает дифференцировку в остеобласты МСК, выделенных из пульпы человека, посредством активации Wnt-пути [24]. CD73 действует как регуляторный фактор остео- и хондрогенной дифференцировки МСК костного мозга мыши через А2А [25]. Во многих исследованиях отмечено, что стимуляция А2В-рецептора приводит к индукции остеогенной дифференцировки как мышиных, так и человеческих МСК костного мозга [3–7]. При этом в большинстве перечисленных работ выявлена экспрессия и А3 аденозинового рецептора, однако его физиологическая роль не описана. Разногласие между нашими результатами и литературными данными об экспрессии А3-рецептора в МСК может быть объяснено тем, что в опубликованных работах анализировали МСК, выделенные из различных тканей, а иногда и организмов. Стоит отметить, что А3 не был обнаружен в хондрогенных прогениторных клетках человека [26].
Рис. 3.
Идентификация различных изоформ аденозиновых рецепторов, функционирующих в МСК. а – Репрезентативный гель-электрофорез продуктов ОТ-ПЦР-анализа препаратов МСК (n = 4) с праймерами, специфичными для генов A1-, A2A-, A2B-, А3-рецепторов и маркеров МСК CD73, CD90, CD105, MCAM. Ампликоны ожидаемого размера были идентифицированы для A1 (349 п.н.), A2A (240 п.н.), A2B (355 п.н.), CD73 (266 п.н.), CD90 (344 п.н.), CD105 (317 п.н.), MCAM (266 п.н.), в то время как транскрипты гена A3-рецептора (537 п.н.) были недетектируемы. В качестве маркеров молекулярных масс (М) использовали GeneRuler 100 bp DNA Ladder (Fermentas). б – Ca2+-ответы МСК на аденозин и агонист А1-рецепторов 2’-MeCCPA (n = 16). в – Ca2+-ответы МСК на аденозин в контроле и присутствии антагониста А2А-рецепторов SCH 58261, а также на агонист А2А-рецепторов CGS 21680 (n = 12). г – Ca2+-ответы МСК на аденозин в контроле и присутствии антагониста А2B-рецепторов PSB 1115, а также на агонист А2B-рецепторов BAY 60-6583 (n = 9). д – Ca2+-ответы МСК на аденозин в контроле и присутствии антагониста А3-рецепторов MRS 3777, а также на агонист А3-рецепторов HEMADO.
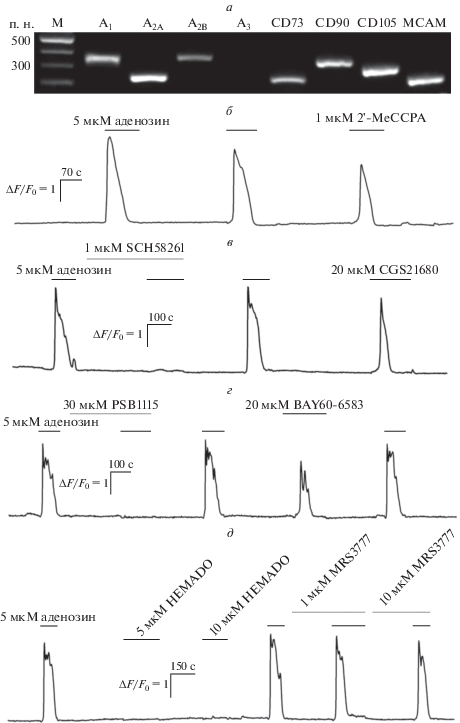
Таким образом, транскриптомный анализ выявил, что в МСК могут функционировать три подтипа аденозиновых рецепторов, тем не менее было неясно, какие из них вовлечены в генерацию Са2+-ответов на аденозин. В связи с этим мы провели ряд физиологических экспериментов, в которых использовали специфические агонисты и антагонисты аденозиновых рецепторов. Оказалось, что часть аденозинергических МСК генерировала Са2+-ответы на специфический агонист A1-рецепторов 2'-MeCCPA (n = 16) (рис. 3б). В ряде случаев наблюдались ответы на агонист A2A-рецепторов CGS 21680, при этом ответы таких клеток на аденозин блокировались в присутствии антагониста этих рецепторов SCH 58261, что свидетельствует в пользу специфичности действия этих соединений (n = 12) (рис. 3в). Еще одна группа клеток генерировала ответы на агонист A2B-рецепторов BAY 60-6583, тогда как их антагонист PSB 1115 полностью подавлял ответы этих клеток на аденозин (n = 9) (рис. 3г). Агонист же А3-рецепторов HEMADO в различных концентрациях не вызывал Са2+-ответов, а их антагонист MRS 3777 никогда не влиял на способность МСК отвечать на аденозин (n = 8) (рис. 3д), что согласуется с результатами ОТ-ПЦР (рис. 3а), свидетельствующими об отсутствии этого рецептора в популяции МСК.
Суммируя полученные данные, можно утверждать, что в МСК жировой ткани человека функционируют A1-, A2A- и A2B-рецепторы аденозина, тогда как A3-рецептор, по-видимому, не экспрессируется. Все экспрессирующиеся подтипы аденозиновых рецепторов в МСК могут быть сопряжены с фосфоинозитидным сигнальным каскадом, а их активация приводит к генерации Са2+-ответов. Полученные нами данные ингибиторного анализа позволяют предположить следующую последовательность событий, инициируемых внеклеточным аденозином в цитоплазме МСК: активированный аденозиновый рецептор посредством G-белка активирует фосфолипазу C, гидролизующую PIP2 до IP3, который стимулирует IP3-рецепторы, что приводит к выбросу депонированного Ca2+, скорее всего зависимому от концентрации агониста, этот первоначальный Ca2+-сигнал стимулирует масштабный выброс Ca2+ из внутриклеточных депо, что продуцирует вторичный Ca2+-ответ, не зависящий от концентрации агониста.
Работа поддержана грантом РФФИ № 18-34-00365 мол_а и стипендией Президента Российской Федерации молодым ученым и аспирантам СП-924.2018.4.
Список литературы
Kaebisch C., Schipper D., Babczyk P., Tobiasch E. 2015. The role of purinergic receptors in stem cell differentiation. Comput. Struct. Biotechnol. J. 13, 75–84.
Katebi M., Soleimani M., Cronstein B.N. 2009. Adenosine A2A receptors play an active role in mouse bone marrow-derived mesenchymal stem cell development. J. Leukoc. Biol. 85 (3), 438–444.
Carroll S.H., Wigner N.A., Kulkarni N., Johnston-Cox H., Gerstenfeld L.C., Ravid K. 2012. A2B adenosine receptor promotes mesenchymal stem cell differentiation to osteoblasts and bone formation in vivo. J. Biol. Chem. 287 (19), 15 718–15 727.
Carroll S.H., Ravid K. 2013. Differentiation of mesenchymal stem cells to osteoblasts and chondrocytes: a focus on adenosine receptors. Expert Rev. Mol. Med. 15, e1.
Ciciarello M., Zini R., Rossi L., Salvestrini V., Ferrari D., Manfredini R., Lemoli R.M. 2013. Extracellular purines promote the differentiation of human bone marrow-derived mesenchymal stem cells to the osteogenic and adipogenic lineages. Stem Cells Dev. 22 (7), 1097–1111.
He W., Mazumder A., Wilder T., Cronstein B.N. 2013. Adenosine regulates bone metabolism via A1, A2A, and A2B receptors in bone marrow cells from normal humans and patients with multiple myeloma. FASEB J. 27 (9), 3446–3454.
Shih Y.R., Hwang Y., Phadke A., Kang H., Hwang N.S., Caro E.J., Nguyen S, Siu M, Theodorakis E.A., Gianneschi N.C., Vecchio K.S., Chien S., Lee O.K., Varghese S. 2014. Calcium phosphatebearing matrices induce osteogenic differentiation of stem cells through adenosine signaling. Proc. Natl. Acad. Sci. USA. 111 (3), 990–995.
Gharibi B., Abraham A.A., Ham J., Evans B.A. 2011. Adenosine receptor subtype expression and activation influence the differentiation of mesenchymal stem cells to osteoblasts and adipocytes. J. Bone Miner. Res. 26 (9), 2112–2124.
Gharibi B., Abraham A.A., Ham J., Evans B.A. 2012. Contrasting effects of A1 and A2B adenosine receptors on adipogenesis. Int. J. Obes. 36 (3), 397–406.
Eisenstein A., Carroll S.H., Johnston-Cox H., Farb M., Gokce N., Ravid K. 2014. An adenosine receptor-Krüppel-like factor 4 protein axis inhibits adipogenesis. J. Biol. Chem. 289 (30), 21 071–21 081.
de Oliveira Bravo M., Carvalho J.L., Saldanha-Araujo F. 2016. Adenosine production: A common path for mesenchymal stem-cell and regulatory T-cell-mediated immunosuppression. Purinergic Signal. 12 (4), 595–609.
Kerkelä E., Laitinen A., Räbinä J., Valkonen S., Taka-talo M., Larjo A., Veijola J., Lampinen M., Siljander P., Lehenkari P., Alfthan K., Laitinen S. 2016. Adenosinergic immunosuppression by human mesenchymal stromal cells requires co-operation with T cells. Stem Cells. 34 (3), 781–790.
Kotova P.D., Sysoeva V.Y., Rogachevskaja O.A., Bystrova M.F., Kolesnikova A.S., Tyurin-Kuzmin P.A., Fadeeva J.I., Tkachuk V.A., Kolesnikov S.S. 2014. Functional expression of adrenoreceptors in mesenchymal stromal cells derived from the human adipose tissue. Biochim. Biophys. Acta. 1843, 1899–1908.
Kotova P.D., Bystrova M.F., Rogachevskaja O.A., Khokhlov A.A., Sysoeva V.Yu., Tkachuk V.A., Kolesnikov S.S. 2018. Coupling of P2Y receptors to Ca2+ mobilization in mesenchymal stromal cells from the human adipose tissue. Cell Calcium. 71, 1–14.
Fredholm B.B., IJzerman A.P., Jacobson K.A., Klotz K.N., Linden J. 2001. International union of pharmacology. XXV: Nomenclature and classification of adenosine receptors. Pharmacological Reviews. 53 (4), 527–552.
Burnstock G. 2018. Purine and purinergic receptors. Brain Neurosci. Adv. 2, 2 398 212 818 817 494.
Sheth S., Brito R., Mukherjea D., Rybak L.P., Ramkumar V. 2014. Adenosine receptors: Expression, function and regulation. Int. J. Mol. Sci. 15 (2), 2024–2052
Котова П.Д., Фадеева Ю.И., Рогачевская О.А., Сысоева В.Ю., Ткачук В.А., Колесников С.С. 2015. Пуринергическая сигнализация в мезенхимных стромальных клетках. Биол. мембраны. 32 (4), 265–273.
Clapham D.E. 2007. Calcium signaling. Cell. 131 (6), 1047–1058.
Xu S.-Z., Zeng F., Boulay G., Grimm C., Harteneck C., Beech D.J. 2005. Block of TRPC5 channels by 2-ami-noethoxydiphenyl borate: A differential, extracellular and voltage-dependent effect. Br. J. Pharmacol. 145 (4), 405–414.
Mustafa T., Walsh J., Grimaldi M., Eiden L.E. 2010. PAC1hop receptor activation facilitates catecholamine secretion selectively through 2-APB-sensitive Ca2+ channels in PC12 cells. Cell Signal. 22 (10), 1420–1426.
Harteneck C., Gollasch M. 2011. Pharmacological modulation of diacylglycerol-sensitive TRPC3/6/7 channels. Curr. Pharm. Biotechnol. 12 (1), 35–41.
Ellis-Davies G.C. 2007. Caged compounds: photorelease technology for control of cellular chemistry and physiology. Nat. Methods. 4 (8), 619–628.
D’Alimonte I., Nargi E., Lannutti A., Marchisio M., Pierdomenico L., Costanzo G., Di Iorio P., Ballerini P., Giuliani P., Caciagli F., Ciccarelli R. 2013. Adenosine A1 receptor stimulation enhances osteogenic differentiation of human dental pulp-derived mesenchymal stem cells via WNT signaling. Stem Cell Res. 11 (1), 611–624.
Ode A., Schoon J., Kurtz A., Gaetjen M., Ode J.E., Geissler S., Duda G.N. 2013. CD73/5'-ecto-nucleotidase acts as a regulatory factor in osteo-/chondrogenic differentiation of mechanically stimulated mesenchymal stromal cells. Eur. Cell Mater. 25, 37–47.
Matta C., Fodor J., Miosge N., Takács R., Juhász T., Rybaltovszki H., Tóth A., Csernoch L., Zákány R. 2015. Purinergic signaling is required for calcium oscillations in migratory chondrogenic progenitor cells. Pflügers Arch. 467 (2), 429–442.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


