Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 4, стр. 299-312
Теоретический анализ влияния флуктуаций активности Н+-ATP-азы плазматической мембраны на холодоиндуцированные электрические реакции растительной клетки
В. С. Сухов a, *, Е. М. Сухова a, Д. А. Ратницына a, М. А. Гринберг a, Л. М. Юдина a, В. А. Воденеев a
a Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
* E-mail: vssuh@mail.ru
Поступила в редакцию 10.12.2019
После доработки 11.01.2020
Принята к публикации 30.01.2020
Аннотация
Наличие флуктуаций в протекании физиологических процессов является одним из ключевых свойств живых систем; при этом такие флуктуации могут играть не только негативную, но и положительную роль в живых организмах. В частности, флуктуации в активности ионных каналов способны повышать возбудимость рецепторов и модулировать активность нейронных сетей. В то же время практически не изучено возможное влияние флуктуаций на процессы электрогенеза у растений. Целью нашей работы стал теоретический анализ влияния флуктуаций активности Н+-ATP-азы плазматической мембраны на развитие холодоинуцированных электрических реакций в растительной клетке. В работе была использована предложенная ранее авторами математическая модель процессов электрогенеза у растений, которая была дополнена флуктуациями активности Н+-ATP-азы. Имитация флуктуаций активности фермента достигалась умножением величины потока протонов через него на нормально распределенную случайную величину (конкретные значения случайной величины рассчитывались с периодом 1 с; среднее значение этой величины было равно 1). При анализе модели было показано, что повышение величины флуктуаций активности Н+-ATP-азы сопровождалось (i) нелинейным увеличением флуктуаций мембранного потенциала в покое, (ii) снижением порога для генерации потенциала действия при анализе отдельных имитированных моделью клеток, (iii) модификацией холодоиндуцированных изменений мембранного потенциала при усреднении электрической активности по большой выборке клеток. Полученные результаты теоретически предсказывают, что флуктуации активности Н+-ATP-азы могут снижать порог для генерации электрических реакций растительной клетки при охлаждении.
ВВЕДЕНИЕ
Биоэлектрогенез, т.е. способность генерировать электрические потенциалы, является универсальным свойством живых организмов, включая растения. В настоящее время хорошо известно, что действие неблагоприятных факторов (охлаждение, нагрев, механическое повреждение и другое) вызывает у растений генерацию электрических реакций [1–4], которые, по-видимому, играют одну из ключевых ролей в регуляции физиологических процессов у растения, включая процессы регенерации [4–7]. В частности, такие реакции способны распространяться по растению, т.е. представляют собой электрические сигналы различных типов (потенциал действия (ПД), вариабельный потенциал, системный потенциал) [8–11]. Известно, что электрические реакции участвуют в формировании стрессового ответа на уровне целого растения [7], включая изменения генной экспрессии [12, 13], усиление продукции стрессовых фитогормонов [14–17], изменения фотосинтеза [18–22] и транспирации [23, 24], активацию дыхания [25, 26], возрастание содержания ATP [26] и многое другое. По-видимому, конечным результатом развития электрических реакций является повышение устойчивости растения к действию неблагоприятных факторов [10, 11, 27–30].
Генерация электрических реакций представляет собой результат взаимодействия систем пассивного и активного ионного транспорта плазматической мембраны растительной клетки, включая, прежде всего, ионные каналы и транспортные ATP-азы. Так, при генерации ПД действие стрессоров умеренной интенсивности вызывает начальную деполяризацию мембранного потенциала и активацию Са2+-каналов плазматической мембраны, что приводит к входу ионов кальция из апопласта в цитоплазму и повышению их цитоплазматической концентрации [9, 31, 32]. В свою очередь, Са2+ активирует хлорные ионные каналы, индуцируя выход Cl– из клетки, и инактивирует Н+-ATP-азу [31–33]; оба процесса вызывают быструю деполяризацию мембраны. Последующее снижение концентрации Са2+, связанное с инактивацией Са2+-каналов при сильной деполяризации и с функционированием Ca2+-ATP-азы плазматической мембраны (выкачивающей наружу ионы кальция), вызванные таким снижением инактивация Cl–-каналов и реактивация Н+-ATP-азы плазматической мембраны, а также открытие активируемых деполяризацией К+-каналов приводят к реполяризации мембранного потенциала [31, 32]. Генерация вариабельного потенциала, вызываемого повреждающими воздействиями, происходит по сходному механизму, однако инактивация Н+-ATP-азы имеет более длительный и выраженный характер [32]. По-видимому, увеличение активности Н+-ATP-азы обеспечивает генерацию системного потенциала, представляющего собой распространяющийся гиперполяризационный сигнал, механизм которого до конца не изучен [11, 34, 35]. Таким образом, изменения активности Н+-ATP-азы плазматической мембраны играют, вероятно, ключевую роль в развитии электрических ответов у растений; кроме того, они могут также участвовать в развитии последующих физиологических ответов [36–40].
Важно отметить, что Н+-ATP-аза плазматической мембраны обладает высокой чувствительностью к широкому спектру факторов, действующих на растения [1–3, 41–44]; в частности, ее активность может регулироваться освещением, температурой, механическими воздействиями, различными химическими соединениями и т.д. В естественных условиях интенсивность таких факторов может флуктуировать в широком диапазоне значений и времен (например, колебания интенсивности освещения и, как следствие, изменения нагрева растения, воздействие ветра и т.д.). На основании этого можно ожидать, что флуктуации активности Н+-ATP-азы в естественных условиях весьма вероятны, а значит анализ их влияния на процессы электрогенеза растительной клетки является актуальной задачей.
Из литературы известно [45–50], что флуктуации могут играть в живых системах не только негативную, но и положительную роль. В частности, выявлено, что флуктуации величины электрического поля могут оказывать существенное влияние на ионный транспорт через ионные каналы плазматической мембраны и, тем самым, увеличивать чувствительность рецепторов [51], повышать интенсивность мембранного транспорта [52], модулировать взаимодействие нейронов [53]; т.е. флуктуации могут оказывать существенное влияние на процессы, связанные с электрогенезом клеток животных. Более того, существует гипотеза о том, что ширина распределения значений мембранного потенциала вокруг средней величины может быть связана с пороговыми характеристиками для переключения на другой уровень мембранного потенциала и с управлением физиологическими процессами [4]. По-видимому, такие эффекты связаны, прежде всего, со снижением порога для развития электрического ответа, что близко к механизму стохастического резонанса [45, 51], при котором дополнительная энергия, сообщаемая системе флуктуациями, облегчает ее переход через потенциальный барьер между различными состояниями системы при действии подпороговой силы.
Следует отметить, что экспериментальный анализ влияния флуктуаций активности систем ионного транспорта на биоэлектрогенез растительной клетки затруднен. Это связано как со сложностью использования стандартных методов исследования электрической активности (прежде всего, микроэлектродного отведения) в естественных условиях, так и с комплексным характером механизмов электрогенеза (результирующие изменения мембранного потенциала зависят от широкого спектра взаимодействующих процессов). Потенциально для решения такой проблемы могут быть использованы теоретические методы, в частности математическое моделирование процессов электрогенеза у растений в условиях флуктуаций параметров систем ионного транспорта. В настоящее время предложен ряд математических моделей, описывающих различные аспекты биоэлектрогенеза растений [39, 40, 54–65]; в частности, нами была ранее разработана математическая модель генерации ПД в условиях постепенного охлаждения [57, 58], которая может быть использована для анализа влияния флуктуаций на электрическую активность.
Таким образом, целью настоящей работы является теоретический анализ влияния флуктуаций активности Н+-ATP-азы плазматической мембраны на холодоиндуцированные электрические реакции, проведенные с использованием модели электрогенеза растительной клетки.
ОПИСАНИЕ МОДЕЛИ
В работе была использована новая модификация ранее разработанной авторами модели [57, 64], которая описывала электрогенез растительной клетки в условиях физиологического покоя и при действии на нее постепенного охлаждения. Рис. 1 показывает общую схему модели и ее основные уравнения. При этом модель описывала процессы активного и пассивного ионного транспорта, включая потенциалзависимые ионные каналы (Ca2+-каналы, Cl–-каналы, активируемые деполяризацией и гиперополяризацией K+-каналы), транспортные ATP-азы (Ca2+- и H+-ATP-азы) и системы вторичного активного транспорта (2H+/Cl−-симпортер и H+/K+-обменник).
Рис. 1.
Электрофизиологическая схема растительной клетки, использованная для моделирования электрогенеза растений в условиях флуктуаций активности Н+-ATP-азы плазматической мембраны, и ее уравнения (на основе работы [53] с модификациями). Em – мембранный потенциал, Pmax – максимальная проницаемость ионного канала, po и pi, – вероятности его открытого и инактивированного состояний, соответственно, k+o(+i) и k–o(–i) – константы скорости перехода ионного канала из закрытого в открытое и обратно (o) или из открытого в инактивированное и обратно (i), ko(i) – константа скорости перехода межу закрытым и открытым (открытым и инактивированным) состояниями при нулевых значениях Em и Eo(i), Co(i) – константа, отражающая заряд воротной структуры и величину ее смещения, необходимого для переходов закрытое – открытое (открытое – инактивированное) состояния, Eo(i) – потенциал, необходимый для перехода половины каналов в открытое (инактивированное) состояние, Act – коэффициент активации хлорных каналов ионами кальция, KA – константа связывания ионов кальция хлорными каналами, Eo – концентрация H+- или Ca2+- ATP-азы, k+1, k–1, k+2, и k–2 – константы скорости прямых и обратных переходов между двумя состояниями ионной ATP-азы, k1 и k2 – константы скорости при нулевом Em и концентрациях ионов 1 М, Inact – коэффициент инактивации H+-ATP-азы ионами кальция, KI – константа связывания ионов кальция H+-ATP-азой, VCl и VK – общие константы скорости 2H+/Cl−-симпортера и H+/K+-обменника, соответственно, $B_{{{\text{in}}}}^{ - }$ и BHin – свободные и связанные с протонами буферные молекулы в цитоплазме, $B_{{{\text{out}}}}^{ - }$, BHout, и BKout – свободные, связанные с протонами и связанные с ионами калия буферные молекулы в апопласте. Стрелки показывают (i) учтенную в модели кальциевую регуляцию: положительное влияние (+) Ca2+ на хлорные каналы и отрицательное влияние (–) на H+-ATP-азу, а также (ii) флукутации активности H+-ATP-азы, которые были описаны путем умножения величины потока Н+ через фермент на нормально распределенную переменную ξ (ξ = 1 ± SD, SD – стандартное отклонение значений от среднего). При этом в ходе анализа, ξ описывали как 1 + σ, где σ – случайная величина со средним значением равным нулю и стандартным отклонением равным SD. Процедура расчета σ описана в тексте. Текущие значения ξ менялись случайным образом каждую секунду модельного времени. Охлаждение имитировали снижением температуры со скоростью 4°С мин–1; влияние температуры на активность ферментов описывали стандартным способом через коэффициент Q10, равный 3 (${\text{Активность}} = {{Q}_{{10}}}^{{\frac{{{{T}_{0}} - T}}{{10}}}}$, где T0 – начальная температура равная 25°С).
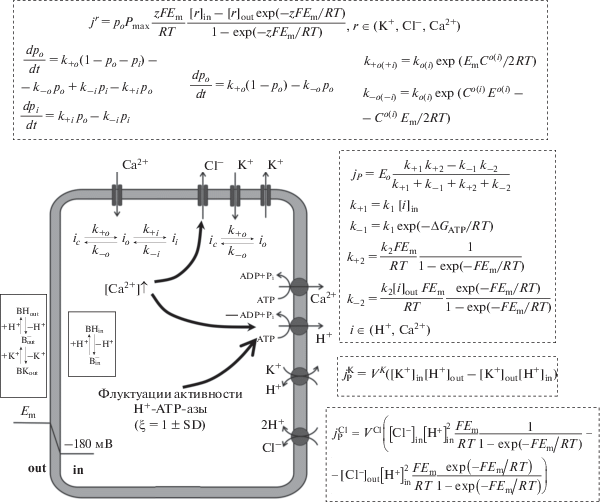
Транспорт ионов через каналы описывали с использованием уравнения Гольдмана–Ходжкина–Катца для потока [64]. Потенциалзависимую регуляцию ионных каналов описывали на основе вероятности открытого состояния; при этом у Cl–-каналов и активируемых деполяризацией и гиперополяризацией K+-каналов учитывали два состояния (закрытое и открытое), а у Ca2+-каналов учитывали три состояния (закрытое, открытое и инактивированное) [56, 57, 64]. Для хлорных ионных каналов учитывали их активацию ионами кальция.
Описание транспорта через Ca2+- и H+-ATP-азы моделировали на основе “two-state” модели, которая учитывала два состояния фермента – свободное и связанное с ионом, а также переходы между ними [64]. В работе также учитывали инактивацию H+-ATP-азы ионами кальция.
Системы вторичного активного транспорта были описаны на основании простых уравнений химической кинетики с учетом того, что 2H+/Cl−-симпортер является электрогенным переносчиком, а H+/K+-обменник – неэлектрогенная система ионного транспорта [57].
Изменения ионных концентраций описывали на основании величины и направления потоков соответствующих ионов. При этом в соответствии с модифицированным авторами подходом Градманна [56, 57] в модели учитывали буферные свойства цитоплазмы (для протонов) и апопласта (для протонов и ионов калия) (рис. 1).
Для описания влияния температуры на системы активного транспорта вводили специальный коэффициент на основании Q10, которое принимали равным трем для всех систем активного транспорта [57].
Принципиально новым элементом модели было описание флуктуаций активности H+-ATP-азы. Для этого величину потока через H+-ATP-азу плазматической мембраны умножали на случайную переменную ξ, имеющую нормальное распределение. При этом среднее значение ξ было равно единице, а стандартное отклонение значений (SD) составляло в различных вариантах анализа 1, 5, 10, 15 и 20% от среднего значения. Для реализации такого описания ξ задавали как 1 + σ, где σ – нормально распределенная случайная величина, SD которой была равна стандартному отклонению для ξ, а среднее значение равнялось нулю. Расчет σ опирался на центральную предельную теорему; для его реализации использовали уравнение (1), которое позволяло достаточно эффективно имитировать нормально распределенную случайную величину с нулевым средним значением:
(1)
$\sigma = a\frac{{\sum\limits_{i = 1}^{10} {\left( {0.5 - {\text{RND}}} \right) + } \sum\limits_{i = 1}^{10} {\left( {{\text{RND}} - 0.5} \right)} }}{{20}},$При анализе модели использовали параметры, предложенные авторами в более ранней работе [57], что позволяло максимально стандартизировать результаты и оценивать только влияние флуктуаций (без дополнительного анализа возможного влияния на результат других средних значений параметров модели). Флуктуации каких-либо других величин, кроме потока протонов через H+-ATP-азу плазматической мембраны, в работе не учитывали.
Уравнения модели решали численно методом Эйлера с использованием специально разработанной компьютерной программы. Учитывая использование случайной величины ξ в модели, при анализе применяли метод Монте-Карло, который заключался в многократном повторном моделировании имитируемого процесса и последующем анализе полученных результатов стандартными методами, применяемыми для анализа экспериментальных выборок. В рамках настоящей работы для каждого варианта анализа модели использовали выборку, включающую в себя 100 повторов.
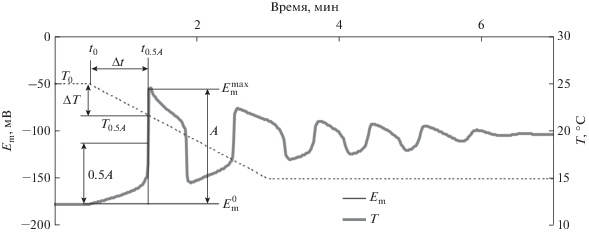
На рис. 2 показаны основные параметры холодоиндуцированных электрических реакций, анализируемые в работе. Амплитуда реакции (А) определялась как разность между максимальным значением мембранного потенциала ($E_{{\text{m}}}^{{{\text{max}}}}$) и его величиной перед охлаждением ($E_{{\text{m}}}^{0}$). При определении длительности (Δt) и величины (ΔT) охлаждения, необходимых для генерации первого ПД, за начало потенциала действия принимали момент (t0.5A), в который величина изменений мембранного потенциала достигала половины от амплитуды реакции. Такой подход позволил избежать искажений, связанных с моментом определения начала ПД, которые могут быть существенны в вариантах с флуктуациями активности H+-ATP-азы.
Рис. 2.
Холодоиндуцированный электрический ответ растительной клетки, имитированный моделью без флуктуаций активности Н+-ATP-азы плазматической мембраны, и анализируемые параметры. А – амплитуда электрического ответа, которая рассчитывалась как разность величины мембранного потенциала в максимуме деполяризации при развитии первого потенциала действия ($E_{{\text{m}}}^{{{\text{max}}}}$) и средней величины мембранного потенциала в течение 5 мин перед началом охлаждения ($E_{{\text{m}}}^{0}$). Δt – длительность охлаждения, необходимая для генерации потенциала действия, которая рассчитывалась как разность времени достижения изменениями мембранного потенциала половины от амплитуды (t0.5A) и времени начала охлаждения (t0). ΔT – величина охлаждения, необходимая для генерации потенциала действия, которая рассчитывалась как разность температуры в момент достижения изменениями мембранного потенциала половины от амплитуды (T0.5A) и температуры в момент начала охлаждения (T0).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
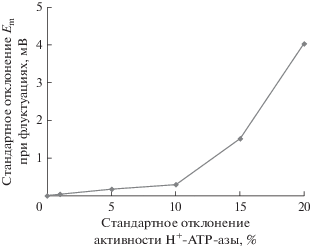
На рис. 3 показаны примеры динамики мембранного потенциала, имитированных моделью в условиях отсутствия стимуляции при разных величинах флуктуаций активности H+-ATP-азы плазматической мембраны; стандартные отклонения значений активности составляли 0 (контроль), 1, 5, 10, 15 и 20% от среднего значения. Как можно видеть из рисунка, повышение величины флуктуаций активности H+-ATP-азы приводило к возникновению флуктуаций мембранного потенциала, амплитуда которых возрастала при увеличении стандартного отклонения значений активности H+-ATP-азы. При этом высокие значения флуктуаций могли приводить к индукции ПД в условиях отсутствия охлаждения: при стандартном отклонении 15% самопроизвольная генерация ПД наблюдалась в 4 случаях из 100, а при стандартном отклонении 20% – в 51 случае из 100. Количественный анализ показал (рис. 4), что возрастание стандартного отклонения активности H+-ATP-азы приводило к нелинейному возрастанию стандартного отклонения величины мембранного потенциала. При этом резкое возрастание стандартного отклонения мембранного потенциала при больших величинах флуктуаций H+-ATP-азы связано, по-видимому, с самопроизвольной генерацией ПД в этих условиях.
Рис. 3.
Примеры динамики имитированного моделью мембранного потенциала (Em) при различном уровне флуктуаций H+-ATP-азы плазматической мембраны. При этом поток протонов через H+-ATP-азу описывали случайной величиной с величиной стандартного отклонения 0% (контроль) (а), 1% (б), 5% (в), 10% (г), 15% (д) и 20% (е). Средняя активность фермента не менялась, период между случайными изменениями активности составлял 1 с.
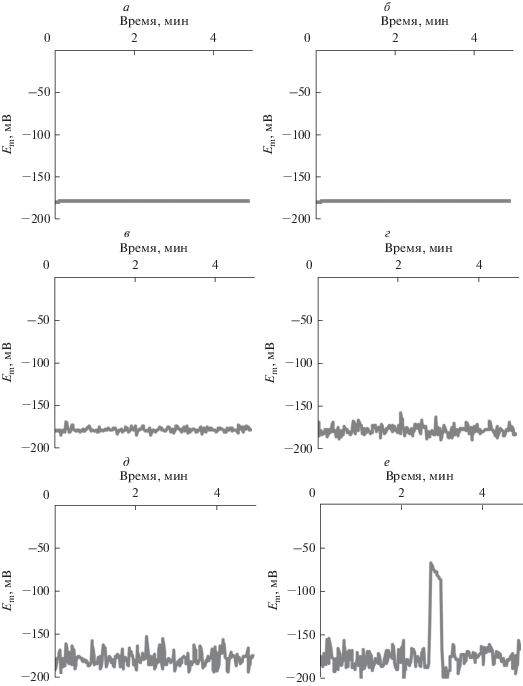
Рис. 4.
Зависимость стандартного отклонения имитированного моделью мембранного потенциала (Em) в условиях без стимуляции от стандартного отклонения активности H+-ATP-азы плазматической мембраны. Величина флуктуаций описывалась нормальным распределением с заданным стандартным отклонением; в качестве точки с нулевым стандартным отклонением брали вариант без флуктуаций. Средняя активность фермента не менялась, период между случайными изменениями активности составлял 1 с. Стандартное отклонение Em рассчитывали как стандартное отклонение между средними значениями имитированного моделью мембранного потенциала (на временном интервале 5 мин). Количество повторов при моделировании каждого варианта было равно 100.
Задачей дальнейшего анализа было исследование влияния интенсивности флуктуаций на холодоиндуцированные электрические ответы, имитированные моделью электрогенеза растительной клетки. При этом из дальнейшего анализа были полностью исключены варианты со стандартными отклонениями активности H+-ATP-азы 1% (так как флуктуации мембранного потенциала в этих условиях практически отсутствовали) и 20% (так как в этих условиях наблюдалось значительное число самопроизвольных генераций ПД). Небольшое количество повторов в варианте со стандартным отклонением активности H+-ATP-азы 15%, у которых наблюдалась самопроизвольная генерация ПД, также было исключено из рассмотрения. Варианты с самопроизвольной генерацией ПД были исключены из рассмотрения, так как такая генерация крайне редко наблюдается у растений [1]; кроме того, в условиях самопроизвольной генерации ответов невозможно корректно оценить пороги генерации потенциалов действия при охлаждении.
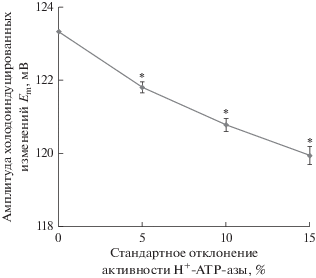
Рис. 5 показывает примеры холодоиндуцированных электрических реакций в условиях различной величины флуктуаций активности H+-ATP-азы. Из рисунка можно видеть, что усиление флуктуаций достаточно слабо влияло на форму ПД, в то же время нестабильность подпороговых изменений мембранного потенциала возрастала. Кроме того, в приведенных примерах наблюдалось некоторое снижение длительности и величины охлаждения, необходимого для генерации ПД, т.е. наблюдалось снижение порога генерации потенциала действия. Последующий количественный анализ показал, что увеличение флуктуаций активности H+-ATP-азы действительно приводило к статистически значимому снижению длительности охлаждения, предшествующего генерации ПД (рис. 6а), а также величины охлаждения, вызывающего генерацию потенциала действия (рис. 6б). При этом снижение этих показателей могло достигать 16% от уровня без флуктуаций. Анализ изменений амплитуды (рис. 7) также показал достоверное снижение ее величины при повышении величины флуктуаций активности H+-ATP-азы. Однако даже при максимальном исследованном стандартном отклонении значения активности H+-ATP-азы (15%) такое снижение амплитуды было менее 3% от уровня без флуктуаций.
Рис. 5.
Примеры имитированных моделью изменений мембранного потенциала (Em) в условиях постепенного снижения температуры (Т) в условиях флуктуации активности H+-ATP-азы плазматической мембраны. При этом поток протонов через H+-ATP-азу описывали случайной величиной с величиной стандартного отклонения 0% (контроль) (а), 5% (б), 10% (в) и 15% (г). Средняя активность фермента не менялась; период между случайными изменениями активности составлял 1 с. Скорость охлаждения составляла 4°C мин–1.
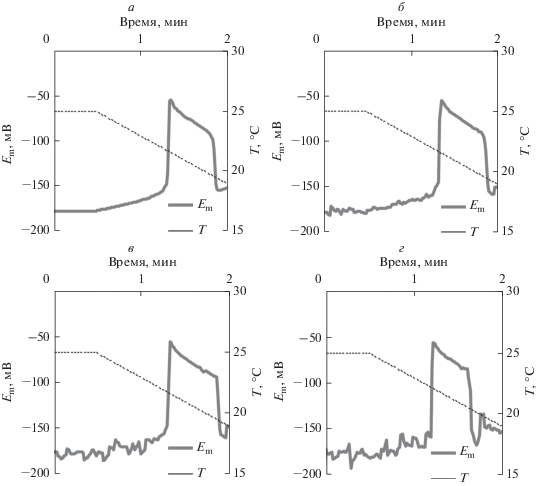
Рис. 6.
Зависимость времени охлаждения, предшествующего началу генерации потенциала действия (ПД) (а), и величины снижения температуры за этот период (б) от стандартного отклонения активности H+-ATP-азы плазматической мембраны. Величина флуктуаций описывалась нормальным распределением с заданным стандартным отклонением; в качестве точки с нулевым стандартным отклонением брали вариант без флуктуаций. Период между случайными изменениями активности составлял 1 с. Скорость охлаждения составляла 4°C мин–1. За начало генерации ПД принимали время, за которое изменения мембранного потенциала достигали 50% от максимальной величины; анализировали только первый потенциал действия. Количество повторов при моделировании каждого варианта равнялось 100. * – отличия от варианта без флуктуаций были статистически значимы (p < 0.05).
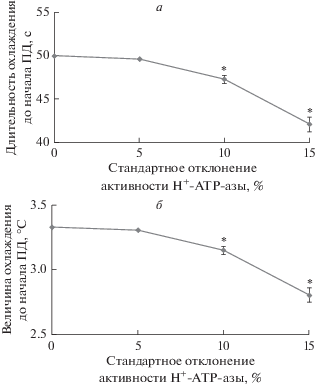
Рис. 7.
Зависимость амплитуды холодоиндуцированных изменений мембранного потенциала (Em) от стандартного отклонения активности H+-ATP-азы плазматической мембраны в ходе флуктуаций. Величина флуктуаций описывалась нормальным распределением с заданным стандартным отклонением; в качестве точки с нулевым стандартным отклонением брали вариант без флуктуаций. Период между случайными изменениями активности составлял 1 с. Скорость охлаждения составляла 4°C мин–1. Амплитуду изменений Em рассчитывали как разность величины мембранного потенциала в максимуме деполяризации при развитии первого потенциала действия и средней величины мембранного потенциала в течение 5 мин перед началом охлаждения; т.е. изменения Em включали в себя как подпороговые изменения потенциала, так и потенциал действия. Количество повторов при моделировании каждого варианта равнялось 100. * – отличия от варианта без флуктуаций были статистически значимы (p < 0.05).
Полученные результаты указывают на то, что добавление в модель флуктуаций активности H+-ATP-азы может приводить к снижению порога генерации ПД при постепенном охлаждении, т.е. вызывает возрастание чувствительности растения к холодовому воздействию. Это хорошо согласуется с литературными данными о способности флуктуаций облегчать переход системы в новое состояние [45, 46], в частности об их способности повышать чувствительность рецепторов [51] или увеличивать устойчивость растений к действию стрессоров [66]. По-видимому, механизм выявленного эффекта близок к общему механизму стохастического резонанса [41, 45]: в каждый момент времени повторяющиеся флуктуации активности H+-ATP-азы могут как повышать, так и понижать чувствительность клетки к охлаждению (сдвигая мембранный потенциал в положительную или отрицательную сторону, соответственно). Однако даже кратковременное повышение чувствительности (сдвиг мембранного потенциала в положительную сторону) на фоне снижения температуры может оказаться достаточным для начала генерации ПД. При этом снижение чувствительности клетки к охлаждению, которое может развиться при следующей флуктуации активности H+-ATP-азы, уже не будет существенно влиять на генерацию ПД, что подтверждается слабым влиянием флуктуаций на динамику мембранного потенциала во время генерации импульса (рис. 5). Самопроизвольная генерация ПД в условиях высокого уровня флуктуаций (рис. 3е) также согласуется с таким механизмом, так как при значительных флуктуациях активности H+-ATP-азы деполяризация может превысить порог для генерации ПД даже при отсутствии стимуляции.
На завершающем этапе анализа модели мы исследовали особенности усредненных холодоиндуцированных изменений мембранного потенциала. Такие изменения были получены для каждой из величин флуктуаций активности H+-ATP-азы путем усреднения всех повторов. Найденные при этом значения соответствовали электрическому ответу, который мог бы быть получен при экстраклеточном измерении изменений мембранного потенциала с ансамбля не связанных между собой возбудимых клеток растения (или клеток с очень слабой электрической связью). Учитывая, что экстраклеточное измерение потенциала может быть реализовано в естественных условиях (в отличие от внутриклеточного) и что электрическая связь между растительными клетками может быть достаточно слабой (например, в основной ткани стебля) [1], анализ такого варианта имел методическое значение, позволяя оценить влияние флуктуаций на результаты экстраклеточных измерений в нестабильных условиях среды.
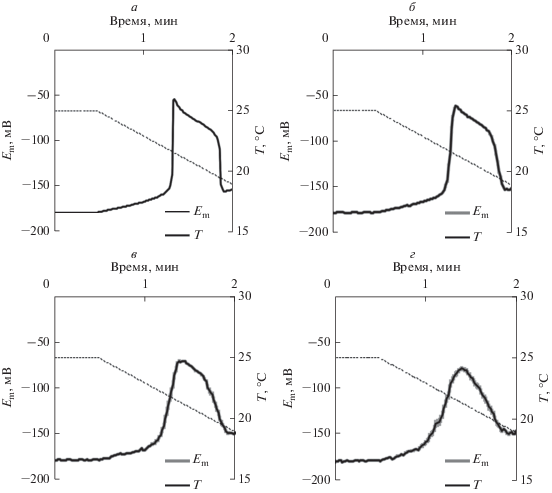
На рис. 8 приведены усредненные динамики холодоиндуцированных изменений мембранного потенциала, которые рассчитывали по 100 независимо имитированным моделью динамикам мембранного потенциала в условиях полностью идентичного охлаждения (различия между такими динамиками были связаны со случайными изменениями активности H+-ATP-азы плазматической мембраны, уникальными для каждого моделирования). Из рисунка видно, что величина флуктуаций активности H+-ATP-азы существенно влияла на усредненные динамики холодоиндуцированных электрических ответов. В частности, при возрастании величины флуктуаций снижение порога генерации ПД сопровождалось уменьшением амплитуды электрической реакции; такое уменьшение могло достигать 17% от величины в условиях отсутствия флуктуаций активности H+-ATP-азы. Также следует отметить, что увеличение флуктуаций приводило к утрате характерной формы ПД у растений, включающей в себя быструю деполяризацию и двухфазную реполяризацию [57]: усредненная деполяризация существенно замедлялась, а реполяризация становилась однофазной. По-видимому, такой эффект связан с уменьшением синхронности генерации ПД в различных клетках (амплитуды ПД на уровне отдельных клеток уменьшаются очень слабо, рис. 7), что приводит к снижению усредненных значений изменений и утрате “тонких” особенностей динамики ответов. Полученные результаты теоретически прогнозируют артефакт, который будет возникать при использовании экстраклеточного отведения и исследовании клеток со слабой электрической связью; это может быть полезным при планировании экспериментов и анализе экспериментальных данных.
Рис. 8.
Усредненные значения имитированных моделью изменений мембранного потенциала (Em) в условиях постепенного снижения температуры (Т) в условиях флуктуации активности H+-ATP-азы плазматической мембраны. При этом поток протонов через H+-ATP-азу описывали случайной величиной с величиной стандартного отклонения 0% (контроль) (а), 5% (б), 10% (в) и 15% (г). Средняя активность фермента не менялась; период между случайными изменениями активности составлял 1 с. Скорость охлаждения составляла 4°C мин–1. Количество повторов при моделировании каждого варианта равнялось 100; усреднение осуществлялось по всем повторам. Стандартные отклонения средних значений показаны серой зоной вокруг усредненных кривых.
В целом, полученные результаты показывают, что флуктуации активности H+-ATP-азы могут повышать чувствительность растительных клеток к воздействию охлаждения и облегчать генерацию электрических реакций. Это согласуется с представлениями о “конструктивной” роли шума в регуляции процессов в живых системах [50] и подтверждает возможность участия флуктуаций в развитии системного стрессового ответа растений на действие неблагоприятных факторов.
Разработка математической модели генерации холодоиндуцированных электрических ответов в условиях флуктуаций активности H+-ATP-азы, а также анализ влияния таких флуктуаций на параметры электрических ответов был выполнен при финансовой поддержке РФФИ в рамках научного проекта № 19-04-00614 А. Анализ возможности самопроизвольной генерации ответов при увеличении амплитуды флуктуаций был осуществлен при финансовой поддержке гранта Президента РФ для поддержки молодых кандидатов наук МК-2707.2019.11.
Список литературы
Опритов В.А., Пятыгин С.С., Ретивин В.Г. 1991. Биоэлектрогенез высших растений. М.: Наука. 216 с.
Пятыгин С.С. 2003. Электрогенез клеток растений в условиях стресса. Успехи соврем. биологии. 123, 552–562.
Krol E., Dziubińska H., Trebacz K. 2004. Low-temperature-induced transmembrane potential changes in mesophyll cells of Arabidopsis thaliana, Helianthus annuus and Vicia faba. Physiol. Plant. 120, 265–270.
Зацепина Г.Н., Безматерных П.М., Коломиец A.A., Тульский C.B., Цаплев Ю.Б. 1992. Электрическая система регуляции процессов жизнедеятельности. М.: Изд-во МГУ. 159 с.
Зацепина Г.Н., Цаплев Ю.Б. 1987. Зависимость регенерации корней традесканции от pH, амплитуды вариабельного потенциала и постоянного электрического поля растения. Биофизика. 32, 492–495.
Зацепина Г.Н., Коломиец A.A., Пономарев Е.Е. 1991. Корреляция между постоянным электрическим полем черешка кислицы и физиологическим состоянием растения. Биофизика. 36, 895–898.
Зацепина Г.Н., Цогбадрах М., Тульский C.В. 1991. Влияние постоянного электрического поля и pH омывающего корней раствора на процесс регенерации листа и корня филлокактуса. Биофизика. 36, 133–136.
Davies E. 2006. Electrical signals in plants: Facts and hypotheses. In: Plant electrophysiology. Theory and methods. Ed. Volkov A.G. Berlin, Heidelberg, New York: Springer-Verlag, p. 407–422.
Fromm J., Lautner S. 2007. Electrical signals and their physiological significance in plants. Plant. Cell. Environ. 30, 249–257.
Sukhov V. 2016. Electrical signals as mechanism of photosynthesis regulation in plants. Photosynth. Res. 130, 373–387.
Sukhov V., Sukhova E., Vodeneev V. 2019. Long-distance electrical signals as a link between the local action of stressors and the systemic physiological responses in higher plants. Progr. Biophys. Mol. Biol. 146, 63–84.
Peña-Cortés H., Fisahn J., Willmitzer L. 1995. Signals involved in wound-induced proteinase inhibitor II gene expression in tomato and potato plants. Proc. Natl. Acad. Sci. USA. 92, 4106–4113.
Mousavi S.A., Chauvin A., Pascaud F., Kellenberger S., Farmer E.E. 2013. Glutamate receptor-like genes mediate leaf-to-leaf wound signalling. Nature. 500, 422–426.
Hlavácková V., Krchnák P., Naus J., Novák O., Spundová M., Strnad M. 2006. Electrical and chemical signals involved in short-term systemic photosynthetic responses of tobacco plants to local burning. Planta. 225, 235–244.
Hlavinka J., Nožková-Hlaváčková V., Floková K., Novák O., Nauš J. 2012. Jasmonic acid accumulation and systemic photosynthetic and electrical changes in locally burned wild type tomato, ABA-deficient sitiens mutants and sitiens pre-treated by ABA. Plant Physiol. Biochem. 54, 89–96.
Krausko M., Perutka Z., Šebela M., Šamajová O., Šamaj J., Novák O., Pavlovič A. 2017. The role of electrical and jasmonate signalling in the recognition of captured prey in the carnivorous sundew plant Drosera capensis. New Phytol. 213, 1818–1835.
Pavlovič A., Jakšová J., Novák O. 2017. Triggering a false alarm: Wounding mimics prey capture in the carnivorous Venus flytrap (Dionaea muscipula). New Phytol. 216, 927–938.
Krupenina N.A., Bulychev A.A. 2007. Action potential in a plant cell lowers the light requirement for non-photochemical energy-dependent quenching of chlorophyll fluorescence. Biochim. Biophys. Acta. 1767, 781–788.
Krupenina N.A., Bulychev A.A., Roelfsema M.R.G., Schreiber U. 2008. Action potential in Chara cells intensifies spatial patterns of photosynthetic electron flow and non-photochemical quenching in parallel with inhibition of pH banding. Photochem. Photobiol. Sci. 7, 681–688.
Pavlovič A., Slováková L., Pandolfi C., Mancuso S. 2011. On the mechanism underlying photosynthetic limitation upon trigger hair irritation in the carnivorous plant Venus flytrap (Dionaea muscipula Ellis). J. Exp. Bot. 62, 1991–2000.
Sukhov V., Sherstneva O., Surova L., Katicheva L., Vodeneev V. 2014. Proton cellular influx as a probable mechanism of variation potential influence on photosynthesis in pea. Plant. Cell. Environ. 37, 2532–2541.
Sukhova E., Mudrilov M., Vodeneev V., Sukhov V. 2018. Influence of the variation potential on photosynthetic flows of light energy and electrons in pea. Photosynth. Res. 136, 215–228.
Kaiser H., Grams T.E., 2006. Rapid hydropassive opening and subsequent active stomatal closure follow heat-induced electrical signals in Mimosa pudica. J. Exp. Bot. 57, 2087–2092.
Сурова Л.М., Шерстнева О.Н., Мысягин С.А., Воденеев В.А., Сухов В.С. 2019. Влияние локального повреждения на транспирацию листьев гороха при различной влажности воздуха. Физиология растений. 66, 58–65.
Filek M., Kościelniak J. 1997. The effect of wounding the roots by high temperature on the respiration rate of the shoot and propagation of electric signal in horse bean seedlings (Vicia faba L. minor). Plant Sci. 123, 39–46.
Surova L., Sherstneva O., Vodeneev V., Katicheva L., Semina M., Sukhov V. 2016. Variation potential-induced photosynthetic and respiratory changes increase ATP content in pea leaves. J. Plant Physiol. 202, 57–64.
Sukhov V., Surova L., Sherstneva O., Vodeneev V. 2014. Influence of variation potential on resistance of the photosynthetic machinery to heating in pea. Physiol. Plant. 152, 773–783.
Sukhov V., Surova L., Sherstneva O., Bushueva A., Vodeneev V. 2015. Variation potential induces decreased PSI damage and increased PSII damage under high external temperatures in pea. Funct. Plant. Biol. 42, 727–736.
Surova L., Sherstneva O., Vodeneev V., Sukhov V. 2016. Variation potential propagation decreases heat-related damage of pea photosystem I by 2 different pathways. Plant Sign. Behav. 11, e1145334.
Sukhov V., Gaspirovich V., Mysyagin S., Vodeneev V. 2017. High-temperature tolerance of photosynthesis can be linked to local electrical responses in leaves of pea. Front. Physiol. 8, 763.
Felle H.H., Zimmermann M.R. 2007. Systemic signalling in barley through action potentials. Planta. 226, 203–214.
Vodeneev V., Akinchits E., Sukhov V. 2015. Variation potential in higher plants: Mechanisms of generation and propagation. Plant. Signal. Behav. 10, e1057365.
Воденеев В.А., Опритов В.А., Пятыгин С.С. 2006. Обратимое изменение внутриклеточного рН при генерации потенциала действия у высшего растения Cucurbita pepo. Физиология растений. 53, 538–545.
Zimmermann M.R., Maischak H., Mithöfer A., Boland W., Felle H.H. 2009. System potentials, a novel electrical long-distance apoplastic signal in plants, induced by wounding. Plant Physiol. 149, 1593–1600.
Zimmermann M.R., Mithöfer A., Will T., Felle H.H., Furch A.C. 2016. Herbivore-triggered electrophysiological reactions: Candidates for systemic signals in higher plants and the challenge of their identification. Plant Physiol. 170, 2407–2419.
Sukhov V., Sherstneva O., Surova L., Katicheva L., Vodeneev V. 2014. Proton cellular influx as a probable mechanism of variation potential influence on photosynthesis in pea. Plant. Cell. Environ. 37, 2532–2541.
Шерстнева О.Н., Воденеев В.А., Катичева Л.А., Сурова Л.М., Сухов В.С. 2015. Участие изменений внутри- и внеклеточного pH в развитии вызванного вариабельным потенциалом фотосинтетического ответа у проростков тыквы. Биохимия. 8, 920–930.
Шерстнева О.Н., Сурова Л.М., Воденеев В.А., Плотникова Ю.И., Бушуева А.В., Сухов В.С. 2015. Роль внутри и внеклеточных протонов в индукции фотосинтетического ответа вариабельным потенциалом в проростках гороха. Биол. мембраны. 32, 446–454.
Шерстнева О.Н., Воденеев В.А., Сурова Л.М., Новикова Е.М., Сухов В.С. 2016. Использование математической модели вариабельного потенциала для анализа его влияния на фотосинтез высших растений. Биол. мембраны. 33, 293–302.
Сухова Е.М., Сухов В.С. 2018. Зависимость поступления CO2 в растительную клетку от активности Н+-ATP-азы плазматической мембраны. Теоретический анализ. Биол. мембраны. 35, 52–65.
Опритов В.А. Функциональные аспекты биоэлектрогенеза у высших растений. 59-е Тимирязевское чтение. Н. Новгород: Изд-во ННГУ, 1998. 46 с.
Krol E., Trebacz K. 1999. Calcium-dependent voltage transients evoked by illumination in the liverwort Conocephalum conicum. Plant Cell Physiol. 40, 17–24.
Пятыгин С.С. 2004. Роль плазматической мембраны в восприятии холодового воздействия на клетки растений. Биол. мембраны. 21, 442–449.
Пятыгин С.С., Воденеев В.А., Опритов В.А. 2006. Деполяризация плазматической мембраны как универсальная первичная биоэлектрическая реакция растительных клеток на действие различных факторов. Успехи соврем. биологии. 126, 493–502.
Gammaitoni L., Hanggi P., Jung P., Marchesoni F. 1998. Stochastic resonance. Rev. Mod. Phys. 70, 223–287.
Paulsson J., Berg O.G., Ehrenberg M. 2000. Stochastic focusing: Fluctuation-enhanced sensitivity of intracellular regulation. Proc. Natl. Acad. Sci. USA. 97, 7148–7153
Berg O.G., Paulsson J., Ehrenberg M. 2000. Fluctuations and quality of control in biological cells: Zero-order ultrasensitivity reinvestigated. Biophys. J. 79, 1228–1236.
Berg O.G., Paulsson J., Ehrenberg M. 2000. Fluctuations in repressor control: Thermodynamic constraints on stochastic focusing. Biophys. J. 79, 2944–2953.
Rao C.V., Wolf D.M., Arkin P.A. 2002. Control, exploitation and tolerance of intracellular noise. Nature. 420, 231–237.
Steuer R., Zhou C., Kurths J. 2003. Constructive effects of fluctuations in genetic and biochemical regulatory systems. BioSystems. 72, 241–251.
Wellens T., Shatokhin V., Buchleitner A. 2004. Stochastic resonance. Rep. Prog. Phys. 67, 45–105.
Fulinski A. 1997. Active transport in biological membranes and stochastic resonances. Phys. Rev. Lett. 79, 4926–4929.
Volkov E.I., Ullner E., Zaikin A.A., Kurths J. 2003. Frequency-dependent stochastic resonance in inhibitory coupled excitable systems. Phys. Rev. E. 68, 061112.
Beilby M. J. 1982. C1– channels in Chara. R. Soc. London B. 299, 435–445.
Mummert H., Gradmann D. 1991. Action potentials in Acetabularia: Measurement and simulation of voltage-gated fluxes. J. Membr. Biol. 124, 265–273.
Gradmann D. 2001. Impact of apoplast volume on ionic relations in plant cells. J. Membr. Biol. 184, 61–69.
Sukhov V., Vodeneev V. 2009. Mathematical model of action potential in cells of vascular plants. J. Membr. Biol. 232, 59–67.
Sukhov V., Nerush V., Orlova L., Vodeneev V. Simulation of action potential propagation in plants. J. Theor. Biol. 291, 47–55.
Sukhov V., Akinchits E., Katicheva L., Vodeneev V. 2013. Simulation of variation potential in higher plant cells. J. Membr. Biol. 246, 287–296.
Beilby M.J., Al Khazaaly S. 2016. Re-modeling Chara action potential: I. From Thiel model of Ca2+ transient to action potential form. AIMS Biophysics. 3, 431–449.
Beilby M.J., Al Khazaaly, S. 2017. Re-modeling Chara action potential: II. The action potential form under salinity stress. AIMS Biophysics. 4, 298–315.
Evans M.J., Morris R.J. 2017. Chemical agents transported by xylem mass flow propagate variation potentials. Plant J. 91, 1029–1037.
Новикова Е.М., Воденеев В.А., Сухов В.С. 2017. Разработка математической модели потенциала действия высших растений, учитывающей роль вакуоли в генерации электрического сигнала. Биол. мембраны. 34, 109–125.
Sukhova E., Akinchits E., Sukhov V. 2017. Mathematical models of electrical activity in plants. J. Membr. Biol. 250, 407–423.
Blyth M.G., Morris R.J. 2019. Shear-enhanced dispersion of a wound substance as a candidate mechanism for variation potential transmission. Front. Plant. Sci. 10, 1393.
Сухов B.C., Воденеев В.А., Oпритов B.A. 2008. Анализ влияния уровня флуктуации в растительном организме на его устойчивость к действию стресс-факторов. Нелинейный мир. 6, 713–717.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


