Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 5, стр. 323-336
Фосфолипаза А2. Методы мониторинга активности
А. С. Алексеева a, И. А. Болдырев a, *
a Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
* E-mail: ivan@lipids.ibch.ru
Поступила в редакцию 07.05.2020
После доработки 13.05.2020
Принята к публикации 14.05.2020
Аннотация
Фосфолипазы А2 (ФЛА2) – белки, обладающие гидролитической активностью в отношении фосфолипидов, они отщепляют жирную кислоту из второго положения (sn-2) фосфолипида. Повышенная активность ФЛА2 коррелирует с протеканием в организме множества различных воспалительных процессов. Для целей диагностики и прогнозирования патологических процессов разрабатывают системы детектирования активности ФЛА2. Ключевой компонент всех тест-систем – это субстрат липидной или нелипидной природы, расщепление которого ферментом приводит к появлению анализируемого сигнала. Сами по себе липиды не поглощают свет в видимой области и не флуоресцируют, поэтому для определения активности ФЛА2 разрабатываются субстраты с различными метками. Тест-системы для определения активности ФЛА2 можно условно разделить на три группы в зависимости от того, на какой стадии действия фермента формируется сигнал: 1) системы, основанные на детектировании продуктов гидролиза; 2) системы, основанные на расщеплении флуоресцентно меченных субстратов; 3) системы, основанные на детектировании разрушения мембраны. У каждой из этих групп есть свои требования к строению субстрата. Настоящий обзор сфокусирован на строении субстратов ФЛА2, используемых в системах для определения активности фермента; предложенная классификация позволяет выявить сильные и слабые стороны существующих систем детектирования и будет актуальна при проектирования новых тест-систем.
ВВЕДЕНИЕ
Фосфолипазы А2 (ФЛА2) – обширное суперсемейство белков, обладающих гидролитической активностью в отношении фосфолипидов, они способны селективно отщеплять жирную кислоту из второго положения (sn-2) фосфолипида. На сегодняшний день принято выделять шесть семейств ФЛА2: секреторные, цитозольные, Са2+-независимые, ацетилгидролазы фактора активации тромбоцитов (к ним относится липопротеин-ассоциированная ФЛА2), лизосомальные и ФЛА2 жировой ткани. Наиболее представительным является семейство секреторных ФЛА2, которое включает в себя десять групп, каждая из которых имеет ряд подгрупп. Секреторные (внеклеточные) ФЛА2 обнаруживаются во всех тканях млекопитающих, входят в состав ядов змей и насекомых. Благодаря своей каталитической активности, ФЛА2 способны высвобождать жирные кислоты (например, арахидоновую) для циклооксигеназ, липоксигеназ и ферментов цитохрома P450, которые в свою очередь продуцируют различные медиаторы воспаления, включая лейкотриены, тромбоксаны и простагландины. Наиболее полное описание структурных особенностей, механизмов действия, локализации и роли в организме для каждого типа ФЛА2 можно найти в обзорах [1, 2].
Интерес к изучению эндогенных ФЛА2 вызван большим диапазоном патологий, в развитии которых участвует этот фермент (см. обзоры [2–5]). Выявление роли ФЛА2 позволит создать средства, влияющие на воспалительные процессы в организме, а в идеале управляющие ими [6].
Интерес к изучению экзогенных ФЛА2 (например, из ядов змей) связан с возможностью найти новые терапевтические средства, например, как это произошло с другими компонентами ядов змей [7]. Важной особенностью ФЛА2 является наличие у фермента двух сайтов связывания: один отвечает за связывание фермента с липидной мембраной, а второй – за связывание конкретной молекулы липида и ее гидролиз [8]. Строение каталитического сайта высококонсервативно и для разных представителей ФЛА2 уже достаточно хорошо изучено (например, для всех секреторных ФЛА2 это остатки His и Asp в каталитическом кармане) [1]. Сайт связывания с мембраной, напротив, формируется несколькими десятками аминокислот и различается от фермента к ферменту [9]. Активность и селективность фермента определяется работой обоих сайтов. По своей природе ФЛА2 являются типичными представителями поверхностных белков (т.е. действующих на поверхности, а не в растворе), и это определяет сложную кинетику ферментативного процесса [10].
Как и любой другой белок, ФЛА2 можно обнаружить с помощью антител. Методы ИФА разработаны для представительного набора секреторных ФЛA2 человека [11] и цитозольной ФЛА2 [12]. Основной недостаток методов ИФА для ФЛА2 состоит в том, что само наличие фермента еще не говорит о развитии патологии – важно, чтобы фермент проявлял активность (см., например, сравнительные исследования по определению ФЛА2 антителами и оценкой ее ферментативной активности [13, 14]). В биологических жидкостях присутствует ряд ФЛА2-связывающих белков, которые могут блокировать сайт связывания с мембраной и/или создавать стерические затруднения для связывания липидного субстрата [15].
Тест-системы для определения активности ФЛА2 разрабатываются с 70-х годов. Но только недавно первая тест-система была внедрена в клиническую практику в США для определения активности липопротеин-ассоциированной ФЛА2, которая позволяет прогнозировать течение ишемической болезни сердца [16]. Длительность времени, прошедшего с момента понимания роли ФЛА2 в развитии ишемической болезни сердца до момента внедрения тест-системы в клинику, показывает, насколько сложно оказалось сконструировать такую тест-систему. Тест-системы для детектирования активности других типов ФЛА2, пригодные для клинического применения, разработать пока не удалось. Однако коммерчески доступно несколько тест-систем для лабораторного определения активности секреторных ФЛА2. Отдельное направление исследований – это создание синтетических низкомолекулярных ингибиторов ФЛА2 [1, 17], оценка их эффективности также производится с помощью тест-систем.
Все тест-системы для определения активности ФЛА2 основаны на отслеживании гидролиза липидов. Это сложно сделать потому, что липиды не поглощают в видимой области и не луоресцируют. Кроме того, фермент действует не на индивидуальные молекулы липидов, а на липиды, организованные в бислойные мембраны. Эти два фактора существенно осложняют детектирование гидролиза липидов. Поэтому ключевым компонентом тест-систем для определения активности ФЛА2 являются меченые субстраты. Гидролиз такого субстрата или сразу приводит к появлению аналитического сигнала, или продукты гидролиза являются реакционноспособными соединениями, которые в свою очередь реагируют со вспомогательными веществами, давая новые продукты, которые можно отследить аналитически. Создание субстратов для определения активности ФЛА2 является сложной задачей. Настоящий обзор посвящен строению таких субстратов и предназначен для разработчиков тест-систем для определения ферментативной активности ФЛА2.
ДЕЙСТВИЕ ФЛА2 НА ЛИПИДНЫЙ БИСЛОЙ И ВОЗМОЖНОСТИ ДЕТЕКТИРОВАНИЯ ЕЕ АКТИВНОСТИ
Активность фермента определяется как число молей субстрата, преобразованных ферментом в единицу времени (ΔC/Δt). Для определения активности необходимо построить зависимость концентрации субстрата от времени, прошедшего с начала гидролиза. Из одной молекулы фосфолипида под действием ФЛА2 получается одна молекула лизолипида и одна молекула жирной кислоты. Активность ФЛА2 можно отслеживать как по уменьшению количества субстрата, так и по появлению одного из продуктов.
ФЛА2 как типичный представитель поверхностных белков не способна гидролизовать липиды в растворе и действует на поверхности липидной мембраны. Для разработки методов детектирования активности ФЛА2 действие фермента на липидный бислой удобно представить в виде трехстадийного процесса, схематически показанного на рис. 1. На первой стадии (i) связанный с мембраной фермент захватывает и гидролизует фосфолипид – высвобождаются продукты реакции: жирная кислота и лизолипид. На второй стадии (ii) продукты гидролиза за счет диффузии распределяются по мембране. На третьей стадии (iii) накопление продуктов гидролиза приводит к повреждению мембраны.
Рис. 1.
Схематическое представление действия ФЛА2 на бислой: i – захват и гидролиз фосфолипида; ii – распределение продуктов гидролиза по мембране; iii – разрушение мембраны за счет накопления продуктов гидролиза.
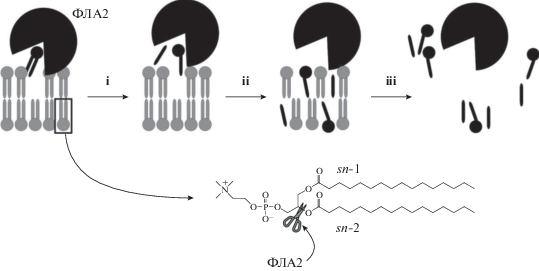
В соответствии со схемой на рис. 1 существует несколько возможностей зарегистрировать активность фермента: 1) отслеживание появления продуктов гидролиза; 2) отслеживание разрушения исходных фосфолипидов; 3) отслеживание разрушения липидной мембраны. Для каждого из этих случаев разработаны свои подходы.
Детектирования активности ФЛА2 по появлению продуктов гидролиза может быть реализовано с использованием природных липидов или липидов с изотопной меткой (рис. 2а). Появляющиеся продукты разделяют хроматографически, а их количество регистрируют. Для построения кинетической кривой необходимо провести несколько последовательных определений с интервалом времени от начала ферментативной реакции. Это единственная схема измерений, позволяющая рассчитать активность фермента напрямую, поскольку регистрируется непосредственно концентрация субстрата или продукта. Скорость изменения этой концентрации и есть активность фермента (ΔC/Δt).
Рис. 2.
Схемы детектирования активности ФЛА2. а – детектирование продуктов гидролиза с использованием природных липидов или липидов с изотопной меткой; б – детектирование активности фермента с использованием субстратов, которые при гидролизе формируют окрашенные продукты; в – детектирование активности фермента с использованием субстратов с флуоресцентной меткой; г – детектирования активности фермента по разрушению липидных агрегатов.
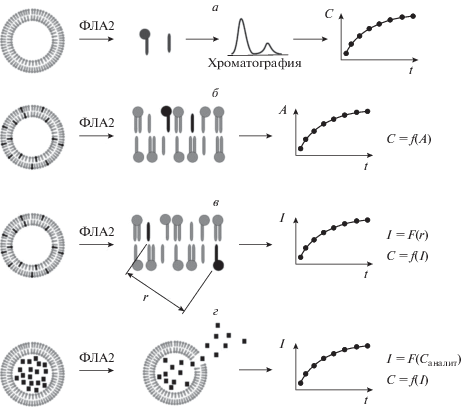
Если для детектирования ФЛА2 используются субстраты, которые при гидролизе дают окрашенные продукты, то за появлением таких продуктов можно следить спектрофотометрически без использования хроматографии (рис. 2б). Наблюдаемый сигнал является функцией от концентрации продукта и описывается законом Бугера–Ламберта–Бера. Однако меченый субстрат связывается с ферментом хуже, чем природные липиды, и поэтому скорость его гидролиза может быть меньше.
Кроме того, меченые субстраты используют вместе с природными липидами, которые формируют бислой, липидную матрицу, необходимую для нормального функционирования фермента. Липиды матрицы тоже гидролизуются ФЛА2. Однако сигнал по схеме б (рис. 2б) возникает только при гидролизе меченых субстратов, но не липидов матрицы.
Таким образом, для того чтобы по наблюдаемой активности фермента можно было судить о его реальной активности, необходимо вводить поправку.
На схеме в (рис. 2в) показано детектирование активности ФЛА2 по расщеплению субстратов с флуоресцентной меткой. В этом случае флуоресцентные зонды содержат флуорофор, присоединенный к одной из гидрофобных цепей липида (обычно в положении sn-2) и специфическую группировку, тушитель флуоресценции, прикрепленную к другой гидрофобной цепи или к полярной головке липида. к Тушение флуоресценции обычно происходит по механизму Фёрстеровского резонансного переноса энергии, интенсивность тушения флуоресценции обратно пропорциональна расстоянию между флуорофором и тушителем в шестой степени. До тех пор, пока флуорофор и тушитель находятся в одной молекуле, интенсивность флуоресценции низкая. При гидролизе и последующей диффузии продуктов гидролиза расстояние между флуорофором и тушителем увеличивается, и флуоресцентный сигнал растет. Если флуорофор и тушитель, несмотря на гидролиз, остаются в липидных агрегатах на некотором расстоянии r друг от друга, то, если это расстояние невелико, сохраняется остаточное тушение флуоресценции.
Кроме того, при анализе наблюдаемого сигнала следует учитывать, что на его уровень влияют рассеяние света в эмульсиях липосом, зависящее, в свою очередь, от хода гидролиза.
На следующей схеме (рис. 2г) показан способ детектирования активности ФЛА2 по разрушению бислоя или какого-либо другого липидного агрегата. В простом случае используют липосомы, во внутреннем водном объеме которых находится краситель (аналит). При разрушении липосом под влиянием фермента краситель вытекает из внутреннего водного объема липосом в окружающую среду, что приводит к изменению регистрируемого сигнала. При детектировании по схеме г аналит не связан ни с субстратом, ни с продуктами гидролиза. Разрушение липосом происходит при накоплении некоторого критического количества продуктов гидролиза.
Таким образом, в большинстве случаев наблюдаемый сигнал зависит от концентрации продуктов гидролиза сложным образом, и требуется внесение поправок. Исключение составляет использование природных липидов или липидов с изотопной меткой. В реальной лабораторной и клинической практике вместо определения всех поправок и выяснения всех зависимостей флуоресцентный сигнал калибруют с помощью стандартных растворов ферментов с известной активностью. Последнюю производитель стандартных растворов определяют по схеме а. Калибровка позволяет получать надежные результаты для систем с окрашенными и флуоресцентными субстратами (схемы б и в) и во многих случаях и для корректировки полученных по разрушению липидных агрегатов (схема г). Для проектирования новых тест-систем для определения ФЛА2 нужно уменьшать влияние всех посторонних (не связанных с ферментом) факторов на наблюдаемый сигнал.
ДЕТЕКТИРОВАНИЕ АКТИВНОСТИ ФЛА2 ПО ПОЯВЛЕНИЮ ПРОДУКТОВ ГИДРОЛИЗА
В простых системах, состоящих из единственного фермента и единственного типа липидов, для обнаружения продуктов гидролиза достаточно использовать тонкослойную хроматографию с окрашиванием по методу Васьковского [18], предложенному еще в 70-х годах. Этот метод окрашивания специфичен относительно остатков фосфата в молекулах липидов. Интенсивность окраски пропорциональна концентрации фосфатных групп, поэтому относительное количество исходных фосфолипидов и продуктов гидролиза, лизофосфолипидов, можно легко установить (см. пример в работе [19]). Метод не позволяет обнаружить малые количества продукта и вычислить небольшие приращения концентраций. Однако метод прост и применяется для обнаружения самого факта гидролиза.
В сложных многокомпонентных системах, таких как плазма крови, культуральная среда или клеточные лизаты, важно знать, что жирные кислоты и лизолипиды получены именно в ходе гидролиза во время измерения, а не присутствовали в системе изначально. Другими словами, если ФЛА2 в системе есть и она активна, в системе накапливаются продукты гидролиза. При определении активности фермента их надо отличать от тех продуктов гидролиза, которые образовались в ходе анализа. Для этого нужно или вести одновременный количественный мониторинг и субстратов, и продуктов, или использовать меченые субстраты. В первом случае можно будет вычислить приращение продуктов гидролиза. Во втором случае образуются меченые продукты, которые легко отличить от липидной матрицы и уже имеющихся в системе жирных кислот и лизолипидов по специфическому сигналу.
Одновременный мониторинг количеств фосфолипидов и продуктов их гидролиза позволяет вычислить, сколько фосфолипидов гидролизовалось в единицу времени, т.е. сразу определить активность фермента (ΔC/Δt). Достаточно долго этот подход было сложно реализовать методически. Однако сейчас, благодаря прогрессу в области масс-спектрометрии и совершенствованием колонок для высокоэффективной жидкостной хроматографии, такой мониторинг уже не является неподъемной задачей. Например, был разработан метод для высокоэффективной жидкостной хроматографии с детектированием на масс-спектрометре с электроспрей-ионизацией [20]. Метод позволяет параллельно определять фосфатидилхолин в качестве субстрата ФЛА2, а также его продукты – жирные кислоты и лизофосфатидилхолин [20]. Особенность метода – в использовании колонки с силикагелем с короткоцепной привитой фазой (С5) и детектировании фосфатидилхолина и лизофосфатидилхолина в виде ацетатных аддуктов. Вслед за Шеббом [20] были разработаны и другие методы высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией, позволяющие одновременное детектирование фосфатидилхолина и продуктов его гидролиза ФЛА2 [21]. Метод позволяет получить результаты всего за несколько минут, что означает его высокую эффективность при одновременном мониторинге продуктов гидролиза и исходных липидов.
Методы высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией позволяют вести мониторинг гидролиза липидов ФЛА2, однако этот мониторинг фактически оказывается не непрерывным, а дискретным – время между двумя измерениями равно времени проведения анализа. Поэтому так важно сокращать время проведения анализа, и именно над уменьшением этого времени и работают исследователи.
Можно решить и обратную задачу – использовать фермент для определения липидов. Тану и соавт. с использованием двумерной тонкослойной хроматографии фосфолипаз А1 и А2 удалось разработать метод определения структуры липидов с установлением мест привязки (sn-1 или sn-2) жирных кислот [22].
Использование меченых субстратов ФЛА2 началось с применения радиоактивно меченных фосфолипидов еще в 70-х–80-х годах. Метод хорошо задокументирован (см., например, [23]). Популярность его была основана на точности радиоактивных методов и на сравнительно легко доступном приборном оснащении. Получаемые данные значительно точнее, чем данные по окрашиванию фосфатных групп методом Васьковского.
Радиоактивные субстраты идентичны по своей структуре исходным липидам. Замена одного из атомов углерода 12С в цепи sn-2 на его изотоп 14С не влияет на способность фермента связывать и гидролизовать субстрат. В этом случае меченый субстрат и липидная матрица представлены однотипной молекулой. Это приводит к существенному преимуществу радиоактивных субстратов – они позволяют измерить активность фермента напрямую. Недостатком метода является сложность получения разрешения на работу с радиоактивными веществами. По мере того, как становились доступными другие методы определения активности ФЛА2, использование радиоактивных методов становилось все более редким.
Непрерывное детектирование (без промежуточной хроматографии) возможно при использовании спектрального оборудования, например спектрофотометра. Однако молекулы фосфолипидов не поглощают свет в видимой области спектра. Поэтому развилось направление исследований по химической модификации липидов, целью которого было предложить такие субстраты ФЛА2, которые бы несли на себе репортерные группы, хромофоры, которые можно было бы детектировать с помощью спектрофотометра.
Поскольку суммарная концентрация репортерных групп в системе в ходе гидролиза меняться не может, то под действием фермента должно происходить такое изменение, которое бы приводило к изменению регистрируемого сигнала. При расщеплении сложноэфирной связи под действием фермента должна меняться окраска исследуемого раствора образца. Были предприняты попытки [24, 25] найти вещества нелипидной природы, которые бы гидролизовались ФЛА2, и полученные фрагменты имели бы отличный от исходного вещества спектр поглощения света.
Таким веществом является, например, 4-нитро-3-октаноилокси-бензойная кислота 4 (рис. 3) [24]. Это вещество поглощает в УФ-диапазоне, но при его гидролизе высвобождается нитрофенольное производное 5 (рис. 3), которое имеет максимум поглощения уже в видимой области (при 425 нм). По мере протекания гидролиза наблюдают появление и усиление желтой окраски.
Рис. 3
Детектирование активности ФЛА2 по появлению продуктов гидролиза. Фосфатидилхолин 1 и продукты его гидролиза ферментом: лизофосфатидилхолин 2 и жирная кислота 3. Цветные (детектируемые) продукты гидролиза обведены. Остальные пояснения в тексте.
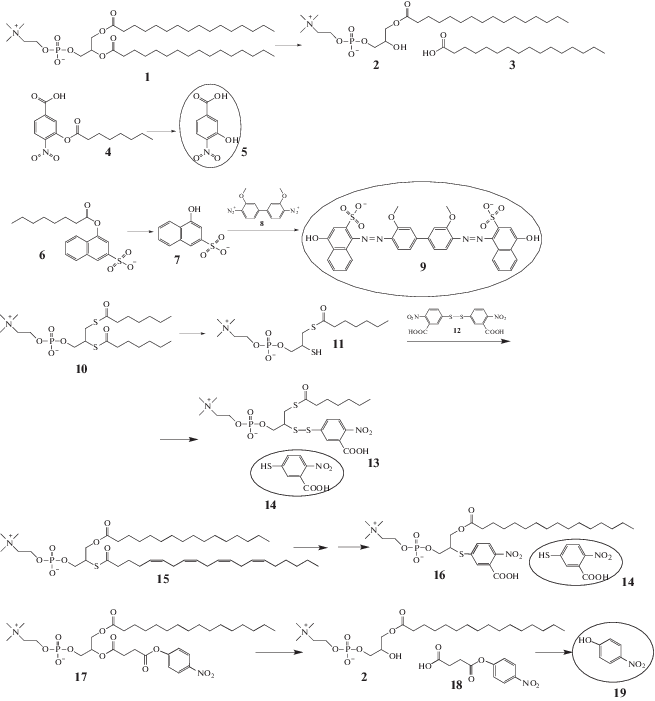
Похожим субстратом является 1-октаноилоксинафталин-3-сульфокислота 6 [25], которая, как было установлено авторами, хорошо гидролизуется ФЛА2. Продуктом ее гидролиза является 1-нафтол-3-сульфокислота 7, которая реагирует с имеющейся в растворе солью диазония 8 (реакция азосочетания) с образованием красно-пурпурного азокрасителя 9 (рис. 3). При этом изменение спектра поглощения исследуемого раствора происходит в ходе дополнительной реакции.
Большую схожесть с природными фосфолипидами имеют тио-производные 10 и 15 (рис. 3). Фактически, от природных фосфолипидов их отличает замена одного атома – кислород в сложноэфирной связи заменен на атом серы. Фосфолипаза А2 способна гидролизовать такую связь, а высвобождающиеся тио-производные реагируют с DTNB (5,5'-дитио-бис-(2-нитро-бензойная кислота)), 12 с образованием окрашенного тионитропроизводного 14. Соединения 10 и 15 служат субстратами секреторной и цитозольной ФЛА2 соответственно. Тио-производное 15 несет остаток арахидоновой кислоты, что является необходимым условием для успешного детектирования активности цитозольной ФЛА2, поскольку цитозольные ФЛА2 – единственные представители суперсемейства ФЛА2, которые проявляют специфичность к остатку арахидоновой кислоты.
Еще один липидоподобный субстрат – 1-миристоил-2-(4-нитрофенилсукцинил)-фосфатидилхолин 17. Этот субстрат представляет собой фосфатидилхолин, у которого вместо жирной кислоты во втором положении находится производное янтарной кислоты и нитрофенола (рис. 3). Ферментативный гидролиз в sn-2 положении приводит к образованию монозамещенного производного янтарной кислоты (п-нитрофенилсукцината, 18), который в свою очередь самопроизвольно гидролизуется с образованием п-нитрофенола 19. Последний дает яркую желтую окраску (пик поглощения 405 нм). Активность фермента определяется спектрофотометрически по окраске раствора. Система разработана для количественного определения липопротеин-ассоциированной ФЛА2 в плазме и сыворотке крови, которая позволяет прогнозировать течение ишемической болезни сердца. Воспроизводимость тест-системы проверялась как силами компании разработчика [26], так и исследовательским организациями [16]. В настоящее время это единственная дошедшая до клинического применения тест-система.
Указанные выше субстраты ФЛА2 не являются природными фосфолипидами. Тио-производные 10 и 15 содержат химическую модификацию в чувствительном месте – там, где происходит разрыв связи под действием фермента, а субстрат 17 содержит хромофорную группу достаточно близко к активному центру фермента. Как следствие, активность фермента относительно этих субстратов отличается от его активности в отношении фосфолипидов. Поэтому в лабораторной и клинической практике необходимо использовать образцы сравнения – чистые образцы фермента с известной активностью. При этом калибровочные кривые необходимо воспроизводить для каждого нового образца, что, несомненно, является ограничением. Преимущество же состоит в том, что измеряемый сигнал – интенсивность поглощения света на определенной длине волны – прямо пропорционален концентрации продукта, что делает определение активности ФЛА2 простым. Альтернативой субстратам ФЛА2 с хромофорными репортерными группами, меняющими цвет, являются субстраты с флуоресцентными метками. Однако их принцип действия другой.
ДЕТЕКТИРОВАНИЕ АКТИВНОСТИ ФЛА2 ПО РАСЩЕПЛЕНИЮ СУБСТРАТА
Метод определения активности ФЛА2 по расщеплению субстрата основан на том, что продукты гидролиза, более не связанные в одну молекулу, диффундируют в липидной матрице удаляясь друг от друга. Это приводит к изменению сигнала. Флуоресцентные зонды содержат флуорофор, присоединенный к одной из гидрофобных цепей липида, и тушитель флуоресценции, прикрепленный к другой гидрофобной цепи или к полярной головке липида. До тех пор, пока флуорофор и тушитель находятся в одной молекуле, флуоресценция оказывается низкой. При гидролизе и последующей диффузии продуктов гидролиза расстояние между флуорофором и тушителем увеличивается, а флуоресцентный сигнал растет.
Фактически при таком подходе регистрируют не продукты гидролиза, а сам факт гидролиза: что остатки жирной кислоты не составляют одну молекулу, а разделены пространственно. Если продукты гидролиза не расходятся в пространстве и остаются достаточно близко друг к другу, флуоресцентный сигнал будет занижен.
Важная роль диффузии продуктов гидролиза в формировании сигнала определяет необходимость использования липидной матрицы. Она формирует среду, в которой диффундируют продукты гидролиза.
При разработке субстратов с флуоресцентной меткой необходимо учитывать, что флуорофоры достаточно объемистые группировки. Они могут препятствовать связыванию ферментом, и гидролиз таких молекул может идти слишком медленно или не идти вовсе. Исходя из структуры каталитического сайта фермента предполагается, что молекула субстрата должна содержать флуорофор и тушитель на конце гидрофобной цепи не ближе, чем 10 атомов углерода от глицеринового остатка липида [27], т.е. далеко от каталитического сайта фермента.
Ниже приводится несколько примеров субстратов ФЛА2 для определения ее активности по изменению сигнала флуоресценции (рис. 4). При достаточно большом разнообразии флуорофоров и тушителей липидная часть у этих молекул остается неизменной.
Рис. 4.
Флуоресцентные субстраты для определения активности ФЛА2, несущие флуорофор и специфический тушитель флуоресценции.
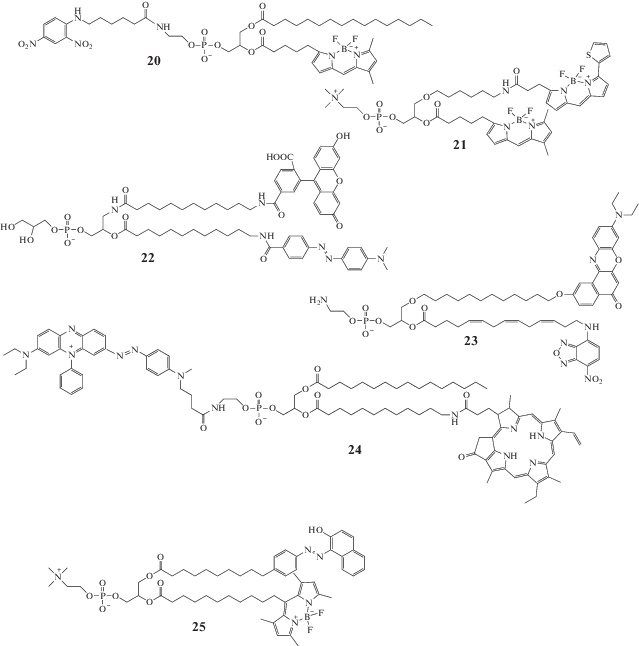
В лабораторной практике достаточно широко применяются коммерчески доступные липидные производные с флуорофором BODIPY на конце жирной цепи и динитрофенильным тушителем, присоединенным к полярной головке липида (20) (рис. 4) (пример применения см. в [28]), а также флуоресцентно меченный зонд Red/Green BODIPY PC-A2 (21). Последний предназначен для работы с клетками и клеточными лизатами. Матрицу составляют фосфолипиды – смесь диолеоилфосфатидилхолина и диолеоилфосфатидилглицерина (примеры применения [29, 30]).
Абе с соавт. предложили фосфатидилглицерин с флуоресцеином в качестве флуорофора и дабсилом в качестве тушителя (22) [31], длина гидрофобных цепей была 12 атомов углерода. При этом лучшим оказался зонд с флуоресцеином по sn-1 положению, а с дабсилом по sn-2 положению (именно эта структура приведена рис. 3).
Вичман с соавт. предложили серию флуоресцентных липидных зондов, у которых флуорофор находился на конце длинной цепи, причем сама цепь напоминала арахидоновую кислоту (23) [32].
Попов с соавт. [33] предложили зонды, в которых в качестве метки использовалось производное феофорбида, испускающее свет в ближней инфракрасной зоне и присоединенное к концу гидрофобной цепи длиной 6 или 12 атомов углерода (24). В качестве тушителя флуоресценции использовалось диазопроизводное – так называемый черный тушитель. Они обнаружили, что производное с короткой цепью (6 атомов) не гидролизовалось ФЛА2, а производное с длинной цепью успешно гидролизовалось (рис. 4).
Вариант Алексеевой и соавт. [27] представляет собой фосфатидилхолин с флуорофором BODIPY и специфическим тушителем его флуоресценции – красителем судан III. Оба прикреплены на концах длинных жирных цепей (25).
Можно утверждать, что за годы разработок исследователям удалось спроектировать такие субстраты ФЛА2, которые, неся на себе громоздкие флуорофоры и тушители, успешно гидролизуются ферментом. Вместе с правильно подобранными матрицами и использованием стандартных образцов ферментов они дают хорошие результаты.
Главный недостаток систем с флуорофорами и тушителями – это то, что наблюдаемый сигнал (интенсивность флуоресценции) и концентрация продуктов гидролиза зависят друг от друга нелинейно. Влияние побочных процессов проявляется особенно сильно в биологических образцах, таких как плазма крови и лизаты клеток. В последних находится множество компонентов, способных влиять на липидную матрицу и, как следствие, на распределение меток в липидном бислое. Необходимо использовать дополнительные способы коррекции. Примером учета побочных процессов может служить работа Алексеевой и соавт. [27]. Для описания кинетики наблюдаемого сигнала флуоресценции они предложили трехстадийную модель, которая включает исходный субстрат в матрице, негидролизованный субстрат вне матрицы и продукты гидролиза. Решение этой модели позволяет вычислить активность фермента в плазме крови. Это достижение, однако, сложно перенести в широкую практику из-за относительно сложного математического аппарата по сравнению с прямым детектированием продуктов гидролиза.
ДЕТЕКТИРОВАНИЕ АКТИВНОСТИ ФЛА2 ПО ПОВРЕЖДЕНИЮ ЛИПИДНОГО БИСЛОЯ
Гидролиз липидов под действием ФЛА2 и накопление в липидном бислое продуктов гидролиза – лизолипидов и жирных кислот – вызывает искажение упаковки мембраны, а затем и полное ее разрушение. Эти изменения можно зарегистрировать и оценивать по ним активность ФЛА2.
Отслеживание изменения светорассеяния исходной дисперсии – один из вариантов такого подхода. Интенсивность рассеянного света зависит от размера частиц. Стабильные липосомы имеют размер не менее 50 нм и могут быть приготовлены методом экструзии со сравнительно узким распределением по размеру. При действии ФЛА2 на липосомы образуются лизолипиды, которые не способны образовывать бислой, а значит, и формировать липосомы. Сами по себе лизолипиды образуют мицеллы, размер которых составляет всего несколько нанометров. Изменение размеров липидных частиц приводит к изменению интенсивности светорассеяния, которое можно отслеживать и судить по нему об активности ФЛА2 [34]. Однако метод требует значительных количеств липидов и фермента.
Еще один вариант – это использование жидкокристаллических сенсоров, где выделяющиеся в ходе работы ФЛА2 продукты гидролиза искажают упаковку молекул жидких кристаллов. Такие сенсоры устроены следующим образом: слой жидких кристаллов, закрепленный на микросетке, находится над слоем липосом. Если в слое липосом оказывается фермент (сенсор может быть настроен и на проточную работу) и происходит гидролиз липидов, то высвобождающиеся жирные кислоты и лизолипиды мигрируют из липидной фазы и встраиваются в слой жидких кристаллов. Это изменяет картину поляризации света, который проходит сквозь слой жидких кристаллов [35]. Альтернативно липиды могут изначально находиться внутри слоя жидких кристаллов, а их гидролиз ФЛА2 до лизолипидов меняет упаковку жидких кристаллов. Детектирование также осуществляется за счет изменения поляризации света [36].
Более простыми и одновременно чувствительными к разрушению бислоя являются методы, основанные на флуоресцентных красителях. В них используются красители, встроенные в липидную мембрану, или красители, находящиеся во внутреннем водном объеме. Системы спроектированы так, чтобы повреждение мембраны вызывало изменение сигнала флуоресценции.
Хуанг и соавт. [37] использовали флуоресцентный краситель ANS (анилинонафталинсульфокислота) встроенный в липидный бислой. Флуоресценция этого красителя зависит от полярности окружения – при переходе от неполярного к полярному окружению она падает. Пока ANS встроен в мембрану, сигнал флуоресценции остается высоким. При разрушении мембраны локальное микроокружение метки становится более полярным – флуоресценция падает. Флуоресценция ANS меняется при его сорбции на альбумине и на множестве других белков. Поэтому для определения активности ФЛА2 в биологических образцах этот метод непригоден.
Для измерения активности фосфолипазы А2 в присутствии альбумина была разработана тест-система с использованием фосфолипидов, несущих в sn-2-положении 10-пиренилдеканоильный остаток [38]. В водной среде такие фосфолипиды образуют везикулы с минимальной флуоресценцией мономера (за счет эксимеризации пиренила). Высвобождающаяся в результате ферментативного расщепления 10-пиренилдекановая кислота «растворяется» в реакционной среде только в присутствии альбумина, который связывает жирные кислоты с высоким сродством. При этом наблюдается усиление флуоресценции пиренильного мономера. В этой системе аналит, пиренилдекановая кислота, является продуктом гидролиза. Субстрат, пиренил-меченый фосфатидилхолин, отличается от субстратов с флуорофором и тушителем тем, что тушение флуоресценции происходит в ходе межмолекулярного взаимодействия, а не в одной молекуле. Два остатка пирена из разных молекул взаимодействуют, образуя эксимер (флуоресценция мономера оказывается затушенной). Гидролиз приводит к разрушению агрегатов из пиренил-меченого фосфатидилхолина, одновременно исчезает среда. в которой могли образовываться эксимеры. Из-за своей простоты эта тест-система нашла широкое применение в лабораторной практике при определении активности образцов фермента, выделенных из разных организмов. Примеры применения [39, 40].
Табей и соавт. [41] использовали иммобилизованные на подложке флуоресцентно меченные липосомы. В поле зрения конфокального микроскопа эти липосомы представляли собой яркие точки. Под действием ФЛА2 липосомы разрушаются, и продукты гидролиза мигрируют из иммобилизованной липосомы в окружающую среду. Интенсивность флуоресценции (яркость точки, представляющей собой липосому) падает. По падению яркости можно вычислить активность фермента. Авторы предполагают, что имеет место взаимодействие одной молекулы фермента с липосомой [41].
Чаще встречается ситуация, когда флуоресценция красителя, встроенного в мембрану, специально затушена (рядом находится тушитель флуоресценции). При разрушении мембраны флуорофор и тушитель расходятся в пространстве, и флуоресценция растет. По такому принципу работает пара липидных зондов TMB-PC/BCHB-PC [42, 43]. Важно, что в этой системе флуорофор и тушитель находятся в разных молекулах. Эта система позволяет оценить масштаб повреждения липидной мембраны. С ее помощью было обнаружено негидролитическое действие гетеродимерных фосфолипаз из секрета ядовитой железы гадюки Никольского [19].
Нарушение целостности липосом можно отслеживать по вытеканию красителя из внутреннего водного объема липосом. Классический пример – липосомы, нагруженные кальцеином. Этот флуоресцентный краситель внутри липосом находится в высокой концентрации. Из-за эффекта внутреннего фильтра флуоресценция концентрированных растворов “затушена”. При разрушении липосом краситель вытекает во внешний водный объем, происходит его разбавление, и уровень флуоресцентного сигнала растет. Этот прием нашел применение в многочисленных исследованиях устойчивости липидного бислоя (см., например, [44]). В случае ФЛА2 он был реализован как метод для высокоэффективной жидкостной хроматографии [45]. Липосомы с кальцеином иммобилизованы на поверхности частиц носителя для хроматографии. При гидролизе высвобождается краситель, и его флуоресценцию регистрируют в системе для высокоэффективной жидкостной хроматографии. Эту систему затем развили, создав на ее основе систему детектирования полихлорированных бифенолов. В этом случае ФЛА2 выступает в роли усилителя сигнала [46, 47].
Чен с соавт. нагружали липосомы тринитрофенолом и затем эмульсию липосом наносили на графеновую подложку. При действии ФЛА2 липосомы разрушаются, и высвобождается тринитрофенол, который сорбируется на графене и меняет его проводимость [48].
Часто вместо липосом используются составные частицы из липидов и каких-либо наночастиц. Например, Ли с соавт. использовали составные наночастицы из квантовых точек, NBD-меченого фосфатидилхолина и гидрогенизированного соевого фосфатидилхолина [49]. Изначально флуоресценция NBD затушена квантовыми точками. После того как фермент гидролизует липиды, частицы разрушаются, NBD высвобождается в раствор, и появляется сигнал флуоресценции. Чен с соавт. использовали золотые наночастицы, покрытые дипальмитоилфосфатидилхолином. При их гидролизе оболочка разрушается, а частицы агрегируют, что меняет спектр поглощения [50]. Гуо с соавт. [51] создали наночастицы на основе гадолиния с перфтор-15-корона-5 и оболочкой из фосфолипидов. Сигнал (время T2 19F MRI) затушен в присутствии гадолиния. При разрушении липидной оболочки ферментом наночастицы распадаются – появляется сигнал. Метод детектирования – магнитный резонанс [51].
Все системы детектирования ФЛА2 по разрушению липидного слоя обладают одним и тем же недостатком. Наблюдаемый сигнал зависит от протекания гидролиза не напрямую, а через стадии накопления продуктов и разрушения липидного слоя. Обе эти стадии могут зависеть от протекания сторонних процессов, таких, например, как сорбция альбумина или других белков, если речь идет о работе со многокомпонентными средами. Иными словами, сторонние процессы могут слишком сильно влиять на сигнал.
ЗАКЛЮЧЕНИЕ
Изучение участия фосфолипазы А2 во множестве патологических процессов, в первую очередь воспалительных, привлекает все больше внимания исследователей. Особое значение имеет детектирование активности ФЛА2 в биологических средах – культуральной жидкости, лизатах клеток, плазме и сыворотки крови. Фосфолипазы А2 входят в состав ядов разнообразных организмов и исследование активности фосфолипаз А2 из новых источников является актуальной и сложной задачей.
Начиная с 70-х годов и до настоящего времени продолжаются разработки системы для определения активности ФЛА2. Однако создание таких систем для биологических образцов оказалась гораздо более сложной задачей. На сегодняшний день в клинической диагностике имеется только одна тест-система по определению липопротеин-асоциированной ФЛА2, позволяющая работать с плазмой и сывороткой крови. Методы, основанные на детектировании продуктов гидролиза и на расщеплении флуоресцентно меченных липидов оказываются более приспособленными для отслеживания активности ФЛА2 в биологических образцах. Методы, основанные на детектировании продуктов гидролиза, проще в применении. Методы, основанные на детектировании расщепления флуоресцентно меченных липидов, требуют сложной математической обработки экспериментальных данных. Методы, основанные на детектировании разрушения мембраны, еще более сложны для применения, потому что аналит не связан с фактом расщепления липидных молекул.
Дальнейшее развитие методов детектирования активности ФЛА2 для клинических применений должно учитывать разницу между строением меченого субстрата и природными липидами так, чтобы скорость гидролиза новых субстратов была близкой к скорости гидролиза природных липидов. Для этого сами субстраты должны быть структурно близкими к липидам, а метки должны располагаться как можно дальше от каталитического сайта связывания фермента. Будущие тест-системы для ФЛА2 должны также учитывать протекание влияющих на сигнал побочных процессов, таких как разрушение липидной матрицы под действием белков плазмы крови. Накопленные к настоящему моменту знания о структуре субстратов и работе тест-систем на их основе уже позволяют разрабатывать такие системы, которые бы соответствовали всем этим требованиям.
Обзор подготовлен в рамках гранта Российского научного фонда №19-75-00101.
Список литературы
Dennis E.A., Cao J., Hsu Y.-H., Magrioti V., Kokotos G. 2011. Phospholipase A2 enzymes: physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chem. Rev. 111 (10), 6130–6185. https://doi.org/10.1021/cr200085w
Vasquez A. M., Mouchlis V.D., Dennis E.A. 2018. Review of four major distinct types of human phospholipase A2. Adv. Biol. Regul. 67 (3), 212–218. https://doi.org/10.1016/j.jbior.2017.10.009
Sofogianni A., Alkagiet S., Tziomalos K. 2018. Lipoprotein-associated phospholipase A2 and coronary heart disease. Curr. Pharm. Des. 24 (3), 291–296. https://doi.org/10.2174/1381612824666180111110550
Talmud P.J., Holmes M.V. 2015. Deciphering the causal role of sPLA2s and Lp-PLA2 in coronary heart disease. Arterioscler. Thromb, Vasc. Biol. 35 (11), 2281–2289. https://doi.org/10.1161/ATVBAHA.115.305234
Dore E., Boilard E. 2019. Roles of secreted phospholipase A 2 group IIA in inflammation and host defense. Biochim. Biophys. Acta Mol. Cell. Biol. Lipids. 1864 (6), 789–802. https://doi.org/10.1016/j.bbalip.2018.08.017
Nikolaou A., Kokotou M.G., Vasilakaki S., Kokotos G. 2019. Small-molecule inhibitors as potential therapeutics and as tools to understand the role of phospholipases A2. Biochim. Biophys. Acta Mol. Cell. Biol. Lipids. 1864 (6), 941–956. https://doi.org/10.1016/j.bbalip.2018.08.009
Zambelli V.O., Picolo G., Fernandes C.A.H., Fontes M.R.M., Cury Y. 2017. Secreted phospholipases A2 from animal venoms in pain and analgesia. Toxins. 9 (12), 406. https://doi.org/10.3390/toxins9120406
Scott D., White S., Otwinowski Z., Yuan W., Gelb M., Sigler P. 1990. Interfacial catalysis: The mechanism of phospholipase A2. Science. 250 (4987), 1541–1546. https://doi.org/10.1126/science.2274785
Winget J.M., Pan Y.H., Bahnson B.J. 2006. The interfacial binding surface of phospholipase A2s. Biochim. Biophys. Acta. 1761 (11), 1260–1269. https://doi.org/10.1016/j.bbalip.2006.08.002
Berg O.G., Gelb M.H., Tsai M.-D., Jain M.K. 2001. Interfacial enzymology: The secreted phospholipase A2-paradigm. Chem. Rev. 101 (9), 2613–2654. https://doi.org/10.1021/cr990139w
Nevalainen T.J., Eerola L.I., Rintala E., Laine V.J. ., Lambeau G., Gelb M.H. 2005. Time-resolved fluoroimmunoassays of the complete set of secreted phospholipases A2 in human serum. Biochim. Biophys. Acta Mol. Cell. Biol. Lipids. 1733 (2–3), 210–223. https://doi.org/10.1016/j.bbalip.2004.12.012
Macdonald D.J., Boyle R. M., Glen A.C.A., Leslie C. C., Glen A.I.M., Horrobin D.F. 2015. The development of an ELISA for group IVA phospholipase A2 in human red blood cells. Prostaglandins, Leukotrienes and Essential Fatty Acids. 94, 43–48. https://doi.org/10.1016/j.plefa.2014.11.003
Topbas C., Swick A., Razavi M., Anderson N.L., Pearson T.W., Bystrom C. 2018. Measurement of lipoprotein-associated phospholipase A2 by use of 3 different methods: Exploration of discordance between ELISA and activity assays. Clin. Chem. 64 (4), 697–704. https://doi.org/10.1373/clinchem.2017.279752
Zhuo S., Wolfert R.L., Yuan C. 2017. Biochemical differences in the mass and activity tests of lipoprotein-associated phospholipase A 2 explain the discordance in results between the two assay methods. Clin. Biochem. 50 (18), 1209–1215. https://doi.org/10.1016/j.clinbiochem.2017.08.019
Šribar J., Križaj I. 2011. Secreted phospholipases A2 – Not just enzymes. Acta Chimica Slovenica, 58 (4), 678–688.
Donato L. J., Meeusen J. W., Callanan H., Saenger A. K., Jaffe A. S. 2016. Advantages of the lipoprotein-associated phospholipase A2 activity assay. Clin. Biochem. 49 (1–2), 172–175. https://doi.org/10.1016/j.clinbiochem.2015.09.002
Ong W.Y., Farooqui T., Kokotos G., Farooqui A.A. 2015. Synthetic and natural inhibitors of phospholipases A2: Their importance for understanding and treatment of neurological disorders. ACS Chem. Neurosci. 6 (6), 814–831. https://doi.org/10.1021/acschemneuro.5b00073
Vaskovsky V.E., Kostetsky E.Y., Vasendin I.M. 1975. A universal reagent for phospholipid analysis. J. Chromatography A. 114 (1), 129–141. https://doi.org/10.1016/S0021-9673(00)85249-8
Alekseeva A.S., Tretiakova D.S., Chernikov V.P., Utkin Y.N., Molotkovsky J.G., Vodovozova E.L., Boldyrev I.A. 2017. Heterodimeric V. nikolskii phospholipases A2 induce aggregation of the lipid bilayer. Toxicon, 133, 169–179. https://doi.org/10.1016/j.toxicon.2017.05.015
Schebb N.H., Falck D., Faber H., Hein E.-M., Karst U., Hayen H. 2009. Fast method for monitoring phospholipase A2 activity by liquid chromatography–electrospray ionization mass spectrometry. J. Chromatography A. 1216 (27), 5249–5255. https://doi.org/10.1016/j.chroma.2009.05.020
Stephenson D.J., MacKnight H.P., Hoeferlin L.A., Park M.A., Allegood J.C., Cardona C.L., Chalfant C.E. 2019. A rapid and adaptable lipidomics method for quantitative UPLC-mass spectrometric analysis of phosphatidylethanolamine and phosphatidylcholine in vitro, and in cells. Anal. Methods. 11 (13), 1765–1776. https://doi.org/10.1039/C9AY00052F
Tan G., Tian Y., Addy M., Cheng Y., Xie Q., Zhang B., Liu Y., Chen P., Ruan R. 2017. Structural analysis of phosphatidylcholine using a thin layer chromatography-based method. Eur. J. Lipid Sci. Technol. 119 (7), 1600282. https://doi.org/10.1002/ejlt.201600282
Leslie C.C., Gelb M.H. 2004. Assaying phospholipase A2 activity. Methods Mol. Biol. (Clifton, N.J.). 284, 229–242.
Petrovic N., Grove C., Langton P.E., Misso N.L.A., Thompson P.J. 2001. A simple assay for a human serum phospholipase A2 that is associated with high-density lipoproteins. J. Lipid Research. 42 (10), 1706–1713.
Eba C., Okano A., Nakano H., Iwasaki Y. 2014. A chromogenic substrate for solid-phase detection of phospholipase A2. Analyt. Biochem. 447 (1), 43–45. https://doi.org/10.1016/j.ab.2013.11.007
Cerelli M.J., Grimm K., Duan X., Mulberg E., Jalilie M., Sekella P., Payes M., Cox H., Blick K.E., Fang K.C., Zychlinsky E. 2016. Evaluation of recombinant enzyme calibration to harmonize lipoprotein-associated phospholipase A 2 activity results between instruments. Clin. Biochem. 49 (6), 480–485. https://doi.org/10.1016/j.clinbiochem.2015.11.018
Alekseeva A.S., Korotaeva A.A., Samoilova E.V, Volynsky P.E., Vodovozova E.L., Boldyrev I.A. 2014. Secretory phospholipase A2 activity in blood serum: The challenge to sense. Biochem. Biophys. Res. Commun. 454 (1), 178–182. https://doi.org/10.1016/j.bbrc.2014.10.069
Benson M.A., Schmalzer K.M., Frank D.W. 2010. A sensitive fluorescence-based assay for the detection of ExoU-mediated PLA2 activity. Clinica Chimica Acta. 411 (3–4), 190–197. https://doi.org/10.1016/j.cca.2009.10.025
Currò M., Ferlazzo N., Risitano R., Condello S., Vecchio M., Caccamo D., Ientile, R. 2014. Transglutaminase 2 and phospholipase A2 interactions in the inflammatory response in human Thp-1 monocytes. Amino Acids. 46 (3), 759–766. https://doi.org/10.1007/s00726-013-1569-y
Machado-Aranda D., Wang Z., Yu B., Suresh M.V., Notter R.H., Raghavendran K. 2013. Increased phospholipase A2 and lyso-phosphatidylcholine levels are associated with surfactant dysfunction in lung contusion injury in mice. Surgery. 153 (1), 25–35. https://doi.org/10.1016/j.surg.2012.05.043
Abe A., Rzepecki P.W., Shayman J.A. 2013. A fluorogenic phospholipid for the detection of lysosomal phospholipase A2 activity. Analyt. Biochem. 434 (1), 78–83. https://doi.org/10.1016/j.ab.2012.11.004
Wichmann O., Gelb M.H., Schultz C. 2007. Probing phospholipase A2 with fluorescent phospholipid substrates. ChemBioChem. 8 (13), 1555–1569. https://doi.org/10.1002/cbic.200600462
Popov A.V., Mawn T.M., Kim S., Zheng G., Delikatny E.J. 2010. Design and synthesis of phospholipase C and A 2 -activatable near-infrared fluorescent smart probes. Bioconjug. Chem. 21 (10), 1724–1727. https://doi.org/10.1021/bc100271v
Maity G., Bhattacharyya D. 2005. Assay of snake venom phospholipase A2 using scattering mode of a spectrofluorimeter. Curr. Sci. 89 (6), 1004–1008.
Horton K.L., Stewart K.M., Fonseca S.B., Guo Q., Kelley S.O. 2008. Mitochondria-penetrating peptides. Chem. Biol. 15 (4), 375–382. https://doi.org/10.1016/j.chembiol.2008.03.015
Liu Y., Cheng D., Lin I.-H., Abbott N.L., Jiang H. 2012. Microfluidic sensing devices employing in situ-formed liquid crystal thin film for detection of biochemical interactions. Lab on a Chip. 12 (19), 3746-3753. https://doi.org/10.1039/c2lc40462a
Huang C., Zhou L., Liu Y., Lai L. 2006. A continuous fluorescence assay for phospholipase A2 with nontagged lipid. Analyt. Biochem. 351 (1), 11–17. https://doi.org/10.1016/j.ab.2006.01.021
Radvanyi F., Jordan L., Russo-Marie F., Bon C. 1989. A sensitive and continuous fluorometric assay for phospholipase A2 using pyrene-labeled phospholipids in the presence of serum albumin. Analyt. Biochem. 177 (1), 103–109. https://doi.org/10.1016/0003-2697(89)90022-5
Mallat Z., Steg P.G., Benessiano J., Tanguy M.L., Fox K.A., Collet J.P., Dabbous O.H., Henry P., Carruthers K.F., Dauphin A., Arguelles C.S., Masliah J., Hugel B., Montalescot G., Freyssinet J., Asselain B., Tedgui A. 2005. Circulating secretory phospholipase A2 activity predicts recurrent events in patients with severe acute coronary syndromes. J. Am. Coll. Cardiol. 46 (7), 1249–1257. https://doi.org/10.1016/j.jacc.2005.06.056
Mallat Z., Benessiano J., Simon T., Ederhy S., Sebella-Arguelles C., Cohen A., Huart V., Wareham N., Luben R., Khaw K., Tedgui A., Boekholdt M. 2007. Circulating secretory phospholipase A2 activity and risk of incident coronary events in healthy men and women: The EPIC-NORFOLK study. Arteriosclerosis, Thrombosis, and Vascular Biology. 27 (5), 1177–1183. https://doi.org/10.1161/ATVBAHA.107.139352
Tabaei S.R., Rabe M., Zetterberg H., Zhdanov V.P., Höök F. 2013. single lipid vesicle assay for characterizing single-enzyme kinetics of phospholipid hydrolysis in a complex biological fluid. J. Amer. Chem. Soc. 135 (38), 14151–14158. https://doi.org/10.1021/ja4046313
Alekseeva A.S., Tretiakova D.S., Melnikova D.N., Molotkovsky U.G., Boldyrev I.A. 2016. Novel fluorescent membrane probe 2,3;5,6-bis(cyclohexyl)-BODIPY-labeled phosphatidylcholine. Russ. J. Bioorgan. Chem. 42 (3), 305–309. https://doi.org/10.1134/S1068162016030031
Tretiakova D.S., Alekseeva A.S., Galimzyanov T.R., Boldyrev A.M., Chernyadyev A.Y., Ermakov Y.A., Batishchev O.V., Vodovozova E.L., Boldyrev I.A. 2018. Lateral stress profile and fluorescent lipid probes. FRET pair of probes that introduces minimal distortions into lipid packing. Biochim. Biophys. Acta Biomembr. 1860 (11), 2337–2347. https://doi.org/10.1016/j.bbamem.2018.05.020
Tretiakova D., Onishchenko N., Boldyrev I., Mikhalyov I., Tuzikov A., Bovin N., Evtushenko E., Vodovozova E. 2018. Influence of stabilizing components on the integrity of antitumor liposomes loaded with lipophilic prodrug in the bilayer. Colloids Surf. B Biointerfaces. 166, 45–53. https://doi.org/10.1016/j.colsurfb.2018.02.061
Liu X.-Y., Nakamura C., Yang Q., Miyake J. 2001. Phospholipase A2-catalyzed membrane leakage studied by immobilized liposome chromatography with online fluorescent detection. Analyt. Biochemistry. 293 (2), 251–257. https://doi.org/10.1006/abio.2001.5136
Liu X.-Y., Nakamura C., Hasegawa M., Miyake J. 2003. Effect of lipid composition on phospholipase A2-catalyzed membrane leakage in immobilized liposomes: Sensitization for polychlorinated biphenyls detection with antibody affinity column tandem with fluorescent liposome column. Electrophoresis. 24 (18), 3165–3171. https://doi.org/10.1002/elps.200305530
Liu X.-Y., Nakamura C., Nakamura N., Hirano T., Shinbo T., Miyake J. 2005. Detection of polychlorinated biphenyls using an antibody column in tandem with a fluorescent liposome column. J. Chromatography A. 1087 (1–2), 229–235. https://doi.org/10.1016/j.chroma.2005.03.013
Chen H., Lim S.K., Chen P., Huang J., Wang Y., Palaniappan A., Platt M., Leidberg B., Tok A. 2015. Reporter-encapsulated liposomes on graphene field effect transistors for signal enhanced detection of physiological enzymes. Phys. Chem. Chem. Phys. 17 (5), 3451–3456. https://doi.org/10.1039/C4CP04644G
Li J., Zhang Y., Ai J., Gao Q., Qi H., Zhang C., Cheng Z. 2016. Quantum dot cluster (QDC)-loaded phospholipid micelles as a FRET probe for phospholipase A2 detection. RSC Advances. 6 (19), 15895–15899. https://doi.org/10.1039/C5RA25292J
Chen S.-H., Hsu Y.-P., Lu H.-Y., Ho J.A. 2014. Gold/Phospholipid nanoconstructs as label-free optical probes for evaluating phospholipase A2 activity. Biosensors and Bioelectronics. 52, 202–208. https://doi.org/10.1016/j.bios.2013.08.017
Guo C., Zhang Y., Li Y., Xu S., Wang L. 2019. 19 F MRI nanoprobes for the turn-on detection of phospholipase A2 with a low background. Analyt. Chem. 91 (13), 8147–8153. https://doi.org/10.1021/acs.analchem.9b00435
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


