Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 5, стр. 337-349
Взаимодействие границ упорядоченных липидных доменов и амфипатических пептидов регулирует вероятность образования пор в мембранах
К. В. Пинигин a, М. В. Воловик a, b, О. В. Батищев a, С. А. Акимов a, *
a Институт физической химии и электрохимии им. А. Н. Фрумкина, РАН
119071 Москва, Россия
b Московский физико-технический институт (государственный университет)
141700 Московская обл., Долгопрудный, Россия
* E-mail: akimov_sergey@mail.ru
Поступила в редакцию 02.04.2020
После доработки 16.05.2020
Принята к публикации 17.05.2020
Аннотация
В состав биологических мембран входят различные липиды. Гетерогенный липидный состав может приводить к фазовому разделению с образованием упорядоченных липидных доменов, отличающихся по липидному составу от неупорядоченной части мембраны. Деформации мембраны, возникающие на границе доменов, могут влиять на латеральное распределение различных мембранных включений. В данной работе в рамках теории упругости липидных мембран рассмотрено влияние границ липидных доменов на латеральное распределение амфипатических пептидов, адсорбированных на мембране. Такие пептиды способны вызывать образование сквозных пор. Показано, что при увеличении поверхностной концентрации амфипатические пептиды сначала выстраиваются в линию вблизи границы домена параллельно ей и не способны индуцировать образование пор. Затем, когда вся граница домена оказывается занята, новые пептиды располагаются параллельно линии пептидов, которые уже находятся на границе, на расстоянии приблизительно 5 нм от границы. В такой конфигурации повышается вероятность образования сквозных пор в мембране. Кроме того, показано, что спонтанная кривизна монослоев упорядоченного домена и неупорядоченной мембраны определяет энергию встраивания пептидов в мембрану и их распределение между двумя фазами, но практически не влияет на их взаимодействие с границей упорядоченного домена.
ВВЕДЕНИЕ
Живая клетка является открытой неравновесной системой. Для ее существования необходимо поддержание относительно постоянного внутреннего состава, отличного от состава окружающей клетку среды. Это достигается за счет отделения клеточных органелл от цитоплазмы и клетки в целом от окружающей среды мембранами, основу которых составляет липидный матрикс, тонкая бимолекулярная пленка, сформированная молекулами липидов. Вследствие амфифильной природы липидов, собранные из них мембраны обладают чрезвычайно низкой проницаемостью к различным веществам, что определяет основную – барьерную, функцию мембран в клетках [1]. В частности, в организмах млекопитающих мембраны позволяют клеткам поддерживать относительно постоянный внутренний ионный состав, значительно отличающийся от ионного состава внешней для клеток среды. В норме контролируемое прохождение заряженных молекул сквозь клеточные мембраны обеспечивается разнообразными ионными каналами. Резкое неконтролируемое повышение проницаемости мембран, как правило, приводит к гибели клеток. На повышении проницаемости мембран клеток патогенных микроорганизмов основано действие некоторых антибиотиков [2]. В частности, антимикробные амфипатические пептиды, такие как мелиттин и магаинин, связываются с бактериальными мембранами и формируют в них сквозные поры [3].
Антимикробные пептиды, формирующие в мембранах сквозные поры, как правило, являются амфипатическими, т.е. сочетают в своей структуре заряженные, полярные и гидрофобные аминокислоты. При взаимодействии с липидной мембраной такие пептиды частично встраиваются в липидный монослой таким образом, чтобы экспонировать в воду заряженные и полярные аминокислоты и скрыть от контакта с водой гидрофобные аминокислоты путем погружения их в мембрану [4–6]. Частичное встраивание пептидной α-спирали в липидный монослой неизбежно приводит к нарушению равновесной упаковки липидных молекул вблизи пептида, т.е. индуцирует упругие деформации мембраны, при которых липидные полярные головки вытесняются в стороны, а гидрофобные цепи липидов заполняют объем под частично встроенным пептидом (рис. 1). Это приводит к увеличению площади липидного монослоя, в который частично встроены амфипатические пептиды, а также к изменению его спонтанной кривизны: такой монослой стремится стать выпуклым, т.е. обладает положительной спонтанной кривизной [7, 8]. Такой же спонтанной кривизной обладают лизоформы липидов, которые, как известно, способствуют образованию пор в мембранах, поскольку при положительной спонтанной кривизне липидного монослоя значительно уменьшается линейное натяжение кромки поры [9–12]. При односторонней адсорбции амфипатических пептидов на замкнутые мембранные бислои, например, гигантских однослойных везикул (ГОВ), за счет встраивания пептидов увеличивается площадь поверхности наружного монослоя без изменения средней площади, приходящейся на одну липидную молекулу. Однако площади наружного и внутреннего монослоев ГОВ должны быть приблизительно равны друг другу. Это означает, что при адсорбции амфипатических пептидов на наружный монослой ГОВ внутренний монослой будет растягиваться, т.е. в нем возникнет латеральное натяжение [13, 14]. Таким образом, амфипатические пептиды могут понижать энергетический барьер образования сквозной поры в мембране как путем уменьшения линейного натяжение кромки (за счет индуцируемой положительной спонтанной кривизны), так и путем увеличения латерального натяжения замкнутых липидных бислоев (за счет частичного встраивания лишь в один из монослоев мембраны).
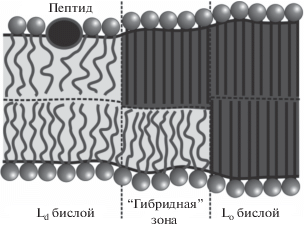
Рис. 1.
Структура мембраны вблизи границы упорядоченного домена. Между жидко-упорядоченным Lo бислоем домена (справа) и жидко-неупорядоченным Ld бислоем остальной части мембраны (слева) находится “гибридная” зона, в которой один монослой − жидко-упорядоченный, а другой − жидко-неупорядоченный. Lo монослои показаны темно-серым цветом, Ld монослои − светло-серым цветом. Частично встроенный в монослой амфипатический пептид (показан черным эллипсом с серым контуром) вытесняет в стороны полярные головки липидов; гидрофобные цепи липидов заполняют объем под пептидом.
Вызванные пептидами деформации мембраны могут распространяться на несколько нанометров [15–18]. Когда расстояние между пептидами достаточно велико, индуцируемые ими деформации независимы, и их энергия аддитивна. Однако при сближении пептидов вызываемые ими деформации начинают перекрываться, что приводит к эффективному латеральному взаимодействию. Ранее мы показали, что глобальный минимум энергии деформаций мембраны достигается, когда оси двух α-спиральных амфипатических пептидов ориентированы параллельно, а пептиды расположены друг напротив друга на расстоянии ∼4.7 нм [18]. При этом в области мембраны между пептидами плотность упругой энергии оказывается достаточной, чтобы понизить энергетический барьер образования поры приблизительно в 2 раза [15]. Таким образом, мы предполагаем, что наиболее вероятно образование поры посередине между параллельными пептидами. Поскольку расстояние между пептидами составляет ∼4.7 нм, то, по крайней мере, исходно образующаяся пора должна быть чисто липидной [15]. Вероятность образования поры по такому механизму должна сильно зависеть от поверхностной концентрации пептидов. Хотя формально пора может быть образована двумя пептидными молекулами, эти пептиды за счет диффузии должны оказаться в узком диапазоне расстояний друг от друга, и угол между их осями также должен попасть в относительно узкий интервал значений [15].
Плазматические мембраны клеток млекопитающих и бактерий различаются электрическим зарядом наружного монослоя: он приблизительно нулевой у клеток млекопитающих и отрицательный − у бактериальных. Поэтому большой положительный заряд антимикробных пептидов обеспечивает их преимущественное связывание с бактериальными мембранами [2]. У типичных антимикробных пептидов, магаинина и мелиттина, в нормальных условиях электрические заряды равны +3 и +5 [5, 19, 20] соответственно. Однако одни лишь электростатические взаимодействия оказываются неспособны обеспечить высокую избирательность связывания пептидов исключительно с бактериальными мембранами. Несмотря на наличие заряда, амфипатические пептиды могут встраиваться и разрушать мембраны эукариотических клеток за счет гидрофобных взаимодействий. Поэтому большинство таких пептидов оказываются токсичными для человека, что значительно ограничивает возможности их применения в качестве антибиотиков.
В наружных монослоях плазматических мембран клеток млекопитающих содержится значительное количество насыщенных липидов с относительно высокой температурой фазового перехода жидкость–гель, в частности, дипальмитоилсфингомиелина [21, 22]. В модельных мембранах, сформированных из насыщенных липидов, ненасыщенных липидов (с относительно низкой температурой фазового перехода жидкость−гель, например, диолеоилфосфатидилхолина [23]) и холестерина, взятых в соотношении близком к таковому в наружных монослоях плазматических мембран, при понижении температуры наблюдается макроскопическое фазовое разделение с образованием жидко-упорядоченной (Lo) и жидко-неупорядоченной (Ld) фаз. Домены Lo фазы практически всегда оказываются бислойными, т.е. если в одном монослое имеется упорядоченный домен, то в противоположном монослое в том же месте также будет располагаться упорядоченный домен [24]. Предполагается, что сопряжение доменов в бислойные структуры обеспечивается нормальными тепловыми флуктуациями формы мембраны [25, 26]. Вследствие различной упорядоченности липидных гидрофобных цепей бислои Lo и Ld фазы имеют разную толщину [27, 28]. Если бы Lo и Ld участки мембраны были бы плоскими и однородными вплоть до межфазной границы, на границе возникал бы скачок толщины бислоя, вдоль которого гидрофобная зона мембраны экспонировалась бы в воду. Линейное натяжение такой границы составляло бы по порядку величины 20−40 пН [29], что приблизительно на два порядка превосходит значения линейного натяжения, измеряемые в экспериментах (обычно ∼1 пН) [24, 30]. Для уменьшения площади контакта полярной и гидрофобной сред мембраны вблизи границы должны деформироваться. Деформации требуют затрат энергии; однако, как следует из теоретических оценок, они энергетически значительно более выгодны по сравнению с экспонированием гидрофобной части мембраны в воду, поэтому за счет деформаций скачок толщины бислоя на границе Lo и Ld фаз закрывается полностью, т.е. поверхности монослоев на границе становятся непрерывными [29].
Деформации мембраны распространяются на несколько нанометров от вызывающих их объектов, в частности, границы упорядоченных доменов [17, 31, 32]. Если в мембране с сосуществующими Lo и Ld фазами имеется амфипатический α-спиральный пептид, частично встроенный в липидный монослой, то при сближении пептида и границы домена вызываемые ими деформации начинают перекрываться, приводя к их взаимодействию. Вдали от границы домена мембрана плоская, т.е. ее геометрическая кривизна равна нулю. Частично встроенный амфипатический пептид индуцирует положительную спонтанную кривизну, т.е. ему энергетически выгодно располагаться в локально выпуклых областях липидного монослоя. Такие области могут появляться только вблизи межфазной границы, где вследствие деформаций, направленных на сглаживание скачка толщины Lo и Ld бислоев, локальная геометрическая кривизна поверхности липидного монослоя может стать отличной от нуля. Ранее мы показали, что глобальный минимум энергии деформаций мембраны достигается, когда частично встроенный амфипатический α-спиральный пептид расположен в Lo фазе в непосредственной близости от межфазной границы [16]. Таким образом, амфипатические пептиды должны накапливаться на границе упорядоченных доменов.
В настоящей работе мы рассматриваем, каким образом упругие деформации опосредуют латеральное взаимодействие двух амфипатических пептидов при наличии в мембране границы Lo и Ld фаз. Деформации возникают вблизи обоих пептидов и межфазной границы. Из анализа полной упругой энергии, рассчитываемой в рамках теории упругости липидных мембран, следует, что пептидам энергетически выгодно занимать границу упорядоченного домена, выстраиваясь на ней в линию. В такой конфигурации образование пор пептидами невозможно, т.е. наличие границы Lo и Ld фаз препятствует порации мембран. Однако при полном заполнении межфазной границы пептидами, следующая пептидная молекула неизбежно столкнется с протяженной линией пептидов, стоящих на границе. В этом случае образование поры в мембране представляется значительно более вероятным, чем при случайном блуждании двух пептидных молекул по мембране большой площади, поскольку положение и ориентация одной из двух пептидных молекул, участвующих в формировании поры, оказываются фиксированными. Таким образом, наличие межфазной границы должно препятствовать образованию пор при низкой поверхностной концентрации пептидов и стимулировать порацию − при высокой.
ПОСТАНОВКА ЗАДАЧИ
Для расчета энергии деформаций воспользуемся теорией упругости жидких кристаллов, адаптированной к липидным мембранам, в рамках подхода Хамма−Козлова [33]. В этой теории средняя ориентация липидных молекул в монослое характеризуется полем единичных векторов n, называемых директорами. Директоры направлены от полярных головок липидов в сторону межмонослойной поверхности мембраны. Поле директоров считается заданным на некоторой поверхности, называемой разделяющей, проходящей внутри монослоя параллельно его внешней полярной поверхности. Форма разделяющей поверхности характеризуется векторным полем ее единичных нормалей N, также направленных в сторону межмонослойной поверхности мембраны. В исходном недеформированном состоянии директоры и нормали параллельны друг другу. Мы рассматриваем следующие деформации: 1) поперечный изгиб, характеризующийся дивергенцией директора вдоль разделяющей поверхности, div(n); 2) наклон, характеризующийся вектором наклона t = n/(nN) – N; 3) латеральное растяжение−сжатие, характеризующееся относительным изменением площади разделяющей поверхности, α = (a – a0)/a0 (здесь a, a0 − текущая и исходная площади разделяющей поверхности, приходящиеся на одну липидную молекулу); 4) латеральное натяжение мембраны, характеризующееся изменением полной площади разделяющей поверхности относительно плоского состояния вследствие деформации. В качестве базового состояния, от энергии которого отсчитывается энергия деформаций, выбран плоский липидный монослой. Деформации считаются малыми, и энергия вычисляется во втором порядке по ним. Для липидного монослоя упругая энергия может быть записана в следующем виде [16, 34]:
(1)
$\begin{gathered} W = \int {dS\left\{ {\frac{B}{2}{{{\left( {\operatorname{div} \left( {\mathbf{n}} \right) + {{J}_{0}}} \right)}}^{2}} - \frac{B}{2}J_{0}^{2} + \frac{{{{K}_{t}}}}{2}{{{\mathbf{t}}}^{2}}} \right.} + \\ \left. { + \,\,\frac{{{{K}_{a}}}}{2}{{{\left( {\alpha - {{\alpha }_{0}}} \right)}}^{2}} + {{\sigma }_{0}}} \right\} - {{\sigma }_{0}}{{A}_{0}}, \\ \end{gathered} $Модуль объемного сжатия мембран очень велик и по порядку величины составляет ∼109–1010 Дж/м3 [36, 37]. Это позволяет считать гидрофобную часть липидного монослоя эффективно локально объемно несжимаемой. Условие объемной несжимаемости с требуемой точностью может быть записано в виде [16, 33, 34]:
(2)
${{h}_{C}} = h - \frac{{{{h}^{2}}}}{2}\operatorname{div} \left( {\mathbf{n}} \right) - h\alpha ,$Характерные длины изменения деформаций мембраны составляют несколько нанометров по порядку величины [18, 34]. Экспериментальные оценки радиусов доменов, зарегистрированных в клеточных мембранах, попадают в диапазон ∼25−100 нм [38–41]. Минимальный размер доменов в модельных мембранах, определяемый методами атомной силовой микроскопии [27] и флуоресцентной микроскопии [42, 43], составляет несколько десятков нанометров. Таким образом, в практически важных случаях размеры упорядоченных доменов значительно превосходят характерные длины изменения деформаций мембраны. Это означает, что при расчетах можно пренебречь кривизной границы домена и считать границу прямой линией, вдоль которой система обладает трансляционной симметрией. Кроме того, ранее мы показали [16, 18], что при анализе взаимодействия двух пептидов или пептида с границей домена можно также пользоваться одномерным приближением, т.е. считать систему трансляционно симметричной вдоль некоторого направления, при условии корректного выбора эффективной длины пептида вдоль направления трансляционной симметрии. Для частично встроенных в мембрану амфипатических пептидов эффективная длина составляла приблизительно реальную длину пептидной α-спирали плюс 1−2 характерные длины затухания энергии деформаций, т.е. приблизительно плюс 2 нм [18].
Будем считать, что мембрана расположена горизонтально. Величины, относящиеся к верхнему монослою, будем обозначать индексом “u”, к нижнему монослою − индексом “l”. Будем также считать, что амфипатические пептиды встроены в верхний монослой. Введем декартову систему координат Oxyz таким образом, чтобы ось Oz была перпендикулярна плоской нейтральной поверхности монослоев в базовом состоянии; ось Oy была направлена вдоль границы упорядоченного домена, т.е. вдоль направления трансляционной симметрии; ось Ox была направлена перпендикулярно границе домена; плоскость Oyz содержала прямую линию границы упорядоченного домена нижнего монослоя. В такой системе координат все деформации зависят только от координаты x. Соответственно, все векторные величины можно заменить их проекциями на ось Ox: n → nx = n, N → → Nx = N, t → tx = t; кроме того, с требуемой точностью div(n) ≈ dn/dx, t ≈ n – N.
Форма мембраны характеризуется тремя функциями: 1) Hu(x) − расстояние от плоскости Oxy до нейтральной поверхности верхнего монослоя; 2) Hl(x) − расстояние от плоскости Oxy до нейтральной поверхности нижнего монослоя; 3) M(x) − расстояние от плоскости Oxy до межмонослойной поверхности; все расстояния измеряются вдоль перпендикуляра к плоскости Oxy. В таких обозначениях условие локальной объемной несжимаемости, Ур. (2), для верхнего и нижнего монослоев, соответственно, может быть записано в виде [16, 18]:
(3)
$\begin{gathered} {{H}_{u}} - M = {{h}_{u}} - \frac{{h_{u}^{2}}}{2}n_{u}^{'} - {{h}_{u}}{{\alpha }_{u}}, \\ M - {{H}_{l}} = {{h}_{l}} - \frac{{h_{l}^{2}}}{2}n_{l}^{'} - {{h}_{l}}{{\alpha }_{l}}, \\ \end{gathered} $(4)
$\begin{gathered} {{\alpha }_{u}} = 1 - \frac{{{{h}_{u}}}}{2}n_{u}^{'} + \frac{1}{{{{h}_{u}}}}M - \frac{1}{{{{h}_{u}}}}{{H}_{u}}, \\ {{\alpha }_{l}} = 1 - \frac{{{{h}_{l}}}}{2}n_{l}^{'} - \frac{1}{{{{h}_{l}}}}M + \frac{1}{{{{h}_{l}}}}{{H}_{l}}. \\ \end{gathered} $Заметим, что с требуемой точностью Nu = dHu/dx, Nl = –dHl(x)/dx, dS = ${{L}_{y}}dx\sqrt {1 + {{{\left( {{\mathbf{grad}}H} \right)}}^{2}}} \approx $ $ \approx {{L}_{y}}dx\left( {1 + \frac{1}{2}{{{\left( {H{\kern 1pt} '} \right)}}^{2}}} \right)$, где Ly − длина рассматриваемого участка мембраны вдоль оси Oy, которую без ограничения общности можно положить равной единице. С учетом вышесказанного запишем в общем виде функционал упругой энергии липидного бислоя:
(5)
$\begin{gathered} W = \int {dx\left\{ {\frac{{{{B}_{u}}}}{2}{{{\left( {n_{u}^{'} + {{J}_{u}}} \right)}}^{2}} - \frac{{{{B}_{u}}}}{2}J_{u}^{2} + \frac{{K_{t}^{u}}}{2}{{{\left( {{{n}_{u}} - H_{u}^{'}} \right)}}^{2}} + } \right.} \\ \left. { + \frac{{\sigma _{0}^{u}}}{2}{{{\left( {H_{u}^{'}} \right)}}^{2}} + \frac{{K_{a}^{u}}}{{2h_{u}^{2}}}{{{\left( {{{h}_{u}} - \frac{{h_{u}^{2}}}{2}n_{u}^{'} + M - {{H}_{u}} - {{h}_{u}}\alpha _{0}^{u}} \right)}}^{2}}} \right\} + \\ + \int {dx\left\{ {\frac{{{{B}_{l}}}}{2}{{{\left( {n_{l}^{'} + {{J}_{l}}} \right)}}^{2}} - \frac{{{{B}_{l}}}}{2}J_{l}^{2} + \frac{{K_{t}^{l}}}{2}{{{\left( {{{n}_{l}} + H_{l}^{'}} \right)}}^{2}} + } \right.} \\ \left. { + \frac{{\sigma _{0}^{l}}}{2}{{{\left( {H_{l}^{'}} \right)}}^{2}} + \frac{{K_{a}^{l}}}{{2h_{l}^{2}}}{{{\left( {{{h}_{l}} - \frac{{h_{l}^{2}}}{2}n_{l}^{'} - M + {{H}_{l}} - {{h}_{l}}\alpha _{0}^{l}} \right)}}^{2}}} \right\}. \\ \end{gathered} $В данном функционале учитывается, что бислой может состоять как из двух одинаковых, так и из двух различных монослоев, а именно из Lo монослоя и Ld монослоя, имеющих различную толщину, модули упругости, спонтанную кривизну, латеральное натяжение. Хотя экспериментально наблюдаемая Lo фаза практически всегда бислойна, ранее мы теоретически показали, что бислойный Lo домен должен быть окружен полосой “гибридного” бислоя, в котором один монослой находится в Lo состоянии, в другой − в Ld [31, 44, 45] (рис. 1).
В ряде работ такие “гибридные” участки мембраны вблизи упорядоченных доменов наблюдались методами молекулярной динамики [46–48]. Характерная ширина “гибридной” полосы составляет всего 2−4 нм, и зарегистрировать ее напрямую в физическом эксперименте до сих пор не удавалось. Таким образом, мембрана вблизи границы домена может быть разделена на три зоны: 1) бислойная Ld мембрана, в которой оба монослоя находятся в жидко-неупорядоченном состоянии; 2) “гибридная” зона, в которой один монослой находится в Ld, а другой − в Lo состоянии; 3) бислойный Lo домен, в котором оба монослоя находятся в жидко-упорядоченном состоянии (рис. 1). При наличии в системе частично встроенного в мембрану амфипатического пептида необходимо отдельно рассматривать участок монослоя, напротив которого расположен пептид.
В работе [33] было показано, что модуль наклона приблизительно равен поверхностному натяжению границы вода-декан и, таким образом, практически не зависит от конкретной химической структуры и фазового состояния липида. Поэтому ниже мы будем считать, что всегда $K_{t}^{u}$ = = $K_{t}^{l}$ = Kt. Латеральное растяжение-сжатие является относительно жесткой деформационной модой, т.е. Ka ⪢ Kt, особенно в мембранах с высоким содержанием холестерина [33, 49]. Это означает, что энергия, запасаемая в данной деформационной моде, относительно мала; в ряде задач, не требующих высокой точности расчетов, эту деформацию вообще не рассматривают. Это позволяет, в частности, не учитывать возможное различие модулей латерального растяжения-сжатия Lo и Ld монослоев, т.е. считать, что $K_{a}^{u}$ = $K_{a}^{l}$ = Ka. Кроме того, будем считать, что к верхнему и нижнему монослоям приложено одно и то же латеральное натяжение, т.е. $\sigma _{0}^{u}$ = $\sigma _{0}^{l}$ = σ0.
Функционал энергии (5) записывается для каждой зоны мембраны. Вариация функционала по функциям nu, nl, Hu, Hl, M приводит к линейным дифференциальным уравнениям Эйлера–Лагранжа. Решения, полученные для различных зон, сшиваются на их границах, исходя из непрерывности директора и нейтральной поверхности всюду, кроме области верхнего монослоя, занятой пептидом. Кроме того, считается, что мембрана остается невозмущенной вдали от пептидов и границы Lo домена. На левой и правой границах пептида ставятся специфические граничные условия на проекцию директора и положение нейтральной поверхности. Для примыкающих к пептиду верхних монослоев записываются граничные условия, отвечающие скачку проекций директора справа и слева от пептида, а также возможности вращения спирального пептида вокруг его продольной оси симметрии: nL – nR = Δn и HR – HL = = (1/2)D(nL + nR), где nL и nR − проекции директора на ось Ox на левой и правой границах пептида соответственно, HL и HR − значения функции Hu(x), характеризующей форму нейтральной поверхности верхнего монослоя, на левой и правой границах пептида соответственно, D − диаметр пептида, который полагается равным 1.3 нм, т.е. приблизительно равным диаметру α-спирали (рис. 2).
Рис. 2.
На границе частично встроенного в липидный монослой амфипатического пептида накладываются граничные условия на скачок проекций директора справа (nR) и слева (nL) от пептида, а также на положения нейтральной поверхности верхнего монослоя справа (HR) и слева (HL) от пептида. D − диаметр α-спирали пептида; h − толщина гидрофобной части монослоя.
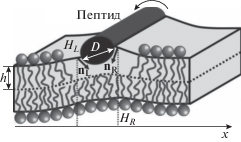
Значение скачка проекции директора Δn оценивается, исходя из геометрических соображений: полагается, что директоры на левой и правой границах пептида направлены в центр масс участка монослоя, расположенного непосредственно под пептидом: $\Delta n = D{\text{/}}\sqrt {{{{\left( {h{\text{/}}2} \right)}}^{2}} + {{{\left( {D{\text{/}}2} \right)}}^{2}}} $, где h − гидрофобная толщина монослоя, в котором находится пептид (рис. 2). В случае, когда пептид расположен на границе упорядоченного липидного домена и неупорядоченной мембраны, граничный скачок проекции директора полагается равным линейной комбинации $\Delta n = \delta D{\text{/}}\sqrt {{{{\left( {{{h}_{d}}{\text{/}}2} \right)}}^{2}} + {{{\left( {D{\text{/}}2} \right)}}^{2}}} $ + $ + \left( {1 - \delta } \right)D{\text{/}}\sqrt {{{{\left( {{{h}_{s}}{\text{/}}2} \right)}}^{2}} + {{{\left( {D{\text{/}}2} \right)}}^{2}}} $, где hs и hd − гидрофобные толщины монослоев неупорядоченной мембраны и упорядоченного домена соответственно, а δ и (1 – δ) – доли диаметра пептида, находящиеся в упорядоченном домене и неупорядоченной мембране соответственно.
РЕШЕНИЕ ЗАДАЧИ
Уравнения Эйлера–Лагранжа для бислоя. Вариация функционала упругой энергии (5) по функциям nu(x), nl(x), Hu(x), Hl(x), M(x) приводит к пяти линейным дифференциальным уравнениям Эйлера–Лагранжа, имеющим следующий вид:
(6)
$\left\{ \begin{gathered} \left( {l_{u}^{2} + \frac{{h_{u}^{2}A}}{4}} \right)n_{u}^{{''}} - {{n}_{u}} - \frac{A}{2}M{\kern 1pt} '\, + \left( {1 + \frac{A}{2}} \right)H_{u}^{'} = 0, \hfill \\ \left( {l_{l}^{2} + \frac{{h_{l}^{2}A}}{4}} \right)n_{l}^{{''}} - {{n}_{l}} + \frac{A}{2}M{\kern 1pt} ' - \left( {1 + \frac{A}{2}} \right)H_{l}^{'} = 0, \hfill \\ \left( {1 + \frac{A}{2}} \right)n_{u}^{'} - \left( {1 + \sigma } \right)H_{u}^{{''}} + \hfill \\ + \,\,\frac{A}{{h_{u}^{2}}}\left( {{{H}_{u}} - M - {{h}_{u}}\left( {1 - {{\alpha }_{0}}} \right)} \right) = 0, \hfill \\ \left( {1 + \frac{A}{2}} \right)n_{l}^{'} + \left( {1 + \sigma } \right)H_{l}^{{''}} - \hfill \\ - \,\,\frac{A}{{h_{l}^{2}}}\left( {{{H}_{l}} - M + {{h}_{l}}\left( {1 - {{\alpha }_{0}}} \right)} \right) = 0, \hfill \\ n_{u}^{'} - n_{l}^{'} + \frac{2}{{h_{u}^{2}}}\left( {{{H}_{u}} - M - {{h}_{u}}\left( {1 - {{\alpha }_{0}}} \right)} \right) + \hfill \\ + \,\,\frac{2}{{h_{l}^{2}}}\left( {{{H}_{l}} - M + {{h}_{l}}\left( {1 - {{\alpha }_{0}}} \right)} \right) = 0, \hfill \\ \end{gathered} \right.$(7)
$\begin{gathered} \left( {4l_{u}^{2}l_{l}^{2}\left( {h_{u}^{2} + h_{l}^{2}} \right)\, + \,A\left( {h_{u}^{4}l_{l}^{2} + h_{l}^{4}l_{u}^{2}} \right)} \right)H_{u}^{{\left( 8 \right)}}\, + \,\frac{{4A\left( {l_{u}^{2}h_{l}^{2} + l_{l}^{2}h_{u}^{2} - 2l_{u}^{2}l_{l}^{2}} \right) - A\sigma \left( {l_{u}^{2} + l_{l}^{2}} \right){\kern 1pt} \left( {h_{u}^{2} + h_{l}^{2}} \right) - 4\sigma \left( {l_{u}^{2} + l_{l}^{2}} \right){\kern 1pt} \left( {h_{u}^{2} + h_{l}^{2}} \right)}}{{1 + \sigma }}H_{u}^{{\left( 6 \right)}}\, + \\ + \,\,\frac{{4{{\sigma }^{2}}\left( {h_{u}^{2} + h_{l}^{2}} \right) + 4A\left( {l_{u}^{2} + l_{l}^{2}} \right) + 4A\sigma \left( {2l_{u}^{2} + 2l_{l}^{2} - h_{u}^{2} - h_{l}^{2}} \right)}}{{{{{\left( {1 + \sigma } \right)}}^{2}}}}H_{u}^{{\left( 4 \right)}} - \frac{{8A\sigma }}{{{{{\left( {1 + \sigma } \right)}}^{2}}}}H_{u}^{{''}} = 0. \\ \end{gathered} $Общее решение данного уравнения имеет вид:
(8)
$\begin{gathered} {{H}_{u}}\left( x \right) = {{c}_{1}}{{e}^{{ - {{q}_{1}}x}}} + {{c}_{2}}{{e}^{{{{q}_{1}}x}}} + {{c}_{3}}{{e}^{{ - {{q}_{2}}x}}} + {{c}_{4}}{{e}^{{{{q}_{2}}x}}} + \\ + \,\,{{c}_{5}}{{e}^{{ - {{q}_{3}}x}}} + {{c}_{6}}{{e}^{{{{q}_{3}}x}}} + {{c}_{7}}x + {{c}_{8}}, \\ \end{gathered} $Уравнения Эйлера−Лагранжа для участка монослоя, расположенного напротив пептида. Выражение для энергии участка монослоя, расположенного напротив пептида, может быть записано в виде:
(9)
$\begin{gathered} W = \int {dx\left\{ {\frac{{{{B}_{l}}}}{2}{{{\left( {n_{l}^{'} + {{J}_{l}}} \right)}}^{2}} - \frac{{{{B}_{l}}}}{2}J_{l}^{2} + \frac{{{{K}_{t}}}}{2}{{{\left( {{{n}_{l}} + H_{l}^{'}} \right)}}^{2}} + _{{_{{_{{_{{}}^{{}}}}^{{}}}}^{{}}}}^{{}}} \right.} \hfill \\ \left. { + \,\,\frac{{{{\sigma }_{0}}}}{2}{{{\left( {H_{l}^{'}} \right)}}^{2}} + \frac{{K_{a}^{{}}}}{{2h_{l}^{2}}}{{{\left( {{{h}_{l}} - \frac{{h_{d}^{2}}}{2}n_{l}^{'} - M + {{H}_{l}} - {{h}_{l}}{{\alpha }_{0}}} \right)}}^{2}}} \right\}. \hfill \\ \end{gathered} $Вариация этого функционала по nl(x), Hl(x), M(x) приводит к трем уравнениям Эйлера–Лагранжа:
(10)
$\left\{ \begin{gathered} \left( {l_{l}^{2} + \frac{{h_{l}^{2}A}}{4}} \right)n_{l}^{{''}} - {{n}_{l}} + \frac{A}{2}M{\kern 1pt} '\, - \left( {1 + \frac{A}{2}} \right)H_{l}^{'} = 0, \hfill \\ \left( {1 + \frac{A}{2}} \right)n_{l}^{'} + \left( {1 + \sigma } \right)H_{l}^{{''}} - \hfill \\ - \,\,\frac{A}{{h_{l}^{2}}}\left( {{{H}_{l}} - M + {{h}_{l}}\left( {1 - {{\alpha }_{0}}} \right)} \right) = 0, \hfill \\ - n_{l}^{'} + \frac{2}{{h_{l}^{2}}}\left( {{{H}_{l}} - M + {{h}_{l}}\left( {1 - {{\alpha }_{0}}} \right)} \right) = 0. \hfill \\ \end{gathered} \right.$Линейные преобразования позволяют получить изолированное уравнение для Hl:
(11)
$H_{l}^{{\left( 4 \right)}} + \frac{\sigma }{{\left( {\sigma + 1} \right)l_{l}^{2}}}H_{l}^{{''}} = 0,$(12)
${{H}_{l}}\left( x \right) = {{d}_{1}}{{e}^{{ - {{p}_{1}}x}}} + {{d}_{2}}{{e}^{{{{p}_{1}}x}}} + {{d}_{3}}x + {{d}_{4}},$Спонтанная кривизна монослоев. Спонтанная кривизна монослоев не входит в уравнения Эйлера–Лагранжа (6), (10), и, таким образом, характерные длины деформаций и функциональный вид их пространственного распределения от спонтанной кривизны не зависят. Однако спонтанная кривизна влияет на латеральное распределение деформаций через величины постоянных коэффициентов с1, с2, …, с8 и d1, d2, d3, d4, (см. уравнения (8) и (12)). Часть этих коэффициентов определяется граничными условиями, описанными выше в разделе “Постановка задачи”. Однако количество граничных условий меньше, чем число коэффициентов. Коэффициенты, оставшиеся неопределенными после подстановки граничных условий, находятся путем минимизации по ним полной энергии системы. Из выражений (5), (9) видно, что при встраивании пептида в мембрану энергетический вклад, связанный со спонтанной кривизной, составляет Wp = BJ0Δn.
Параметры, относящиеся к Lo монослою, будем обозначать индексом “d”, к Ld монослою – индексом “s”. Плоский монослой с ненулевой спонтанной кривизной испытывает изгибный стресс, плотность энергии которого определяется величиной ws = (B/2)$J_{0}^{2}$ (см. выражение (1)). Частичная релаксация изгибного стресса возможна за счет изменения ориентации директора на межфазной границе. При этом со стороны Lo монослоя на граничный директор действует вращающий момент, равный BdJd, а со стороны Ld монослоя − BsJs. Итоговая ориентация директора на границе монослоев Lo и Ld фаз определяется конкуренцией этих моментов. При спонтанных кривизнах монослоев, удовлетворяющих соотношению Jd = (Bs/Bd)Js, переориентации граничного директора не происходит [29]. Чтобы разделить эффекты релаксации упругих стрессов на межфазной границе и взаимодействия с границей встроенных пептидов, без ограничения общности всюду ниже будем считать, что спонтанные кривизны Lo и Ld монослоев удовлетворяют соотношению Jd = (Bs/Bd)Js.
Упругие параметры мембраны. Для иллюстрации результатов расчетов использовались следующие значения упругих параметров мембраны. Модуль изгиба монослоя B полагался равным 20 kBT и 10 kBT (T = 300 K) для упорядоченного домена и неупорядоченной мембраны соответственно [49–52]; модуль наклона Kt полагался равным 40 мН/м ≈ 10 kBT/нм2, исходя из оценки, приведенной в работе [33], и одинаковым для монослоев обеих фаз ($K_{t}^{u} = K_{t}^{l} = {{K}_{t}}$); модуль латерального растяжения-сжатия Ka полагался одинаковым для обеих фаз ($K_{a}^{u} = K_{a}^{l} = {{K}_{a}}$) и равным Ka = 120 мН/м = 30 kBT/нм2 [49, 52]; латеральное натяжение полагалось одинаковым в обоих монослоях в обеих фазах ($\sigma _{0}^{u} = \sigma _{0}^{l} = {{\sigma }_{0}}$) и равным σ0 = = 0.01 мН/м = 0.0025 kBT/нм2 [53]; спонтанное латеральное растяжение-сжатие α0 = σ0/Ka ≈ 0.8 × 10–4; гидрофобная толщина полагалась hd = 1.8 нм и hs = 1.3 нм для монослоев упорядоченного домена и неупорядоченной мембраны соответственно [28, 46, 47].
РЕЗУЛЬТАТЫ
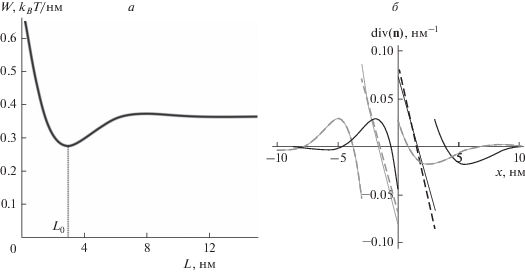
Структура границы Lo домена. Ранее было показано, что в равновесной конфигурации границы монослойных упорядоченных доменов, расположенных в противоположных монослоях мембраны, сдвинуты друг относительно друга на небольшое расстояние [16, 31, 44]. Для указанных выше упругих параметров мембраны величина сдвига составляет L0 = 3 нм (рис. 3а). При таком сдвиге энергия деформаций мембраны, возникающих на границе доменов при компенсации разности толщин Lo и Ld монослоев, оказывается минимальной. В силу симметрии системы эта энергия оказывается минимальной также при относительном сдвиге границ монослойных доменов L0 = –3 нм. На рис. 3б показано распределение вблизи границы упорядоченного домена величины div(n), которая определяет эффективную локальную кривизну липидного монослоя (с точностью до знака). Вдали от границы div(n) → 0, а в переходной зоне div(n) ≠ 0, причем имеются участки, где div(n) > 0 (локальная кривизна отрицательна) и div(n) < 0 (локальная кривизна положительна).
Рис. 3.
Структура деформаций вблизи границы упорядоченного домена. а − Зависимость упругой энергии мембраны от относительного сдвига границ L монослойных упорядоченных доменов, расположенных в противоположных монослоях. При сдвиге L0 = ±3 нм упругая энергия минимальна. б − Распределение дивергенции директора, div(n), вблизи границы упорядоченного домена в верхнем монослое (сплошные кривые) и нижнем монослое (штриховые кривые). Черные кривые − L0 = 3 нм; толстые серые кривые − L0 = –3 нм.
Взаимодействие пептида с границей Lo домена. Частично встроенный в мембрану амфипатический пептид индуцирует положительную кривизну, или, что эквивалентно, обладает положительной спонтанной кривизной. Таким мембранным компонентам энергетически выгодно располагаться в областях липидного монослоя, в которых локальная кривизна положительна, т.е. div(n) < 0. В мембране с сосуществующими Lo и Ld фазами такие области могут быть только вблизи межфазной границы. На рис. 4а показана зависимость упругой энергии мембраны (отнесенной к единице длины вдоль границы домена) от положения пептида. В отсутствие пептида граница Lo и Ld фаз симметрична относительно знака сдвига границ монослойных доменов L0: энергия границы одинакова при L0 = 3 нм и L0 = –3 нм. Однако при встраивании пептида в верхний монослой симметрия нарушается, и зависимость энергии от положения пептида оказывается различной в случаях L0 = 3 нм и L0 = –3 нм (рис. 4а).
Рис. 4.
Взаимодействие амфипатического пептида с границей упорядоченного домена. а − Зависимость линейного натяжения границы упорядоченного липидного домена от положения амфипатического пептида, встроенного в верхний монослой, при различных спонтанных кривизнах монослоев неупорядоченной мембраны Js и домена Jd. По оси абсцисс отложена координата правой границы пептида X0, упорядоченный домен расположен в положительном направлении оси абсцисс, координата 0 соответствует положению границы упорядоченного домена в нижнем монослое. Сплошные линии соответствуют относительному сдвигу липидных монослойных доменов L0 = 3 нм, штриховые − L0 = −3 нм. Нижняя пара кривых − Js = −0.1 нм–1, Jd = (Bs/Bd)Js = −0.05 нм–1; средняя пара кривых − Js = Jd = 0; верхняя пара кривых − Js = 0.1 нм–1, Jd = (Bs/Bd)Js = 0.05 нм–1. б − Форма мембраны с сосуществующими Lo и Ld фазами (показаны темно-серым и светло-серым цветом соответственно) и частично встроенным амфипатическим пептидом (показан черным эллипсом) при оптимальном расположении пептида, при котором линейное натяжение границы имеет глобальный минимум (см. панель а). Верхний график − L0 = 3 нм; нижний график − L0 = –3 нм.
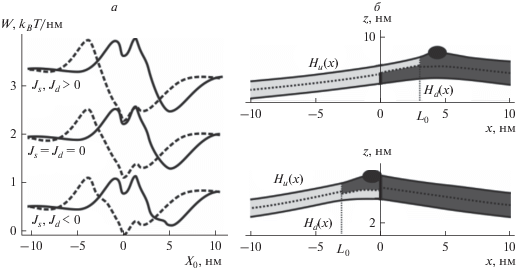
Из расчетов следует, что минимуму энергии системы соответствует положение пептида вблизи границы упорядоченного домена (рис. 4б). При положительной спонтанной кривизне монослоев домена и неупорядоченной части мембраны упругая энергия системы увеличивается. При отрицательной спонтанной кривизне монослоев частично компенсируется положительная спонтанная кривизна, индуцируемая встроенным пептидом, и упругая энергия уменьшается. В целом, зависимости упругой энергии от положения пептида, соответствующие случаям с ненулевыми спонтанными кривизнами, сдвигаются вверх или вниз относительно зависимости для случая нулевых спонтанных кривизн; при этом форма зависимостей изменяется слабо, а глубина энергетической ямы в глобальном минимуме энергии не изменяется: 0.90 kBT/нм при L0 = 3 нм и 0.72 kBT/нм при L0 = –3 нм. После умножения на эффективную длину пептида можно получить абсолютное значение глубины минимума [18]. Так, для α-спирального пептида магаинина, состоящего из 23 аминокислот и, соответственно, имеющего длину ∼0.15 нм × 23 = 3.45 нм, получаем: 0.90 kBT/нм × (3.45 + 2) нм ≈ 4.9 kBT и 0.72 kBT/нм × × (3.45 + 2) нм ≈ 3.9 kBT для L0 = 3 нм и L0 = –3 нм соответственно. Эти значения глубины минимумов значительно превышают среднюю энергию теплового движения пептида (∼1 kBT). Таким образом, пептид, оказываясь в положении, соответствующем глобальному минимуму упругой энергии, должен задерживаться в нем на продолжительное время.
При положительной спонтанной кривизне относительно понижается энергия при расположении пептида в упорядоченном домене вдали от границы; при отрицательной − напротив, при расположении в неупорядоченной мембране (рис. 4а). Предпочтительное расположение пептида в той или иной фазе связано с тем, что добавка к упругой энергии при ненулевой спонтанной кривизне составляет Wp = BJ0Δn; при этом мы выбирали величины спонтанных кривизн монослоев Lo и Ld фаз так, чтобы BsJs = BdJd. Таким образом, энергия в фазах различается только за счет различной величины скачка проекции директора на границах пептида, Δn. Скачок директора $\Delta {{n}_{{s,d}}} = D{\text{/}}\sqrt {{{{\left( {{{h}_{{s,d}}}{\text{/}}2} \right)}}^{2}} + {{{\left( {D{\text{/}}2} \right)}}^{2}}} $ оказывается большим в неупорядоченной мембране, чем в упорядоченном домене, поскольку hs < hd; соответственно, абсолютная величина энергетического сдвига |Wp| = |BJ0Δn| при ненулевой спонтанной кривизне оказывается больше в неупорядоченной мембране, чем в домене, а знак сдвига совпадает со знаком спонтанной кривизны. Таким образом, при положительной спонтанной кривизне энергия при расположении пептида в неупорядоченной мембране относительно возрастает, а при отрицательной − относительно понижается (рис. 4а).
Мембрана с двумя встроенными пептидами. Зафиксируем один пептид в оптимальном положении вблизи границы упорядоченного домена, в соответствии с глобальным минимумом зависимости упругой энергии, изображенной на рис. 4а. Рассмотрим зависимость упругой энергии мембраны от положения второго пептида, который считается ориентированным параллельно границе домена и первому пептиду (рис. 5). На малом расстоянии пептиды отталкиваются (рис. 5).
Рис. 5.
Зависимость упругой энергии мембраны с сосуществующими Lo и Ld фазами и двумя встроенными амфипатическими пептидами от расстояния между пептидами X при фиксированном оптимальном положении одного из пептидов вблизи границы упорядоченного домена (см. рис. 4). Пептиды встроены в верхний монослой мембраны. Зависимости рассчитаны для различных относительных сдвигов границ монослойных упорядоченных доменов: L0 = 3 нм (сплошные линии) и L0 = −3 нм (штриховые линии), а также для различных спонтанных кривизн монослоев неупорядоченной мембраны Js и упорядоченного домена Jd: нижняя пара кривых − Js = −0.1 нм–1, Jd = (Bs/Bd)Js = −0.05 нм–1; средняя пара кривых − Js = Jd = 0; верхняя пара кривых − Js = 0.1 нм–1, Jd = = (Bs/Bd)Js = 0.05 нм–1. Отрицательное расстояние соответствует положению нефиксированного пептида слева от фиксированного.
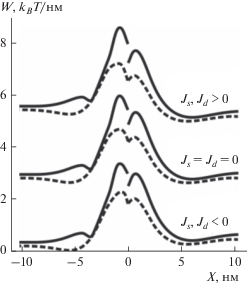
Однако при расстоянии между пептидами приблизительно 5 нм упругая энергия мембраны имеет глобальный минимум глубиной 0.16–0.23 kBT/нм. Схожая зависимость энергии от расстояния между пептидами была получена для случая латерально однородной мембраны без сосуществующих Lo и Ld фаз [15, 18]. Глубина минимума зависит от величины спонтанной кривизны монослоев мембраны и относительного сдвига границ монослойных упорядоченных доменов L0. Исключение составляет только случай Js = −0.1 нм–1, L0 = 3 нм, при котором глубина глобального минимума составляет всего 0.02 kBT/нм. При расчете зависимостей, показанных на рис. 5, положение одного из пептидов фиксировалось. Однако при малой вариации положения фиксированного пептида абсолютное значение энергии в глобальном минимуме возрастает (данные не показаны), и, таким образом, рассчитанные глобальные минимумы упругой энергии (рис. 5) являются глобальными минимумами упругой энергии системы при произвольном положении двух пептидов и фиксированном относительном сдвиге границ монослойных доменов. Аналогично рис. 4а, упругая энергия мембраны с двумя встроенными пептидами возрастает или уменьшается в зависимости от знака спонтанной кривизны липидных монослоев; форма графиков при этом изменяется незначительно.
ОБСУЖДЕНИЕ
В данной работе был проведен анализ влияния упругих деформаций липидного бислоя, возникающих на границе между жидко-упорядоченным липидным доменом и жидко-неупорядоченной мембраной, на взаимодействие амфипатических пептидов, частично встроенных в один из липидных монослоев. Расчеты показывают, что пептидам энергетически выгодно располагаться вблизи границы упорядоченного домена (рис. 4). При увеличении поверхностной концентрации пептидов им сначала энергетически выгодно заполнять свободные места вдоль границы упорядоченного липидного домена, располагаясь параллельно этой границе. Затем, при дальнейшем росте концентрации, когда вся граница домена заполняется полосой пептидов, очередным молекулам пептидов энергетически выгодно располагаться параллельно полосе, находящейся на границе домена, на расстоянии около 5 нм от нее (рис. 5).
Ранее было показано [18], что в латерально однородной мембране (без липидных доменов) двум пептидам энергетически выгодно располагаться параллельно друг другу на расстоянии ∼4.7 нм друг от друга. В такой конфигурации может повышаться вероятность образования сквозной поры в мембране [15]. В области мембраны между параллельными пептидами плотность упругой энергии максимальна, и, согласно оценкам работы [15], эта упругая энергия достаточна для того, чтобы покрыть приблизительно половину энергетических затрат, необходимых для образования сквозной поры. Как показано в настоящей работе, наличие границы упорядоченного липидного домена может препятствовать образованию пор при малых концентрациях пептидов: в этих условиях пептидам энергетически выгодно выстраиваться в линию, заполняя свободные места на границе домена. Однако при высокой поверхностной концентрации пептидов, когда все вакантные места на границе домена уже заполнены, вероятность образования пор должна резко увеличиваться. Поскольку пептиды на границе доменов находятся в глубокой энергетической яме, количество их степеней свободы ограничено. При этом остальные пептидные молекулы, диффундируя по мембране, с высокой вероятностью столкнутся с протяженной линией пептидов, выстроенных вдоль границы, и расположатся параллельно этой линии из-за наличия энергетической ямы упругой энергии при расстоянии ∼5 нм между пептидами (рис. 5). За счет этого должна повышаться вероятность образования сквозных пор. Таким образом, из результатов расчетов настоящей работы следует, что при низкой концентрации амфипатических пептидов упорядоченные домены должны оказывать протекторное действие, а при высокой − напротив, способствовать порации мембраны. Это позволяет объяснить противоречия в имеющихся экспериментальных данных по эффективности формирования пор амфипатическими пептидами в мембранах с сосуществующими Lo и Ld фазами.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации, а также Российского фонда фундаментальных исследований (грант № 18-54-74001).
Список литературы
Alberts B., Johnson A., Lewis J., Morgan D, Raff M., Roberts K., Walter P. 2017. Molecular biology of the cell (6th ed.). N.Y.: Garland Science.
Panteleev P.V., Bolosov I.A., Balandin S.V., Ovchinnikova T.V. 2015. Structure and biological functions of β-hairpin antimicrobial peptides. Acta Naturae. 7 (1), 37–47.
Fuertes G., Giménez D., Esteban-Martín S., Sánchez-Munoz O.L., Salgado J. 2011. A lipocentric view of peptide-induced pores. Eur. Biophys. J. 40, 399–415.
Pan J., Tieleman D.P., Nagle J.F., Kučerka N., Tristram-Nagle S. 2009. Alamethicin in lipid bilayers: Combined use of X-ray scattering and MD simulations. Biochim. Biophys. Acta. 1788, 1387–1397.
Chen C.H., Wiedman G., Khan A., Ulmschneider M.B. 2014. Absorption and folding of melittin onto lipid bilayer membranes via unbiased atomic detail microsecond molecular dynamics simulation. Biochim. Biophys. Acta. 1838, 2243–2249.
Vácha R., Frenkel D. 2014. Simulations suggest possible novel membrane pore structure. Langmuir. 30, 1304–1310.
Fuller N., Rand R.P. 2001. The influence of lysolipids on the spontaneous curvature and bending elasticity of phospholipid membranes. Biophys. J. 81, 243–254.
Kollmitzer B., Heftberger P., Rappolt M., Pabst G. 2013. Monolayer spontaneous curvature of raft-forming membrane lipids. Soft Matter. 9, 10877–10884.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane I: Continuous reversible trajectory from intact bilayer through hydrophobic defect to transversal pore. Sci. Rep. 7, 12152.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane II: Energy landscape under external stress. Sci. Rep. 7, 12509.
Карпунин Д.В., Акимов С.А., Фролов В.А. 2005. Формирование пор в плоских липидных мембранах, содержащих лизолипиды и холестерин. Биол. мембраны. 22, 429–432.
Молотковский Р.Ю., Акимов С.А. 2009. Расчет линейного натяжения в различных моделях кромки поры в липидном бислое. Биол. мембраны. 26, 149–158.
Chen F.Y., Lee M.T., Huang H.W. 2003. Evidence for membrane thinning effect as the mechanism for peptide-induced pore formation. Biophys. J. 84, 3751–3758.
Jackman J.A., Zan G.H., Zhdanov V.P., Cho N.J. 2013. Rupture of lipid vesicles by a broad-spectrum antiviral peptide: influence of vesicle size. J. Phys. Chem. B. 117, 16117–16128.
Акимов С.А., Александрова В.В., Галимзянов Т.Р., Батищев О.В. 2017. Взаимодействие амфипатических пептидов, опосредованное упругими деформациями мембраны. Биол. мембраны. 34, 162–173.
Pinigin K.V., Kondrashov O.V., Jiménez-Munguía I., Alexandrova V.V., Batishchev O.V., Galimzyanov T.R., Akimov S.A. 2020. Elastic deformations mediate interaction of the raft boundary with membrane inclusions leading to their effective lateral sorting. Sci. Rep. 10, 4087.
Akimov S.A., Frolov V.A., Kuzmin P.I., Zimmerberg J., Chizmadzhev Y.A., Cohen F.S. 2008. Domain formation in membranes caused by lipid wetting of protein. Phys. Rev. E 77, 051901.
Kondrashov O.V., Galimzyanov T.R., Jiménez-Munguía I., Batishchev O.V., Akimov S.A. 2019. Membrane-mediated interaction of amphipathic peptides can be described by a one-dimensional approach. Phys. Rev. E 99, 022401.
Matsuzaki K., Nakamura A., Murase O., Sugishita K.I., Fujii N., Miyajima K. 1997. Modulation of magainin 2− lipid bilayer interactions by peptide charge. Biochemistry 36, 2104–2111.
Santo K.P., Berkowitz M.L. 2012. Difference between magainin-2 and melittin assemblies in phosphatidylcholine bilayers: results from coarse-grained simulations. J. Phys. Chem. B. 116, 3021–3030.
Arsov Z., González-Ramírez E.J., Goñi F.M., Tristram-Nagle S., Nagle J.F. 2018. Phase behavior of palmitoyl and egg sphingomyelin. Chem. Phys. Lipids. 213, 102–110.
Ingólfsson H.I., Melo M.N., Van Eerden F.J., Arnarez C., Lopez C.A., Wassenaar T.A., Periole X., de Vries A.H., Tieleman D.P., Marrink S.J. 2014. Lipid organization of the plasma membrane. J. Am. Chem. Soc. 136, 14554–14559.
Jaschonek S., Cascella M., Gauss J., Diezemann G., Milano G. 2018. Intramolecular structural parameters are key modulators of the gel-liquid transition in coarse grained simulations of DPPC and DOPC lipid bilayers. Biochem. Biophys. Res. Comm. 498, 327–333.
Baumgart T., Hess S.T., Webb W.W. 2003. Imaging coexisting fluid domains in biomembrane models coupling curvature and line tension. Nature. 425, 821–824.
Галимзянов Т.Р., Калуцкий М.А., Кондрашов О.В., Пинигин К.В., Молотковский Р.Ю., Кузьмин П.И., Батищев О.В., Акимов С.А. 2019. Нормальные флуктуации формы биологических мембран как фактор сопряжения упорядоченных монослойных доменов. Биол. мембраны. 36, 184–191.
Galimzyanov T.R., Kuzmin P.I., Pohl P., Akimov S.A. 2017. Undulations drive domain registration from the two membrane leaflets. Biophys. J. 112, 339–345.
Galimzyanov T.R., Lyushnyak A.S., Aleksandrova V.V., Shilova L.A., Mikhalyov I.I., Molotkovskaya I.M., Akimov S.A., Batishchev O.V. 2017. Line activity of ganglioside GM1 regulates raft size distribution in a cholesterol-dependent manner. Langmuir. 33, 3517–3524.
Rinia H.A., Snel M.M., van der Eerden J.P., de Kruijff B. 2001. Visualizing detergent resistant domains in model membranes with atomic force microscopy. FEBS Lett. 501, 92–96.
Kuzmin P.I., Akimov S.A., Chizmadzhev Yu.A., Zimmerberg J., Cohen F.S. 2005. Line tension and interaction energies of membrane rafts calculated from lipid splay and tilt. Biophys. J. 88, 1120–1133.
Esposito C., Tian A., Melamed S., Johnson C., Tee S.Y., Baumgart T. 2007. Flicker spectroscopy of thermal lipid bilayer domain boundary fluctuations. Biophys. J. 93, 3169–3181.
Галимзянов Т.Р., Молотковский Р.Ю., Кузьмин П.И., Акимов С.А. 2011. Стабилизация бислойной структуры рафтов за счет упругих деформаций мембраны. Биол. мембраны. 28, 307–314.
Галимзянов Т.Р., Молотковский Р.Ю., Калуцкий М.А., Пинигин К.В., Кузьмин П.И., Батищев О.В., Акимов С.А. 2020. Латеральное взаимодействие влияет на кинетику метастабильных сквозных пор в липидных мембранах. Биол. мембраны. 37, 83–93.
Hamm M., Kozlov M.M. 2000. Elastic energy of tilt and bending of fluid membranes. Eur. Phys. J. E 3, 323–335.
Kondrashov O.V., Galimzyanov T.R., Pavlov K.V., Kotova E.A., Antonenko Y.N., Akimov S.A. 2018. Membrane elastic deformations modulate gramicidin A transbilayer dimerization and lateral clustering. Biophys. J. 115, 478–493.
Leikin S., Kozlov M.M., Fuller N.L., Rand R.P. 1996. Measured effects of diacylglycerol on structural and elastic properties of phospholipid membranes. Biophys. J. 71, 2623–2632.
Nagle J.F., Wilkinson D.A. 1978. Lecithin bilayers. Density measurement and molecular interactions. Biophys. J. 23, 159–175.
Terzi M.M., Deserno M., Nagle J.F. 2019. Mechanical properties of lipid bilayers: a note on the Poisson ratio. Soft Matter. 15, 9085–9092.
Frisz J.F., Lou K., Klitzing H.A., Hanafin W.P., Lizunov V., Wilson R.L., Carpenter K.J., Kim R., Hutcheon I.D., Zimmerberg J., Weber P.K., Kraft M.L. 2013. Direct chemical evidence for sphingolipid domains in the plasma membranes of fibroblasts. Proc. Natl. Acad. Sci. USA. 110, E613–E622.
Frisz J.F., Klitzing H.A., Lou K., Hutcheon I.D., Weber P.K., Zimmerberg J., Kraft M.L. 2013. Sphingolipid domains in the plasma membranes of fibroblasts are not enriched with cholesterol. J. Biol. Chem. 288, 16 855–16 861.
Lillemeier B.F., Pfeiffer J.R., Surviladze Z., Wilson B.S., Davis M.M. 2006. Plasma membrane-associated proteins are clustered into islands attached to the cytoskeleton. Proc. Natl. Acad. Sci. USA. 103, 18 992–18 997.
Pralle A., Keller P., Florin E.L., Simons K., Hörber J.H. 2000. Sphingolipid–cholesterol rafts diffuse as small entities in the plasma membrane of mammalian cells. J. Cell Biol. 148, 997–1008.
Saitov A., Akimov S.A., Galimzyanov T.R., Glasnov T., Pohl P. 2020. Ordered lipid domains assemble via concerted recruitment of constituents from both membrane leaflets. Phys. Rev. Lett. 124, 108102.
Koukalová A., Amaro M., Aydogan G., Gröbner G., Williamson P.T., Mikhalyov I., Hof M., Šachl R. 2017. Lipid driven nanodomains in giant lipid vesicles are fluid and disordered. Sci. Rep. 7, 1–12.
Galimzyanov T.R., Molotkovsky R.J., Bozdaganyan M.E., Cohen F.S., Pohl P., Akimov S.A. 2015. Elastic membrane deformations govern interleaflet coupling of lipid-ordered domains. Phys. Rev. Lett. 115, 088 101.
Galimzyanov T.R., Molotkovsky R.J., Kheyfets B.B., Akimov S.A. 2013. Energy of the interaction between membrane lipid domains calculated from splay and tilt deformations. JETP Lett. 96, 681–686.
Risselada H.J., Marrink S.J. 2008. The molecular face of lipid rafts in model membranes. Proc. Natl. Acad. Sci. USA. 105, 17367–17372.
Perlmutter J.D., Sachs J.N. 2011. Interleaflet interaction and asymmetry in phase separated lipid bilayers: Molecular dynamics simulations. J. Am. Chem. Soc. 133, 6563–6577.
Pantano D.A., Moore P.B., Klein M.L., Discher D.E. 2011. Raft registration across bilayers in a molecularly detailed model. Soft Matter. 7, 8182–8191.
Evans E., Rawicz W. 1990. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys. Rev. Lett. 64, 2094.
Pan J., Tristram-Nagle S., Nagle J.F. 2009. Effect of cholesterol on structural and mechanical properties of membranes depends on lipid chain saturation. Phys. Rev. E. 80, 021931.
Baumgart T., Das S., Webb W.W., Jenkins J.T. 2005. Membrane elasticity in giant vesicles with fluid phase coexistence. Biophys. J. 89, 1067–1080.
Rawicz W., Olbrich K.C., McIntosh T., Needham D., Evans E. 2000. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophys. J. 79, 328–339.
Morris C.E., Homann U. 2001. Cell surface area regulation and membrane tension. J. Membr. Biol. 179, 79–102.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


