Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 5, стр. 373-380
Клеточная тест-система с генетически кодируемыми сенсорами цитоплазматического и ретикулярного кальция
П. Д. Котова a, *, О. А. Рогачевская a
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Московская обл., Пущино, Россия
* E-mail: p.d.kotova@gmail.com
Поступила в редакцию 05.03.2020
После доработки 19.05.2020
Принята к публикации 21.05.2020
Аннотация
Ионы кальция являются универсальным вторичным посредником и регулируют множество внутриклеточных процессов. Многие агонисты и первичные посредники, вовлеченные в межклеточные коммуникации и аутокринные/паракринные регуляции, действуют через поверхностные рецепторы, сопряженные с мобилизацией внутриклеточного Са2+. Существующие представления о механизмах внутриклеточной Са2+-сигнализации основаны преимущественно на мониторинге Са2+ в цитозоле. Между тем обмен Са2+ между цитозолем и различными клеточными органеллами имеет ключевое значение для физиологии клеток и биологических тканей в целом. Поэтому мониторинг Са2+-сигналов в различных компартментах клетки представляется необходимым для анализа различных аспектов внутриклеточной Са2+-сигнализации. До последнего времени внутриклеточную Са2+-сигнализацию исследовали с помощью синтетических Са2+-зондов, которые невозможно избирательно загрузить в клеточные компартменты, вовлеченные в поддержание Са2+-гомеостаза, включая цитозоль, эндоплазматический ретикулум, митохондрии, кислые лизосомы. Поэтому специфические для компартментов Са2+-сигналы идентифицировали за счет использования Са2+-зондов с различной аффинностью к Са2+ в сочетании с пермеабилизацией плазматической мембраны клеток. В последние годы были разработаны генетически кодируемые Са2+-индикаторы, представляющие собой Са2+-чувствительные флуоресцентные белки, одним из основных преимуществ которых является возможность их локализации в определенных органеллах. В настоящей работе описано получение моноклональных клеточных линий, экспрессирующих одновременно флуоресцентные сенсоры цитоплазматического Са2+ GEM-GECO1 и ретикулярного Са2+ R-CEPIA1er. Полученные клоны могут быть использованы как клеточная система для анализа сопряжения поверхностных рецепторов с внутриклеточной Са2+-сигнальной системой и для изучения механизмов регуляции выброса депонированного Са2+.
ВВЕДЕНИЕ
Ионы кальция являются универсальным внутриклеточным вторичным посредником, регулирующим множество жизненно важных процессов, включая сокращение клеток, их рост, синаптическую передачу, экспрессию генов. Благодаря активному транспорту плазматическая мембрана отделяет цитоплазму клетки, где содержание Са2+ низко (~100 нМ), от внеклеточного пространства, концентрация Са2+ в котором на четыре порядка выше (1–2 мМ). В основном Са2+ внутри клетки депонирован и содержится во внутриклеточных компартментах, таких как эндоплазматический ретикулум, аппарат Гольджи, эндосомы, лизосомы и митохондрии, где его концентрация составляет 10–100 мкМ. Перечисленные органеллы принимают участие в поддержании общего Са2+-гомеостаза клетки, а также играют роль хранилища и источника Ca2+ в генерации локальных и глобальных Ca2+-сигналов в ответ на внешние стимулы [1–3].
Разработка подходов для мониторинга свободного Са2+ в живой клетке стала методологическим вызовом для исследований в области клеточной биологии, среди предлагавшихся приемов наиболее эффективным оказалось введение в клетку Са2+-чувствительного агента, оптические свойства которого меняются при изменении концентрации внутриклеточного Са2+. Первая относительно удачная попытка визуализации изменения концентрации внутриклеточного Са2+ была предпринята еще в 1928 году путем инъекции красителя ализарина сульфоната в амебу [4]. Однако рутинным мониторинг внутриклеточного Са2+ стал лишь спустя десятилетия, когда в исследовательскую практику были внедрены синтетические Са2+-зонды, флуоресценция которых зависит от концентрации Са2+ в диапазоне 50 нМ–1 мкМ. Особенно полезными оказались Са2+-зонды, флуорофор которых связан с производным ацетоксиметилового эфира, который позволяет им проникать через плазмалемму и благодаря гидролизу внутриклеточными эстеразами аккумулироваться внутри клетки [5–8]. Такие Са2+-зонды позволили установить многие ключевые механизмы внутриклеточной Са2+-сигнализации и остаются инструментом, широко используемым в клеточной биологии. По мере развития представлений о внутриклеточной сигнализации стало ясно, что информации, получаемой путем мониторинга цитозольного Са2+, недостаточно для анализа функционирования разветвленных внутриклеточных сигнальных систем, даже если ограничиваться только Са2+-зависимыми процессами. Так, одним из основных путей стимул-зависимого увеличения концентрации Ca2+ в цитоплазме клетки является высвобождение Ca2+ из ретикулума, которое требуется для регуляции различных клеточных процессов, таких как сокращение, оплодотворение, секреция везикул, синаптическая пластичность [9]. Гомеостаз Са2+ в эндоплазматическом ретикулуме имеет решающее значение для реализации определенных клеточных функций, и его нарушение ассоциируется с развитием ряда клеточных и тканевых патологий, включая нейродегенеративные и сердечно-сосудистые заболевания, а истощение ретикулярного Са2+ вызывает апоптоз [10]. Таким образом, исследование гомеостаза Ca2+ внутри эндоплазматического ретикулума необходимо для более глубокого понимания механизмов генерации внутриклеточных Ca2+-сигналов и их роли в физиологии и патофизиологии клетки.
Поскольку в покое нормальный уровень Ca2+ в ретикулуме оценивается величиной порядка 100 мкМ [1], для мониторинга опустошения Са2+-депо требуется использовать Ca2+-зонды с низкой аффинностью к Ca2+, такие как Mag-Fura-2 (Kd = = 25 мкМ), Fluo-5N (Kd = 90 мкМ), Oregon Green 488 BAPTA-5N (Kd = 20 мкМ) и ряд других. Хотя эти низкоаффинные Ca2+-зонды принципиально позволяют осуществлять мониторинг изменения депонированного Са2+, не существует методов их загрузки исключительно в люминальное пространство ретикулума без загрузки в другие внутриклеточные компартменты и прежде всего в цитоплазму клетки. Поэтому в тотальную Са2+-зависимую флуоресценцию клетки, содержащей Са2+-зонд, вносят вклад молекулы флуорофора, локализованные как в ретикулуме, так и в цитозоле. Поскольку объем цитозоля превышает объем ретикулума как минимум на два порядка, то в процессе генерации цитоплазматических Са2+-сигналов количество низкоаффинных флуорофоров, связанных с Са2+ в цитоплазме и ретикулуме, обычно сопоставимо. В связи с этим флуоресцентный сигнал, соответствующий повышению Са2+ в цитоплазме (0.1 → 1 мкМ), обычно превышает или нивелирует флуоресцентный сигнал, соответствующий падению Са2+ в ретикулуме (100 → 10 мкМ). По этой причине мониторинг Ca2+ в ретикулуме с помощью низкоаффинных Ca2+-зондов не может быть выполнен без удаления зонда из цитоплазмы с помощью диализа или пермеабилизации клетки [11], что, в свою очередь, сопровождается потерей важных внутриклеточных регуляторных компонентов. Таким образом, накопленный опыт работы с синтетическими Са2+-зондами и знания о внутриклеточных процессах выявили ряд ограничений этого поколения Са2+-индикаторов и инициировали создание индикаторов нового поколения, а именно генетически кодируемых Са2+-сенсоров на основе флуоресцентных белков [12–14].
В связи с простотой оптического мониторинга наиболее перспективными генетически кодируемыми Са2+-индикаторами являются Са2+-чувствительные флуоресцентные белки, представляющие собой химеры флуоресцентного (GFP) и Са2+-чувствительного (кальмодулин) белков. Такие индикаторы обладают яркостью, достаточной для визуализации динамики Ca2+ с субклеточным разрешением, а их реакция на изменение концентрации Ca2+ обратима и не требует кофакторов. Главным же их преимуществом над синтетическими Са2+-зондами является возможность их специфической экспрессии в определенных органеллах, которая достигается благодаря внесению в молекулу индикатора специфичной сигнальной последовательности, направляющей синтезировавшийся белок в целевые органеллы. Таким образом, флуоресцентные генетически кодируемые Ca2+-индикаторы являются эффективным инструментом для мониторинга Ca2+ избирательно в различных клеточных компартментах [15–17].
Генетически кодируемые Са2+-индикаторы семейства GECO являются на сегодняшний день самыми совершенными представителями индикаторов своего класса. GECO, разработанные как сенсор цитоплазматического Са2+, характеризуются высокими аффинностью к Са2+ (Кd = 300–1100 нМ) и яркостью флуоресценции, обеспечивающей хорошее соотношение сигнал/шум регистрируемых от них сигналов. Также немаловажным для практического применения является широкая цветовая палитра представителей этого семейства: на сегодняшний день в ней присутствуют белки, флуоресцирующие в зеленой (G-GECO), синей (B-GECO) и красной (R-GECO1) областях спектра, а также сине-зеленые ратиометрические индикаторы (GEM-GECO1 и GEX-GECO1) [15]. На основе GECO было создано семейство генетически кодируемых Са2+-индикаторов CEPIA, представители которого характеризуются высокой интенсивностью флуоресценции, хорошим соотношением сигнал/шум и широкой цветовой палитрой, присущими GECO, но отличаются от них пониженным сродством к Ca2+ (Кd = 500–700 мкМ). Благодаря внесению в аминокислотную последовательность этих сенсоров соответствующего сигнального пептида они транспортируются в эндоплазматический ретикулум, что позволяет детектировать динамические изменения концентрации исключительно ретикулярного Ca2+ [16, 17].
Таким образом, генетически кодируемые Са2+-индикаторы являются эффективным инструментом для более детального анализа механизмов внутриклеточной Са2+-сигнализации и Са2+-зависимых процессов, позволяя, в частности, проводить независимый мониторинг ретикулярного и цитоплазматического Са2+. Данная работа была направлена на создание моноклональных клеточных линий, экспрессирующих флуоресцентные сенсоры цитоплазматического GEM-GECO1 и ретикулярного Са2+ R-CEPIA1er, с целью расширения методологических возможностей изучения механизмов внутриклеточной трансдукции внешних стимулов.
МАТЕРИАЛЫ И МЕТОДЫ
Культура клеток. Клетки линии НЕК 293 (Российская коллекция клеточных культур позвоночных) культивировали в среде DMEM (Gibco) с высоким содержанием глюкозы с добавлением 10% эмбриональной бычьей сыворотки (HyClone), 100 мг/мл гентамицина (Sigma), 2 мМ глутамина (Sigma) (ростовая среда) во влажной атмосфере c 5% содержанием CO2 в воздухе при 37°C. Полученные моноклональные линии культивировали в присутствии 300 мкг/мл антибиотика G418 (Invivogen).
Трансфекция клеток. Клетки НЕК 293 трансфицировали плазмидными векторами CMV–GEM-GECO1 (#32442, Addgene) и CMV R-CEPIA1er (#58216, Addgene) одновременно с использованием набора для липофекции Lipofectamine 3000 (Invitrogen) по оптимизированному согласно рекомендациям производителя протоколу. Накануне трансфекции клетки НЕК 293 рассевали в ростовой среде из расчета (2–4) × 105 клеток в 1 лунку 12-лучночного планшета. К 800 мкл ростовой среды в лунку добавляли трансфекционную смесь, которая содержала 200 мкл среды OptiMEM (Gibco), 2 мкл P3000 Reagent (Invitrogen), 2 мкл Lipofectamine 3000 (Invitrogen), и по 1 мкг каждого плазмидного вектора. Через 24 ч среду заменяли на свежую ростовую и оценивали эффективность трансфекции по наличию в клетках флуоресценции экспрессируемых белков. Через 48 ч клетки обрабатывали раствором Версена (Sigma) и 0.25% раствором трипсина (Sigma), затем рассевали в соотношении 1 : 10 в чашку Петри 60 мм и культивировали в присутствии 700 мкг/мл селективного антибиотика G418 (Invivogen) в течение 2 недель. В результате селекции на чашке оставались колонии клеток, обладающие различным уровнем флуоресценции белков интереса, обусловленным различиями в уровне их экспрессии.
Сортировка клеток. Полученную гетерогенную популяцию клеток использовали для получения клеточных моноклонов с высоким уровнем экспрессии обоих экспрессируемых белков. Накануне сортировки (3 – 4) × 106 клеток переносили в 25 см2 культуральный флакон в 5 мл ростовой среды. Непосредственно перед сортировкой клетки однократно обрабатывали раствором Версена и затем инкубировали в 0.5 мл 0.25% раствора трипсина до полного открепления клеток от пластика, ферментативную реакцию останавливали добавлением 1 мл ростовой среды и переносили клетки в коническую микропробирку объемом 1.5 мл. Затем клетки осаждали центрифугированием при 50 g и ресуспендировали в 1 мл среды для сортировки клеток на основе фосфатного буфера (pH 7.4) и 1% эмбриональной бычьей сыворотки. Для получения суспензии одиночных клеток их пропускали через клеточное сито с размером ячейки 40 мкм (Corning cell strainer, Sigma). Полученную суспензию клеток анализировали с помощью сортера клеток FACSAria SORP (BD Biosciences). Флуоресценцию клеток возбуждали при длинах волн 407 и 561 нм, эмиссию регистрировали в областях 525 ± 10 нм и 582 ± 7.5 нм для GEM-GECO1 и R-CEPIA1er соответственно. Для получения моноклонов отбирали клетки, обладающие наибольшей интенсивностью флуоресценции обоих экспрессируемых белков, и помещали их по одной в каждую лунку 96-луночного планшета, содержащую 150 мкл ростовой среды с повышенным до 15% содержанием сыворотки.
Наращивание моноклональных клеточных линий. Отсортированные и помещенные по одной в лунку клетки наращивали до количества, достаточного для проведения их тестирования. Планшеты с клетками помещали в СО2-инкубатор, на 7 день культивирования в лунки добавляли по 50 мкл ростовой среды, содержащей 10% сыворотки. На 10 день проводили первичный визуальный контроль наличия в лунках живых моноклонов и их флуоресценции с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss). Растущие клеточные моноклоны обладали разной пролиферативной активностью, в связи с этим лунки 96-луночных планшетов раз в 3 дня проверяли на наличие клонов, достигших 50–70% конфлюентности; такие клоны переносили в лунки с большей ростовой поверхностью (24-луночный планшет). Для дальнейшего наращивания отбирали клоны, флуоресценция которых была наиболее яркой и однородной. При пересеве моноклонов с лунки 12- на лунку 6-луночного планшета часть клеток каждого клона оценивали визуально и тестировали физиологически.
Конфокальная микроскопия. Клетки каждого полученного моноклона анализировали визуально с помощью лазерного сканирующего конфокального микроскопа Leica TCS SP5 confocal microscope (Leica), оборудованного объективом с масляной иммерсией Plan Apochromat HCX PL APO Lambda Blue 63× 1.4 Oil UV (Leica). Изображения регистрировали с помощью программы Leica Application Suite Advanced Fluorescence (LAS AF) ver. 2.6.4.8702 (Leica). Флуоресценцию возбуждали при 458 и 543 нм, эмиссию регистрировали в областях 490–550 и 560–660 нм для GEM-GECO1 и R-CEPIA1er соответственно.
Микрофотометрия. Для создания запланированного клеточного сенсора недостаточно только визуального контроля флуоресценции белковых Са2+-индикаторов в полученных клетках. Заключительный этап отбора клонов заключался в их тестировании по физиологическим критериям, а именно по характеристикам Са2+-сигналов, генерируемых клетками в ответ на стимуляцию ацетилхолином. Клетки прикрепляли ко дну фотометрической камеры с помощью адгезивного материала Cell Tak и выдерживали при комнатной температуре 30 мин. Внеклеточный раствор содержал (мМ): NaCl – 110, KCl – 5.5, CaCl2 – 2, MgCl2 – 0.8, HEPES – 10, глюкозу – 10. Фотометрические эксперименты проводили с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss), оборудованного объективом Plan NeoFluar 20×/0.75 и цифровой ECCD камерой LucaR (Andor Technology). Флуоресценцию клеток поочередно возбуждали при 380 ± 5.5 и 572 ± 17.5 нм, эмиссию регистрировали в областях 523 ± 23 и 634 ± 34 нм для GEM-GECO1 и R-CEPIA1er соответственно. Изменение концентрации Са2+ в цитоплазме и эндоплазматическом ретикулуме клетки оценивали по относительному изменению интенсивностей флуоресценции ΔF/F0 GEM-GECO1 и R-CEPIA1er соответственно, где ΔF = F0 – F, F и F0 – текущая интенсивность эмиссии Са2+-индикатора и его эмиссия в начале регистрации соответственно. Количественный фотометрический анализ изображений осуществляли с использованием программы NIS Elements (Nikon).
Криоконсервация. Отобранные по физиологическим критериям моноклональные линии клеток культивировали для получения клеточной массы, достаточной для криоконсервации 10 криоампул, по (4 – 5) × 106 клеток в каждой. Криоконсервацию осуществляли в растворе сыворотки с 10% DMSO.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Настоящая работа была направлена на создание клеточной тест-системы с генетически кодируемыми сенсорами цитоплазматического и ретикулярного Са2+. Представляется, что такая клеточная система расширит возможности анализа сопряжения поверхностных рецепторов с внутриклеточной Са2+-сигнальной системой и, в частности, будет полезна для изучения механизмов регуляции выброса депонированного Са2+. Основой для создания сенсора стали клетки НЕК 293; такой выбор был обусловлен тем, что клетки этой линии эндогенно экспрессируют множество G-белков, которые необходимы для сопряжения GPCR-рецепторов с различными внутриклеточными сигнальными системами, в том числе с мобилизацией внутриклеточного Са2+. В качестве молекулярного сенсора цитоплазматического Са2+ был выбран Са2+-чувствительный флуоресцентный белок GEM-GECO1. Высокая аффинность GEM-GECO1 к Са2+ (Kd = 340 нМ) и его оптические свойства, а именно эмиссия на двух длинах волн 511 и 455 нм при возбуждении в районе 390 нм, позволяют проводить ратиометрические измерения концентрации Са2+ в цитоплазме клетки [15]. Для мониторинга Са2+ в эндоплазматическом ретикулуме использовали Са2+-чувствительный флуоресцентный (λex = 562 нм, λem = 584 нм) белок R-CEPIA1er, который обладает пониженной аффинностью к Са2+ (Kd = 565 мкМ) и содержит сигнальную последовательность, позволяющую ему находиться исключительно в эндоплазматическом ретикулуме [16]. Спектры возбуждения и эмиссии этих белков не пересекаются, что дает возможность проводить одновременную регистрацию их флуоресценции, позволяя тем самым независимо регистрировать изменения концентрации Са2+ в цитоплазме и ретикулуме клетки. Следует отметить, что эффективность временной трансфекции клеток линии HEK 293 плазмидными векторами обычно не превышает 50%, при этом получающиеся клеточные популяции гетерогенны и содержат субпопуляции клеток с весьма вариабельным уровнем экспрессии белков интереса. Между тем, анализ внутриклеточных Са2+-сигналов требует стабильного и высокого уровня экспрессии обоих Са2+-индикаторов в доминирующей клеточной популяции. В связи с этим возникла необходимость создания моноклональных клеточных линий с требуемыми свойствами.
Для получения клеточных линий, стабильно экспрессирующих белки интереса, необходимо, чтобы кодирующие их последовательности встроились в геном клеток. Плазмидный вектор pCMV R-CEPIA1er несет в себе ген устойчивости к антибиотику G-418, что позволяет производить отбор клеток на селективной среде и значительно обогащать популяцию клетками, у которых кодирующая белок последовательность встроилась в геном. Однако вектор CMV–GEM-GECO1 не несет гена устойчивости к какому-либо антибиотику. Мы предположили, что, хотя оба плазмидных вектора попадают в одну и ту же клетку примерно равновероятно, при культивировании в присутствии G-418 происходит сегрегация клеток – нуклеотидная последовательность R-CEPIA1er закрепляется в геноме, в то время как встраивание в геном последовательности GEM-GECO1, не подверженной селекционному давлению, носит случайный характер. В эксперименте оказалось, что спустя 24 ч после трансфекции практически все клетки, экспрессирующие R-CEPIA1er, также экспрессировали GEM-GECO1, судя по специфической флуоресценции клеток в зеленой и красной областях спектра. После 2 недель культивирования в присутствии 700 мкг/мл G418 в ростовой среде ~60% клеток содержали R-CEPIA1er, хотя экспрессия GEM-GECO1 сохранилась только у 5% из них. Поскольку за это время клетки претерпели многократные деления, можно было полагать, что у клеток, сохранивших экспрессию обоих белков в процессе селекции, кодирующие их последовательности были встроены в геном. Поэтому полученная клеточная популяция подвергалась дальнейшей селекции с использованием клеточного сортера. В результате было приготовлено три 96‑луночных планшета, и в каждой из 288 лунок должно было содержаться не более одной клетки, обладающей высоким уровнем флуоресценции обоих Са2+-сенсоров. На десятый день культивирования выживаемость клонов составила ~20%. В четырех выживших клонах флуоресценция GEM-GECO1 не детектировалась, а в пяти других уровень флуоресценции того или другого Са2+-индикатора заметно варьировал. Кроме того, моноклоны обладали различной способностью к пролиферации, и некоторые из них прекращали пролиферировать после нескольких делений. По пролиферативной активности, яркости и локализации флуоресценции обоих Са2+-индикаторов для дальнейшего анализа были отобраны 32 клона.
Отобранные визуально GEM-GECO1/R-CEPIA1er клоны исследовали с использованием функциональных тестов на основе микрофотометрии (Ca2+ imaging). Для оценки чувствительности и динамического диапазона генетически кодируемых Са2+-сенсоров клетки полученных моноклональных линий стимулировали ацетилхолином, который в немодифицированных HEK 293 вызывал мобилизацию Са2+ в 70–80% клеток. Хотя цитоплазматический индикатор GEM-GECO1 позволяет проводить ратиометрические измерения концентрации Са2+ благодаря эмиссии на двух длинах волн (455 и 511 нм), мы ограничились технически более простым вариантом и регистрировали эмиссию GEM-GECO1 только в области 523 ± 23 нм. Практически все GEM-GECO1/R-CEPIA1er клоны в ответ на ацетилхолин демонстрировали хорошо детектируемые Са2+-сигналы от цитоплазматического индикатора, однако в большинстве из них сигналы, регистрируемые от ретикулярного сенсора, обладали неудовлетворительным соотношением сигнал/шум. Хотя сам факт падения уровня ретикулярного Са2+ зарегистрировать удавалось, мониторинг деталей и динамики этого процесса оказывался невозможным.
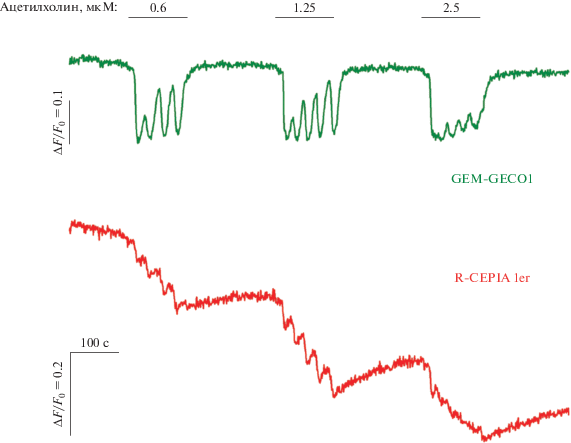
По результатам проведенных физиологических экспериментов из 32 клонов были отобраны 5, для которых был характерен высокий уровень экспрессии обоих Са2+-индикаторов практически во всех клетках. Характерно, что R-CEPIA1er был локализован в примембранной области (рис. 1а), что соответствует расположению эндоплазматического ретикулума, GEM-GECO1 же был распределен в клетке более равномерно (рис. 1б), что свидетельствует о его цитоплазматической локализации. Зарегистрированные с помощью генетически кодируемых Са2+-индикаторов сигналы вполне соответствовали нашим представлениям о механизмах генерации Са2+-ответов на ацетилхолин, которые возникают в цитоплазме клеток HEK 293 за счет выброса депонированного Са2+. При стимуляции клеток интенсивность флуоресценции GEM-GECO1 в области 520 нм падала (рис. 2, зеленая кривая), отражая повышение концентрации Са2+ в цитоплазме клеток [15], интенсивность флуоресценции CEPIA1er также падала (рис. 2, красная кривая), отражая выброс ретикулярного Са2+ [16]. Основным достоинством отобранных клонов было то, что сигналы, регистрируемые от сенсора ретикулярного Са2+ R-CEPIA1er, обладали высоким соотношением сигнал/шум при достаточном динамическом диапазоне, что позволяло отслеживать динамику выброса Са2+ из ретикулума достаточно детально. Так, Са2+-ответы ряда клеток на ацетилхолин носили осцилляторный характер, и это находило отражение не только в сигнале, регистрируемом от GEM-GECO1, но и в сигнале R-CEPIA1er, что наглядно демонстрирует способность сенсоров быстро реагировать на изменение концентрации Са2+ в обоих компартментах клетки (рис. 2).
Рис. 1.
Конфокальные изображения клеток линии GEM-GECO1/R-CEPIA1er. а – Специфическая (красная) флуоресценция клеток, индуцированная экспрессией R-CEPIA1er, б – специфическая (зеленая) флуоресценция клеток, индуцированная экспрессией GEM-GECO1, в – суперпозиция флуоресцентных изображений а и б; г – те же клетки в проходящем свете. Все изображения представлены в одном масштабе, указанном на г
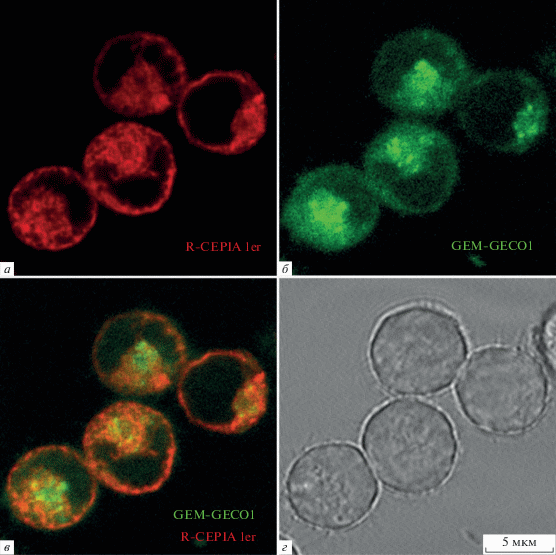
Рис. 2.
Мониторинг Ca2+ в клетках линии GEM-GECO1/R-CEPIA1er. Синхронная регистрация флуоресценции GEM-GECO1 (зеленая кривая), отражающей динамику цитозольного Ca2+ при аппликации ацетилхолина в различных дозах, и флуоресценции R-CEPIA1er (красная кривая), отражающей динамику ретикулярного Ca2+. Падение флуоресценции GEM-GECO1 соответствует повышению концентрации цитозольного Са2+, падение флуоресценции R-CEPIA1er соответствует понижению концентрации Са2+ в эндоплазматическом ретикулуме. Данные представлены как ΔF/F0, где ΔF = F–F0, F – текущая интенсивность флуоресценции, F0 – средняя интенсивность флуоресценции в начальный момент регистрации.
Таким образом, полученые моноклональные клеточные линии, экспрессирующие генетически кодируемые Са2+-индикаторы с определенной внутриклеточной локализацией, позволяют эффективно проводить одновременный мониторинг Са2+ в цитоплазме и ретикулуме одиночных клеток. В дальнейшем эти клеточные системы могут быть использованы для анализа функционирования эндоплазматического ретикулума как Са2+-депо, в частности для изучения механизмов Са2+-индуцированного выброса Са2+. Кроме того, полученные клоны могут быть использованы как тест-система для установления сопряжения поверхностных рецепторов с внутриклеточной Са2+-сигнализацией.
Авторы благодарят Д.М. Поташникову за помощь в проведении работ по сортировке клеток (поддержаны Программой развития МГУ) и А.В. Кучина за помощь в работе с конфокальным микроскопом (сектор оптической микроскопии и спектрофотометрии ЦКП ПНЦБИ РАН).
Работа поддержана грантом РНФ № 19-75-10068.
Список литературы
Berridge M.J. 2016. The inositol trisphosphate/calcium signaling pathway in health and disease. Physiol. Rev. 96, 1261–1296.
Patel S., Ramakrishnan L., Rahman T., Hamdoun A., Marchant J.S., Taylor C.W., Brailoiu E. 2011. The endo-lysosomal system as an NAADP-sensitive acidic Ca2+ store: Role for the two-pore channels. Cell Calcium. 50 (2), 157–167.
López-Crisosto C., Bravo-Sagua R., Rodriguez-Peña M., Mera C., Castro P.F., Quest A.F.G., Rothermel B.A., Cifuentes M., Lavandero S. 2015. ER-to-mitochondria miscommunication and metabolic diseases. Biochim. Biophys. Acta. 1852, 2096–2105.
Pollack H. 1928. Micrurgical studies in cell physiology: VI calcium ions in living protoplasm. J. Gen. Physiol. 11, 539–545.
Tsien R.Y. 1980. New calcium indicators and buffers with high selectivity against magnesium and protons: Design, synthesis and properties of prototype structures. Biochemistry. 19, 2396–2404.
Tsien R.Y. 1981. A non-disruptive technique for loading calcium buffers and indicators into cells. Nature. 290, 527–528.
Tsien R.Y., Pozzan T., Rink T.J. 1982. Calcium homeostasis in intact lymphocytes: cytoplasmic free calcium monitored with a new, intracellularly trapped fluorescent indicator. J. Cell Biol. 94, 325–334.
Grynkieuwicz G., Poenie M., Tsien R.Y. 1985. A new generation of Ca2+ indicators with greatly improved fluorescent properties. J. Biol. Chem. 260, 3440–3450.
Berridge M.J., Lipp P., Bootman M.D. 2000. The versatility and universality of calcium signalling. Nat. Rev. Mol. Cell Biol. 1, 11–21.
Mekahli D., Bultynck G., Missiaen L. 2011. Endoplasmic-reticulum calcium depletion and disease. Cold Spring Harb. Perspect. Biol. 3 (6), a004317.
Khan S.A., Rossi A.M., Riley A.M., Potter B.V., Taylor C.W. 2013. Subtype-selective regulation of IP(3) receptors by thimerosal via cysteine residues within the IP(3)-binding core and suppressor domain. Biochem. J. 451 (2), 177–184.
Raimondo J.V., Joyce B., Kay L., Schlagheck T., Newey S.E., Srinivas S., Akerman C.J. 2013. A genetically-encoded chloride and pH sensor for dissociating ion dynamics in the nervous system. Front. Cell Neurosci. 7, 202.
Lindenburg L., Merkx M. 2014. Engineering genetically encoded FRET sensors. Sensors (Basel). 14 (7), 11691–11713.
Kwon S.K., Hirabayashi Y., Polleux F. 2016. Organelle-specific sensors for monitoring Ca2+ dynamics in neurons. Front Synaptic Neurosci. 8, 29.
Zhao Y., Araki S., Wu J., Teramoto T., Chang Y.F., Nakano M., Abdelfattah A.S., Fujiwara M., Ishihara T., Nagai T., Campbell R.E. 2011. An expanded palette of genetically encoded Ca2+ indicators. Science. 333 (6051), 1888–1891.
Suzuki J., Kanemaru K., Ishii K., Ohkura M., Okubo Y., Iino M. 2014. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat. Commun. 5, 4153.
Suzuki J., Kanemaru K., Iino M. 2016. Genetically encoded fluorescent indicators for organellar calcium imaging. Biophys. J. 111 (6), 1119–1131.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


