Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 5, стр. 361-372
Регуляция активированным протеином с и пептидом-агонистом ПАР1 провоспалительной активации клеток линии RBL-2H3
И. И. Бабкина a, b, *, Е. В. Киселева c, Л. Р. Горбачева a, b
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
b Российский национальный исследовательский медицинский университет
им. Н.И. Пирогова Минздрава России
117997 Москва, Россия
c Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, Россия
* E-mail: irinababkina92@gmail.com
Поступила в редакцию 16.04.2019
После доработки 05.02.2020
Принята к публикации 10.02.2020
Аннотация
Настоящее исследование посвящено проблеме регуляции провоспалительной активности тучных клеток через специфический класс рецепторов, активируемых протеазами – ПАР. В работе впервые продемонстрирована регуляция новым пептидом-агонистом ПАР1 (NPNDKYEPF-амид) активности клеток RBL-2H3, аналогов тучных клеток. Показано, что пептид-агонист ПАР1, подобно активированному протеину С (АПС), проявляет антивоспалительное и цитопротекторное действие на RBL-2H3 при их активации провоспалительными стимулами. Инкубация тучных клеток с липополисахаридом (ЛПС) вызывает транзиторное увеличение концентрации внутриклеточного свободного кальция, повышает уровень секреции гистамина клетками, снижает их пролиферацию. Предварительная инкубация клеток как с пептидом, так и с АПС предотвращает эффект эндотоксина. Активация RBL-2H3 тромбином и кальциевым ионофором приводит к реорганизации актина, что может свидетельствовать об активации клеток и запуске секреции. Обработка клеток как пептидом, так и АПС на фоне действия активаторов приводит к упорядочиванию актина в подмембранной области клеток, что характерно для контрольной группы. Таким образом, впервые обнаруженные антивоспалительные и протекторные свойства пептида-агониста ПАР1 открывают возможность поиска новых подходов к терапии воспалительных процессов на основе препаратов пептидной природы через модулирование активности рецепторов семейства ПАР.
ВВЕДЕНИЕ
В развитие и исход процессов воспаления активно вовлечены протеазы системы свертывания крови, в частности тромбин и активированный протеин С (АПС). В связи с этим одной из фундаментальных проблем физиологии является понимание механизмов вовлечения протеаз гемостаза в воспалительные и репаративные процессы в тканях. Тромбин и АПС регулируют внутриклеточные каскады через специфический класс рецепторов, активируемых протеазами – ПАР. Показано, что тромбин и АПС, взаимодействуя с одним и тем же рецептором – ПАР1, оказывают разнонаправленное действие при эксайтотоксичности и воспалении [1, 2]. Данный тип взаимодействия был назван “смещенный агонизм” [3–5]. Кроме того, агонистами ПАР могут быть синтетические пептиды с аминокислотной последовательностью аналогичной “привязанному лиганду”, освобождаемому при расщеплении рецептора протеазой, и имеющие разные последовательности в случае активации тромбином или АПС [6–8]. Таким образом, исследование роли ключевых протеаз гемостаза, а также рецепторов, активируемых протеазами, в воспалительных процессах представляется весьма актуальным и перспективным как для фундаментальной физиологии, так и для практической медицины. Поиск новых агонистов ПАР – регуляторов воспаления может быть перспективным направлением поиска соединений, эффективно купирующих воспалительные процессы. Одними из основных участников воспалительного процесса являются тучные клетки (ТК). Они экспрессируют ПАР и содержат целый ряд медиаторов воспаления, однако механизмы взаимодействия протеаз системы гемостаза с тучными клетками изучены недостаточно. В связи с этим целью исследования было выяснение механизмов антивоспалительного действия АПС и его функционального аналога, синтетического пептида-агониста ПАР1 (АП9) в условиях воспаления in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследований использовали клеточную линию RBL-2H3 – культивируемый аналог тучных клеток, полученную из периферической крови крыс с базофильной лейкемией [9, 10].
Материалы. Активированный протеин С, тромбин человека, персульфат аммония (PSA), диметилсульфоксид (DMSO), ортофталевый альдегид, гистамин, липополисахарид из E. coli (ЛПС), ионофор А23187, ингибиторы протеаз и фосфатаз, лизирующий буфер RIPA (Sigma, США), Na3PO4, NaCl, KCl, CaCl2, MgCl2, KH2PO4, Na2HPO4, HEPES, параформальдегид, инактивированная эмбриональная телячья сыворотка (HI FBS), раствор Хенкса без кальция и без магния (Ca2+, Mg2+-free HBSS), трипсин-EDTA, L-глутамин, пенициллин/стрептомицин, GlutaMax (Gibco, Invitrogen, США); MTT (3‑(4,5‑диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолийбромид), EGTA, иономицин, Тритон X-100, Fura-2/AM, Syto59, DAPI, Pluronic F-127 (Molecular Probes, США); антитела: первичные анти-ThrombinR (анти-ПАР1) антитела (АТАР2, С18, SantaCruz, США), анти-GAPDH антитела (Millipore, США); вторичные антитела AlexaFluor 488, AlexaFluor 555 (Molecular Probes); раствор Версена, среда α-МЕМ (Панэко, Россия); реагент Бредфорд, трис-буферный солевой раствор (TBS) (Bio-Rad, США); хемилюменисцентный набор ECL (Thermo Scientific, США).
Синтез пептида-агониста ПАР1 (АП9) (NPNDKYEPF-амид) был осуществлен в лаборатории синтеза пептидов ФГБУ “Российский кардиологический научно‑производственный комплекс” Минздрава РФ М.В. Сидоровой по стандартной технологии пептидного синтеза на твердой фазе с применением методологии Fmoc-(9-флуоренилметоксикарбонил). Структура пептида подтверждена данными 1Н-ЯМР-спектроскопии, а гомогенность – данными аналитической ВЭЖХ.
Клеточная культура RBL-2H3. В работе были использованы культивируемые аналоги тучных клеток – клетки линии RBL-2H3. Эта линия клеток была получена из крыс линии Вистар с химически индуцированной базофильной лейкемией. Данные клетки экспрессируют рецепторы FcεRI и способны секретировать гистамин. Клетки обладают способностью к дегрануляции, т.е. к высвобождению ряда веществ, связанных с иммунными реакциями. Клетки линии RBL-2H3 были предоставлены ИБР РАН.
Клетки выращивали на культуральных флаконах 25 см2 в среде α-МЕМ, содержащей 0.5 мМ L-глутамин, 10% HI FBS и 100 ед/мл пенициллина/стрептомицина. Пассирование клеток осуществляли с использованием раствора Версена и 0.05% трипсина-EDTA 1 раз в 3 дня. Для экспериментов клетки культивировали на 96- и 48-луночных планшетах (по 5 × 104 и 8 × 104 клеток/лунка соответственно) или на чашках Петри Glass Bottom (MatTek, США) (по 8 × 104 клеток/стекло) при 37°С и 5% СО2. Воздействия исследуемыми веществами осуществляли через 24 ч после нанесения клеточной суспензии на культуральные планшеты или чашки Петри.
Иммуноцитохимическое окрашивание. Клетки, культивируемые на чашках Петри Glass Bottom (MatTek, США), промывали теплым фосфатно-солевым буфером (PBS) и фиксировали в 4% параформальдегиде (15 мин). После отмывки (1 × × 10 мин 120 мМ Na2HPO4; 1 × 10 мин низкосолевым буфером (150 мМ NaCl, 10 мМ Na2HPO4), 2 × × 10 мин высокосолевым буфером (0.5 М NaCl, 20 мМ Na2HPO4)) клетки пермеабилизовали и для блокирования неспецифического связывания инкубировали в буфере FSBB, содержащем 0.1% Тритон X-100, 5% FBS (эмбриональная телячья сыворотка), в PBS. Первичные анти-ThrombinR антитела (АТАР2, С18) инкубировали с клетками в течение ночи при 4°С в FSBB. На следующий день культуры трижды отмывали от первичных антител высокосолевым буфером, затем в течение 1.5 ч инкубировали со вторичными антителами. Для оценки реорганзации F-актина клетки инкубировали с фаллоидином (1 : 40), конъюгированным с Alexa 488. Далее клетки промывали (1 × 10 мин высокосолевым буфером (0.5 М NaCl, 20 мМ Na2HPO4); 1 × 10 мин 120 мМ Na2HPO4; 1 × 10 мин 5 мМ Na2HPO4). Для визуализации ядер к клеткам добавляли ДНК-тропный краситель Syto59 или DAPI (1 : 500), разведенные в 5 мМ NaH2PO4. Далее клетки анализировали с помощью лазерного сканирующего микроскопа LSM 700 (ZIESS, Германия).
Вестерн-блотинг. Для подтверждения данных иммуноцитохимии экспрессию рецептора ПАР1 оценивали при помощи метода вестерн-блотинга. Культуральные чашки Петри с клетками линии RBL-2H3 переносили на лед, 1 раз отмывали холодным фосфатно-солевым буфером. Затем клетки лизировали с использованием буфера RIPA, содержащего ингибиторы протеаз и фосфатаз (Sigma). Лизаты собирали, инкубировали 30 мин и далее центрифугировали при 14 000 об/мин, 4°С в течение 10 мин. Супернатанты аккуратно отбирали, измеряли содержание белка с помощью реагента Бредфорд (Bio-Rad), замораживали и хранили при –70°С. При проведении ПААГ-электрофореза аликвоту лизата каждой группы добавляли к соответствующему объему буфера (12.5 мМ Тris/HCl (pH 6.8), 2% SDS, 10% глицерин, 0.025% бромфеноловый синий, 20% β-меркаптоэтанол, рН 6.8) и наносили в лунки геля. После разделения белков в ПААГ осуществляли перенос белков на нитроцеллюлозную мембрану при 20 В, 0.4 А в течение часа. Мембрану блокировали (5% обезжиренное сухое молоко в TBS) и затем инкубировали с первичными антителами к ПАР1 (1 : 100, Santa Cruz, США) в течение ночи при +4°С на шейкере. Далее несвязавшиеся антитела отмывали, мембрану инкубировали со вторичными HRP-антителами в течение 1.5 ч. После отмывки мембрану проявляли на пленку, используя хемилюминесцентный набор ECL (Thermo Scientific). Далее мембрану инкубировали в растворе Stripping Buffer (Thermo Scientific) в течение 30 мин, отмывали, блокировали и инкубировали с анти-GAPDH антителами (1 : 300, Millipore, США) с последующей детекцией, как указано выше.
Определение пролиферации RBL-2H3 (МТТ-тест). Основа МТТ-метода при оценке содержания живых клеток в культуре – восстановление клетками солей тетразолия до сильно поглощающих в видимой области спектра формазанов [11]. MTT (3‑(4,5‑диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолийбромид) восстанавливается до формазана дегидрогеназами митохондрий только живых клеток. Водный раствор МТТ добавляли в культуральную среду до конечной концентрации 0.5 мг/мл и инкубировали клетки 2 ч при 37°С, 5% СО2. Растворение формазанов осуществляли с помощью DMSO (Sigma). Оптическую плотность измеряли на фотометре iMark (Bio-Rad) при 530 нм. Оценивали результаты в процентах по отношению к контролю.
Измерение секреции гистамина клетками линии RBL-2H3. Для индукции секреции гистамина клетки линии RBL-2H3 инкубировали с исследуемыми веществами 90 мин при 37°С, 5% СО2. Реакцию останавливали помещением планшета на лед. Анализ экстраклеточного гистамина проводили в клеточном супернатанте. Для определения внутриклеточного гистамина клетки разрушали 15-минутной инкубацией с 0.1% раствором Тритона Х-100. Метод определения гистамина основан на реакции конденсации гистамина с ортофталевым альдегидом, в результате которой образуется флуоресцирующий комплекс. Для определения содержания гистамина к пробам добавляли 1 N NaОН и 0.1% раствор ортофталевого альдегида в 96% этаноле. Образовавшийся флуорофор стабилизировали подкислением раствора 3N НCl [12, 13]. Флуоресценцию измеряли на плашечном спектрофлуориметре Multilabel counter 1420, VICTOR2 PerkinElmer при 460 нм, возбуждая при 355 нм.
Для определения количества секретируемого гистамина клетками строили калибровочную кривую (5; 2; 1; 0.8; 0.6; 0.45; 0.3; 0.15 мкг/мл гистамина).
Для каждой отдельной пробы рассчитывали долю высвободившегося гистамина в процентах. Высвобождение гистамина (%) = (концентрация гистамина в супернатанте)/(концентрация гистамина в супернатанте + концентрация внутриклеточного гистамина) × 100%. Уровень секреции гистамина клетками в разных условиях (при воздействии тестируемых веществ) выражали в процентах от уровня секреции гистамина клетками контрольной группы (спонтанная секреция), принятого за 100%.
Микрофлуориметрические измерения [Ca2+]i. [Ca2+]i измеряли методом флуоресцентной микроскопии с помощью высокоаффинных Ca2+-индикаторов Fluo-4 и Fura-2 (Molecular Probes) [14].
Перед экспериментом клетки нагружали ацетоксиметильным (АМ) эфиром индикатора Fura-2 или Fluo-4 в культуральной среде в течение 40 мин при 37°С в СО2-инкубаторе, добавляя индикаторы в концентрациях 1–2 мкМ. Для облегчения проникновения индикаторов сквозь клеточную мембрану загрузку осуществляли в присутствии “мягкого” неионного детергента Pluronic F-127 (0.02%) (Molecular Probes), затем клетки отмывали HEPES-солевым буфером и выдерживали в нем 10–15 мин для полной деэтерификации молекул индикатора.
Стекло с клетками помещали на столик лазерного сканирующего микроскопа LSM 700 (ZIESS, Германия) в случае использования Fluo-4 или Olimpus (любезно предоставленного ФГАУ “НМИЦ здоровья детей”, Минздрава России) при регистрации кальциевого сигнала с помощью Fura-2. Флуоресценцию Fura-2 возбуждали, облучая клетки поочередно светом с длинами волн 340 и 380 нм в течение 100–200 мс, с интервалом 5–10 с; эмиссию регистрировали в диапазоне 505–535 нм. Флуоресценцию Fluo-4 возбуждали, облучая клетки светом с длиной волны 488 нм в течение 100–200 мс, с интервалом 10–13 с; эмиссию регистрировали в диапазоне 505–535 нм. Данные Ca2+-зависимой флуоресценции представлены в виде относительных значений, полученных в результате нормирования флуоресцентного сигнала в каждой клетке на эффект иономицина, принятый за единицу.
Статистическая обработка данных. Обработку данных проводили в программе GraphPad Prism 6 (GraphPad Software Inc., США). Для анализа использовали данные 4– 6 независимых экспериментов. Данные представлены как среднее ± ± стандартная ошибка среднего. Для анализа использовали параметрический критерий One-way ANOVA и непараметрические критерии Краскела–Уоллеса (Kruskal–Wallis test) и Манна–Уитни (Mann–Whitney test). Различия считали достоверными при р < 0.05, n – число независимых экспериментов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Антивоспалительное и пролиферативное действие агонистов ПАР1 – АПС и АП9 на клетки линии RBL-2H3, активированные липополисахаридом
Для исследования антивоспалительного действия активированного протеина С (АПС) и нового пептида-агониста ПАР1 – АП9 были использованы клетки линии RBL-2H3 базофильной лейкемии крыс. Они экспрессируют широкий спектр рецепторов и отвечают активацией и повышением секреции на действие провоспалительных/повреждающих стимулов подобно тучным клеткам, что делает их удобным объектом для исследования воспалительных процессов.
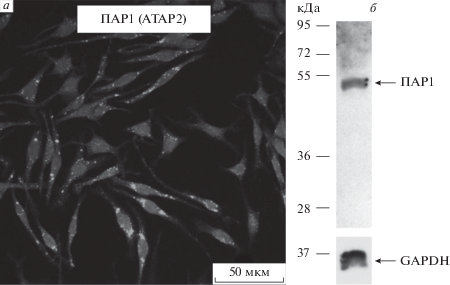
Ряд данных зарубежных и отечественных исследователей указывает на вовлечение в АПС-зависимую регуляцию клеточных функций ПАР1 и эндотелиального рецептора протеина С (ЭРПС) [2, 6, 7]. Используя вестерн-блотинг и иммуноцитохимическое окрашивание клеток линии RBL-2H3, с помощью специфических анти-ПАР1 антител мы установили, что RBL-2H3 экспрессируют указанный тип рецепторов (рис. 1). Данный факт позволяет предположить возможность рецептор-опосредованной регуляции клеточных функций протеазой АПС и ее функциональным аналогом пептидом АП9. Ранее в нашей лаборатории была показана ПАР1-зависимая реализация эффектов АП9 на тучных клетках из перитониальной полости крыс и гиппокампальных нейронах [15–17].
Рис. 1.
Экспрессия ПАР1 в клетках линии RBL-2H3. Репрезентативные данные иммуноцитохимического окрашивания (а) и вестерн-блота (б). ПАР1 (ATAP2) – cпецифические анти-ПАР1-антитела, GAPDH –анитела к анти-глицеральдегид-3-фосфат–дегидрогеназе.
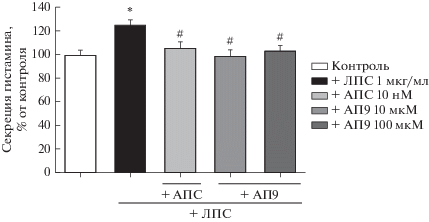
Влияние АПС и АП9 на секрецию гистамина клетками линии RBL-2H3, вызванную липополисахаридом. ЛПС является широко используемым индуктором воспаления в исследованиях in vitro и in vivo. Показано, что с помощью TLR4 тучные клетки распознают ЛПС и секретируют во внешнюю среду провоспалительные факторы IL-1, IL-6 и TNFα [18]. Кроме того, запуск ЛПС сигнальных каскадов в тучных клетках сопряжен с активацией транскрипционного фактора NF-κB и последующей секрецией провоспалительных цитокинов [19]. При активации тучных клеток провоспалительными стимулами происходит дегрануляция и секреция медиаторов во внеклеточную среду [20]. Уровень дегрануляции может служить маркером активации тучных клеток и интенсивности воспалительного процесса. В настоящем исследовании нами показано, что инкубация клеток линии RBL-2H3 с ЛПС (1 мкг/мл, 90 мин) приводит к увеличению секреции гистамина на 26% по сравнению с контрольной группой (рис. 2). Обнаружено, что предобработка клеточных культур АПС (10 нМ) или АП9 (10 и 100 мкМ) способствует снижению уровня дегрануляции на 20, 26 и 22% соответственно по сравнению с группой активированных, но не обработанных протекторами клеток (рис. 2). Полученные данные впервые демонстрируют антивоспалительный эффект АПС и АП9 на клетках линии RBL-2H3 в условиях активации ЛПС. Согласно литературным данным, цитопротекторный эффект АПС осуществляется через вовлечение β-аррестинов независимо от G-белков [21, 22]. В связи с этим, возможным механизмом протекторного действия АПС на клетки линии RBL-2H3 является запуск сигнальных каскадов с привлечением β-аррестина [23] и стабилизацией подмембранного цитоскелета.
Рис. 2.
Влияние АПС (10 нМ) и АП9 (10 и 100 мкМ) на секрецию гистамина клетками линии RBL-2H3, активированными провоспалительным агентом – ЛПС (1 мкг/мл). В качестве контроля выступали неактивированные клетки без АПС или АП9, n = 4. * p < 0.05 по сравнению с контролем, # p < 0.05 по сравнению с клетками, активированными ЛПС, но без добавления АПС и АП9.
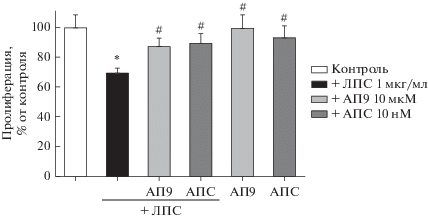
Влияние АПС и АП9 на выживаемость клеток линии RBL-2H3 в условиях действия эндотоксина. Активация тучных клеток в условиях воспаления может приводить не только к повышению их секреторной активности, но и сопровождаться клеточной гибелью. В наших исследованиях мы оценивали число живых клеток с помощью МТТ-теста при действии эндотоксина ЛПС (1 мкг/мл).
В процессе развития острой воспалительной реакции, вызванной инкубацией клеток в присутствии ЛПС в течение 24 ч, наблюдалось снижение уровня живых клеток в культуре. Установлено, что инкубация клеток с ЛПС приводит к снижению данного показателя на 30%. Предобработка клеток АПС (10 нМ) или АП9 (10 мкМ) предотвращала ЛПС-вызванную гибель клеток, в результате доля живых клеток не отличалась от контрольных значений. Необходимо отметить, что пролиферация клеток RBL-2H3, обработанных АПС или АП9, не отличалась от пролиферации клеток контрольной группы (рис. 3).
Рис. 3.
Влияние АПС (10 нМ) и АП9 (10 мкМ) на выживаемость клеток линии RBL-2H3, активированных ЛПС (1 мкг/мл). В качестве контроля выступали неактивированные и не обработанные исследуемыми веществами клетки, n = 4. * p < 0.05 по сравнению с контролем, # p < 0.05 по сравнению с клетками, активированными ЛПС, но без добавления АПС и АП9.
Активация RBL-2H3, вызванная эндотоксином, сопровождается снижением пролиферации и активацией секреции. АП9, подобно АПС, защищает клетки, снижая уровень секреции и приводя к нормализации процесса пролиферации.
Таким образом, агонисты ПАР1 – АПС и АП9 защищают клетки линии RBL-2H3 от токсического воздействия эндотоксина.
2. Влияние провоспалительной активации клеток линии RBL-2H3 тромбином и липополисахаридом на концентрацию свободного внутриклеточного кальция
Возрастание концентрации ионов кальция является ключевым фактором, опосредующим многие внутриклеточные процессы и, в частности, активацию клеток. Ранее на клетках линии RBL-2H3 было показано, что развитие воспалительной реакции сопровождается увеличением концентрации цитозольного Са2+ ([Ca2+]i) [24]. На уровень внутриклеточного Са2+ может дозозависимо влиять сериновая протеаза гемостаза – тромбин, которая в высоких концентрациях выступает в качестве провоспалительного фактора. Известно, что тромбин в высоких концентрациях через ПАР1 активирует перитониальные тучные клетки, вызывая их дегрануляцию [25]. Вместе с тем и ЛПС (1 мкг/мл) стимулирует дегрануляцию клеток и способствует FcεRI-зависимой мобилизации Са2+ через SOCs (Store‑Operated Ca2+ Channels), влияя на экспрессию и транскрипцию субъединиц этих каналов [24]. При активации тучных клеток происходит повышение [Ca2+]i, связанное с его выходом из эндоплазматического ретикулума, ведущее к истощению этого депо Ca2+ и инициирующее вход Ca2+ через SOCs плазматической мембраны. Все это приводит к увеличению [Ca2+]i, что является существенным для сигнальных каскадов клетки [26–28].
Тромбин (10 нМ) вызывает транзиторное увеличение [Ca2+]i в RBL-2H3, имеющее сходную конфигурацию с ответом клеток на ЛПС, но более выраженное по амплитуде (о чем свидетельствует размер площади под графиком, рис. 4б), чем при добавке эндотоксина (рис. 4). На рис. 4а видно, что вызванное ЛПС изменение Ca2+-зависимой флуоресценции Fura-2 отменяется предварительной инкубацией клеток с тромбином. Вероятно, это связано с трансдукцией сигналов, запускаемых тромбином через Gq-белок при расщеплении ПАР1 и активируемых ЛПС TLR4 через фосфоинозитидный путь с образованием вторичного мессенджера IP3, приводящего к выходу кальция из эндоплазматического ретикулума [29–31]. Можно предположить, что к моменту добавления ЛПС (на фоне тромбина) запасы Са2+ истощены или инактивированы механизмы его высвобождения в цитозоль.
Рис. 4.
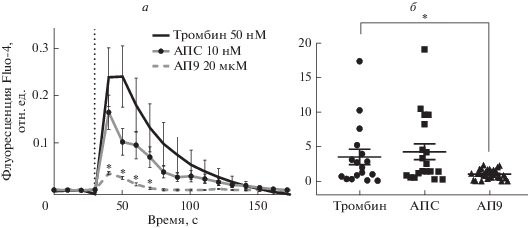
Влияние тромбина (10 нМ) и ЛПС (1 мкг/мл) на изменение внутриклеточной концентрации кальция в культуре клеток линии RBL-2H3. а – Изменение Са2+-зависимой флуоресценции высокоаффинного кальциевого индикатора Fura-2 во времени. б – Площадь под кривой Са2+-зависимой флуоресценции высокоаффинного кальциевого индикатора Fura-2 во времени (отн. ед. × с). n = 60 ± 10. * p < 0.05 по сравнению с тромбином.
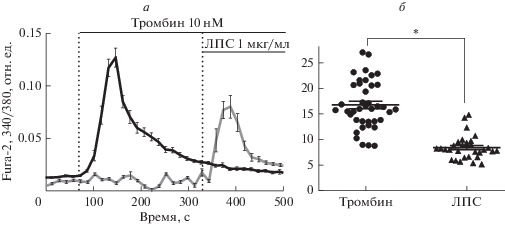
Обнаруженное нами возрастание [Ca2+]i в клетках RBL-2H3 под действием тромбина может быть одним из механизмов протеаза-зависимой активации клеток, что согласуется с данными, полученными в нашей лаборатории о провоспалительном действии тромбина [25, 32].
На следующем этапе мы оценивали влияние АПС и АП9 на [Ca2+]i в RBL-2H3. АПС и АП9 не влияли на [Ca2+]i, что согласуется с ранее полученными нами данными на культивируемых гиппокампальных нейронах [33]. При этом 10-минутная предобработка клеток линии RBL-2H3 в присутствии АП9 приводила к существенному уменьшению амплитуды Са2+-ответа, вызванного тромбином (рис. 5). Интересно, что АПС не обладал столь выраженным действием в этих условиях (рис. 5). Возможно, протекторный механизм действия синтетического пептида АП9 связан с запуском β-аррестин-зависимого сигнального каскада, который, как показано ранее, вызывает эффект, противоположный G-белок-зависимому действию тромбина [21, 22].
Рис. 5.
Влияние АПС (10 нМ) и АП9 (20 мкМ) на изменение внутриклеточной концентрации кальция в культуре клеток линии RBL-2H3, при активации их тромбином (50 нМ). а – Изменение Са2+-зависимой флуоресценции высокоаффинного кальциевого индикатора Fluo-4 во времени. б – Площадь под кривой Са2+-зависимой флуоресценции высокоаффинного кальциевого индикатора Fluo-4 во времени (отн. ед. × с). n = 80 ± 5. * p < 0.05 по сравнению с тромбином.
3. Влияние АПС и АП9 на перестройку актинового цитоскелета, вызванную провоспалительной активацией клеток RBL-2H3
Активация иммунокомпетентных клеток сопровождается запуском секреции, что сопряжено с перестройкой актинового цитоскелета [34]. Данный процесс, например, в макрофагах опосредован нарастанием Са2+ в цитозоле, в присутствии которого актин-связывающий белок гельзолин вызывает фрагментацию актиновых филаментов [35]. Существуют данные о том, что кальмодулин также играет важную роль в Ca2+-зависимой разборке F-актина в клетках RPMC [36]. В активированных клетках RBL-2H3 кальмодулин концентрировался в богатом актином кортексе (подмембранной области) клетки [37], где взаимодействовал с актин-связывающим каркасным белком IQGAP1. Rho GTP-азы высвобождаются из IQGAP1, когда кальмодулин связывает Ca2+. Поэтому повышение [Ca2+]i инициирует разборку существующего актинового кортекса клетки, устраняя тем самым физическую преграду для слияния везикул с плазматической мембраной [38].
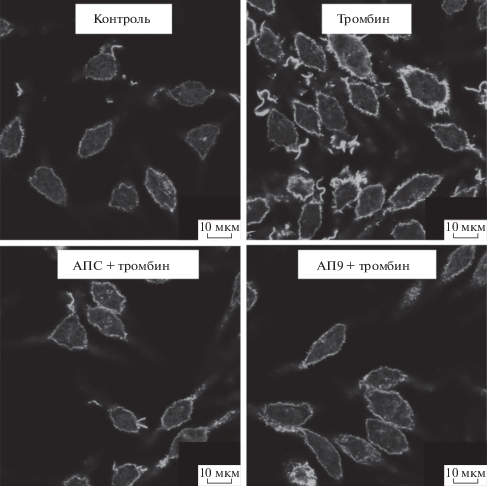
В следующей серии экспериментов мы активировали клетки тромбином (50 нМ, 1.5 ч) или кальциевым ионофором А23187 (50 нМ, 24 ч) и затем с помощью фаллоидина оценивали состояние F-актина в клетках линии RBL-2H3 в присутствии исследуемых ПАР1-агонистов (рис. 6 и 7). Тромбин в высокой концентрации и ионофор А23187 однонаправлено изменяли структуру актинового цитоскелета клеток, обеспечивая перестройку актина, характерную для экзоцитоза (рис. 6 и 7). При этом актиновые филаменты смещаются в околоядерную зону из подмембранной области отростков. Схожие перестройки кортикального F-актина наблюдаются после стимуляции FcεRI тучных клеток и интерпретируются во многих исследованиях как важный шаг в облегчении слияния гранул с плазматической мембраной, необходимого для высвобождения их содержимого во внеклеточную среду [34, 39–42]. Подобные изменения, вероятно, опосредованы взаимодействием тромбина с ПАР1 и усилением сигнала через активацию RhoA, что приводит к перестройке цитоскелета в клетках [43]. Это согласуется с данными, полученными на культуре астроцитов, где тромбин в высоких концентрациях вызывал изменение актинового цитоскелета, в частности повышение количества стресс-фибрилл в клетках [32]. Кроме того, подобная реорганизация цитоскелета может быть следствием тромбин-опосредованного повышения внутриклеточного Са2+ и запуском Са2+-зависимых сигнальных каскадов через актин-регулирующие белки, РКСs и др. При этом предобработка клеток АП9 или АПС способствовала стабилизации цитоскелета подобно ситуации, наблюдаемой в контрольной группе (рис. 6 и 7). Аналогичный эффект АПС был продемонстрирован на астроцитах, где он снижал вызванную тромбином дезорганизацию фибрилл и образование “free fields” [32].
Рис. 6.
Влияние АП9 (10 мкМ) на изменение актинового цитоскелета клеток линии RBL-2H3 через 24 ч после их активации ионофором А23187 (50 нМ). Репрезентативные снимки соответствующих клеточных культур, полученные с помощью лазерного сканирующего микроскопа LSM 700.
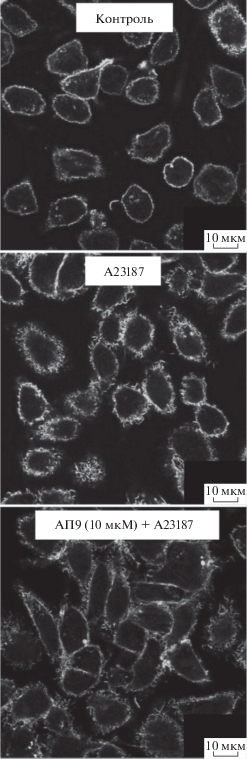
Рис. 7.
Влияние АПС (10 нМ) и АП9 (10 мкМ) на изменение актинового цитоскелета клеток линии RBL-2H3, активированных тромбином (50 нМ). Репрезентативные снимки соответствующих клеточных культур, полученные с помощью лазерного сканирующего микроскопа LSM 700.
Таким образом, на линии клеток RBL-2H3 впервые продемонстрировано вовлечение в регуляцию воспалительного ответа агонистов ПАР1. Выявленный антивоспалительный эффект нового пептида-агониста ПАР1, функционального аналога АПС, предоставляет новую возможность поиска препаратов пептидной природы с комплексным антивоспалительным действием.
Авторы приносят искреннюю благодарность А.М. Сурину (ФГАУ “НМИЦ здоровья детей” Минздрава России) за ценные замечания и рекомендации, сделанные в ходе обсуждения результатов.
Работа поддержана грантом РФФИ 19-015-00529. Работа Е.В. Киселевой выполнена в рамках раздела Государственного задания ИБР РАН, № 0108‑2019‑0004.
Список литературы
Zlokovic B.V. 2011. Neurovascular pathways to neurodegeneration in Alzheimer’s disease and other disorders. Nature Rev. Neurosci. 12, 723–738.
Mosnier L.O., Zlokovic B.V., Griffin J.H. 2014. Cytoprotective-selective activated protein C therapy for ischaemic stroke. Thromb. Haemost. 112 (11), 883–892.
Russo A, Soh U.J, Paing M.M, Arora P, Trejo J. 2009. Caveolae are required for protease-selective signaling by protease-activated receptor-1. Proc. Natl. Acad. Sci. USA. 106, 6393–6397.
Grimsey N., Soto A.G., Trejo J. 2011. Regulation of protease-activated receptor signaling by posttranslational modifications. IUBMB life. 63 (6), 403–411.
Austin K.M., Covic L., Kuliopulos A. 2013. Matrix metalloproteases and PAR1 activation. Blood. 21 (3), 431–439.
Gorbacheva L., Davidova O., Sokolova E., Ishiwata S., Pinelis V., Strukova S., Reiser G. 2009. Endothelial protein C receptor is expressed in rat cortical and hippocampal neurons and is necessary for protective effect of activated protein C at glutamate excitotoxicity. J. Neurochem. 111 (4), 967–75.
Mosnier L.O., Sinha R.K., Burnier L., Bouwens E.A., Griffin J.H. 2012. Biased agonism of protease-activated receptor 1 by activated protein C caused by non-canonical cleavage at Arg46. Blood. 120 (26), 5237–5246.
Hollenberg M.D., Mihara K., Polley D., Suen J.Y., Han A., Fairlie D.P., Ramachandran R. 2014. Biased signalling and proteinase-activated receptors (PARs): Targeting inflammatory disease. Br. J. Pharmacol. 171 (5), 1180–1194.
Eccleston E., Leonard B.J., Lowe J.S., Welford H.J. 1973. Basophilic leukaemia in the albino rat and a demonstration of the basopoietin. Nat. New Biol. 133 (244), 73–76.
Kulczycki A.J., Isersky C., Metzger H. 1974. The interaction of IgE with rat basophilic leukemia cells. I. Evidence for specific binding of IgE. J. Exp. Med. 3 (139), 600–616.
Mosmann T. 1983. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. J. Immunol. Methods. 65, 55–63.
Shore P.A. 1971. The chemical determination of histamine. In: Methods of Biochemical Analysis: Analysis of Biogenic Amines and Their Related Enzymes. Ed. Glick D. New York: Wiley Interscience, p. 89–92.
Shore P.A., Burkhalter A., Cohn V.H.Jr. 1959. A method for the fluorometric assay of histamine in tissues. J. Pharmacol. Exp. Ther. 127, 182–186.
Grynkiewicz G., Poenie M., Tsien R.Y. 1985. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J. Biol. Chem. 260 (6), 3440–3450.
Бабкина И.И., Струкова С.М., Пинелис В.Г., Райзер Г., Горбачева Л.Р. 2016. Новый синтетический пептид защищает нейроны от гибели, вызванной токсическим воздействием активированных тучных клеток, через рецептор, активируемый протеазами. Биол. мембраны. 33 (1), 70–79.
Киселева Е.В., Сидорова М.В., Горбачева Л.Р., Струкова С.М. 2014. Пептид-агонист рецептора, активируемого протеазами, стимулирует пролиферацию кератиноцитов и заживление раны эпителиального пласта подобно активированному протеину С. Биомед. химия. 60 (6), 702–706.
Горбачева Л.Р., Киселева Е.В., Савинкова И.Г., Струкова С.М. 2017. Новая концепция действия протеаз гемостаза на процессы воспаления, нейротоксичности и регенерации тканей. Биохимия. 82 (7), 1018–1032.
Цибулькина В.Н., Цибулькин Н.А. 2017. Тучная клетка как полифункциональный элемент иммунной системы. Аллергология и иммунология в педиатрии. 2 (49).
Nizamutdinova I.T., Dusio G.F., Gasheva O.Y., Skoog H., Tobin R., Peddaboina C., Meininger C.J., Zawieja D.C., Newell-Rogers M.K., Gashev A.A. 2016. Mast cells and histamine are triggering the NF-κB-mediated reactions of adult and aged perilymphatic mesenteric tissues to acute inflammation. Aging (Albany NY). 8 (11), 3065.
da Silva E.Z.M., Jamur M.C., Oliver C. 2014. Mast cell function: A new vision of an old cell. J. Histochem. Cytochem. 62 (10), 698–738.
Schulte G., Shenoy S.K. 2011. Beta-arrestin and disheveled coordinate biased signaling. Proc. Natl. Acad. Sci. USA. 108 (50), 19839–19840.
Wisler J.W., Xiao K., Thomsen A.R., Lefkowitz R.J. 2014. Recent developments in biased agonism. Curr. Opin. Cell Biol. 27, 18–24.
Soh U.J., Trejo J. 2011. Activated protein C promotes protease activated receptor 1 cytoprotective signaling through β arrestin and dishevelled 2 scaffolds. Proc. Natl. Acad. Sci. USA. 108, 1372–1380.
Yang C., Mo X., Lv J., Liu X., Yuan M., Dong M., Li L., Luo X., Fan X., Jin Z., Liu Z., Liu J. 2012. Lipopolysaccharide enhances FcεRI-mediated mast cell degranulation by increasing Ca2+ entry through store-operated Ca2+ channels: Implications for lipopolysaccharide exacerbating allergic asthma. Exp. Physiol. 12 (97), 1315–1327.
Strukova S.M., Dugina T.N., Khlgatian S.V., Redkozubov A.E., Redkozubova G.P., Pinelis V.G., 1996. Thrombin-mediated events implicated in mast cell activation. Semin. Thromb. Hemost. 22, 145–150.
Dráber P., Sulimenko V., Dráberová E., 2012. Cytoskeleton in mast cell signaling. Front. Immunol. 3, 130.
Blank U., Rivera J. 2004. The ins and outs of IgE-dependent mast-cell exocytosis. Trends Immunol. 25 (5), 266–273.
Rivera J., Fierro N.A., Olivera A., Suzuki R. 2008. New insights on mast cell activation via the high affinity receptor for IgE. Adv. Immunol. 98, 85–120.
Coughlin S.R., 2000. Thrombin signaling and protease activated receptors. Nature. 407, 258–264.
Tauseef M., Knezevic N., Chava K.R., Smith M., Sukriti S., Gianaris N., Obukhov A.G., Vogel S.M., Schraufnagel D.E., Dietrich A., Birnbaumer L. 2012. TLR4 activation of TRPC6-dependent calcium signaling mediates endotoxin-induced lung vascular permeability and inflammation. J. Exp. Med. 209 (11), 1953–1968.
Chiang C.Y., Veckman V., Limmer K., David M. 2012. Phospholipase Cγ-2 and intracellular calcium are required for lipopolysaccharide-induced Toll-like receptor 4 (TLR4) endocytosis and interferon regulatory factor 3 (IRF3) activation. J. Biol. Chem. 287 (6), 3704–3709.
Иванова А.Е., Горбачева Л.Р., Струкова С.М., Пинелиc В.Г., Райзер Г. 2013. Участие активированного протеина С и тромбина в регуляции функций астроцитов. Биол. мембраны. 30 (5–6), 387–397.
Gorbacheva L.R., Storozhevykh T.P., Pinelis V.G., Davydova O.N., Ishivata S., Strukova S.M. 2008. Activated protein C via the PAR1 receptor regulates the survival of neurons under glutamate excitotoxicity. J. Biochemistry. 73 (6), 893–902.
Deng Z., Zink T., Chen H.Y., Walters D., Liu F.T., Liu G.Y., 2009. Impact of actin rearrangement and degranulation on the membrane structure of primary mast cells: A combined atomic force and laser scanning confocal microscopy investigation. Biophys. J. 96 (4), 1629–1639.
Sun H.Q., Lin K.M., Yin H.L. 1997 Gelsolin modulates phospholipase C activity in vivo through phospholipid binding. J. Cell. Biol. 138 (4), 811–820.
Sullivan R., Burnham M., Torok K., Koffer A. 2000. Calmodulin regulates the disassembly of cortical F-actin in mast cells but is not required for secretion. Cell Calcium. 28, 33–46.
Psatha M., Koffer A., Erent M., Moss S.E., Bolsover S. 2004. Calmodulin spatial dynamics in RBL-2H3 mast cells. Cell Calcium. 36, 51–59.
Psatha M., Razi M., Koffer A., Moss S.E., Sacks D.B., Bolsover S.R. 2007. Targeting of calcium: Calmodulin signals to the cytoskeleton by IQGAP1. Cell Calcium. 41, 593–605.
Frigeri L., Apgar J.R. 1999. The role of actin microfilaments in the down-regulation of the degranulation response in RBL-2H3 mast cells. J. Immunol. 162, 2243–2250.
Nielsen E.H., Braun K., Johansen T. 1989. Reorganization of the subplasmalemmal cytoskeleton in association with exocytosis in rat mast cells. Histol. Histopathol. 4, 473–477.
Narasimhan V., Holowka D., Baird B. 1990. Microfilaments regulate the rate of exocytosis in rat basophilic leukemia cells. Biochem. Biophys. Res. Commun. 171, 222–229.
Oka T., Hori M., Tanaka A., Matsuda H., Karaki H., Ozaki H. 2004. IgE alone-induced actin assembly modifies calcium signaling and degranulation in RBL-2H3 mast cells. Am. J. Physiol. Cell Physiol. 286, 256–263.
Soh U.J., Dores M.R., Chen B., Trejo J., 2010. Signal transduction by protease-activated receptors. Br. J. Pharmacol. 160 (2), 191–203.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


