Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 6, стр. 466-476
Липидный профиль корней пшеницы при действии мембранотропных агентов
Ю. Н. Валитова a, *, В. Р. Хабибрахманова b, А. В. Белкина b, А. Г. Ренкова a, Ф. В. Минибаева a
a Казанский институт биохимии и биофизики – обособленное структурное подразделение
Федерального исследовательского центра “Казанский научный центр Российской академии наук”
420111 Казань, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Казанский национальный исследовательский технологический университет”
420015 Казань, Россия
* E-mail: yulavalitova@mail.ru
Поступила в редакцию 21.04.2020
После доработки 28.07.2020
Принята к публикации 01.08.2020
Аннотация
Большинство сельскохозяйственных культур испытывают серьезные угрозы от воздействия различных абиотических стрессоров. Биологическая мембрана является первичным защитным барьером при действии стрессовых факторов и выступает в роли своеобразной мишени, принимающей удар на себя. Мембранные липиды являются важным компонентом, от которого зависит состояние растительной мембраны, степень ее проницаемости для ионов, микровязкость, а также работа мембраносвязанных ферментных комплексов. Целью настоящего исследования явилось изучение липидного профиля в корнях проростков пшеницы Triticum aestivum L. при направленном изменении состояния мембран специфическими агентами: CaCl2 (1 мМ) и β-ситостерином (0.5 мМ), уплотняющими мембрану, а также каналоформером нистатином (0.1 мМ) и детергентом тритоном Х-100 (16 мкМ), увеличивающими ее проницаемость. Установлено, что стабилизация мембран CaCl2 не приводила к изменениям в липидном составе клеток корней пшеницы, при этом индекс стабильности и степень упорядоченности мембран увеличивались. Насыщение мембран β-ситостерином также вызывало увеличение мембранной стабильности и упорядоченности липидного бислоя, что сопровождалось увеличением содержания стеринов и моногалактозилдиацилглицерида и снижением уровня фосфатидилхолина и гликоцерамидов. Действие нистатина на интактные проростки не влияло на стабильность и упорядоченность мембран, несмотря на снижение общего уровня стеринов в клетках корней пшеницы. Повреждение мембран клеток корней тритоном Х-100, проявлявшееся в значительном увеличении выхода электролитов и снижении упорядоченности бислоя, сопровождалось увеличением в липидном профиле доли терпеноидов.
ВВЕДЕНИЕ
Проблема стрессовой устойчивости сельскохозяйственных растений является предметом пристального внимания исследователей в течение многих лет. Актуальная задача – выявление эндогенных механизмов защиты растений, в том числе опосредованных изменением состояния клеточных мембран. При воздействии абиотических стрессовых факторов окружающей среды на растение клеточная мембрана выступает в роли своеобразной мишени, принимая удар на себя, что зачастую может привести к ее повреждению, нарушению деятельности растительной клетки и гибели организма в целом [1]. В естественных условиях растения постоянно подвергаются различным стрессовым воздействиям: колебания температуры (перегрев и охлаждение), засуха, засоление, окислительный стресс. При действии стрессовых факторов биологические мембраны претерпевают изменения биофизических параметров – текучести и проницаемости. Несмотря на возможные различия в механизмах действия, естественные абиотические стрессоры могут приводить к последствиям, схожим с действием мембранотропных агентов тритона и нистатина (увеличение проницаемости мембран) или кальция и ситостерина (увеличение микровязкости и уменьшение проницаемости). Так, в литературе имеется достаточно информации о стресс-индуцированных изменениях мембранных характеристик. В частности, показано увеличение проницаемости мембран клеток кукурузы в условиях засухи [2], при солевом стрессе в корнях гидропонной культуры Atriplex halimus subsp. Schweinfurthii [3, 4].
Колебания температуры приводят к изменению мембранной текучести [5, 6]. Тепловой стресс вызывает повреждение мембран, нарушение стабильности и увеличение проницаемости мембран для электролитов в пшенице [7]. В наших исследованиях было показано увеличение проницаемости для электролитов мембран клеток корней проростков пшеницы, подвергнутых действию низких положительных температур [8]. Адаптивные возможности растений в значительной степени зависят от того, насколько они способны сохранять текучесть мембран и предотвращать фазовый переход липидов при действии стрессоров [9, 10]. Нарушение целостности клеточной мембраны и последующая утечка внутриклеточного содержимого могут иметь драматические последствия для клетки и организма в целом. В связи с этим анализ стабильности клеточных мембран используется в качестве одного из маркеров устойчивости растений при различных абиотических стрессах [11]. Состояние мембран во многом определяется составом мембранных липидов – фосфолипидов, гликолипидов и стеринов [12]. Важным показателем физико-химического состояния биологических мембран является микровязкость мембран, которая определяется природой мембранных липидов [13]. Степень микровязкости мембран зависит от многих факторов, например содержания стеринов, состава жирных кислот, состояния и количества белков в мембране, рН, ионной силы и т.д. Все эти факторы влияют на характер упаковки бислоя и подвижность его компонентов. Физико-химическое состояние бислоя может влиять на эластичность мембран и их проницаемость, подвижность и активность мембранных белков и липидов [14]. Эти изменения определяют работу многочисленных мембраносвязанных ферментных комплексов, в том числе компонентов сигнальных систем, запускающих стрессовые реакции и адаптационные процессы. Выявление взаимосвязи биофизического состояния мембран и их липидного состава может способствовать пониманию фундаментальных механизмов стрессовой устойчивости растений. Целью настоящего исследования явилось изучение липидного профиля в корнях проростков пшеницы Triticum aestivum L. при направленном изменении состояния мембран агентами, стабилизирующими мембраны – CaCl2 и β-ситостерином, а также агентами, увеличивающими мембранную проницаемость, – каналоформером нистатином и детергентом тритоном Х-100.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы. В работе использовали следующие реактивы: CaCl2 (Fluka Chemie AG, Швейцария), сахароза (ТатХимПродукт, Россия), Sigma-Aldrich, США: тритон Х-100, нистатин, β-ситостерин, триолеин, олеиновая кислота, сквален, фосфатидилхолин, смесь гликоцерамидов, HEPES, EDTA, поливинилпирролидон, дитиотреитол, фенилметансульфонилфторид, лаурдан.
Объект исследования. В работе использовали яровую пшеницу (T. aestivum L.) сорта “Казанская юбилейная”. Семена пшеницы, предварительно замоченные в дистиллированной воде в течение суток, помещали на различные среды для проращивания: 0.25 мМ CaCl2 – контроль; 1 мМ CaCl2; 0.5 мМ β-ситостерин; 0.1 мМ нистатин; 16 мкМ тритон Х-100. Проростки пшеницы выращивали в течение 4 сут при температуре +22°C и освещенности 100 Вт/м2 с 12-часовым фотопериодом.
Проростки пшеницы выращивали на средах с добавлением исследуемых мембранотропных веществ в течение 4 сут. При исследовании влияния на клеточные мембраны детергента, октилфенолполиэтиленгликольного эфира, тритона Х-100, 4‑дневные проростки пшеницы, выращенные на дистиллированной воде, помещали в раствор детергента на 3 ч, после чего их отмывали и анализировали.
Определение выхода электролитов и индекса мембранной стабильности (ИМС). Навеску корней проростков пшеницы (0.1 г) несколько раз промывали в бидистиллированной воде, затем погружали в бюксы с бидистиллированной водой (10 мл) и выдерживали в термостате при температуре 40°C в течение 30 мин. Электропроводность раствора после инкубации (C1) измеряли с помощью кондуктометра Cond 7310 (WTW, Германия). Полный выход электролитов (C2) определяли по электропроводности той же вытяжки после разрушения растительной ткани кипячением в течение 10 мин [15]. Выход электролитов (C) рассчитывали в процентах от полного выхода по формуле:
Определение величины генерализационной поляризации возбуждения флуоресценции липофильного зонда лаурдана в микросомальных мембранах растительных клеток. Навеску корней (10 г) гомогенизировали в среде, содержащей 250 мМ сахарозы, 50 мМ HEPES (рН 7.5), 1 мМ EDTA (рН 8.0), 0.6% поливинилпирролидон, 5 мМ дитиотреитол, 1 мМ фенилметансульфонилфторида. Микросомальные мембраны осаждали центрифугированием гомогената в течение 30 мин при 100 000 g. Осадок ресуспендировали в среде, содержащей 250 мМ сахарозы, 50 мМ HEPES (рН 7.0), и использовали для исследования. Степень микровязкости мембран микросомальной фракции клеток корней пшеницы анализировали с помощью флуоресцентного липофильного зонда лаурдана. Флуоресценция лаурдана в разных частях спектра позволяет выявить изменения в упорядоченности фосфолипидов в мембране, которая зависит от физического состояния липидного бислоя [16]. К микросомальным мембранам добавляли 1 мМ раствор лаурдана и инкубировали при комнатной температуре в течение 15 мин в темноте. Измерение интенсивности флуоресценции лаурдана проводили на спектрофлуориметре Флюорат-02-Панорама (Россия). По изменению интенсивности излучения флуоресценции лаурдана проводили расчет значения ГП, по которому оценивали микровязкость мембран. Обобщенная поляризация возбуждения была получена из уравнения:
По данным литературы, значение ГП колеблется в пределах от –1 до +1. –1 означает неупорядоченную фазу, тогда как значение ГП + 1 означает полностью упорядоченную фазу. Экспериментально эти значения зависят от липидного состава мембран, температуры окружающей среды и прочих факторов [17].
Экстракция липидов из корней пшеницы и анализ их состава методом высокоэффективной тонкослойной хроматографии (ВЭТСХ). Экстракцию липидов из корней пшеницы осуществляли изопропанолом, затем смесью изопропанол/хлороформ (1:1) по методу Николса [18] с модификациями [19]. Выход липидов определяли гравиметрическим методом. Анализ состава липидов, экстрагированных из корней пшеницы, проводили с помощью высокоэффективной тонкослойной хроматографии (ВЭТСХ) с использованием оборудования фирмы CAMAG (Швейцария). Для хроматографии использовали классические ТСХ-пластины на стекле, силикагель 60, размером 10 × × 20 см (Merck KGaA, Германия), которые перед анализом элюировали этанолом и активировали нагреванием +120°C 20 мин. Нанесение растворов объектов исследования и стандартов на ТСХ-пластину выполняли на автоматическом аппликаторе Linomat 5 в виде треков шириной 8 мм. Разделение липидов проводили в автоматической камере для элюирования ADC 2, линия фронта подвижной фазы – 80 мм. Для анализа нейтральных липидов в качестве подвижной фазы использовали смесь петролейный эфир : этиловый эфир : уксусная кислота (80 : 20 : 1), полярных липидов – хлороформ : метанол : вода (65 : 25 : 4). Для дериватизации использовали реагент – 5%-раствор H2SO4 в этаноле. Пластину опрыскивали реагентом с помощью пульверизатора (Ленхром, Россия), высушивали, переносили в сушильный шкаф и нагревали 20 мин при температуре +150°C. Денситометрическое сканирование ТСХ-пластин после дериватизации проводили на приборе TLS Scanner 4 с использованием компьютерной программы winCATS 1.4.9. Параметры сканирования: режим – отражательная абсорбция, длина волны – 490 нм, щель – 8.00 × × 0.40 мм, скорость сканирования 20 мм/с, разрешение – 100 мкм/шаг, математический фильтр Savitsky–Golay 7. Количественное определение отдельных липидов в исследуемых экстрактах из корней проростков пшеницы осуществляли с помощью калибровочных уравнений зависимости площади пиков (y) от количества чистых липидов – стандартов (x) (табл. 1).
Таблица 1.
Калибровочные уравнения для количественного определения липидов
| Вещества-стандарты | Количество вещества, мкг | Полученное калибровочное уравнение (по площади пиков) | r; sdv |
|---|---|---|---|
| Фосфатидилхолин | 4; 6; 8 | у = 1629 + 864.6х | 0.97; 9.47 |
| Гликоцерамид 1 | 2.4; 3.6; 4.8 | у = 4703 + 2020х | 0.99; 1.44 |
| Гликоцерамид 2 | 1.6; 2.4; 3.2 | у = 2336 + 2365х | 0.99; 0.53 |
| β-Ситостерол | 2; 4; 6; 8; 10 | у = 4812.461 + 668.782х | 0.96; 6.88 |
| Циклоартенол | 0.2; 0.3; 0.4 | у = 1344 + 5.852х | 0.99; 2.57 |
| Сквален | 4; 6; 8 | у = 4081 + 651х | 0.99; 3.07 |
Статистическая обработка данных. Статистическая обработка экспериментальных данных проводилась путем расчета стандартного отклонения с использованием t-критерия Стьюдента с помощью программы Microsoft Excel и U-критерия Манна–Уитни с использованием автоматической программы для онлайн расчета U-критерия Манна–Уитни (https://statpsy.ru/mana-uitni/ onlajn-raschet-kriteriya-u-manna-uitni/). Результаты денситометрии обрабатывались автоматически с помощью специализированной программы winCATS, версия 1.4.9 с использованием фильтра Savitsky–Golay 7.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящей работе с помощью мембранотропных агентов были смоделированы различные состояния растительных мембран: стабилизация, уплотнение и нарушение проницаемости, которые могут наблюдаться в клетках растений в естественных стрессовых условиях. При действии мембранотропных агентов нами обнаружены изменения таких важных мембранных характеристик, как проницаемость мембран, микровязкость и индекс мембранной стабильности.
Исследование влияния мембранотропных соединений на проницаемость и микровязкость мембран клеток корней пшеницы
В формировании ответной реакции растений на внешние воздействия значительную роль играет клеточная поверхность, от состояния которой зависят как ранние реакции, так и более длительные, связанные с адаптацией процессы. Одним из элементов защитной реакции клеток на воздействие является снижение проницаемости мембран для ионов [20]. Особое значение в интеграции клеточных функций у растений принадлежит Ca2+, который является универсальным триггером многих клеточных процессов [21]. Известно, что экзогенный кальций выполняет роль стабилизатора интегральной фосфолипидной и белковой фазы мембран [22]. Ионы кальция, связываясь с мембранами, образуют мостики между отрицательно заряженными группами двух соседних молекул белков (а также липидов) мембран. На тенях эритроцитов показано, что 80% Ca2+ связывается с карбоксильными группами белков, а 15–20% – с фосфатными группами кислых фосфолипидов [23]. Кроме того, связанный отрицательно заряженной группой ион Ca2+ способен вызывать дегидратацию. Частичная дегидратация и снижение отрицательного заряда мембраны, по мнению Левина [24], являются факторами, стабилизирующими структуру мембран. В наших экспериментах выращивание проростков пшеницы на 1 мМ CaCl2 приводило к снижению выхода электролитов из корневых клеток, увеличению ИМС на 7% и возрастанию ГП на 4%, что свидетельствует об увеличении микровязкости мембран (табл. 2).
Таблица 2.
Выход электролитов, ИМС и ГП в корнях проростков пшеницы при действии мембранотропных веществ (n = 9)
| Вариант | Выход электролитов, % | ИМС, % | ГП |
|---|---|---|---|
| Контроль | 26.4 ± 0.3 | 73.6 | 0.16 ± 0.01 |
| СаСl2 (1 мМ) | 19.5 ± 5.1 | 80.5 | 0.19 ± 0.01 |
| β-Ситостерин (0.5 мМ) | 22.3 ± 1.3 | 77.7 | 0.21 ± 0.03 |
| Нистатин (0.1 мМ) | 24.8 ± 2.1 | 75.2 | 0.14 ± 0.05 |
| Тритон Х-100 (16 мкМ) | 54.5 ± 10.7 | 45.5 | 0.11 ± 0.01 |
Стабилизирующий эффект на мембраны клеток корней пшеницы также наблюдался при добавлении в среду выращивания проростков β-ситостерина (0.5 мМ), в частности, наблюдалось уменьшение выхода электролитов из клеток, увеличение ИМС на 4.7% и возрастание ГП на 5% (табл. 2). Известно, что β-ситостерин является одним из основных стеринов, содержащихся в плазматической мембране растительных клеток, который увеличивает упорядоченность мембран [25].
Другим агентом, модифицирующим мембраны, является полиеновый антибиотик, каналоформер нистатин. Действие нистатина достаточно подробно изучено на модельных мембранах [26]. Было показано, что нистатин нарушает структурную организацию мембран путем связывания со стеринами, входящими в их состав, и образования пор. В результате этого взаимодействия увеличивается ионная проницаемость мембран, происходит потеря клеткой воды, аминокислот и других компонентов [27, 28]. Ранее на модельной системе, отсеченных корнях проростков пшеницы, нами было показано, что уже с первых минут действия нистатина на корни происходит значительное увеличение проницаемости мембран для электролитов и деполяризация плазматической мембраны [28], наблюдается нарушение важнейших физиологических процессов и значительное снижение жизнеспособности клеток [29]. Возможно, что токсические действия нистатина на клетки усугублялись раневым стрессом, сопровождающим отсечение корней от проростков [30]. В настоящем исследовании действию нистатина подвергались интактные проростки пшеницы, которые выращивались на растворе антибиотика в течение 4 сут. В отличие от предыдущих экспериментов, нистатин не оказывал дестабилизирующего действия на мембраны клеток корней пшеницы: выход электролитов, индекс мембранной стабильности и микровязкость были близки к контрольным значениям (табл. 1). Можно предположить, что для интактных корней использование нистатина в данной концентрации не было токсичным и не вызвало изменений в проницаемости клеточных мембран и ИМС.
В нашей работе было изучено действие на корни пшеницы еще одного мембранотропного агента, резко меняющего физико-химические параметры мембран, тритона Х-100. Тритон Х-100 – это неионный детергент, механизм действия которого основан на извлечении мембранных фосфолипидов и разрушении их комплексов с белками [31]. Показано, что обработка проростков пшеницы тритоном Х-100 приводила к двукратному увеличению выхода электролитов, снижению ИМС на 28% и заметному снижению микровязкости мембран (табл. 2).
Таким образом, изучение мембранных характеристик клеток корней пшеницы при действии мембранотропных веществ подтвердило специфичность их действия на мембраны клеток.
Анализ липидного состава корней пшеницы при действии мембранотропных веществ
На рис. 1 и рис. 2 приведены пластины ТСХ анализа нейтральных и полярных липидов в исследуемых экстрактах корней пшеницы. Результаты их денситометрии приведены в табл. 3.
Рис. 1.
Хроматограмма нейтральных липидов в экстрактах корней пшеницы, содержащих липофильные соединения, в видимом свете после дериватизации пластин 5% раствором H2SO4 в этаноле: Rc1,2,3 – контроль; Rca1,2,3 – CaCl2; Rn1,2,3 – нистатин; Rs1,2,3 – β-ситостерин; Rt1,2,3 – тритон Х-100; St1,2,3 – стандарт (β-ситостерин).
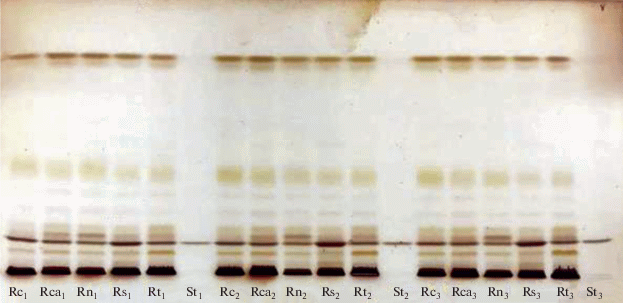
Рис. 2.
Хроматограмма полярных липидов в экстрактах корней пшеницы, содержащих липофильные соединения, в видимом свете, после дериватизации пластин 5% раствором H2SO4 в этаноле: Rc1,2,3 – контроль; Rca1,2,3 – CaCl2; Rn1,2,3 – нистатин; Rs1,2,3 – β-ситостерин; Rt1,2 – тритон Х-100; St1,2,3 – стандарт (фосфатидилхолин); Gl –стандарт (гликоцерамиды).
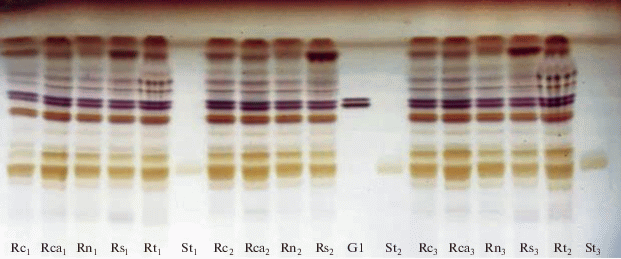
Таблица 3.
Состав и содержание липидов в экстрактах из корней проростков пшеницы, обработанных мембранотропными веществами (n = 3)
| Rf | Содержание, %* | Отнесение | ||||
|---|---|---|---|---|---|---|
| контроль | СaCl2 (1 мМ) |
β-Ситостерин (0.5 мМ) | Нистатин (0.1 мМ) | Тритон Х-100 (16 мкМ) | ||
| Нейтральные липиды | ||||||
| 0.04 | 42.2 ± 2.5 | 41.8 ± 1.1 | 40.9 ± 2.1 | 39.8 ± 2.4 | 39.2 ± 2.3 | Не идентифицировано |
| 0.14 | 3.7 ± 0.5 | 3.9 ± 0.2 | 4.7 ± 0.6 | 3.5 ± 0.6 | 7.5 ± 0.5 | 1,2-Диглицериды*** |
| 0.18 | 14.0 ± 1.0 | 12.5 ± 0.4 | 21.4 ± 1.9 | 11.5 ± 0.3 | 12.7 ± 0.4 | Стерины** |
| 0.21 | 2.4 ± 0.4 | 4.3 ± 0.2 | 3.1 ± 0.9 | 7.4 ± 1.1 | 4.2 ± 0.6 | Высшие спирты*** |
| 0.25 | 3.3 ± 0.9 | 3.7 ± 0.6 | 3.0 ± 0.2 | 3.4 ± 0.8 | 5.0 ± 0.3 | Терпеноиды** |
| 0.33 | 0.9 ± 0.1 | 1.2 ± 0.2 | 1.2 ± 0.1 | 1.2 ± 0.1 | 1.0 ± 0.2 | Жирные кислоты** |
| 0.41 | 0.8 ± 0.1 | 1.0 ± 0.1 | 0.6 ± 0.1 | 0.8 ± 0.1 | 0.9 ± 0.1 | Не идентифицировано |
| 0.51 | 10.3 ± 0.5 | 7.5 ± 0.4 | 6.3 ± 0.5 | 9.7 ± 1.4 | 8.7 ± 0.4 | Триглицериды** |
| 0.65 | 0.9 ± 0.1 | 0.9 ± 0.1 | 0.8 ± 0.2 | 0.7 ± 0.1 | 0.6 ± 0.1 | Не идентифицировано |
| 0.92 | 3.3 ± 1.2 | 3.2 ± 0.4 | 2.5 ± 0.4 | 2.4 ± 0.5 | 3.5 ± 1.0 | Не идентифицировано |
| 0.98 | 4.7 ± 0.7 | 6.0 ± 0.4 | 3.9 ± 0.7 | 5.2 ± 0.7 | 4.7 ± 0.6 | Эфиры стеринов*** |
| 1.00 | 13.6 ± 1.9 | 14.0 ± 0.7 | 11.6 ± 1.1 | 14.3 ± 1.1 | 12.1 ± 1.1 | Углеводороды, сквален** |
| Полярные липиды | ||||||
| 0.15 | 1.1 ± 0.1 | 0.9 ± 0.2 | 1.4 ± 1.0 | 1.0 ± 0.7 | 1.5 ± 0.4 | Фосфатидилсерин*** |
| 0.17 | 0.6 ± 0.5 | 1.8 ± 0.5 | 1.1 ± 0.5 | 1.2 ± 0.8 | 1.5 ± 0.8 | Фосфатидилинозитол*** |
| 0.31 | 3.2 ± 0.2 | 3.4 ± 0.4 | 2.7 ± 0.5 | 3.2 ± 0.4 | 4.0 ± 0.9 | Не идентифицировано |
| 0.38 | 19.3 ± 1.5 | 18.1 ± 2.5 | 15.1 ± 1.7 | 18.6 ± 1.3 | 15.9 ± 1.1 | Фосфатидилхолин** |
| 0.45 | 7.6 ± 1.0 | 10.6 ± 0.3 | 7.1 ± 0.3 | 8.4 ± 1.0 | 9.4 ± 1.5 | Фосфатидилглицерин*** |
| 0.49 | 2.7 ± 0.2 | 2.6 ± 0.2 | 2.2 ± 0.4 | 2.6 ± 0.1 | 2.0 ± 0.5 | Дифосфатидилглицерин*** |
| 0.57 | 1.9 ± 0.4 | 2.0 ± 0.1 | 1.4 ± 0.1 | 1.8 ± 0.2 | 2.0 ± 0.7 | Дигалактозилдиацилглицерид*** |
| 0.66 | 13.4 ± 1.0 | 12.7 ± 0.1 | 11.7 ± 0.4 | 13.6 ± 0.3 | 13.2 ± 0.1 | Фосфатидилэтаноламин*** |
| 0.72 | 6.0 ± 0.5 | 6.2 ± 0.5 | 5.7 ± 0.2 | 6.5 ± 0.4 | 6.4 ± 0.1 | Гликоцерамид 1** |
| 0.74 | 6.6 ± 1.0 | 6.4 ± 0.9 | 4.7 ± 0.2 | 5.5 ± 0.7 | 5.4 ± 0.3 | Гликоцерамид 2** |
| 0.80 | 3.4 ± 0.5 | 3.2 ± 0.5 | 4.0 ± 0.4 | 3.2 ± 0.7 | 5.2 ± 0.5 | Не идентифицировано |
| 0.83 | 4.8 ± 0.8 | 4.7 ± 1.0 | 6.2 ± 1.0 | 4.1 ± 0.6 | 6.2 ± 0.3 | Не идентифицировано |
| 0.87 | 3.2 ± 0.6 | 3.8 ± 0.8 | 3.6 ± 0.8 | 3.5 ± 0.7 | 2.6 ± 0.1 | Не идентифицировано |
| 0.93 | 12.0 ± 1.1 | 9.8 ± 0.9 | 19.9 ± 2.8 | 11.8 ± 1.2 | 9.9 ± 1.1 | Моногалактозилдиацилглицерид*** |
| 0.99 | 14.9 ± 2.2 | 13.6 ± 0.7 | 13.1 ± 1.2 | 14.3 ± 1.5 | 14.9 ± 2.9 | Не идентифицировано |
* Рассчитано по площади пиков на денситограмме. ** Отнесение путем сопоставления Rf пятна с Rf вещества-стандарта. *** Отнесение в сопоставлении с литературными данными [32].
В ходе проведенного ВЭТСХ анализа было показано, что экстракты из корней пшеницы в контрольном и опытных вариантах имеют одинаковый качественный состав липидов, но отличаются по их количественному содержанию. Нейтральные липиды корней пшеницы представлены как омыляемыми (ацилглицериды, эфиры стеринов), так и неомыляемыми липидами (стерины, терпеноиды, ЖК и др.). Во всех исследуемых экстрактах стерины и углеводороды, в том числе сквален, занимают наибольшую долю в сумме липидных веществ (табл. 3). Содержание ацилглицеридов (триацилглицеридов (ТАГ) и диацилглицеридов (ДАГ)), являющихся основными запасными липидами, составляет в сумме около 10–16%, тогда как на долю ЖК приходится не более 1%.
Качественный анализ фосфолипидного состава показал, что среди спектра разнообразных фосфолипидов, обнаруженных во всех исследуемых экстрактах, наибольшее количество (около 19 и 13% соответственно) приходится на фосфатидилхолин (ФХ) и фосфатидилэтаноламин (ФЭ). (табл. 3). Эти соединения являются главными липидными компонентами мембран в клетках высших растений и метаболически связаны друг с другом [33]. Предшественником их синтеза является фосфатидилсерин, содержание которого в исследуемых экстрактах почти в 13–16 раз ниже по сравнению с ФХ и ФЭ. Исследование липидного профиля корней Arabidopsis при недостатке Ca2+ показало повышение уровня ФХ, лизо-ФХ, ФЭ, лизо-ФЭ, фосфатидилинозитола (ФИ) и ТАГ, биосинтеза фосфатидной кислоты и биосинтеза ДАГ [34]. Повышение содержания ТАГ и молярного соотношения ФХ/ФЭ в этих корнях может быть направлено на поддержание стабильности мембраны и баланса между мембранными и запасными липидами. Это исследование демонстрирует важную роль Ca2+ в поддержании стабильности плазматической мембраны [34]. В наших экспериментах выращивание проростков пшеницы на 1 мМ CaCl2 не вызвало изменений в содержании основных фосфолипидов – ФХ и ФЭ (табл. 3), стабильность и упорядоченность мембран при этом возрастали (табл. 2). Ранее было показано, что увеличение уровня экзогенного Ca2+ приводило к увеличению содержания стеринов, ФЛ, СЖК в отсеченных корнях пшеницы, что, по мнению авторов, приводило к стабилизации мембран, характерной для клеток корня при переходе в состояние “относительного покоя” [21]. В наших экспериментах в присутствии CaCl2 наблюдалось увеличение содержания ФГ и ФИ. Учитывая то, что ФИ является основным компонентом митохондриальных мембран [35], можно предположить, что возрастание количества этого фосфолипида необходимо для поддержания Ca2+-депонирующей функции митохондрий.
В составе гликолипидов, идентифицированных в исследуемых экстрактах, показано наличие гликоцерамидов двух типов: моногалактозилдиацилглицерида (МГДГ) и дигалактозилдиацилгрицерида (ДГДГ) (табл. 3). Известно, что эти соединения являются важными мембранными липидными компонентами в растениях. Несмотря на то, что гликолипиды не считаются основными компонентами непластидных мембран, изменения в их содержании часто наблюдаются в условиях стресса, что свидетельствует об их важной роли в приобретении стрессовой устойчивости растений [36]. Было показано, что действие β-ситостерина на корни пшеницы приводило к существенным изменениям в содержании МГДГ и ДГДГ в липидном профиле. По сравнению с контролем содержание МГДГ увеличивается в 1.6 раза, а ДГДГ – наоборот снижается в 1.3 раза (табл. 3). В литературе имеются данные о том, что в условиях дефицита фосфора может наблюдаться увеличение содержания галактолипидов как в фотосинтезирующих, так и в нефотосинтезирующих тканях [36]. По мнению Киселевой с соавтором, недостаток фосфора может стимулировать синтез ФХ по так называемому альтернативному механизму, путем последовательного трехступенчатого метилирования ФЭ [37]. При этом на фоне редукции предшественников, в том числе ФК и ФЭ, происходит аккумуляция ФХ, которые в дальнейшем, при участии фосфолипазы С подвергаются гидролизу до диацилглицеридов. Образующиеся диацилглицериды расходуются на синтез гликолипидов, главным образом ДГДГ и/или МГДГ [37]. В настоящее время точно установлено, что дефицит фосфата вызывает замену мембранных фосфолипидов нефосфатсодержащими галактолипидами МГДГ и ДГДГ [38]. Замена фосфолипида на ДГДГ происходит в листьях и корнях Arabidopsis [39], побегах и корнях овса [40], культуры кленовых клеток сикамора [41], соевых бобах [42]. В нашем случае, вероятно, происходит вытеснение молекул ФХ β-ситостерином, которое вызывает увеличение содержания МГДГ.
В табл. 4 обобщены данные определения суммарного количества липидных веществ, извлекаемых из контрольного и опытных вариантов корней пшеницы, и количественного анализа отдельных липидов в полученных экстрактах.
Таблица 4.
Количество липидов в корнях пшеницы при действии мембранотропных веществ (n = 3)
| Количество, мкг/г сырого веса корней |
Вариант | ||||
|---|---|---|---|---|---|
| контроль | СаСl2 (1 мМ) |
β-Ситостерин (0.5 мМ) | Нистатин (0.1 мМ) |
Тритон Х-100 (16 мкМ) | |
| Сумма липидов | 1350 ± 212 | 1600 ± 141 | 1600 ± 141 | 1550 ± 71 | 4400 ± 282 |
| Стерины | 36.8 ± 3.3 | 32.2 ± 2.8 | 125.4 ± 5.6 | 11.1 ± 0.7 | 35.6 ± 1.5 |
| Терпеноиды | 1.6 ± 0.4 | 1.3 ± 0.7 | 0.7 ± 0.2 | 1.5 ± 0.5 | 2.5 ± 0.5 |
| Фосфатидилхолин | 180.4 ± 15.5 | 191.4 ± 1.2 | 131.6 ± 8.5 | 156.4 ± 11.3 | 162.8 ± 12.8 |
| Гликоцерамид 1 | 7.2 ± 0.7 | 8.1 ± 1.0 | 4.7 ± 2.0 | 9.8 ± 0.8 | 9.9 ± 2.5 |
| Гликоцерамид 2 | 19.7 ± 0.3 | 21.1 ± 0.1 | 8.5 ± 0.4 | 11.1 ± 0.5 | 14.4 ± 2.3 |
| Углеводороды, в том числе сквален | 61.2 ± 8.5 | 51.5 ± 1.7 | 37.5 ± 6.8 | 44 ± 8.0 | 42.6 ± 5.4 |
Установлено, что количество липидных веществ в корнях пшеницы при действии CaCl2, β-ситостерина и нистатина практически не изменяется. Наибольшее количество липидов было получено при экстракции корней пшеницы, обработанных тритоном Х-100 (табл. 4). Это почти в 3 раза выше, чем в контроле и других опытных образцах. Наблюдаемый эффект резкого увеличения количества липидов, полученных из корней пшеницы на фоне тритона Х-100, может быть обусловлен повышением доступности липидов к извлечению за счет их высвобождения из мембранных клеточных структур в присутствии детергента.
Анализ действия других мембранотропных веществ выявил существенные изменения липидного профиля в корнях пшеницы (табл. 4). Так, показано, что при выращивании проростков на среде с β-ситостерином в 3.4 раза увеличивается содержание стеринов в корнях по сравнению с контролем (табл. 4). Это указывает на то, что растительные клетки способны использовать экзогенный β-ситостерин, что приводит к увеличению стабильности мембран (табл. 2). Из данных литературы известны структурные особенности стеринов, необходимые для их встраивания в мембраны и выполнения ими структурной функции: это наличие свободной β-гидроксильной группы при С-3, плоский тетрациклический скелет и алифатическая боковая цепь с 8–10 атомами углерода [43]. Основные растительные стерины обладают этими характеристиками. Эксперименты на модельных мембранах из ФХ и стеринов сои показали, что все растительные стерины могут регулировать жидкостность и проницаемость фосфолипидных бислоев, но с разной эффективностью [44–46]. Функциональный анализ физических свойств моделей растительных мембран показал, что среди различных стеринов β-ситостерин является основным стерином, увеличивающим упорядоченность жидкой фазы растительных мембран [46, 47].
Стерины и другие изопреноидные производные могут влиять на свойства мембран посредством изменения состояния мембран в результате взаимодействия с другими липидами бислоя [46]. В мембранах стерины взаимодействуют с гликоцерамидами и фосфолипидами. Важной особенностью гликоцерамидов является их высокое сродство к стеринам, обусловленное Ван-дер-Ваальсовыми взаимодействиями боковых цепей стеринов с насыщенными алкильными цепями сфинголипидов. Это способствует более плотной упаковке и облегчает образование липидных микродоменов (“рафтов”). В литературе эти два класса липидов часто называют рафтообразующими липидами [48]. Эти микродомены могут играть важную роль в передаче сигнала в клетку и служить платформами для ферментных сигнальных комплексов.
Ранее в наших исследованиях была обнаружена интересная закономерность: изменение уровня стеринов при действии низких положительных температур [8] и стерин-связывающих агентов [29, 49] сопровождается обратнонаправленным изменением уровня гликоцерамидов. В настоящей работе также наблюдались подобные взаимосвязанные изменения: увеличение уровня стеринов под действием β-ситостерина сопровождались снижением содержания гликоцерамидов (ГлЦер) (табл. 4), что свидетельствует о наличии функциональной взаимосвязи между этими двумя классами липидов. Кроме того, исследования на клетках дрожжей и животных показали, что пути биосинтеза стеринов и сфинголипидов взаимосвязаны [50], это также может иметь место и у растений. Например, нарушение пути биосинтеза стеринов у проростков лука-порея нарушает синтез сложных сфинголипидов, таких как глюкозилцерамиды [29, 51]. Можно полагать, что существует взаимосвязь между метаболизмом стеринов и сфинголипидов, что может иметь значение для поддержания соотношений и функционального взаимодействия этих классов липидов [29, 52].
Выращивание проростков на среде со стеринсвязывающим агентом нистатином ожидаемо приводило к резкому (в 3.3 раза) снижению количества детектируемых стеринов (табл. 4). Наряду с этим при действии нистатина наблюдалось снижение уровня ФХ.
Влияние на мембраны неионного детергента тритона Х-100, как известно, обусловлено взаимодействием его липофильных цепей с гидрофобными поверхностями молекул белков и вытеснением их из мембран. Тритон Х-100 действует на мембраны достаточно агрессивно, солюбилизируя до 80% белков и 90% фосфолипидов [53]. В работе Гордона с соавторами [28] показано, что добавление тритона Х-100 в среду инкубации отсеченных корней вызывает резкое усиление проницаемости плазмалеммы для ионов и значительную стимуляцию потребления кислорода корнями пшеницы. Исследования, проведенные на пшенице и сахарной свекле, показали эффективность тритона Х-100 как эпимутагена [54]. Воздействие тритона Х-100 на растения сахарной свеклы приводило к изменению морфологии корня и листьев, признака “стерильность–фертильность” пыльцы, динамики прорастания семян [55]. Таким образом, можно заключить, что тритон Х-100 оказывает мощное стрессовое воздействие на мембраны клеток. В настоящей работе мы наблюдали его значительное повреждающее действие на клеточные мембраны корней пшеницы, которое выражалось в двукратном увеличении выхода электролитов, снижении ИМС на 28% и заметном снижении микровязкости мембран (табл. 2). Эти изменения мембранных характеристик сопровождались увеличением количества терпеноидов в 1.6 раза относительно контроля, незначительным снижением количества ГлЦер 2, снижением содержания ФХ, уровень стеринов оставался неизменным (табл. 4). Кроме того, при действии тритона Х-100 наблюдалось многократное увеличение общей массы выделенных липидных веществ. Можно полагать, что увеличение количества терпеноидов может быть результатом большей доступности липидных компонентов для детергента.
ЗАКЛЮЧЕНИЕ
В настоящей работе корни проростков пшеницы подвергались действию мембранотропных агентов (СаСl2, β-ситостерин, нистатин, тритон Х-100) с целью моделирования стресс-индуцированных состояний мембран растительных клеток. Обработка корней СаСl2 и β-ситостерином приводила к увеличению мембранной стабильности и упорядоченности липидного бислоя. Парадоксальным представляется факт, что, несмотря на значительное снижение количества детектируемых стеринов при действии каналоформера нистатина на интактные корни, уменьшения стабильности и упорядоченности мембран не наблюдалось. Значительное повреждение клеточных мембран детергентом тритоном Х-100 сопровождалось увеличением в липидном профиле корней доли терпеноидов, возможно, обусловленным большей доступностью липидных компонентов к извлечению. Наиболее выраженным среди всех обнаруженных эффектов оказалось действие экзогенного β-ситостерина. Увеличение стабильности и упорядоченности мембран в присутствии этого стерина сопровождалось увеличением общего содержания стеринов и МГДГ, а также снижением количества ФХ и ГлЦер. На наш взгляд, эти изменения в липидном профиле могут быть взаимосвязаны. Так, встраивание β-ситостерина может приводить к вытеснению из мембран молекул ФХ, уменьшение доли которых, в свою очередь, вызывает увеличение содержания галактолипидов, в частности МГДГ. Обратнонаправленные изменения в содержании стеринов и ГлЦер, показанные в присутствии экзогенного β-ситостерина, наблюдались нами ранее и при других воздействиях. Это может свидетельствовать о наличии функциональной взаимосвязи между этими двумя классами липидов.
Таким образом, воздействие на клетки проростков пшеницы мембранотропных агентов индуцирует изменения не только физико-химического состояния мембран, но и их липидного состава. Комплекс этих изменений может быть одним из механизмов, которые запускаются в клетках растений в стрессовых условиях.
Работа выполнена в рамках государственного задания ФИЦ КазНЦ РАН, а также при финансовой поддержке гранта РФФИ № 20-04-00988 (для Ю.Н. Валитовой) и гранта Президента РФ МК-264.2020.4 (для А.Г. Ренковой).
Список литературы
Shi H., Jiang C., Ye T., Tan D.X., Reiter R.J., Zhang H., Liu R., Chen Z. 2015. Comparative physiological, metabolomic, and transcriptomic analyses reveal mechanisms of improved abiotic stress resistance in bermudagrass [Cynodon dactylon (L). Pers.] by exogenous melatonin. J. Exp. Bot. 66, 681–694.
Li-Ping B., Fang-Gong S., Ti-Da G., Zhao-Hui S., Yin-Yan L., Guang-Sheng Z. 2006. Effect of soil drought stress on leaf water status, membrane permeability and enzymatic antioxidant system of maize1. Pedosphere. 16, 326–332.
Nedjimi B., Daoud Y. 2009. Ameliorative effect of CaCl2 on growth, membrane permeability and nutrient uptake in Atriplex halimus subsp. schweinfurthii grown at high (NaCl) salinity. Desalination. 249, 163–166.
Guo Q., Liu L., Barkla B.J. 2019. Membrane lipid remodeling in response to salinity. Int. J. Mol. Sci. 20, 4264.
Singer S. D., Zou J., Weselake R.J. 2016. Abiotic factors influence plant storage lipid accumulation and composition. Plant. Sci. 243, 1–9.
Niu Y., Xiang Y. 2018. An overview of biomembrane functions in plant responses to high-temperature stress. Front. Plant. Sci. 9, 915.
Hasanuzzaman M., Nahar K., Alam M.M., Roychowdhury R., Fujita M.H. 2013. Physiological, biochemical, and molecular mechanisms of heat stress tolerance in plants. Int. J. Mol. Sci. 14, 9643–9684.
Valitova J., Renkova A., Mukhitova F., Dmitrieva S., Minibayeva F. 2019. Membrane sterols and genes of sterol biosynthesis are involved in the response of Triticum aestivum seedlings to cold stress. Plant. Physiol. Biochem. 142, 452–459.
Лось Д.А. 2005. Молекулярные механизмы холодоустойчивости растений Вестн. РАН. 75, 338–345.
Narayanan S., Tamura P.J., Roth M.R., Prasad P.V., Welti R. 2016. Wheat leaf lipids during heat stress: I. High day and night temperatures result in major lipid alterations. Plant. Cell. Environ. 39, 787–803.
Senthil-Kumar M., Ali K., Dahuja A., Tyagi A. 2015. Role of phytosterols in drought stress tolerance in rice. Plant. Physiol. Biochem. 96, 83–89.
Mazur P. 1969. Freezing injury in plants. Ann. Rev. Plant. Physiol. 20, 419–448.
Gerbeau-Pissot P., Der C., Dominique T., Anca I., Grosjean K., Roche Y., Perrier-Cornet J., Mongrand S., Plas F. 2014. Modification of plasma membrane organization in tobacco cells elicited by cryptogein. Plant. Physiol. 164, 273–286.
Болдырев А.А. 1985. Биологические мембраны и транспорт ионов. М.: Изд-во МГУ. 208 с.
Sairam R.K., Saxena D.C. 2000. Oxidative stress and antioxidants in wheat genotypes: Possible mechanism of water stress tolerance. J. Agron. Crop. Sci. 184, 55–61.
Bagatolli L., Gratton E., Fidelio G. 1998. Water dynamics in glycosphingolipid aggregates studied by LAURDAN fluorescence. Biophys. J. 75, 331–341.
Sanchez S.A., Tricerri M.A., Gunther G., Gratton E. 2007. Laurdan generalized polarization: From cuvette to microscope. Formatex. 1007–1014.
Nichols B.W. 1963. Separation of the lipids of photosynthetic tissues: Improvements in analysis by thin-layer chromatography. Biochem. Biophys. Acta. 70, 417–422.
Котлова Е.Р., Сеник C.B., Кюхер Т., Шаварда А.Л., Кияшко A.A., Псурцева Н.В., Зубарев P.A. 2009. Изменения в составе мембранных глицеро- и сфинголипидов в ходе развития поверхностной культуры Flammulina velutipes II. Микробиология. 78, 226–235.
Александров В.Я., Кислюк И.М. 1994. Реакция клетки на тепловой шок: физиологический аспект. Цитология. 36, 5–59.
Алексеева В.Я., Лыгин А.В., Гордон Л.Х., Николаев Б.А. 1999. Изменение липидного состава корней пшеницы при модификации кальцием клеточной поверхности. Физиология и биохимия культурных растений. 31, 440–446.
Hepler P.K., Wayne R.O. Calcium and plant development. 1985. Annu. Rev. Plant. Physiol. 36, 397–439.
Forstner J., Manery J. 1970. Calcium binding sites in human erythrocyte ghosts. Fed. Proc. 29, 664.
Левин С.В. 1976. Структурные изменения клеточных мембран. Л.: Наука ЛО. 224 с.
Marsan M., Muller I., Milon A. 1996. Ability of clionasterol and poriferasterol (24-epimers of sitosterol and stigmasterol) to regulate membrane lipid dynamics. Chem. Phys. Lipids. 84, 117–121.
Ермишкин Л.Н., Зильберштейн А.Я. 1982. Ионные каналы, образуемые антибиотиками. Структура и свойства. Итоги науки и техники. Биофизика мембран. М., 2, 82–160.
Coutinho A., Silva L., Fedorov A., Prieto M. 2004. Cholesterol and ergosterol influence nystatin surface aggregation: relation to pore formation. Biophys. J. 87, 3264–3276.
Гордон Л.X., Валитова Ю.Н., Огородникова Т.И., Рахматуллина Д.Ф., Алябьев А.Ю., Лосева Н.Л., Ценцевицкий А.Н., Рубан Н.Ф. 2005. Энергетический обмен клеток корней пшеницы при модификации ионной проницаемости плазмалеммы каналоформером нистатином. Цитология. 7, 1088–1094.
Valitova J., Sulkarnayeva A., Kotlova E., Ponomareva A., Mukhitova F., Murtazina L., Ryzhkina I., Beckett R., Minibayeva F. 2014. Sterol binding by methyl-b-cyclodextrin and nystatin - comparative analysis of biochemical and physiological consequences for plants. FEBS J. 281, 2051–206.
Renkova A., Valitova J., Schaller H., Minibayeva F. 2019. The homoeologous genes encoding C24-sterol methyltransferase 1 in Triticum aestivum: Structural characteristics and effects of cold stress. Biol. Plantarum. 63, 59–69.
Xu H., Zhou S., Jiang D., Chen H.Y. 2018. Cholesterol oxidase/triton x-100 parked microelectrodes for the detection of cholesterol in plasma membrane at single cells. Anal. Chem. 90, 1054–1058.
Кейтс М. 1975. Техника липидологии. Выделение, анализ и идентификация липидов. М.: Мир. 322 с.
Ленинджер А. 1974. Биохимия. М.: Мир. 957 с.
Zhang T., Yang J., Sun Y., Kang Y., Yang J., Qi Z.J. 2018. Calcium deprivation enhances non-selective fluid-phase endocytosis and modifies membrane lipid profiles in Arabidopsis roots. Plant Physiol. 226, 22–30.
Horvath S. E., Daum G. 2013. Lipids of mitochondria. Prog. Lipid. Res. 52, 590-614.
Zhang M., Deng X., Yin L., Qi L., Wang X., Wang S., Li H. 2016. Regulation of galactolipid biosynthesis by over expression of the rice mgd gene contributes to enhanced aluminum tolerance in tobacco. Front. Plant. Sci. 7, 337.
Киселева М.А., Котлова Е.Р. Влияние длительного фосфорного голодания на мембранные липиды свободноживущей и симбиотических зеленых водорослей рода Pseudococcomyxa II. 2008. Бот. журн. 93, 88–96.
Tjellström H., Andersson M.X., Larsson K.E., Sandelius A.S. 2008. Membrane phospholipids as a phosphate reserve: The dynamic nature of phospholipid-to-digalactosyl diacylglycerol exchange in higher plants. Plant. Cell. Environ. 31, 1388–1398.
Härtel H., Dormann P., Benning C. 2000. DGD1-independent biosynthesis of extraplastidic galactolipids after phosphate deprivation in Arabidopsis. Proc. Natl. Acad. Sci. USA. 97, 10649–10654.
Andersson M.X., Larsson K.E., Tjellström H., Liljenberg C., Sandelius A.S. 2005. Phosphate-limited oat. The plasma membrane and the tonoplast as major targets for phospholipid-to-glycolipid replacement and stimulation of phospholipases in the plasma membrane. J. Biol. Chem. 280, 27578–27586.
Jouhet J., Maréchal E., Baldan B., Bligny R., Joyard J., Maryse A., Block J. 2004. Phosphate deprivation induces transfer of DGDG galactolipid from chloroplast to mitochondria. Cell. Biol. 167, 863–874.
Gaude N., Tippmann H., Flemetakis E., Katinakis P., Udvardi M., Dörmann P. 2004. The galactolipid digalactosyldiacylglycerol accumulates in the peribacteroid membrane of nitrogen-fixing nodules of soybean and Lotus. J. Biol. Chem. 279, 34624–34630.
Bloch, K.E. 1983. Sterol structure and membrane function. Crit. Rev. Biochem. 14, 47–82.
Shuler I., Durtail G., Glasser N., Benveniste P., Hartmann M.A. 1990. Soybean phosphatidylcholine vesicles containing plant sterols: a fluorescence anisotropy study. Biochim. Biophys. Acta Biomembr. 1028, 82–88.
Schaller H. 2003. The role of sterols in plant growth and development. Prog. Lipid. Res. 42, 163–175.
Валитова Ю.Н., Сулкарнаева А.Г., Минибаева Ф.В. 2016. Растительные стерины: многообразие, биосинтез, физиологические функции. Биохимия. 81, 1050–1068.
Schuler I., Milon A., Nakatani Y., Ourisson G., Albrecht A.M., Benveniste P., Hartman M.A. 1991. Differential effects of plant sterols on water permeability and on acyl chain ordering of soybean phosphatidylcholine bilayers. Proc. Natl. Acad. Sci. USA. 88, 6926–6930.
Furt F., Simon-Plas F., Mongrand S. Murphy A.S., Schulz B., Peer W. 2011. Lipids of the plant plasma membrane. Plant. Cell. Monographs. Heidelberg: Springer. 19, 3–30.
Valitova J.N., Minibayeva F.V., Kotlova E.R., Novikov A.V., Shavarda A.L., Murtazina L.I., Ryzhkina I.S. 2011. Effects of sterol-binding agent nystatin on wheat roots: The changes in membrane permeability, sterols and glycoceramides. Phytochemistry. 72, 1751–1759.
Swain E., Baudry K., Stukey J., McDonough V., Germann M., Nickels J.T. 2002. Sterol-dependent regulation of sphingolipid metabolism in Saccharomyces cerevisiae. J. Biol. Chem. 277, 26177–26184.
Hartmann M.A., Perret A.M., Carde J.P., Cassagne C., Moreau P. 2002. Inhibition of the sterol pathway in leek seedlings impairs phosphatidylserine and glucosylceramide synthesis but triggers an accumulation of triacylglycerols. Biochim. Biophys. Acta. 1583, 285–296.
Nieto B., Fores O., Arry M., Ferrer A. 2009. Arabidopsis 3-hydroxy-3-methylglutaryl-CoA reductase is regulated at the post-translational level in response to alterations of the sphingolipid and the sterol biosynthetic pathways. Phytochemistry. 70, 53–59.
Скоупс Р. 1985. Методы очистки белков. М.: Мир. 358 с.
Махмудова К.Х., Богданова Е.Д., Левитес Е.В. 2009. Индукция тритоном Х-100 наследуемых изменений морфологических признаков у Triticum aestivum L. Генетика. 45, 564–568.
Кирикович С.С., Левитес Е.В. 2010. Морфологические и физиологические изменения у Beta vulgaris L. под действием Тритона Х-100. Экологическое равновесие и устойчивое развитие территории: Сб. науч. тр. СПб: ЛГУ им. А.С. Пушкина. 268–272.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


