Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 6, стр. 453-465
Половые различия возрастных изменений экспрессии рианодиновых RyR2 и инозитол-1,4,5-трисфосфатных IP3R1,2,3 рецепторов и их модуляторов СаМ и Epac в аорте и миокарде крыс
Л. М. Кожевникова a, *, И. Ф. Суханова a, Н. П. Семенова a, С. А. Крыжановский b
a Научно-исследовательский институт общей патологии и патофизиологии
125315 Москва, Россия
b Научно-исследовательский институт фармакологии им. В.В. Закусова
125315 Москва, Россия
* E-mail: lubovmih@yandex.ru
Поступила в редакцию 22.04.2020
После доработки 22.05.2020
Принята к публикации 23.05.2020
Аннотация
Целью исследования была оценка возрастных изменений транскрипционной активности генов, участвующих в регуляции Ca2+-сигнализации – IP3R, RyR и модуляторов их активности СаМ и Epac, в сосудах и миокарде крыс обоего пола. Экспрессию оценивали по содержанию мРНК исследуемого белка относительно содержания мРНК β-актина. Показано, что у крыс обоего пола при старении в аорте развиваются однонаправленные изменения экспрессии генов, кодирующих IP3Rs и RyR2, и различные, в зависимости от пола животных, изменения экспрессии генов белков, модулирующих их активность – СаМ и Epac. В сосудах старых крыс (24 мес.) обоего пола снижен относительный уровень мРНК для IP3R 2 и 3 типа, не изменен для IP3R1 и значительно повышен для рецепторов RyR2 по сравнению с этими показателями у молодых крыс (4 мес.). В аорте старых самок снижено относительное содержание мРНК для СаМ и Epac1 и не изменено для Epac2, у самцов, напротив, повышена экспрессия Epac1 и Epac2 на 67 и 50%, соответственно, по сравнению с аналогичными показателями у молодых крыс (4 мес.) и не изменяется для СаМ, что свидетельствует о гендерных различиях в нарушении тонких механизмов модуляции активности RyR2 и IP3Rs в сосудах. Значительные изменения выявлены в миокарде старых крыс. У старых самцов возрастает экспрессия RyR2, IP3R1,2,3 в левом желудочке, RyR2 и IP3R1 – в левом предсердии, RyR2 и IP3R3 – в правом предсердии. В отличие от самцов в левом желудочке самок содержание мРНК для RyR2, IP3R1,2,3 было значительно ниже, чем у молодых животных. В правом предсердии старых самок выявлен высокий уровень экспрессии IP3R1 и IP3R3, в левом – IP3R3. Во всех отделах сердца самок неизменной была экспрессия IP3R2. В миокарде старых крыс обоего пола значительно возрастала экспрессия белков СаМ и Epac2. Выявленные возрастные различия в транскрипционной активности генов, участвующих в регуляции внутриклеточного Ca2+-сигналинга на уровне IP3Rs- и RyR2-опосредованных механизмов позволяют предположить, что с увеличением продолжительности жизни у самцов вероятность развития гипертрофии миокарда и нарушения сердечного ритма значительно выше, чем у самок.
ВВЕДЕНИЕ
В мире с каждым годом растет численность пожилого населения. С увеличением продолжительности жизни возрастает и риск развития сердечно-сосудистых заболеваний, которые являются ведущей причиной смертности во всем мире [1, 2]. С возрастом в сосудах и сердце изменяются структурные и электромеханические свойства гладкомышечных клеток и кардиомиоцитов. Предшественниками или проявлением подобных трансформаций являются изменения уровней экспрессии генов белков, принимающих участие в регуляции внутриклеточной сигнализации и функциональной активности клеток [3–7]. Знание, в какой степени возрастные изменения способствуют адаптации или развитию сердечно-сосудистых заболеваний, является чрезвычайно важным. Показано, что в процессе физиологического старения целостность структуры миокарда в большей степени сохраняется в женском организме, что может быть одной из причин различия в продолжительности жизни между женщинами и мужчинами [8]. У пожилых людей возрастает частота и тяжесть мерцательных аритмий, которая играет критическую роль в генезе внезапной сердечной смерти. По результатам эпидемиологического исследования возникновение фибрилляции предсердий (Atrial fibrillation, AF) у пожилых мужчин выше, чем у женщин [7, 9–11]. Полагают, что это связано с более ранним поражением коронарных артерий у мужчин. У женщин AF диагностируется в более пожилом возрасте, чем у мужчин, но у них высок риск развития связанных с AF осложнений. В экспериментах на крысах также продемонстрировано, что возрастные структурные и функциональные изменения в сосудах и миокарде у самцов развиваются раньше, чем у самок [12]. Полагают, что это связано с дефицитом тестостерона, который может вызвать аритмогенную утечку ионов Ca2+ из саркоплазматического ретикулума (sarcoplasmic reticulum, SR) [13].
Поддержание внутриклеточного кальциевого гомеостаза имеет решающее значение для нормального функционирования клеток, поскольку Ca2+ играет центральную роль в регуляции процессов возбуждения, сокращения, транскрипции и пролиферации клеток. Важнейшую роль в генерации, распространении и регуляции внутриклеточных кальциевых сигналов играют встроенные в мембрану сарко/эндоплазматического ретикулума (SR/ER) Ca2+-селективные внутриклеточные каналы – инозитол-1,4,5-трисфосфатные (IP3R) и рианодиновые (RyR) рецепторы. Они регулируют многочисленные физиологические и патофизиологические процессы в организме [14–16]. Нарушения тонуса сосудов и сердечного ритма связывают, в первую очередь, с IP3R- и RyR2-индуцированной дисрегуляцией внутриклеточного кальциевого обмена [17–19].
Идентифицировано по три изоформы IP3Rs (IP3R1,2,3) и RyRs (RyR1,2,3) рецепторов [20–22]. В сосудах и миокарде существует региональная гетерогенность в экспрессии изоформ IP3Rs и RyRs, что, по-видимому, имеет значение в реализации различных физиологических функций, таких как возбудимость, сократимость и экспрессия генов [18, 23–25]. Локализация этих рецепторов на мембране SR/ER также является изоформной и тканеспецифичной [14, 26].
Показано, что в гладкомышечных клетках сосудов (ГМК) наиболее высокоэкспрессируемой изоформой является IP3R1, затем со значительной гетерогенностью в экспрессии – IP3R3 и IP3R2, в кардиомиоцитах – RyR2. Активность IP3Rs и RyRs стимулируется многими эндогенными молекулами, которые действуют через сопряженные с G-белками рецепторы (G protein-coupled receptors – GPCR), и модулируется Ca2+, кальмодулином (СаМ), протеинкиназами A и G (PKA и PKG), активными формами кислорода и др. [27–32]. Агонисты, действующие через Gs-белок, активируют аденилатциклазу, что приводит к повышению концентрации циклического аденозинмонофосфата (cAMP), активации PKA и cAMP-связывающих белков Epac (Exchange Proteins Directly Activated by cAMP), последующему фосфорилированию IP3Rs и RyRs и изменению их функциональной активности [16, 33]. Для понимания механизмов, лежащих в основе биологического старения, и выявления возможных факторов риска развития ассоциированных с возрастом сердечно-сосудистых заболеваний нам представлялось важным изучить особенности изменений транскрипционной активности генов IP3Rs, RyRs и модуляторов их активности – сигнальных белков СаМ и Epac в сосудах и миокарде крыс в зависимости от пола животных.
Цель исследования – оценка возрастных изменений транскрипционной активности генов белков, участвующих в регуляции Ca2+-сигнализации – IP3Rs, RyRs рецепторов и модуляторов их активности СаМ и Epac в сосудах и миокарде крыс обоего пола.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на беспородных крысах самцах и самках в возрасте 4 и 24 мес. Условия содержания животных соответствовали приказу МЗ РФ № 708н “Об учреждении правил лабораторной практики” от 23.08.2010 и этическим нормам, изложенным в Правилах лабораторной практики (GLP) Хельсинской декларации (2000).
Включенные в исследование крысы были рандомизированы на 4 группы: 1-я группа – самцы в возрасте 4 мес. (молодые, n = 10); 2-я группа – самцы в возрасте 24 мес. (старые, n = 8); 3-я группа – самки в возрасте 4 мес. (молодые, n = = 14); 4-я группа – самки в возрасте 24 мес. (старые, n = 10). Наркотизированных (25%-ный раствор уретана, 4 мл/кг) крыс декапитировали, вскрывали грудную клетку, извлекали фрагменты сердца и аорты, отмывали от крови в физиологическом растворе натрия хлорида при 4°C, после чего ткани помещали в раствор RNAlater (Ambion, США) и хранили до выделения РНК при температуре –20°С. Кусочки тканей предсердий, левого желудочка и аорты перетирали в жидком азоте. Выделение РНК из тканей проводили с помощью набора GeneJET™ (Thermo Fisher Scientific Inc., США) согласно протоколу производителя. Концентрацию суммарной РНК в образцах определяли на спектрофотометре NanoDrop® ND-1000 (Thermo Fisher Scientific Inc., США). Выделенную суммарную РНК для предотвращения контаминации геномной ДНК обрабатывали ДНКазой I (Thermo Fisher Scientific Inc., США). Синтез кДНК проводили с помощью набора RevertAidTM H Minus First Strand cDNA Synthesis Kit (Thermo Fisher Scientific Inc., США) согласно протоколу производителя. Для синтеза брали 76 нг тотальной РНК. ПЦР-РВ проводили с помощью набора qPCRmix-HS (Евроген, Россия), используя праймеры и флуоресцентные зонды (ДНК-синтез, Россия), согласно протоколам производителей на амплификаторе CFX96TM Real-Time PCR Detection Systems (Bio-Rad Laboratories Inc., США). Полученные значения экспрессии для каждого исследуемого гена нормировали на значение экспрессии для референсного гена. В качестве референсного гена был использован ген β-актина. Уровень экспрессии гена β-актина между сравниваемыми группами (самки 4 и 24 мес.; самцы 4 и 24 мес.) в условиях наших экспериментов оставался неизменным. Изменение уровня экспрессии гена-мишени оценивали по изменению уровня мРНК исследуемого гена/мРНК β-актина. Отрицательные контроли были поставлены согласно общепринятым стандартам к отрицательным контролям при проведении количественной ПЦР: для исключения контаминации реагентов реакция была запущена без фрагментов кДНК; для исключения контаминации кДНК геномной ДНК реакция была запущена с образцом тотальной РНК. Таблица 1
Таблица 1.
Последовательности праймеров, используемых в работе.
| Белок | Прямой праймер | Обратный праймер | Праймер с флуоресцентным зондом |
|---|---|---|---|
| RyR2 | CAGCAGACTGGAGAGACTGG | CCTTCTTTGATGATATTCAGAG | FAM-GTCCTCTGGTATCCTGGAGGTC-BHQ1 |
| IP3R3 | AACTCAACGAGGGCTTCATC | CATTGTTGGGAACATCGC | FAM-GACCGCAGGTTTGTCATCCAG-BHQ1 |
| IP3R2 | CATAGACACAGAGGAAGAGAG | CACACGATGGCAAAGGCT | FAM-CATGCTGAAAATTGGGACCTGC-BHQ1 |
| IP3R1 | CCCTGACTTTGAGGAAGAATG | CACAGAGACCAGAGAGTACACC | FAM-AGCCCTCAGTGGACCCTGATC-BHQ1 |
| CaM | GGTGGATGCTGATGGCAAT | GTATCTCCTCCTCGCTGTCTG | FAM-CATTGACTTCCCAGAGTTCCTGAC-BHQ1 |
| Epac1 | GCTCCCTGGACTTCAGAGTG | CAAGAGATGACGGTACAGGA | FAM-CTGGAGCAGGCCACCACAGAG-BHQ1 |
| Epac2 | GGACGCCTGTTTGCCTG | CATCTGGTACGCCAAGTCT | FAM-CGACTCACTGACTCCCTTGCCA-BHQ1 |
Статистика. Предварительную обработку результатов проводили с использованием программного обеспечения, приложенного к прибору. Дальнейшая обработка проводилась в приложении Microsoft Excel с использованием алгоритма 2–ΔΔCt. Статистическую значимость различий определяли с помощью t-критерия Стьюдента. Различия считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Аорта. В тканях аорты крыс самцов и самок оценивали уровень мРНК рианодиновых (RyR2) и инозитол-1,4,5-трисфосфатных (IP3R1, IP3R2, IP3R3) рецепторов, а также регуляторных белков – CaM, Epac1 и Epac2. Анализ полученных результатов свидетельствует о том, что в аорте старых крыс обоего пола (24 мес.) снижается уровень мРНК для IP3R2 (до 63 и 61% соответственно у самок и самцов) и IP3R3 (до 62 и 67% соответственно у самок и самцов) и не меняется экспрессия рецепторов IP3R2-типа по сравнению с аналогичными данными у молодых крыс (4 мес.). Установлено, что у старых крыс независимо от пола животных в сосудах более чем в 1.5 раза возрастает содержание мРНК для RyR2 (до 153% у самцов и до 185% у самок) (рис. 1а).
Рис. 1.
Возрастные изменения уровня мРНК рианодиновых (RyR2), инозитол-1,4,5-трисфосфатных рецепторов (IP3R1, IP3R2, IP3R3) (а), кальмодулина (CaM) и белков Epac1, Epac2 (б) в аорте крыс самцов и самок. Значения экспрессии для каждого исследуемого гена нормировали на значение экспрессии референсного гена – β-актина в том же образце ткани. Содержание мРНК каждого исследуемого белка выражено в процентах от среднего значения содержания того же белка в группе молодых крыс самцов или самок, принятого за 100%. * – p < 0.01 по сравнению с крысами в возрасте 4 мес.
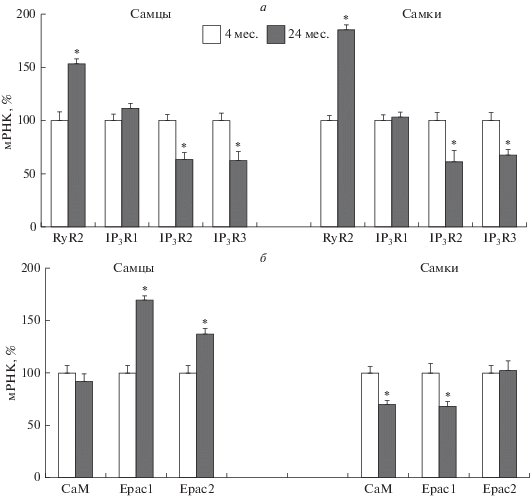
Вместе с тем отмечаются значительные половые отличия в характере возрастных изменений экспрессии генов СаМ и белков Epac. Выявлено, что у старых самок в аорте уменьшается уровень мРНК для СаМ и Epac1 (соответственно на 30 и 32%) и не меняется для Epac2 по сравнению с аналогичными показателями в сосудах молодых самок (рис.1б). В отличие от самок в сосудах старых крыс самцов, напротив, возрастает экспрессия белков Epac1 и Epac2 и не меняется для СаМ (рис. 1б).
Функция IP3Rs в сосудах. IP3Rs играют центральную роль в генерации и поддержании миогенного тонуса сосудов. Однако до сих пор точно неизвестно, в какой степени каждый из трех подтипов IP3Rs вносит вклад в сложную передачу сигналов Ca2+ в клетке. Остается непонятной роль IP3R сосудов в развитии гипертонии, а имеющиеся данные противоречивы. Полагают, что при гипертонии повышение чувствительности к фенилэфрину вызвано увеличением экспрессии IP3R1 в ГМК сосудов в результате Ca2+-зависимой активации транскрипционного фактора CN-NFAT (calcineurin-Nuclear factor of activated T-cells) [34]. В то же время показано, что в мозговых артериях активация IP3R1, расположенных в непосредственной близости к Ca2+-активируемым калиевым каналам большой проводимости (BKCa), повышает чувствительность этих каналов к Ca2+. По мнению авторов, с помощью этого механизма может ограничиваться IP3-индуцированная вазоконстрикция в мозговых артериях [35].
В экспериментах на культуре клеток HeLa, которые экспрессируют сопоставимые количества IP3R1 и IP3R3, было показано, что подавление экспрессии подтипа IP3R1 методом РНК-интерференции приводит к значительному уменьшению суммарных Ca2+-сигналов и прекращению осцилляций Ca2+ [17]. И, напротив, подавление экспрессии IP3R3 приводит к более устойчивым и продолжительным колебаниям внутриклеточной концентрации Ca2+, чем в контроле. Сходные эффекты нокаута IP3R3 получены и на клетках COS-7, которые преимущественно экспрессируют IP3R3 [17]. Эти результаты позволили авторам предположить, что в клетках IP3R1 и IP3R3 оказывают противоположные эффекты на генерацию внутриклеточных колебаний Ca2+.
В экспериментах на культуре ГМК аорты крысы показано, что пролиферирующие клетки экспрессируют преимущественно IP3R2 и IP3R3, но в процессе их развития экспрессия этих типов рецепторов уменьшается, а IP3R1, напротив, увеличивается [36, 37]. Установлено, что IP3R1 распределены по всей цитоплазме, IP3R2 тесно связаны с ядром и с плазматической мембраной, IP3R3 распределены преимущественно вокруг ядра. Показано, что каждая изоформа IP3Rs может приводить к активации апоптоза [38]. Однако изоформа IP3R3 играет особую роль в индукции апоптоза преимущественно путем передачи Ca2+-сигналов в митохондрии, поскольку IP3R3 имеет особую склонность к формированию субклеточных кластеров с митохондриями, что приводит к образованию ассоциированных сигнальных микродоменов. Интересно, что IP3R3 могут не только активировать, но и ингибировать апоптоз, и этот процесс реализуется по Akt-IP3R3-зависимому механизму [39].
Нами было установлено, что одним из проявлений возрастных изменений сосудов является дисбаланс в экспрессии IP3Rs: снижается экспрессия рецепторов 2 и 3 типов и не изменяется IP3R1. Эти изменения в экспрессии подтипов IP3Rs в стареющих сосудах животных обоего пола, по-видимому, могут быть критичными для различных форм передачи Ca2+-сигналов как в ГМК, так и в эндотелиальных клетках и влиять на сократительные свойства сосудов. Кроме того, можно предположить, что значительное снижение экспрессии IP3R2 и IP3R3 типов в аорте старых крыс обоего пола является проявлением возрастного снижения пролиферативной и апоптотической активности ГМК.
Функция RyRs в сосудах. Функция RyRs в ГМК менее понятна. Хотя RyRs в гладких мышцах генерируют локальные Ca2+-спарки (sparks), которые аналогичны тем, которые наблюдаются в поперечно-полосатых мышцах, однако вклад этих изменений в вызванное деполяризацией глобальное повышение внутриклеточной концентрации Ca2+ ([Ca2+]i) довольно ограничен. В отличие от сердечной или скелетной мышц, RyR-зависимый Ca2+-индуцированный выброс кальция (calcium-induced calcium release, CICR) не является необходимым для вазоконстрикции, потому что в ГМК сосудов концентрация Ca2+, вызывающая сокращение сосудов, ниже требуемой для RyR-опосредованной активации CICR [40]. В ГМК сосудов RyR-опосредованные Ca2+-спарки сопровождаются активацией BKCa, что приводит к снижению миогенного тонуса и вазодилятации. Вместе с тем показано, что BKСа- и RyR-каналы играют разные роли в регуляции миогенного и нейрогенного тонуса: в то время как BKСа- и RyR-каналы действуют совместно, чтобы противодействовать миогенной вазоконстрикции, BKСа-каналы противодействуют нейрогенной вазоконстрикции, а RyR каналы, напротив, усиливают ее [41]. Авторы полагают, что на уровне нейрогенной вазоконстрикции резистивных артерий RyRs действуют совместно с потенциал-зависимыми Ca2+-каналами L-типа.
Нами установлено, что в сосудах старых самок и самцов возрастает уровень мРНК RyR2 соответственно в 1.9 и 1.5 раз по сравнению с аналогичными показателями у молодых крыс. Вызванное старением повышение экспрессии RyR2 и понижение IP3R2 и IP3R3 в аорте крыс обоего пола указывают на существенные изменения внутриклеточного обмена Ca2+, но пока неясно, каким образом они влияют на регуляцию миогенного и нейрогенного тонуса сосудов в условиях целостного организма. Кроме того, в процессе старения сосудов изменяется экспрессия важнейших регуляторов активности канальных белков – СаМ и Epac. Нами выявлено, что на фоне высокой экспрессии RyR2 в аорте старых самок наблюдается значительное снижение экспрессии СаМ и Epac1, в то время как в сосудах самцов уровень мРНК для СаМ остается неизменным, но возрастает экспрессия белков Epac1 и Epac2.
Для RyRs кальций является основным физиологическим регулятором их активности [30, 42]. При умеренном повышении [Ca2+]i возбуждение RyRs опосредуется через активацию CaMK-зависимого фосфорилирования каналов или путем взаимодействия Ca2+ с Ca2+-связывающим белком S100A, который конкурирует с СаМ за связывание с RyRs. Вазодилататоры, которые действуют на рецепторы, связанные с Gs-белком, активируют аденилатциклазу, что приводит к увеличению уровня cAMP и последующей активации PKA- и Epac-опосредованного фосфорилирования RyRs, что приводит к увеличению частоты RyR-зависимых локальных кальциевых сигналов, последующей активации BKCa-каналов и вазодилатации. При высоком уровне [Ca2+]i. активность RyR, напротив, ингибируется через механизмы, включающие Ca2+-связывающие белки сорбин (SORC) или CaM [16].
Как и в случае с RyRs, высокие уровни внутриклеточного Ca2+ ингибируют активность IP3Rs через CaM-зависимые механизмы. Основными стимулами активации IP3R являются индуцированное вазоконстрикторами увеличение IP3 и умеренное увеличение [Ca2+]i. Активация IP3Rs ионами Ca2+ реализуется путем их прямого взаимодействия с каналами или опосредовано через активацию CaMK и последующего фосфорилирования каналов. В отличие от RyRs PKA- или Epac-индуцированное фосфорилирование IP3Rs приводит к снижению их активности [16].
Таким образом, в процессе старения в аорте крыс развиваются однонаправленные изменения экспрессии генов канальных белков IP3Rs и RyR2, и различные в зависимости от пола крыс изменения экспрессии белков, модулирующих их активность – СаМ и Epac, что свидетельствует о возрастных изменениях внутриклеточного кальциевого обмена. Можно предположить, что высокий уровень экспрессии Epac1 и Epac 2 в сосудах старых крыс самцов негативно влияет на активность IP3Rs и позитивно – на RyRs, поскольку Epac-индуцированное фосфорилирование приводит к снижению активности первых и повышению вторых. Уменьшение экспрессии СаМ в сосудах старых самок, возможно, приводит к снижению его ингибирующего влияния на IP3Rs и RyRs, а Epac1 – к снижению активирующего влияния на RyR2 и ингибирующего на IP3Rs. По-видимому, одним из признаков стареющих сосудов, является нарушение тонких механизмов модуляции важнейших ионных каналов, участвующих в регуляции [Ca2+]i, которые имеют определенную специфичность у самок и самцов крыс. Выявленные изменения могут вносить существенный вклад в возраст-инициированную патологию сосудов на уровне их сократительной, пролиферативной и апоптотической активности. Однако не исключено, что некоторые из них могут быть проявлением компенсаторных механизмов, направленных на сохранение Ca2+-гомеостаза в стареющих сосудах.
Сердце. Установлено, что у старых крыс самцов в левом желудочке и обоих предсердиях возрастает уровень мРНК RyR2 (рис. 2). У старых самцов в левом желудочке увеличивается содержание мРНК для всех трех типов IP3Rs, в левом предсердии только для IP3R1-типа, в правом предсердии – возрастает для IP3R3-типа, но снижается уровень мРНК для IP3R2-типа по сравнению с контрольными животными (рис. 2).
Рис. 2.
Возрастные изменения уровня мРНК рианодиновых (RyR2) и инозитол-1,4,5-трисфосфатных рецепторов (IP3R1, IP3R2, IP3R3) в левом желудочке, левом и правом предсердиях сердца крыс самцов и самок. Значения экспрессии для каждого исследуемого гена нормировали на значение экспрессии референсного гена – β-актина в том же образце ткани. Содержание мРНК каждого исследуемого белка выражено в процентах от среднего значения содержания того же белка в группе молодых крыс самцов или самок, принятого за 100%. * – p < 0.05; ** – p < 0.01 по сравнению с крысами в возрасте 4 мес.
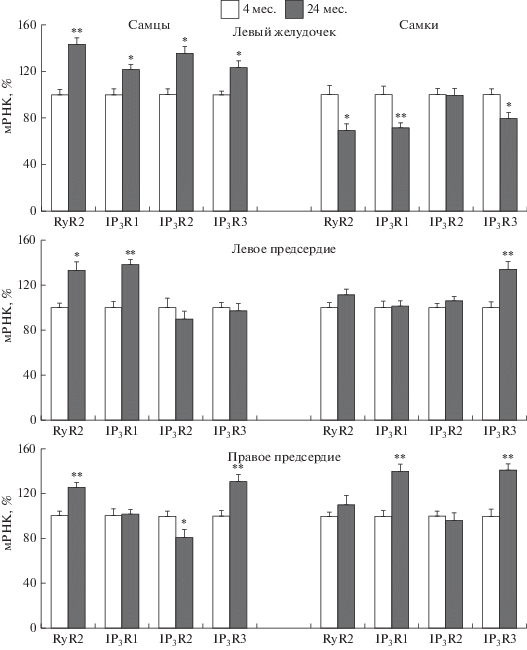
Иные возрастные изменения в экспрессии генов RyR2 и IP3Rs выявлены в сердцах старых самок. Установлено, что у самок в процессе старения в левом желудочке в отличие от самцов снижается экспрессия RyR2, IP3R1 и IP3R3, в то время как в левом предсердии возрастает уровень мРНК для IP3R3-типа, в правом – для рецепторов IP3R1- и IP3R3-типа (рис. 2). Уровень экспрессии мРНК IP3R2-типа в сердцах старых самок не отличается от показателей в сердцах молодых крыс.
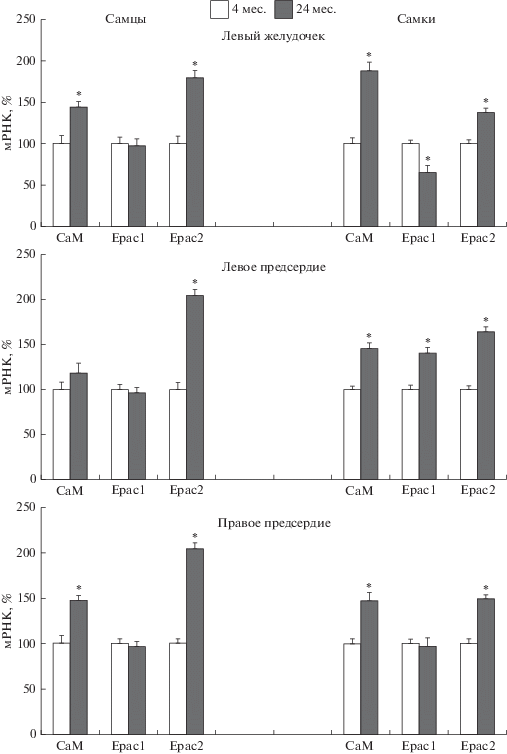
В процессе старения в левом желудочке и предсердиях крыс обоего пола значительно возрастает экспрессия СаМ и Epac2, о чем свидетельствует более высокий уровень их мРНК по сравнению с аналогичными показателями у молодых животных (рис. 3). У старых самцов в сердце остается неизменным уровень мРНК для Epac1, в то время как у самок уровень мРНК данного белка понижается в левом желудочке и, напротив, повышается в левом предсердии (рис. 3).
Рис. 3.
Возрастные изменения уровня мРНК кальмодулина (CaM) и белков Epac1, Epac2 в левом желудочке, левом и правом предсердиях сердца крыс самцов и самок. Значения экспрессии для каждого исследуемого гена нормировали на значение экспрессии референсного гена – β-актина в том же образце ткани. Содержание мРНК каждого исследуемого белка выражено в процентах от среднего значения того же белка в группе молодых крыс самцов или самок, принятого за 100%. * – p < 0.01 по сравнению с крысами в возрасте 4 мес.
Известно, что стареющее сердце характеризуется сниженной реакцией на симпатическую стимуляцию, высоким риском развития аритмий и внезапной сердечной смерти [43–45]. Связанную с возрастом электрическую нестабильность и сократительную дисфункцию миокарда связывают прежде всего с нарушением гомеостаза Ca2+. Однако специфические молекулярные механизмы, лежащие в основе измененной регуляции обмена Сa2+ в стареющем сердце, остаются недостаточно изученными. Показано, что у пожилых людей снижается функциональная активность синоатриального узла, что, как полагают, связано с возрастным снижением экспрессии основного Ca2+-проводящего канала SR – RyR2, а также с изменением экспрессии других ионных каналов – увеличением Na(v)1.5, Na(v)β1 и Ca(v)1.2 и снижением K(v)1.5 и HCN1 [46].
Функция RyRs в сердце. Известно, что RyR2 рецепторы являются ключевыми внутриклеточными структурами, реализующими воздействие симпатической нервной системы на миокард. Нами показано, что у старых самцов в левом желудочке и предсердиях значительно возрастает экспрессия RyR2, в то время как у самок, напротив, снижается в левом желудочке и не изменяется в предсердиях. Одновременно c изменением экспрессии RyR2 в стареющих сердцах крыс обоего пола выявлен высокий уровень экспрессии мРНК белков СаМ и Epac2. Изменения на уровне транскрипции данных генов могут приводить к чрезмерной активации RyR2 и к серьезным нарушениям кальциевого обмена в кардиомиоцитах [25, 47]. Установлено, что чрезмерное повышение активности RyR2 в результате их окисления, нитрозилирования или гиперфосфорилирования способствует развитию сердечной недостаточности и возникновению желудочковых аритмий [48, 49]. Известно, что активация β-адренорецепторов (β-AR) может спровоцировать сердечные аритмии через cAMP-зависимые механизмы путем увеличения утечки Ca2+ из SR в диастолу. cAMP может активировать как PKA, так и белки Epac. В исследованиях с использованием генетических модификаций Epac1, Epac2, RyR2 и CaMKII было показано, что активация Epac и PKA может в равной степени способствовать возникновению β-AR-индуцированных аритмий и утечки Ca2+ из SR. Показано, что вызванное β1-AR усиление аритмогенных выбросов Ca2+ опосредуется Epac2 [50]. Аритмогенное действие Epac2 было продемонстрировано в многочисленных исследованиях последних лет [47, 51]. Установлено, что β-AR-cAMP-Epac2-PI3K-Akt-NOS1-CaMKII сигнальный каскад опосредует повышенную (патологическую) утечку Ca2+ из SR в диастолу, в то время как с помощью cAMP-PKA-пути реализуются главным образом инотропный и люситропный эффекты β-AR [52].
В кардиомиоцитах CaM регулирует активность RyR2 путем прямого взаимодействия с ними, а также через CaMKII, которые фосфорилируют как RyR2, так и IP3Rs [53]. CaM снижает вероятность открытия RyR2 при субмикромолярной (диастолической) и микромолярной (систолической) концентрациях Ca2+. В последние годы получены данные о ключевой роли CaM в механизмах развития гипертрофии сердца. В экспериментах in vitro и in vivo показано, что подавление экспрессии гена СаМ с помощью микроРНК оказывает выраженное антигипертрофическое действие [54]. Установлено, что точечные мутации в CaM-связывающем домене RyR2 (W3587A/L3591D/F3603A) у мышей приводят к тяжелой гипертрофии сердца, резкому снижению инотропной функции левого желудочка и ранней смерти животных [55, 56]. Полученные нами данные о высоком уровне экспрессии RyR2, СаМ и Epac2 в сердцах старых животных, позволяют предположить, что у самцов вероятность развития гипертрофии миокарда и возникновения желудочковых аритмий значительно выше, чем у самок (рис. 2, 3).
Функция IP3Rs в сердце. Если роль RyR2 как рецептора, регулирующего высвобождение Ca2+ из SR, необходимого для реализации электромеханического сопряжения кардиомиоцитов, очевидна, то до настоящего времени нет четкого представления о вкладе IP3Rs в этот процесс. В физиологических условиях в кардиомиоцитах, в отличие от невозбудимых клеток, низкий уровень Gq-индуцированной генерации IP3 и слабый ответ на него IP3R [18]. Роль IP3Rs в патофизиологии, особенно в аритмогенезе и гипертрофии миокарда, более очевидна. В настоящее время доказано, что в глобальном увеличении [Сa2+]i в кардиомиоцитах доля IP3R-индуцированного высвобождения Ca2+ из SR незначительна, что делает их вклад в регуляцию процесса электромеханического сопряжения кардиомиоцитов минимальным. Полагают, что важным условием активации IP3Rs является их локализация в субсарколеммальной зоне, т.е. в непосредственной близости от места генерации IP3 [18].
В настоящем исследовании нами были выявлены половые различия возрастных изменений уровня экспрессии рецепторов IP3R1–IP3R3 типов в левом желудочке сердец старых крыс. Так, у старых самцов в левом желудочке экспрессия IP3R1, IP3R2 и IP3R3 была значительно выше, а у самок, напротив, ниже (IP3R1 и IP3R3), чем в сердцах молодых крыс.
В сердце IP3R1 локализуются преимущественно в проводящих, а IP3R2 в сократительных кардиомиоцитах, причем в кардиомиоцитах желудочков IP3R2 находятся преимущественно в области перинуклеарной мембраны [57, 58]. Клетки предсердий экспрессируют большее количество IP3Rs по сравнению с кардиомиоцитами желудочков. В них в основном преобладают IP3Rs 1 и 2 типа [59]. В предсердиях количество IP3R2 в 6–10 раз больше, чем в желудочках, и в SR они находятся в непосредственной близости от сарколеммы в тесной близости с RyRs [57, 58]. Было показано, что агонист-индуцированная активация фосфолипазы С (PLC) в кардиомиоцитах предсердий вызывает возникновение локальных Ca2+-спарков, которые могут передаваться на расположенные рядом RyR2 и усиливать ответ CICR, и, таким образом, IP3Rs могут влиять на процесс электромеханического сопряжения в предсердиях [60]. Полагают, что IP3R-вызванная активация RyR2, других ионных каналов и обменников, в частности Ca2+-каналов L-типа и Na+/Ca2+-обменника, может приводить к фибрилляции предсердий [59].
С учетом данных литературы о преимущественной локализации IP3R1 типа в проводящих кардиомиоцитах, можно предположить, что увеличение экспрессии данной изоформы рецепторов в левом желудочке и левом предсердии старых крыс самцов является фактором риска развития у них аритмий. Кроме того, высокий уровень экспрессии IP3R2 в левом предсердии также может провоцировать фибрилляцию предсердий, поскольку их роль в аритмогенезе доказана [61, 62].
Показано, что ось GPCR/IP3R модулирует не только нарушения сердечного ритма, но и развитие гипертрофии. Имеются убедительные данные о причастности IP3R2 к развитию гипертрофии миокарда в условиях повышенной экспрессии этих рецепторов и/или их чрезмерной активации в результате агонист-индуцированного сигналинга от GPCR [63], и эти механизмы реализуются на уровне ядерных мембран.
В последние годы все больше внимания уделяется изучению особенностей передачи Ca2+-сигналов в ядрах кардиомиоцитов и их роли в регуляции транскрипции генов [64, 65]. На транскрипцию генов и рост клеток оказывают влияние ядерные сигналы Сa2+, которые отличаются от сигналов цитозольного Сa2+. Регуляция внутриядерной концентрации Ca2+ ([Ca2+]nuc) осуществляется главным образом посредством пассивной диффузии ионов из цитоплазмы. Однако в ядре имеется дополнительный источник Ca2+, полностью независимый от цитозольного, – это ядерная мембрана (nuclear envelope, NE), которая представляет собой клеточный компартмент с собственным перинуклеарным хранилищем Ca2+ [66]. В NE экспрессируются белки, регулирующие трафик Ca2+, включая IP3R, обращенные как к нуклеоплазме, так и цитоплазме [67]. Специфические стимулы GPCR могут через IP3R-опосредованное высвобождение Ca2+ из NE увеличивать [Ca2+]nuc независимо от концентрации ионов Ca2+ в цитозоле клетки ([Ca2+]cyt ) [68]. В отличие от глобального увеличения [Ca2+]cyt, в настоящее время считается, что центральную роль в регуляции экспрессии генов в кардиомиоцитах играет локальный прирост [Ca2+]nuc.
Структурная организация передачи Ca2+-сигналов в ядре может включать в себя как рецепторы и генерацию IP3 на мембранах Т-канальцев кардиомиоцитов желудочков, находящихся в непосредственной близости от ядра, так и GPCR-комплексы, локализованные на NE [64, 65]. Известно, что в кардиомиоцитах желудочков IP3R2-типа сконцентрированы в NE [69]. Специфические стимулы GPCR, такие как эндотелин 1, ангиотензин II и др., могут через IP3R2-опосредованное высвобождение Ca2+ из NE увеличивать [Ca2+]nuc независимо от [Ca2+]cyt [68]. Локализованные на NE IP3R2 ассоциированы с СаМ, CaMKII. Активация CaMKII-зависимой ядерной сигнализации запускает фосфорилирование гистоновых деацетилаз класса II (HDAC) и экспорт ядерных HDAC, что приводит к активации MEF2-зависимой транскрипции различных генов (myocyte enhancer factor-2) [70]. Также активируется и CaN-NFAT транскрипционный путь. Наличие локальных Ca2+-зависимых механизмов IP3R2-опосредованной регуляции проницаемости ядерных пор для трафика транскрипционных факторов в кардиомиоцитах взрослых крыс предполагает вовлеченность IP3R2 в развитие у старых самцов патологической гипертрофии левого желудочка. В пользу данного предположения свидетельствует высокий уровень экспрессии IP3R2, а также СаМ в кардиомиоцитах левого желудочка крыс в возрасте 24 мес. по сравнению с аналогичными показателями у молодых крыс.
В отличие от самцов у старых самок высока вероятность развития мерцательной аритмии, поскольку в процессе старения в правом предсердии сердца самок значительно возрастает уровень экспрессии IP3R1. Повышение уровня IP3Rs наблюдается и в кардиомиоцитах предсердий у пациентов с хронической фибрилляцией предсердий [71, 72]. В отличие от самцов у старых самок риск развития желудочковых аритмий, как и их гипертрофии минимален, поскольку у них в левом желудочке выявлен низкий уровень экспрессии RyR2, IP3R1 и IP3R3 и неизмененный – для IP3R2-типа.
Установлено, что IP3R3-изоформа рецепторов причастна к развитию различных заболеваний человека [73]. Однако менее изучена роль IP3R3 в регуляции сердечной деятельности в норме и при патологии. Известно, что IP3R3-зависимый Ca2+-сигналинг необходим для NO-индуцированной дифференцировки кардиомиоцитов, полученных из эмбриональных стволовых клеток [74]. С учетом вышеизложенных данных о важном вкладе IP3R3 в модуляцию генерации Ca2+-осцилляций [17] можно предположить, что значительное увеличение экспрессии данных рецепторов в кардиомиоцитах крыс обоего пола в сочетании с измененной экспрессией RyR2, IP3R1 и IP3R2 свидетельствует о переходе на новый уровень регуляции внутриклеточного кальциевого обмена в сердцах старых крыс.
ЗАКЛЮЧЕНИЕ
Старение является естественным процессом увядания функциональной активности организма на уровне всех систем и органов, что приводит к перепрограммированию профиля экспрессии генов, которые направлены в первую очередь на поддержание жизнедеятельности в условиях меняющихся потребностей организма, т.е. носят адаптивный характер. Важнейшую роль в этих процессах играет цитозольный и ядерный Сa2+-сигналинг. Вместе с тем, с учетом полученных данных есть все основания полагать, что в процессе старения организма в ГМК и кардиомиоцитах происходят значительные изменения на уровне регуляции внутриклеточного кальциевого обмена, которые могут вносить существенный вклад в развитие ассоциированных с возрастом сердечно-сосудистых заболеваний. Выявленные гендерные возрастные различия в транскрипционной активности генов, участвующих в регуляции внутриклеточного Сa2+-сигналинга на уровне IP3Rs- и RyR2-опосредованных механизмов позволяют предположить, что с увеличением продолжительности жизни у самцов вероятность развития гипертрофии миокарда и нарушения сердечного ритма значительно выше, чем у самок. Возрастные изменения в уровне экспрессии генов RyR2 и IP3Rs и модуляторов их активности – СаМ и Epac в аорте также могут негативно отразиться на сократительной активности сосудов в старости.
Список литературы
Lakatta E.G. So! What’s aging? Is cardiovascular aging a disease? 2015. J. Mol. Cell Cardiol. 83, 1–13.
de Almeida A.J.P.O., Ribeiro T.P., de Medeiros I.A. 2017. Aging: Molecular pathways and implications on the cardiovascular system. Oxid. Med. Cell. Longev. 2017, 7941563.
Sheydina A., Riordon D.R., Boheler K.R. 2011. Molecular mechanisms of cardiomyocyte aging. Clin. Sci. (Lond). 121 (8), 315–329.
Thijssen D.H., Carter S.E., Green D.J. 2016. Arterial structure and function invascular ageing: Are you as oldas your arteries? J. Physiol. 594 (8), 2275–2284.
Saeed Y., Temple I.P., Borbas Z., Atkinson A., Yanni J., Maczewski M., Mackiewicz U., Aly M., Logantha S.J.R.J., Garratt C.J., Dobrzynski H. 2018. Structural and functional remodeling of the atrioventricular node with aging in rats: The role of hyperpolarization-activated cyclic nucleotide-gated and ryanodine 2 channels. Heart Rhythm. 15 (5), 752–760.
Wirth A., Wang S., Takefuji M., Tang C., Althoff T.F., Schweda F., Wettschureck N., Offermanns S. 2016. Age-dependent blood pressure elevation is due to increased vascular smooth muscle tone mediated by G-protein signaling. Cardiovascular Research. 109, 131–140.
Lin Y.K., Chen Y.A., Lee T.I., Chen Y.C., Chen S.A., Chen Y.J. 2018. Aging modulates the substrate and triggers remodeling in atrial fibrillation. Circ. J. 82 (5), 1237–1244.
Olivetti G., Giordano G., Corradi D., Melissari M., Lagrasta C., Gambert S.R., Anversa P. 1995. Gender differences and aging: Effects on the human heart. J. Am. Coll. Cardiol. 26 (4), 1068–1079.
Magnani J.W., Moser C.B., Murabito J.M., Nelson K.P., Fontes J.D., Lubitz S.A., Sullivan L.M., Ellinor P.T., Benjamin E.J. 2012. Age of natural menopause and atrial fibrillation: The framingham heart study. Am. Heart J. 163 (4), 729–734.
Magnani J.W., Moser C.B., Murabito J.M., Sullivan L.M., Wang N., Ellinor P.T., Vasan R.S., Benjamin E.J., Coviello A.D. 2014. Association of sex hormones, aging, and atrial fibrillation in men: The framingham heart study. Circ. Arrhythm. Electrophysiol. 7 (2), 307–712.
Kavousi M. 2020. Differences in epidemiology and risk factors for atrial fibrillation between women and men. Front. Cardiovasc. Med. 7, 3.
Al-Gburi S., Deussen A.J., Galli R., Muders M.H., Zatschler B., Neisser A., Müller B., Kopaliani I. 2017. Sex-specific differences in age-dependent progression of aortic dysfunction and related cardiac remodeling in spontaneously hypertensive rats. Am. J. Physiol. Regul. Integr. Comp. Physiol. 312 (5), R835–R849.
Tsuneda T., Yamashita T., Kato T., Sekiguchi A., Sagara K., Sawada H., Aizawa T., Fu L.T., Fujiki A., Inoue H. 2009. Deficiency of testosterone associates with the substrate of atrial fibrillation in the rat model. J. Cardiovasc. Electrophysiol. 20 (9), 1055–1060.
Ghosh D., Syed A.U., Prada M.P., Nystoriak M.A., Santana L.F., Nieves-Cintrón M., Navedo M.F. 2017. Calcium channels in vascular smooth muscle. Adv. Pharmacol. 78, 49–87.
Sun M.Y., Geyer M., Komarova Y.A. 2017. IP3 Receptor signaling and endothelial barrier function. Cell Mol. Life Sci. 74 (22), 4189–4207.
Tykocki N.R., Boerman E.M., Jackson W.F. 2017. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr. Physiol. 7 (2), 485–581.
Hattori M., Suzuki A.Z., Higo T., Miyauchi H., Michikawa T., Nakamura T., Inoue T., Mikoshiba K. 2004. Distinct roles of inositol 1,4,5-trisphosphate receptor types 1 and 3 in Ca2+ signaling. Biol. Chem. 279 (12), 11967–11975.
Woodcock E.A., Matkovich S.J. 2005. Ins(1,4, 5)P3 receptors and inositol phosphates in the heart-evolutionary artefacts or active signal transducers? Pharmacol. Ther. 107(2), 240–251.
Greiser M. 2017. Calcium signalling silencing in atrial fibrillation. J. Physiol. 595 (12), 4009–4017.
Foskett J.K., White C., Cheung K.H., Mak D.O. 2007. Inositol trisphosphate receptor Ca2+ release channels. Physiol. Rev. 87, 593–658.
Lanner J.T., Georgiou D.K., Joshi A.D., Hamilton S.L. 2010. Ryanodine receptors: Structure, expression, molecular details and function in calcium release. Cold Spring Harb. Perspect. Biol. 2 (11), a003996.
Mak D.O., Foskett J.K. 2015. Inositol 1,4,5-trisphosphate receptors in the endoplasmic reticulum: A single-channel point of view. Cell Calcium. 58, 67–78.
Grayson T.H., Haddock R.E., Murray T.P., Wojcikiewicz R.J., Hill C.E. 2004. Inositol 1,4,5-trisphosphate receptor subtypes are differentially distributed between smooth muscle and endothelial layers of rat arteries. Cell Calcium. 36, 447–458.
Narayanan D., Adebiyi A., Jaggar J.H. 2012. Inositol trisphosphate receptors in smooth muscsle cells. Am. J. Physiol. Heart. Circ. Physiol. 302 (11), H2190–H2210.
Meissner G. 2017. The structural basis of ryanodine receptor ion channel function. J. Gen. Physiol. 149 (12), 1065–1089.
Zhao G., Adebiyi A., Blaskova E., Xi Q., Jaggar J.H. 2008. Type 1 inositol 1,4,5-trisphosphate receptors mediate UTP-induced cation currents, Ca2+ signals, and vasoconstriction in cerebral arteries. Am. J. Physiol. Cell Physiol. 295, C1376–C1384.
Serysheva I.I. 2014. Toward a high-resolution structure of IP3R channel. Cell Calcium. 56 (3), 125–132.
Rossi A.M., Taylor C.W. 2004. Ca2+ regulation of inositol 1,4,5-trisphosphate receptors: Can Ca2+ function without calmodulin? Mol. Pharmacol. 66 (2), 199–203.
Prole D.L. Taylor C.W. 2019. Structure and Function of IP3 Receptors. Cold Spring Harb. Perspect. Biol. 11 (4), a035063.
Seo M.D., Enomoto M., Ishiyama N., Stathopulos P.B., Ikura M. 2015. Structural insights into endoplasmic reticulum stored calcium regulation by inositol 1,4,5-trisphosphate and ryanodine receptors. Biochim. Biophys. Acta. 1853 (9), 1980–1991.
Amador F.J., Stathopulos P.B., Enomoto M., Ikura M. 2013. Ryanodine receptor calcium release channels: Lessons from structure-function studies. FEBS J. 280 (21), 5456–5470.
Van Petegem F. 2015. Ryanodine receptors: Allosteric ion channel giants. J. Mol. Biol. 427, 31–53.
Dobrev D., Wehrens X.H. 2014. Role of RyR2 phosphorylation in heart failure and arrhythmias: Controversies around ryanodine receptor phosphorylation in cardiac disease. Circ. Res. 114 (8), 1311–1319.
Abou-Saleh H., Pathan A.R., Daalis A., Hubrack S., Abou-Jassoum H., Al-Naeimi H., Rusch N.J., Machaca K. 2013. Inositol 1,4,5-trisphosphate (IP3) receptor up-regulation in hypertension is associated with sensitization of Ca2+ release and vascular smooth muscle contractility. J. Biol. Chem. 288 (46), 32941–32951.
Zhao G., Neeb Z.P., Leo M.D., Pachuau J., Adebiyi A., Ouyang K., Chen J., Jaggar J.H. 2010. Type 1 IP3 receptors activate BKCa channels via local molecular coupling in arterial smooth muscle cells. J. Gen. Physiol. 136, 283–291.
Tasker P.N., Michelangeli F., Nixon G.F. 1999. Expression and distribution of the type 1 and type 3 inositol 1,4,5-trisphosphate receptor in developing vascular smooth muscle. Circ. Res. 84, 536–542.
Tasker P.N., Taylor C.W., Nixon G.F. 2000. Expression and distribution of InsP(3) receptor subtypes in proliferating vascular smooth muscle cells. Biochem. Biophys. Res. Commun. 273, 907–912.
Mendes C.C., Gomes D.A., Thompson M., Souto N.C., Goes T.S., Goes A.M., Rodrigues M.A., Gomez M.V., Nathanson M.H., Leite M.F. 2005. The type III inositol 1,4,5-trisphosphate receptor preferentially transmits apoptotic Ca2+ signals into mitochondria. J. Biol. Chem. 280 (49), 40892–40900.
Marchi S., Marinello M., Bononi A., Bonora M., Giorgi C., Rimessi A., Pinton P. 2012. Selective modulation of subtype III IP3R by Akt regulates ER Ca2+ release and apoptosis. Cell Death. Dis. 3 (5), e304.
Guerrero-Hernández A., Gómez-Viquez L., Guerrero-Serna G., Rueda A. 2002. Ryanodine receptors in smooth muscle. Front. Biosci. 7, d1676-1688.
Krishnamoorthy G., Sonkusare S.K., Heppner T.J., Nelson M.T. 2014. Opposing roles of smooth muscle BK channels and ryanodine receptors in the regulation of nerve-evoked constriction of mesenteric resistance arteries. Am. J. Physiol. Heart Circ. Physiol. 306 (7), H981–H988.
Van Petegem F. 2012. Ryanodine receptors: Structure and function. J. Biol. Chem. 287 (38), 31624–31632.
de Lucia C., Eguchi A., Koch W.J. 2018. New insights in cardiac β-adrenergic signaling during heart failure and aging. Front. Pharmacol. 9, 904.
Hamilton S., Terentyev D. 2019. Altered intracellular calcium homeostasis and arrhythmogenesis in the aged heart. Int. J.Mol. Sci. 20 (10), E2386.
Federico M., Valverde C.A., Mattiazzi A., Palomeque J. 2020. Unbalance between sarcoplasmic reticulum Ca2+ uptake and release: A first step toward Ca2+ triggered arrhythmias and cardiac damage. Front. Physiol. 10, 1630.
Tellez J.O., Mczewski M., Yanni J., Sutyagin P., Mackiewicz U., Atkinson A., Inada S., Beresewicz A., Billeter R., Dobrzynski H., Boyett M.R. 2011. Ageing-dependent remodelling of ion channel and Ca2+ clock genes underlying sino-atrial node pacemaking. Exp. Physiol. 96 (11), 1163–1178.
Ruiz-Hurtado G., Morel E., Domínguez-Rodríguez A., Llach A., Lezoualc’h F., Benitah J.P., Gomez A.M. 2013. Epac in cardiac calcium signaling. J. Mol. Cell. Cardiol. 58, 162–171.
Marx S.O., Marks A.R. 2013. Dysfunctional ryanodine receptors in the heart: New insights into complex cardiovascular diseases. J. Mol. Cell. Cardiol. 58, 225–231.
Houser S.R. 2014. Role of RyR2 phosphorylation in heart failure and arrhythmias: Protein kinase A-mediated hyperphosphorylation of the ryanodine receptor at serine 2808 does not alter cardiac contractility or cause heart failure and arrhythmias. Circ. Res. 114 (8), 1320–1327.
Pereira L., Cheng H., Lao D.H., Na L., van Oort R.J., Brown J.H., Wehrens X.H., Chen J., Bers D.M. 2013. Epac2 mediates cardiac β1-adrenergic-dependent sarcoplasmic reticulum Ca2+ leak and arrhythmia. Circulation. 127 (8), 913–922.
Schmidt M., Dekker F.J., Maarsingh H. 2013. Exchange protein directly activated by cAMP (epac): A multidomain cAMP mediator in the regulation of diverse biological functions. Pharmacol. Rev. 65 (2), 670–709.
Pereira L., Bare D.J., Galice S., Shannon T.R., Bers D.M. 2017. β-Adrenergic induced SR Ca2+ leak is mediated by an Epac-NOS pathway. J. Mol. Cell. Cardiol. 108, 8–16.
Urrutia J., Aguado A., Muguruza-Montero A., Núñez E., Malo C., Casis O., Villarroel A. 2019. The crossroad of ion channels and calmodulin in disease. Int. J. Mol. Sci. 20 (2), E400.
Zhou X., Sun F., Luo S., Zhao W., Yang T., Zhang G., Gao M., Lu R., Shu Y., Mu W., Zhuang Y., Ding F., Xu C., Lu Y. 2017. Let-7a is an antihypertrophic regulator in the heart via targeting calmodulin. Int. J. Biol. Sci. 13 (1), 22–31.
Arnáiz-Cot J.J., Damon B.J., Zhang X.H., Cleemann L., Yamaguchi N., Meissner G., Morad M. 2013. Cardiac calcium signalling pathologies associated with defective calmodulin regulation of type 2 ryanodine receptor. J. Physiol. 591 (17), 4287–4299.
Yamaguchi N., Chakraborty A., Huang T-Q., Xu L., Gomez A.C., Pasek D.A., Meissner G. 2013. Cardiac hypertrophy associated with impaired regulation of cardiac ryanodine receptor by calmodulin and S100A1. Am. J. Physiol. Heart Circ. Physiol. 305 (1), H86–H94.
Lipp P., Laine M., Tovey S.C., Burrell K.M., Berridge M.J., Li W., Bootman M.D. 2000. Functional InsP3 receptors that may modulate excitation-contraction coupling in the heart. Curr. Biol. 10 (15), 939–942.
Kockskämper J., Zima A.V., Roderick H.L, Pieske B., Blatter L.A., Bootman M.D. 2008. Emerging roles of inositol 1,4,5-trisphosphate signaling in cardiac myocytes. J. Mol. Cell. Cardiol. 45 (2), 128–147.
Kim J.C., Son M.J., Subedi K.P., Li Y., Ahn J.R., Woo S.H. 2010. Atrial local Ca2+ signaling and inositol 1,4,5-trisphosphate receptors. Prog. Biophys. Mol. Biol. 103 (1), 59–70.
Zima A.V., Blatter L.A. 2004. Inositol-1,4,5-trisphosphate-dependent Ca2+ signalling in cat atrial excitation-contraction coupling and arrhythmias. J. Physiol. 555 (3), 607–615.
Ju Y.K., Woodcock E.A., Allen D.G., Cannell M.B. 2012. Inositol 1,4,5-trisphosphate receptors and pacemaker rhythms. J. Mol. Cell. Cardiol. 53 (3), 375–381.
Kapoor N., Tran A., Kang J., Zhang R., Philipson K.D., Goldhaber J.I. 2015. Regulation of calcium clock-mediated pacemaking by inositol-1,4,5-trisphosphate receptors in mouse sinoatrial nodal cells. J. Physiol. 593 (12), 2649–2663.
Nakayama H., Bodi I., Maillet M., De Santiago J., Domeier T.L., Mikoshiba K., Lorenz J.N., Blatter L.A., Bers D.M., Molkentin J.D. 2010. The IP3 receptor regulates cardiac hypertrophy in response to select stimuli. Circ. Res. 107 (5), 659–666.
Wu X., Zhang T., Bossuyt J., Li X., McKinsey T.A., Dedman J.R., Olson E.N., Chen J., Brown J.H., Bers D.M. 2006. Local InsP3-dependent perinuclear Ca2+ signaling in cardiac myocyte excitation-transcription coupling. J. Clin. Invest. 116 (3), 675–682.
Kockskämper J., Seidlmayer L., Walther S., Hellenkamp K., Maier L.S., Pieske B. 2008. Endothelin-1 enhances nuclear Ca2+ transients in atrial myocytes through Ins(1,4,5)P3-dependent Ca2+ release from perinuclear Ca2+ stores. J. Cell. Sci. 121 (2), 186–195.
Ljubojevic S., Radulovic S., Leitinger G., Sedej S., Sacherer M., Holzer M., Winkler C., Pritz E., Mittler T., Schmidt A., Sereinigg M., Wakula P., Zissimopoulos S., Bisping E., Post H., Marsche G., Bossuyt J., Bers D.M., Kockskämper J., Pieske B. 2014. Early remodeling of perinuclear Ca2+ stores and nucleoplasmic Ca2+ signaling during the development of hypertrophy and heart failure. Circulation. 130 (3), 244–255.
Echevarría W., Leite M.F., Guerra M.T., Zipfel W.R., Nathanson M.H. 2003. Regulation of calcium signals in the nucleus by a nucleoplasmic reticulum. Nat. Cell. Biol. 5 (5), 440–446.
Ljubojevic S., Bers D.M. 2015. Nuclear calcium in cardiac myocytes. J. Cardiovasc. Pharmacol. 65 (3), 211–217.
Zima A.V., Bare D.J., Mignery G.A., Blatter L.A. 2007. IP3-dependent nuclear Ca2+ signalling in the mammalian heart. J. Physiol. 584 (2), 601–611.
Bossuyt J., Helmstadter K., Wu X., Clements-Jewery H., Haworth R.S., Avkiran M., Martin J.L., Pogwizd S.M., Bers D.M. 2008. Ca2+/calmodulin-dependent protein kinase IIdelta and protein kinase D overexpression reinforce the histone deacetylase 5 redistribution in heart failure. Circ. Res. 102 (6), 695–702.
Liang X., Xie H., Zhu P.H., Hu J., Zhao Q., Wang C.S., Yang C. 2009. Enhanced activity of inositol-1,4,5-trisphosphate receptors in atrial myocytes of atrial fibrillation patients. Cardiology. 114 (3), 180-191.
Yamada J., Ohkusa T., Nao T., Ueyama T., Yano M., Kobayashi S., Hamano K., Esato K., Matsuzaki M. 2002. Up-regulation of inositol 1,4,5-trisphosphate receptor expression in atrial tissue in patients with chronic atrial fibrillation. J. Cardiol. 39, 57–58.
Mangla A., Guerra M.T., Nathanson M.H. 2020. Type 3 inositol 1,4,5-trisphosphate receptor: A calcium channel for all seasons. Cell Calcium. 85, 102132.
Wei W., Huang W., Yue J. 2016. Requirement of IP3 receptor 3 (IP3R3) in nitric oxide induced cardiomyocyte differentiation of mouse embryonic stem cells. Exp. Cell Res. Actions. 346 (1), 9–16.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


