Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 1, стр. 3-19
Баланс двух ветвей РАС может препятствовать тяжелому течению COVID-19
Н. В. Бобкова *
Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”, Институт биофизики клетки РАН
142290 Московской обл., Пущино, Россия
* E-mail: nbobkova@mail.ru
Поступила в редакцию 13.08.2020
После доработки 09.09.2020
Принята к публикации 22.09.2020
Аннотация
Пандемия COVID-19 охватила весь мир и потребовала мобилизации усилий ученых и клиницистов во всем мире для борьбы с эти тяжелым недугом. Наряду с исследованиями вирологии SARS-CoV-2 особую значимость приобретает понимание фундаментальных физиологических процессов, молекулярно-клеточных механизмов и путей внутриклеточной сигнализации, лежащих в основе клинических проявлений COVID-19, знание которых важно для разработки эффективной терапии данного заболевания. В обзоре подробно рассмотрено взаимодействие компонентов ренин-ангиотензиновой системы (РАС) и рецепторов конечных гликозилированных продуктов (RAGE), которое играет особую роль в нормальной физиологии легких и в условиях патологии при COVID-19, вплоть до развития острого респираторного дистресс-синдрома и “цитокинового шторма”. Отдельный раздел посвящен знакомству читателя с новейшими разработками, направленными на коррекцию дисфункции РАС, вызываемой связыванием вируса с ангиотензин-конвертирующим энзимом 2 (ACE2) – центральным элементом этой системы. Анализ опубликованных теоретических, клинических и экспериментальных данных свидетельствует о необходимости комплексного воздействия для предотвращения тяжелого течения COVID-19 с использованием агонистов MasR, блокаторов AT1R и NF-kB сигнального пути, а также соединений с нейропротекторным и нейрорегенеративным действием.
ВВЕДЕНИЕ
Пандемия, вызванная новым штаммом коронавируса, которому Международный комитет по таксономии вирусов 11 февраля 2020 г. присвоил официальное название SARS-COV-2, охватила весь мир вследствие отсутствия эффективных способов профилактики, облегчения течения заболевания и снижения смертности [1, 2] По данным на начало октября 2020 года в мире умерло свыше 1.2 миллионов человек, а официально заболело более 35.2 миллионов. Смертность в США составила около 2.81%, в России – 1.43%. В Европейских странах, наиболее пострадавших от пандемии, погибло более 10% заболевших COVID-19. Глава ВОЗ Тедрос Аданом Гебрейесус считает, что в глобальном масштабе наблюдается ускорение распространения пандемии в мире [3, 4] В настоящее время ожидается “вторая волна” заражения и отмечено появление новых разновидностей данного вируса с повышенной вирулентностью. Поэтому остро стоит проблема разработки вакцин и новых эффективных фармакологических препаратов для лечения данного заболевания.
Основные симптомы COVID-19
Ранее сходные инфекционные заболевания возникали в 2002–2003 годах и в 2011 году, получившие названия Тяжелого острого респираторного синдрома (SARS) и Средневосточного респираторного синдрома (MERS), возбудителями которых были другие штаммы коронавирусов SARS-CoV и MERS-CoV соответственно. SARS-CoV-2 имеет высокое сходство с возбудителем SARS (79%). Наиболее распространенным клиническим проявлением нового варианта коронавирусной инфекции является двусторонняя пневмония, у 3–4% пациентов зарегистрировано развитие острого респираторного дистресс-синдрома, который у 75% таких больных сопровождается тромботической коагулопатией, а в терминальных стадиях развиваются тромбозы и “цитокиновый шторм”, характеризующийся системным выделением провоспалительных цитокинов: интерлейкинов ИЛ-2, ИЛ-6, ИЛ-7, гранулоцит колониестимулирующего фактора, хемокина 10 (CXCL10), хемокина лиганда 2 (CCL2) и фактора некроза опухолей-α (TNF-α), отмечается лейкопения, свидетельствующая о сниженном клеточном иммунитете [5, 6]. Изменение обоняния (гипосмия) или ухудшение вкуса наблюдаются у 15–30% больных на ранней стадии заболевания и может рассматриваться как один из диагностических признаков COVID-19 [7, 8].
Краткая характеристика SARS-CoV-2
Новый коронавирус SARS-CoV-2 представляет собой одноцепочечный РНК-содержащий вирус и относится к семейству Coronaviridae к линии Beta-CoV B. Он характеризуется высокой контагиозностью и в основном распространяется людьми с бессимптомным течением заболевания, которые составляют более 30% среди лиц с позитивным тестом на присутствие в организме вируса [9].
Основной первоначальной мишенью вируса является ангиотензин-конвертирующий энзим 2 (ACE2), локализованный на наружной мембране клеток во многих органах и тканях [10–12], хотя нельзя полностью исключить возможность его взаимодействия с другими рецепторами, такими как CD147, CD26, DPP4, TMPRSS2 [13–15].
Для проникновения в клетку SARS-CoV-2, как и вирус “атипичной пневмонии” SARS-CoV, использует S-белок, состоящий из двух субъединиц [16]. На S1 субъединице расположен сайт связывания вируса с N-концом внеклеточного домена ACE2 рецептора. S2 субъединица необходима для активации эндоцитоза и проникновения вируса в клетку хозяина. Вирус SARS-CoV-2 преимущественно взаимодействует с немногочисленными клетками в легких – пневмоцитами II типа, составляющими менее 10%, которые одновременно с ACE2 коэкспрессируют сериновую протеазу TMPRSS2, которая через взаимодействие с сайтом, находящимся на стыке S1/S2 субъединиц S-белка вируса, осуществляет праймирование другого сайта, локализованного на S2 субъединице и ответственного за ее протеолиз и проникновение вируса в клетку. Следует отметить, что для активации непосредственно этого сайта протеолиза требуется фуриновая протеаза хозяина, что является отличительной чертой SARS-CoV-2 [17, 18]. В настоящее время определена кристаллическая структура ACE2 молекулы и участка связывания c SARS-CoV-2 [12]. В большинстве случаев ACE2 находится в комплексе с внутриклеточным мембранным транспортером аминокислот BAT1 и существует в виде гетеродимера. Два таких комплекса, в свою очередь, формируют гомодимер. Его целостность обеспечивают взаимодействия одноименных участков двух молекул ACE2, к которым за счет полярных взаимодействий присоединяется S1 субъединица SARS-CoV-2 в районе участка, который не связан с протеазной активностью (протеазным доменом) ACE2, обеспечивающим в норме отрыв одного аминокислотного остатка от пептида ангиотензина II (ANGII, ANG1–8), включенного как и ACЕ2 в регуляторную ренин-ангиотензивную систему (РАС). При этом с одним ACE2 может быть связан тример вирусных белков, а с димером ACE2 соединено два тримера соответственно [12]. Вначале вирус поражает поверхностные бокаловидные клетки слизистой оболочки носа, языка и гортани; а затем пневмоциты типа II в легких, секретирующие сурфактант, который в норме препятствует слипанию альвеол и обладает выраженным противомикробным действием [19, 20]. Здесь уместно отметить, что активность протеаз, способствующих проникновению вируса в клетку хозяина, снижается при повышении pH во внеклеточной и внутриклеточной среде. Это, например, достигается при лечении Гидроксихлорохином или Хлорохином [21]. Поэтому логично, что во время пандемии СOVID-19 при отсутствии эффективных противовирусных препаратов и вакцины, в качестве профилактического средства целесообразна ингаляция парами 1% раствора гидрокарбоната натрия. Этим методом, не задумываясь о механизмах его действия, давно пользовались при различных респираторных, легочных инфекциях и гриппе, эмпирически доказав его эффективность [22]. Многочисленные АCE2 рецепторы также присутствуют на эндотелиальных клетках сосудов сердца и почек, на нейронах и глии, а также на энтероцитах, выстилающих тонкую кишку и участвующих в процессе всасывания питательных веществ. Усиление проницаемости стенки кишечника в результате воспаления, вызванного вирусом, сопровождается изменением микробиоты и попаданием вирусных частиц и токсинов в кровоток [23].
В настоящее время уже получены прямые доказательства присутствия SARS-CoV-2 в мозге у человека [20]. Диссеминация вируса в мозг может происходить как из системного кровотока в результате нарушения гематоэнцефалического барьера, так и непосредственно из носовой и ротовой полости по обонятельному и языкоглоточному нервам, а также по веточкам лицевого и блуждающего нервов. Проникновение вируса в головной мозг, богатый AСЕ2 рецепторами, расположенными на мембранах нейронов и глии, может приводить к нарушению мозговых функций [20, 24, 25]. Ранее в экспериментах на трансгенных мышах, несущих человеческий ген ACE2, была установлена возможность проникновения вируса SARS-CoV в мозг, поражение нейронов во многих мозговых структурах, включая и дыхательный центр, расположенный в продолговатом мозге. Причиной гибели этих животных была патология, сходная с острым респираторным дистресс-синдромом, развивающимся и при тяжелом течении COVID-19 у человека [26]. В связи с этим важно отметить, что нарушение дыхательной функции при COVID-19 может быть как следствием локального нарушения газообмена в альвеолах легких, так и нарушением работы дыхательного центра в мозге на поздних этапах развития инфекции [27–29]. Регуляция активности инспираторных нейронов в дыхательном центре в основном осуществляется хеморецепторами, которые очень чувствительны к увеличению уровня в крови CO2, Н+ и в значительно меньшей степени к O2. Эти факторы усиливают деятельность дыхательного центра, воздействуя на центральные и периферические хеморецепторы, что необходимо учитывать как при подключении больных COVID-19 к аппаратам искусственной вентиляции легких (ИВЛ), так и при снятии с них. Наблюдения за больными с COVID-19 свидетельствуют о развитии у них неврологических и психиатрических осложнений в виде инсультов, полинейропатий, депрессий, последствий посттравматического стресса. Высказываются предположения, что у переболевших COVID-19 могут развиться нейродегенеративные заболевания, включая болезнь Паркинсона и болезнь Альцгеймера [30–32]. В настоящее время установлено, что проникновение вируса в клетку вызывает усиление экспрессии генов, ответственных за синтез белков, связанных с апоптозом [33], что и приводит к гибели инфицированной клетки. Ранее нами было установлено, что повреждение обонятельной луковицы, первой мозговой структуры, связанной с обонятельным нервом, действительно может вызвать развитие нейродегенеративного процесса альцгеймеровского типа у животных, а интраназальное введение таких нейропротекторов, как белок теплового шока или YB-1, способно предотвратить гибель нейронов и защитить мозг от развития дегенерации [34–36].
Известно, что биология вируса во многом зависит от организма хозяина. Так, SARS-CoV-2 для своего внедрения в клетку и репликации, как уже указывалось ранее, использует целый ряд протеаз хозяина, включая катепсин L, катепсин B, трипсин, фактор X, эластазу, фурин и TMPRSS2 (трансмембранную сериновую протеазу 2), при этом сам факт связывания вируса с АСЕ2 влияет на эффективность экспрессии этого энзима, играющего существенную роль в защите ткани легких от повреждений [37–39]. Поэтому торможение синтеза вирусных белков или воздействие на механизмы репликации вируса через блокаду эндогенных протеаз может наносить вред организму хозяина, что выражается в тяжелых побочных реакциях при использовании ряда фармакологических средств [40–49]. В настоящее время наиболее эффективным препаратом для лечения COVID-19, по мнению ВОЗ, является Ремдесивир, созданный в США, который блокирует синтез РНК вируса путем торможения вирусной РНК-полимеразы, конкурируя за включение в ее молекулу с эндогенным ATP [50, 51]. В настоящее время основное внимание уделяется разработке вакцин, однако следует иметь в виду, что вакцина, являясь специфичной по отношению к данному вирусу, может оказаться неэффективной для предотвращения заражения другими вирусными инфекциями, даже родственными с SARS-CоV-19. Хорошие результаты дает метод, применявшийся еще в прошлом веке – введение сыворотки крови переболевших инфекцией людей [52]. К сожалению, только 30% такой сыворотки имеет достаточный титр противовирусных антител (IgG), необходимый для терапевтического эффекта. У значительной части носителей вирусной инфекции болезнь протекает бессимптомно, что свидетельствует о наличии в организме хозяина протекторных механизмов, активация которых способна нивелировать проявления заболевания, но не избавиться от носительства вируса. Хотя предполагается, что такую защитную функцию, прежде всего, выполняет неспецифический врожденный иммунитет [53], тем не менее в последнее время появились данные о важной роли состояния РАС [23, 38, 39, 54]. Однако в арсенале врачей практически отсутствуют препараты, влияющие на ACE2 – центральный рецептор связывания вируса и основной регулятор РАС. Даже возможность применения блокаторов ангиотензинового рецептора 1 (AT1R) у больных COVID-19 с гипертонией вызывала горячие дискуссии среди врачей [55–57].
Мы попытались восполнить недостающую информацию новыми данными о включении РАС в патогенез COVID-19 и возможных мишенях терапевтического воздействия.
Физиология РАС
В настоящее время уже установлено, что риском тяжелого течения COVID-19 является не столько сам возраст пациента, сколько так называемые возрастные заболевания, такие как гипертония, диабет, сердечно-сосудистые патологии, в развитии которых прямо или опосредованно задействована РАС и ACE2 рецептор [23]. Уже более 20 лет известно, что ACE2 представляет собой один из важнейших элементов РАС, которая обеспечивает поддержание гомеостаза путем регуляции взаимодействия сердечно-сосудистой и дыхательной систем, водно-солевого и углеводного обменов, а также регуляции кровяного давления [23]. На рис. 1 представлены основные элементы РАС и их регуляторы в норме и при заражении SARS-CoV-19.
Рис. 1.
Основные компоненты РАС. Слева – первая ветвь РАС; справа – вторая компенсаторная ветвь РАС. Прямоугольники – биологически активные ангиотензины и их рецепторы, овалы – конвертирующие их энзимы. AGT – ангиотензиноген, сывороточный глобулин, являющийся предшественником ANG I. ACE2 – ангиотензин-конвертирующий энзим 2, центральный регулятор баланса активности ветвей РАС, взаимодействующий с SARS-CoV-2 при СOVID-19.
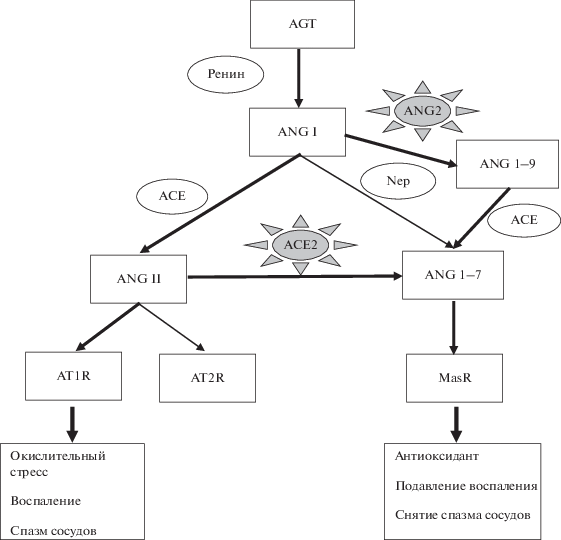
Классическая РАС состоит из двух ветвей, первая из которых включает ангиотензиноген/ренин/ANGI (ANG1–10)/ангиотензин-конвертирующий энзим (АСЕ)/ангиотензин II (ANGII, ANG1–8)/ангиотензиновый рецептор типа I (AT1R). В норме эта ветвь активирует центральные и периферические механизмы, ответственные за регуляцию кровяного давления. Однако именно ее активность ассоциируется с развитием различных патологий, включая фиброзы, воспаление, сердечно-сосудистую патологию, метаболический синдром, рак, старение, диабет, гипертонию [58]. Установлено, что ANGII, взаимодействуя с AT1R, активирует ERK1/2 (киназы, участвующие в трансдукции экстраклеточных сигналов) и p38 MAPK сигнальные пути, что приводит к снижению экспрессии гена ACE2 [59] и повышению активности ADAM17 путем фосфорилирования ее внутриклеточного домена [60, 61]. С активацией ADAM17 связывают и появление циркулирующей формы TNF-α с последующей индукцией воспаления [23, 62]. Если первая ветвь РАС известна уже более 100 лет, вторая ветвь, включающая ACE2/ANG1–7/MasR, открыта относительно недавно, и до сих пор некоторые аспекты ее функционирования остаются не до конца исследованными [63].
Активация второй ветви РАС оказывает действие, противоположное эффекту первой ветви РАС, и сопровождается снижением кровяного давления, противовоспалительными реакциями, активацией врожденного иммунитета и стимуляцией клеточной дифференцировки. ACE2 является ключевым ферментом, превращающим ANGII (ANG1–8) – лиганд AT1R, в ANG1–7 с последующей активацией MasR [64]. Следует указать, что существует и минорный шунтирующий путь, снижающий гиперактивацию первой ветви РАС, через связывание ANGII с ангиотензиновым рецептором второго типа (AT2R), опосредующим снижение кровяного давления, дилятацию сосудов. Однако плотность этого рецептора значительно уступает AT1R и резко снижается с возрастом. Учитывая все сказанное, следует с особой осторожностью относиться к разработке лекарственных средств против SARS-CoV-2, блокирующих и протеазный домен ACE2, что может существенно снизить эффективность “защитной” роли второй ветви РАС (ACE2/ANG1–7/MasR) и резко усилить связывание ANGII с AT1R, вызывая обострение течения всех сопутствующих патологий. С другой стороны, блокирование сайта связывания ACE2 на S-белке самого вируса может спровоцировать аллостерические модификации, обеспечивающие новую возможность связывания вирусного белка S c ACE2. Уже сейчас некоторые авторы предвидят возможность появления единичной мутации S-белка в позиции 501, что приведет к усилению способности вируса связываться с человеческим ACE2 с плохо прогнозируемыми последствиями [16].
Как уже указывалось, ACE2 широко распространен в организме и может существовать в двух формах – преимущественно связанной с мембраной монокарбоксипептидазы (120 кДа) и в виде циркулирующей свободной формы, состоящей из одного экстраклеточного домена, несущего сайт связывания с ANGII и участок взаимодействия с S-белком вируса. В образовании свободной формы участвует протеаза ADAM17. Важно отметить, что нокаутные ACE2−/− мыши развивали ряд показателей, характерных для COVID-19: окислительный стресс, нейтрофильную инфильтрацию, выброс провоспалительных цитокинов, активацию митоген активированной протеин киназы (МАРК) [65]. По-видимому, не сам вирус, а вызываемый им дисбаланс в активности двух ветвей РАС может являться одним из базовых механизмов развития патологии. В настоящее время ведутся ожесточенные споры о том, что же реально происходит с ACE2 рецептором у больных COVID-19. В экспериментах на животных, инфицированных вирусом, было выявлено снижение активности этого рецептора преимущественно в легких, но не в окружающих тканях, что также сопровождалось падением содержания ANG1–7 и повышением активности ANGII со всеми негативными последствиями его активации [23]. Умеренное снижение экспрессии гена ACE2 наблюдается и в клетках легких человека, инфицированных вирусом [66]. Одним из факторов большей подверженности заражению и более тяжелому течению болезни у людей пожилого возраста с сопутствующими патологиями может являться пониженный уровень этого рецептора в различных органах и тканях [67, 68]. Однако у перенесших COVID-19 пациентов не наблюдалось падение уровня этого рецептора в легких, а в исследованиях на тканях и клетках нечеловекообразных приматов и культуре клеток человека было обнаружено, что под влиянием вирусных инфекций происходит не снижение, а напротив, усиление экспрессия гена ACE2. Классическая схема формирования ответной реакции организма на внедрение вируса включает несколько этапов. Сначала вирусная РНК узнается эндосомальными РНК рецепторами хозяина, TLR3 и TLR7, а также цитозольным сенсором РНК, RIG-I/ MDA5, и активируется сигнальный каскад NF-κB и IRF3 с транслокацией этих транскрипционных факторов в ядро, стимуляцией экспрессии интерферонов 1 типа (альфа- и гамма-интерферонов) и выделением их во внеклеточную среду. Далее интерфероны взаимодействуют с мембранными рецепторами IFNAR, в результате чего активируется JAK-STAT система. Белки STAT1 и STAT2, фосфорилированные с участием JAK1 и TYK2 киназ, формируют комплекс с IRF9 и проникают в ядро, где стимулируют определенные гены (ISGs), при этом ответная реакция находится под контролем специального элемента ISRE, расположенного на промоторе этих генов. Предполагается, что чувствительный к стимулирующему действию интерферонов элемент расположен и на промоторе гена ACE2 человека [54]. Однако установлено, что коронавирусы вмешиваются в формирование защитной реакции организма как на этапе синтеза интерферонов, так и на этапе фосфорилирования STAT1. Первоначально задержанная стимуляция ISGs затем реализуется в гиперактивации экспрессии провоспалительных цитокинов [69]. Возможно, поэтому усиленное применение интерферонов на развитой фазе инфекции может сопровождаться как улучшением, так и ухудшением течения заболевания [54, 70, 71]. Перегрузка активированной системы интерферонов действительно может привести к “цитокиновому шторму” и необходимости использования супрессоров иммунной системы [72], включая антитела к провоспалительным цитокинам, таким как ИЛ-6 и TNF-α или их рецепторам [40] Важно отметить, что мышиный АСЕ2, хотя и и имеет 84%-ную идентичность со структурой человеческого ACE2, и его усиленная экспрессия, так же как и у человека, наблюдается в легких, сердце и почках [73], заражение мышей SARS-CоV-19 не происходит, и активация гена ACE2 не регулируется интерферонами, что свидетельствует о необходимости с осторожностью относиться к прямой трансляции данных, полученных на нетрансгенных мышиных клеточных моделях, на человека [54].
ANG1–7 является следующим компонентом второй ветви РАС, который впервые был открыт в мозге крысы в 1983 году [74], но его важность была доказана только 1988 году благодаря наличию гипотензивного и антипролиферативного эффектов, что было противоположно действию ANGII [75, 76]. В основном ANG1–7 превращается из ANGII c помощью ACE2, поскольку аффинность ACE2 к ANGII в 400 раз выше, чем к другим ангиотензинам [77]. Однако обнаружены, по меньшей мере, еще два минорных пути формирования ANG1–7, включающие ANG1/ ANG2/ANG1–9/ACE/неприлизин/ANG1–7 и ANGI/неприлизин/ANG1–7 [78]. В 2000 году был обнаружен эффект ANG1–7 на Na+, K+-ATP-азную активность, который при высоких концентрациях ANG1–7 сходен с действием ANGII и, по-видимому, опосредуется через A779-чувствительный рецептор, а не через MasR [79, 80]. Изменения в уровне циркулирующего ANG1–7 ассоциируются с хроническими тяжелыми заболеваниями, такими как гипертония, преэклампсия, заболевания миокарда, включая инфаркт миокарда, почечные заболевания, цирроз печени [77]. Также было установлено, что ANG1–7 понижает толерантность к глюкозе и усиливает чувствительность к инсулину, а его рецептор MasR рассматривается как компонент рецепторного инсулинового сигнального пути [81]. В экспериментах на мышах с церебральной ишемией ANG1–7 подавлял воспалительную реакцию через торможение NF-κB пути [82]. В число эффектов ANG1–7 входят подавление норадренергической нейропередачи, торможение апоптоза, усиление клеточной дифференцировки и антиоксидантное действие. Активация системы ANG1–7/MasR рекомендуется при инсульте [83]. Интересно отметить, что повышение соотношения уровней ACE/ACE2 сопровождалось острым респираторным дистресс-синдромом, который можно было предотвратить применением ANG1–7 или блокаторами АТ1R [84]. Для лечения COVID-19 также важна способность этого пептида препятствовать апоптозу альвеолярных эпителиальных клеток [85]. В мозге ANG1–7 оказывает нейропротекторное действие и стимулирует синаптогенез [86]. Восстановление обоняния у выздоровевших от COVID-19 людей, возможно, происходит за счет активации нейрогенеза и дифференцировкой нейрональных прогениторов, мигрирующих из субвентрикулярной зоны в обонятельную луковицу [87]. Однако широкое внедрение ANG1–7 в клиническую практику ограничено его быстрым разрушением в организме и, возможно, сложностью доставки в ткань легких и мозга при внутривенном его введении.
Действие ANG1–7 опосредовано через взаимодействие с MasR, который впервые был описан в 2003 году [63]. После связывания с лигандом MasR интернализуется в ранние эндосомы через механизм, опосредованный клатрином, а затем вновь встраивается в клеточную мембрану. MasR является классическим гептаспиральным рецептором, сопряженным с гетеротримерным Gαq/11-белком. Его взаимодействие с лигандом приводит к активации фосфолипазы С. Было установлено, что активация MasR оказывает противоположные эффекты с AT1R, с которым MasR формирует гетеродимер и, таким образом, блокирует его активность [88]. Активация MasR снижает экспрессию воспалительных генов и имеет протекторный эффект на эндотелиальные клетки, нейроны и гематоэнцефалический барьер. Связывание ANG1–7 с MasR стимулирует формирование окиси азота (NO), синтез арахидоновой кислоты, Akt и фосфорилированной ERK1/2. Недавно появились данные, что MasR может активироваться не только ANG1–7, но и другими соединениями, такими как Нейропептид FF, Аламандин, Ангиотензин III, Ангиотензин IV и Ангиопротектин. Агонисты MasR оказывают позитивное влияние в лечении хронической почечной недостаточности, приостанавливая развитие фиброза и воспаления в почках [89]. Интересно отметить, что все рецепторы РАС, включая и ACE2, расположены не только на внешней мембране клеток, но также имеют митохондриальную и ядерную локализацию [90]. Взаимодействует ли вирус с внутриклеточным ACE2, пока остается невыясненным.
Из представленных данных следует, что агонисты MasR могут нивелировать нарушения в РАС, вызываемые снижением уровня ACE2 рецептора при COVID-19, восстанавливать баланс в активности двух ветвей РАС и поэтому представляют перспективные соединения для разработки средств лечения этого заболевания.
Перспективные разработки лигандов MasR
В настоящее время наряду с ANG1–7 известны другие пептидные и неорганические лиганды MasR. Так, [Ala1]-ANG1–7 узнается MasR и вызывает вазодилятацию сосудов, [Pro1, Glu2]-ANGII присутствует в плазме крови человека и характеризуется высокой аффинностью к MasR [63, 90]. D-Ala7 ANG1–7 и D-Pro7 ANG1–7 являются антагонистами MasR и полностью блокируют активность ANG1–7 [63, 91]. В арсенале исследователей имеются и непептидные агонисты этого рецептора, такие как AVE 0991 и AR234960, которые оказывают противовоспалительное и противоапоптозное действие, а также снижают окислительный стресс через активацию сигнального пути MasR/PKA/CREB/UCP-2 [92]. Недостатком таких агонистов, как AR234960 и нейропептида NPFF, является быстрая десенситизация MasR и накопление внутриклеточного кальция [93]. Для лечения когнитивных нарушений и потери памяти, связанной с нейровоспалением, разработан агонист PNA5, являющийся гликозилированным ANG1–7 с заменой в седьмом положении аминокислотного остатка пролина на серин с присоединением глюкозы и образованием амидов на С-конце, который тормозит окислительный стресс в эндотелиальных клетках путем активации MasR. Для этого соединения характерна улучшенная биодоступность вследствие повышения проницаемости гематоэнцефалического барьера, что сопровождается увеличенной экспрессией и активацией MasR в мозге [94]. Высокая активация MasR отмечена при связывании с мономерами формулы FLGYCIYLNRKRRGDPAFKRRLRD (CGEN-856S) и SMCHRWSRAVLFPAAHRP (CGEN-857S), в которых аминокислотный остаток цистеина заменен на серин [95]. Увеличение экспрессии MasR в легких вызывает Лираглутид – агонист рецептора глюкагон-подобного пептида 1 [96]. В настоящее время на второй фазе клинических испытаний в качестве препарата против COVID-19 находится NCT01597635, рекомбинантный внеклеточный домен человеческого ACE2, который стимулирует экспрессию MasR и одновременно, взаимодействуя с вирусом, снижает его возможность связываться с мембранным ACE2 и поражать клетки [97].
Таким образом, для лечения COVID-19 и других вирусных инфекций, возбудители которых используют ACE2, для коррекции нарушений РАС предпочтение следует отдавать стойким аналогам ANG1–7, активирующим MasR, или стимуляции минорных путей, где центральным агентом является неприлизин (рис. 1).
Локальные и системная РАС
Хотя ранее РАС характеризовалась как единая эндокринная система, мишенями которой являются как центральные, так и периферические рецепторы, в настоящее время получены убедительные доказательства наличия РАС в отдельных органах и тканях, где она осуществляет влияние на локальную активность клеток и представлена внутриклеточными и внеклеточными компонентами [98, 99]. Так, в легочной ткани очень важная роль принадлежит компонентам второй ветви РАС: ACE2/ANG1–7/MasR, оказывающим защитное действие на легкие от различных повреждающих факторов [100]. В норме эти локальные системы функционируют относительно независимо, о чем косвенно свидетельствуют различия в содержании компонентов РАС от фентомолярных до наномолярных концентраций в разных органах и крайне низкие уровни ACE2 или ANG1–7 в крови [101, 102]. При ухудшении состояния хронических больных и, особенно в терминальных состояниях, отмечается повышенное системное содержание свободной внемембранной формы ACE2 [99, 103].
Подтверждением относительной независимости функционирования локальных РАС служат и данные, свидетельствующие, что при введении в почечную артерию агонистов MasR, AT1R или AT2R, отмечались только изменения функционирования почек, что не отражалось на сердечной деятельности или на уровне артериального давления [104]. Это обстоятельство необходимо учитывать при использовании системного введения лекарственных средств, призванных воздействовать на компоненты локальных РАС.
Как уже указывалось, локальные РАС участвуют в поддержании гомеостаза тканей и их регенерации после повреждения. При этом показано, что нарушения именно в локальных РАС приводят к таким дисфункциям, как атеросклероз, гипертрофия сердца, фиброз почек, диабет второго типа, резистентность к инсулину и ожирение [105]. Причем экспрессия компонентов РАС при таких патологиях чаще всего усиливается: возрастает уровень ангиотензиногена, активность ACE и уровень ANGII [106]. Поэтому ингибиторы ACE или же АТ1R показали свою эффективность и получили очень широкое распространение в терапии гипертонии, гипертрофии сердца, инфаркта миокарда, хронической сердечной недостаточности и диабетической нефропатии, легочной патологии. Особую роль дисбаланс локальной РАС, выражающийся в росте соотношения ANGII/ ANG1–7, играет в легких, вызывая острый респираторный дистресс-синдром с 30% летальностью. Повышенный локальный уровень ANGII в легких усиливает инфильтрацию иммунных клеток, которые в свою очередь увеличивают синтез провоспалительных цитокинов TNF-α, ИЛ-1, ИЛ-6. Важно отметить, что при связывании ANGII с AT1R, как и при взаимодействии ряда провоспалительных цитокинов со своими рецепторами, активируются JAK/STAT сигнальные пути [107, 108].
По мере развития заболевания поражаются эндотелиальные клетки микрососудов не только легких, но сердца, почек и кишечника. Связывание ANGII c AT1R приводит к активации р38 МАРК и NF-kB сигнальных путей наряду с гиперактивацией иммунной системы, что и вызывает “цитокиновый шторм” [109]. Сходная картина развития событий, начинающихся в легких, по-видимому, происходит и при COVID-19. Поэтому перспективными являются разработки блокаторов JAK (IJAK), которые одновременно предотвращают развитие эффектов активации AT1R и ряда провоспалительных цитокинов.
Данные по влиянию различных антигипертензивных соединений на содержания компонентов РАС свидетельствуют, что самым эффективным средством повышения ANG1–7 в плазме крови является рекомбинантная форма свободного ACE2 (табл. 1) [110]. Однако важно отметить, что данное соединение не прошло клинических испытаний, поскольку несмотря на наличие ожидаемых биохимических изменений, снижение кровяного давления отмечалось только у пациентов с исходно повышенным содержанием ANGII в плазме крови, при этом эффект достигался только при очень высоких концентрациях ACE2 [97].
Таблица 1.
Эффекты антигипертензивных средств на уровень вазоактивных пептидов в плазме
| Класс соединений | ANGI | ANGII | ANG1–7 |
|---|---|---|---|
| AR1B | ↑ | ↑↑ | ↑ |
| ACEi | ↑↑ | ↓ | ↑↑ |
| C-ACEi | ↑↑ | ↓ | ↑ |
| NEPi | ↑ | ↑ | ↓ |
| ACEi/NEPi | ↑↑ | ↓ | ↑ |
| ARNI | ↑ | ↑↑ | = |
| AGT-siRNA | ↓↓ | ↓↓ | ↓↓ |
| APAi | = | = | = |
| rhACE2 | ↑ | ↓↓ | ↑↑↑ |
Размышляя о биологии вирусов SARS-CoV и SARS-CoV-19, характеризующихся относительно других вирусных инфекций невысокой контагиозностью, но усиленной аффинностью к ACE2, и учитывая значительное число случаев с бессимптомным течением инфекции, можно полагать, что не сам вирус, а ответная реакция организма на его присутствие определяет характер и тяжесть течения заболевания. Следует заметить, что вирус поражает легкодоступные крупные железистые клетки, расположенные в дыхательных путях, с хорошо развитой системой синтеза самых различных соединений, входящих в состав вырабатываемого ими секрета. О нарушении секреции с начала заболевания свидетельствуют практически отсутствие насморка и сухой кашель. Впоследствии присоединяется нарушение альвеолярного дыхания, причинами которого могут быть как слипание альвеол из-за недостаточности сурфактанта, секретируемого пневмоцитами типа II и задействованного в газообмене, воспаление и активация бактериальной флоры, всегда присутствующей в дыхательных путях, а также нарушение водно-солевого обмена, нейтрофильная инфильтрация и т.д. Снижение уровня ACE2 в результате интернализации их комплекса с вирусом теоретически препятствовало бы дальнейшему распространению инфекции в организме данного хозяина. Но при попадании вируса в клетку отмечается стимуляция экспрессии гена ACE2 c задержанной умеренной активацией синтеза интерферонов – элементов врожденного иммунитета, наряду с появлением Т-лимфоцитов и активированных макрофагов. По-видимому, усиленный синтез ACE2 компенсирует его падение и не столь драматично отражается на функционировании второй ветви РАС и образовании ANG1–7. Процесс может протекать локально в легочной ткани и, возможно, в мозге, ограничиваясь обонятельной луковицей, являющейся мощным барьером на пути дальнейшего проникновения вирусов, микробов и других вредных соединений в разные структуры мозга [88]. Сохранности мембранного АСЕ2 способствует и возможность распространение именно SARS-CoV-2 путем слияния пораженных клеток со здоровыми и образования синтиция, благодаря взаимодействию фуриновой протеазы с сайтом на S2 субъединице S-белка вируса [17]. По-видимому, указанные механизмы позволяют инфекции длительное время протекать локально и бессимптомно без поражения многих систем организма, где обнаружены ACE2 рецепторы даже в большем количестве по сравнению с легкими – сердце, сосудах, почках, кишечнике, нейронах мозга. Однако у пожилых людей с сопутствующими патологиями на фоне уже сниженного содержания ACE2 в легких поражаются не только относительно малочисленные пневмоциты типа II (менее 3.6%) и цилиарные клетки (около 8%), коэкспрессирующие одновременно ACE2 и TMPRSS2, но и соседние пневмоциты I и II типов, несущие одиночные рецепторы ACE2 [19]. Клинические данные свидетельствуют и об образовании синтиция [14]. Такой неблагоприятный сценарий развития событий быстро приводит к развитию острого респираторного дистресс-синдрома, характеризующегося выраженным воспалением, окислительным стрессом и отеком, свидетельствующим о нарушении баланса жидкости в легких. Вряд ли причиной столь серьезного осложнения является только нарушение выделения сурфактанта пневмоцитами типа II, поскольку вирус поражает, как указывалось выше, относительно небольшое число этих клеток, а серьезные поражения легочной ткани отмечаются даже у лиц с относительно легким течением заболевания. В связи с этим возникло предположение, что при COVID-19 не только ослаблена деятельность второй компенсаторной ветви РАС, но в результате активации АТ1R задействован дополнительный механизм, опосредованный через рецептор конечных гликозилированных продуктов (RAGE), участвующий в развитии острого респираторного дистресс-синдрома [111].
Роль RAGE в патогенезе COVID-19
Известно, что RAGE является полифункциональным рецептором с многочисленными лигандами, имеющими сайты связывания как на экстраклеточных, так и на внутриклеточном домене [112, 113]. RAGE участвует в патогенезе многих тяжелых хронических заболеваний, включая и легочные патологии, связанные с нарушением баланса жидкости и воспалением [114–116]. В легких RAGE локализован на многочисленных альвеолярных пневмоцитах I типа (95–98% всех альвеолярных клеток), ответственных за газообмен между воздухом в альвеолах и кровью в легочных капиллярах [117], но встречается также и на мембранах пневмоцитов II типа [118]. В молодом здоровом организме фоновая экспрессия RAGE незначительна, за исключением ткани легких, где этот рецептор ответствен за баланс ионов в тканевой жидкости и за регуляцию окислительно-восстановительного потенциала. Известно, что посредством окисления свободных тиолов (например, группы SH) происходит образование дисульфидов. Тиоредоксин 1 восстанавливает дисульфидные связи белков в реакции тиол-дисульфидного обмена, при этом тиоловые группы тиоредоксина окисляются, а их восстановление происходит посредством окислительно-восстановительной реакции с тиоредоксин-редуктазой. Цикл окисления и последующего восстановления служит молекулярным переключателем для регулирования физиологической функции белков и для поддержания гомеостаза, а нарушение этого процесса приводит к окислительному стрессу [119]. В экспериментах на эпителиальных клетках альвеол показано, что связывание RAGE с лигандами сопровождалось усилением окисления белков, а нокдаун RAGE, вызванный siРНК, приводил к увеличению свободных SH-групп и к снижению экспрессии антиоксидантных энзимов, таких как супероксид-дисмутазы 1, тиоредоксина и белка 17, содержащего домен тиоредоксина [120]. Интересно отметить, что на моделях поражения легких у грызунов позитивный эффект оказывали соединения с дисульфидной связью, под влиянием которых снижалась интенсивность окислительного стресса и выраженность воспалительной реакции [121, 122]. В настоящее время ингаляции тиосульфатом натрия (Na2S2O3) предложены для лечения пораженных легких при COVID-19 [123]. При COVID-19 даже при локальном поражении РАС в легких наблюдается повышение уровня ANG II и активация его рецептора AT1R с последующей трансактивацией цитозольного домена RAGE и активацией сигнального пути NF-κB, приводящего к экспрессии провоспалительных генов [124], генов AT1R и RAGE.
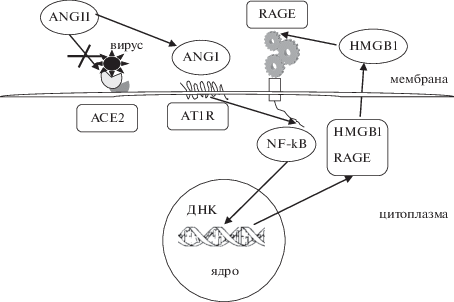
По мере прогрессирования воспалительного процесса и разрушения эпителиального барьера в альвеолах повышенная экспрессия RAGE наблюдается в эндотелиальных клетках и гладкомышечных клетках сосудов, что сопровождается повышением их проницаемости [125, 126]. Для многочисленных эндотелиальных клеток описан несколько другой механизм активации RAGE при взаимодействии ANG II с ATIR, дополнительно включающий экспрессию гена одного из основных эндогенных лигандов RAGE – high mobility group box 1 (HMGB1). Являясь негистоновым ядерным протеином, преимущественно локализованным в ядре, он может выделяться в межклеточное пространство и взаимодействовать с RAGE, повторно запуская активацию NF-κB сигнального пути, реализуя схему последовательной активации: ANGII/ATIR/NF-κB/HMGB1/RAGE [127]. Благодаря наличию положительной обратной связи между активностью AT1R, экспрессией RAGE и его активацией, происходит дальнейшее развитие локального патологического процесса с переходом на системный уровень и поражением сосудов сердца, почек и кишечного тракта. Важно отметить, что центральная роль в патологической взаимосвязи AT1R и RAGE принадлежит NF-κB сигнальному пути [128], блокада активности элементов которого возможна с использованием ингибиторов адаптерных белков путем стабилизации белковых комплексов для удержания их в цитоплазме, а также через ингибирование фактора транскрипции, что в эксперименте имеет выраженный терапевтический эффект [129]. На рис. 2 представлены пути возможного взаимодействия РАС и RAGE, что необходимо учитывать при разработке подходов к лечению COVID-19.
Рис. 2.
Схема возможного взаимодействия РАС и RAGE сигнальных путей. Связывание вируса с ACE2 приводит к увеличению уровня ANGII, его взаимодействию с AT1R с последующей трансактивацией цитозольного домена RAGE и активацией NF-κB сигнального пути, стимулирующего экспрессию провоспалительных генов, включая RAGE и одного из центральных лигандов RAGE – HMGB1, который при выходе из клетки взаимодействует с внеклеточным доменом RAGE и вновь запускает процесс, опосредованный активацией NF-κB.
В настоящее время пока нет объяснений, почему дети редко заболевают COVID-19, но если болезнь все-таки развивается и уже получила специальное название “Педиатрический мультисистемный воспалительный синдром” (PMIS), потенциально ассоциированный с COVID-19, то имеет симптоматику, сходную с болезнью Кавасаки, при которой погибают эндотелиальные клетки сосудов сердца и кишечного тракта. В модели этого заболевания на грызунах было выявлено, что апоптоз и некроз этих клеток вызывается активацией сигнального пути HMGB1/RAGE/ cathepsin B [130].
Таким образом, прогрессирование COVID-19 обусловлено переходом от локального нарушения РАС в легких к ее системному дисбалансу с гиперактивацией первой ветви и образованием ANGII, AT1R и RAGE. Многие авторы указывают, что активация синтеза ACE2 может, с одной стороны, вызвать активацию ANG1–7/MasR, но с другой стороны, одновременно увеличить возможность вируса проникать в клетки. Создается впечатление, что только активация локальной ANG1–7/MasR системы наряду с блокадой AT1R и NF-κB сигнальных путей позволят восстановить баланс РАС и предотвратить негативный сценарий развития COVID-19.
ЗАКЛЮЧЕНИЕ
В обзоре представлены различные механизмы SARS-CoV-2 инфекции с акцентом на влияние вируса на функционирование ренин-ангиотензиновой системы (РАС) – важнейшей системы в организме, участвующей в регуляции деятельности сердца, сосудов, мозга, почек, кишечника и особенно легких. Дисбаланс РАС вызывает острый респираторный дистресс-синдром и “цитокиновый шторм” – характерные признаки тяжелого течения COVID-19. Использование фармакологических субстанций, восстанавливающих РАС, столь же перспективно, как и таргетирование самого вируса. Однако для нормализации РАС необходимо более комплексное воздействие, включающее активацию MasR наряду с блокадой AT1R и NF-kB сигнального пути. Важно отметить, что такое лечение, основанное на знании молекулярно-клеточных механизмов развития заболевания, применимо в отношении любых вирусов, использующих для своего внедрения в клетку ACE2 рецептор. В обзоре сознательно не освещен вопрос о роли иммунной системы в патогенезе данной вирусной инфекции, хотя имеется ряд прекрасных обзоров, посвященных этому вопросу [131, 132]. Терапевтическое воздействие на вирусную инфекцию может оказать непредсказуемое влияние на ответную реакцию дисфункциональной иммунной системы больного, от состояния которой зависит тяжесть протекания COVID-19, что важно учитывать при разработке вакцин и проведении иммунотерапии. Очевидно, что открытие механизмов бессимптомного носительства вируса и коррекция ответной реакции организма на внедрение вируса помогут не только справиться с данной пандемией, но и окажутся эффективными при других инфекционных заболеваниях.
Работа выполнена при поддержке гранта РНФ № 18-15-00392. Автор выражает сердечную благодарность Марии Дюпонт за помощь в обсуждении особенностей биологии SARS-CoV-2.
Список литературы
Lu R., Zhao X., Li J., Niu P., Yang B., Wu H., Wang W., Song H., Huang B., Zhu N., Bi Y., Ma X., Zhan F., Wang L., Hu T., Zhou H., Hu Z., Zhou W., Zhao L., Chen J., Meng Y., Wang J., Lin Y., Yuan J., Xie Z., Ma J., Liu W.J., Wang D., Xu W., Holmes E.C., Gao G.F., Wu G., Chen W., Shi W., Tan W. 2020. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 395, 565–574. https://doi.org/10.1016/S0140-6736(20)30251-8
Paules C.I., Marston H.D., Fauci A.S. 2020. Coronavirus infections – more than just the common cold. JAMA. 323 (8), 707–708. https://doi.org/10.1001/jama.2020.0757
Данные по заразившимся коронавирусом на начало октября 2020 года. https://www.google.com/search?client=firefox-b-d&q=статистика + + по + коронавирусу + в + мире
El-Aziz T.M.A., Stockand J.D. 2020. Recent progress and challenges in drug development against COVID-19 coronavirus (SARS-CoV-2) – an update on the status. Infect. Genet. Evol. 83, 104 327.
Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y., Zhang L., Fan G., Xu J., Gu X., Cheng Z., Yu T., Xia J., Wei Y., Wu W., Xie X., Yin W., Li H., Liu M., Xiao Y., Gao H., Guo L., Xie J., Wang G., Jiang R., Gao Z., Jin Q., Wang J., Cao B. 2020. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 395, 497–506.
Barrett C.D., Moore H.B., Moore E.E., McIntyre R.C., Moore P.K., Burke J., Hua F., Apgar J., Talmor D.S., Sauaia A., Liptzin D.R., Veress L.A., Yaffe M.B. 2020. Fibrinolytic therapy for refractory COVID-19 acute respiratory distress syndrome: Scientific rationale and review. Res. Pract. Thromb. Haemost. 4 (4), 524–531. https://doi.org/10.1002/rth2.12357
Mao L., Jin H., Wang M., Hu Y., Chen S., He Q., Chang J., Hong C., Zhou Y., Wang D., Miao X., Li Y., Hu B. 2020. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol. 77 (6), 1–9. 1127.https://doi.org/10.1001/jamaneurol
Gelardi M., Trecca E., Cassano M., Ciprandi G. 2020. Smell and taste dysfunction during the COVID-19 outbreak: A preliminary report. Acta Biomed. 91 (2), 230–231. https://doi.org/10.23750/abm.v91i2.9524
Qiu J. 2020. Covert coronavirus infections could be seeding new outbreaks. Nature. https://doi.org/10.1038/d41586-020-00822-x
Zhou P., Yang X.L., Wang X.G., Hu B., Zhang L., Zhang W., Si H.R., Zhu Y., Li B., Huang C.L., Chen H.D., Chen J., Luo Y., Guo H., Jiang R.D., Liu M.Q., Chen Y., Shen X.R., Wang X., Zheng X.S., Zhao K., Chen Q.J., Deng F., Liu L.L., Yan B., Zhan F.X., Wang Y.Y., Xiao G.F., Shi Z.L. 2020. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 579, 270–273. https://doi.org/10.1038/s41586-020-2012-7
Hoffmann M., Kleine-Weber H., Schroeder S., Krüger N., Herrler T., Erichsen S., Schiergens T.S., Herrler G., Wu N.H., Nitsche A., Müller M.A., Drosten C., Pöhlmann S. 2020. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically-proven protease inhibitor. Cell. 181 (2), 271–280. https://doi.org/10.1016/j.cell.2020.02.052
Wrapp D., Wang N., Corbett K.S., Goldsmith J.A., Hsieh C.L., Abiona O., Graham B.S., McLellan J.S. 2020. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 367 (6483), 1260–1263. https://doi.org/10.1126/science.abb2507
Li Y., Zhang Z., Yang L., Lian X., Xie Y., Li S., Xin S., Cao P., Lu J. 2020. The MERS-CoV receptor DPP4 as a candidate binding target of the SARS-CoV-2 spike. iScience. 23 (6), 101 160. https://doi.org/10.1016/j.isci.2020.101160
Lukassen S., Chua R.L., Trefzer T., Kahn N.C., Schneider M.A., Muley T., Winter H., Meister M., Veith C., Boots A.W., Hennig B.P., Kreuter M., Conrad C., Eils E. 2020. SARS-CoV-2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchial transient secretory cells. EMBO J. 39 (10), e105114. https://doi.org/10.15252/embj.20105114
Vankadari N., Wilce J.A. 2020. Emerging WuHan (COVID-19) coronavirus: Glycan shield and structure prediction of spike glycoprotein and its interaction with human CD26. Emerg. Microb. Infect. 9, 601–604. https://doi.org/10.1080/22221751.2020.1739565
Wan Y., Shang J., Graham R., Baric R.S., Li F. 2020. Receptor recognition by the novel coronavirus from Wuhan: An analysis based on decade-long structural studies of SARS coronavirus. J. Virol. 94 (7), e00127-20. https://doi.org/10.1128/JVI.00127-20
Hoffmann M., Kleine-Weber H., Pöhlmann S. 2020. A multibasic cleavage site in the spike protein of SARS-CoV-2 is essential for infection of human lung cells. Mol. Cell. 78 (4), 779–784. https://doi.org/10.1016/j.molcel.2020.04.022
Coutard B., Valle C., de Lamballerie X., Canard B., Seidah N.G., Decroly E. 2020. The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade. Antiviral Res. 176, 104742.https://doi.org/10.1016/j.antiviral.104742
García-Fojeda B., González-Carnicero Z., de Lorenzo A., Minutti C.M., de Tapia L., Euba B., Iglesias-Ceacero A., Castillo-Lluva S., Garmendia J., Casals C. 2019. Lung surfactant lipids provide immune protection against haemophilus influenzae respiratory infection. Front. Immunol. 10, 458. https://doi.org/10.3389/fimmu.2019.00458
Buzhdygan T.P., DeOre B.J., Baldwin-Leclair A., McGary H., Razmpour R, Galie P.A., Potula R., Andrews A.M., Ramirez S.H. 2020. The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in vitro models of the human blood-brain barrier. Neurobiol. Dis. 146, 105131. https://doi.org/10.1016/j.nbd.2020.105131
Vincent M.J., Bergeron E., Benjannet S., Erickson B.R., Rollin P.E., Ksiazek T.G., Seidah N.G., Nichol S.T. 2005. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread. Virol. J. 2, 69. https://doi.org/10.1186/1743-422X-2-69
Dobay O., Laub K., Stercz B., Kéri A., Balázs B., Tóthpál A., Kardos S., Jaikumpun P., Ruksakiet K. Quinton P.M, Zsembery Á. 2018. Bicarbonate inhibits bacterial growth and biofilm formation of prevalent cystic fibrosis pathogens. Front. Microbiol. 9, 2245. https://doi.org/10.3389/fmicb.2018.02245
Gheblawi M., Wang K., Viveiros A., Nguyen Q., Zhong J.C., Turner A.J., Raizada M.K., Grant M.B., Oudit G.Y. 2020. Angiotensin-converting enzyme 2: SARS-CoV-2 receptor and regulator of the renin-angiotensin system: Celebrating the 20th anniversary of the discovery of ACE2. Circ. Res. 126 (10), 1456–1474. https://doi.org/10.1161/CIRCRESAHA.120.317015
Chigr F., Merzouki M., Najimi M. 2020. Autonomic brain centers and pathophysiology of COVID-19. ACS Chem. Neurosci. 11 (11), 1520–1522. https://doi.org/10.1021/acschemneuro.0c00265
Orsucci D., Ienco E.C., Nocita G., Napolitano A., Vista M. 2020. Neurological features of COVID-19 and their treatment. Drugs Context. 9, 2020-5-1. eCollection 2020.https://doi.org/10.7573/dic.2020-5-1
Netland J., Meyerholz D.K., Moore S., Cassell M., Perlman S. 2008. Severe acute respiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2. J. Virol. 82 (15), 7264–7275. https://doi.org/10.1128/JVI.00737-08
Li Y.C., Bai W.Z., Hashikawa T.J. 2020. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. Med. Virol. 92 (6), 552–555. https://doi.org/10.1002/jmv.25728
Tassorelli C., Mojoli F., Baldanti F., Bruno R., Benazzo M. 2020. COVID-19: What if the brain had a role in causing the deaths? Eur. J. Neurol.https://doi.org/10.1111/ene.14275
Dziewas R., Warnecke T., Zürcher P., Schefold J.C. 2020. Dysphagia in COVID-19 –multilevel damage to the swallowing network? Eur J Neurol.https://doi.org/10.1111/ene.14367
Montalvan V., Lee J., Bueso T., De Toledo J., Rivas K. 2020. Neurological manifestations of COVID-19 and other coronavirus infections: A systematic review. Clin. Neurol. Neurosurg. 194, 105 921. https://doi.org/10.1016/j.clineuro.2020.105921
Serrano-Castro P.J., Estivill-Torrús G., Cabezudo-García P., Reyes-Bueno J.A., Ciano Petersen N., Aguilar-Castillo M.J., Suárez-Pérez J., Jiménez-Hernández M.D., Moya-Molina M.Á., Oliver-Martos B., Arrabal-Gómez C., de Fonseca F. R. 2020. Impact of SARS-CoV-2 infection on neurodegenerative and neuropsychiatric diseases: A delayed pandemic? Neurología (English Edition). 35 (4), 14 021–14 027. https://doi.org/10.1016/j.nrleng.2020.04.002
Iroegbu J.D., Ifenatuoha C.W., Ijomone O.M. 2020. Potential neurological impact of coronaviruses: Implications for the novel SARS-CoV-2. Neurol Sci. 41 (6), 1329–1337. https://doi.org/10.1007/s10072-020-04469-4
Guzzi P.H., Mercatelli D., Ceraolo C., Giorgi F.M. 2020. Master regulator analysis of the SARS-CoV-2/ human interactome. J. Clin. Med. 9, 982–997. ).https://doi.org/10.3390/jcm9040982
Gulyaeva N.V., Bobkova N.V., Kolosova N.G., Samokhin A.N., Stepanichev M.Y., Stefanova N.A. 2017. Molecular and cellular mechanisms of sporadic Alzheimer’s disease: Studies on rodent models in vivo. Biochem. (Mosc). 82 (10), 1088–1102. https://doi.org/10.1134/S0006297917100029
Bobkova N.V., Lyabin D.N., Medvinskaya N.I., Samokhin A.N., Nekrasov P.V., Nesterova I.V., Aleksandrova I.Y., Tatarnikova O.G., Bobylev A.G., Vikhlyantsev I.M., Kukharsky M.S., Ustyugov A.A., Polyakov D.N., Eliseeva I.A., Kretov D.A., Guryanov S.G., Ovchinnikov L.P. 2015. The Y-Box binding protein 1 suppresses Alzheimer’s disease progression in two animal models. PLoS One. 10 (9). e0138867. https://doi.org/10.1371/journal.pone.0138867
Evgen’ev M.B., Krasnov G.S., Nesterova I.V., Garbuz D.G., Karpov V.L., Morozov A.V., Snezhkina A.V., Samokhin A.N., Sergeev A., Kulikov A.M., Bobkova N.V. 2017. Molecular mechanisms underlying neuroprotective effect of intranasal administration of human Hsp70 in mouse model of Alzheimer’s disease. J. Alz. Dis. 59 (4), 1415–1426. https://doi.org/10.3233/JAD-170398
Millet J.K., Whittaker G.R. 2015. Host cell proteases: critical determinants of coronavirus tropism and pathogenesis. Virus. Res. 202, 120–134. https://doi.org/10.1016/j.virusres.2014.11.021
Imai Y., Kuba K., Rao S., Huan Y., Guo F., Guan B., Yang P., Sarao R., Wada, T., Leong-Poi H., Crackower M.A., Fukamizu A., Hui C.C., Hein L., Uhlig S., Slutsky A.S., Jiang C., Penninger J.M. 2005. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature. 436 (7047), 112–116. https://doi.org/10.1038/nature03712
Kuba K., Imai Y., Rao S., Gao H., Guo F., Guan B., Huan Y., Yang P., Zhang Y., Deng W., Bao L., Zhang B., Liu G., Wang Z., Chappell M., Liu Y., Zheng D., Leibbrandt A., Wada T., Slutsky A.S., Liu D., Qin C., Jiang C., Penninger J.M. 2005. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat. Med. 11 (8), 875–879. https://doi.org/10.1038/nm1267
Методические рекомендации Минздрава России “Профилактика, диагностика и лечение новой коронавирусной инфекции COVID-19” (вер. 6 от 28.04.2020)
Colson P., Rolain J.M., Lagier J.C., Brouqui P., Raoult D. 2020. Chloroquine and hydroxychloroquine as available weapons to fight COVID-19. Int. J. Antimicrob. Agents. 55 (4), 105 932. https://doi.org/10.1016/j.ijantimicag.2020.105932
Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y., Zhang L., Fan G., Xu J., Gu X., Cheng Z., Yu T., Xia J., Wei Y., Wu W., Xie X., Yin W., Li H., Liu M., Xiao Y., Gao H, Guo L., Xie J., Wang G., Jiang R., Gao Z., Jin Q., Wang J., Cao B. 2020. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 395 (10223), 497–506. https://doi.org/10.1016/S0140-6736(20)30183-5
Dayer M.R., Taleb-Gassabi S., Dayer M.S. 2017. Lopinavir; a potent drug against coronavirus infection: Insight from molecular docking study. Arch. Clin. Infect. Dis. 12 (4), 13823. https://doi.org/0.5812/archcid.13823
Lu H. 2020. Drug treatment options for the 2019-new coronavirus (2019-nCoV). Biosci. Trends. 14 (1), 69–71. https://doi.org/10.5582/bst.2020.01020
Hart B.J., Dyall J., Postnikova E., Zhou H., Kindrachuk J., Johnson R.F., Olinger G.G., Frieman M.B., Holbrook M.R., Jahrling P.B., Hensley L. 2014. Interferon-β and mycophenolic acid are potent inhibitors of Middle East respiratory syndrome coronavirus in cell-based assays. J. Gen. Virol. 95 (Pt 3), 571–577. https://doi.org/10.1099/vir.0.061911-0
Barlow A., Landolf K.M., Barlow B., Yeung S.Y.A., Heavner J.J., Claassen C.W., Heavner M.S. 2020. Review of emerging pharmacotherapy for the treatment of coronavirus disease 2019. Pharmacother. 40 (5), 416–437. https://doi.org/10.1002/phar.2398
Wang Y., Jiang W., He Q., Wang C., Wang B., Zhou P., Dong N., Tong Q. 2020. A retrospective cohort study of methylprednisolone therapy in severe patients with COVID-19 pneumonia. Signal. Transduct. Target. Ther. 5, 57. https://doi.org/10.1038/s41392-020-0158-2
Randomised Evaluation of COVID-19 Therapy (RECOVERY). 2020. Low-cost dexamethasone reduces death by up to one third in hospitalised patients with severe respiratory complications of COVID-19. 2020. Available at: https://www.recoverytrial.net/news/low-cost-dexamethasone-reduces-death- by-up-to-one-third-in-hospitalised-patients-with-severe-respiratory-complications-of-covid-19. Accessed June 23, 2020.
Richardson P., Griffin I., Tucker C., Smith D., Oechsle O., Phelan A., Rawling M., Savory E., Stebbing J. 2020. Baricitinib as potential treatment for 2019-nCoV acute respiratory disease. Lancet. 395 (10 223), e30–e31. https://doi.org/10.1016/S0140-6736(20)30304-4
de Wit E., Feldmann F., Cronin J., Jordan R., Okumura A., Thomas T., Scott D., Cihlar T., Feldmann H. 2020. Prophylactic and therapeutic remdesivir (GS-5734) treatment in the rhesus macaque model of MERS-CoV infection. Proc. Natl. Acad. Sci. U S A. 117 (12), 6771–6776. https://doi.org/10.1073/pnas.1922083117
Pardo J., Shukla A.M., Chamarthi G., Gupte A. 2020. The journey of remdesivir: From Ebola to COVID-19. Drugs. Context. 9, 2020-4-14. https://doi.org/10.7573/dic.2020-4-14
Mair-Jenkins J., Saavedra-Campos M., Baillie J.K., Cleary P., Khaw F.M., Lim W.S., Makki S, Rooney K.D., Nguyen-Van-Tam J.S., Beck C.R. Convalescent plasma study group. 2015. The effectiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: A systematic review and exploratory meta-analysis. J. Infect. Dis. 211 (1), 80–90. https://doi.org/10.1093/infdis/jiu396
Iwasaki A., Pillai P.S. 2014. Innate immunity to influenza virus infection. Nat. Rev. Immunol. 14 (5), 315–328. https://doi.org/10.1038/nri3665
Ziegler C.G.K., Allon S.J., Nyquist S.K., Mbano I.M., Miao V.N., Tzouanas C.N., Cao Y., Yousif A.S., Bals J., Hauser B.M., Feldman J., Muus C., Wadsworth M.H., Kazer S.W., Hughes T.K., Doran B., Gatter G.J., Vukovic M., Taliaferro F., Mead B.E., Guo Z., Wang J.P., Gras D., Plaisant M., Ansari M., Angelidis I., Adler H., Sucre J.M.S., Taylor C.J., Lin B., Waghray A., Mitsialis V., Dwyer D.F., Buchheit K.M., Boyce J.A., Barrett N.A., Laidlaw T.M., Carroll S.L., Colonna L., Tkachev V., Peterson C.W., Yu A., Zheng H.B., Gideon H.P., Winchell C.G., Lin P.L., Bingle C.D., Snapper S.B., Kropski J.A., Theis F.J., Schiller H.B., Zaragosi L.E., Barbry P., Leslie A., Kiem H.P., Flynn J.L., Fortune S.M., Berger B., Finberg R.W., Kean L.S., Garber M., Schmidt A.G., Lingwood D., Shalek A.K., Ordovas-Montanes J. 2020. SARS-CoV-2 Receptor ACE2 Is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues. Cell. 181 (5), 1016–1035.e19. https://doi.org/10.1016/j.cell.2020.04.035
Fang L., Karakiulakis G., Roth M. 2020. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? Lancet Respir. Med. 8 (4), E21. https://doi.org/10.1016/S2213-2600(20)30116-8
Liu P.P., Blet A., Smyth D., Li H. 2020. The Science underlying COVID-19: Implications for the cardiovascular system. Circulation. 142 (1), 68–78. https://doi.org/10.1161/CIRCULATIONAHA.120.047549
Liu Y., Huang F., Xu J., Yang P., Qin Y., Cao M., Wang Z., Li X., Zhang S., Ye L., Lu J., Wei J., Xie T., Gao H., Xu K.-F., Wang F., Liu L., Jang C. 2020. Anti-hypertensive Angiotensin II receptor blockers associated to mitigation of disease severity in elderly COVID-19 patients. medRxiv 2020.2003.2020.20039586.).https://doi.org/10.1101/2020.03.20.20039586
Kreutz R., Algharably E.A.E., Azizi M., Dobrowolski P., Guzik T., Januszewicz A., Persu A., Prejbisz A., Riemer T.G., Wang J.G., Burnier M. 2020. Hypertension, the renin-angiotensin system, and the risk of lower respiratory tract infections and lung injury: Implications for COVID-19. Cardiovasc. Res. 116 (10), 1688–1699. cvaa097.https://doi.org/10.1093/cvr/cvaa097
Koka V., Huang X.R., Chung A.C., Wang W., Truong L.D., Lan H.Y. 2008. Angiotensin II up-regulates angiotensin I-converting enzyme (ACE), but down-regulates ACE2 via the AT1-ERK/p38 MAP kinase pathway. Am. J. Pathol. 172 (5), 1174–1183. https://doi.org/10.2353/ajpath.2008.070762
Patel V.B., Clarke N., Wang Z., Fan D., Parajuli N., Basu R., Putko B., Kassiri Z., Turner A.J., Oudit G.Y. 2014. Angiotensin II induced proteolytic cleavage of myocardial ACE2 is mediated by TACE/ADAM-17: A positive feedback mechanism in the RAS. J. Mol. Cell. Cardiol. 66, 167–176. https://doi.org/10.1016/j.yjmcc.2013.11.017
Scott A.J., O’Dea K.P., O’Callaghan D., Williams L., Dokpesi J.O., Tatton L., Handy J.M., Hogg P.J., Takata M. 2011. Reactive oxygen species and p38 mitogen-activated protein kinase mediate tumor necrosis factor α-converting enzyme (TACE/ADAM-17) activation in primary human monocytes. J. Biol. Chem. 286 (41), 35466–35476. https://doi.org/10.1074/jbc.M111.277434
Chappell M.C. 2016. Biochemical evaluation of the renin-angiotensin system: The good, bad, and absolute? Am. J. Physiol. Heart. Circ. Physiol. 310 (2), H137–H152. https://doi.org/10.1152/ajpheart.00618.2015
Santos R.A.S., Simoes e Silva A.C., Maric C., Silva D.M.R., Machado R.P., Buhr I., Heringer-Walther S., Pinheiro S.V.B., Teresa Lopes M., Bader M., Mendes E.P., Lemos V.S., Campagnole-Santos M.J., Schultheiss H.-P., Speth R., Walther T. 2003. Angiotensin-(1–7) is an endogenous ligand for the G protein-coupled receptor Mas. PNAS. 100 (14), 8258–8263.
Santos R.A., Ferreira A.J., Simões e Silva A.C. 2008. Recent advances in the angiotensin-converting enzyme 2–angiotensin(1–7)–Mas axis. Exp. Physiol. 93 (5), 519–527. https://doi.org/10.1113/expphysiol.2008.042002
Oudit G.Y., Kassiri Z., Patel M.P., Chappell M., Butany J., Backx P.H., Tsushima R.G., Scholey J.W., Khokha R., Penninger J.M. 2007. Angiotensin II-mediated oxidative stress and inflammation mediate the age-dependent cardiomyopathy in ACE2 null mice. Cardiovasc. Res. 75 (1), 29–39. https://doi.org/10.1016/j.cardiores.2007.04.007
Guzzi P.H., Mercatelli D., Ceraolo C., Giorgi F.M. 2020. Master regulator analysis of the SARS-CoV-2. Human. Interactome. J. Clin. Med. 9 (4), 982–997. https://doi.org/10.3390/jcm9040982
Verdecchia P., Cavallini C., Spanevello A., Angeli F. 2020. The pivotal link between ACE2 deficiency and SARS-CoV-2 infection. Eur. J. Intern. Med. 76, 14–20. https://doi.org/10.1016/j.ejim.2020.04.037
Magrone T., Magrone M., Jirillo E. 2020. Focus on receptors for coronaviruses with special reference to angiotensin-converting enzyme 2 as a potential drug target – a perspective. Endocr. Metab. Immune. Disord. Drug. Targets. 20 (6), 807–811. https://doi.org/10.2174/1871530320666200427112902
de Wit E., van Doremalen N., Falzarano D., Munster V.J. 2016. SARS and MERS: Recent insights into emerging coronaviruses. Nat. Rev. Microbiol. 14 (8), 523–534. https://doi.org/10.1038/nrmicro.2016.81
Dong L., Hu S., Gao J. 2020. Discovering drugs to treat coronavirus disease 2019 (COVID-19). Drug Discov. & Therap. 14 (1), 58–60. doi.org/.https://doi.org/10.5582/ddt.2020.01012
Prompetchara, E., Ketloy C., Palaga T. 2020. Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian. Pac. J. Allergy. Immunol. 38 (1), 1–9. https://doi.org/10.12932/AP-200220-0772
Choy E.H., De Benedetti F., Takeuchi T., Hashizume M., John M.R., Kishimoto T. 2020. Translating IL-6 biology into effective treatments. Nat. Rev. Rheumatol. 16 (6), 335–345. https://doi.org/10.1038/s41584-020-0419-z
Xie X.D., Chen J.Z., Wang X.X., Zhu J.H., Sun J., Tao M., Shang Y.P., Guo X.G. 2005. Cloning, expression and sequence analysis and tissue distribution of angiotensin-converting enzyme 2 (ACE2) gene in adult mice. Zhejiang Da Xue Xue Bao Yi Xue Ban. 34 (1), 48–54.
Tonnaer J.A., Engels G.M., Wiegant V.M., Burbach J.P., De Jong W., De Wied D. 1983. Proteolytic conversion of angiotensins in rat brain tissue. Eur. J. Biochem, 131 (2), 415–421. https://doi.org/10.1111/j.1432-1033.1983.tb07279.x
Santos R.A., Brosnihan K.B., Chappell M.C., Pesquero J., Chernicky C.L., Greene L.J., Ferrario C.M. 1988. Converting enzyme activity and angiotensin metabolism in the dog brainstem. Hypertension. 11 (2 Pt 2), 1153–1157. https://doi.org/10.1161/01.hyp.11.2_pt_2.i153
Ribeiro-Oliveira A., Nogueira A.I., Pereira R.M., Boas W.W.V., dos Santos R.A.S., De Silva A.C.S. 2008. The renin–angiotensin system and diabetes: An update. Vasc. Health. Risk. Manag. 4 (4), 787–803.
Rice G.I., Thomas D.A., Grant P.J., Turner A.J., Hooper N.M. 2004. Evaluation of angiotensin-converting enzyme (ACE), its homologue ACE2 and neprilysin in angiotensin peptide metabolism. Biochem. J. 383 (Pt 1), 45–51. https://doi.org/10.1042/BJ20040634
Donoghue M., Hsieh F., Baronas E., Godbout K., Gosselin M., Stagliano N., Donovan M., Woolf B., Robison K., Jeyaseelan R., Breitbart R.E, Acton S. 2000. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1–9. Circ. Res. 87 (5), E1–E9. https://doi.org/10.1161/01.res.87.5.e1
Caruso-Neves C., Lara L.S., Rangel L.B., Grossi A.L., Lopes A.G. 2000. Angiotensin-(1–7) modulates the ouabain-insensitive Na+-ATPase activity from basolateral membrane of the proximal tubule. Biochim. Biophys. Acta, 1467 (1), 189–197. https://doi.org/10.1016/s0005-2736(00)00219-4
Lara L.S., Bica R.B.S., Sena S.L.F., Correa J.S., Marques-Fernandes M.F., Lopes A.G., Caruso-Neves C. 2002. Angiotensin-(1–7) reverts the stimulatory effect of angiotensin II on the proximal tubule Na+-ATPase activity via a A779-sensitive receptor. Regul. Pept. 103 (1), 17–22. https://doi.org/10.1016/s0167-0115(01)00322-6
Moreira de Macêdo S., Guimarães T.A., Feltenberger J.D., Sousa Santos S.H. 2014. The role of renin-angiotensin system modulation on treatment and prevention of liver diseases. Peptides. 62, 189–196. https://doi.org/10.1016/j.peptides.2014.10.005
Jiang T., Gao L., Guo J., Lu J., Wang Y., Zhang Y. 2012. Suppressing inflammation by inhibiting the NF-κB pathway contributes to the neuroprotective effect of angiotensin-(1–7) in rats with permanent cerebral ischaemia. Br. J. Pharmacol. 167 (7), 1520–1532. https://doi.org/10.1111/j.1476-5381.2012.02105.x
Jiang T., Gao L., Lu J. 2013. ACE2-Ang-(1-7)-Mas axis in brain: A potential target for prevention and treatment of ischemic stroke. Curr. Neuropharmacol. 11 (2), 209–217. https://doi.org/10.2174/1570159X11311020007
Wösten-van Asperen R.M., Lutter R., Specht P.A., Moll G.N., van Woensel,J.B., van der Loos C.M., van Goor H., Kamilic J., Florquin S., Bos A.P. 2011. Acute respiratory distress syndrome leads to reduced ratio of ACE/ACE2 activities and is prevented by angiotensin-(1–7) or an angiotensin II receptor antagonist. J. Pathol. 225 (4), 618–627. Epub 2011 Oct 18.https://doi.org/10.1002/path.2987
Uhal B.D., Li X., Xue A., Gao X., Abdul-Hafez A. 2011. Regulation of alveolar epithelial cell survival by the ACE-2/angiotensin 1–7/Mas axis. Am. J. Physiol. Lung Cell. Mol. Physiol. 301 (3), L269–L274. https://doi.org/10.1152/ajplung.00222.2010
Jackson L.D., Eldahshan W., Fagan S.C., Ergul A. 2018. Within the brain: The renin angiotensin system. Int. J. Mol. Sci. 19 (3), 876. https://doi.org/10.3390/ijms19030876
Loseva E.V., Karnup S.V. 2004. Neurogenesis in the mature olfactory bulb and it’s possible functional destination. Usp. Fiziol. Nauk. 35 (4), 11–18.
Kostenis E., Milligan G., Christopoulos A., Sanchez-Ferrer C.F., Heringer-Walther S., Sexton P.M., Gembardt F., Kellett E., Martini L., Vanderheyden P., Schultheiss H.P., Walther T. 2005. G-protein-coupled receptor Mas is a physiological antagonist of the angiotensin II type 1 receptor. Circulation. 111 (14), 1806–1813. https://doi.org/10.1161/01.CIR.0000160867.23556.7D
da Silva Saldanha A.A., Rodrigues Prestes T.R., Lauar A.O., Finotti B.B., Simoes E., Silva A.C. 2017. Renin angiotensin system and cytokines in chronic kidney disease: Clinical and experimental evidence. Protein. Pept. Lett. 24 (9), 799–808. https://doi.org/10.2174/0929866524666170818160809
Dilek I., Henning R.H., van Gilst W.H., Roks A.J.M. 2008. Angiotensin-(1-7): Pharmacological properties and pharmacotherapeutic perspectives. Eur. J. Pharmacol. 585 (2–3), 303–312. https://doi.org/10.1016/j.ejphar.2008.02.090
Santos R.A., Campagnole-Santos M.J., Baracho N.C., Fontes M.A., Silva L.C., Neves L.A., Oliveira D.R., Caligiorne S.M., Rodrigues A.R., Gropen J.C. 1994. Characterization of a new angiotensin antagonist selective for angiotensin-(1-7): Evidence that the actions of angiotensin-(1-7) are mediated by specific angiotensin receptors. Brain Res. Bull. 35 (4), 293–298. https://doi.org/10.1016/0361-9230(94)90104-x
Wiemer G., Dobrucki L.W., Louka F.R. 2002. AVE 0991, a nonpeptide mimic of the effects of Angiotensin-(1–7) on the endothelium. Hypertension. 40 (6), 847–852. https://doi.org/10.1161/01.hyp.0000037979.53963.8f
Tirupula K.C., Desnoyer R., Speth R.C., Karnik S.S. 2014. Atypical signaling and functional desensitization response of MAS receptor to peptide ligands. PLoS One. 9 (7), e103520. https://doi.org/10.1371/journal.pone.0103520
Hay M., Polt R., Heien M.L., Vanderah T.W., Largent-Milnes T.M., Rodgers K., Falk T., Bartlett M.J., Doyle K.P., Konhilas J.P. 2019. A Novel angiotensin-(1-7) glycosylated Mas receptor agonist for treating vascular cognitive impairment and inflammation-related memory dysfunction. J. Pharmacol. Exp. Ther. 369 (1), 9–25. https://doi.org/10.1124/jpet.118.254854
Savergnini S.Q., Beiman M., Lautner R.Q., de Paula-Carvalho V., Allahdadi K., Pessoa D.C., Costa-Fraga F.P., Fraga-Silva R.A., Cojocaru G., Cohen Y., Bader M., de Almeida A.P., Rotman G., Santos R.A.S. 2010. Vascular relaxation, antihypertensive effect, and cardioprotection of a novel peptide agonist of the MAS receptor. Hypertension. 56 (1), 112–120. https://doi.org/10.1161/HYPERTENSIONAHA.110. 152942
Fandiño J., Vaz A. A., Toba L., Romaní-Pérez M., González-Matías L., Mallo F., Diz-Chaves Y. 2018. Liraglutide enhances the activity of the ACE-2/ Ang(1–7)/ Mas receptor pathway in lungs of male pups from food-restricted mothers and prevents the reduction of SP-A. Int. J. Endocrin. 2018, 6 920 620.https://doi.org/10.1155/2018/6920620
Khan A., Benthin C., Zeno B., Albertson T.E., Boyd J., Christie J.D., Hall R., Poirier G., Ronco J.J., Tidswell M., Hardes K., Powley W.M., Wright T.J., Siederer S.K., Fairman D.A., Lipson D.A., Bayliffe A.I., Lazaar A.L. 2017. A pilot clinical trial of recombinant human angiotensin-converting enzyme 2 in acute respiratory distress syndrome. Crit. Care. 21, 234. https://doi.org/10.1186/s13054-017-1823-x
Paul M., Poyan M.A., Kreutz R. 2006. Physiology of local renin-angiotensin systems. Physiol. Rev. 86 (3), 747–803. https://doi.org/10.1152/physrev.00036.2005
Chapell M.C. 2016. Biochemical evaluation of the renin-angiotensin system: The good, bad, and absolute? Am. J. Physiol. Heart. Circ. Physiol. 310 (2), H137–H152. https://doi.org/10.1152/ajpheart.00618.2015
Imai Y., Kuba K., Rao S., Huan Y., Guo F., Guan B., Yang P., Sarao R., Wada T., Leong-Poi H., Crackower M.A., Fukamizu A., Hui C.C., Hein L., Uhlig S., Slutsky A.S., Jiang C., Penninger J.M. 2005. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature. 436 (7047), 112–116. https://doi.org/10.1038/nature03712
Kobori H., Katsurada A., Miyata K., Ohashi N., Satou R., Saito T., Hagiwara Y., Miyashita K., Navar L.G. 2008. Determination of plasma and urinary angiotensinogen levels in rodents by newly developed ELISA. Am. J. Physiol. Renal. Physiol. 294 (5), F1257–F1263. https://doi.org/10.1152/ajprenal.005882007
Campbell D.J., Duncan A.M., Kladis A., Harrap S.B. 1995. Angiotensin peptides in spontaneously hypertensive and normotensive Donryu rats. Hypertension. 25 (5), 928–934. https://doi.org/10.1161/01.hyp.25.5.928
Epelman S., Shrestha K., Troughton R.W., Francis G.S., Sen S., Klein A.L., Tang W.H. 2009. Soluble angiotensin-converting enzyme 2 in human heart failure: Relation with myocardial function and clinical outcomes. J. Card. Fail. 15 (7), 565–571. https://doi.org/10.1016/j.cardfail.2009.01.014
Luo H., Wang X., Chen C., Wang J., Zou X., Li C., Xu Z., Yang X., Shi W., Zeng C. 2015. Oxidative stress causes imbalance of renal renin angiotensin system (RAS) components and hypertension in obese Zucker rats. J. Am. Heart. Assoc. 4 (2), e001559. https://doi.org/10.1161/JAHA.114.001559
Nehme A., Zouein F.A., Zayeri Z.D., Zibara K. 2019. An update on the tissue renin angiotensin system and its role in physiology and pathology. J. Cardiovasc. Dev. Dis. 6 (2), 14. https://doi.org/10.3390/jcdd6020014
Engeli S., Negrel R., Sharma A.M. 2000. Physiology and pathophysiology of the adipose tissue renin-angiotensin system. Hypertension. 35 (6), 1270–1277. https://doi.org/10.1161/01.hyp.35.6.1270
Lee E.B., Fleischmann R., Hall S., Wilkinson B., Bradley J.D., Gruben D., Koncz T., Krishnaswami S., Wallenstein G.V., Zang C., Zwillich S.H., van Vollenhoven R.F. 2014. Tofacitinib versus methotrexate in rheumatoid arthritis. N. Engl. J. Med. 370 (25), 2377–2386. https://doi.org/10.1161/01.hyp.35.6.1270
Aazami F.S.H., Khoshmirsafa M., Kamali M., Mohsenzadegan M., Pornour M., Mansouri D. 2020. JAK inhibition as a new treatment strategy for patients with COVID-19. Int. Arch. Allergy. Immunol. 181 (6), 467–475. https://doi.org/10.1159/000508247
Li Y., Cao Y., Zeng Z., Liang M., Xue Y., Xi C., Zhou M., Jiang W. 2015. Angiotensin-converting enzyme 2/ angiotensin-(1–7)/Mas axis prevents lipopolysaccharide–induced apoptosis of pulmonary microvascular endothelial cells by inhibiting JNK/NF–kB pathways. Sci. Rep. 5, 8209. https://doi.org/10.1038/srep08209
Arendse L.B., Danser A.H.J., Poglitsch M., Touyz R.M., Burnett J.C., Llorens-Cortes C., Ehlers M.R. 2019. Therapeutic approaches targeting the renin-angiotensin system and associated peptides in hypertension and heart failure. Pharmacol. Rev. 71 (4), 539–570. https://doi.org/10.1124/pr.118.017129
Rojas A., Gonzalez I., Morales M.A. 2020. SARS-CoV-2-mediated inflammatory response in lungs: Should we look at RAGE? Inflamm. Res. 69 (7), 641–643. https://doi.org/10.1007/s00011-020-01353-x
Rojas A., Delgado-Lypez F., Gonzlez I., Perez-Castro R., Romero J., Rojas I. 2013. The receptor for advanced glycation end-products: A complex signaling scenario for a promiscuous receptor. Cell. Signal. 25 (3), 609–614. https://doi.org/10.1016/j.cellsig.2012.11.022
Bongarzone S., Savickas V., Luzi F., Gee A.D. 2017. Targeting the receptor for advanced glycation endproducts (RAGE): A medicinal chemistry perspective. J. Med. Chem. 60 (17), 7213−7232. https://doi.org/10.1021/acs.jmedchem.7b00058
Rojas A., Mercadal E., Figueroa H., Morales M.A. 2008. Advanced glycation and ROS: A link between diabetes and heart failure. Curr. Vasc. Pharmacol. 6 (1), 44–51. https://doi.org/10.2174/157016108783331312
Frank J.A., Briot R., Lee J.W., Ishizaka A., Uchida T, Matthay M. A. 2007. Physiological and biochemical markers of alveolar epithelial barrier dysfunction in perfused human lungs. Am. J. Physiol. Lung. Cell. Mol. Physiol. 293 (1), L52–59. https://doi.org/10.1152/ajplung.00256.2006
Su X., Looney M.R., Gupta N., Matthay M.A. 2009. Receptor for advanced glycation end-products (RAGE) is an indicator of direct lung injury in models of experimental lung injury. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297 (1), L1–5. https://doi.org/10.1152/ajplung.90546.2008
Shirasawa M., Fujiwara N., Hirabayashi S., Ohno H., Iida J., Makita K., Hata Y. 2004. Receptor for advanced glycation end-products is a marker of type I lung alveolar cells. Genes. Cells. 9 (2), 165–174. https://doi.org/10.1111/j.1356-9597.2004.00712.x
Katsuoka F., Kawakami Y., Arai T., Imuta H., Fujiwara M., Kanma H., Yamashita K. 1997. Type II alveolar epithelial cells in lung express receptor for advanced glycation end products (RAGE) gene. Biochem. Biophys. Res. Commun. 238 (2), 512–516. https://doi.org/10.1006/bbrc.1997.7263
Helms M.N., Jain L., Self J.L., Eaton D.C. 2008. Redox regulation of epithelial sodium channels examined in alveolar type 1 and 2 cells patch-clamped in lung slice tissue. J. Biol. Chem. 283 (33), 22875–22883. https://doi.org/10.1074/jbc.M801363200
Downs C.A., Johnson N.M., Tsaprailis G., Helms M.N. 2018. RAGE-induced changes in the proteome of alveolar epithelial cells. J. Proteomics. 177, 11–20. https://doi.org/10.1016/j.jprot.2018.02.010
Faller S., Hausler F., Goeft A., von Itter M.N.A., Gyllenram V., Hoetzel A., Spassov S.G. 2018. Hydrogen sulfide limits neutrophil transmigration, inflammation, and oxidative burst in lipopolysaccharideinduced acute lung injury. Sci. Rep. 8 (1), 14 676. doi.org/10. 1038/s41598-018-33101.
Zhang Z., Wang J., Xu G., Ding M., Liu F., Yuan L., Wang T., Xu J., Xie X., Deng B., Sun D., Lu W. 2019. Inhalation of sodium hydrosulfide (NaHS) alleviates NO and induced pulmonary function and hematological impairment in rats. Life. Sci. 232, 116 650. doi.org/10. 1016/j.lfs.2019.116650.
Evgen’ev M.B., Frenkel A. 2020. Possible application of H2S-producing compounds in therapy of coronavirus (COVID-19) infection and pneumonia. Cell. Stress and Chaperones. 25 (5), 713–715. https://doi.org/10.1007/s12192-020-01120-1
Pickering R.J., Tikellis C., Rosado C.J., Tsorotes D., Dimitropoulos A., Smith M, Huet O., Seeber R.M., Abhayawardana R., Johnstone E.K., Golledge J., Wang Y, Jandeleit-Dahm K.A., Cooper M.E., Pfleger K.D., Thomas M.C. 2019. Transactivation of RAGE mediates angiotensin-induced inflammation and atherogenesis. J. Clin. Invest. 129 (1), 406–421. https://doi.org/10.1172/JCI99987
Polverino F., Celli B.R., Owen C.A. 2018. COPD as an endothelial disorder: Endothelial injury linking lesions in the lungs and other organs? Pulm. Circ. 8 (1), 2045894018758528. https://doi.org/10.1177/2045894018758528
Prasad K. 2019. AGE-RAGE Stress in the pathophysiology of pulmonary hypertension and its treatment. Int. J. Angiol. 28 (2), 71–79. https://doi.org/10.1055/s-0039-1687818
Jeong J., Lee J., Lim J., Cho S., An S., Lee M., Yoon N., Seo M., Lim S., Park S. 2019. Soluble RAGE attenuates AngII-induced endothelial hyperpermeability by disrupting HMGB1-mediated crosstalk between AT1R and RAGE. Exp. Mol. Med. 51 (9), 1–15. https://doi.org/10.1038/s12276-019-0312-5
Pickering R.J., Tikellis C., Rosado C.J., Tsorotes D., Dimitropoulos A., Smith M., Huet O., Seeber R.M., Abhayawardana R., Johnstone E.K.M., Golledge J., Wang Y., Jandeleit-Dahm K.A., Cooper M.E., Pfleger K.D.G., Thomas M.C. 2019. Transactivation of RAGE mediates angiotensin-induced inflammation and atherogenesis. J. Clin. Invest. 129 (1). 406–421. https://doi.org/10.1172/JCI99987
Gilmore T.D., Garbati M.R. 2011. Inhibition of NF-κappaB signaling as a strategy in disease therapy. Curr. Top. Microbiol. Immunol. 349, 245–263. https://doi.org/10.1007/82_2010_105
Jia C., Zhang J., Chen H., Zhuge Y., Chen H., Qian F., Zhou K., Niu C., Wang F., Qiu H., Wang Z., Xiao J., Rong H., Chu M. 2019. Edothelial cell pyroptosis plays an important role in Kawasaki disease via HMGB1/RAGE/cathespin B signaling pathway and NLRP3 inflammasome activation. Cell. Death. Dis. 10 (10), 778–794. doi.org/.https://doi.org/10.1038/s41419-019-2021-3
Tay M.Z., Poh C.M., Rénia L., MacAry P.A., Ng L.F.P. 2020. The trinity of COVID-19: Immunity, inflammation and intervention. Nat. Rev. Immunol. 20 (6), 363–374. https://doi.org/10.1038/s41577-020-0311-8
Prompetchara E., Ketloy C., Palaga T. 2020. Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian. Pac. J. Allergy. Immunol. 38 (1), 1–9. https://doi.org/10.12932/AP-200220-0772
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


