Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 2, стр. 152-160
Влияние оксимов дициклогексилкарбамимидоила на свойства модельных липидных мембран
С. С. Ефимова a, *, Д. Н. Чернышова a, З. М. Саркисян b, П. Бремонд c, О. С. Остроумова a
a Институт цитологии РАН
194064 Санкт-Петербург, Россия
b Санкт-Петербургский государственный педиатрический медицинский университет
194110 Санкт-Петербург, Россия
c Aix Marseille University, CNRS, INSERM, Institut Paoli-Calmettes, CRCM
13009 Marseille, France (Марсель, Франция)
* E-mail: efimova@incras.ru
Поступила в редакцию 31.10.2020
После доработки 26.11.2020
Принята к публикации 02.12.2020
Аннотация
В работе исследовали молекулярные механизмы действия дициклогексилсодержащих производных О-иминоизомочевины, (Е)-O-(N,N'-дициклогексилкарбамимидоил)оксим циклогексанона (1), (Е)-O-(N,N'-дициклогексилкарбамимидоил)оксим пропан-2-она (2) и (1-(Е)-[(Е)-(N,N'-дициклогексилкарбамимидоил)окси]имино-1-(пиридин-4-ил)этана (3), на модельные липидные мембраны, однослойные везикулы и плоские липидные бислои. Установлено, что все тестируемые производные не влияют на электрические свойства незаряженных мембран из 1-пальмитоил-2-олеил-sn-глицеро-3-фосфохолина (ПОФХ), в то время как оксим 2 при концентрации более 0.2 мМ вызывает рост граничного потенциала отрицательно заряженных мембран из 1-пальмитоил-2-олеил-sn-глицеро-3-фосфо-1'-rac-глицерина (ПОФГ) на 40 мВ. Показано, что способность индуцировать утечку флуоресцентного маркера кальцеина из ПОФХ-липосом при эквимолярном соотношении оксим : липид уменьшается в ряду 2 > 1 ≈ 3 от 25 до 15%. Соединение 2 высвобождает до 50% всего захваченного ПОФГ-везикулами кальцеина, а производные 1 и 3 – не более 15%. Обнаруженные отличия способности соединения 2 вызывать утечку маркера из ПОФХ- и ПОФГ-липосом могут быть объяснены образованием ион-проницаемых пор в ПОФГ-мембранах. Большая эффективность соединения 2 по сравнению с 1 и 3 обусловлена разупорядочивающим действием производного 2 на липидные бислои, что подтверждается данными дифференциальной сканирующей микрокалориметрии. Полученные результаты важны при выборе матрицы для дальнейшей химической модификации при разработке противораковых препаратов на основе дициклогексилкарбамимидоила.
ВВЕДЕНИЕ
Несмотря на большие успехи в изучении процессов канцерогенеза, в разработке новых высокоэффективных лекарственных препаратов и методов ранней диагностики различных опухолей, темпы снижения онкологической летальности до сих пор не достаточны. По этой причине поиск новых противораковых средств остается актуальной задачей современной фармакохимии.
Особый интерес в этой связи представляют алкоксиамины. В определенных условиях эти соединения способны продуцировать свободные радикалы, которые могут быть использованы для индукции окислительного стресса в опухолевых клетках. В частности, оксимы дициклогексилкарбамимидоила могут при температурах выше 80°С запускать радикальную полимеризацию [1]. Таким образом, встает вопрос о выборе химического скаффолда, который может быть использован для дальнейшей модификации оксимов дициклогексилкарбамимидоила с целью снижения температуры образования свободных радикалов при разработке противораковых препаратов. При выборе стратегии химической модификации также следует учесть и сведения о биологической активности близкородственных веществ. В частности, N,N'-дициклогексил-4-морфолинкарбоксамидин является селективным блокатором почечных ATP-чувствительных K+-каналов и может быть использован в качестве перорального калийсберегающего мочегонного средства [2]. Пралидоксим, тримедоксим, HI-6, обидоксим и метоксим (производные пиридинальдоксимов) применяются в качестве антидотов при поражении нервно-паралитическими ядами и пестицидами, поскольку реактивируют фосфорилированную ацетилхолинэстеразу и используются для восстановления нервно-мышечной передачи [3]. WIN 64338 является первым непептидным антагонистом рецептора брадикинина В2 [4, 5].
Необходимым этапом на пути создания современного фармакологического средства является изучение его взаимодействия с клеточной мембраной как первичной мишенью действия любых экзогенных соединений. При разработке противораковых препаратов, действующих путем индукции окислительного стресса, необходимо исключить возможность влияния пролекарства, предшественника свободных радикалов, на свойства мембран, а также обеспечить избирательность действия соединения на опухолевые клетки. Клеточные мембраны – это сложноорганизованные структуры, поэтому для изучения влияния на них различных экзогенных соединений во многих случаях целесообразно использовать модельные системы, плоские липидные бислои и липосомы.
Целью работы являлось исследование механизмов взаимодействия дициклогексилсодержащих производных О-иминоизомочевины с бислойными липидными мембранами. Химическая структура тестируемых соединений представлена в табл. 1. Полученные результаты расширяют представления о влиянии молекул-предшественников свободных радикалов на свойства модельных и биологических мембран. Эти результаты имеют важное значение для оценки перспектив использования этих структурных матриц для дальнейшей химической модификации дициклогексилсодержащих производных О-иминоизомочевины при разработке противораковых препаратов.
Таблица 1.
Физико-химические параметры молекул тестируемых производных
| Агент | Химическое название | Химическая структура | Коэффициент распределения октанол/вода* | Заряд молекулы при рН 7.4* | Дипольный момент, Д** |
|---|---|---|---|---|---|
| 1 | (Е)-O-(N,N'-дициклогексилкарбамимидоил)оксим циклогексанона | 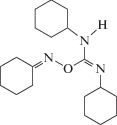 |
5.47 | 0 | 1.23 |
| 2 | (Е)-O-(N,N'-дициклогексилкарбамимидоил)оксим пропан-2-она | 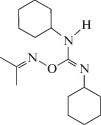 |
4.09 | 0 | 2.19 |
| 3 | 1-(Е)-[(Е)-(N,N'-дициклогексилкарбамимидоил)окси]имино-1-(пиридин-4-ил)этан | 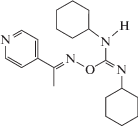 |
4.30 | 0 | 0.49 |
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали: 1-пальмитоил-2-олеил-sn-глицеро-3-фосфохолин (ПОФХ), 1-пальмитоил-2-олеил-sn-глицеро-3-фосфо-1'-rac-глицерин (ПОФГ), 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (ДПФХ), 1,2-дипальмитоил-sn-глицеро-3-фосфо-1'-rac-глицерин (ДПФГ), KCl, KOH, HEPES, диметилсульфоксид (ДМСО), EDTA, тритон Х-100, кальцеин, пентан, этанол (Sigma-Aldrich).
Синтез соединений 1–3. Оксимы 1–3 синтезированы в Университете Марселя совместно с Санкт-Петербургским государственным педиатрическим медицинским университетом согласно методике [6]. Структура и состав полученных соединений были доказаны с помощью масс-спектрометрии и высокоэффективной жидкостной хроматографии.
Формирование плоских липидных бислоев и регистрация токов, протекающих через модельные мембраны. Формирование бислойных липидных мембран проводили по методу Монтала и Мюллера [7]. Плоские липидные бислои формировали из ПОФХ или ПОФГ. Эксперименты проводили при одинаковом ионном составе разделяемых мембраной водных растворов электролита (0.1 M KCl, 5 мМ HEPES-KOH, рН 7.4). Тестируемые соединения 1, 2 и 3 добавляли из раствора в ДМСО (78 мМ, 104 мМ, 150 мМ соответственно) в цис-отсек камеры до конечной концентрации 1.5, 1.6 и 2.0 мМ. Для каждой системы “агент–липидный бислой” было проведено не менее трех независимых экспериментов (повторов).
Измерения и оцифровку трансмембранных токов проводили в режиме фиксации потенциала с помощью усилителя Axopatch 200B и аналого-цифрового преобразователя Digidata 1440A (Axon Instrument, США). Для обработки данных использовали 8-полярный фильтр Бесселя (Model 9002, Frequency Devices) и частоту фильтрации 1 кГц. Обработку записей трансмембранных токов осуществляли с использованием программного пакета Clampfit 9.0 (Axon Instruments, США). Статистический анализ полученных данных проводили при помощи программы Origin 8.0 (Origin Lab., США).
Оценка изменений электрического потенциала на границе мембрана/водный раствор. Ионофор нонактин из раствора в этаноле добавляли в омывающие растворы с обеих сторон ПОФХ- или ПОФГ-мембраны до конечной концентрации 0.1–1.0 мкМ. Проводимость липидного бислоя (G) рассчитывали как отношение стационарного трансмембранного тока, индуцированного комплексом нонактина с ионами калия, к трансмембранному потенциалу, равному 50 мВ. Изменения электрического потенциала на границе мембрана/водный раствор при введении тестируемых производных 1–3 (Δφd) определяли как описано ранее в [8, 9]:
(1)
$\Delta {{\varphi }_{b}} = \frac{{RT}}{{zF}}\ln \left( {\frac{{{{G}_{m}}}}{{G_{m}^{0}}}} \right),$Проводили независимые эксперименты (4–6) и определяли среднее значение изменения граничного потенциала мембран при адсорбции тестируемых соединений для каждой из экспериментальных систем (среднее ± SE).
Измерение утечки флуоресцентного маркера из липидных везикул. Липосомы из ПОФХ или ПОФГ формировали методом экструзии с использованием мини-экструдера производства Avanti Polar Lipids (США) и заполняли раствором, состоящим из 35 мМ кальцеина, 10 мМ HEPES, 1 мМ EDTA, pH 7.4, как описано ранее в [10, 11]. В каждый экспериментальный образец вводили соединение 1, 2 или 3 из исходного раствора в ДМСО до соотношения липид : агент, равного 1 : 1. Максимальная утечка кальциена из липосом в присутствии ДМСО в эквивалентных добавке тестируемых соединений концентрациях составляет не более 4%.
Проницаемость одноламеллярных липосом для флуоресцентного красителя кальцеина определяли с помощью спектрофлуориметра “Флюорат Панорама-02” (Россия) путем измерения интенсивности флуоресценции маркера, вытекающего из липидных везикул при длине волны возбуждения (490 нм) и эмиссии (520 нм).
Относительную величину утечки красителя из липосом под действием соединений 1–3 определяли как:
(2)
$IF = \frac{{{{I}_{i}} - {{I}_{0}}}}{{({{{{I}_{{\max }}}} \mathord{\left/ {\vphantom {{{{I}_{{\max }}}} {0.9}}} \right. \kern-0em} {0.9}}) - {{I}_{0}}}} \times 100\% ,$Дифференциальная сканирующая микрокалориметрия липосом. Гигантские одноламеллярные липосомы формировали из ДПФХ или ДПФГ в электрическом поле c помощью прибора Nanion vesicle prep pro (Германия), как описано в [11, 12]. Концентрация липида в суспензии составляла 5 мМ. В экспериментальные образцы вводили тестируемые соединения 1, 2 или 3 в эквимолярном соотношении к липиду, а в ячейку сравнения добавляли эквивалентный объем ДМСО. Термограммы липосомных суспензий получали при помощи дифференциального сканирующего микрокалориметра µDSC7 (Setaram, Франция) при скорости сканирования 0.2°С/мин. Пики на термограммах характеризовали температурой предперехода (Tp), а также температурой плавления (Tm) и шириной пика, соответствующего основному фазовому переходу (ΔTα). Значение минимальной и максимальной температуры при установлении ширины пика основного фазового перехода определяли по резкому возрастанию и снижению скорости изменения теплового потока с ростом температуры.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
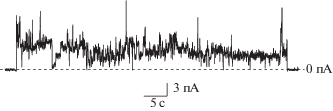
Введение оксимов 1, 2, 3 в растворы, омывающие ПОФХ-мембраны, до концентрации 1.5, 1.6 и 2.0 мМ соответственно не вызывает изменений ионной проницаемости бислоев указанного состава. Дальнейшее увеличение концентрации оксимов приводит к дестабилизации мембран и последующему их разрушению. Замена незаряженного ПОФХ на отрицательно заряженный ПОФГ в физиологических условиях сопровождается снижением пороговой концентрации соединений: разрыв ПОФГ-бислоев происходит при концентрациях агентов, в 1.5–2.0 раза меньших, чем в случае ПОФХ-мембран. Стоит отметить, что в присутствии соединения 2 в концентрации 0.5–0.8 мМ в омывающем мембраны растворе при трансмембранном напряжении более 150 мВ наблюдаются ступенеобразные флуктуации трансмембранного тока, имеющие различную амплитуду и в подавляющем большинстве случаев предшествующие полному разрушению бислоев из ПОФГ. На рис. 1 представлен пример записей подобных флуктуаций тока, которые могут быть результатом появления под действием соединения 2 в мембране ион-проницаемых дефектов.
Рис. 1.
Записи соответствующих образованию ион-проницаемых дефектов флуктуаций трансмембранного тока, индуцированных соединением 2 в концентрации 0.5 мМ. Мембраны из ПОФГ омываются 0.1 M KCl (рH 7.4). Приложенный трансмембранный потенциал составляет 150 мВ.
В табл. 2 представлены характеристические параметры влияния тестируемых соединений на физико-химические свойства липидных бислоев различного состава. Для установления влияния тестируемых соединений на электрические параметры была проведена оценка изменения граничного потенциала модельных липидных мембран (Δφb) при добавлении соединений 1–3. Максимальная величина уменьшения граничного потенциала ПОФХ-мембран не зависит от типа оксима и в среднем составляет не более 5 мВ (табл. 2). Адсорбция соединений 1 и 3 приводит к сходному незначительному падению граничного потенциала ПОФГ-мембран (не более 4 мВ), в то время как введение агента 2 сопровождается более ощутимым эффектом – ростом φb на 40 мВ (табл. 2). Граничный потенциал мембраны представляет собой сумму двух компонент – поверхностного и дипольного потенциалов. Первая, экранируемая компонента обусловлена наличием заряда у мембранообразующих или сорбирующихся на бислое молекул, а вторая, неэкранируемая – специфической взаимной ориентацией диполей мембранообразующих молекул и воды [13–15]. Учитывая электронейтральность тестируемых соединений при рН 7.4 (табл. 1), при их адсорбции можно ожидать изменения только дипольной компоненты граничного потенциала. Нами оценены величины дипольных моментов соединений 1, 2 и 3 в вакууме (табл. 1). Среди тестируемых соединений производное 2 имеет наибольший дипольный момент, что хорошо согласуется с его высокой модифицирующей способностью в отношении ПОФГ-бислоев. При этом различная эффективность электронейтрального агента 2 для нейтральных и отрицательно заряженных мембран может указывать на различие его ориентации в ПОФХ и ПОФГ мембранах.
Таблица 2.
Характеристические параметры влияния тестируемых агентов на свойства бислойных липидных мембран
| Агент | Δφb(max), мВ | IFmax, % | τ, мин | ΔTр, °C | ΔTm, °C | ΔΔTα, °C |
|---|---|---|---|---|---|---|
| ПОФХ | ДПФХ | |||||
| 1 | –6 ± 3 | 18 ± 5 | 12 ± 4 | –5.5 ± 0.8 | –1.6 ± 0.2 | –0.7 ± 0.2 |
| 2 | –5 ± 4 | 25 ± 4 | 26 ± 7 | –* | –1.7 ± 0.1 | 2.8 ± 1.1 |
| 3 | –4 ± 3 | 15 ± 3 | 13 ± 3 | –5.8 ± 0.5 | –1.1 ± 0.2 | –0.6 ± 0.1 |
| ПОФГ | ДПФГ | |||||
| 1 | –4 ± 2 | 16 ± 2 | 11 ± 2 | –* | –0.4 ± 0.1 | –0.3 ± 0.2 |
| 2 | 40 ± 9 | 50 ± 4 | 25 ± 4 | –* | –0.5 ± 0.1 | 1.9 ± 0.5 |
| 3 | –3 ± 2 | 15 ± 3 | 11 ± 4 | –* | –0.2 ± 0.1 | –0.2 ± 0.1 |
Примечание: Δφb(max) – максимальное изменение граничного потенциала бислоя при адсорбции тестируемых соединений; IFmax – максимальная утечка кальцеина из липосом в присутствии тестируемых соединений при эквимолярном отношении липид : агент; τ – характеристическое время, описывающее экспоненциальную зависимость оксим-индуцированной утечки от времени; ΔTp, ΔTm, ΔΔTα – изменение температуры максимума предперехода, температуры плавления и ширины пика, соответствующего основному фазовому переходу ДПФХ или ДПФГ при эквимолярном отношении липид : агент. * – Предпереход на термограмме в присутствии оксима не обнаруживается.
Проницаемость липосомальных мембран для кальцеина определяли путем измерения флуоресценции красителя, высвобождаемого из липосом под действием тестируемых соединений. На рис. 2 представлены временны́е зависимости высвобождения кальцеина из везикул различного состава при добавлении соединений 1, 2 и 3. Кинетические зависимости высвобождения кальцеина из липосом под действием тестируемых оксимов удовлетворительно описываются экспоненциальными функциями с параметрами, равными максимальной относительной утечке (IFmax) и характеристическому времени (τ). В табл. 2 представлены параметры экспоненциальных функций, аппроксимирующих полученные временны́е зависимости утечки кальцеина из незаряженных и отрицательно заряженных липосом в присутствии агентов 1–3 в суспензии при эквимолярном отношении липид : агент. Из представленных данных видно, что соединения 1 и 3 способны высвобождать около 15% захваченного ПОФХ-липосомами кальцеина, а производное 2 – около 25% (табл. 2). В случае адсорбции соединений 1 и 3 наблюдается сходный рост проницаемости ПОФГ-липосом (IFmax составляет около 15%) (табл. 2). Введение агента 2 в суспензию ПОФГ-везикул сопровождается большей утечкой флуоресцентного красителя (около 50%) (рис. 2б, табл. 2). Из табл. 2 видно, что τ не зависит от липидного состава везикул, а определяется видом оксима: высвобождение красителя под действием соединения 2 происходит медленнее, чем утечка, индуцированная агентами 1 и 3.
Рис. 2.
Временны́е зависимости высвобождения кальцеина из ПОФХ- (а) и ПОФГ-везикул (б) под действием тестируемых производных: 1 (черные кривые), 2 (темно-серые кривые) и 3 (светло-серые кривые). Соотношение липид : агент составляет 1 : 1.
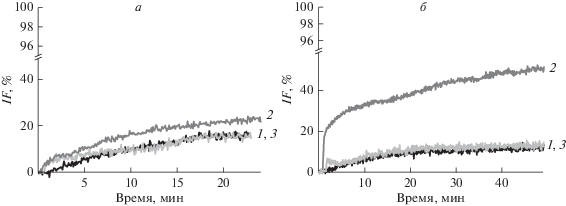
Возрастание в ряду 2 ≤ 3 < 1 десятичного логарифма коэффициента распределения между октанолом и водой (табл. 1) не позволяет объяснить бóльшую величину IFmax в присутствии оксима 2 по сравнению с 1 и 3 (табл. 2) его бóльшей липофильностью. Кроме того, электронейтральность производного 2 (табл. 1) не позволяет говорить о преимущественном взаимодействии этого производного с отрицательно зараженными мембранами, что могло бы быть причиной различия IFmax для ПОФХ и ПОФГ мембран (табл. 2). Причиной различий во влиянии тестируемых агентов на утечку маркера из липосом может быть изменение трансмембранного распределения латерального давления в присутствии оксимов. По всей вероятности, соединение 2 характеризуется бóльшим разупорядочивающим действием на липидные бислои по сравнению с 1 и 3, что может быть связано как с бóльшей глубиной погружения оксима 2 в мембрану, так и с различием в ориентации тестируемых соединений при встраивании в липидный матрикс. Различная способность оксима 2 вызывать утечку кальцеина из ПОФХ- и ПОФГ-липосом хорошо согласуется с предположением о различной ориентации этого производного в мембранах указанного состава. Кроме того, более выраженное влияние соединения 2 на ПОФГ-везикулы по сравнению с ПОФХ-липосомами может быть объяснено способностью этого оксима индуцировать дополнительные транспортные пути для кальцеина за счет формируемых им ион-проницаемых дефектов в ПОФГ-мембранах (рис. 1).
Предположение о различном разупорядочивающем действии тестируемых агентов верифицировали с помощью дифференциальной сканирующей микрокалориметрии суспензии липосомальных везикул, сформированных из ДПФХ или ДПФГ. В отсутствие растворителя и тестируемых соединений основные характеристики эндотерм плавления ДПФХ и ДПФГ хорошо согласуются с данными литературы [16–19]. Известно, что ДМСО вызывает рост температуры фазовых переходов липидов, в частности, увеличивает температуру предперехода и основного фазового перехода ДПФХ [20]. Считается, что сдвиг в сторону больших температур является результатом конденсации и связывания липидов молекулами ДМСО на поверхности мембраны [21, 22]. Сходные эффекты ДМСО были обнаружены при изучении плотности упаковки дипальмитоилфосфоэтаноламиновых, дипальмитоилфосфоглицериновых и дипальмитоилфосфосериновых монослоев [21].
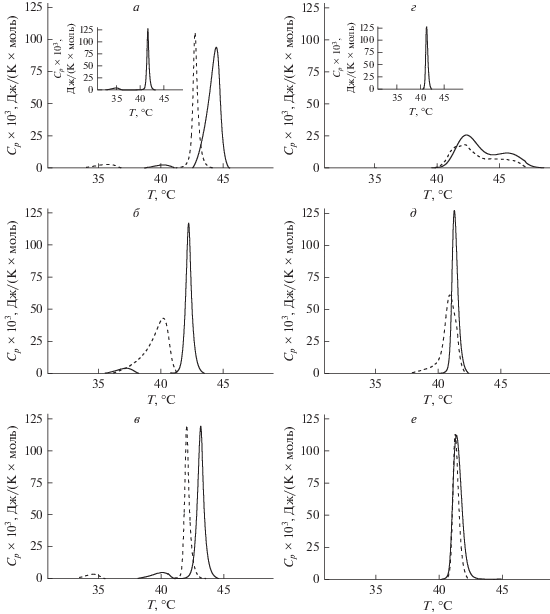
Нами определены эндотермы плавления ДПФХ и ДПФГ в присутствии разных объемных концентраций ДМСО, которые были выбраны с учетом растворимости тестируемых оксимов. Введение ДМСО в суспензию липосом до концентраций 20, 0.5 и 3% соответствует содержанию растворителя в пробах при добавлении соединений 1, 2 и 3 до эквимолярного отношения липид : агент. На рис. 3а–3д представлены термограммы плавления липидов в присутствии указанных количеств ДМСО (сплошные линии). Сравнение представленных на рис. 3б и 3д термограмм с термограммами плавления ДПФХ и ДПФГ в отсутствие растворителя (вставки на рис. 3а, 3г) позволяет заключить, что ДМСО в концентрации 0.5% практически не влияет на эндотермы плавления ДПФХ и ДПФГ. Увеличение концентрации ДМСО до 3% приводит к значительному росту температуры предперехода ДПФХ и менее выраженному увеличению температуры основного фазового перехода ДПФХ и ДПФГ, что согласуется с литературными данными об увеличении температуры фазового перехода липидов под действием ДМСО. Увеличение концентрации растворителя до 20% приводит к существенной модификации эндотерм плавления липидов: температура плавления ДПФХ и ДПФГ возрастает, ширина пиков, соответствующих основному фазовому переходу ДПФХ и ДПФГ, увеличивается, в случае ДПФГ также наблюдается разделение основного пика на несколько компонент (рис. 3а, 3б). Влияние производных 1–3 на эндотермы плавления мембранообразующих липидов оценивали по изменению температуры предперехода ДПФХ (ΔTp), изменению температуры плавления ДПФХ и ДПФГ (ΔTm) и ширины пика, соответствующего основному фазовому переходу указанных липидов (ΔΔTα) по сравнению с липосомными суспензиями в присутствии эквивалентных количеств растворителя (табл. 2). При эквимолярном отношении липид : агент соединения 1 и 3 вызывают значительное падение температуры предперехода ДПФХ (пик сдвигается влево почти на 6°C), менее существенное уменьшение температуры плавления (на 1.1–1.6°C) и ширины основного пика, соответствующего переходу ДПФХ из риппл-фазы в жидкокристаллическое состояние (на 0.6–0.7°C) (рис. 3а, 3в, табл. 2). Добавление в липосомальную суспензию производного 2 приводит к исчезновению предперехода, уменьшению температуры плавления ДПФХ (на 1.7°C) и увеличению ширины основного пика почти на 3°C (рис. 3б, табл. 2). Оксимы 1 и 3 вызывают незначительное уменьшение ширины пика, соответствующего основному фазовому переходу ДПФГ (изменения не превышают 0.2–0.3°C) (рис. 3г, 3е), при этом наблюдается и некоторое уменьшение температуры плавления ДПФГ (в присутствии оксимов 1 и 3 пик сдвигается влево на 0.4 и 0.2°C соответственно). Как и в случае незаряженных липосом из ДПФХ, производное 2 вызывает значительный рост ширины основного пика на термограмме плавления ДПФГ (почти на 2°C) при его сдвиге влево на 0.5°C (рис. 3д, табл. 2).
Рис. 3.
Термограммы плавления ДПФХ и ДПФГ в присутствии 20 (а, г), 0.5 (б, д) и 3% (в, е) ДМСО (черные сплошные линии) и соединений 1 (а, г), 2 (б, д) и 3 (в, е) в эквимолярном соотношении к липиду (черные пунктирные линии). На вставке термограмма плавления ДПФХ (а) и ДПФГ (г) в отсутствие каких-либо растворителей и агентов.
Анализируя результаты измерения утечки флуоресцентного маркера из липосом и изучения термотропного поведения липидов в присутствии тестируемых агентов, можно отметить следующие закономерности: 1) высвобождение кальцеина из липидных везикул под действием соединений 1 и 3 не зависит от их состава; 2) способность агента 2 индуцировать утечку маркера из ПОФГ-липосом выше, чем везикул из ПОФХ; 3) производное 2 характеризуется большей эффективностью в отношении увеличения проницаемости ПОФХ- и ПОФГ-мембран для кальцеина по сравнению с оксимами 1 и 3; 4) соединения 1 и 3 вызывают незначительный рост размера кооперативной единицы ДПФХ и ДПФГ в присутствии ДМСО; 5) размер кооперативной единицы ДПФХ и ДПФГ под действием оксима 2 существенно падает.
Таким образом, данные о влиянии соединений 1 и 3 на плавление мембранообразующих липидов и утечку флуоресцентного красителя из липосом (табл. 2) свидетельствует об их незначительном разупорядочивающем действии, которое обусловлено малым погружением в липидный бислой. Напротив, соединение 2 характеризуется выраженным разупорядочивающим действием, заключающимся в увеличении проницаемости липидных везикул для кальцеина и падении размера кооперативной единицы из мембранообразующих липидов, что указывает на значительное погружение этого оксима в мембрану.
Полученные результаты расширяют представления о молекулярных механизмах действия тестируемых оксимов на свойства модельных липидных мембран как на первичную мишень действия молекул-предшественников свободных радикалов. Эти результаты имеют значение для оценки перспектив использования дициклогексилсодержащих производных О-иминоизомочевины в разработке противораковых препаратов. На основании полученных данных можно сделать заключение о том, что наиболее предпочтительными матрицами для дальнейшей химической модификации при разработке противораковых соединений являются соединения 1 и 3, поскольку они не оказывают выраженного действия на электрические и эластические свойства липидного матрикса мембран в отличие от производного 2.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-14-00110).
Список литературы
Lee K.C., Jeong S.B., Kim D.Y., Lee T.H., Kim S.G., Kim S.G., Lee S.-H., Noh S.M., Park Y. 2018. Synthesis and radical polymerization properties of thermal radical initiators based on O-imino-isourea: The effect of the alkyl side chain on the radical initiation temperature. J. Pol. Sci. Part A: Polymer Chem. 56, 1749–1756.
Perricone S.C., Humphrey S.J., Skaletzky L.L., Graham B.E., Zandt R.A., Zins G.R. 1994. Synthesis and diuretic activity of alkyl- and arylguanidine analogs of N,N'-dicyclohexyl-4-morpholinecarboxamidine in rats and dogs. J. Med. Chem. 37, 3693–3700.
Kamata Y., Fujita T., Kato T., Hayashi I., Kurosaka M., Katori M., Fujita Y., Majima M. 2009. An ATP-sensitive potassium channel blocker suppresses sodium-induced hypertension through increased secretion of urinary kallikrein. Hypertens. Res. 32, 220–226.
Salvino J.M., Seoane P.R., Douty B.D., Awad M.M., Dolle R.E., Houck W.T., Faunce D.M., Sawutz D.G. 1993. Design of potent non-peptide competitive antagonists of the human bradykinin B2 receptor. J. Med. Chem. 36, 2583–2584.
Sawutz D.G., Salvino J.M., Dolle R.E., Casiano F., Ward S.J., Houck W.T., Faunce D.M., Douty B.D., Baizman E., Awad M.M. 1994. The nonpeptide WIN 64338 is a bradykinin B2 receptor antagonist. Proc. Natl. Acad. Sci. USA. 91, 4693–4697.
Kim B., Lee D.G., Kim D.Y., Kim H.J., Kong N.S., Kim J.C., Noh S.M., Jung H.W., Park Y.I. 2016. Thermal radical initiator derivatives based on O-imino-isourea: synthesis, polymerization, and characterization. J. Pol. Sci. Part A: Polymer Chem. 54, 3593–3600.
Montal M., Muller P. 1972. Formation of bimolecular membranes from lipid monolayers and study of their electrical properties. Proc. Nat. Acad. Sci. USA. 65, 3561–3566.
Ефимова С.С., Остроумова О.С. 2015. Модификаторы дипольного потенциала липидных бислоев. Acta Naturae. 7 (4), 79–88.
Ефимова С.С., Щагина Л.В., Остроумова О.С. 2017. Диполь-модифицирующее действие стирилпиридиновых красителей и флавоноидов на модельные мембраны различного состава. Цитология. 59 (3), 229–235.
Ефимова С.С., Медведев Р.Я., Щагина Л.В., Остроумова О.С. 2016. Увеличение текучести модельных липидных мембран под действием местных анестетиков. Цитология. 58 (5), 378–384.
Ефимова С.С., Остроумова О.С. 2020. Разупорядочивающее действие растительных метаболитов на модельные липидные мембраны различной толщины. Цитология. 62 (4), 293–302.
Ефимова С.С., Медведев Р.Я., Чулков Е.Г., Щагина Л.В., Остроумова О.С. 2018. Регуляция порообразующей активности цекропина А местными анестетиками. Цитология. 60 (3), 219–227.
Gawrisch K., Ruston D., Zimmerberg J., Parsegian V.A., Rand R.P., Fuller N. 1992. Membrane dipole potentials, hydration forces, and the ordering of water at membrane surfaces. Biophys. J. 61, 1213–1223.
Wang L. 2012. Measurements and implications of the membrane dipole potential. Annu. Rev. Biochem. 81, 615–635.
Ermakov Yu.A., Nesterenko A.M. 2017. Boundary potential of lipid bilayers: methods and interpretations. J. Phys.: Conf. Ser. 780, 012002.
Wang P.Y., Lu J.Z., Chen J.W., Hwang F. 1994. Interaction of the interdigitated DPPG or DPPG/DMPC bilayer with human erythrocyte band 3: Differential scanning calorimetry and fluorescence studies. Chem. Phys. Lipids. 69, 241–249.
Riske K.A., Barroso R.P., Vequi-Suplicy C.C., Germano R., Henriques V.B., Lamy M.T. 2009. Lipid bilayer pre-transition as the beginning of the melting process. Biochim. Biophys. Acta. 1788, 954–963.
Cyboran S., Bonarska-Kujawa D., Pruchnik H., Zylka R., Oszmianski J., Kleszczynska H. 2014. Phenolic content and biological activity of extracts of blackcurrant fruit and leaves. Food Rew. Intern. 65, 47–58.
Pruchnik H., Bonarska-Kujawa D., Zyłka R., Oszmianski J., Kleszczynska H. 2018. Application of the DSC and spectroscopy methods in the analysis of the protective effect of extracts from the blueberry fruit of the genus Vaccinium in relation to the lipid membrane. J. Therm. Anal. Calorim. 134, 679–689.
Ricci M., Oliva R., Del Vecchio P., Paolantoni M., Morresi A., Sassia P. 2016. DMSO-induced perturbation of thermotropic properties of cholesterol-containing DPPC liposomes. Biochim. Biophys. Acta. 1858, 3024–3031.
Chen X., Huang Z., Hua W., Castada H., Allen H.C. 2010. Reorganization and caging of DPPC, DPPE, DPPG, and DPPS monolayers caused by dimethylsulfoxide observed using brewster angle microscopy. Langmuir. 26, 18 902–18 908.
Cheng C.Y., Song J., Pas J., Meijer L.H., Han S. 2015. DMSO induces dehydration near lipid membrane surfaces. Biophys J. 109, 330–339.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


