Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 2, стр. 83-97
Структура и функции щелевых контактов и составляющих их коннексинов в ЦНС млекопитающих
Е. Ю. Кириченко a, *, С. Н. Скачков b, c, **, А. М. Ермаков d, ***
a Академия биологии и биотехнологии им. Д.И. Ивановского, Южный федеральный университет
344090 г. Ростов-на-Дону, Россия
b Департамент биохимии, Медицинская Школа, П.О. Бокс 60327, Центральный Карибский Университет
PR-00960-6032 Пуэрто-Рико, Байамон, США
c Департамент физиологии, Медицинская Школа, П.О. Бокс 60327, Центральный Карибский Университет
PR-00960-6032 Пуэрто-Рико, Байамон, США
d Донской государственный технический университет, факультет “Биоинженерия и ветеринарная медицина”
344003 г. Ростов-на-Дону, Россия
* E-mail: kiriche.evgeniya@yandex.ru
** E-mail: serguei.skatchkov@uccaribe.edu
*** E-mail: amermakov@yandex.ru
Поступила в редакцию 01.08.2020
После доработки 19.10.2020
Принята к публикации 21.10.2020
Аннотация
Многочисленные данные последних 30 лет свидетельствуют о том, что все отделы центральной и периферической нервных систем (ЦНС и ПНС) от головного мозга, глазной сетчатки и обонятельной луковицы до спинного мозга, ганглиев и энтероглии содержат клетки, соединенные щелевыми контактами (ЩК). Единичные субъединицы ЩК (белки коннексины) собраны, как правило, в гексамерные комплексы или мембранные полуканалы (коннексоны). При этом, когда две контактирующие клетки соединяются посредством коннексонов в ЩК, разнообразие представленных в них субъединиц белков коннексинов способствует специфичности и множественности функций в нейронах, астроцитах, в сателлитной и энтеральной глии. Коннексины и ЩК нейронов, объединяя определенные типы тормозных гиппокампальных и неокортикалькальных нейронных ансамблей, обеспечивают синхронизацию локальной импульсной и ритмической активности, таламокортикальное проведение, контроль возбуждающих связей, что отражает их важную роль в процессах восприятия, концентрации внимания и консолидации памяти как на клеточном, так и на системном уровнях. Коннексины макроглиальных клеток повсеместно экспрессируются в головном мозге, а образуемые ими ЩК обеспечивают метаболическую кооперацию и играют определенную роль в процессах миграции нейронов при развитии мозга, миелинизации, а также в гомеостазе тканей и апоптозе. Мутации в генах глиальных коннексинов, а также дефицит этих белков ассоциированы с такими заболеваниями, как врожденные нейропатии, потеря слуха, кожные заболевания, опухоли мозга, аутизм. В обзоре обобщены данные многочисленных молекулярных, электрофизиологических, фармакологических и морфологических исследований, направленных на прогресс в изучении физиологического и патофизиологического значения глиальных и нейрональных коннексинов и ЩК для ЦНС.
ВВЕДЕНИЕ
Щелевые контакты, или нексусы (gap junctions, nexus), относятся к проводящему типу межклеточных контактов и обеспечивают непосредственный переход из цитоплазмы одной клетки в цитоплазму другой небольших водорастворимых молекул с молекулярной массой не более 1.5 кДа (неорганические ионы, сахара, аминокислоты, нуклеотиды, витамины и т.д.). Впервые их существование было отмечено при изучении ультраструктуры нейронов нервной цепочки речного рака в 1953 году [1]. Чуть позже эти структуры были описаны как одиночные пятислойные пластинки, тесно связывающие мембраны клеток и, предположительно, участвующие в электрической проводимости кардиомиоцитов [2]. Первые свидетельства существования ЩК в ЦНС млекопитающих относятся к 1960–1970 годам [3–6]. Затем последовало интенсивное изучение их функциональной значимости с помощью электрофизиологической регистрации токов от пар соседних нейронов, инъекции флуоресцентных красителей и оценки их межклеточного распространения, а также ультраструктурные исследования их локализации в различных отделах ЦНС. Многочисленные данные последних 30 лет свидетельствуют о том, что все отделы центральной и периферической нервных систем от головного мозга, глазной сетчатки и обонятельной луковицы до спинного мозга, ганглиев и энтероглии содержат клетки, соединенные ЩК [7–9]. Субъединицы ЩК (белки коннексины) собраны, как правило, в гексамерные комплексы, или мембранные полуканалы (коннексоны). Пронизывая билипидные слои мембран двух контактирующих клеток, коннексоны формируют гексагональную пору диаметром 1.5 нм. Когда две контактирующие клетки соединяются посредством коннексонов в ЩК, разнообразие представленных в них субъединиц-коннексинов обеспечивает специфичность и множественность функций в нейронах [10], в астроцитах [11–13], в сателлитной и энтеральной глии [14, 15]. Коннексоны соединены так, что смежные мембраны разделены щелью шириной 2–4 нм (отсюда термин “щелевой контакт”). Электронная микроскопия позволяет визуализировать коннексоны ЩК на репликах в виде сотен плотно сгруппированных округлых скрученных розеток, формирующих своеобразные “бляшки” (plaques) [16, 17].
Клетки ЦНС, соединенные ЩК, могут быть как глиальными, так и нейрональными. Глиальные ЩК формируются в основном между клетками макроглии, способными накапливать полиамины, и обеспечивают метаболическое сопряжение клеток [18, 19]. ЩК нейронов обеспечивают электротоническую кооперацию клеток и функционируют как электрические синапсы [20, 21]. Пока не существует четкого морфологического подтверждения существования ЩК между нейронами и глиальными клетками. Параллельно с описанными выше исследованиями проводилось изучение структуры ЩК, их каналов, белков, составляющих эти каналы, цитоплазматических и внеклеточных доменов, а также их деградации для определения возможных механизмов регулирования их функционального состояния и межклеточного проведения. Целью настоящего обзора является описание существующих знаний об особенностях молекулярной структуры ЩК, составляющих их белков коннексинов, а также их функций в ЦНС в результате анализа данных мировой литературы.
1. ХАРАКТЕРИСТИКА ГЕНОВ КОННЕКСИНОВ И ИХ ДОМЕННОЙ СТРУКТУРЫ
Согласно современной номенклатуре, размещенной в Глобальной поисковой системе полных геномов “Entrez Gene”, гены коннексинов разделяются на 5 групп: альфа, бета, гамма, дельта и эпсилон. В каждой группе нумерация новым генам присваивалась по мере их описания; например, GJA1 является первым описанным коннексином альфа-группы у человека. Этот ген кодирует коннексин с молекулярной массой 43 кДа (Сх43). На сегодняшний день в семействе коннексинов насчитывается около 20 индивидуальных белков, отличающихся друг от друга по молекулярной массе и по спектру тканевой экспрессии [22, 23]. В ЦНС млекопитающих обнаруживаются коннексин 36 (Сх36), коннексин 45 (Сх45), коннексин 43 (Сх43), коннексин 30 (Сх30), коннексин 26 (Сх26), коннексин 32 (Сх32) и др. (табл. 1).
Таблица 1.
Основные коннексины ЦНС млекопитающих, кодирующие гены и их локализация
| Тип коннексина | Ген | Млекопитающее | Хромосома | Клетки центральной нервной системы |
|---|---|---|---|---|
| Коннексин 36, Сх36 | Gjd2, Группа Дельта 2 | Mus musculus (мышь) | Хромосома 2 | Нейроны центральной нервной системы |
| Коннексин 43,СХ43 | GJA1, Группа Альфа 1 | Homo sapiens (человек) | Хромосома 6 | Астроциты, глиальные опухоли ЦНС |
| Коннексин 43,Сх43 | Gja1, Группа Альфа 1 | Mus musculus (мышь) | Хромосома 10 | Астроциты |
| Коннексин 30, СХ30 | GJB6, Группа Бета 6 | Homo sapiens (человек) | Хромосома 13 | » |
| Коннексин 30, Сх30 | Gjb6, Группа Бета 6 | Mus musculus (мышь) | Хромосома 14 | » |
| Коннексин 26, СХ26 | GJB2, Группа Бета 2 | Homo sapiens (человек) | Хромосома 13 | Олигодендроциты |
| Коннексин 62, CX62 | GJA10, Группа Альфа 10 | » | Хромосома 6 | Горизонтальные клетки сетчатки В-типа |
| Коннексин 32, СX32 | GJB1, Группа Бета 1 | » | Хромосома 10 | Миелинизированные Шванновские клетки |
| Коннексин 47, СX47 | GJC2, Группа Гамма 2 | » | Хромосома 1 | Олигодендроциты |
| Коннексин 31, CX31 | GJB3, Группа Бета 3 | » | Хромосома 1 | Дофаминэргические нейроны |
Традиционно коннексин имеет краткое обозначение для животных “Cx”, а для человека “СХ”, при этом, гены коннексинов животных обозначаются “Gj”, гены коннексинов людей – “GJ”. Первоначальные представления о доменной структуре всех генов, кодирующих коннексины, были довольно простые. Они состояли из одного экзона с расположенным на нем 5′-нетранслируемым регионом и второго экзона с основной кодирующей частью и 3'-нетранслируемым концом [24]. Дальнейшее детальное изучение структуры этих генов показало, что их кодирующие участки могут прерываться некодирующими интронами, например, у гена Gjd2, кодирующего Сх36 [25], Gjd4, кодирующего Сх39 [26], Gja10, кодирующего Сх57 [27].
Последующие молекулярные исследования продемонстрировали существование у одного гена коннексина нескольких сплайс-изоформ транскриптов. К примеру, для гена коннексина 32 у крысы и человека было обнаружено два разных сплайс-варианта транскриптов [28, 29], а у коровы и мыши – три [30, 31]. При этом было показано, что большинство этих изоформ появлялись за счет 5′-регионов и альтернативного использования промоторных участков; кодирующая же часть гена в мРНК оставалась неизмененной. Экспрессия таких изоформ транскриптов является специфичной для различных тканей и органов. Так, в гепатоцитах и секреторных ацинарных клетках поджелудочной железы транскрипция мРНК Сх32 начинается с промотора, лежащего выше первого экзона, а в Шванновских клетках ЦНС – с так называемого нервно-специфического промотора, лежащего между первым и вторым кодирующим экзоном [32]. Существование таких различных вариантов тканеспецифичных транскриптов у млекопитающих было показано для многих коннексинов (Сх40, Сх43, Сх45, Сх30 и др.), что связывают с особенностью семейства этих генов. В классическом представлении экспрессия коннексинов во многом регулируется на уровне транскрипции с вовлечением различных транскрипционных факторов и эпигенетических модификаций, таких как гистонные преобразования или метилирование ДНК [33]. Однако в литературе отмечены также факторы регуляции экспрессии на трансляционном уровне, например, элементы IRES (internal ribosome entry site – внутренний сайт для входа в рибосому) или uORFs (upstream open reading frames – открытые рамки считывания) в генах коннексина [32].
2. СИНТЕЗ КОННЕКСИНА И ЕГО МОЛЕКУЛЯРНАЯ СТРУКТУРА
Синтез коннексинов является постоянным динамическим процессом в связи с коротким периодом их полураспада и необходимостью постоянного замещения. Подобно другим мембранным белкам, коннексины синтезируются на мембране эндоплазматического ретикулума (ЭР) с последующей олигомеризацией, транспортировкой через аппарат Гольджи и встраиванием в мембрану клетки [34]. Каждая молекула коннексина в виде нестабильного мономера состоит из четырех гидрофобных трансмембранных спиральных доменов (M1–4), двух экстраклеточных петель (extracellular loop 1 (EL1) и extracellular loop 2 (ЕL2)), одной цитоплазматической петли (cytoplasmic loop (CL)) и N-, С-свободных концевых доменов молекулы, которые также обозначаются NT и CT (Т – tail) (рис. 1a).
Рис. 1.
Схематичное изображение молекулы коннексина и щелевого контакта. а – Доменная структура одной молекулы коннексина, встроенной в билипидный слой мембраны. Обозначения: M1–M4 – трансмембранные домены, EL1–EL2 – внеклеточные петли, CL – внутриклеточная петля, NT – N-конец молекулы, CT – С-конец. б – Агрегация индивидуальных каналов от 10 до несколько тысяч формирует кластер или бляшку щелевых контактов. Расстояние между бляшками порядка 2–3 нм. Каждый коннексон составлен из шести молекул (субъединиц) коннексина. Типы коннексонов щелевых контактов: 1 – гетеромерный гетеротипический, 2 – гомомерный гетеротипический, 3 – гетеромерный гомотипический, 4 – гомомерный гомотипический.
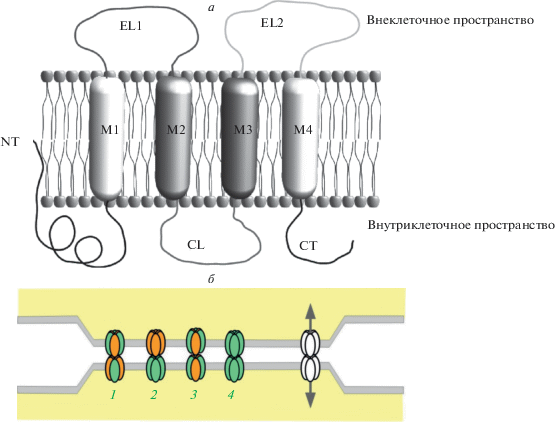
Олигомеризация, или сборка коннексинов в гексамерные комплексы, происходит по-разному, в зависимости от вида коннексина. Исходя из структурной гомологии, коннексины могут быть разделены на две отдельные группы по процессу олигомеризации. Коннексины, кодируемые генами Gjb1–Gjb7 (так называемые β-коннексины, включая Cx26 и Cx32), следуют более традиционному пути, где полная олигомеризация в гексамерные полуканалы необходима перед транспортировкой из ЭР в аппарат цис-Гольджи [35]. Другие коннексины (не-β-коннексины Cx43, Cx40, Cx46) стабилизируются с помощью специфического для коннексина мономера и транспортируются в сеть транс-Гольджи для олигомеризации на поздних стадиях секреторного пути [36]. После олигомеризации коннексины приобретают свою оригинальную структуру в виде комплекса белков из 6 молекул коннексина – коннексона и доставляются к плазматической мембране для встраивания и сборки в бляшки ЩК [37]. Кристаллографическое исследование полуканала показало, что коннексоны имеют положительно заряженный цитоплазматический вход, воронку, отрицательно заряженный трансмембранный участок и внеклеточную полость. В воронке отмечено сужение, образованное шестью N-концевыми спиралями, выстилающими стенку канала. Такая структура канала ограничивает размер проходящей через него молекулы [38].
Цитоплазматические и внеклеточные домены молекулы коннексина, встроенного в мембрану, выполняют различные функции. Например, внеклеточные петли молекулы участвуют в обеспечении соединений с коннексинами соседних клеток, в то время как NT- и CT-концы молекулы ответственны за селективность канала для малых молекул [37]. Длина цитоплазматических петель, так же как и длина С-доменов, варьирует от коннексина к коннексину. Кроме того, на С-конце существуют так называемые сайты фосфорилирования [39]. Фосфорилирование этих С-концевых участков коннексинов посредством киназ является одним из способов посттрансляционного изменения этих белков. Посттрансляционная модификация коннексинов регулирует, в свою очередь, многие важные аспекты их жизненного цикла, включая синтез, транспортировку, стробирование каналов и межбелковые взаимодействия [40]. Современные данные позволяют предположить, что перспективным механизмом влияния на ЩК и полуканалы может быть именно воздействие на определенные киназы, что позволит управлять продолжительностью жизни коннексинов, их миграцией к плазматической мембране, собиранием бляшек полуканалов, формированием ЩК и проницаемостью поры [41]. Кроме того, взаимодействие С-конца с целым рядом киназ определяет его взаимодействие с другими белками и таким образом модулирует его сигнальную функцию.
3. ДЕГРАДАЦИЯ КОННЕКСИНОВ И ЩЕЛЕВЫХ КОНТАКТОВ
Период полураспада коннексинов составляет около 1.5 ч, причем причины такого короткого периода жизни белка до сих пор не объяснены [42]. Полуканалы ЩК подвергаются как протеасомной, так и лизосомной деградации с предшествующей интернализацией посредством комбинированного эндо/экзоцитозного процесса [43]. Этот процесс происходит путем инвагинации бляшек ЩК в цитоплазму клетки, отделения от плазматической мембраны и образования двухмембранного кольцевого соединения, или “коннексосомы”, подвергающегося последующей деградации [44]. При этом одна из контактирующих посредством ЩК клеток является донором коннексосомы, которая поглощается другой клеткой. Ультраструктурные исследования процесса деградации коннексосом свидетельствуют о том, что этот процесс, вероятно, происходит посредством лизосом или аутолизосом, поскольку отмечено, что внутри этих органелл пятислойная структура ЩК “размывается” в некоторых местах [45]. Существует по меньшей мере два вида таких цитоплазматических везикул, участвующих в интернализации ЩК: большие и медленно разрушающиеся везикулы (диаметром порядка 0.5–5 мкм) и более мелкие, разрушающиеся в течение нескольких секунд (диаметром 0.18–0.27 мкм) [46]. Поглощенные таким образом коннексины подвергаются рециркуляции и транспортируются либо обратно в плазматическую мембрану, либо в аппарат Гольджи [47].
4. ТИПЫ КОННЕКСОНОВ И ИХ СТЫКОВКИ
В процессе олигомеризации коннексоны могут быть составлены из коннексинов одного вида (гомомерные коннексоны) или из коннексинов разных видов (гетеромерные коннексоны). Соответственно, составленные гомомерными или гетеромерными коннексонами ЩК могут быть гомотипическими либо гетеротипическими, что зависит от состава коннексонов. В литературе описаны различные сочетания коннексонов и типы ЩК: гомомерный гомотипический, гетеромерный гомотипический, гомомерный гетеротипический, гетеромерный гетеротипический (рис. 1б). Функциональные свойства (проницаемость и селективность для различных молекул и ионов) у гетеротипических каналов, образованных двумя различными коннексинами, могут отличаться от соответствующих свойств гомотипических каналов [48]. Например, гетеротипические ЩК и их функциональное отличие от гомотипических ЩК обсуждается в статье Lin с соавт. [49], в которой было показано, что ЩК желудочков сердца содержат только Сх43, а ЩК предсердий сердца состоят из Сх40 и Сх43. Коэкспрессия этих коннексинов является основной причиной большинства динамических стробирующих свойств ЩК предсердий по сравнению с ЩК желудочков. Эти различия в свойствах ЩК предсердий и желудочков могут играть определенную роль в генезе медленной проводимости миокарда и аритмий [49].
Механизмы совместимости коннексинов в составе гетеротипических контактов на настоящий момент не вполне выяснены/изучены. Теоретически при совмещении двух коннексинов можно сформировать до 196 вариантов различных каналов. Однако было установлено, что стыковка двух полуканалов с образованием одного функционального канала ЩК возможна только между совместимыми коннексинами; молекулярный механизм этого процесса неясен. Предполагается, что в основе механизма стыковки полуканалов в единую пору ЩК лежат водородные связи, нарушение которых является причиной каналопатий [50]. Наиболее важным элементом молекулы коннексина для селективной стыковки и формирования функциональных каналов считают внеклеточный домен E2, а не Е1 [51]. Вместе с тем стыковка полуканалов конкретной пары коннексонов зависит от предполагаемого числа водородных связей на каждом стыковочном интерфейсе E2–E2. Изучение кристаллической структуры канала ЩК показало образование в общей сложности около 36 водородных связей на шести состыкованных внеклеточных доменах E2–E2 [38, 52]. При этом аминокислотные остатки, формирующиеся после стыковки доменов E1–E1 и E2–E2, могут содержать различные мутации, связанные с наследственными заболеваниями человека, такими как нейропатия Шарко–Мари–Тута [53], дисплазии, сердечные аритмии, врожденные катаракты, глухота и др. [54–57].
ХАРАКТЕРИСТИКА И ФУНКЦИИ КОННЕКСИНОВ В ЦНС
Характеристика экспрессии различных коннексинов в нервной ткани необходима для понимания функциональной значимости создаваемых ими полуканалов и ЩК. В ЦНС функции и свойства ЩК определены тем, соединяют ли они нервные или глиальные клетки.
Коннексины нейронов
Коннексин 36 (Cx36). Экспрессия гена Cx36 (как и экспрессия других коннексинов), как правило, определяется исследователями с помощью метода гибридизации in situ с РНК-зондами, репортерного гена lacZ и анализа синтезируемого белка методами вестерн-блот, иммуногистохимии и электронной иммуногистохимии. Функции коннексина 36 исследуют в основном электрофизиологическими методами на нокаутных и трансгенных животных. ЩК, состоящие из Cx36, образуются только гомомерными коннексонами [58], при этом формируемая ими пора функционирует с очень низкой проводимостью порядка 10–15 пСм [59]. В качестве основной функции ЩК, содержащих коннексин 36, исследователи определяют электрическое сопряжение и синхронизацию межклеточной импульсной активности нейронов.
В раннем постнатальном развитии различные типы уже дифференцированных нейронов соединяются посредством ЩК. Эта связь не только позволяет создать сеть клеток с координированным метаболизмом, но и обеспечивает передачу нервных импульсов в условиях, когда химические синапсы еще не функционируют. Обнаруженные временные электрические связи между нейронами обеспечиваются по большей части электрическими синапсами, образованными Сх36 [60]. Количество ЩК между нейронами резко сокращается к 18-му дню постнатального развития, в то время как развитие химических синапсов приближается к взрослым показателям [61]. Во взрослом мозге млекопитающих Сх36 является нейрональным коннексином, специфичным для ЩК между тормозными ГАМКергическими нейронами [62], реже между возбуждающими нейронами [9, 61]. При этом наибольшее количество таких ЩК соединяют дендриты ГАМКергических нейронов, экспрессирующих кальций-связывающие белки и нейропептиды, например парвальбумин. Морфологические свидетельства существования таких связей были продемонстрированы в исследованиях в гиппокампе и четвертом слое неокортекса (баррельной коре) [63, 64]. Авторы этих работ разработали классификацию парвальбумин-содержащих быстроспайковых нейронов по дистальному и проксимальному расположению ЩК на дендритах этих клеток. Кроме того, такие типы парвальбумин-содержащих нейронов содержали в цитоплазме сомы и проксимальных дендритах таламический везикулярный глутаматный транспортер 2, что указывает на их участие в прямых таламокортикальных связях. Существование подобных сетей может свидетельствовать в пользу того факта, что ЩК, содержащие Сх36, участвуют в контроле возбуждающих связей, обеспечивают регулирование таламокортикального взаимодействия, обеспечивают синхронизацию как локальной импульсной активности, так и ритмической активности крупных и малых нейронных ансамблей в гиппокампе и неокортексе при альфа-, тета -, гамма- и высокочастотных колебаниях [65, 66]. Предполагается, что некоторые из этих ритмических колебаний участвуют в процессах восприятия, концентрации внимания и памяти как на клеточном, так и на системном уровне. Однако такие нейронные сети, объединенные ЩК, остаются мало исследованными не только для большинства областей мозга, но даже не описаны для всех слоев кортикальной колонки неокортекса, что, безусловно, должно являться целью будущих нейрофизиологических и нейроморфологических исследований.
Коннексин 45 (Сх45). Исследования экспрессии Сх45 и содержащих этот белок ЩК немногочисленны. Так же как и Сх36, Сх45 относится к группе белков ЩК нейронов ЦНС, поскольку не экспрессируется ни в олигодендроцитах, ни в астроцитах [67]. Высокий уровень экспрессии гена Сх45 отмечается уже во время эмбриогенеза и в течение первых двух недель постнатального развития во всех областях мозга. После этого его экспрессия ограничивается таламическими структурами, областью СА3 гиппокампа и мозжечком [67]. Значительное совпадение уровня экспрессии обоих коннексинов развивающихся нейронов (Cх36 и Cх45) в раннем постнатальном развитии позволяет предположить, что в этот период они играют схожую роль и могут способствовать функциональной специализации определенных подтипов развивающихся нейронов.
Во взрослом мозге Сх45 был обнаружен в пирамидных клетках, которые, как известно, формируют электрические связи, но не экспрессируют Cx36. Такие клетки были идентифицированы в неокортексе, гиппокампе (регионы CA1–CA4) и таламусе [67, 68]. Кроме того, Cx45 экспрессируется в нейронах обонятельной луковицы [69] и в субпопуляциях нейронов оливоцеребеллярной системы [70]. По аналогии с Сх36, белок Сх45 образует ЩК с довольно низкой проводимостью, которые чувствительны к изменениям мембранного потенциала и закрываются при гиперполяризации мембраны [71]. При этом существования гетеротипических ЩК Сх36/Сх45 до настоящего момента продемонстрировано не было. Предполагается, что одной из основных функций ЩК, содержащих Cx45, является синхронизация осцилляторной активности нейронов в диапазонах гамма-частот [72].
Коннексины глиальных клеток
Межглиальные ЩК наиболее характерны не для клеток-представителей иммунной системы, возникающих из мезенxимы – микроглии (макрофагов в ЦНС и ПНС), а для клеток макроглии (астроцитов, олигодендроцитов, питуицитов, таницитов, Мюллеровских и Бергманновских клеток). Первичная макроглия возникает из эктодермы и общего с нервными клетками стволового предшественника – радиальной глии, которая в процессе онтогенеза дает как разновидности астроцитов и другой глии, так и нейронов. Во взрослом организме радиальная глия ЦНС представлена Мюллеровскими клетками в сетчатке глаза и глией Бергмана в мозжечке, при этом в других структурах ЦНС она практически редуцирована. Тем не менее, все клетки, имеющие происхождение из радиальной глии, объединяет уникальная способность накапливать полиамины и осуществлять межклеточный обмен небольшими молекулами посредством ЩК, содержащих различные виды коннексинов [18]. Коннексины глиальных клеток повсеместно экспрессируются в ЦНС и ПНС, обеспечивая метаболическую, синцитиальную и сигнальную кооперацию, и играют определенную роль в процессах миграции как самих астроцитов, так и нейронов. Мутации в генах глиальных коннексинов и их дефицит связаны с множеством заболеваний [73], одним из которых является аутизм [74].
Коннексин 43 (Cx43). В развивающемся мозге эмбриональные клетки-предшественники нейронов связаны между собой ЩК, содержащими Cx43 [75]. Кроме того, Cx43 экспрессируется радиальными клетками глии, по которым мигрируют молодые нейроны из вентрикулярной зоны в слои неокортекса [76]. Cчитается, что Cx43 не образует ЩК, а способствует обеспечению адгезии нейронов в процессе миграции [77]. Более того, ключевую и критическую роль в этом процессе играет цитоплазматический С-концевой домен Cx43 [75]. Коннексоны, содержащие Cx43, образуют каналы с умеренной проводимостью, при этом ЩК, состоящие из Cx43, являются низкочувствительными к изменениям мембранного потенциала и закрываются в ответ на деполяризацию мембраны [71]. Во взрослом мозге Cx43 является основным белком, составляющим ЩК астроцитов [78], распространенных повсеместно, включая кору, подкорковые структуры, гиппокамп и другие структуры.
Следует отметить, что при схожих морфологических характеристиках нейрональные ЩК, содержащие Сх36, и макроглиальные ЩК, содержащие Сх43, имеют различное функциональное назначение. ЩК между нейронами являются редкостью и служат для лавинообразной синхронизации электрических сигналов в небольших клеточных ансамблях, в то время как ЩК эктодермальной глии масштабны и необходимы для организации синцития. Астроцитарный синцитий – это трехмерный глиальный каркас в структурах мозга, выполняющий ряд важных функций, таких как контроль концентраций внеклеточных ионов и нейротрансмиттеров, а также осуществление метаболических процессов [79]. Для поддержания этих функций в синцитии необходимым условием является открытие ЩК, что связано с наличием полиаминов [80]. При этом во взрослом мозге накопление полиаминов (спермина, спермидина, путресцина, агматина) является отличительной особенностью именно астроцитов, но не нейронов [81–84]. Уникальная способность Сх43 поддерживать в открытом состоянии ЩК в синцитии была показана при сравнении Сх43 и Сх40 и демонстрации явления блокады полиаминами аминокислотной последовательности (сайта связвания) в N-конце Сх40 [85]. Такие специфические сайты связывания для полиамина спермина не были обнаружены в Сх43 [86]. Более того, в дальнейших исследованиях было отмечено, что Сх43 чувствителен к полиаминам, которые открывают каналы ЩК, а также, что наиболее важно для физиологии клеток, полиамины устраняют блокаду этих каналов катионами водорода [87] и кальция [88]. Устранение катионного блока полиаминами является критически важным фактором для функционирования ЩК в глии, поскольку именно подкисление цитоплазмы и последующее высвобождение кальция (так называемые кальциевые волны в астроцитах) является отличительным свойством астроцитарного синцития, но не нейронных ансамблей.
Накопление полиаминов в глиальных клетках необходимо не только для поддерживания ЩК открытыми [89], но и для регуляции калиевых токов в калиевых каналах глии [90]. Известная способность астроцитов шунтировать друг друга и объединять единичные клетки в общий синцитий посредством ЩК позволяет осуществлять недавно открытое свойство “астроцитарной изопотенциальности” [91]. Суть этого свойства астроцитов состоит в том, что мембранный потенциал каждой клетки зафиксирован (стабилизирован) вследствие контакта с соседними клетками, что позволяет удерживать коллективный мембранный потенциал глиального синцития на уровне –90 мВ, что на 20–30 мВ ниже нейронального и создает условия для входа ионов калия в клетки против концентрационного градиента. Необходимость такого захвата ионов калия из внеклеточной среды продиктована накоплением избыточного калия в межклеточном пространстве при генерации спайков нейронами. Транспортировка калия в цитоплазму глии из пространства вокруг нейронов осуществляется с помощью калиевых каналов Kir4.1 (KCNJ10) астроцитов. Следует отметить, что калиевые каналы Kir4.1 (KCNJ10) являются преобладающими каналами клеток глии и локализованы исключительно в их мембранах [92]; более того, многие заболевания ЦНС и ПНС связывают с нарушением работы именно этих каналов [73, 93]. В то же время деполяризация такого синцития при повышении концентрации ионов калия при эпилепсии, нейротравме или ишемии [94] ведет к потере астроцитами способности устранять избыток калия из межклеточного пространства, что приводит к инактивации нейрональной активности и коме.
Помимо вышеописанного механизма, динамическая регуляция сетей астроцитов, объединенных ЩК из Сх43, осуществляется путем фосфорилирования Cx43 протеинкиназами, в том числе протеинкиназой C (PKC) и тирозинкиназой [95]. Фосфорилирование Cx43 снижает проницаемость межклеточных каналов и подавляет межклеточное сообщение посредством ЩК. При дефиците белка Cx43 в астроцитах снижается количество ЩК и распространение кальциевых волн нарушается [96], что напрямую отражается на активности нейронов.
Cx43, помимо астроцитов, также был обнаружен в большинстве изученных астроцитом человека и в астроглиальном компоненте нейроглиальных опухолей. В то время как в глиомах низких степеней злокачественности (в более чем 60% от всех случаев) после проведения иммуногистохимии проявлялось сильное мембранное окрашивание, в большинстве астроцитом высоких степеней злокачественности отмечено снижение типичной мембранной и цитоплазматической локализации этого белка. Иммуноблотинг продемонстрировал наличие нескольких изоформ Cx43 как в контрольных образцах коры, так и в глиомах низких степеней злокачественности. При этом в большинстве злокачественных глиом присутствует только одна единственная изоформа Сх43, соответствующая нефосфорилированной форме. Повышенное по сравнению с контрольной группой содержание белка Cx43 было выявлено в реактивных астроцитах перифокальной зоны эпилептического очага, а также в перифокальных зонах глиом низких степеней злокачественности. Возможно, это указывает на существование некоего регуляторного пути с участием Cx43 и астроглиального синцития в регионах, подверженных опухолевому росту. В связи с этим существует предположение о том, что высокая экспрессия генов коннексинов в глиомах низких степеней злокачественности, как и в перитуморальных зонах, может способствовать возникновению опухолезависимых эпилептиформных ритмов [39].
Коннексин 30 (Сх30). Помимо Сх43, к коннексинам астроцитов относятся Cx30 и Cx26 [97]. Уже в первых работах было установлено, что Сх30 появляется в мозге в индивидуальном развитии значительно позже, чем Сх43 [98]. Первое проявление экспрессии гена Cx30 отмечается в астроцитах серого вещества с различными региональными закономерностями в развивающемся мозге ближе к взрослому возрасту. Отличительной чертой Сх30 оказалось почти его полное отсутствие в белом веществе. В подкорковых структурах мозга содержание этого белка выше, чем в неокортексе [99]. Наблюдаемые различия в экспрессии Сх30 вполне могут быть связаны с функционированием нейронных сетей, в работу которых вовлечены те или иные локальные популяции астроцитов, экспрессирующих данный белок. Как показали проведенные нами ранее исследования в коре мозга и обонятельной луковице, Сх30 в основном концентрируется в тонких веточках астроцитов вокруг микрокапилляров и сосудов. В некоторых ЩК, типичных по ультраструктуре, продукты иммуногистохимической реакции с антителами к Сх30 локализованы только в одном из контактирующих отростков. Вероятно, такие ассиметричные контакты вокруг сосудов образованы двумя различными коннексинами астроцитов [100].
В экспериментах с нейротоксическим воздействием было выявлено сильное и специфичное изменение уровней экспрессии мРНК Cx30 в реактивных астроцитах, находящихся в окружении нейронов, подвергшихся клеточной гибели. Это указывало на прямое или косвенное вовлечение этого типа коннексина в апоптотический процесс нейронов [19, 97]. Также было показано, что мутации в Cx30 могут вызывать сенсорную потерю слуха и различные кожные заболевания [39]. Мыши с дефицитом Cx30 проявляли патологию внутреннего уха, связанную с увеличением апоптоза клеток кохлеарного сенсорного эпителия, что приводило к отсутствию эндокохлеарного потенциала и прогрессированию потери слуха [101].
Коннексин 26 (Сх26). Сх26 является третьим (наравне с Сх30 и Сх43) представителем коннексинов глиальных клеток. В раннем нейрогенезе ген Cx26 экспрессируется в ЦНС в клетках лептоменингеальной оболочки, а также в астроцитах и нейронах развивающегося головного и спинного мозга [19]. Хотя было высказано предположение о существовании ЩК, содержащих Сх26, связывающих нейроны и астроциты, морфологических подтверждений этому найдено не было [102, 103]. В настоящее время существует стойкое мнение о том, что Cx26 входит в состав гетеротипических ЩК между астроцитами и олигодендроцитами, поскольку часто отмечается его колокализация с Сх43, Сх30 и Сх32 [19]. Существование таких контактов поднимает вопросы о гетерогенности глиальных клеток по экспрессии коннексинов, о более сложном уровне состыковки коннексонов из гетеротипических комбинаций коннексина, нацеленной на взаимодействие нейронов и панглиальных сетей.
Врожденные мутации в гене GJB2 коннексина 26 являются основой калечащих синдромов нейросенсорной тугоухости, потери слуха и гиперкератоза с аутосомно-рецессивным (DFNB1) и аутосомно-доминантным типами наследования (DFNA3) [104, 105]. Эти мутации описаны как миссенс-мутации, которые приводят к неконсервативной аминокислотной замене, нарушению функции внеклеточной петли EL1 молекулы Cx26 и неспособности белка образовывать коннексоны и ЩК. Более того, в литературе все чаще встречаются случаи сочетания описанного синдрома с пороком развития Дэнди Уокера [106], в связи с чем роль гена GJB2 предполагается и в других, подобных этому пороку, врожденных заболеваниях известной и неизвестной этиологии.
Коннексин 32 (Сх32). Ген белка Cx32 экспрессируется в Шванновских клетках (леммоцитах), располагающихся вдоль аксонов периферических нервных волокон. Сх32 связывает тело клетки Шванна с миелиновой оболочкой и играет критическую роль в процессе миелинизации. Кроме того, Сх32 обнаруживается в олигодендроцитах и участвует в функциональных процессах, связанных с этими клетками [107, 108]. ЩК олигодендроцитов, содержащие Cx32, в основном составлены из гетеротипических коннексонов и обнаружены между олигодендроцитами, между олигодендроцитом и астроцитом, а также между последовательными слоями миелина [19]. Одним из наиболее известных заболеваний, связанных с мутацией в гене Cx32, является болезнь Шарко–Мари–Тута, или наследственная моторно-сенсорная нейропатия [53], проявляющаяся гиперплазией Шванновских клеток и миелинопатией: сегментарной димиелинизацией или ремиелинизацией. Одним из перспективных направлений терапии данного наследственного заболевания может являться доставка вектора с “правильным” геном GJB1 для последующего встраивания в геном клеток человека.
Иннексины и паннексины. Коннексины являются не единственными каналообразующими белками ЩК. Существует, например, семейство белков, называемых иннексины (коннексины беспозвоночных). Гены иннексинов кодируют белки в ЩК Drosophila, Caenorhabditis elegans, а также видов Mollusca, Annelida и Platyhelminthes [109]. При этом белки иннексины образуют функциональные ЩК [110]. Белки паннексины (Panx1, Panx2 и Panx3) были открыты Панчиным в эмбрионе актинии Nematostella vectensis [111]. Эти белки были признаны гомологичными белкам ЩК беспозвоночных [112, 113]. Молекулы иннексинов имеют мало сходства с коннексинами, за исключением двух консервативных остатков цистеина в их внеклеточных петлях. Однако некоторые субъединицы коннексина и паннексина удивительно похожи [114]. Функция паннексинов в ЦНС млекопитающих на настоящий момент остается неясной. Известно, что существует четкая экспрессия мРНК Panx1 и Panx2 в определенных нейронах, включая пирамидные клетки и интернейроны гиппокампа [113]. Однако сложно ответить на вопрос, существуют ли электрические синапсы нейронов позвоночных, составленные из паннексинов. На настоящий момент известно, что паннексины играют важную биологическую роль в качестве составляющих полуканалов, способствующих высвобождению ATP и модулирующих межклеточную передачу кальциевых волн [115].
ЗАКЛЮЧЕНИЕ
Интерес к изучению структуры, функций, жизненного цикла ЩК и составляющих их белков в клетках живых организмов в норме и при развитии патологий отмечен в течение последних 50 лет, и количество этих исследований продолжает возрастать и в настоящее время. Актуальность исследований этих структур в ЦНС обуславливается представлением о том, что объединенные ЩК клетки могут быть морфологической основой регуляторных механизмов в мозге, чрезвычайно важной для правильной работы неокортекса, гиппокампа, таламических ядер и других структур мозга.
Известно, что среди существующих индивидуальных коннексинов, специфичными и наиболее важными для ЦНС являются коннексины Сх36, Сх45, Сх43, Сх30, Сх26 и Сх32. Доменная структура генов коннексинов состоит из двух экзонов, кодирующие участки которых могут прерываться некодирующими интронами. Для многих коннексинов, в том числе для коннексинов ЦНС, характерно наличие сплайс-изоформ транскриптов, экспрессия которых является специфичной для различных тканей и органов. Экспрессия коннексинов может регулироваться как на транскрипционном, так и на трансляционном уровнях и является постоянным активным динамическим процессом клетки из-за короткого периода жизни как самого белка, так и ЩК. Причины короткого периода полураспада коннексинов и ЩК в клетке до сих пор неизвестны. Вновь синтезированная молекула каждого коннексина имеет характерную структуру с внутриклеточными, внеклеточными и мембранными доменами, каждый из которых выполняет свои специфические функции. В процессе миграции к плазматической мембране коннексины претерпевают олигомеризацию, или сборку молекул в гексагональную структуру, – коннексон. При состыковке коннексонов могут образовываться различные типы щелевых контактов, в том числе в ЦНС: гетеромерные гетеротипические, гомомерные гетеротипические, гетеромерные гомотипические, гомомерные гомотипичсеские. Однако механизм стыковки и принцип совместимости этих полуканалов до конца не изучен. Гомотипические и гетеротипические ЩК могут обладать разными стробирующими свойствами. Деградация коннексинов в составе ЩК происходит с помощью эндо/экзоцитозного процесса и образования коннексосом с последующим разрушением этих структур в лизосомах или аутолизосомах.
Исследования ЩК ЦНС условно можно разделить на два типа: изучение нейро-нейрональных ЩК, составленных из Сх36 и/или Сх45, а также изучение глиа-глиальных ЩК, содержащих основные коннексины макроглии (Сх43, Сх30, Сх32, Сх26 и др.). Помимо коннексинов, для ЦНС известно существование и альтернативных каналообразующих белков ЩК – паннексинов, функция которых на настоящий момент является недостаточно ясной. При схожих морфологических характеристиках нейрональные ЩК, содержащие Сх36, и макроглиальные ЩК, содержащие Сх43, имеют различное функциональное назначение. Существование ЩК между нервными клетками связывают с обеспечением процессов синхронизации как локальной импульсной активности, так и ритмической активности целых групп нейронов определенного типа развивающегося и взрослого мозга, объединенных этими контактами. Ансамбли тормозных нейронов, объединенных электрическими синапсами, были обнаружены в неокортексе и гиппокампе, однако остаются неизученными во многих других областях мозга. Подобные сети нейронов могут играть важную роль в формировании и консолидации памяти, обработке пространственно-временнóй, сенсорной, внутриорганной информации, механизмах восприятия, концентрации внимания и других когнитивных процессах. Глиа-глиальные ЩК и коннексины еще при развитии мозга способствуют адгезии во время миграции нейронов по тяжам радиальной глии. Во взрослом мозге такие контакты способствуют образованию глиальных синцитиев, выполняющих ряд важных функций, например контроль концентрации внеклеточных ионов и нейротрансмиттеров, а также осуществлению метаболических процессов и поддержанию внутриклеточного и внеклеточного гомеостаза. Кроме того, обеспечивая распространение калиевых и кальциевых волн в глиальном синцитии, ЩК и полуканалы напрямую способны контролировать активность как отдельных нейронов, так и нейронных сетей. Для осуществления этих функций в синцитии необходимым условием является открытие ЩК, что связано с наличием полиаминов (спермина, спермидина, путресцина, агматина). Во взрослом мозге накопление полиаминов является уникальной отличительной особенностью именно астроцитов, но не нейронов.
ЩК и коннексины являются объектом исследований при изучении патогенеза различных заболеваний, в том числе распространенных заболеваний ЦНС. Существуют врожденные мутации генов коннексинов, приводящие к наследственным заболеваниям, таким как потеря слуха, кожные заболевания, нейропатии, ассоциированные с демиелинизацией, ремиелинизацией и дисплазией клеток, аутизм и др. Дальнейший анализ особенностей молекулярной структуры, физиологических и поведенческих функций ЩК и коннексинов может способствовать развитию таргетной терапии коннексин-ассоциированных заболеваний, в том числе с помощью генной инженерии. Терапевтическое средство должно быть направлено на исправление поврежденных генов коннексинов, а также на стимуляцию восстановления новых белков и ЩК, и обеспечивать персонализированное лечение наследственных заболеваний человека.
Следует отметить большое значение исследований экспрессии коннексинов и формирования ЩК в контексте нейроканцерогенеза. Это исследовательское направление находится в самом начале своего развития. Однако уже первые работы в этой области позволяют говорить о формировании нового взгляда на индивидуальную предрасположенность к опухолям головного мозга, а также о перспективе новых возможностей в диагностике и лечении неоплазм ЦНС. Различные сплайс-изоформы коннексинов, потенциальные регуляторные участки их генов и транскриптов, домены молекулы коннексина, управление функциональным состоянием ЩК могут послужить инструментами для поиска и создания новых терапевтических стратегий, основанных на регуляции экспрессии коннексинов и активности щелевых контактов и полуканалов в опухолях головного мозга человека.
Работа поддержана грантом Министерства науки и высшего образования РФ № БАЗ 0110/20-5-14АБ, а также грантом Национальныx Институтов Здоровья США-NIH-NINDS № 1R15-NS-116 478-01.
Список литературы
Robertson J.D. 1953. Ultrastructure of two invertebrate synapses. Proceedings of the society for experimental biology and medicine. Proc. Soc. Exp. Biol. Med. 82 (2), 219–223.
Sjostrand F.S., Andersson-Cedergren E, Dewey M.M. 1958. The ultrastructure of the intercalated discs of frog, mouse and guinea pig cardiac muscle. J. Ultrastruct. Res. 1 (3), 271–287.
Hinrichsen C.F., Larramendi L.M. 1968. Synapses and cluster formation of the mouse mesencephalic fifth nucleus. Brain Res. 7 (2), 296–299.
Korn H., Sotelo C., Crepel F. 1973. Electrotonic coupling between neurons in the rat lateral vestibular nucleus. Exp. Brain Res. 16, 255–275.
Baker R., Llinás R. 1971. Electrotonic coupling between neurons in the rat mesencephalic nucleus. J. Physiol. 212, 45–63.
Sloper J.J, Powell T.P.S. 1978. Gap junctions between dendrites and somata of neurons in the primate sensori-motor cortex. Proc. R. Soc. Lond. B. Biol. Sci. 203, 39–47.
Nagy J.I., Dudek F.E., Rash J.E. 2004. Update on connexins and gap junctions in neurons and glia in the mammalian nervous system. Brain Res. Rev. 47, 191–215.
Rash J.E., Yasumura T., Davidson K.G., Furman C.S., Dudek F.E., Nagy J.I. 2001. Identification of cells expressing Cx43, Cx30, Cx26, Cx32 and Cx36 in gap junctions of rat brain and spinal cord. Cell Commun. Adhes. 8 (4–6), 315–320.
Connors B.W., Long M.A. 2004. Electrical synapses in the mammalian brain. Annu. Rev. Neurosci. 27, 393–418.
Nagy J. I., Pereda A. E., Rash J. E. 2018. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochim. Biophys. Acta Biomembr. 1860 (1), 102–123.
Eugenin E.A., Basilio D., Sáez J.C., Orellana J.A., Raine C.S., Bukauskas F., Bennett M.V., Berman J.W. 2012. The role of gap junction channels during physiologic and pathologic conditions of the human central nervous system. J. Neuroimmune Pharmacol. 7 (3), 499–518.
Giaume C.B., Naus C.C., Saez J.C., Leybaert L. 2020. Glial connexins and pannexins in the healthy and diseased brain. Physiol. Rev. https://doi.org/10.1152/physrev.00043.2018
Gutiérrez Y., García-Marques J., Liu X., Fortes-Marco L., Sánchez-González R., Giaume C., López-Mascaraque L. 2019. Sibling astrocytes share preferential coupling via gap junctions. Glia. 67 (10), 1852–1858.
Hanani M., Spray D. C. 2020. Emerging importance of satellite glia in nervous system function and dysfunction. Nat. Rev. Neurosci. 21 (9), 485–498.
Grubišić V., Parpura V. 2017. Two modes of enteric gliotransmission differentially affect gut physiology. Glia. 65 (5), 699–711.
Caspar D.L.D., Goodenough D.A., Makowski L., Phillips W.C. 1977. Gap junction structures. Correlated electron microscopy and x-ray diffraction. J. Cell Biol. 74, 605–628.
Staehelin L.A., Hull B.E. 1978. Junctions between living cells. Sci. Am. 238 (5), 141–152.
Skatchkov S.N., Woodbury-Fariña M.A., Eaton M. 2014. The role of glia in stress. Psychiatr. Clin. North Am. 37, 653–678.
Nagy J., Rash J.E. 2000. Connexins and gap junctions of astrocytes and oligodendrocytes in the CNS. Brain Res. Rev. 32, 29–44.
Gibson J.R., Beierlein M., Connors B.W. 2005. Functional properties of electrical synapses between inhibitory interneurons of neocortical layer 4. J. Neurophysiol. 93, 467–480.
Zhang X.L., Zhang L., Carlen P.L. 2004. Electrotonic coupling between stratum oriens interneurones in the intact in vitro mouse juvenile hippocampus. J. Physiol. 558, 825–839.
Willecke K., Elberger J., Degen J., Eckardt D., Romualdi A., Güldenagel M., Deutsch U., Söhl G. 2002. Structural and functional diversity of connexin genes in the mouse and human genome. Biol. Chem. 383, 725–737.
Sohl G., Willecke K. 2004. Gap junctions and the connexin protein family. Cardiovasc. Res. 62, 228–232.
Oyamada M., Oyamada Y., Takamatsu T. 2005. Regulation of connexin expression (Review). Biochim. Biophys. Acta. 1719 (1–2), 6–23.
Cicirata F., Parenti R., Spinella F., Giglio S., Tuorto F., Zuffardi O., Gulisano M., 2000. Genomic organization and chromosomal localization of the mouse Connexin36 (mCx36) gene. Gene. 251 (2), 123–130.
Maltzahn J., Euwens C., Willecke K., Sohl G. 2004. The novel mouse connexin39 gene is expressed in developing striated muscle fibers. J. Cell Sci. 117, 5381–5392.
Hombach S., Janssen-Bienhold U., Sohl G., Schubert T., Bussow H., Ott T., Weiler R., Willecke K. 2004. Functional expression of connexin57 in horizontal cells of themouse retina. Eur. J. Neurosci. 19, 2633–2640.
Sohl G., Gillen C., Bosse F., Gleichmann M., Muller H.W., Willecke K. 1996. A second alternative transcript of the gap junction gene connexin32 is expressed in murine Schwann cells and modulated in injured sciatic nerve. Eur. J. Cell Biol. 69, 267–275.
Neuhaus I.M., Bone L., Wang S., Ionasescu V., Werner R. 1996. The human connexin32 gene is transcribed from two tissue-specific promoters. Biosci. Rep. 16, 239–248.
Duga S., Asselta R., Del Giacco L., Malcovati M., Ronchi S., Tenchini M.L., Simonic T. 1999. A new exon in the 5′ untranslated region of the connexin32 gene. Eur. J. Biochem. 259, 188–196.
Sohl G., Theis M., Hallas G., Brambach S., Dahl E., Kidder G., Willecke K. 2001. A new alternatively spliced transcript of the mouse connexin32 gene is expressed in embryonic stem cells, oocytes, and liver. Exp. Cell Res. 266, 177–186.
Oyamada M., Takebe K., Oyamada Y. 2013. Regulation of connexin expression by transcription factors and epigenetic mechanisms. Biochim. Biophys. Acta. 1828 (1), 118–133.
Bedner P., Steinhauser C., Theis M. 2012. Functional redundancy and compensation among members of gap junction protein families? Biochim. Biophys. Acta. 1818 (8), 1971–1984.
Bennett M.V., Zukin R.S. 2004. Electrical coupling and neuronal synchronization in the Mammalian brain. Neuron. 41 (4), 495–511.
Das S., Smith T.D., Sarma J.D., Ritzenthaler J.D., Maza J., Kaplan B.E., Cunningham L.A., Suaud L., Hubbard M.J., Rubenstein R.C., Koval M. 2009. ERp29 restricts Connexin43 oligomerization in the endoplasmic reticulum. Mol. Biol Cell. 20 (10), 2593–2604.
Maza J., Das Sarma J., Koval M. 2005. Defining a minimal motif required to prevent connexin oligomerization in the endoplasmic reticulum. J. Biol. Chem. 280 (22), 21115–21121.
Thévenin A.F., Kowal T.J., Fong J. T., Kells R.M., Fisher C.G., Falk M.M. 2013. Proteins and mechanisms regulating gap-junction assembly, internalization, and degradation. Physiology (Bethesda). 28 (2), 93–116.
Maeda S., Nakagawa S., Suga M., Yamashita E., Oshima A., Fujiyoshi Y. Tsukihara T. 2009. Structure of the connexin 26 gap junction channel at 3.5 A resolution. Nature. 458, 597–602.
Hamdan R., Maissa Y., Rabih S. Talhouk, Marwan E. El-Sabban. 2013. Pathophysiology of gap junctions. in the brain. In: Gap Junctions in the Brain, Physiological and Pathological Roles. Ekrem Dere. USA: Acad. Press, p. 60–95.
Aasen T., Johnstone S.,Vidal-Brime L., Lynn K.S., Koval M. 2018. Connexins: Synthesis, post-translational modifications, and trafficking in health and disease. Int. J. Mol. Sci. 19 (5), 1296.
Solan J.L., Lampe P.D. 2018. Spatio-temporal regulation of connexin43 phosphorylation and gap junction dynamics. Biochim. Biophys. Acta Biomembr. 1860 (1), 83–90.
Gaietta G., Deerinck T.J., Adams S.R., Bouwer J., Tour O., Laird D.W., Sosinsky G.E., Tsien R.Y., Ellisman M.H. 2002. Multicolor and electron microscopic imaging of connexin trafficking. Science. 296, 503–507
Kopanic J.L., Schlingmann B., Koval M., Lau A.F., Sorgen P.L., Vivian F. Su. 2015. Degradation of gap junction connexins is regulated by the interaction with Cx43-interacting protein of 75 kDa (CIP75). Biochem. J. 466 (3), 571–585.
Laird D. 2005. Connexin phosphorylation as a regulatory event linked to gap junction internalization and degradation. Biochim. Biophys. Acta. 1711, 172–182.
Lichtenstein A., Minogue P.J., Beyer E.C., Berthoud V.M. 2011. Autophagy: a pathway that contributes to connexin degradation. J. Cell Sci. 124, 910–920.
Falk M.M., Kells R.M., Berthoud V.M. 2014. Degradation of connexins and gap junctions. FEBS Lett. 588 (8), 1221–1229.
Scita G., Di Fiore P.P. 2010. The endocytic matrix. Nature. 463, 464–473.
Ayad W.A., Locke D., Koreen I.V., Harris A.L. 2006. Heteromeric, but not homomeric, connexin channels are selectively permeable to inositol phosphates. J. Biol. Chem. 281 (24), 16727–16739.
Lin X., Gemel J., Glass A., Zemlin C.W., Beyer E.C., Veenstra R.D. 2010. Connexin40 and connexin43 determine gating properties of atrial gap junction channels. J. Mol. Cell Cardiol. 48, 238–245.
Gong X.-Q., Nakagawa S., Tsukihara T., Bai D. 2013. A mechanism of gap junction docking revealed by functional rescue of a human-disease-linked connexin mutant. J. Cell Sci. 126 (Pt 14), 3113–3120.
White T.W., Bruzzone R., Wolfram S., Paul D.L. 1994. Goodenough D.A. Selective interactions among the multiple connexin proteins expressed in the vertebrate lens: The second extracellular domain is a determinant of compatibility between connexins. J. Cell Biol. 125, 879–892.
Suga M., Maeda S., Nakagawa S.,Yamashita E., Tsukihara T. 2009. A description of the structural determination procedures of a gap junction channel at 3.5 A resolution. Acta Crystallogr. D. Biol. Crystallogr. 65, 758–766.
Kleopa K.A., Abrams C.K., Scherer S.S. 2012. How do mutations in GJB1 cause X-linked Charcot-Marie-Tooth disease? Brain Res. 1487, 198–205.
Paznekas W.A., Karczeski B., Vermeer S., Lowry R.B., Delatycki M., Laurence F., Koivisto P.A., Van Maldergem L., Boyadjiev S.A., Bodurtha J.N., Jabs E.W. 2009. GJA1 mutations, variants, and connexin 43 dysfunction as it relates to the oculodentodigital dysplasia phenotype. Hum. Mutat. 30, 724–733.
Scherer S.S., Wrabetz L. 2008. Molecular mechanisms of inherited demyelinating neuropathies. Glia. 56, 1578–1589.
Bai D. 2014. Atrial fibrillation-linked GJA5/connexin40 mutants impaired gap junctions via different mechanisms. FEBS Lett. 588,1238–1243.
Beyer E.C., Ebihara L., Berthoud V.M. 2013. Connexin mutants and cataracts. Front. Pharmacol. 4, 43.
Teubner B., Degen J., Söhl G., Güldenagel M., Bukauskas F.F., Trexler E.B., Verselis V.K., De Zeeuw C.I., Lee C.G., Kozak C.A., Petrasch-Parwez E., Dermietzel R., Willecke K. 2000. Functional expression of the murine connexin 36 gene coding for a neuron-specific gap junctional protein. J. Membr. Biol. 176, 249–262.
Srinivas M., Rozental R., Kojima T., Dermietzel R., Mehler M., Condorelli D.F., Kessler J.A., Spray D.C. 1999. Functional properties of channels formed by the neuronal gap junction protein connexin36. J. Neurosci. 19, 9848–9855.
Venance L., Rozov A., Blatow M., Burnashev N., Feldmeyer D., Monyer H. 2000. Connexin expression in electrically coupled postnatal rat brain neurons. Proc. Natl. Acad. Sci. USA. 97, 10 260–10 265.
Peinado A. 2001. Immature neocortical neurons exist as extensive syncitial networks linked by dendrodendritic electrical connections. J. Neurophysiol. 85 (2), 620–629.
Condorelli D.F., Belluardo N., Trovato-Salinaro A., Mudò G. 2000. Expression of Cx36 in mammalian neurons. Brain Res. Rev. 32, 72–85.
Fukuda T, Kosaka T, Singer W, Galuske RA. 2006. Gap junctions among dendrites of cortical GABAergic neurons establish a dense and widespread intercolumnar network. J. Neurosci. 26 (13), 3434–3443.
Shigematsu N., Nishi A., Fukuda T. 2019. Gap junctions interconnect different subtypes of parvalbumin-positive interneurons in barrels and septa with connectivity unique to each subtype. Cerebral Cortex. 29, 1414–1429.
Hormuzdi S.G., Pais I., LeBeau F.E., Towers S.K., Rozov A., Buhl E.H., Whittington M.A., Monyer H. 2001. Impaired electrical signaling disrupts gamma frequency oscillations in connexin-36 deficient mice. Neuron. 31, 487–496.
Deans M.R., Gibson J.R., Sellitto C., Connors B.W., Paul D.L. 2001. Synchronous activity of inhibitory networks in neocortex requires electrical synapses containing connexin36. Neuron. 31, 477–485.
Maxeiner S., Krüger O., Schilling K., Traub O., Urschel S., Willecke K. 2003. Spatiotemporal transcription of connexin45 during brain development results in neuronal expression in adult mice. Neuroscience. 119, 689–700.
Krüger O., Plum A., Kim J.S., Winterhager E., Maxeiner S., Hallas G., Kirchhoff S., Traub O., Lamers W.H., Willecke K. 2000. Defective vascular development in connexin 45-deficient mice. Development. 127, 4179–4193.
Zhang C., Restrepo D. 2002. Expression of connexin 45 in the olfactory system. Brain Res. 929, 37–47.
Van der Giessen R.S., Maxeiner S., French P.J., Willecke K., De Zeeuw C.I. 2006. Spatiotemporal distribution of Connexin45 in the olivocerebellar system. J. Comp. Neurol. 495, 173–184.
González D., Gómez-Hernández J.M., Barrio L.C. 2007. Molecular basis of voltage dependence of connexin channels: an integrative appraisal. Prog. Biophys. Mol. Biol. 94, 66–106.
Dere E., Zlomuzica A. 2012. The role of gap junctions in the brain in health and disease. Neurosci. Biobehav. Rev. 36, 206–217.
Olsen M. L., Khakh B. S., Skatchkov S. N., Zhou M., Lee C.J., Rouach N. 2015. New insights on astrocyte ion channels: Critical for homeostasis and neuron-glia signaling. J. Neurosci. 35 (41), 13827–13835.
Grubišić V., Parpura V. 2015. The second brain in autism spectrum disorder: could connexin 43 expressed in enteric glial cells play a role? Front. Cell. Neurosci. 9, 242.
Bruzzone R., Dermietzel R. 2006. Structure and function of gap junctions in the developing brain. Cell Tissue Res. 326, 239–248.
Cina C., Bechberger J.F., Ozog M.A., Naus C.C.G. 2007. Expression of connexins in embryonic mouse neocortical development. J. Comp. Neurol. 504, 298–313.
Elias L.A., Wang D.D., Kriegstein A.R. 2007. Gap junction adhesion is necessary for radial migration in the neocortex. Nature. 448, 901–907.
Yamamoto T., Vukelic J., Hertzberg E.L., Nagy J.I. 1992. Differential anatomical and cellular patterns of connexin43 expression during postnatal development of rat brain. Brain Res. Dev. 66, 165–180.
Kirichenko E.Y., Churyumova G.A., Logvinov A.K. 2016. Ultrastructural study of glial gap junctions in the thalamic nuclei of rat. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology. 10, (3), 207–217.
Benedikt J., Inyushin M., Kucheryavykh Y. V., Rivera Y., Kucheryavykh L.Y., Nichols C.G., Eaton M.J., Skatchkov S.N. 2012. Intracellular polyamines enhance astrocytic coupling. Neuroreport. 23 (17), 1021–1025.
Laube G., Bernstein H.-G. 2017. Agmatine: multifunctional arginine metabolite and magic bullet in clinical neuroscience? Biochem. J. 474, 2619–2640.
Laube G., Veh R.W. 1997. Astrocytes, not neurons, show most prominent staining for spermidine/spermine-like immunoreactivity in adult rat brain. Glia. 19, 171–179.
Hamon L., Savarin P., Pastré D. 2016. Polyamine signal through gap junctions: A key regulator of proliferation and gap-junction organization in mammalian tissues? Bioessays. 38 (6), 498–507.
Skatchkov S.N., Antonov S.M., Eaton M.J. 2016. Glia and glial polyamines. Role in brain function in health and disease. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology. 10, 73–98.
Musa H., Fenn E., Crye M., Gemel J., Beyer E.C., Veenstra R.D. 2004. Amino terminal glutamate residues confer spermine sensitivity and affect voltage gating and channel conductance of rat connexin40 gap junctions. J. Physiol. 557, 863–878.
Gemel J., Lin X., Veenstra R.D., Beyer E.C. 2006. N-terminal residues in Cx43 and Cx40 determine physiological properties of gap junction channels, but do not influence heteromeric assembly with each other or with Cx26. J. Cell Sci. 119, 2258–2268.
Skatchkov S.N., Bukauskas F.F., Benedikt J., Inyushin M., Kucheryavykh Y.V. 2015. Intracellular spermine prevents acid-induced uncoupling of Cx43 gap junction channels. Neuroreport. 26, 528–532.
Kucheryavykh L.Y., Benedikt J., Cubano L.A., Skatchkov S.N., Bukauskas F.F., Kucheryavykh Y.V. 2017. Polyamines reserve connexin 43-mediated gap junctional communication during intracellular hypercalcemia and acidosis. Neuroreport. 28 (4), 208–213.
Zayas-Santiago A., Agte S., Rivera Y., Benedikt J., Ulbricht E., Karl A., Dávila J., Savvinov A., Kucheryavykh Y., Inyushin M., Cubano L.A., Pannicke T., Veh R.W., Francke M., Verkhratsky A., Eaton M.J., Reichenbach A., Skatchkov S.N. 2014. Unidirectional photoreceptor-to-Müller glia coupling and unique K+ channel expression in Caiman retina. PLoS One. 9 (5), e97155.
Biedermann B., Skatchkov S.N., Brunk I., Bringmann A., Pannicke T., Bernstein H.G., Faude F., Germer A., Veh R., Reichenbach A. 1998. Spermine/spermidine is expressed by retinal glial (Muller) cells and controls distinct K+ channels of their membrane. Glia. 23, 209–220.
Ma B., Buckalew R., Du Y., Kiyoshi C.M., Alford C.C., Wang W., McTigue D.M., Enyeart J.J., Terman D., Zhou M. 2016. Gap junction coupling confers isopotentiality on astrocyte syncytium. Glia. 64 (2), 214–226.
Poopalasundaram S., Knott C., Shamotienko O.G., Foran P.G., Dolly J.O., Ghiani C.A., Gallo V., Wilkin G.P. 2000. Glial heterogeneity in expression of the inwardly rectifying K-channel, Kir4.1, in adult rat CNS. Glia. 30, 362–372.
Sala-Rabanal M., Kucheryavykh L.Y., Skatchkov S.N., Eaton M.J., Nichols C.G. (2010) Molecular mechanisms of EAST/SeSAME syndrome mutations in Kir4.1 (KCNJ10). J. Biol. Chem. 285, 36 040–36 048.
Wang Q., Wang W., Aten S., Kiyoshi C.M., Du Y., Zhou M. 2020. Epileptiform neuronal discharges impair astrocyte syncytial isopotentiality in acute hippocampal slices. Brain Sci. 10 (4), 208.
Loo L.W., Berestecky J.M., Kanemitsu M.Y., Lau A.F. 1995. pp60src-mediated phosphorylation of connexin 43, a gap junction protein. J. Biol. Chem. 270, 12 751–12 761.
Scemes E., Dermietzel R., Spray D.C. 1998. Calcium waves between astrocytes from Cx43 knockout mice. Glia. 24, 65–73.
Koulakoff A., Ezan P., Giaume C. 2008. Neurons control the expression of connexin 30 and connexin 43 in mouse cortical astrocytes. Glia. 56, 1299–1311.
Kunzelmann P., Schroder W., Traub O., Steinhauser C., Dermietzel R., Willecke K. 1999. Late onset and increasing expression of the gap junction protein connexin30 in adult murine brain and long-term cultured astrocytes. Glia. 25, 111–119.
Nagy J.I., Patel D., Ochalski P.A., Stelmack G.L. 1999. Connexin30 in rodent, cat and human brain: Selective expression in gray matter astrocytes, co-localization with connexin43 at gap junctions and late developmental appearance. Neuroscience. 88 (2), 447–468.
Kirichenko E.Yu., Povilaitite P.E., Logvinov A.K., Kirichenko Yu.G., Filippova S.Yu. 2018. Gap junctions in the composition of neurogliovascular ensembles in rat cortical barrel columns. Cell and Tissue Biology. 12 (6), 477–483.
Teubner B, Michel V, Pesch J, et al. 2003. Connexin30 (Gjb6)-deficiency causes severe hearing impairment and lack of endocochlear potential. Hum. Mol. Genet. 12, 13–21.
Filippov M.A., Hormuzdi S.G., Fuchs E.C., Monyer H. 2003. A reporter allele for investigating connexin 26 gene expression in the mouse brain. Eur. J. Neurosci. 18, 3183–3192.
Rash J.E., Olson C.O., Davidson K.G., Yasumura T., Kamasawa N., Nagy J.I. 2007. Identification of connexin36 in gap junctions between neurons in rodent locus coeruleus. Neuroscience. 147, 938–956.
Richard G., White T.W., Smith L.E., Bailey R.A., Compton J.G., Paul D.L., Bale S.J. 1998. Functional defects of Cx26 resulting from a heterozygous missense mutation in a family with dominant deaf-mutism and palmoplantar keratoderma. Hum. Genet. 103, 393–399.
Heathcote K., Syrris P., Carter N.D., Patton M.A. 2000. A connexin 26 mutation causes a syndrome of sensorineural hearing loss and palmoplantar hyperkeratosis (MIM 148350). J. Med. Genet. 37 (1), 50–51.
Todt I., Mazereeuw-Hautier J., Binder B., Willems P.J. 2009. Dandy–Walker malformation in patients with KID syndrome associated with a heterozygote mutation (p.Asp50Asn) in the GJB2 gene encoding connexin 26. Clin. Genet. 76, 404–408.
Scherer S.S., Deschênes S.M., Xu Y.T., Grinspan J.B., Fischbeck K.H., Paul D.L. 1995. Connexin32 is a myelin-related protein in the PNS and CNS. J. Neurosci. 15, 8281–8294.
Scherer S.S., Xu Y.T., Nelles E., Fischbeck K., Willecke K., Bone L.J. 1998. Connexin32-null mice develop demyelinating peripheral neuropathy. Glia. 24, 8–20.
Phelan P., Starich T.A. 2001. Innexins get into the gap. Bioessays. 23, 388–396.
Landesman Y., White T.W., Starich T.A., Shaw J.E., Goodenough D.A., Paul D.L. 1995. Innexin-3 forms connexin-like intercellular channels. J. Cell Sci. 112, 2391–2396.
Panchin Y., Kelmanson I., Matz M., Lukyanov K., Usman N. Lukyanov S. 2000. A ubiquitous family of putative gap junction molecules. Curr. Biol. 10 (13), R473–474.
Baranova A., Ivanov D., Petrash N., et al. 2004. The mammalian pannexin family is homologous to the invertebrate innexin gap junction proteins. Genomics. 83, 706–716.
Bruzzone R., Hormuzdi S.G., Barbe M.T., Herb A., Monyer H. 2003. Pannexins, a family of gap junction proteins expressed in brain. Proc. Natl. Acad. Sci. USA. 100, 13644–13649.
Hua V.B., Chang A.B., Tchieu J.H., Nielsen P.A., Saier Jr.M.H. 2003. Sequence and phylogenetic analyses of 4 TMS junctional proteins of animals: Connexins, innexins, claudins and occludins. J. Mem. Biol. 194, 59–76.
Scemes E., Suadicani S.O., Dahl G., Spray D.C. 2007. Connexin and pannexin mediated cell-cell communication. Neuron Glia Biol. 3, 199–208.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


