Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 2, стр. 123-128
Стириловые красители di-4-ANEPPS и RH-421 как датчики протонов на поверхности липидных мембран
А. Н. Константинова a, Ю. В. Харитонова a, b, В. Ю. Ташкин a, В. С. Соколов a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Россия
* E-mail: sokolovvs@mail.ru
Поступила в редакцию 09.11.2020
После доработки 22.11.2020
Принята к публикации 24.11.2020
Аннотация
Показано, что электрохромные стириловые красители могут быть использованы как зонды для изучения связывания протонов на поверхности мембраны. Эти красители адсорбируются на мембране как нейтральные молекулы, обладающие значительным дипольным моментом, из-за чего на границе мембраны с раствором возникает дипольный скачок потенциала. Понижение рН приводило к исчезновению как этого скачка потенциала, так и флуоресценции связанных с мембраной молекул красителей di-4-ANEPPS или RН-421. Это объясняется тем, что протонированные молекулы красителей, образующиеся при низких рН, не способны адсорбироваться на липидных мембранах. По измеренной в эксперименте зависимости дипольного скачка потенциала от рН сделана оценка pK красителей, которая составила около 4.5. Десорбция молекул красителей с поверхности липидной мембраны происходила не только при понижении рН в растворе, но и при фотоактивированном освобождении протонов на поверхности мембраны, вызванном фотолизом молекул Caged-H+ – 2-метокси-5-нитрофенилсульфатом натрия. Это свидетельствует о значительном увеличении концентрации протонов на поверхности липидной мембраны, вызванном этим процессом.
ВВЕДЕНИЕ
В последнее время интерес исследователей привлекает особое состояние протонов на поверхности мембраны. Предполагают, что обмен протонов, связанных на поверхности, с водным раствором происходит через высокий потенциальный барьер. Из-за барьера перемещение протонов в мембране между донором и акцептором может происходить вдоль ее поверхности, а не через водный раствор [1]. На этом основаны различные гипотезы окислительного фосфорилирования [2]. Ключевой вопрос, ответ на который позволяет проверить подобные механизмы, состоит в оценке величины потенциального барьера между протонами на поверхности и в воде. Для выяснения этого вопроса проводились исследования диффузии протонов вдоль мембраны с применением флуоресцентных зондов [3–6]. Один из экспериментальных способов обеспечить скачок концентрации протонов на поверхности мембраны основан на применении фотоактивируемых соединений “Caged-H+”, молекулы которых связаны на мембране и освобождают протоны при поглощении кванта света [3, 7, 8]. Одно из таких соединений изучалось нами ранее. Было показано, что при фотоактивации этого соединений вспышкой УФ-света происходит изменение емкости мембраны и скачка электростатического потенциала на ее границе [9]. Были сделаны оценки изменения рН около мембраны, составляющие менее 0.1 ед. [10], но они представляются заниженными и, возможно, отражают изменение рН не на поверхности, а в неперемешиваемом слое в воде около мембраны Для корректного изучения связывания протонов на поверхности мембраны желательно использовать рН-чувствительный зонд с известными характеристиками. В данной работе исследуется возможность использования в качестве такого зонда молекул стириловых красителей di-4-ANEPPS и RH-421 (рис. 1а). Ранее они использовались нами как мишени синглетного кислорода, измерение скорости окисления которых на поверхности мембраны позволяло оценить эффективность фотосенсибилизаторов [11]. Оказалось, что адсорбция этих красителей на мембране зависит от рН [12]. В настоящей работе влияние рН на адсорбцию красителей на липидной мембране изучено более подробно, и показано, что эти красителя могут быть использованы и как pH-зонды, позволяющие регистрировать скачок концентрации протонов, связанных на поверхности мембраны, при фотоактивации “Caged-H+”.
Рис. 1.
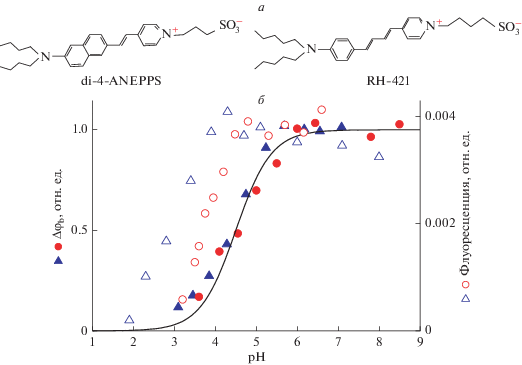
а – Структуры di-4-ANEPPS и RH-421. б – Зависимости изменения граничного потенциала БЛМ (сплошные символы, шкала слева) и флуоресценции липосом (пустые символы, шкала справа) при адсорбции RH-421 (кружки) или di-4-ANEPPS (треугольники) от рН раствора. Данные для di-4-ANEPPS взяты из [12]. Концентрация RH-421 при измерении Δφb составляла 3 мкМ, при измерении флуоресценции – 1 мкМ. Раствор содержал 20 мМ KCl, 2 мМ цитрат, 2 мМ HEPES. Зависимость Δφb от рН получена при добавлении di-4-ANEPPS или RH-421 в раствор с одной стороны мембраны, а HCl или KOH – с двух сторон мембраны. Значения потенциала, нормированные на величины в области плато при высоких рН, получены усреднением по результатам не менее трех экспериментов. Кривая проведена по уравнению $\Delta {{\varphi }_{{\text{b}}}} = \frac{1}{{1 + {{{10}}^{{{\text{pK}} - {\text{pH}}}}}}}$ с параметром pK = 4.5.
МАТЕРИАЛЫ И МЕТОДЫ
Бислойные липидные мембраны (БЛМ) формировали методом Мюллера–Рудина в тефлоновой ячейке на отверстии диаметром 0.8 мм из раствора дифитаноилфосфатидилхолина (Avanti Polar Lipids, США) в н-декане в концентрации 15 мг/мл. Растворы готовили на дважды дистиллированной воде c использованием KCl, лимонной кислоты (Россия), HEPES, Трис и имидазола (Sigma, США). В экспериментах использовались стириловые красители di-4-ANEPPS и RH-421 (Sigma-Aldrich, США), а также Caged-H+ – 2-метокси-5-нитрофенилсульфат натрия (MNPS), синтезированный А.И. Иловайским в Институте органической химии им. Н.Д. Зелинского РАН. При освещении БЛМ постоянным светом использовали ультрафиолетовый светодиод LED-003W-48C-000-000LM-EL-P с длиной волны 375 нм и электрической мощностью 3 Вт (Artleds, Россия). Caged-H+ добавляли в дальний (по отношению к источнику света) отсек ячейки. Растворы в обоих отсеках ячейки непрерывно перемешивались с помощью магнитной мешалки.
В измерениях использовали хлорсеребряные электроды с агаровыми мостиками, заполненными тем же раствором, который находился в ячейке. Разность граничных потенциалов измеряли методом компенсации внутримембранного поля, разработанным в [13] (см. также обзоры [14, 15]). Экспериментальная установка для измерений этим методом была идентична использованной в наших предыдущих работах [11].
Флуоресценцию измеряли на спектрофлуориметре “Флуорат-2 “Панорама” (Люмэкс, Россия) при длине волны возбуждения 500 нм, регистрации – 594 нм. Липосомы готовили из дифитаноилфосфатидилхолина с помощью экструдера, используя фильтры с размером пор 100 нм. Концентрация липида составляла 0.2 мг/мл. Флуоресценция красителей в водном растворе в отсутствие липосом не наблюдалась.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследования адсорбции стириловых красителей на мембране показали, что она зависит от рН. Зависимость адсорбции красителей от рН изучалась двумя методами: по измерению разности граничных потенциалоа Δφb на плоских БЛМ и флуоресценции липосом. Зависимости Δφb и флуоресценции от рН в случае di-4-ANEPPS изучались нами ранее [12], а для RH-421 эти зависимости были получены в настоящей работе. Для удобства сравнения двух красителей потенциалы нормировались на величины в области плато, наблюдавшееся при высоких значениях рН. Полученные зависимости изображены на рис. 1б.
Известно, что молекулы красителей обладают значительным дипольным моментом, образованным положительно заряженным атомом азота в середине молекулы и отрицательно заряженной сульфогруппой на ее конце (рис. 1а). Они адсорбируются на поверхности мембраны в нейтральном виде, встраиваясь в мембрану гидрофобным концом молекулы, и создают на ней дипольный скачок потенциала со знаком плюс внутри мембраны [16]. Исчезновение этого потенциала при уменьшении рН можно объяснить тем, что при низких рН происходит протонирование второго атома азота молекулы красителя, из-за чего она становится положительно заряженной. При этом гидрофобная область молекулы становится более полярной, что значительно уменьшает ее сродство к мембране. Протонированные молекулы красителей в водном растворе были обнаружены по спектрам поглощения, которые зависели от рН [17].
При уменьшении рН исчезает и флуоресценция красителей на липосомах, поскольку способностью к флуоресценции обладают только те молекулы красителей, которые связаны с липидной мембраной [12]. Поэтому интенсивность флуоресценции свидетельствует о количестве молекул красителя, адсорбированных на мембранах липосом. Зависимость интенсивности флуоресценции от рН приведена на рис. 1б. Как показывает рисунок, флуоресценция обоих красителей при уменьшении рН исчезала. В целом зависимости от рН флуоресценции и Δφb оказались похожи, но спад флуоресценции происходил при более низких значениях рН, чем спад Δφb.. Как можно видеть на рисунке, зависимости Δφb и флуоресценции от рН для обоих красителей (di-4-ANEPPS и RH-421) близки. Совпадение зависимостей объясняется сходством структур этих красителей. У обоих красителей имеется два атома азота, один из которых всегда заряжен, а второй протонируется и становится заряженным при низких рН. Главное различие структур красителей состоит в строении ароматических колец: у ANEPPS имеется нафталиновое кольцо, а у RH-421 – бензольное. Это различие, как показывает рис. 1б, не оказывает заметного влияния на зависимость их адсорбции на мембране от рН. По зависимости Δφb от рН была проведена оценка рK протонирования красителей. Ее величина составила около 4.5. Эта величина оказалась близка к значению, полученному из измерений зависимости от рН спектров поглощения водных растворов RH-421, которое составляло около 4.9 [17].
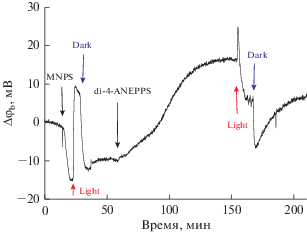
Зависимость адсорбции стириловых красителей от рН позволяет использовать их как зонды рН на поверхности мембраны. Представлялось интересным использовать их для оценки изменения рН на поверхности мембраны при фотоактивируемом выделении протонов с помощью Caged-H+, в качестве которого использовалось соединение MNPS. Типичная кинетика изменения потенциала представлена на рис. 2. Сначала в ячейку добавляли MNPS, в результате чего происходило изменение граничного потенциала, вызванного адсорбцией анионов MNPS на поверхности мембраны. При освещении мембраны с адсорбированными на ней ионами MNPS кинетика изменения потенциала была аналогична наблюдавшейся нами ранее [9]. Как показано в [9], это изменение потенциала вызвано разрушением MNPS и протонированием поверхности БЛМ. Далее в ячейку добавляли di-4-ANEPPS и дожидались окончания адсорбции, о чем свидетельствовало достижение стационарной величины потенциала. После включения освещения происходило изменение граничного потенциала с более сложной кинетикой, чем в отсутствие красителей. В начальный момент после включения света изменение потенциала было положительного знака и напоминало изменение потенциала, наблюдавшееся в отсутствие di-4-ANEPPS. В дальнейшем изменение потенциала происходило в отрицательную сторону. По амплитуде оно было близко к величине изменения потенциала, вызванного адсорбцией di-4-ANEPPS. Очевидно, это изменение потенциала связано с уходом молекул di-4-ANEPPS с поверхности мембраны, вызванным выделением протонов при освещении MNPS. При прекращении освещения происходило частичное восстановление потенциала, кинетика которого также отличалась от той, что была в отсутствие красителей. Потенциал изменялся сначала в отрицательном направлении, затем – в положительном. Начальное отрицательное изменение потенциала напоминает восстановление потенциала, наблюдавшееся в отсутствие di-4-ANEPPS. Оно вызвано, очевидно, адсорбцией анионов MNPS и восстановлением равновесия протонов на поверхности мембраны [9]. Эти процессы происходят быстрее, чем адсорбция di-4-ANEPPS, которая вызывает медленное изменение потенциала в положительную сторону. Это объясняет начальную быструю отрицательную фазу и последующую медленную положительную фазу изменения потенциала в темноте. Аналогичная кинетика изменения потенциала при освещении с MNPS была получена и с другим красителем – RH-421.
Рис. 2.
Кинетика изменения разности граничных потенциалов при адсорбции на БЛМ 300 мкМ MNPS и 2 мкМ di-4-ANEPPS и освещении непрерывным светом. Моменты включения и выключения света обозначены стрелками вверх и вниз с надписями Light и Dark. Исходный раствор содержал 20 мМ KCl и по 0.2 мМ Трис, HEPES и цитрата, рН 8.0.
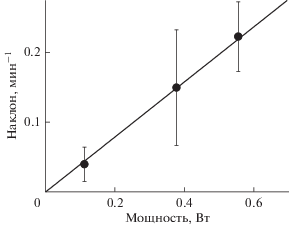
Кинетика изменения потенциала при освещении напоминает наблюдавшуюся нами ранее при разрушении молекул di-4-ANEPPS синглетным кислородом, образующимся при освещении в присутствии фотосенсибилизаторов [11, 12], где для количественной оценки скорости разрушения красителей определяли наклон относительного изменения потенциала в момент начала освещения. Аналогичный параметр был использован и в настоящей работе. Он определялся как наклон зависимости от времени медленной фазы изменения потенциала в момент начала освещения, нормированный на величину потенциала, возникающего при адсорбции этих красителей. Этот параметр оказался пропорционален интенсивности освещения (рис. 3).
Рис. 3.
Зависимость скорости медленного изменения потенциала в отрицательную сторону в начальный момент включения освещения от его электрической мощности. Средние значения скорости определяли по результатам не менее трех измерений. Исходный раствор содержал 20 мМ KCl и по 0.2 мМ Трис, HEPES и цитрата, рН 8.0. С одной стороны мембраны добавлены 300 мкМ MNPS и 2 мкМ RH-421.
Поскольку измерения проводились при рН 8, а заметное уменьшение потенциалов адсорбции красителей наблюдалось при рН меньше 5 (рис. 1б), можно предположить, что уменьшение рН на поверхности мембраны при фотолизе MNPS составляет несколько единиц. Эта величина намного превышает полученную нами ранее в [10] оценку (0.1 единиц), где изменение рН при фотолизе MNPS, вызванном вспышкой света, определяли по изменению потенциала разомкнутой цепи селективной по протонам мембраны с пентахлорфенолом. Конечно, сравнение этих экспериментов не совсем корректно, поскольку в [10] использовалась вспышка света, а в настоящей работе – непрерывное освещение. Другая существенная причина расхождения этих оценок состоит в том, что они отражают изменение рН в разных областях. Оценка, сделанная в работе [10], отражает изменение рН в воде около мембраны, поскольку равновесный потенциал мембраны, селективной по протонам, определяется разностью рН в водных растворах. В настоящей работе для оценки изменения рН использовались молекулы стириловых красителей, встроенные в мембрану, и изменение потенциала происходило при их протонировании непосредственно в мембране, из-за чего происходила десорбция молекул красителей в водный раствор.
Таким образом, стириловые красители могут быть использованы в качестве рН-зондов на поверхности мембраны. С их помощью удалось показать, что изменение рН на поверхности мембраны при фотоактивируемом фотолизе MNPS составляет несколько единиц.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (тема № АААА-А20-120101090002-4, фотоэлектрические измерения с MNPS), а также проектов РНФ № 19-13-00410 (спектральные измерения) и РФФИ № 19-04-00694 (измерения граничных потенциалов на БЛМ).
Список литературы
Agmon N., Bakker H.J., Campen R.K., Henchman R.H., Pohl P., Roke S., Thamer M., Hassanali A. 2016. Protons and hydroxide ions in aqueous systems. Chem. Rev. 116 (13), 7642–7672.
Cherepanov D.A., Feniouk B.A., Junge W., Mulkidjanian A.Y. 2003. Low dielectric permittivity of water at the membrane interface: Effect on the energy coupling mechanism in biological membranes. Biophys. J. 85 (2), 1307–1316.
Serowy S., Saparov S.M., Antonenko Y.N., Kozlovsky W., Hagen V., Pohl P. 2003. Structural proton diffusion along lipid bilayers. Biophys. J. 84 (2 Pt 1), 1031–1037.
Springer A., Hagen V., Cherepanov D.A., Antonenko Y.N., Pohl P. 2011. Protons migrate along interfacial water without significant contributions from jumps between ionizable groups on the membrane surface. Proc. Natl. Acad. Sci. USA. 108 (35), 14 461–14 466.
Weichselbaum E., Osterbauer M., Knyazev D.G., Batishchev O.V., Akimov S.A., Hai N.T., Zhang C., Knor G., Agmon N., Carloni P., Pohl P. 2017. Origin of proton affinity to membrane/water interfaces. Sci. Rep. 7 (1), 4553.
Zhang C., Knyazev D.G., Vereshaga Y.A., Ippoliti E., Nguyen T.H., Carloni P., Pohl P. 2012. Water at hydrophobic interfaces delays proton surface-to-bulk transfer and provides a pathway for lateral proton diffusion. Proc. Natl. Acad. Sci. USA. 109 (25), 9744–9749.
Geissler D., Antonenko Y.N., Schmidt R., Keller S., Krylova O.O., Wiesner B., Bendig J., Pohl P., Hagen V. 2005. (Coumarin-4-yl)methyl esters as highly efficient, ultrafast phototriggers for protons and their application to acidifying membrane surfaces. Angew. Chem. Int. Ed Engl. 44 (8), 1195–1198.
Fibich A., Janko K., Apell H.J. 2007. Kinetics of proton binding to the sarcoplasmic reticulum Ca-ATPase in the E1 state. Biophys. J. 93 (9), 3092–3104.
Ташкин В.Ю., Вишнякова В.Е., Щербаков А.А., Финогенова О.А., Ермаков Ю.А., Соколов В.С. 2019. Изменение емкости и граничного потенциала бислойной липидной мембраны при быстром освобождении протонов на ее поверхности. Биол. мембраны. 36 (2), 101–108.
Ташкин В.Ю., Щербаков А.А., Апель Х.-Ю., Соколов В.С. 2013. Конкурентный транспорт ионов натрия и протонов в цитоплазматическом канале Na+,K+-ATP-азы. Биол. мембраны. 30 (2), 105–114.
Sokolov V.S., Gavrilchik A.N., Kulagina A.O., Meshkov I.N., Pohl P., Gorbunova Y.G. 2016. Voltage-sensitive styryl dyes as singlet oxygen targets on the surface of bilayer lipid membrane. J. Photochem. Photobiol. B. 161, 162–169.
Konstantinova A.N., Sokolov V.S., Jimenez-Munguia I., Finogenova O.A., Ermakov Y.A., Gorbunova Y.G. 2018. Adsorption and photodynamic efficiency of meso-tetrakis(p-sulfonatophenyl)porphyrin on the surface of bilayer lipid membranes. J. Photochem. Photobiol. B. 189, 74–80.
Соколов В.С., Кузьмин В.Г. 1980. Измерение разности поверхностных потенциалов бислойных мембран по второй гармонике емкостного тока. Биофизика. 25 (1), 170–172.
Ermakov Yu.A., Sokolov V.S. 2003. Boundary potentials of bilayer lipid membranes: Methods and interpretations. In: Planar Lipid Bilayers (BLMs) and their applications. Eds. Tien H.T., Ottova-Leitmannova A. Amsterdam etc.: Elsevier, p. 109–141.
Sokolov V.S., Mirsky V.M. 2004. Electrostatic potentials of bilayer lipid membranes: Basic research and analytical applications. In: Ultrathin electrochemical chemo- and biosensors: Technology and performance. Ed. Mirsky V.M. Heidelberg: Springer-Verlag, p. 255–291.
Malkov D.Y., Sokolov V.S. 1996. Fluorescent styryl dyes of the RH series affect a potential drop on the membrane/solution boundary. Biochem. Biophys. Acta. 1278, 197–204.
Clarke R.J., Schrimpf P., Schoneich M. 1992. Spectroscopic investigations of the potential-sensitive membrane probe RH421. Biochim. Biophys. Acta. 1112 (1), 142–152.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


