Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 2, стр. 129-138
Влияние метилтриклозана на функционирование изолированных митохондрий печени крыс и проницаемость мембраны липосом
К. С. Теньков a, *, М. В. Дубинин a, А. А. Семенова a, К. Н. Белослудцев a, b, c
a Марийский государственный университет
424000 Республика Марий Эл, Йошкар-Ола, Россия
b Институт теоретической и экспериментальной биофизики РАН
142290 Пущино, Россия
c Институт общей физики им. А.М. Прохорова РАН
119991 Москва, Россия
* E-mail: kirill.tenkove@gmail.com
Поступила в редакцию 13.08.2020
После доработки 23.10.2020
Принята к публикации 09.11.2020
Аннотация
Изучено влияние метилтриклозана, который является продуктом биодеградации известного противомикробного агента триклозана, на функциональные параметры митохондрий печени крысы. Установлено, что метилтриклозан ингибирует активность комплексов II и IV дыхательной цепи органелл, что может обуславливать снижение скорости потребления кислорода митохондриями в состоянии 3 и 3UДНФ. Показано, что метилтриклозан увеличивает скорость образования перекиси водорода митохондриями печени крысы. Продемонстрировано, что метилтриклозан индуцирует неспецифическую проницаемость внутренней митохондриальной мембраны и мембраны однослойных лецитиновых липосом. Метилтриклозан, в отличие от триклозана, оказывает более “мягкое” влияние на органеллы и их мембраны, что, как предполагается, связано с молекулярной структурой данного соединения. В работе обсуждаются возможные механизмы влияния метилтриклозана на митохондрии и липосомы.
ВВЕДЕНИЕ
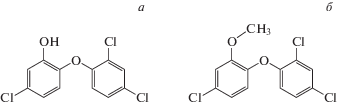
Триклозан (5-хлор-2-(2,4-дихлорфенокси)фенол) (рис. 1а) – синтетический противомикробный препарат широкого спектра действия. Он используется во многих средствах личной гигиены, чистящих средствах, медицинском оборудовании, ветеринарии, текстильной промышленности и производстве пластмасс [1]. Антибактериальное действие триклозана связано с подавлением синтеза жирных кислот путем ингибирования фермента ENR (редуктаза белка-переносчика еноил-ацильного радикала), который участвует в синтезе жирных кислот бактериальной мембраны [2, 3]. Повышение концентрации триклозана в окружающей среде вследствие его чрезмерного использования привело к возникновению резистентности некоторых бактерий к этому препарату.
На сегодняшний день токсическое действие триклозана широко изучено, в литературе накопилось достаточно информации, описывающей различные негативные эффекты, индуцированные триклозаном, – от модуляции гормонального статуса организма до летального исхода [4–13]. Известно, что на клеточном уровне триклозан вызывает падение мембранного митохондриального потенциала и разобщение процессов дыхания и окислительного фосфорилирования митохондрий млекопитающих и других позвоночных [14, 15]. Также известно, что данный агент способен индуцировать нарушение структуры бислойных липидных мембран, что приводит к их дестабилизации и последующей пермеабилизации. Такое действие триклозана может приводить к набуханию митохондрий и выбросу проапоптотического белка цитохрома с из органелл [15, 16].
Метилтриклозан (2,4-дихлор-1-(4-хлор-2-метоксифенокси)бензол) (рис. 1б) является продуктом трансформации триклозана, образующимся путем аэробной биодеградации последнего [17, 18]. Известно, что метилтриклозан, как и его предшественник триклозан, накапливается в воде, иловых отложениях, рыбе и беспозвоночных организмах, вблизи очистных сооружений. Данные по влиянию метилтриклозана на живые организмы достаточно фрагментарны. На сегодняшний день известно, что метилтриклозан, в отличие от триклозана, не проявляет антибактериальных свойств [19]. С другой стороны, метилтриклозан подобно триклозану способен оказывать токсическое действие на эмбриональное развитие рыбок Danio rerio и Paracentrotus lividus [20], влиять на развитие дождевого червя Eisenia andrei [21] и оказывать токсический эффект на культуру клеток HepG2 [22].
Молекулярные механизмы токсического действия метилтриклозана на клетки эукариотических организмов до конца не установлены. Можно предположить, что метилтриклозан, как и триклозан, способен индуцировать дисфункцию митохондрий и пермеабилизацию клеточных мембран. Однако действие метилтриклозана, оказываемое на живые организмы, может быть менее выражено по сравнению с действием триклозана в связи с заменой гидроксильной группы на метильную в его структуре (рис. 1). Известно, что подобные структурные особенности значительно снижают мембранотропные свойства различных агентов [23] и в том числе могут оказывать непосредственное влияние на эффекты, вызываемые метилтриклозаном на фосфолипидные мембраны. Поэтому в настоящей работе нами исследовано in vitro влияние метилтриклозана на параметры дыхания и окислительного фосфорилирования митохондрий печени крысы, активность комплексов дыхательной цепи органелл и продукцию ими перекиси водорода. Кроме того, нами изучено влияние этого соединения на проницаемость внутренней мембраны митохондрий, а также фосфолипидной мембраны искусственных липосом. Полученные в работе данные свидетельствуют о том, что метилтриклозан в высоких концентрациях вызывает нарушение функциональной активности комплексов дыхательной цепи митохондрий, а также индуцирует неспецифическую пермеабилизацию внутренней мембраны органелл и мембраны однослойных лецитиновых липосом.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение митохондрий из печени крыс. Митохондрии выделяли из печени половозрелых крыс (самцов) линии Wistar (масса 220–250 г) общепринятым методом дифференциального центрифугирования в соответствии с ранее описанной методикой [24]. Среда выделения содержала 210 мM маннитол, 70 мM сахарозу, 1 мM EDTA и 10 мM HEPES–KOH, pH 7.4. Полученная суспензия митохондрий содержала 70–80 мг митохондриального белка на 1 мл, концентрация которого определялась методом Лоури [25].
Оценка дыхания и окислительного фосфорилирования митохондрий. Дыхание митохондрий регистрировали полярографическим методом при 25°C в термостатируемой ячейке объемом 1 мл с помощью кислородного электрода типа Кларк и установки Oxygraph Plus (Hansatech Instruments, Великобритания) [26]. Среда инкубации содержала 200 мМ сахарозу, 20 мМ KCl, 5 мМ янтарную кислоту (или 2.5 мМ глутамат и 2.5 мМ малат), 5 мМ КН2РО4, 0.5 мМ EGTA, 2 мМ MgCl2, 10 мМ HEPES–KOH (рН 7.4) Концентрация митохондриального белка в кювете составляла ~1.3 мг/мл. Следующие функциональные состояния были определены: состояние 2 – базальное дыхание митохондрий в присутствии энергетического субстрата; состояние 3 – дыхание митохондрий в присутствии субстратов, стимулированное добавкой ADP; состояние 4 – митохондриальное дыхание после того, как добавленный ADP будет полностью фосфорилирован; состояние 3UДНФ – максимальное дыхание митохондрий в присутствии разобщителя 2,4-динитрофенола (ДНФ). Коэффициент дыхательного контроля определяли как отношение скорости дыхания в состоянии 3 к скорости дыхания в состоянии 4.
Оценка активности комплексов дыхательной цепи митохондрий. Влияние метилтриклозана на активность комплексов дыхательной цепи митохондрий печени крыс оценивали спектрофотометрически с помощью планшетного спектрофотометра Multiscan Go (Thermo, Финляндия) в соответствии с протоколом [27, 28]. Для разрушения митохондрий, освобождения индивидуальных комплексов дыхательной цепи и достижения их максимальной ферментативной активности изолированные митохондрии (10–15 мг/мл митохондриального белка) предварительно подвергали трехкратной процедуре замораживания/оттаивания при –20/+30°C в гипотоническом буфере, содержавшем 10 мМ Трис–HCl, pH 7.6. Активность комплекса I дыхательной цепи оценивали при 25°C по эффективности окисления добавленного NADH суспензией разрушенных митохондрий (0.15 мг/мл), которое определялось по снижению светопоглощения суспензии при длине волны 340 нм. Активность комплекса II дыхательной цепи оценивали при 37°C по эффективности восстановления 2.6-дихлорфенолиндофенолята натрия суспензией разрушенных митохондрий (0.2 мг/мл) в присутствии субстрата окисления сукцината, которое определялось по снижению светопоглощения суспензии при длине волны 600 нм. Активность комплекса III дыхательной цепи оценивали при 25°C по эффективности восстановления добавленного цитохрома с суспензией разрушенных митохондрий (0.1 мг/мл), которое определялось по снижению оптической плотности суспензии при длине волны 550 нм. Активность комплекса IV дыхательной цепи оценивали при 25°C по эффективности окисления добавленного цитохрома с (восстановленного в соответствии c [27]) суспензией разрушенных митохондрий (0.1 мг/мл), которое определялось по снижению оптической плотности суспензии при длине волны 550 нм. Активность комплексов дыхательной цепи (в отсутствие и в присутствии метилтриклозана) регистрировали через 2–3 мин после начала окислительно-восстановительной реакции (в нмоль/мин на 1 мг белка).
Образование H2O2 митохондриями печени. Скорость образования H2O2 суспензией митохондрий печени крыс измеряли с помощью флуоресцентного индикатора Amplex Red на планшетном флуориметре Tecan Spark 10M (Tecan, Швейцария) при длине волны возбуждения 560 нм и длине волны излучения 590 нм [26]. Среда инкубации содержала 210 мM маннитола, 70 мM сахарозы, 5 мM сукцината, 1 мM KH2PO4, 10 мкM EGTA, 1 мкM ротенона и 10 мM HEPES–KOH (pH 7.4), 10 мкМ Amplex Red и пероксидазу хрена (акт. 1 ед/мл). Концентрация митохондриального белка составляла 0.15 мг/мл. Измерения проводились при 37°C и постоянном перемешивании. Количество образованной перекиси водорода рассчитывалось по калибровочной кривой.
Индукция неспецифической проницаемости внутренней мембраны митохондрий. Открытие митохондриальной поры оценивали по набуханию митохондрий, которое регистрировали по изменению оптической плотности суспензии митохондрий (A540) на планшетном спектрофотометре Multiscan Go (Thermo, Финляндия). Среда инкубации содержала 210 мМ маннитола, 70 мМ сахарозы, 5 мМ янтарной кислоты, 10 мкМ EGTA, 1 мкМ ротенона, 3 мМ Трис–HCl, pH 7.4. Концентрация митохондриального белка в кювете составляла ~0.4 мг/мл. Скорость набухания митохондрий (Vmax = ΔА540/мин на 1 мг белка) рассчитывали как изменение оптической плотности суспензии в течение первых 30 с от начала высокоамплитудного набухания.
Электронная микроскопия митохондрий печени крыс. Для проведения электронной микроскопии образцы митохондрий фиксировали в течение 2 ч с использованием 2.5% глутарового альдегида, предварительно растворенного в среде инкубации, состоящей из 210 мM маннитола, 70 мM сахарозы, 5 мM сукцината, 10 мкM EGTA, 1 мкM ротенона и 10 мM HEPES–KOH, pH 7.4, после чего осуществлялась постфиксация 1% тетраоксидом осмия. Далее образцы заливали в эпоксидную смолу Epon 812. Микроскопические срезы, полученные с помощью микротома Leica EM UC6 (Leica, Германия), окрашивались цитратом свинца и уранилацетатом, после этого они подвергались электронно-микроскопическому исследованию на микроскопе JEM-100B (JOEL, Япония).
Приготовление однослойных липосом. Липосомы были получены методом экструзии [16]. 7.5 мг лецитина гидратировали в течение 2 ч при периодическом перемешивании в 0.75 мл буфера, содержащего 10 мМ Трис–HCl (pH 7.5), 40 мМ KCl и 50 мкМ EGTA. Полученную суспензию многослойных липосом подвергали 5 циклам замораживания/оттаивания при температуре –20/+30°C. На следующем этапе суспензия липосом подвергалась экструзии через поликарбонатную мембрану (диаметр пор 0.1 мкм) с использованием микроэкструдера Avanti (Avanti Polar Lipids, США). Все описанные выше операции (за исключением процедуры замораживания/оттаивания) проводились при комнатной температуре.
Приготовление липосом, загруженных сульфородамином Б. Липосомы, загруженные сульфородамином Б (СрБ), готовили из лецитина с использованием метода, описанного выше. Отличия заключались в буфере для гидратации, содержащем 50 мМ СрБ вместо 40 мМ KCl, и дополнительной очистке полученных после экструзии липосом от внешнего СрБ на колонке, заполненной сефадексом G-50. Для уравновешивания колонки применялся буфер следующего состава: 10 мM Трис–HCl (pH 7.5), 50 мкM EGTA и 40 мM KCl.
Измерение выхода сульфородамина Б из липосом. Выход СрБ из липосом оценивали по увеличению флуоресценции исследуемой суспензии однослойных липосом согласно ранее описанному методу [29]. Среда инкубации содержала 40 мM KCl, 50 мкM EGTA, 10 мM Трис–HCl (pH 7.5). Изменение уровня флуоресценции измерялось с использованием спектрофлуориметрической оптоволоконной системы USB 2000 (Ocean Optics, Inc, США) (длины волн возбуждения и излучения флуоресценции – 565 и 586 нм, соответственно). Выход СрБ из липосом определялся в течение 5 мин после добавления триклозана и метилтриклозана. Уровень СрБ, загруженный в липосомы, определялся после добавления 0.1% раствора неионного детергента Тритона Х-100.
Статистический анализ. Полученные данные были проанализированы с использованием программ GraphPad Prism 7 и Microsoft Excel и представлены как средние значения ± ошибка среднего (n = 3–7). Статистический анализ проводили с использованием t-критерия, при этом значимыми считались различия, удовлетворяющие условию p < 0.05.
РЕЗУЛЬТАТЫ
Метилтриклозан ингибирует дыхание митохондрий печени крысы
В настоящей работе изучено влияние метилтриклозана на дыхание митохондрий печени крысы в разных функциональных состояниях. Измерения проводили в присутствии глутамата и малата – субстратов комплекса I дыхательной цепи и сукцината, субстрата комплекса II дыхательной цепи митохондрий.
В табл. 1 показано влияние различных концентраций метилтриклозана на дыхание митохондрий печени крысы, энергизованных глутамат/малатом. Установлено, что в концентрациях 5, 10 и 20 мкМ данный агент не оказывает влияния на скорость потребления кислорода митохондриями. Лишь 50 мкМ метилтриклозан вызывает снижение скорости потребления кислорода при стимуляции дыхания ADP (состояние 3) и ДНФ (состояние 3UДНФ), не оказывая влияние на дыхание органелл в состояниях 2 и 4. Также было установлено, что метилтриклозан достоверно снижает коэффициент дыхательного контроля (ДК) только в концентрации 50 мкМ. В то же время можно отметить, что триклозан уже в концентрации 5 мкМ существенно стимулирует дыхание в состояниях 2 и 4 и ингибирует дыхание органелл, стимулированное ADP и ДНФ (состояние 3 и 3UДНФ), тем самым значительно снижая параметр дыхательного контроля (табл. 1).
Таблица 1.
Влияние метилтриклозана и триклозана на параметры дыхания и окислительного фосфорилирования митохондрий печени крыс, окислящих глутамат и малат
| Метилтриклозан, мкМ | Состояние 2 | Состояние 3 | Состояние 4 | Состояние 3UДНФ | ДК, отн. ед. |
|---|---|---|---|---|---|
| нмоль О2/мин на 1 мг белка | |||||
| 0 | 2.96 ± 0.25 | 31.74 ± 2.26 | 5.56 ± 0.45 | 28.28 ± 1.46 | 5.72 ± 0.10 |
| 5 | 2.70 ± 0.20 | 29.91 ± 1.29 | 5.30 ± 0.30 | 27.80 ± 0.40 | 5.65 ± 0.08 |
| 10 | 2.58 ± 0.03 | 31.00 ± 2.25 | 5.50 ± 0.40 | 26.22 ± 0.02 | 5.64 ± 0.03 |
| 20 | 2.83 ± 0.37 | 29.63 ± 1.88 | 5.25 ± 0.15 | 27.80 ± 2.00 | 5.45 ± 0.02 |
| 50 | 2.90 ± 0.10 | 23.64 ± 0.39* | 5.15 ± 0.25 | 22.38 ± 0.42* | 4.60 ± 0.30* |
| 5 мкМ триклозан | 4.35 ± 0.23* | 26.04 ± 0.46* | 6.14 ± 0.17* | 25.41 ± 0.21* | 4.25 ± 0.19* |
Примечание. Приведены средние значения ± ошибка среднего (n = 3). ДК – коэффициент дыхательного контроля (состояние 3/состояние 4). * Различия между контролем (в отсутствие метилтриклозана или триклозана) и экспериментом (в присутствии метилтриклозана или триклозана) статистически значимы, p < 0.05.
При использовании сукцината в качестве субстрата дыхания метилтриклозан уже в концентрации 10 мкМ вызывает снижение скорости потребления кислорода в состоянии 3UДНФ. В концентрации 20 мкМ метилтриклозан стимулирует скорость дыхания митохондрий в состоянии 2, но при этом подавляет стимуляцию дыхания разобщителем ДНФ (дыхание митохондрий в состоянии 3UДНФ). Метилтриклозан в концентрации 50 мкМ увеличивает скорость потребления кислорода в состояниях 2 и 4 и снижает скорость дыхания в состояниях 3 и 3UДНФ. Показатель дыхательного контроля статистически значимо снижается только при использовании метилтриклозана в концентрации 50 мкМ. В то же время триклозан в концентрации 5 мкМ существенно увеличивает скорость дыхания в состояниях 2 и 4 и ингибирует дыхание органелл в состояниях 3 и 3UДНФ, что сопровождается значительным снижением параметра дыхательного контроля (табл. 2).
Таблица 2.
Влияние метилтриклозана и триклозана на параметры дыхания и окислительного фосфорилирования митохондрий печени крыс, окисляющих сукцинат
| Метилтриклозан, мкМ | Состояние 2 | Состояние 3 | Состояние 4 | Состояние 3UДНФ | ДК, отн. ед. |
|---|---|---|---|---|---|
| нмоль О2/мин на 1 мг белка | |||||
| 0 | 12.41 ± 0.26 | 57.80 ± 0.29 | 12.50 ± 0.46 | 69.67 ± 0.49 | 4.65 ± 0.12 |
| 5 | 13.79 ± 0.93 | 57.15 ± 1.95 | 12.98 ± 1.07 | 71.28 ± 4.50 | 4.40 ± 0.23 |
| 10 | 13.01 ± 0.81 | 57.48 ± 0.95 | 13.09 ± 0.40 | 62.92 ± 0.33* | 4.39 ± 0. 07 |
| 20 | 13.81 ± 0.16* | 56.56 ± 1.83 | 13.60 ± 0.54 | 58.97 ± 3.59* | 4.15 ± 0.29 |
| 50 | 14.13 ± 0.10* | 56.77 ± 0.06* | 14.92 ± 0.32* | 60.80 ± 1.08* | 3.81 ± 0.09* |
| 5 мкМ триклозан | 17.94 ± 0.32* | 50.34 ± 2.05* | 17.14 ± 0.71* | 56.74 ± 2.02* | 2.95 ± 0.24* |
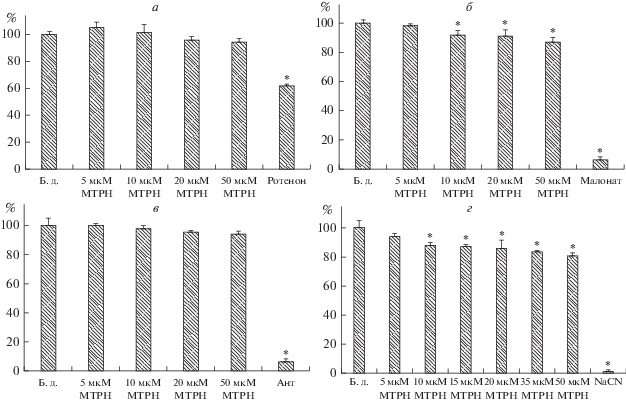
На рис. 2 показано влияние метилтриклозана на активность комплексов дыхательной цепи митохондрий печени крыс. Из рисунка следует, что метилтриклозан не оказывает влияния на активность комплексов I и III (рис. 2а, 2в). Однако в концентрации 50 мкМ метилтриклозан статистически достоверно ингибирует активность комплексов II и IV дыхательной цепи на 10 и 15% соответственно.
Рис. 2.
Влияние метилтриклозана на активность комплексов I (а), II (б), III (в) и IV (г) дыхательной цепи митохондрий печени крыс (в % от контроля). Активность комплексов в контроле, т.е. без добавок (Б.д.), принята за 100%. Концентрация митохондриального белка в кювете 0.1–0.15 мг/мл. В отсутствие добавок (Б.д.) активность комплексов I, II, III, IV составляла 341 ± 18, 449 ± 14, 695 ± 21 и 483 ± 24 нмоль/мин/мг белка соответственно. Добавки: метилтриклозан (МТРН) в указанных на рисунке концентрациях, 10 мкМ ротенон, 10 мМ малонат, 10 мкг/мл антимицин А (Ант), 300 мкМ NaCN. Приведены средние значения ± ошибка среднего (n = 5). * – Различия между контролем (в отсутствие добавок) и экспериментом (в присутствии метилтриклозана или специфического ингибитора) статистически значимы, p < 0.05.
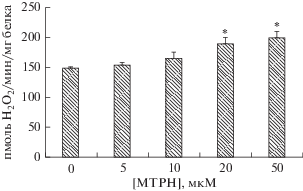
Влияние метилтриклозана на продукцию H2O2 митохондриями
На рис. 3 продемонстрирована способность метилтриклозана статистически значимо усиливать продукцию перекиси водорода митохондриями. При этом данный эффект является дозозависимым, минимальная действующая концентрация составляет 5 мкМ, а максимальный эффект наблюдается при концентрации этого агента равной 50 мкМ.
Метилтриклозан индуцирует пермеабилизацию митохондрий печени крыс
Известно, что в концнтрации 10–5 М триклозан индуцирует пермеабилизацию внутренней мембраны митохондрий и однослойных лецитиновых липосом [16]. В связи с этим была изучена способность метилтриклозана индуцировать неспецифическую проницаемость митохондрий печени крысы.
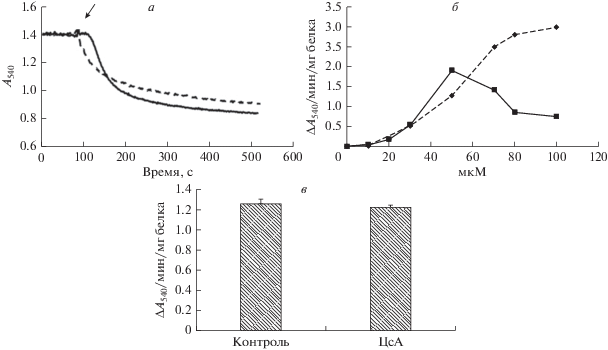
На рис. 4а показано, что добавление 50 мкМ метилтриклозана к суспензии митохондрий приводит к высокоамплитудному набуханию органелл, которое сопровождается лаг-периодом. В то же время можно видеть, что триклозан в той же концентрации индуцирует интенсивное набухание органелл без лаг-периода (рис. 4а). Показано, что 50 мкМ метилтриклозан индуцирует максимальное набухание органелл (рис. 4б). Дальнейшее увеличение концентрации метилтриклозана приводит к снижению скорости митохондриального набухания. В то же время эффект триклозана дозозависим и достигает максимума при 100 мкМ этого агента (рис. 4б). Как показано ранее, эффект триклозана проявляется в присутствии циклоспорина А, известного ингибитора MPT-поры [16]. Набухание митохондрий, индуцированное метилтриклозаном, также не чувствительно к циклоспорину А (рис. 4в). Последнее говорит о том, что механизм набухания в этом случае не связан с образованием белковой MPT-поры. Возможно, в основе процесса лежит образование пор в липидной фазе внутренней мембраны органелл, как это показано нами ранее для триклозана [16].
Рис. 4.
Набухание митохондрий печени крыс в присутствии триклозана и метилтриклозана. а – Изменение оптической плотности суспензии митохондрий печени крысы, индуцированное 50 мкМ метилтриклозана (сплошная линия) и 50 мкМ триклозана (штриховая линия). Стрелкой обозначено время добавки изучаемых агентов. Представлены данные типичного эксперимента, полученные на одном препарате митохондрий. б – Зависимость скорости изменения оптической плотности суспензии митохондрий печени крыс от концентрации метилтриклозана (сплошная линия) и триклозана (штриховая линия). Приведены средние значения ± ошибка средней (n = 5). в – Скорость набухания митохондрий печени крысы, индуцированного 50 мкМ метилтриклозана в отсутствие (Контроль) и в присутствии 1 мкМ циклоспорина А (ЦсА). Приведены средние значения ± ошибка среднего (n = 5).
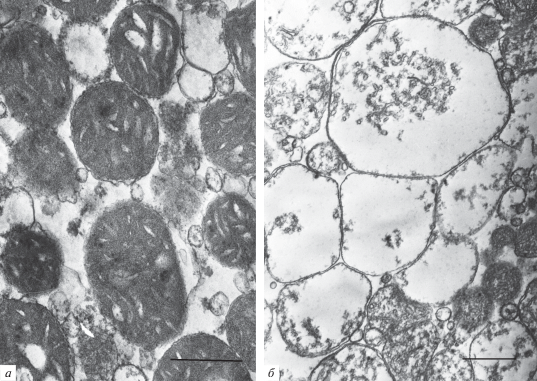
На рис. 5 представлены типичные микрофотографии митохондрий печени крыс до и после обработки суспензии органелл метилтриклозаном. Можно видеть, что контрольные митохондрии обладают плотной структурой матрикса и четко различимыми кристами. Добавление метилтриклозана к митохондриям печени приводит к их набуханию: происходит увеличение размера митохондрий, снижение плотности матрикса и потеря внешней митохондриальной мембраны.
Метилтриклозан индуцирует пермеабилизацию липосомальной мембраны
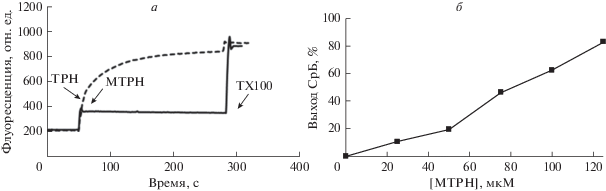
Поскольку метилтриклозан вызывает циклоспорин А-нечувствительное набухание митохондрий, была оценена способность данного агента индуцировать пермеабилизацию липосомальной мембраны. Для этого были использованы однослойные лецитиновые липосомы, загруженные СрБ. Из рис. 6а следует, что добавление 50 мкМ метилтриклозана к суспензии липосом приводит к резкому кратковременному увеличению интенсивности флуоресценции, что свидетельствует о выходе СрБ из липосом. На рис. 6б показана зависимость выхода СрБ из липосом от концентрации метилтриклозана. Минимальная действующая концентрация метилтриклозана составляет 25 мкМ. При концентрации метилтриклозана 125 мкМ наблюдается 90% выброс красителя из липосом. Стоит обратить внимание, что в этом случае концентрация метилтриклозана в 3 раза выше, чем концентрация липидов в системе (125 мкМ метилтриклозана против 40–45 мкМ лецитина). Можно отметить, что, как и в предыдущих экспериментах данного исследования, триклозан является более эффективным агентом: в концентрации 50 мкМ он индуцирует практически полный выброс красителя из липосом (рис. 6).
Рис. 6.
Влияние триклозана и метилтриклозана на проницаемость мембраны однослойных лецитиновых липосом. а – Выход СрБ из липосом, индуцированный МТРН (сплошная линия) и ТРН (штриховая линия). Добавки: 50 мкМ МТРН, 50 мкМ ТРН, 0.1% тритон X-100 (TX100). б – Зависимость выхода СрБ из липосом от концентрации метилтриклозана. Приведены средние значения ± ошибка среднего (n = 5).
ОБСУЖДЕНИЕ
В настоящей работе исследовано влияние метилтриклозана на дыхание и окислительное фосфорилирование митохондрий печени крысы. Можно видеть, что данный агент, в отличие от триклозана, оказывает слабое влияние на дыхание и окислительное фосфорилирование митохондрий. Лишь в концентрации 20 мкМ и более метилтриклозан способен активировать дыхание органелл, окисляющих сукцинат в состояниях 2 и 4 и снижать скорость ДНФ-стимулированного дыхания митохондрий. В этом случае метилтриклозан достоверно снижает коэффициент дыхательного контроля лишь в концентрации 50 мкМ, в то время как триклозан снижает коэффициент ДК уже в концентрации 5 мкМ (табл. 1 и 2). При этом нами установлено, что метилтриклозан, в отличие от триклозана, не оказывает существенного влияния на активность комплексов дыхательной цепи митохондрий печени крыс. Лишь в высоких концентрациях (50 мкМ) метилтриклозан незначительно (но статистически достоверно) подавляет активность комплексов II и IV дыхательной цепи митохондрий (рис. 2). Это ингибирующее действие может объяснить подавление дыхания митохондрий метилтриклозаном.
Ранее мы установили, что триклозан способен индуцировать дозозависимое набухание митохондрий, не чувствительное к циклоспорину А [16]. В настоящей работе показано, что метилтриклозан также способен индуцировать неспецифическую проницаемость внутренней митохондриальной мембраны и набухание органелл. Набухание органелл было продемонстрировано как в экспериментах по светорассеянию суспензии митохондрий, так и с помощью электронной микроскопии. Как и в случае с триклозаном, метилтриклозан индуцировал циклоспорин А-нечувствительное набухание органелл. Данный факт свидетельствует о том, что пермеабилизующее действие метилтриклозана не связано с индукцией МРТ-поры во внутренней мембране митохондрий. При этом эффекты триклозана и метилтриклозана различаются как подинамике набухания митохондрий, так и по концентрациям, при которых развиваются эффекты. При добавлении метилтриклозана к суспензии митохондрий набухание запускается после небольшого лаг-периода (около 10–15 с), а набухание митохондрий, обработанных триклозаном, происходит без лаг-фазы (рис. 4а) [16]).
Ранее мы установили, что в основе механизма пермеабилизующего действия триклозана лежит формирование поры в липидной фазе мембраны [16]. При высоких концентрациях (более 50 мкМ) триклозан проявлял детергентное действие [16]. В настоящей работе мы также исследовали влияние метилтриклозана на проницаемость липосомальной мембраны для флуоресцентного зонда сульфородамина Б. Метилтриклозан подобно триклозану индуцирует неспецифическую проницаемость липосомальной мембраны. Но по сравнению с триклозаном этот агент менее эффективен, поскольку индуцирует полный выход красителя из липосом лишь в концентрации более чем 120 мкМ, в то время как триклозан демонстрирует подобный эффект при концентрации 50 мкМ (рис. 6а).
Таким образом, полученные результаты позволяют заключить, что метилтриклозан, как и триклозан, вызывает комплексное нарушение функционирования митохондрий. В частности, метилтриклозан снижает скорость потребления кислорода митохондриями вследствие ингибирования активности комплексов II и IV дыхательной цепи, усиливает продукцию перекиси водорода органеллами, а также индуцирует пермеабилизацию митохондрий печени крыс и однослойных лецитиновых липосом, что, по всей видимости, обусловлено образованием липидных пор.
Следует отметить, что метилтриклозан, в отличие от триклозана, оказывает более “мягкое” влияние на органеллы и их мембраны. Можно полагать, что это связано с их разными химическими структурами (рис. 1). В процессе биотрансформации происходит замена гидроксильной группы в молекуле триклозана на метильную. Подобная модификация может обуславливать снижение мембранотропных (разобщающих, пермеабилизующих и детергентных) эффектов метилтриклозана [23]. Возможно, подобные перестройки объясняют разницу и между эффектами, оказываемыми на митохондрии печени и липосомы триклозаном и метилтриклозаном. Более того, появление метильной группировки в молекуле триклозана должно способствовать снижению токсического действия данного соединения на живые организмы в целом.
Работа выполнена при финансовой поддержке РФФИ (№ 20-015-00124) и гранта президента РФ для поддержки молодых ученых (МК-61.2019.4).
Список литературы
Weatherly L.M., Grosse J.A. 2017. Triclosan exposure, transformation, and human health effects. J. Toxicol. Environ. Health B. Crit. Rev. 20 (8), 447–469.
Levy C.W., Roujeinikova A., Sedelnikova S., Baker P.J., Stuitje A.R., Slabas A.R., Rice D.W., Rafferty J.B. 1999. Molecular basis of triclosan activity. Nature. 398, 383–384.
Heath R.J., Rubin J.R., Holland D.R., Zhang E., Snow M.E., Rock C.O. 1999. Mechanism of triclosan inhibition of bacterial fatty acid synthesis. J. Biol. Chem. 274, 11 110–11 114.
Zhang L., Niu J., Wang Y. 2016. Full life-cycle toxicity assessment on triclosan using rotifer Brachionus calyciflorus. Ecotoxicol. Environ. Saf. 127, 30–35.
Wang F., Xu R., Zheng F. 2018. Effects of triclosan on acute toxicity, genetic toxicity and oxidative stress in goldfish. Exp. Anim. 67 (2), 219–227.
Palenske N.M., Nallani G.C., Dzialowski E.M. 2010. Physiological effects and bioconcentration of triclosan on amphibian larvae. J. CBPC. 152 (2), 232–240.
Matozzo V.A., Devoti C., Marin M.G. 2012. Immunotoxic effects of triclosan in the clam Ruditapes philippinarum. Ecotoxicology. 21 (1), 66–74.
Feng Y., Zhang P., Zhang Z., Shi J., Jiao Z., Shao B. 2016. Endocrine disrupting effects of triclosan on the placenta in pregnant rats. PLoS One. 11 (5), e0154758.
Louis G.W., Hallinger D.R., Braxton M.J., Kamel A., Stoker T.E. 2017. Effects of chronic exposure to triclosan on reproductive and thyroid endpoints in the adult Wistar female rat. Toxicol. Environ. Health A. 80 (4), 236–249.
Paul K.B., Hedge J.M., Bansal R., Zoeller R.T., Peter R., DeVito M.J., Crofton K.M. 2012. Developmental triclosan exposure decreases maternal, fetal, and early neonatal thyroxine: A dynamic and kinetic evaluation of a putative mode-of-action. J. Toxicology. 300 (1–2), 31–45.
Zorrilla L.M., Gibson E.K., Jeffay S.C., Crofton K.M., Setzer W.R., Cooper R.L., Stoker T.E. 2009. The effects of triclosan on puberty and thyroid hormones in male Wistar rats. Toxicol. Sci. 107 (1), 56–64.
Axelstad M., Boberg J., Vinggaard A.M., Christiansen S., Hass U. 2013. Triclosan exposure reduces thyroxine levels in pregnant and lactating rat dams and in directly exposed offspring. J. Food Chem. Toxicol. 59, 534–540.
Wang. X., Chen X., Feng X., Chang F., Chen M., Xia Y., Chen L. 2015. Triclosan causes spontaneous abortion accompanied by decline of estrogen sulfotransferase activity in humans and mice. J. Sci. Rep. 5, 18252.
Teplova V.V., Belosludtsev K.N., Kruglov A.G. 2017. Mechanism of triclosan toxicity: Mitochondrial dysfunction including complex II inhibition, superoxide release and uncoupling of oxidative phosphorylation. Toxicol. Lett. 275, 108–117.
Dubinin M.V., Tenkov K.S., Svinin A.O., Samartsev V.N., Belosludtsev K.N. 2020. Effect of triclosan on the functioning of liver mitochondria and permeability of erythrocyte membranes of marsh frog (Pelophylax ridibundus (Pallas, 1771)). J. Membr. Biol. 253 (1), 1–10.
Belosludtsev K.N., Belosludtseva N.V., Tenkov K.S., Penkov N.V., Agafonov A.V., Pavlik L.L., Yashin V.A., Samartsev V.N., Dubinin M.V. 2018. Study of the mechanism of permeabilization of lecithin liposomes and rat liver mitochondria by the antimicrobial drug triclosan. Biochim. Biophys. Acta Biomembr. 1860 (2), 264–271.
Lindstrom A., Buerge I.J., Poiger T., Bergqvist P.A., Muller M.D., Buser H.R. 2002. Occurrence and environmental behavior of the bactericide triclosan and its methyl derivative in surface waters and in wastewater. Environ. Sci. Technol. 36, 2322–2329.
Chen X., Nielsen J. L., Furgal K., Liu Y., Lolas I.B., Bester K. 2011. Biodegradation of triclosan and formation of methyl-triclosan in activated sludge under aerobic conditions. Chemosphere. 84, 452–456.
Clayborn A.B., Toofan S.N., Champlin F.R. 2011. Influence of methylation on the antibacterial properties of triclosan in Pasteurella multocida and Pseudomonas aeruginosa variant strains. J. Hosp. Infect. 77, 129–133.
Fu J., Gong Z., Bae S. 2019. Assessment of the effect of methyl-triclosan and its mixture with triclosan on developing zebrafish (Danio rerio) embryos using mass spectrometry-based metabolomics. J. Hazard Mater. 368, 186–196.
Chevillot F., Guyot M., Desrosiers M., Cadoret N., Veilleux E., Cabana H., Bellenger J.P. 2019. Accumulation and sublethal effects of triclosan and its transformation product methyl-triclosan in the earthworm Eisenia andrei exposed to environmental concentrations in an artificial soil. Environ. Toxicol. Chem. 37 (7), 1940–1948.
Wang L., Mao B., He H., Shang Y., Zhong Y., Yu Z., Yang Y., Li H., An J. 2018. Comparison of hepatotoxicity and mechanisms induced by triclosan (TCS) and methyl-triclosan (MTCS) in human liver hepatocellular HepG2 cells. Toxicol. Res. (Camb). 8 (1), 38–45.
Rosen M. 2004. Surfactants and Interfacial Phenomena. 3rd ed. Hoboken: John Wiley & Sons, Inc. 444 p.
Belosludtsev K.N., Belosludtseva N.V., Agafonov A.V., Astashev M.E., Kazakov A.S., Saris N.-E.L., Mironova G.D. 2014. Ca2+-dependent permeabilization of mitochondria and liposomes by palmitic and oleic acids: A comparative study. Biochim. Biophys. Acta. 1838 (10), 2600–2606.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. 1951. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193 (1), 265–275.
Dubinin M.V., Svinin A.O., Vedernikov A.A., Starinets V.S., Tenkov K.S., Belosludtsev K.N., Samartsev V.N. 2019. Effect of hypothermia on the functional activity of liver mitochondria of grass snake (Natrix natrix): inhibition of succinate-fueled respiration and K+ transport, ROS-induced activation of mitochondrial permeability transition. J. Bioenerg. Biomembr. 3, 219–229.
Spinazzi M., Casarin A., Pertegato V., Salviati L., Angelini C. 2012. Assessment of mitochondrial respiratory chain enzymatic activities on tissues and cultured cells. Nat. Protoc. 7, 1235–1246.
Dubinin M.V., Semenova A.A., Ilzorkina A.I., Mikheeva I.B., Yashin V.A., Penkov N.V., Vydrina V.A., Ishmuratov G.Y., Sharapov V.A., Khoroshavina E.I., Gudkov S.V., Belosludtsev K.N. 2020. Effect of betulin and betulonic acid on isolated rat liver mitochondria and liposomes. Biochim. Biophys. Acta. Biomembr. 1862 (10), 183 383. https://doi.org/10.1016/j.bbamem.2020.183383
Agafonov A., Gritsenko E., Belosludtsev K., Kovalev A., Gateau-Roesch O., Saris N.-E.L., Mironova G.D. 2003. A permeability transition in liposomes induced by the formation of Ca2+/palmitic acid complexes. Biochim. Biophys. Acta. 1609, 153–160.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии