Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 3, стр. 163-175
Взаимодействие упорядоченных липидных доменов в присутствии амфипатических пептидов
К. В. Пинигин a, Т. Р. Галимзянов a, С. А. Акимов a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: akimov_sergey@mail.ru
Поступила в редакцию 16.11.2020
После доработки 11.12.2020
Принята к публикации 12.12.2020
Аннотация
В плазматических мембранах эукариотических клеток возможно образование относительно упорядоченных липид-белковых доменов. Домены, обогащенные сфингомиелином и холестерином, называют рафтами. Характер взаимодействия доменов может оказывать существенное влияние на процессы, для протекания которых необходима колокализация нескольких мембранных белков. Толщина упорядоченного липидного бислоя превышает толщину окружающей неупорядоченной мембраны, поэтому предполагается, что на границе упорядоченных доменов возникают упругие деформации, направленные на сглаживание скачка толщины бислоя. Характерная длина деформаций составляет несколько нанометров, и при сближении двух доменов деформации, индуцируемые их границами, начинают перекрываться, что приводит к эффективному латеральному взаимодействию. В настоящей работе мы теоретически рассмотрели, каким образом изменяется профиль энергии взаимодействия упорядоченных доменов при адсорбции на мембрану амфипатических пептидов. Амфипатические пептиды способны частично встраиваться в мембрану, вызывая в ней упругие деформации. Для анализа энергии деформаций различных конфигураций упорядоченных доменов и амфипатических пептидов использовалась теория упругости липидных мембран. В мембране без пептидов приведение в контакт двух параллельных границ упорядоченных доменов требует преодоления некоторого энергетического барьера. Согласно результатам наших расчетов, при наличии в мембране амфипатических пептидов высота этого энергетического барьера возрастает в несколько раз. Таким образом, амфипатические пептиды должны существенно затруднять слияние упорядоченных доменов и способствовать стабилизации ансамбля нанодоменов.
ВВЕДЕНИЕ
Плазматические мембраны клеток млекопитающих латерально неоднородны. Считается, что мембранные белки и липиды образуют домены [1, 2], причем специфическое липидное окружение необходимо для правильного функционирования белков [3, 4]. Домены, обогащенные сфингомиелином и холестерином, называют рафтами [5]. Типичный латеральный размер клеточных рафтов составляет 10–200 нм в зависимости от метода его определения [1, 6]. Малый размер рафтов существенно затрудняет их экспериментальное исследование in vivo.
В модельных мембранах, которые не содержат белков и состав которых близок к липидному составу наружных монослоев плазматических клеточных мембран, при понижении температуры (например, до комнатной) происходит фазовое разделение [7] и образуются домены микронных размеров, обогащенные сфингомиелином и холестерином [8]. Такие домены используются в качестве модели клеточных рафтов. Для их исследования могут применяться различные, в том числе и оптические, экспериментальные методы. В модельных мембранах было установлено, что липиды в доменах находятся в жидкоупорядоченном (Lo) состоянии, в то время как окружающая мембрана – жидконеупорядоченная (Ld) [9]. Толщина бислоя рафтов на 0.5–1 нм превосходит толщину окружающей мембраны [10, 11]. Кроме того, упорядоченные домены практически всегда бислойны: если в одном монослое мембраны находится упорядоченный домен, то в противоположном монослое в том же месте также будет находиться упорядоченный домен [12, 13].
Физические причины сохранения малого размера доменов в клеточных мембранах до сих пор не установлены. Классическая теория кинетики фазового разделения в жидкой системе предсказывает образование единой упорядоченной макроскопической фазы [14], хотя характерное время ее формирования может составлять несколько часов [15]. При этом для некоторых мембранных процессов, сопровождающихся колокализацией нескольких мембранных белков, показано, что до запуска процесса белки были надежно разделены пространственно и заведомо не взаимодействовали друг с другом [16, 17]. Предполагается, что исходно белки располагались в различных мембранных доменах, причем случайное слияние доменов было исключено. В работе [2] из плазматических мембран было выделено четыре вида доменов, характеризующихся различным липидным и белковым составом. Однако в модельных мембранах, сформированных из трех основных липидных компонентов плазматических клеточных мембран, упорядоченные домены, как правило, сливаются практически при каждом столкновении [18]. Мы полагаем, что за стабилизацию малых доменов в клеточных мембранах могут быть ответственны минорные мембранные компоненты, мольные доли которых составляют доли или единицы мольных процентов. В частности, в модельной системе было показано, что при добавлении ганглиозида GM1 в концентрации <1 мол. % средний размер доменов уменьшается в несколько раз [11, 19]. Согласно теоретической модели работы [11], ганглиозид GM1 накапливается в узкой полосе на границе доменов и значительно понижает энергию межфазной Lo/Ld-границы. Данная модель предсказывает аналогичный эффект для любых мембранных компонентов с ненулевой спонтанной кривизной; спонтанная кривизна ганглиозида GM1 положительна и равна ∼0.25 нм–1 [20]. В частности, было теоретически показано, что на границе упорядоченных доменов должны накапливаться амфипатические пептиды, также обладающие положительной спонтанной кривизной [21, 22].
В настоящей работе мы рассмотрели взаимодействие параллельных границ двух упорядоченных доменов, разделенных полосой окружающей мембраны. Предполагалось, что взаимодействие опосредовано упругими деформациями мембраны. Профили энергии взаимодействия были рассчитаны для случаев чисто липидной мембраны и мембраны, на которую адсорбированы и в которую частично встроены амфипатические пептиды. Показано, что в чисто липидной мембране для приведения границ доменов в плотный контакт необходимо преодолеть энергетический барьер. При оптимальном расположении адсорбированных пептидов относительно границ упорядоченных доменов высота этого энергетического барьера резко возрастает. Таким образом, минорные мембранные компоненты с ненулевой спонтанной кривизной, помимо понижения энергии межфазной Lo/Ld-границы, должны также затруднять слияние доменов.
ПОСТАНОВКА ЗАДАЧИ
Функционал упругой энергии. Для расчета энергии деформаций мы рассматриваем мембрану как непрерывную упругую среду. В латеральном направлении мембрана предполагается жидкой в том смысле, что работа по квазиравновесному латеральному сдвигу равна нулю. Экспериментально было установлено, что толщина бислоя Lo-фазы превышает толщину окружающей Ld-мембраны на 0.5–1 нм [10, 11]. Предполагается, что на границе Lo-доменов мембрана деформируется таким образом, чтобы сгладить этот скачок толщины. Ранее было показано, что энергия деформаций минимальна, когда границы Lo-доменов в противоположных монослоях мембраны сдвинуты друг относительно друга на 2–4 нм [23]. Таким образом, в окрестности границы домена можно выделить три зоны: Lo-бислой, Ld-бислой и “гибридный” бислой между ними шириной 2–4 нм, в котором один монослой находится в Lo-состоянии, а другой – в Ld.
Малые деформации, характерный пространственный масштаб которых значительно превышает толщину мембраны, как правило, хорошо описываются с помощью классического функционала упругой энергии, полученного Хельфрихом [24]. В рамках подхода Хельфриха мембрана рассматривается как двумерная бесконечно тонкая пленка, не имеющая какой-либо внутренней структуры. Упругая энергия мембраны полностью определяется формой поверхности и пропорциональна квадрату ее геометрической кривизны. В настоящей работе исследуются деформации мембраны, возникающие на характерных масштабах порядка нескольких нанометров. В связи с этим необходимо учитывать деформацию наклона липидных молекул относительно нормали к поверхности липидного монослоя, характерный масштаб которой сравним с толщиной мембраны, т.е. составляет несколько нанометров [23, 24]. В рамках линейной теории упругости липидных мембран функционал энергии, учитывающий деформацию наклона, был впервые получен Хаммом и Козловым [25]. В дальнейшем вывод Хамма–Козлова был пересмотрен в работах [26–28], в которых было показано, что необходимый учет изменения толщины монослоев мембраны при деформациях приводит к дополнительным квадратичным слагаемым, не учтенным в функционале Хамма–Козлова. В данной работе для функционала упругой энергии липидного монослоя мы используем следующее наиболее полное квадратичное выражение [28]:
(1)
$\begin{gathered} w = \int {\left\{ {\frac{B}{2}{{{\left( {\nabla {\mathbf{n}} + {{J}_{0}}} \right)}}^{2}} + \frac{B}{2}J_{0}^{2} + \frac{{{{k}_{t}}}}{2}{{{\mathbf{T}}}^{2}} + } \right.} \\ + \,\left. {{{k}_{c}}{\mathbf{T}}\left( {\nabla \nabla {\mathbf{n}}} \right) + \frac{{{{k}_{{gr}}}}}{2}{{{\left( {\nabla \nabla {\mathbf{n}}} \right)}}^{2}} + {{\sigma }_{0}}} \right\}dS - {{\sigma }_{0}}{{S}_{0}}. \\ \end{gathered} $В данном функционале векторное поле единичных векторов n, называемых директорами, характеризует среднюю ориентацию гидрофобных цепей липидов. Директор считается направленным от гидрофильной части липидных молекул к гидрофобной. Поле векторов наклона ${\mathbf{T}} \equiv \frac{{\mathbf{n}}}{{{\mathbf{N}} \cdot {\mathbf{n}}}} - {\mathbf{N}}$ характеризует отклонение директора от нормали N к так называемой разделяющей поверхности, которая проходит внутри липидного монослоя в области сочленения гидрофильной и гидрофобной частей липидных молекул. Векторные поля n и T определены на разделяющей поверхности. В функционале (1) выражение $\frac{1}{2}B(\nabla \cdot {\mathbf{n}} + J_{0}^{{}})_{{}}^{2} - \frac{1}{2}BJ_{0}^{2}$ описывает поверхностную плотность деформации изгиба, а последние три слагаемых, $\frac{1}{2}{{k}_{t}}{{{\mathbf{T}}}^{2}} + $ $ + \,\,k_{c}^{{}}{\mathbf{T}} \cdot (\nabla \nabla \cdot {\mathbf{n}}) + \frac{{{{k}_{{gr}}}}}{2}(\nabla \nabla \cdot {\mathbf{n}})_{{}}^{2}$, – поверхностную плотность энергии деформации наклона [27, 28]. Кроме того, мы учитываем приложенное к мембране латеральное натяжение σ0, однако пренебрегаем вкладом деформации латерального растяжения–сжатия. Таким образом, формально расчеты проводятся в приближении kA → ∞, где kA – модуль латерального растяжения–сжатия. Допустимость данного приближения подтверждается экспериментальными данными, согласно которым в мембранах, содержащих холестерин, модуль латерального растяжения–сжатия значительно превосходит модуль наклона (kA $ \gg $ kt), и, таким образом, энергия деформации латерального растяжения–сжатия должна быть значительно меньше энергии деформации наклона. При этом мы рассматриваем взаимодействие доменов Lo-фазы, которая образуется только в мембранах с высоким содержанием холестерина (∼20–50 мол. %) [29, 30].
Упругие параметры мембраны. Для получения количественных результатов, использовались следующие параметры мембраны: модуль изгиба B полагался равным 20 kBT и 10 kBT (T = 300 K) для монослоев Lo-домена и окружающей Ld-мембраны, соответственно [29–32]; спонтанные кривизны монослоев обеих фаз считались равными нулю; модуль наклона kt = 50 мН/м ≈ 12 kBT/нм2, исходя из теоретической оценки работы [25], одинаковый для обеих фаз; модуль kc = −5 kBT и модуль kgr = 3 kBT/нм2, согласно оценке, приведенной в работе [28], одинаковые для обеих фаз. Латеральное натяжение полагалось равным 0.6 мН/м ≈ ≈ 0.125 kBT/нм2 в каждом монослое и одинаковым в обеих фазах. Гидрофобная толщина монослоев Lo-домена и окружающей Ld-мембраны полагалась равной hd = 1.8 нм и hs = 1.3 нм соответственно [10, 33, 34].
Параметризация системы. Будем считать, что диаметр Lo-домена значительно превышает характерную длину изменения деформаций мембраны. Это позволяет пренебречь локальной кривизной границы домена и считать ее прямой линией, вдоль которой система обладает трансляционной симметрией. Для определенности рассмотрим горизонтальную мембрану. Введем декартову систему координат Oxyz. Пусть в недеформированном состоянии мембрана параллельна плоскости Oxy, ось Ox направлена перпендикулярно границе Lo-домена; ось Oy направлена вдоль границы Lo-домена, ось Oz перпендикулярна плоскости мембраны; начало координат расположено на границе Lo-домена в нижнем монослое мембраны. Величины, относящиеся к верхнему и нижнему монослоям, будем обозначать индексами “u” и “l ” соответственно. Обозначим форму разделяющих поверхностей H, а форму межмонослойной поверхности – M. Вследствие трансляционной симметрии системы вдоль границы домена, энергию деформаций можно относить к единице длины вдоль границы домена, а векторные величины, входящие в функционал упругой энергии, заменить их проекциями на ось Ox: n → nx = n, N → Nx = N, t → tx = t.
Граничные условия. Для описания системы мембрана разделяется на зоны, соответствующие бислойному Lo-домену, бислойной окружающей мембране и переходному участку между ними, в котором один монослой находится в Lo-состоянии, а другой – в Ld. На границах зон налагаются условия непрерывности директоров и разделяющих поверхностей. Помимо этого, считается, что деформации ограничены и затухают (обращаются в нуль) вдали от границы домена.
Амфипатический пептид будем располагать в верхнем монослое мембраны параллельно границе упорядоченного домена. В области монослоя, занятой пептидом, разделяющая поверхность не существует. Соответственно, участок нижнего монослоя напротив пептида находится в условиях, отличных от условий, в которых находится монослой в составе бислоя. Для учета этого различия явно вводится дополнительная зона мембраны – монослой напротив встроенного амфипатического пептида. На границах этого монослойного участка директор и разделяющая поверхность также считаются непрерывными.
При частичном встраивании в мембрану амфипатического пептида должны раздвигаться в стороны полярные головки липидов. Это приводит к скачку проекции директора на правой и левой границах пептида (рис. 1).
Рис. 1.
Частичное встраивание амфипатического пептида в липидный монослой приводит к скачку директора на правой (nR) и левой (nL) границах пептида. При повороте пептида вокруг его продольной оси изменяются z-координаты разделяющей поверхности монослоя на правой (HR) и левой (HL) границах пептида. D – диаметр пептида; h – толщина гидрофобной части монослоя.
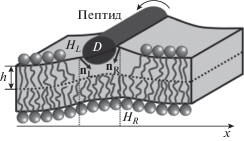
Для оценки величины скачка проекций директора мы предполагаем, что директоры, характеризующие ориентацию гидрофобных цепей липидных молекул, ближайших к пептиду, направлены в центр масс гидрофобной части участка монослоя, расположенного непосредственно под пептидом: $\left| {{{n}_{R}} - {{n}_{L}}} \right|$ = $\Delta n$ = ${D \mathord{\left/ {\vphantom {D {\sqrt {{{{\left( {{h \mathord{\left/ {\vphantom {h 2}} \right. \kern-0em} 2}} \right)}}^{2}} + {{{\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}^{2}}} }}} \right. \kern-0em} {\sqrt {{{{\left( {{h \mathord{\left/ {\vphantom {h 2}} \right. \kern-0em} 2}} \right)}}^{2}} + {{{\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}^{2}}} }}$, где h – гидрофобная толщина монослоя в недеформированном состоянии; D – диаметр пептида, который мы оцениваем приблизительно как диаметр α-спирали пептида, D = 1.3 нм; nL и nR – значения проекций директора на правой и левой границах пептида, соответственно. При этом, если пептид находится частично и в Lo-домене, и в окружающей мембране, то мы полагаем Δn = $ = \,{{\delta D} \mathord{\left/ {\vphantom {{\delta D} {\sqrt {{{{\left( {{{{{h}_{d}}} \mathord{\left/ {\vphantom {{{{h}_{d}}} 2}} \right. \kern-0em} 2}} \right)}}^{2}}\, + \,{{{\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}^{2}}} }}} \right. \kern-0em} {\sqrt {{{{\left( {{{{{h}_{d}}} \mathord{\left/ {\vphantom {{{{h}_{d}}} 2}} \right. \kern-0em} 2}} \right)}}^{2}}\, + \,{{{\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}^{2}}} }}\, + \,\left( {1 - \delta } \right){D \mathord{\left/ {\vphantom {D {\sqrt {{{{\left( {{{{{h}_{s}}} \mathord{\left/ {\vphantom {{{{h}_{s}}} 2}} \right. \kern-0em} 2}} \right)}}^{2}}\, + \,{{{\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}^{2}}} }}} \right. \kern-0em} {\sqrt {{{{\left( {{{{{h}_{s}}} \mathord{\left/ {\vphantom {{{{h}_{s}}} 2}} \right. \kern-0em} 2}} \right)}}^{2}}\, + \,{{{\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}^{2}}} }}$, где δ является долей диаметра пептида, находящейся в Lo-домене, hs и hd – гидрофобные толщины монослоев окружающей Ld-мембраны и Lo-домена, соответственно [22]. Помимо этого граничного условия, мы учитываем возможность вращения пептида как целого вокруг его продольной оси, что налагает условие на z-координаты разделяющей поверхности монослоя на правой и левой границах пептида: HR – HL = (1/2)D(nL + nR), где HR и HL – z-координаты разделяющих поверхностей на правой и левой границах пептида, соответственно (рис. 1) [22].
РЕШЕНИЕ ЗАДАЧИ
Уравнения Эйлера–Лагранжа для переходной зоны между Lo-доменом и окружающей Ld-мембраной. Выражение для функционала упругой энергии (1) выводится в предположении локальной объемной несжимаемости гидрофобной части липидного монослоя [28]. Это предположение оправдано большой величиной модуля объемного сжатия мембран, сравнимого с модулем объемного сжатия воды [35–37]. Условие локальной объемной несжимаемости имеет вид: Hu – M = $ = {{h}_{u}} - \frac{{{{h}^{2}}}}{2}\frac{d}{{dx}}{{n}_{u}}$ и $M - {{H}_{l}} = {{h}_{l}} - \frac{{{{h}^{2}}}}{2}\frac{d}{{dx}}{{n}_{l}}$ для верхнего и нижнего монослоя, соответственно [25]. Работа против латерального натяжения при деформации мембраны может быть записана в виде: ${{\sigma }_{0}}\left( {\sqrt {1 + {{{\left( {\frac{{dH}}{{dx}}} \right)}}^{2}}} - 1} \right) \approx \frac{{{{\sigma }_{0}}}}{2}{{\left( {\frac{{dH}}{{dx}}} \right)}^{2}}$.
Кроме того, с требуемой точностью Nu = = dHu/dx, Nl = –dHl/dx и, соответственно, выражения для проекций векторов наклона можно записать в следующем виде: ${{T}_{u}} = {{n}_{u}} - \frac{d}{{dx}}{{H}_{u}}$, ${{T}_{l}} = {{n}_{l}} + \frac{d}{{dx}}{{H}_{l}}$. Подставим Hu и Hl из условий объемной несжимаемости в выражения для проекций векторов наклона, а затем все эти выражения подставим в функционал упругой энергии бислоя (1). Получающийся функционал зависит от трех неизвестных функций: nu, nl и M. Варьируя функционал по этим функциям, мы получаем следующую систему линейных дифференциальных уравнений Эйлера–Лагранжа:
(2)
$\left\{ \begin{gathered} 0 = - \frac{d}{{dx}}M + (h_{u}^{2} - l_{u}^{2} + 2{{l}_{c}})\frac{{{{d}^{2}}}}{{d{{x}^{2}}}}{{n}_{u}} + \left( { - \frac{1}{2}h_{u}^{2} - {{l}_{c}} - \frac{1}{2}sh_{u}^{2}} \right)\frac{{{{d}^{3}}}}{{d{{x}^{3}}}}M + \hfill \\ + \,\,\left( {\frac{1}{4}h_{u}^{4} + {{l}_{c}}h_{u}^{4} + {{l}_{{gr}}} + \frac{1}{4}sh_{u}^{4}} \right)\frac{{{{d}^{4}}}}{{d{{x}^{4}}}}{{n}_{u}} + {{n}_{u}}, \hfill \\ 0 = - \frac{d}{{dx}}{{n}_{l}} + \frac{d}{{dx}}{{n}_{u}} + ( - 2 - 2s)\frac{{{{d}^{2}}}}{{d{{x}^{2}}}}M + \left( { - \frac{1}{2}h_{l}^{2} - {{l}_{c}} - \frac{1}{2}sh_{l}^{2}} \right)\frac{{{{d}^{3}}}}{{d{{x}^{3}}}}{{n}_{l}} + \hfill \\ + \,\,\left( {\frac{1}{2}h_{u}^{2} + {{l}_{c}} + \frac{1}{2}sh_{u}^{2}} \right)\frac{{{{d}^{3}}}}{{d{{x}^{3}}}}{{n}_{u}}, \hfill \\ 0 = \frac{d}{{dx}}M + (h_{l}^{2} - l_{l}^{2} + 2{{l}_{c}})\frac{{{{d}^{2}}}}{{d{{x}^{2}}}}{{n}_{l}} + \left( {\frac{1}{2}h_{l}^{2} + {{l}_{c}} + \frac{1}{2}sh_{l}^{2}} \right)\frac{{{{d}^{3}}}}{{d{{x}^{3}}}}M + \hfill \\ + \,\,\left( {\frac{1}{4}h_{l}^{4} + {{l}_{c}}h_{l}^{2} + {{l}_{{gr}}} + \frac{1}{4}sh_{l}^{4}} \right)\frac{{{{d}^{4}}}}{{d{{x}^{4}}}}{{n}_{l}} + {{n}_{l}}, \hfill \\ \end{gathered} \right.$где ${{l}_{u}} = \sqrt {{{{{B}_{u}}} \mathord{\left/ {\vphantom {{{{B}_{u}}} {{{k}_{t}}}}} \right. \kern-0em} {{{k}_{t}}}}} $, ${{l}_{l}} = \sqrt {{{{{B}_{l}}} \mathord{\left/ {\vphantom {{{{B}_{l}}} {{{k}_{t}}}}} \right. \kern-0em} {{{k}_{t}}}}} $, ${{l}_{c}} = {{{{k}_{c}}} \mathord{\left/ {\vphantom {{{{k}_{c}}} {{{k}_{t}}}}} \right. \kern-0em} {{{k}_{t}}}}$, ${{l}_{{gr}}} = {{{{k}_{{gr}}}} \mathord{\left/ {\vphantom {{{{k}_{{gr}}}} {{{k}_{t}}}}} \right. \kern-0em} {{{k}_{t}}}}$, $s = {{{{\sigma }_{0}}} \mathord{\left/ {\vphantom {{{{\sigma }_{0}}} {{{k}_{t}}}}} \right. \kern-0em} {{{k}_{t}}}}$. С помощью линейных преобразований можно получить изолированное уравнение для nu вида:
где Ak – известные коэффициенты, зависящие от упругих параметров мембраны, которые, однако, слишком громоздкие для их записи в явном виде. Уравнение (3) является линейным дифференциальным уравнением. Находя его решение в явном виде, можно определить оставшиеся неизвестные функции nl и M, подставив решение для nu в систему уравнений (2).
Уравнения Эйлера–Лагранжа для зон Lo-домена и окружающей Ld-мембраны. Для зон мембраны, соответствующих бислойному Lo-домену и бислойной окружающей Ld-мембране, можно записать: ${{h}_{u}} = {{h}_{l}} \equiv h$ и ${{l}_{u}} = {{l}_{l}} \equiv l$. Поэтому система уравнений (2) значительно упрощается:
(4)
$\left\{ \begin{gathered} \left( {h_{{}}^{2} - {{l}^{2}} + 2{{l}_{c}}} \right)\frac{{{{d}^{2}}}}{{d{{x}^{2}}}}{{n}_{ + }} + \left( {\frac{1}{4}{{h}^{2}} + {{l}_{c}}{{h}^{2}} + {{l}_{{gr}}} + \frac{1}{4}s{{h}^{4}}} \right)\frac{{{{d}^{4}}}}{{d{{x}^{4}}}}{{n}_{ + }} + {{n}_{ + }} = 0, \hfill \\ - 2\frac{d}{{dx}}M + \left( {{{h}^{2}} - {{l}^{2}} + 2{{l}_{c}}} \right)\frac{{{{d}^{2}}}}{{d{{x}^{2}}}}{{n}_{ - }} + \left( { - {{h}^{2}}s - {{h}^{2}} - 2{{l}_{c}}} \right)\frac{{{{d}^{3}}}}{{d{{x}^{3}}}}M + \hfill \\ + \,\,\left( {\frac{1}{4}{{h}^{4}} + {{l}_{c}}{{h}^{2}} + {{l}_{{gr}}} + \frac{1}{4}sh_{u}^{2}} \right)\frac{{{{d}^{4}}}}{{d{{x}^{4}}}}{{n}_{ - }} + {{n}_{ - }} = 0, \hfill \\ \frac{d}{{dx}}{{n}_{ - }} + ( - 2 - 2s)\frac{{{{d}^{2}}}}{{d{{x}^{2}}}}M + \left( {\frac{1}{2}{{h}^{2}} + {{l}_{c}} + \frac{1}{2}s{{h}^{2}}} \right)\frac{{{{d}^{3}}}}{{d{{x}^{3}}}}{{n}_{ - }} = 0, \hfill \\ \end{gathered} \right.$где ${{n}_{ + }} = {{n}_{u}} + {{n}_{l}}$, ${{n}_{ - }} = {{n}_{u}} - {{n}_{l}}$. Решение первого уравнения легко находится, но является слишком объемным для его записи здесь в явном виде. С помощью линейных преобразований оставшихся двух уравнений мы получаем следующее изолированное уравнение для M:
(5)
$\begin{gathered} \frac{{{{d}^{6}}}}{{d{{x}^{6}}}}M - \frac{{ - {{l}^{2}}s + 2{{l}_{c}}s - l_{u}^{2}}}{{{{l}_{c}}^{2} - {{l}_{{gr}}}s - {{l}_{{gr}}}}}\frac{{{{d}^{4}}}}{{d{{x}^{4}}}}M - \\ - \,\,\frac{s}{{{{l}_{c}}^{2} - {{l}_{{gr}}}s - {{l}_{{gr}}}}}\frac{{{{d}^{2}}}}{{d{{x}^{2}}}}M = 0. \\ \end{gathered} $Явное решение данного уравнения также является слишком объемным для того, чтобы быть представленным здесь. После подстановки этого решения в систему (4) находится решение для ${{n}_{ - }}$, и затем выражаются nu и nl.
Уравнения Эйлера–Лагранжа для участка монослоя под пептидом. Зона под пептидом представляет собой участок нижнего липидного монослоя, уравнения Эйлера–Лагранжа для которого имеют следующий вид:
(6)
$\left\{ \begin{gathered} \frac{{d{{n}_{l}}}}{{dx}} + \left( {1 + s} \right)\frac{{{{d}^{2}}M}}{{d{{x}^{2}}}} + \left( {\frac{{{{h}^{2}}}}{2} + {{l}_{c}} + \frac{{s{{h}^{2}}}}{2}} \right)\frac{{{{d}^{3}}{{n}_{l}}}}{{d{{x}^{3}}}} = 0, \hfill \\ \frac{{dM}}{{dx}} + \left( {{{h}^{2}} - {{l}^{2}} + 2{{l}_{c}}} \right)\frac{{{{d}^{2}}{{n}_{l}}}}{{d{{x}^{2}}}} + \left( {\frac{{{{h}^{2}}}}{2} + {{l}_{c}} + \frac{{s{{h}^{2}}}}{2}} \right)\frac{{{{d}^{3}}M}}{{d{{x}^{3}}}} + \hfill \\ + \,\,\left( {\frac{{{{h}^{4}}}}{4} + {{l}_{c}}{{h}^{2}} + {{l}_{{gr}}} + \frac{{s{{h}^{2}}}}{4}} \right)\frac{{{{d}^{4}}{{n}_{l}}}}{{d{{x}^{4}}}} + {{n}_{l}} = 0. \hfill \\ \end{gathered} \right.$С помощью линейных преобразований можно получить изолированное линейное дифференциальное уравнение для функции M, которое совпадает с уравнением (5). Подставляя соответствующее решение в систему (6), мы находим решение для nl.
РЕЗУЛЬТАТЫ
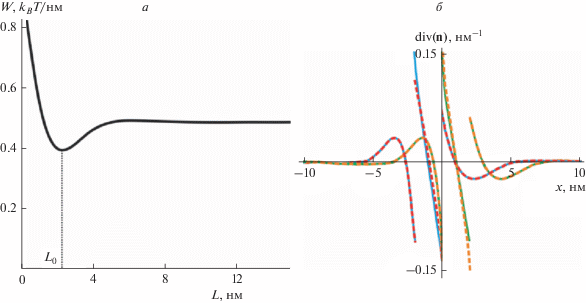
Деформации мембраны в переходной зоне между Lo- и Ld-фазами. Рассмотрим структуру переходной зоны между Lo-доменом и окружающей Ld‑мембраной в отсутствие пептида. Глобальному минимуму упругой энергии системы соответствует относительный сдвиг границ упорядоченных монослойных доменов, расположенных в противоположных монослоях мембраны, на расстояние L0 = 2 нм (рис. 2а); при этом из-за симметрии системы энергия не зависит от знака L0. При дальнейших расчетах это расстояние фиксировалось и полагалось равным либо L0 = 2 нм, либо L0 = −2 нм. Вблизи границы домена происходит изменение гидрофобной толщины бислоя от 2hd в области Lo-домена до 2hs в области Ld-мембраны вдали от границы. Кроме того, локальная эффективная кривизна разделяющих поверхностей липидных монослоев, характеризующаяся величиной div(n), отлична от нуля только в узкой области вблизи границы домена (рис. 2б). Отметим, что характерная длина затухания деформаций, возникающих на границе домена, составляет несколько нанометров (рис. 2б).
Рис. 2.
Энергия и распределение деформаций вблизи границы упорядоченного домена. а – Зависимость энергии упругих деформаций мембраны, возникающих на границе Lo-домена с окружающей Ld-мембраной, от относительного сдвига L границ монослойных упорядоченных доменов, расположенных в противоположных монослоях. Минимум энергии достигается при L = L0 ≈ 2 нм. б – Латеральное распределение эффективной кривизны монослоев, div(n) (зависимость от координаты x): сплошные зеленая и синяя кривые – в нижнем монослое; штриховые красная и оранжевая кривые – в верхнем монослое; зеленая и оранжевая кривые – конфигурация L0 = 2 нм; синяя и красная кривые – конфигурация L0 = –2 нм. Точка x = 0 соответствует положению границы Lo-домена в нижнем монослое.
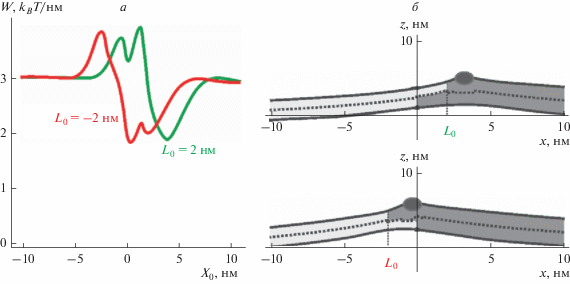
Оптимальное положение амфипатического пептида относительно границы Lo-домена. Частично встроенный в мембрану амфипатический пептид деформирует мембрану вследствие ненулевого скачка проекции директора на его правой и левой границах. Характерные длины затухания деформаций, индуцированных амфипатическим пептидом, составляют несколько нанометров. Перекрытие деформаций, возникающих вблизи границы Lo-домена и деформаций, индуцированных амфипатическим пептидом, приводит к эффективному латеральному взаимодействию границы и пептида. Согласно расчетам, энергия упругих деформаций оказывается минимальна, когда пептид располагается в Lo-фазе вблизи границы [21, 22]. На рис. 3а показаны зависимости упругой энергии системы, отнесенной к единице длины вдоль границы домена, от координаты X0 правой границы пептида для случаев L0 = 2 нм и L0 = −2 нм; точке x = 0 соответствует положение границы Lo-домена в нижнем монослое. Чтобы найти абсолютную упругую энергию, необходимо отнесенную к единице длины вдоль границы домена энергию умножить на эффективную длину пептида в направлении границы домена [38]. Эффективная длина классических антимикробных пептидов типа мелиттина и магаинина составляет 4–6 нм. Таким образом, глубина минимума упругой энергии при оптимальном расположении пептида относительно границы домена составляет (0.8 – 0.9 kBT/нм) × (4 – – 6 нм) ≈ 3 – 5.5 kBT, что в несколько раз превосходит среднюю энергию, приходящуюся на одну поступательную степень свободы пептида, т.е. 0.5kBT. Из этого можно заключить, что частично встроенные в мембрану амфипатические пептиды должны выстраиваться вдоль границы Lo-доменов. Форма мембраны, рассчитанная для оптимальных положений пептида, показана на рис. 3б.
Рис. 3.
Оптимальное положение амфипатического пептида относительно границы Lo-домена. а – Зависимости упругой энергии системы от координаты X0 правой границы пептида для случаев L0 = 2 нм (зеленая кривая) и L0 = −2 нм (красная кривая). б – Форма мембраны при оптимальных положениях амфипатического пептида, соответствующих глобальным минимумам упругой энергии системы, для случаев L0 = 2 нм (вверху) и L0 = −2 нм (внизу). Пептид показан темно-серым эллипсом; упорядоченные домены показаны серым цветом; окружающая мембрана показана светло-серым цветом; пунктирной линией показана межмонослойная поверхность M(x).
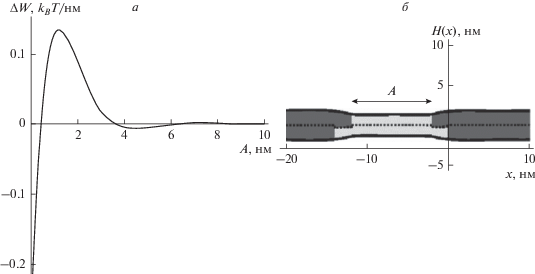
Взаимодействие Lo-доменов без пептидов. Ранее [18, 39] в мембране без пептидов было рассмотрено латеральное взаимодействие границ двух Lo-доменов, разделенных полосой Ld-бислоя, и было показано, что для приведения границ в контакт и последующего слияния доменов необходимо преодолеть энергетический барьер высотой ∼0.1–0.2kBT/нм. Поскольку амфипатические пептиды, как правило, отталкиваются друг от друга при сильном сближении [28, 38], можно предположить, что для слияния Lo-доменов, вдоль границ которых выстроены амфипатические пептиды в оптимальных положениях, высота энергетического барьера должна увеличиваться по сравнению со случаем слияния доменов в мембране без пептидов.
На рис. 4а показана зависимость упругой энергии системы от минимального расстояния A между Lo-доменами за вычетом энергии при бесконечном расстоянии между Lo-доменами (A = ∞). Из данного графика следует, что для приведения границ в плотный контакт и последующего слияния доменов необходимо преодолеть энергетический барьер, высота которого составляет ∼0.14 kBT/нм. При сближении Lo-доменов упругая энергия сначала уменьшается и достигает минимума при расстоянии A = 4.5 нм. При дальнейшем сближении упругая энергия возрастает, достигая максимума при расстоянии между доменами A = 1.5 нм. На рис. 4б показана форма мембраны при A = 10 нм. Рисунок 4 иллюстрирует только случай L0 = −2 нм, поскольку вследствие симметрии системы зависимость упругой энергии от расстояния между Lo-доменами и форма мембраны совпадают для случаев L0 = 2 нм и L0 = –2 нм.
Рис. 4.
Латеральное взаимодействие двух Lo-доменов в мембране без амфипатических пептидов. а – Зависимость полной упругой энергии системы от расстояния A между Lo-доменами за вычетом энергии при бесконечном расстоянии между Lo-доменами (A = ∞). б – Форма мембраны при A = 10 нм. Упорядоченные домены показаны серым цветом; окружающая мембрана показана светло-серым цветом; пунктирной линией показана межмонослойная поверхность M(x).
Взаимодействие Lo-доменов в случае наличия амфипатических пептидов на их границах. Рассмотрим взаимодействие Lo-доменов в мембране, в которую частично встроены амфипатические пептиды. Как следует из рис. 3а, глобальному минимуму упругой энергии соответствует положение амфипатического пептида вблизи границы Lo-домена. Зафиксируем амфипатические пептиды в оптимальных положениях относительно границ Lo-доменов в соответствии с рис. 3. Рассмотрим латеральное взаимодействие двух Lo-доменов, границы которых полностью заполнены линией амфипатических пептидов. Зависимость упругой энергии системы от минимального расстояния A между Lo-доменами показана на рис. 5а, 5б для случаев L0 = 2 нм и L0 = –2 нм, соответственно, за вычетом упругой энергии системы при бесконечном расстоянии между Lo-доменами (A = ∞).
Рис. 5.
Взаимодействие двух Lo-доменов, вдоль границ которых расположены амфипатические пептиды. Амфипатические пептиды зафиксированы в оптимальных положениях относительно границ Lo-доменов в соответствии с рис. 3. Зависимость упругой энергии системы от минимального расстояния A между Lo-доменами за вычетом энергии при A = ∞ для случаев: а – L0 = 2 нм; б – L0 = –2 нм. На вставках на графиках показана форма мембраны при A = 10 нм. Пептид показан темно-серым эллипсом; упорядоченные домены показаны серым цветом; окружающая мембрана показана светло-серым цветом; пунктирной линией показана межмонослойная поверхность M(x).
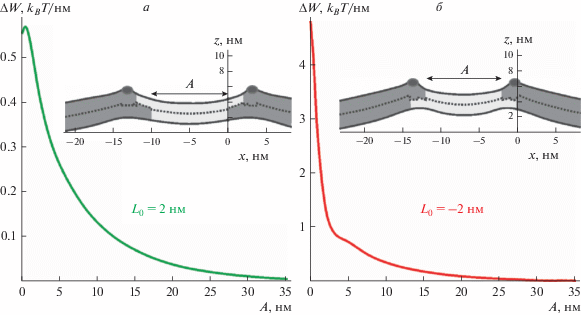
Из рис. 5 следует, что высота энергетического барьера, который необходимо преодолеть для приведения границ доменов в плотный контакт, значительно повышается в случае, когда вдоль границ доменов расположены амфипатические пепитды. В конфигурации L0 = 2 нм высота барьера составляет 0.56kBT/нм, а в конфигурации L0 = −2 нм – приблизительно 4.8kBT/нм. В случае взаимодействия доменов без пептидов, высота соответствующего энергетического барьера составляла 0.14kBT/нм.
Приведенная расчетная величина высоты энергетического барьера слияния доменов в присутствии пептидов на их границах может быть несколько завышена, поскольку при расчетах положение пептидов относительно границ доменов считалось фиксированным. Однако может оказаться, что при сближении доменов пептидам будет энергетически выгодно сдвинуться относительно положения, соответствующего глобальному минимуму энергии на рис. 3а. Тем не менее, величину этого барьера возможно оценить снизу. Рассмотрим зависимость упругой энергии системы от расстояния между пептидами, когда расстояние между доменами равно нулю, A = 0, т.е. в случае, когда произошло слияние двух из четырех монослойных доменов. Вычтем из этой зависимости величину энергии в глобальном минимуме в случае, когда домены находятся далеко друг от друга (A = ∞), т.е. вычтем удвоенную минимальную энергию на кривых W(X0) рис. 3а. Получающиеся зависимости энергии от расстояния между пептидами приведены на рис. 6; при некотором расстоянии между пептидами энергия имеет глобальный минимум. Высота энергетического барьера слияния доменов в присутствии пептидов на их границах не может быть ниже, чем величина энергии в этом глобальном минимуме. Это связано с тем, что высота энергетического барьера на траектории между начальным (A = ∞) и конечным (A = 0) состояниями системы, каждое из которых характеризуется локальным минимумом упругой энергии по положению пептидов, не может быть меньше, чем разница энергий конечного и начального состояний. Эта разница и соответствует минимумам энергии на графиках рис. 6.
Рис. 6.
Зависимость упругой энергии системы от расстояния между пептидами при A = 0, за вычетом упругой энергии системы при A = ∞ для случаев L0 = 2 нм (зеленая кривая) и L0 = −2 нм (красная кривая).
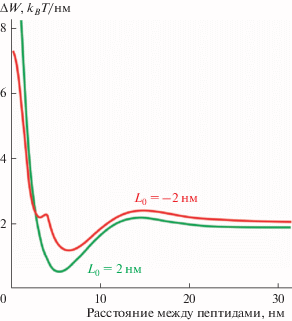
Из рис. 6 следует, что для случая L0 = 2 нм высота энергетического барьера слияния доменов должна быть не менее ∼0.53kBT/нм, а для L0 = −2 нм – не менее ∼1.16kBT/нм. Данные оценки высоты барьера превосходят в ∼3.8 раза и в ∼8.3 раза высоту энергетического барьера слияния доменов в мембране без пептидов для конфигураций L0 = 2 нм и L0 = −2 нм соответственно (рис. 4). Таким образом, можно заключить, что высота энергетического барьера слияния Lo-доменов повышается в несколько раз в случае, если на мембрану адсорбированы амфипатические пептиды.
ОБСУЖДЕНИЕ
В настоящей работе мы рассмотрели латеральное взаимодействие липидных упорядоченных доменов, опосредованное упругими деформациями мембраны, в случае, когда в мембрану частично встроены амфипатические пептиды. Ранее было показано [21, 22], что с точки зрения минимизации энергии деформаций мембраны амфипатическим пептидам выгодно расположиться вблизи границы доменов. Это связано с тем, что при частичном встраивании в мембрану амфипатического пептида раздвигаются в стороны полярные головки липидов и индуцируется положительная кривизна мембраны, т.е. мембрана становится локально выпуклой для наблюдателя, расположенного со стороны амфипатического пептида. Иными словами, амфипатические пептиды обладают положительной спонтанной кривизной. Упругая энергия минимальна, когда локальная геометрическая кривизна липидного монослоя совпадает со спонтанной кривизной, индуцируемой мембранными компонентами. Однако геометрическая кривизна мембраны, в которой сосуществуют Lo- и Ld-фазы, отлична от нуля лишь в узкой области вблизи межфазной Lo/Ld-границы (рис. 2б); остальная часть мембраны – плоская, и кривизна ее поверхности равна нулю. Таким образом, упругая энергия мембраны минимальна, когда амфипатические пептиды располагаются вблизи межфазной Lo/Ld-границы в областях, в которых разделяющие поверхности липидных монослоев локально выпуклые.
Ранее было показано [18, 39], что в мембране без пептидов для приведения границ двух Lo-доменов в контакт и их последующего слияния необходимо преодолеть энергетический барьер. Кроме того, в работах [28, 38] было показано, что два амфипатических пептида, встроенные в один и тот же монослой мембраны, отталкиваются на расстояниях порядка нескольких нанометров. В связи с этим можно ожидать, что наличие пептидов на границе Lo-доменов должно приводить к увеличению высоты энергетического барьера процесса слияния доменов. Действительно, как показывают наши расчеты, высота барьера увеличивается: в случае конфигурации L0 = 2 нм высота увеличивается как минимум в ∼3.8 раза, а в случае L0 = −2 нм – в ∼8.3 раза. Отметим, что конфигурация границ доменов L0 = −2 нм наиболее вероятно реализуется в плазматических мембранах клеток млекопитающих. Плазматические мембраны асимметричны по липидному составу монослоев. Их наружный монослой относительно обогащен насыщенными липидами [40], которые преимущественно и формируют упорядоченные домены [9]. Таким образом, суммарная площадь упорядоченных доменов в наружном монослое плазматической мембраны должна быть больше, чем во внутреннем монослое. В среднем, в каждом бислойном рафте в плазматической мембране площадь монослойного упорядоченного домена, расположенного в наружном монослое, должна превышать площадь домена во внутреннем монослое. Амфипатические пептиды, как правило, находятся или добавляются снаружи клеток и встраиваются в наружный монослой плазматической мембраны. Это соответствует конфигурации L0 = –2 нм, если считать наружный монослой верхним, а внутренний – нижним в наших обозначениях.
Увеличение высоты энергетического барьера слияния доменов может препятствовать образованию макроскопических доменов в мембране. Экспериментально было показано [41, 42], что в результате фазового разделения с образованием упорядоченной Lo- и неупорядоченной Ld-фаз могут образовываться либо макроскопические домены характерного размера порядка нескольких микрометров, либо нанодомены характерного размера порядка десятков нанометров. В работе [42] было продемонстрировано, что средний размер доменов определяется величиной линейного натяжения их границы: макроскопические домены образуются, только когда линейное натяжение превосходит приблизительно 0.3 пН ≈ 0.075kBT/нм. Амфипатические пептиды повышают энергию межфазной Lo/Ld-границы (ср. рис. 2а и 3а); однако пептиды могут стабилизировать нанодомены за счет затруднения их слияния (рис. 5), поскольку увеличение размера доменов на поздних стадиях фазового разделения происходит преимущественно за счет их слияния [15].
Амфипатические пептиды в настоящее время рассматриваются как перспективные антимикробные препараты [43, 44]. Показано, что некоторые амфипатические пептиды способны адсорбироваться на мембранах бактериальных клеток и вызывать в них образование сквозных пор [44]. Избирательное связывание пептидов с бактериальными мембранами обеспечивается, в основном, различием электрического заряда наружных монослоев плазматических мембран эукариотических и бактериальных клеток: наружные монослои бактериальных мембран имеют отрицательный заряд, в то время как наружные монослои мембран эукариотических клеток электрически нейтральны. В связи с этим, перспективные антимикробные пептиды, как правило, несут большой положительный заряд [43, 44]. Степень избирательности антимикробного пептида характеризуется его антибактериальным и гемолитическим действием, т.е. соотношением эффективностей образования пор в мембранах бактериальных и эукариотических клеток. Низкая гемолитическая активность подразумевает, что концентрация адсорбирующегося пептида на мембранах эукариотических клеток недостаточна для эффективного образования сквозных пор. Однако из результатов нашей работы следует, что, даже если амфипатический пептид не разрушает мембрану эукариотической клетки, он может существенно изменять характеристики взаимодействия рафтов. В работе [45] было показано, что при замене в рафтообразующей смеси холестерина на его метаболический предшественник, 7-дегидрохолестерин, рафты при столкновениях начинают “слипаться”: они не сливаются и не расходятся на большие расстояния, образуя протяженные агрегаты круглых доменов. У человека недостаток холестерина и накапливание 7-дегидрохолестерина вызывает синдром Смита–Лемли–Опитца [46]. Таким образом, вариация характера взаимодействия рафтов может иметь серьезные последствия как на уровне отдельных клеток, так и на уровне организма в целом. Насколько нам известно, подобный побочный эффект, потенциально вызываемый антимикробными пептидами, ранее систематически не исследовался.
В работах [11, 21] было показано, что липиды, обладающие положительной спонтанной кривизной, например ганглиозид GM1, также должны накапливаться в узкой полосе вблизи межфазной Lo/Ld-границы. Аналогично полосе амфипатических пептидов, полоса таких липидов должна индуцировать скачок проекции директора на своей правой и левой границах, что, в свою очередь, должно приводить к повышению высоты энергетического барьера, который необходимо преодолеть для приведения границ Lo-доменов в плотный контакт. Этот вывод согласуется с экспериментальными данными: в работах [11, 19, 41], было показано, что наличие ганглиозида GM1 в мембране стабилизирует нанодомены, по-видимому, за счет понижения вероятности их слияния при столкновениях. Ганглиозиды находятся преимущественно во внешних монослоях плазматических мембран клеток, что соответствует конфигурации L = −2 нм в наших обозначениях.
Таким образом, из результатов наших расчетов можно заключить, что амфипатические пептиды, встроенные в монослой липидной мембраны, в которой сосуществуют домены жидкоупорядоченной и жидконеупорядоченной фаз, должны существенно затруднять слияние доменов и, тем самым, стабилизировать ансамбль нанодоменов.
Работа выполнена при частичной поддержке Министерства науки и высшего образования Российской Федерации.
Список литературы
Lillemeier B.F., Pfeiffer J.R., Surviladze Z., Wilson B.S., Davis M.M. 2006. Plasma membrane-associated proteins are clustered into islands attached to the cytoskeleton. Proc. Natl. Acad. Sci. USA. 103, 18992–18997.
Ayuyan A.G., Cohen F.S. 2008. Raft composition at physiological temperature and pH in the absence of detergents. Biophys. J. 94, 2654–2666.
Yang S.T., Kiessling V., Simmons J.A., White J.M., Tamm L.K. 2015. HIV gp41–mediated membrane fusion occurs at edges of cholesterol-rich lipid domains. Nat. Chem. Biol. 11, 424–431.
Allen J.A., Halverson-Tamboli R.A., Rasenick M.M. 2007. Lipid raft microdomains and neurotransmitter signalling. Nat. Rev. Neurosci. 8, 128–140.
Pike L.J. 2006. Rafts defined: A report on the Keystone Symposium on lipid rafts and cell function. J. Lip. Res. 47, 1597–1598.
Pralle A., Keller P., Florin E.L., Simons K., Hörber J.H. 2000. Sphingolipid–cholesterol rafts diffuse as small entities in the plasma membrane of mammalian cells. J. Cell Biol. 148, 997–1008.
Samsonov A.V., Mihalyov I., Cohen F.S. 2001. Characterization of cholesterol-sphingomyelin domains and their dynamics in bilayer membranes. Biophys. J. 81, 1486–1500.
Petruzielo R.S., Heberle F.A., Drazba P., Katsaras J., Feigenson G.W. 2013. Phase behavior and domain size in sphingomyelin-containing lipid bilayers. Biochim. Biophys. Acta. 1828, 1302–1313.
Veatch S.L., Polozov I.V., Gawrisch K., Keller S.L. 2004. Liquid domains in vesicles investigated by NMR and fluorescence microscopy. Biophys. J. 86, 2910–2922.
Rinia H.A., Snel M.M., van der Eerden J.P., de Kruijff B. 2001. Visualizing detergent resistant domains in model membranes with atomic force microscopy. FEBS Lett. 501, 92–96.
Galimzyanov T.R., Lyushnyak A.S., Aleksandrova V.V., Shilova L.A., Mikhalyov I.I., Molotkovskaya I.M., Akimov S.A., Batishchev O.V. 2017. Line activity of ganglioside GM1 regulates raft size distribution in a cholesterol-dependent manner. Langmuir. 33, 3517–3524.
Baumgart T., Hess S.T., Webb W.W. 2003. Imaging coexisting fluid domains in biomembrane models coupling curvature and line tension. Nature. 425, 821–824.
Saitov A., Akimov S.A., Galimzyanov T.R., Glasnov T., Pohl P. 2020. Ordered lipid domains assemble via concerted recruitment of constituents from both membrane leaflets. Phys. Rev. Lett. 124, 108102.
Ландау Л.Д., Лифшиц Е.М., Питаевский Л.П. 2002. Теоретическая физика. Т. Х. Физическая кинетика. М.: Физматлит. 470 с.
Frolov V.A.J., Chizmadzhev Y.A., Cohen F.S., Zimmerberg J. 2006. “Entropic traps” in the kinetics of phase separation in multicomponent membranes stabilize nanodomains. Biophys. J. 91, 189–205.
Ayuyan A.G., Forsyth C.B., Zhang L., Keshavarzian A., Cohen F.S. 2009. Protein movement between membrane domains: The epidermal growth factor receptor (EGFR) signaling cascade. Biophys. J. 96, 676a.
Молотковская И.М., Свирщевская Е.В., Литвинов И.С., Михалев И., Дятловицкая Э.В., Молотковский Ю.Г., Бергельсон Л.Д. 1992. Исследование иммуносупрессорных свойств гликосфинголипидов. Изучение взаимодействия интерлейкина-2 с ганглиозидами на клетках и в модельных системах. Биол. мембраны. 9, 143–151.
Staneva G., Osipenko D.S., Galimzyanov T.R., Pavlov K.V., Akimov S.A. 2016. Metabolic precursor of cholesterol causes formation of chained aggregates of liquid-ordered domains. Langmuir. 32, 1591–1600.
Bao R., Li L., Qiu F., Yang Y. 2011. Atomic force microscopy study of ganglioside GM1 concentration effect on lateral phase separation of sphingomyelin/dioleoylphosphatidylcholine/cholesterol bilayers. J. Phys. Chem. B. 115, 5923–5929.
Dimova R., Dasgupta R., Fricke N., Liu Y., Agudo-Canalejo J., Grafmuller A., Lipowsky R. 2016. Spontaneous tubulation in giant vesicles induced by GM1 or PEG adsorption. Biophys. J. 110, 244a.
Pinigin K.V., Kondrashov O.V., Jiménez-Munguía I., Alexandrova V.V., Batishchev O.V., Galimzyanov T.R., Akimov S.A. 2020. Elastic deformations mediate interaction of the raft boundary with membrane inclusions leading to their effective lateral sorting. Sci. Rep. 10, 4087.
Пинигин К.В., Воловик М.В., Батищев О.В., Акимов С.А. 2020. Взаимодействие границ упорядоченных липидных доменов и амфипатических пептидов регулирует вероятность образования пор в мембранах. Биол. мембраны. 37, 337–349.
Галимзянов Т.Р., Молотковский Р.Ю., Кузьмин П.И., Акимов С.А. 2011. Стабилизация бислойной структуры рафтов за счет упругих деформаций мембраны. Биол. мембраны. 28, 307–314.
Helfrich W. 1973. Elastic properties of lipid bilayers: Theory and possible experiments. Z. Naturforsch. C. 28, 693–703.
Hamm M., Kozlov M.M. 2000. Elastic energy of tilt and bending of fluid membranes. Eur. Phys. J. E. 3, 323–335.
Terzi M.M., Deserno M. 2017. Novel tilt-curvature coupling in lipid membranes. J. Chem. Phys. 147, 084702.
Terzi M.M., Ergüder M.F., Deserno M. 2019. A consistent quadratic curvature-tilt theory for fluid lipid membranes. J. Chem. Phys. 151, 164108.
Pinigin K.V., Kuzmin P.I., Akimov S.A., Galimzya-nov T.R. 2020. Additional contributions to elastic energy of lipid membranes: Tilt-curvature coupling and curvature gradient. Phys. Rev. E 102, 042406.
Evans E., Rawicz W. 1990. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys. Rev. Lett. 64, 2094.
Pan J., Tristram-Nagle S., Nagle J.F. 2009. Effect of cholesterol on structural and mechanical properties of membranes depends on lipid chain saturation. Phys. Rev. E 80, 021931.
Baumgart T., Das S., Webb W.W., Jenkins J.T. 2005. Membrane elasticity in giant vesicles with fluid phase coexistence. Biophys. J. 89, 1067–1080.
Rawicz W., Olbrich K.C., McIntosh T., Needham D., Evans E.A. 2000. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophys. J. 79, 328–339.
Risselada H.J., Marrink S.J. 2008. The molecular face of lipid rafts in model membranes. Proc. Natl. Acad. Sci. USA. 105, 17367–17372.
Perlmutter J.D., Sachs J.N. 2011. Interleaflet interaction and asymmetry in phase separated lipid bilayers: Molecular dynamics simulations. J. Am. Chem. Soc. 133, 6563–6577.
Braganza L.F., Worcester D.L. 1986. Structural changes in lipid bilayers and biological membranes caused by hydrostatic pressure. Biochemistry. 25, 7484–7488.
Scarlata S.F. 1991. Compression of lipid membranes as observed at varying membrane positions. Biophys. J. 60, 334–340.
Terzi M.M., Deserno M., Nagle J.F. 2019. Mechanical properties of lipid bilayers: A note on the Poisson ratio. Soft Matter. 15, 9085–9092.
Kondrashov O.V., Galimzyanov T.R., Jiménez-Munguía I., Batishchev O.V., Akimov S.A. 2019. Membrane-mediated interaction of amphipathic peptides can be described by a one-dimensional approach. Phys. Rev. E 99, 022401.
Galimzyanov T.R., Molotkovsky R.J., Kheyfets B.B., Akimov S.A. 2013. Energy of the interaction between membrane lipid domains calculated from splay and tilt deformations. JETP Lett. 96, 681–686.
Ingólfsson H.I., Melo M.N., van Eerden F.J., Arnarez C., Lopez C.A., Wassenaar T.A., Periole X., de Vries A.H., Tieleman D.P., Marrink S.J. 2014. Lipid organization of the plasma membrane. J. Am. Chem. Soc. 136, 14554–14559.
Puff N., Watanabe C., Seigneuret M., Angelova M.I., Staneva G. 2014. Lo/Ld phase coexistence modulation induced by GM1. Biochim. Biophys. Acta. 1838, 2105–2114.
Feigenson G.W. 2009. Phase diagrams and lipid domains in multicomponent lipid bilayer mixtures. Biochim. Biophys. Acta. 1788, 47–52.
Panteleev P.V., Bolosov I.A., Balandin S.V., Ovchinnikova T.V. 2015. Structure and biological functions of β-hairpin antimicrobial peptides. Acta Naturae. 7, 37–47.
Pérez-Peinado C., Dias S.A., Domingues M.M., Benfield A.H., Freire J.M., Rádis-Baptista G., Gaspar D., Castanho M.A.R.B., Craik D.J., Henriques S.T., Veiga A.S., Andreu D. 2018. Mechanisms of bacterial membrane permeabilization by crotalicidin (Ctn) and its fragment Ctn (15–34), antimicrobial peptides from rattlesnake venom. J. Biol. Chem. 293, 1536–1549.
Staneva G., Chachaty C., Wolf C., Quinn P.J. 2010. Comparison of the liquid-ordered bilayer phases containing cholesterol or 7-dehydrocholesterol in modeling Smith-Lemli-Opitz syndrome. J. Lip. Res. 51, 1810–1822.
Smith D.W., Lemli L., Opitz J.M. 1964. A newly recognized syndrome of multiple congenital anomalies. J. Pediatr. 64, 210–217.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


