Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 3, стр. 176-186
Влияние ионной силы на адсорбцию полипептидов на липидных мембранах. Теоретический анализ
Р. Ю. Молотковский a, *, Т. Р. Галимзянов a, b, Ю. А. Ермаков a
a Институт физической химии и электрохимии им. А. Н. Фрумкина РАН
119071 Москва, Россия
b Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Россия
* E-mail: rodion.molotkovskiy@gmail.com
Поступила в редакцию 06.11.2019
После доработки 13.01.2020
Принята к публикации 14.01.2021
Аннотация
Проведен теоретический анализ поверхностного (дзета) потенциала липосом из анионного фосфолипида, кардиолипина, измеренного ранее электрокинетическим методом в присутствии молекул полилизина разной молекулярной массы и фонового электролита, KCl, в концентрации 10, 40 и 100 мМ. Для аппроксимации экспериментальных зависимостей потенциала от количества полилизина в суспензии использована теоретическая модель с параметрами, среди которых наиболее физически значимыми являются толщина полимерного слоя, константа адсорбции и доля занятой полипептидом поверхности липидных мембран в области насыщения. Найденные значения параметров модели показывают влияние длины молекул полипептида на структуру полимерного слоя от однородного до неравномерно распределенного по поверхности. Заметное снижение эффективности адсорбции при увеличении ионной силы среды объяснено конформационными перестройками макромолекул на поверхности и понижением площади, доступной для их адсорбции при насыщении поверхности.
ВВЕДЕНИЕ
В многочисленных биомедицинских приложениях все большую роль играют коллоидные суспензии липосом, покрытых полимерным слоем натуральных и синтетических полиэлектролитов [1, 2]. В составе липосом, имитирующих поверхность клеточных мембран, обычно присутствуют анионные фосфолипиды, которые создают отрицательный заряд поверхности, характерный для липидного матрикса биомембран. По этой причине большое значение для решения биотехнологических задач приобретают положительно заряженные полимеры, поликатионы, и, в частности, линейные полимеры на основе лизина. Синтетические поликатионы и полилизины разной длины и молекулярной массы находят применение при создании комплексных систем доставки генов и лекарственных препаратов, антибактериальных средств и антисептиков разного типа [3–5]. Ключевую роль в этих разработках играют сведения о характере адсорбции поликатионов на поверхности, прежде всего об их электростатических взаимодействиях с заряженной поверхностью клеток и их липидных аналогах [6–8]. Не менее важным фактором является и изменение энтропии системы, сопровождающее конформационную перестройку молекул поликатиона при их связывании с поверхностью [9]. Одним из возможных способов экспериментального изучения таких взаимодействий являются электрокинетические измерения [10–12]. Количественное описание результатов таких измерений осуществляется в рамках теоретических моделей различной сложности, развитие которых можно проследить в течение нескольких десятилетий [11, 13, 14].
Ранее мы сформулировали модель, включающую минимальный набор параметров, достаточных для описания электрокинетических данных с учетом основных экспериментальных фактов. Согласно опубликованным в литературе сведениям, при адсорбции полилизинов может происходить изменение знака заряда липидных мембран [15, 16], причем отрицательно заряженные липиды кластеризуются под молекулами адсорбирующегося полимера [17, 18]. В работах [6, 16] исследована обратимость адсорбции для полимеров с различной степенью полимеризации, которая становится практически необратимой при повышении молекулярной массы полимера [16, 19]. Молекулярно-динамические методы в целом подтверждают эти наблюдения [20, 21] и обнаруживают изменение конформации цепей поликатиона большой длины, экспонированных в раствор [22]. Электростатическое взаимодействие поликатионов с поверхностью, безусловно, должно зависеть от состава окружающей среды и, прежде всего, от ионной силы раствора. В частности, исследования, проведенные методом Монте-Карло, предсказывают понижение адсорбционной способности поликатионов при высокой ионной силе раствора [23]. Очевидно, что все перечисленные факты и их связь с ионным составом водного окружения должны найти отражение в изменении параметров теоретической модели. В данной работе мы демонстрируем эту связь на примере предложенной нами ранее модели, в которой участвуют физически значимые характеристики системы: константа связывания K, толщина слоя адсорбировавшегося полимера h и доля площади β0, занятой полимером в насыщении [24]. Следует отметить, что все параметры модели имеют ясный физический смысл и их значения могут быть верифицированы другими методами, например методом атомно-силовой микроскопии [16].
ОПИСАНИЕ МЕТОДОВ
Нами были использованы экспериментальные данные по адсорбции полилизинов различной длины на липосомах из отрицательно заряженного липида кардиолипина (КЛ), частично опубликованные в [15]. В этой работе электрофоретическую подвижность мультислойных липосом размером около 0.5 мкм при типичном содержании липида в суспензии 1 мг/мл фонового раствора (10, 40 и 100 мМ KCl, pH около 6.5 при температуре 22°С) измеряли методом динамического светорассеяния на оборудовании Zetasizer II (Malvern Inst., Великобритания) с применением коррелятора PhotoCor-SP (США). Дзета-потенциал липосом определялся по результатам измерения электрокинетической подвижности в предположении, что выполняется соотношение Смолуховского. Постановка эксперимента и методов анализа данных приведена в цитированной работе и обзоре [25].
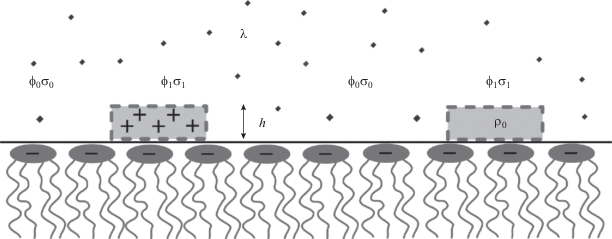
Для аппроксимации электрокинетических данных нами была разработана теоретическая модель, учитывающая особенности адсорбции полиэлектролитов [24]. Не вдаваясь в детали вывода формул, используемых в модели, приведем здесь основные ее положения. Во-первых, мы считаем, что величина дзета-потенциала совпадает с электрическим потенциалом на поверхности мембраны ϕ. Мы считаем, что последний представляет собой сумму двух различных вкладов – потенциала ϕ1 в области над адсорбированным полимером и потенциала ϕ0 в области, свободной от полимера (см. рис. 1).
Рис. 1.
Схематическое изображение рассматриваемой системы полимер–липид в растворе электролита с дебаевской длиной экранирования, равной λ. Потенциал вблизи поверхности над участком мембраны, занятым полимером, обозначается ϕ1, с плотностью заряда σ1. Потенциал над свободным от полимера участком мембраны обозначается ϕ0, с поверхностной плотностью заряда σ0. Заряд адсорбированных молекул полимера полагается равномерно распределенным по толщине слоя h. Объемная плотность заряда обозначается как ρ0.
Величина электрокинетического потенциала везикулы ϕ принимается равной средневзвешенному по площади покрытия поверхности полимером значению потенциалов ϕ1 и ϕ0:
(1)
$\phi \left( c \right) = \beta \left( c \right){{\phi }_{1}} + \left( {1 - \beta \left( c \right)} \right){{\phi }_{0}},$где с – концентрация полилизина, выраженная в молярных единицах одиночных звеньев полимера, а β обозначает долю занятой им площади. Чтобы исследовать свойства адсорбированного полимера, необходимо связать потенциалы ϕ1 и ϕ0 с поверхностной плотностью заряда σi в данной области. Для этого используется модель Гуи–Чепмена:
(2)
${{\phi }_{i}} = 2\frac{{kT}}{e}\operatorname{arsh} \left( {\frac{{{{\sigma }_{i}}}}{{4e{{c}_{0}}\lambda }}} \right),\,\,\,\,i = 0,1,$где e – заряд электрона, c0 – концентрация электролита, σi – плотность заряда на разных участках поверхности. Предполагается, что заряд липида равномерно распределен по области адсорбции на мембране с поверхностной плотностью σ0, а полимер равномерно заряжен с объемной плотностью заряда ρ0 и адсорбируется в виде областей со средней высотой h (рис. 1). В этом случае плотность заряда на поверхности в области с адсорбированным полимером вычисляется по формуле:
Мы учитываем, что в адсорбированном состоянии толщина полимера не может быть ниже определенного порогового значения h0, например, соответствующему размерам мономера лизина. Мы принимаем это значение равным примерно 0.5 нм в соответствии с данными [22]. Для удобства мы нормируем толщину h на значение h0 и оперируем в дальнейшем безразмерной величиной d = h/h0.
При построении изотермы адсорбции мы учитываем, что в обычном эксперименте количество адсорбируемого вещества в растворе фиксировано. Это приводит к понижению концентрации полимера в экспериментальной ячейке на некоторую величину Δc поскольку заметная часть вещества адсорбируется на достаточно большой поверхности липосом (десятки см2 при количестве липида около 1 мг в 1 мл суспензии), величина Δc пропорциональна доле площади мембран β, занятой адсорбированным полимером; параметр G отражает уменьшение концентрации полимера, пропорциональное величине β. Подобное предположение было успешно использовано ранее в работах [25, 26] при анализе адсорбции высокоафинных неорганических многовалентных катионов. Коэффициент G может быть записан в следующем виде [24]:
где Clip – суммарное количество липида, образующего липосомы (в мг/мл раствора); Mcl – молярная масса КЛ.
Мы предполагаем, опираясь на полученные ранее экспериментальные данные, что доля площади β в области насыщения не может быть больше некоторого фиксированного значения β0, которое должно зависеть от доли КЛ в составе мембраны, как это обнаруживается в эксперименте [16]. Однако адсорбция полимерных молекул в общем случае обратима, а степень обратимости можно характеризовать константой связывания K, зависящей от размеров полимерной цепи. Таким образом, кинетическое уравнение адсорбции полипептидов может быть записано в следующем виде:
(5)
$\frac{{d\beta }}{{dt}} = K\left( {c - G\beta } \right)\left( {{{\beta }_{0}} - \beta } \right) - \beta $.В стационарных условиях левая часть формулы (5) равна нулю. Решая уравнение относительно β, можно получить явный вид изотермы адсорбции β(c). В итоге после подстановки всех формул в исходное выражение (1), мы получаем зависимость потенциала ϕ от концентрации c мономеров полилизина в ячейке и от параметров K, d и β0. Аппроксимируя экспериментальные данные полученной функцией ϕ = ϕ(c, K, d, β0) мы находим зависимость этих параметров от исследуемой характеристики системы – ионной силы.
Для вычисления ошибки в процессе аппроксимации экспериментальных данных был использован метод наименьших квадратов. Для оценки доверительного интервала мы используем метод, применявшийся ранее в работе [27]. Предположим, что имеется Nex экспериментальных точек вида (ci, ϕi), i = 1, …, Nex. Функция ошибок E, зависящая от параметров минимизации pj, j = 1, …, M, определяется по формуле:
(6)
$E\left( {{{p}_{1}}, \ldots ,{{p}_{M}}} \right) = \sum\limits_{i = 1}^{{{N}_{{{\text{ex}}}}}} {{{{\left\{ {F\left( {{{c}_{i}}} \right) - {{\phi }_{i}}} \right\}}}^{2}}} .$Функция E минимизируется по параметрам pj, что дает искомые значения параметров модели $p_{j}^{*}$. Доверительный интервал для параметров $p_{j}^{*}$ находится следующим образом: для каждого из параметров pj фиксируются все остальные параметры, отвечающие минимуму функции ошибки, и строится зависимость функции ошибки E($p_{1}^{*}$, …, $p_{{j - 1}}^{*}$, pj, $p_{j}^{*}$, …, pM) от рассматриваемого параметра в окрестности оптимальных значений $p_{j}^{*}$. Доверительным интервалом параметра является интервал, в котором ошибка изменяется не более чем на 5% от своего минимального значения.
РЕЗУЛЬТАТЫ РАСЧЕТОВ
Нами получены экспериментальные данные по адсорбции полилизинов различной молекулярной массы на липосомы, составленные из КЛ при различных значениях ионной силы раствора (рис. 2). Данные приведены для полилизинов, длина которых оценивалась по среднему значению молекулярной массы полилизинов. Эта масса определялась вискозиметрически согласно паспортным данным препаратов, таблица которых приведена ранее при публикации оригинальных экспериментальных данных в [15, 28]. Средняя степень полимеризации препаратов n = 5, 12, 130 и 1435 указана на рисунке. Измерения были проведены при трех значениях ионной силы растворов KCl – I = 10 мМ; I = 40 мМ; I = 100 мМ.
Рис. 2.
Зависимости дзета-потенциала липосом, сформированных из кардиолипина, от концентрации полилизина с различным средним количеством мономеров в полимерной цепи, измеренные при трех значениях ионной силы фонового раствора. Данные были получены и использованы ранее в работе [15].
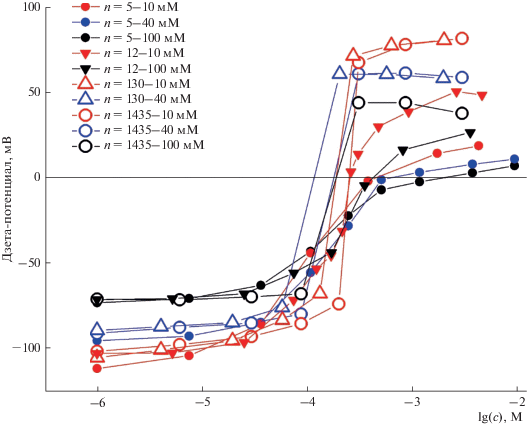
Как видно из рис. 2, экспериментальные точки для лизина со средней степенью полимеризации 1400 и 130 практически совпадают вне зависимости от ионной силы. В силу этого целесообразно объединить полилизины с n ≈ 130 и с n ≈ 1400 в одну группу, условно называемую длинными полимерами. Полилизины с n = 12 и с n = 5 будут называться, соответственно, полимерами средней длины и короткими. Ранее нами было показано, что ключевые характеристики полимеров – d, β0 и K – существенно различаются для полимеров различной длины [24]. Следуя обозначениям, принятым в данной работе, характеристики, относящиеся к длинным полимерам, мы будем обозначать нижним индексом L, к полимерам средней длины – индексом M, к коротким полимерам – индексом S. В данной работе мы исследуем изменение данных параметров при варьировании ионной силы I. В дальнейшем параметры, относящиеся к фиксированным значениям ионной силы, будем обозначать верхним индексом: 10, 40 и 100 для значений I = 10, 40 и 100 мМ соответственно. В перечисленных растворах ионная сила определяет длину экранирования Дебая, равную 3, 1.9 и 1 нм соответственно. Поскольку размеры липосом существенно превышают дебаевскую длину экранирования, мы в дальнейшем не делаем различия между значениями дзета и поверхностного потенциалов, как это оказывается необходимым в рамках модели электрического двойного слоя Гуи–Чепмена–Штерна во многих других случаях [25].
Теоретическая модель, используемая для аппроксимации данных рис. 2, предлагает три варьируемых параметра – безразмерную толщину d, константу связывания K и долю поверхности, занятую полимером в насыщении β0. Каждый из них в общем случае может зависеть как от ионной силы, так и от размера полимерной молекулы. Таким образом, имеется восемь значений для каждого из них: $({{\beta }_{0}})_{L}^{{10}}$, $({{\beta }_{0}})_{L}^{{40}}$, $({{\beta }_{0}})_{L}^{{100}}$, $({{\beta }_{0}})_{M}^{{10}}$, $({{\beta }_{0}})_{M}^{{100}}$, $({{\beta }_{0}})_{S}^{{10}}$, $({{\beta }_{0}})_{S}^{{40}}$, $({{\beta }_{0}})_{S}^{{100}}$ и аналогичный набор для d и K. Введение ряда упрощающих предположений позволяет существенно сократить число параметров. Во-первых, нас интересует изменение при варьировании ионной силы конформационных характеристик полимеров, определяемых значениями d и β0, тогда как константа связывания K в большей степени влияет на кинетику адсорбции и при достижении равновесных условий оказывается менее существенной. Кроме того, имеющиеся в литературе экспериментальные данные указывают на полиномиальный характер зависимости константы связывания от ионной силы [18, 29]. По этим причинам мы считаем возможным в первом приближении пренебречь изменением величины K при вариации ионной силы. Следовательно, количество искомых значений константы связывания сводится к трем параметрам для полимеров разного размера: KL, KM и KS. Далее согласно результатам работы [23] ортогональный компонент радиуса гирации, отражающий среднее удаление молекулы полимера от поверхности, практически не меняется при изменении ионной силы. В это же время латеральный компонент радиуса гирации, описывающий проекционную площадь молекулы, меняется значительно сильнее. Это позволяет предполагать независимость от ионной силы толщины d полимера. Таким образом, мы сокращаем число независимых параметров до трех значений толщины адсорбированного слоя dL, dM и dS.
В итоге мы имеем 14 параметров, используемых для аппроксимации экспериментальных данных: толщины dL, dM и dS; константы связывания KL, KM и KS; доли поверхности, занятые полимером в насыщении $({{\beta }_{0}})_{L}^{{10}}$, $({{\beta }_{0}})_{L}^{{40}}$, $({{\beta }_{0}})_{L}^{{100}}$, $({{\beta }_{0}})_{M}^{{10}}$, $({{\beta }_{0}})_{M}^{{100}}$, $({{\beta }_{0}})_{S}^{{10}}$, $({{\beta }_{0}})_{S}^{{40}}$, $({{\beta }_{0}})_{S}^{{100}}$. Кроме того, количество и условная концентрация липидов, формирующих экспонированную в раствор поверхность липосом, принимается также неизвестным параметром Clip. Эта концентрация может отличаться от полного количества липида в суспензии (1 мг/мл), поскольку некоторая часть липида может участвовать в образовании небислойных структур, либо оставаться недоступной при адсорбции полимера на внешней поверхности мультислойных липосом. В процессе минимизации мы накладываем на параметры аппроксимации определенные ограничения, обусловленные общефизическими соображениями. Так, мы полагаем, что толщина адсорбционного слоя превышает величину h0 вне зависимости от ионной силы I и степени полимеризации n. Это означает, что величина d всегда больше единицы. Учитывая приведенные выше условия, мы провели аппроксимацию экспериментальных данных, представленных на рис. 2. Результаты аппроксимации показаны на рис. 3 для значений поверхностного (дзета) потенциала, измеренного при варьировании концентрации полилизинов малого, среднего и большого размеров.
Рис. 3.
Зависимости потенциала ϕ на мембране от концентрации мономеров лизина в растворе c для случаев длинного (а), среднего (б) и короткого (в) полимеров. Кривые и экспериментальные точки, соответствующие ионной силе 10 мМ, выделены красным, ионной силе 40 мМ – синим, ионной силе 100 мМ – фиолетовым цветом.

Полученные параметры позволяют вычислить условную “емкость” мембран Cp к полимеру данного типа, т.е. предельное отношение числа зарядов полимера к числу зарядов на мембране, когда следующий полимер уже не может адсорбироваться. Этот параметр вычисляется по формуле Cp = β0d. Равновесные значения доли поверхности β0 и произведения β0d в зависимости от длины Дебая λ представлены на рис. 4.
Рис. 4.
Зависимость равновесной доли поверхности β0 (а) и емкости Cp (б) от длины Дебая в фоновом растворе для полимеров с разной длиной цепи. Синим цветом показаны результаты для длинных полимеров; красным – для полимеров средней длины; зеленым – для коротких полимеров.

Данные по константе связывания K и безразмерной толщине d в зависимости от размера полимерной цепи приведены в табл. 1. Равновесное значение параметра Clip равно Clip = 0.16 ± 0.02 мг/мл, что указывает на то, что лишь 16% используемого липида формирует поверхность везикул, экспонированную в основной раствор.
ОБСУЖДЕНИЕ
Большинство моделей, описывающих электрокинетические эксперименты, оперируют усредненными характеристиками, такими как количество адсорбированного вещества или средний поверхностный заряд [11, 30]. В ряде случаев это приводит к искаженным результатам, особенно при изучении адсорбции поликатионов [31] – использование модели Гуи–Чепмена приводит к заниженным изменениям дзета-потенциала при добавлении поликатионов в раствор. Возникает необходимость определить минимальный набор физических параметров, наиболее подходящий для анализа таких систем. Исходя из результатов, полученных нами ранее методом атомно-силовой микроскопии [16], мы предложили вместо количества адсорбированного вещества ввести две независимые характеристики – долю поверхности β0, занятую полимером в насыщении, и толщину полимерного слоя h. Эти параметры позволяют провести более полный анализ электрокинетических экспериментов.
В данной работе нами проведена аппроксимация экспериментальных данных, измеренных при различных значениях ионной силы раствора. Полученные результаты позволяют сделать ряд важных выводов о поведении системы в этих условиях. Во-первых, мы видим существенное различие в поведении пентализина (самый короткий полимер) и полимеров с большей степенью полимеризации (средний и длинный полимеры). Как следует из рис. 4, степень заполнения поверхности полимером, т.е. доля поверхности β0, занятая коротким полимером в насыщении, в 2 раза превосходит аналогичный показатель для среднего и длинного полимеров и мало отличается от 100%. При этом толщина слоя пентализина совпадает с минимальной толщиной h0 равной 0.5 нм и соответствующей полностью расправленной полимерной цепочке. Толщина же слоя для средних и длинных полимеров в несколько раз превосходит h0, что вкупе с малым значением β0 (порядка 0.3–0.4) говорит об отличии конформации крупных полимеров от конформации олигомеров. В то время как пентализин занимает практически всю доступную поверхность однородным слоем, крупные полимеры образуют на поверхности многослойные кластеры. На это указывает сходство поведения пентализина при адсорбции со случаем моно- и двухвалентных ионов, в отличие от крупных полимеров. Наиболее наглядно такое различие демонстрируется при анализе “емкостей” мембраны по различным полимерам, представленным на рис. 4б. Видно, что “емкость” по пентализину мало отличается от единицы, что указывает на его адсорбцию в один слой. В то же время значение “емкости” для среднего и крупного полимера составляет от 2.5 до 3.5 в зависимости от длины полимерной цепи и ионной силы. Этот факт согласуется с экспериментальным наблюдением за перезарядкой поверхности липосом. Полученные нами значения соответствуют экспериментальным данным, опубликованным в работе [32] для поливинилпиридина. Для длинного полимера при ионной силе I = 10 мМ значение емкости составляет около Cp ≈ 2. Таким образом, при количественном анализе адсорбции коротких полимеров, в том числе при варьировании ионной силы раствора, допустимо использовать модель адсорбции малых ионов, основанную на теории электрического двойного слоя Гуи-Чепмена-Штерна [26]. В то же время можно считать доказанным, что в случае длинных полимеров необходимо учитывать образование кластеров полимер–липид с физическими характеристиками, зависящими от длины макромолекулы. Следует отметить различие в константах связывания в описанных случаях, которое указывает на появление признаков необратимой адсорбции полимеров с большой степенью полимеризации n. Эти закономерности находятся в согласии с полученными нами ранее результатами [15, 16, 24].
Проведенный нами количественный анализ указывает на некоторое понижение “емкости” мембраны Cp к среднему и длинному полимерам (рис. 4б) с ростом ионной силы раствора I, обусловленное уменьшением доли поверхности β0, занятой в насыщении (рис. 4а). Это говорит о понижении эффективности адсорбции крупных поликатионов и в целом подтверждается как экспериментальными данными [15], так и результатами молекулярно-динамических расчетов [23]. Наши расчеты показывают, что в случае больших полимеров понижение эффективности адсорбции является следствием не только изменения в окружающем растворе электролита (длины Дебая), но также обусловлено локальными затруднениями при связывании молекул полимера с поверхностью. Такой же вывод был сформулирован в работе [23] в контексте изменения конформации адсорбирующейся молекулы. Авторы с применением методов молекулярной динамики (Монте Карло) показали, что, начиная с некоторого значения ионной силы, электростатические взаимодействия между молекулами полимера и поверхностными зарядами заметно экранируются ионами раствора, в результате чего конформационная перестройка, сопровождающая связывание молекул с поверхностью, становится энергетически невыгодной. Такая закономерность становится более выраженной с увеличением степени полимеризации n, т.е. с увеличением длины полимерной цепи. Полученные нами результаты полностью согласуются с этим выводом.
Резюмируя вышесказанное, мы приходим к двум важным выводам.
1. Конформация и расположение адсорбированных на поверхности мембран крупных полимеров и олигомеров существенно различаются. Так, пентализин занимает практически всю доступную поверхность однородным тонким слоем, а крупные полимеры образуют на поверхности неоднородные локальные структуры. Можно считать доказанным, что в случае длинных полимеров необходимо учитывать образование кластеров полимер–липид с физическими характеристиками, зависящими от длины макромолекулы.
2. Увеличение ионной силы приводит к понижению удельной “емкости” мембраны, особенно ярко выраженному в случае крупных полимеров. Понижение “емкости” отражает необходимость дополнительных энергетических затрат для конформационной перестройки больших полимерных молекул при связывании их с поверхностью мембраны. У коротких полимеров такие перестройки весьма незначительны в силу их малых размеров, и потому вызванные ими эффекты становятся менее заметными.
Следует отметить, что в нашем анализе мы использовали ряд упрощающих предположений и игнорировали некоторые важные свойства системы. Не учтена возможная зависимость константы связывания и толщины адсорбционного слоя от ионной силы. Степень ионизации полимера f (т.е. доля заряженных мономеров в составе полимера) полагалась близкой к единице и не зависящей от состава раствора (ионной силы). Если в растворах с ионной силой в 10 мМ это можно считать доказанным [20], то повышение ионной силы должно приводить к некоторому изменению степени ионизации полимера, определяющего привносимый им заряд на поверхность. Заметим также, что все использованные здесь экспериментальные данные были получены на чистом кардиолипине. Это обстоятельство не позволяет оценить эффект кластеризации заряженного липида в мембранах смешанного состава под адсорбирующимся полимером, описанный в работе [9], а также вероятное изменение конформации адсорбирующихся полимерных молекул при уменьшении доли отрицательно заряженной компоненты в составе мембраны. При анализе экспериментальных данных мы считали, что значения поверхностного и дзета-потенциалов практически совпадают. При высоких ионных силах это условие может не выполняться. Более того, при дальнейшем развитии модели мы планируем оценить возможное смещение плоскости скольжения по мере заполнения поверхности полимерными молекулами и то влияние, которое оно оказывает на величину равновесных параметров при изменении ионной силы.
На интерпретацию экспериментальных данных может также оказывать влияние флокуляция липосом под действием адсорбирующихся поликатионов, т.е. формирование поликомплексов поликатионов и липосом, приводящее к образованию соответствующих агрегатов различной величины и формы. Однако эффект флокуляции может быть заметным только в области малых поверхностных потенциалов, когда заряд поверхности также мал (см., например, обзоры [33, 34]). Это можно наблюдать по зависимости размера частиц от концентрации полимера, описанной в работе [35]. Из приведенных в данной работе результатов можно заключить, что флокуляция, во-первых, обратима, а во-вторых, существенна только вблизи точки нулевого заряда. В наших экспериментах подобные потенциалы в основном наблюдаются только в случае пентализина, добавленного в максимальной концентрации. Поскольку аппроксимация данных проводится совместно по всем наборам данных, мы считаем, что вносимая в результате неучтенного эффекта флокуляции ошибка не должна оказывать существенного влияния на полученные результаты.
Безусловно, основные выводы, сделанные при теоретическом анализе электрокинетических кривых, следует сопоставить не только с данными молекулярно-динамических симуляций липид-пептидных систем, но подтвердить их структурными методами, например, с применением малоуглового рентгеновского рассеяния. Определенный успех в этом отношении оказался возможен в последние годы с применением высокоэффективных источников синхротронного излучения [36]. Существенное развитие и проверку корректности использованного нами теоретического подхода мы ожидаем, в первую очередь, при анализе электрокинетических данных, полученных в суспензии липосом варьируемого состава.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (тема №АААА-А19-119010990119-9), а также проекта РФФИ № 19-04-00242-а.
Список литературы
Meier W. 2000. Polymer nanocapsules. Chem. Soc. Rev. 25, 295–303. https://pubs.rsc.org/en/content/articlehtml/2000/cs/a809106d.
Xu T., Zhang N., Nichols H.L., Shi D., Wen X. 2007. Modification of nanostructured materials for biomedical applications. Mater. Sci. Eng. C. 27, 579–594. https://doi.org/10.1016/j.msec.2006.05.029
Cho Y.W., Kim J.-D., Park K. 2003. Polycation gene delivery systems: Escape from endosomes to cytosol. J. Pharm. Pharmacol. 55, 721–734. https://doi.org/10.1211/002235703765951311
Hong S., Leroueil P.R., Janus E.K., Peters J.L., Kober M.M., Islam M.T., Orr B.G. 2006. Baker J.R., Banaszak Holl M.M. Interaction of polycationic polymers with supported lipid bilayers and cells: Nanoscale hole formation and enhanced membrane permeability. Bioconjug. Chem. 17, 728–734. https://doi.org/10.1021/bc060077y
Illergård J., Römling U., Wågberg L., Ek M. 2012. Biointeractive antibacterial fibres using polyelectrolyte multilayer modification. Cellulose. 19, 1731–1741. https://doi.org/10.1007/s10570-012-9742-0
McGeachy A.C., Dalchand N., Caudill E.R., Li T., Doǧangün M., Olenick L.L., Chang H., Pedersen J.A., Geiger F.M. 2018. Interfacial electrostatics of poly(vinylamine hydrochloride), poly(diallyldimethylammonium chloride), poly-L-lysine, and poly-L-arginine interacting with lipid bilayers. Phys. Chem. Chem. Phys. 20, 10846–10856. https://doi.org/10.1039/c7cp07353d
May S., Harries D., Ben-Shaul A. 2000. Lipid demixing and protein-protein interactions in the adsorption of charged proteins on mixed membranes. Biophys. J. 79, 1747–1760. https://doi.org/10.1016/S0006-3495(00)76427-7
Schwieger C., Blume A. 2007. Interaction of poly(L-lysines) with negatively charged membranes: An FT-IR and DSC study. Eur. Biophys. J. 36, 437–450. https://doi.org/10.1007/s00249-006-0080-8
Mbamala E.C., Ben-Shaul A., May S. 2005. Domain formation induced by the adsorption of charged proteins on mixed lipid membranes. Biophys. J. 88, 1702–1714. https://doi.org/10.1529/biophysj.104.048132
Hurwitz G., Guillen G.R., Hoek E.M.V. 2010. Probing polyamide membrane surface charge, zeta potential, wettability, and hydrophilicity with contact angle measurements. J. Memb. Sci. 349, 349–357. https://doi.org/10.1016/j.memsci.2009.11.063
Freire J.M., Domingues M.M., Matos J., Melo M.N., Veiga A.S., Santos N.C., Castanho M.A.R.B. 2011. Using zeta-potential measurements to quantify peptide partition to lipid membranes. Eur. Biophys. J. 40, 481–487. https://doi.org/10.1007/s00249-010-0661-4
Alvares D.S., dos Santos Cabrera M.P., Ruggiero Neto J. 2016. Strategies for exploring electrostatic and nonelectrostatic contributions to the interaction of helical antimicrobial peptides with model membranes. Adv. Biomembr. Lipid Self-Assembly. 24, 43–73. https://doi.org/10.1016/bs.abl.2016.05.001
Dobrynin A.V., Rubinstein M. 2005. Theory of polyelectrolytes in solutions and at surfaces. Prog. Polym. Sci. 30, 1049–1118. https://doi.org/10.1016/j.progpolymsci.2005.07.006
Ohshima H. 1995. Electrophoresis of soft particles. Adv. Colloid Interface Sci. 62, 189–235. https://doi.org/10.1016/0001-8686(95)00279-Y
Finogenova O.A., Filinsky D.V., Ermakov Yu.A. 2008. Electrostatic effects upon adsorption and desorption of polylysines on the surface of lipid membranes of different composition. Biochem. Suppl. Ser. A Membr. Cell Biol. 2, 181–188. https://doi.org/10.1134/s1990747808020128
Marukovich N., McMurray M., Finogenova O., Nesterenko A., Batishchev O., Ermakov Yu. 2013. Interaction of polylysines with the surface of lipid membranes. Adv. Planar Lipid. 17, 139–166. https://doi.org/10.1016/b978-0-12-411516-3.00006-1
Ярославов А. А., Ефимова А. А., Лобышев В. И., Ермаков Ю. А., Кабанов В. А. 1996. Обратимость изменения структуры липидных мембран, индуцированных адсорбцией поликатиона. Биол. мембраны. 13 (6), 628–633.
Heimburg T., Angerstein B., Marsh D. 1999. Binding of peripheral proteins to mixed lipid membranes: Effect of lipid demixing upon binding. Biophys. J. 76, 2575–2586. https://doi.org/10.1016/S0006-3495(99)77410-2
Marukovich N.I., Nesterenko A.M., Ermakov Yu.A. 2015. Structural factors of lysine and polylysine interaction with lipid membranes. Biochem. (Moscow), Suppl. Ser. A Membr. Cell Biol. 9, 40–47. https://doi.org/10.1134/S1990747814060038
Kostritskii A.Y., Kondinskaia D.A., Nesterenko A.M., Gurtovenko A.A. 2016. Adsorption of synthetic cationic polymers on model phospholipid membranes: Insight from atomic-scale molecular dynamics simulations. Langmuir. 32, 10402–10414. https://doi.org/10.1021/acs.langmuir.6b02593
Khomich D.A., Nesterenko A.M., Kostritskii A.Y., Kondinskaia D.A., Ermakov Yu.A., Gurtovenko A.A. 2017. Independent adsorption of monovalent cations and cationic polymers at PE/PG lipid membranes. J. Phys. Conf. Ser. 794, 012010. https://doi.org/10.1088/1742-6596/794/1/012010
Mcgeachy A.C., Caudill E.R., Liang D., Cui Q., Pe-dersen J.A., Geiger F.M. 2018. Counting charges on membrane-bound peptides. Chem. Sci. 9, 4285–4298. https://doi.org/10.1039/c8sc00804c
Duan X., Zhang R., Li Y., Shi T., An L., Huang Q. 2013. Monte Carlo study of polyelectrolyte adsorption on mixed lipid membrane. J. Phys. Chem. B. 117, 989–1002. https://doi.org/10.1021/jp310017j
Molotkovsky R.J., Galimzyanov T.R., Ermakov Yu.A. 2019. Polypeptides on the surface of lipid membranes. Theoretical analysis of electrokinetic data. Colloid J. 81, 125–135. https://doi.org/10.1134/S1061933X19020108
Ermakov Yu.A. 2000. Ion equilibrium near lipid membranes: Empirical analysis of the simplest model, Colloid J. 62, 389-400.
Ermakov Yu. 1990. The determination of binding site density and assocition constants for monovalent cation adsorption onto liposomes made from mixtures of zwitterionic and charged lipids. Biochim. Biophys. Acta. Biomembr. 1023, 91–97.
Sokolov V.S., Batishchev O.V., Akimov S.A., Galimzyanov T.R., Konstantinova A.N., Malingriaux E., Gorbunova Y.G., Knyazev D.G., Pohl P. 2018. Residence time of singlet oxygen in membranes. Sci. Rep. 8, 1-11. https://doi.org/10.1038/s41598-018-31901-9
Finogenova O.A., Batischev O.V., Indenbom A.V., Zolotarevsky V.I., Ermakov Yu.A. 2009. Molecular distribution and charge of polylysine layers at the surface of lipid membranes and mica. Biochem. (Moscow), Suppl. Ser. A Membr. Cell Biol. 3, 496–503. https://doi.org/10.1134/S1990747809040187
Porcar I., Garcia R., Gómez C., Campos A., Abad C. 1997. Macromolecules in ordered media: 7. Influence of ionic strength and bilayer composition on the association of polyelectrolytes to mixed liposomes. Polymer (Guildf). 38, 5107–5113. https://doi.org/10.1016/S0032-3861(97)00061-X
Shin Y., Roberts J.E., Santore M.M. 2002. The relationship between polymer/substrate charge density and charge overcompensation by adsorbed polyelectrolyte layers. J. Colloid Interface Sci. 247, 220–230. https://doi.org/10.1006/jcis.2001.8100
Murray D., Arbuzova A., Hangyás-Mihályné G., Gambhir A., Ben-Talvvs N., Honig B., McLaughlin S. 1999. Electrostatic properties of membranes containing acidic lipids and adsorbed basic peptides: Theory and experiment. Biophys. J. 77, 3176–3188. https://doi.org/10.1016/S0006-3495(99)77148-1
Ivashkov O.V., Sybachin A.V., Efimova A.A., Pergu-shov D.V., Orlov V.N., Schmalz H., Yaroslavov A.A. 2015. The influence of the chain length of polycations on their complexation with anionic liposomes. ChemPhysChem. 16, 2849–2853. https://doi.org/10.1002/cphc.201500474
Gregory J., Barany S. 2011. Adsorption and flocculation by polymers and polymer mixtures. Adv. Coll. Int. Sci. 169, 1–12. https://doi.org/10.1016/j.cis.2011.06.004
Feng L., Stuart M. C., Adachi Y. 2015. Dynamics of polyelectrolyte adsorption and colloidal flocculation upon mixing studied using mono-dispersed polystyrene latex particles. Adv. Coll. Int. Sci. 226, 101–114. https://doi.org/10.1016/j.cis.2015.09.004
Yaroslavov A.A., Efimova A.A., Lobyshev V.I., Kaba-nov V.A. 2002. Reversibility of structural rearrangements in the negative vesicular membrane upon electrostatic adsorption/desorption of the polycation. Biochim. Biophys. Acta. Biomembr. 1560, 14–24. https://doi.org/10.1016/S0005-2736(01)00453-9
Ermakov Yu.A., Asadchikov V.E., Volkov Y.O., Nuzhdin A.D., Roshchin B.S., Honkimaki V., Ti-khonov A.M. 2019. Electrostatic and structural effects at the adsorption of polylysine on the surface of the DMPS monolayer. JETP Lett. 109, 334–339. https://doi.org/10.1134/S0021364019050060
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


