Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 4, стр. 257-267
Конфигурации границы упорядоченного домена в липидной мембране на твердой подложке
Т. Р. Галимзянов a, С. А. Акимов a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина, РАН
119071 Москва, Россия
* E-mail: akimov_sergey@mail.ru
Поступила в редакцию 03.03.2021
После доработки 18.03.2021
Принята к публикации 19.03.2021
Аннотация
Латеральное распределение белков и липидов в плазматических мембранах клеток млекопитающих неоднородно. Липид-белковые домены, обогащенные сфингомиелином и холестерином, называют рафтами. Размер рафтов клеточных мембран чрезвычайно мал, что существенно затрудняет их экспериментальное исследование. В модельных мембранах, липидный состав которых близок к составу плазматической мембраны, возможно образование упорядоченных доменов в результате фазового разделения, индуцируемого понижением температуры. Эффективным методом исследования модельных рафтов является атомно-силовая микроскопия, позволяющая регистрировать домены, размер которых меньше дифракционного предела видимого света. Однако этот метод предполагает нанесение мембраны на твердую подложку. За счет электростатических, ван-дер-ваальсовых и гидратационных взаимодействий с подложкой ближайший к ней монослой мембраны оказывается в физических условиях, отличных от условий, в которых находится удаленный от подложки монослой. Вследствие асимметрии физических условий изменяется структура и энергия границы рафта. В результате, из двух возможных состояний границы равной энергии в свободной мембране на подложке практически реализуется только одно. Это может приводить к изменению эффективности специфических линейно-активных липидов, накапливающихся на границе доменов и регулирующих их размер за счет понижения энергии границы, аналогично действию поверхностно-активных веществ в трехмерных системах.
ВВЕДЕНИЕ
Внешние оболочки животных клеток представляют собой липидные мембраны с погруженными в них белковыми молекулами. Как липидный, так и белковый состав мембран очень разнообразен – клеточные цитоплазматические мембраны содержат порядка ста видов различных липидов и сотни видов различных белков [1, 2]. Было показано, что латеральное распределение липидов и мембранных белков крайне неоднородно. Липиды и белки могут формировать специфические домены, состав которых существенно отличается от среднего состава мембраны. Одним из видов таких доменов являются так называемые рафты – домены, обогащенные сфингомиелином и холестерином [3], относительно устойчивые к действию неионных детергентов [4, 5]. Большой интерес к исследованию рафтов связан с тем, что содержащиеся в них белки принимают активное участие в таких жизненно важных процессах, как внутриклеточная передача сигналов [6], инфицирование клеток оболочечными вирусами [7], кавеолин-зависимый эндоцитоз [4], дефосфорилирование [8] и т.д. Для нормального функционирования белков требуется специфическое микроокружение, которое обеспечивается в рафтах благодаря специфическому липидному составу и их физико-химическим свойствам. При экстракции из плазматической мембраны холестерина, приводящей к разрушению рафтов [5], протекание некоторых клеточных процессов изменяется [9]. Экспериментальное исследование рафтов in vivo затруднительно из-за сложного состава клеточных мембран и относительно малого размера доменов, который составляет 10–200 нм [10–12]. Однако в модельных чисто липидных мембранах в результате фазового разделения в жидко-неупорядоченной (Ld) мембране могут формироваться жидко-упорядоченные (Lo) домены микронных размеров, которые используются в качестве модели клеточных рафтов и которые могут быть исследованы различными экспериментальными методами [13–16].
Одним из эффективных инструментов исследования мембранных доменов является атомно-силовая микроскопия (АСМ). В отличие от флуоресцентной микроскопии разрешение АСМ не ограничено дифракционным пределом видимого света. В АСМ экспериментах было установлено, что домены в плоскости мембраны, как правило, имеют форму круга, т.е., по-видимому, липид в них находится в жидком состоянии. Толщина Lo-бислоя на 1–2 нм больше толщины окружающей мембраны. Методами флуоресцентной микроскопии было обнаружено, что в модельных мембранах домены практически всегда имеют бислойную структуру, т.е. располагаются в монослоях мембраны один под другим [14, 16–18]. Ранее было показано [19], что одной из возможных причин стабилизации бислойной структуры Lo-доменов могут являться упругие деформации мембраны, возникающие на границе домена для компенсации разности толщин бислоев. Если бы при скачке толщины бислоя на границе домена в 1–2 нм мембрана оставалась бы недеформированной, это привело бы к контакту гидрофобной зоны мембраны с водой или с липидными полярными группами и, как следствие, к большой величине линейного натяжения границы – 20–40 пН. В такой ситуации энергетически выгодно деформировать мембрану на границе таким образом, чтобы полностью сгладить скачок толщины и обеспечить непрерывность поверхности мембраны. При этом с точки зрения минимизации энергии деформаций оказывается выгоден небольшой относительный сдвиг границ монослойных доменов, составляющих бислойный рафт, на величину 2–4 нм. Эти результаты, полученные в теоретических работах [19–21], подтверждаются данными молекулярного моделирования методами молекулярной динамики [22, 23]. Энергетически выгодно формирование бислойных доменов таких, что радиусы составляющих их монослойных соосных доменов в разных монослоях отличаются на 2–4 нм. Для определенности, бислойный Lo-домен будем называть рафтом; таким образом, рафт состоит из двух монослойных Lo-доменов. В экспериментах с гигантскими липосомами, мембранами Мюллера–Рудина и т.д. монослои мембраны одинаковы и находятся в практически идентичных условиях. Поэтому при фазовом разделении площади образующейся Lo-фазы в обоих монослоях должны совпадать. Однако в АСМ мембрана наносится на твердую слюдяную подложку. Липидный монослой, прилегающий к подложке, находится в физических условиях, отличающихся от физических условий, в которых находится противоположный монослой, обращенный в объемную водную фазу. Исследованию некоторых эффектов, возникающих вследствие такой асимметрии граничных условий, посвящена настоящая работа.
ПОСТАНОВКА ЗАДАЧИ
В работе [24] было рассмотрено взаимодействие плоской мембраны с локально сферическим зондом в АСМ экспериментах. Сферичность зонда учитывалась в рамках теории Дерягина [25]. Считалось, что сила взаимодействия включает электростатическое взаимодействие мембраны с отрицательно заряженным зондом и ван-дер-ваальсово притяжение. Известно, что как у слюды, так и у полярных головок липидных молекул имеются гидратные оболочки, состоящие из частично ориентированных молекул воды; эти гидратные оболочки взаимно отталкиваются [26]. По аналогии с расчетом взаимодействия мембраны и зонда можно рассчитать взаимодействие мембраны и плоской подложки. С учетом электростатических взаимодействий, ван-дер-ваальсова притяжения и гидратационного отталкивания, полная сила взаимодействия мембраны с плоской заряженной подложкой, отнесенная к единице площади, может быть записана в виде [24, 26]:
(1)
$f = \frac{{2{{\sigma }_{m}}{{\sigma }_{p}}}}{{{{\varepsilon }_{0}}{{\varepsilon }_{w}}}}{{e}^{{ - \frac{z}{{{{l}_{{\text{D}}}}}}}}} - \frac{{{{H}_{a}}}}{{12\pi {{l}_{{\text{D}}}}{{z}^{2}}}} + {{P}_{0}}{{e}^{{ - \frac{z}{{{{l}_{h}}}}}}},$(2)
$w\left( H \right) = \int\limits_H^\infty {fdz} = \frac{{2{{l}_{{\text{D}}}}{{\sigma }_{m}}{{\sigma }_{p}}}}{{{{\varepsilon }_{0}}{{\varepsilon }_{w}}}}{{e}^{{ - \frac{H}{{{{l}_{{\text{D}}}}}}}}} - \frac{{{{H}_{a}}}}{{12\pi {{l}_{{\text{D}}}}H}} + {{P}_{0}}{{l}_{h}}{{e}^{{ - \frac{H}{{{{l}_{h}}}}}}},$(4)
${{l}_{{\text{D}}}} = \sqrt {\frac{{{{\varepsilon }_{0}}{{\varepsilon }_{w}}{{k}_{{\text{B}}}}T}}{{{{e}^{2}}J}}} ,$Таким образом, вблизи твердой подложки незаряженная или слабо заряженная мембрана оказывается в потенциале, минимум которого расположен на некотором расстоянии H0 от подложки. Это налагает на систему дополнительные граничные условия. В частности, если в мембране сосуществуют макроскопические фазы с разной толщиной бислоя, то эффективный измеряемый методом АСМ перепад толщины на границе фаз должен быть бислойный, а не монослойный, как в случае свободной мембраны, поскольку вдали от границы домена H = H0 для обеих фаз (рис. 1), при условии, что фазы одинаково взаимодействуют с подложкой. Кроме того, новое граничное условие приводит к изменению энергии границы рафта, т.е. ее линейного натяжения, что, в свою очередь, должно влиять на распределение рафтов по размерам [28]. Ниже вычисляется линейное натяжение границы рафта в случае мембраны, находящейся вблизи твердой подложки.
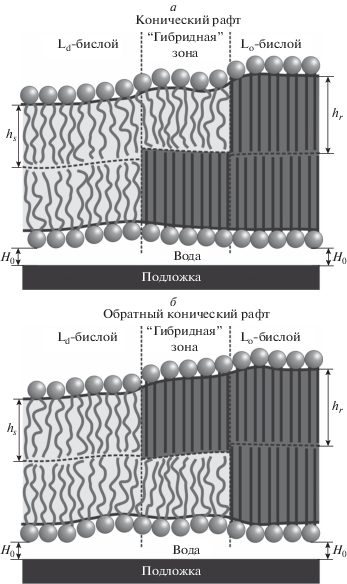
Рис. 1.
Структура границы рафта в мембране, нанесенной на твердую подложку. Упорядоченные домены (толщина монослоя hr) закрашены темно-серым цветом, неупорядоченная мембрана (толщина монослоя hs) – светло-серым цветом; H0 – равновесная толщина слоя воды между нижним монослоем мембраны и подложкой. Между бислойными Lo- и Ld-фазами расположена “гибридная” зона, в которой один монослой упорядоченный, а другой – неупорядоченный. Возможны две конфигурации гибридной зоны в зависимости от состояния ближайшего к подложке монослоя: упорядоченный (а) и неупорядоченный (б). Этим двум конфигурациям гибридной зоны соответствует “конический” рафт (а) и “обратный конический” рафт (б).
РЕШЕНИЕ ЗАДАЧИ
Будем считать, что рафт представляет собой совокупность двух монослойных доменов, расположенных в разных монослоях мембраны; положения границ доменов могут не совпадать. Для простоты рассмотрим случай рафта большого радиуса, такого, что кривизной границ составляющих его доменов локально можно пренебречь и приближенно считать границы прямыми линиями. В этом случае система обладает трансляционной симметрией вдоль границы рафта. Деформации мембраны вблизи границ монослойных доменов будем описывать в рамках теории упругости жидких кристаллов, адаптированной к липидным мембранам [29]. Средняя ориентация липидных молекул характеризуется векторным полем единичных векторов n, называемых директорами. Будем учитывать две основные моды упругих деформаций – поперечный изгиб и наклон. Деформация изгиба характеризуется дивергенцией директора вдоль поверхности монослоя, деформация наклона характеризуется разностью директора и единичной нормали N к поверхности монослоя. Деформации предполагаются малыми, и поверхностная плотность энергии монослоя вычисляется в квадратичном приближении по ним согласно выражению [29]:
(5)
$w = \frac{B}{2}{{\left( {div{\mathbf{n}}} \right)}^{2}} + \frac{{{{K}_{t}}}}{2}{{\left( {{\mathbf{n}} - {\mathbf{N}}} \right)}^{2}},$(6)
${{W}_{u}} = \int {{{w}_{u}}d{{S}_{u}},\,\,\,\,{{W}_{d}} = \int {\left( {{{w}_{d}} + {{w}_{h}}} \right)d{{S}_{d}}} } .$Решения дифференциальных уравнений Эйлера–Лагранжа содержат неопределенные коэффициенты, которые находятся из следующих граничных условий: 1) деформации ограничены и затухают при удалении от границы рафта, 2) директор непрерывен в каждом из монослоев, 3) поверхность каждого монослоя непрерывна. Оставшиеся после подстановки этих граничных условий неопределенные коэффициенты находятся путем минимизации по ним полной энергии системы (7). В силу трансляционной симметрии системы вдоль границы рафта энергию будем относить к единице длины вдоль границы, т.е. вычислять линейное натяжение границы рафта. Более подробно алгоритм вычисления изложен в Приложении.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для получения количественных результатов будем использовать следующие численные значения параметров: модуль изгиба B = 10 kBT (на один монослой) [30], модуль наклона Kt = 40 мН/м (на один монослой) [29], толщина монослоя рафта hr = 1.8 нм, толщина монослоя окружающей мембраны hs = 1.3 нм [22, 23].
На рис. 2а представлена зависимость линейного натяжения от величины относительного сдвига границ монослойных доменов, составляющих бислойный рафт (от ширины гибридной зоны, L), в случае “свободной” мембраны, т.е. мембраны, находящейся вдали от подложки, для которой kh = 0. Из графика видно, что в этом случае минимальной граничной энергии соответствует конфигурация, в которой расстояние между границами монослойных доменов составляет некоторую конечную величину (L ≈ 3 нм на рис. 2а). Подобный равновесный сдвиг границ монослойных доменов, составляющих бислойный рафт, наблюдался в ряде работ методами молекулярной динамики [22, 23]. Этот же результат был получен нами в предшествующих теоретических работах [19–21]. Из зависимости рис. 2а следует, что упругие деформации, возникающие на границе рафта при компенсации гидрофобного несоответствия, стабилизируют его бислойную структуру с точностью до небольшого сдвига границ ∼3 нм. Кроме того, при отражении свободной мембраны относительно плоскости межмонослойной поверхности структура границы рафта и, следовательно, энергия деформаций мембраны остаются неизменными, т.е. конфигурации конического рафта и обратного конического рафта имеют одинаковую энергию. Иными словами, в симметричной по липидному составу монослоев свободной мембране, расположенной далеко от подложки, при условии равенства площадей Lo-фазы в обоих монослоях с точки зрения минимизации граничной энергии выгодно формирование ансамбля рафтов, такого, что у половины рафтов нижний домен имеет радиус на 3 нм больший, чем верхний (конический рафт), а у другой половины – верхний домен имеет радиус на 3 нм больший, чем нижний (обратный конический рафт) (рис. 1). Более точный расчет энергии круглых доменов, подтверждающий этот вывод, проделан в работе [20].
Рис. 2.
Зависимость линейного натяжения границы рафта от ширины гибридной зоны: а – в случае свободной мембраны (kh = 0); б–г – для случая мембраны, нанесенной на твердую подложку. Характерная длина гидратационного отталкивания Lo-монослоя и подложки считалась равной: б – lh = 0.1 нм; в – lh = 0.2 нм; г – lh = 0.3 нм; для Ld-монослоя во всех случаях lh = 0.1 нм. Сплошные кривые – конический рафт, штриховые кривые – обратный конический рафт, в соответствии с рис. 1.
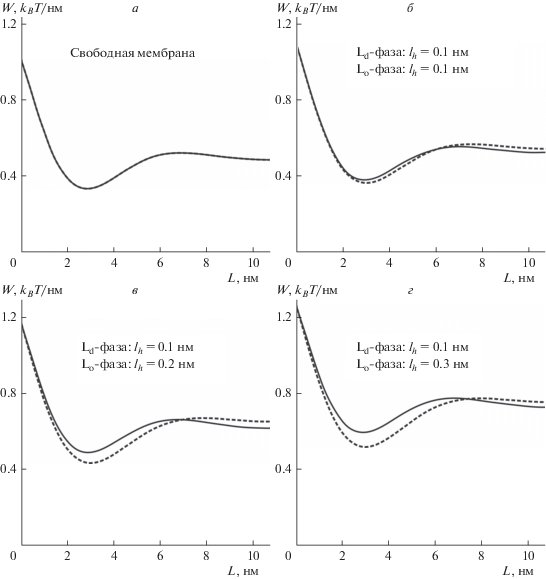
Наличие подложки нарушает симметрию границы рафта. На рис. 2б–2г приведена зависимость граничной энергии бислойного рафта от разности координат границ верхнего и нижнего монослойных доменов при различных значениях длины гидратационного отталкивания lh упорядоченной фазы. Значение lh определяется средней степенью гидратации полярных головок липидов, которая, в свою очередь, определяется их химической структурой и поверхностной плотностью. Различия параметров в Lo- и Ld-фазах обусловлены различной концентрацией сфингомиелина, предположительно ослабляющего гидратационное отталкивание Lo-фазы и слюдяной подложки. Мы рассмотрели три значения длины гидратационного отталкивания Lo-фазы: lh = 0.1 нм (рис. 2б), lh = 0.2 нм (рис. 2в) и lh = 0.3 нм (рис. 2г), зафиксировав при этом lh = 0.1 нм для Ld-фазы окружающей мембраны. При данных значениях длины гидратационного отталкивания получаются следующие величины жесткости потенциала kh и равновесного расстояния H0: lh = 0.1 нм соответствует kh = 1.1 kBT/нм4 и H0 = 0.37 нм; lh = 0.2 нм соответствует kh = 0.07 kBT/нм4 и H0 = 1.2 нм; lh = = 0.3 нм соответствует kh = 0.02 kBT/нм4 и H0 = 2.2 нм. На каждом графике изображены зависимости энергии от ширины гибридной зоны L для конического и обратного конического рафтов (рис. 2). Из приведенных графиков видно, что оптимальная ширина переходной области ∼3 нм слабо зависит от величины lh и конфигурации границы. Также видно, что при взаимодействии с подложкой появляется асимметрия, т.е. при одинаковой ширине переходной области линейное натяжение границы конического рафта будет отличаться от линейного натяжения границы обратного конического рафта. При оптимальной ширине переходной области (L ≈ 3 нм) линейное натяжение границы конического рафта оказывается выше линейного натяжения границы обратного конического рафта (рис. 2б–2г).
Несмотря на небольшое различие в энергии различных типов границ, оно может приводить к существенному дисбалансу количества конических и обратных конических рафтов. Рассмотрим систему при lh = 0.3 нм (рис. 2г). При оптимальной ширине гибридной зоны линейное натяжение границы обратного конического рафта равно 0.52 kBT/нм, конического рафта – 0.59 kBT/нм. Таким образом, разница погонной энергии границы в этих двух конфигурациях составляет 0.07 kBT/нм. Для рафта диаметром 10 нм это соответствует разности энергий E = π × 10 нм × × 0.07 kBT/нм ≈ 2.2 kBT, при диаметре 50 нм – E = = π × 50 нм × 0.07 kBT/нм ≈ 11 kBT. В равновесных условиях долю рафтов определенного типа можно считать пропорциональной больцмановскому фактору ∼exp(–E/kBT). С учетом этого фактора, в случае рафтов диаметром 10 нм доля конических рафтов будет составлять ∼11% от полного числа рафтов. При среднем диаметре рафтов 50 нм доля конических рафтов будет составлять ∼1.7 × 10–3%, т.е. практически все домены будут иметь обратную коническую структуру.
Разница радиусов монослойных доменов в противоположных монослоях должна приводить к разности площадей Lo-фазы в верхнем и нижнем монослоях. Этот дисбаланс, в принципе, может компенсироваться образованием монослойных Lo-доменов в нижнем монослое мембраны, прилегающем к подложке, таким образом, чтобы все рафты имели энергетически выгодную обратную коническую структуру, а избыток Lo-фазы образовывал монослойные Lo-домены в нижнем монослое. Формирование монослойных доменов должно приводить к повышению общей энергии системы за счет увеличения длины совокупной границы Lo- и Ld-фаз. Предположим, что избыток площади Lo-фазы от каждого Lo-домена собирается в n монослойных доменов, где n может быть меньше единицы, что означает конденсацию избытка от 1/n рафтов в один монослойный домен. При таких предположениях эффективное линейное натяжение конического/обратного конического рафта дается выражением:
(8)
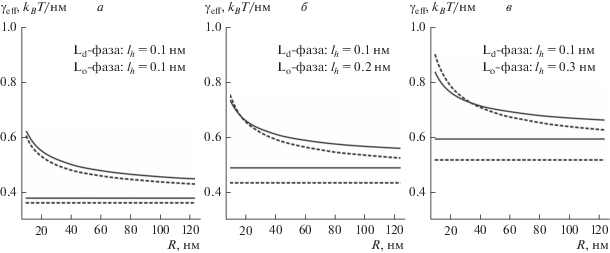
$\gamma _{{{\text{eff}}}}^{{d,u}} = \gamma _{0}^{{d,u}} + \gamma _{{{\text{mono}}}}^{{u,d}}\sqrt {\frac{{2\pi RL}}{{n\pi {{R}^{2}}}}} = \gamma _{0}^{{d,u}} + \gamma _{{{\text{mono}}}}^{{u,d}}\sqrt {\frac{{2L}}{{nR}}} ,$Рис. 3.
Зависимость эффективного линейного натяжения рафтов от их радиуса при n = 1. Длина гидратационного отталкивания для Lo-фазы составляет: а – lh = 0.1 нм; б – lh = 0.2 нм; в – lh = 0.3 нм. Сплошные кривые – конические рафты; штриховые кривые – обратные конические рафты. Горизонтальные прямые соответствуют величине эффективного линейного натяжения равного минимальному линейному натяжению на кривых рис. 2б–2г.
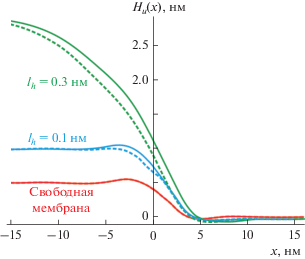
На рис. 4 показаны характерные профили верхней поверхности мембраны вблизи границы рафта для обоих типов границ. Из рисунка видно, что в случае свободной мембраны различие уровней верхних поверхностей Lo- и Ld-фаз мембраны вдали от границы составляет 0.5 нм, что соответствует разности толщин упорядоченного и неупорядоченного монослоев (рис. 4, красные кривые). При одинаковой длине гидратационных взаимодействий Lo- и Ld-фаз lh = 0.1 нм различие уровней составляет 1 нм, что соответствует разности толщин упорядоченного и неупорядоченного бислоев (рис. 4, синие кривые). При различной длине гидратационных взаимодействий Lo- и Ld-фаз разность уровней верхних поверхностей мембраны определяется комбинацией перепада толщины бислоя на границе фаз (1 нм) и разностью равновесных расстояний H0 между подложкой и нижними Lo- и Ld-монослоями (рис. 4, зеленые кривые). Во всех случаях взаимодействия мембраны с подложкой профили верхней поверхности мембраны слабо зависят от типа границы (конический/обратный конический рафты), т.е. практически неразличимы методом атомно-силовой микроскопии. При одинаковой длине гидратационных взаимодействий lh = 0.1 нм для Lo- и Ld-фазы деформации затухают на расстоянии порядка 10 нм от границы (рис. 4, синие кривые). В случае различного взаимодействия с подложкой липидов упорядоченной и неупорядоченной фаз деформации затухают на расстоянии от переходной области порядка 5 нм в сторону неупорядоченной фазы и на расстоянии порядка 15 нм в сторону упорядоченной фазы (рис. 4, зеленые кривые).
Рис. 4.
Форма верхней поверхности мембраны Hu(x) для случаев: свободной мембраны (красные кривые); мембраны на твердой подложке с одинаковой длиной гидратационных взаимодействий lh = 0.1 нм для Lo и Ld фазы (синие кривые); мембраны на твердой подложке с длиной гидратационных взаимодействий lh = = 0.1 нм для Ld фазы и lh = 0.3 нм для Lo фазы (зеленые кривые). Сплошные кривые – конический рафт; штриховые кривые – обратный конический рафт. Ширина гибридной зоны во всех случаях равна 3 нм.
Кроме непосредственного влияния подложки на конфигурацию доменов в мембране, она также должна изменять латеральное распределение линейно-активных липидов, действие которых аналогично действию поверхностно-активных веществ в трехмерных системах. В работе [31] было показано, что ганглиозид GM1 накапливается на границе упорядоченных доменов, существенно изменяя их распределение по размерам. Там же было показано, что преимущественной областью распределения GM1 является упорядоченный монослой в гибридной зоне границы. В случае “обратной конической” конфигурации рафта эта область расположена в верхнем монослое, а в случае “конической” конфигурации – в нижнем монослое, обращенном к подложке. Таким образом, наличие подложки в данном случае ведет к тому, что экзогенно добавляемый ганглиозид GM1 будет распределяться на границу практически всех доменов, поскольку энергетически выгодна конфигурация обратных конических рафтов, и именно в этой конфигурации в промежуточной приграничной области мембраны верхний монослой находится в упорядоченном состоянии (рис. 1б). При отсутствии взаимодействия с подложкой лишь в половине доменов выгодная для распределения ганглиозида зона будет доступна из объемной водной фазы, и экзогенно добавленный компонент будет преимущественно распределяться на границу только половины общего числа рафтов.
Список литературы
Ingólfsson H.I., Melo M.N., Van Eerden F.J., Arnarez C., Lopez C.A., Wassenaar T.A., Periole X., de Vries A.H., Tieleman D.P., Marrink S.J. 2014. Lipid organization of the plasma membrane. J. Am. Chem Soc. 136, 14 554–14 559.
Ingólfsson H.I., Carpenter T.S., Bhatia H., Bremer P.T., Marrink S.J., Lightstone F.C. 2017. Computational lipidomics of the neuronal plasma membrane. Biophys. J. 113, 2271–2280.
Pike L.J. 2006. Rafts defined: A report on the Keystone Symposium on lipid rafts and cell function. J. Lip. Res. 47, 1597–1598.
Simons K., Ikonen, E. 1997. Functional rafts in cell membranes. Nature. 387, 569–572.
Edidin M. 2001. Shrinking patches and slippery rafts: Scales of domains in the plasma membrane. Trends Cell Biol. 11, 492–496.
Bocharov E.V., Mineev K.S., Pavlov K.V., Akimov S.A., Kuznetsov A.S., Efremov R.G., Arseniev A.S. 2017. Helix-helix interactions in membrane domains of bitopic proteins: Specificity and role of lipid environment. Biochim. Biophys. Acta 1859, 561–576.
Ripa I., Andreu S., López-Guerrero J.A., Bello-Morales R. 2021. Membrane rafts: Portals for viral entry. Frontiers Microbiol. 12, 120.
Ayuyan A.G., Cohen F.S. 2008. Raft composition at physiological temperature and pH in the absence of detergents. Biophys. J. 94, 2654–2666.
Дунина-Барковская А.Я., Вишнякова Х.С., Баратова Л.А., Радюхин В.А. 2019. Модуляция холестерин-зависимой активности макрофагов IC-21 пептидом, содержащим два CRAC-мотива из белка M1 вируса гриппа. Биол. мембраны. 36, 271–280.
Lillemeier B.F., Pfeiffer J.R., Surviladze Z., Wilson B.S., Davis M.M. 2006. Plasma membrane-associated proteins are clustered into islands attached to the cytoskeleton. Proc. Natl. Acad. Sci. USA. 103, 18 992–18 997.
Pralle A., Keller P., Florin E.L., Simons K., Hörber J.H. 2000. Sphingolipid–cholesterol rafts diffuse as small entities in the plasma membrane of mammalian cells. J. Cell Biol. 148, 997–1008.
Frisz J.F., Klitzing H.A., Lou K., Hutcheon I.D., Weber P.K., Zimmerberg J., Kraft M.L. 2013. Sphingolipid domains in the plasma membranes of fibroblasts are not enriched with cholesterol. J. Biol. Chem. 288, 16855–16861.
Samsonov A.V., Mihalyov I., Cohen F.S. 2001. Characterization of cholesterol-sphingomyelin domains and their dynamics in bilayer membranes. Biophys. J. 81, 1486–1500.
Veatch S.L., Polozov I.V., Gawrisch K., Keller S.L. 2004. Liquid domains in vesicles investigated by NMR and fluorescence microscopy. Biophys. J. 86, 2910–2922.
Staneva G., Osipenko D.S., Galimzyanov T.R., Pavlov K.V., Akimov S.A. 2016. Metabolic precursor of cholesterol causes formation of chained aggregates of liquid-ordered domains. Langmuir. 32, 1591–1600.
Baumgart T., Hess S.T., Webb W.W. 2003. Imaging coexisting fluid domains in biomembrane models coupling curvature and line tension. Nature. 425, 821–824.
Saitov A., Akimov S.A., Galimzyanov T.R., Glasnov T., Pohl P. 2020. Ordered lipid domains assemble via concerted recruitment of constituents from both membrane leaflets. Phys. Rev. Lett. 124, 108102.
Vinklárek I.S., Vel’as L., Riegerová P., Skála K., Mikhalyov I., Gretskaya N., Hof M., Šachl R. 2019. Experimental evidence of the existence of interleaflet coupled nanodomains: An MC-FRET study. J. Phys. Chem. Lett. 10, 2024–2030.
Галимзянов Т.Р., Молотковский Р.Ю., Кузьмин П.И., Акимов С.А. 2011. Стабилизация бислойной структуры рафтов за счет упругих деформаций мембраны. Биол. мембраны. 28, 307–314.
Galimzyanov T.R., Molotkovsky R.J., Bozdaganyan M.E., Cohen F.S., Pohl P., Akimov S.A. 2015. Elastic membrane deformations govern interleaflet coupling of lipid-ordered domains. Phys. Rev. Lett. 115, 088101.
Galimzyanov T.R., Molotkovsky R.J., Cohen F.S., Pohl P., Akimov S.A. 2016. Comment on “Elastic membrane deformations govern interleaflet coupling of lipid-ordered domains” Reply. Phys. Rev. Lett. 116, 079802.
Risselada H.J., Marrink S.J. 2008. The molecular face of lipid rafts in model membranes. Proc. Natl. Acad. Sci. USA. 105, 17 367–17 372.
Perlmutter J.D., Sachs J.N. 2011. Interleaflet interaction and asymmetry in phase separated lipid bilayers: Molecular dynamics simulations. J. Am. Chem. Soc. 133, 6563–6577.
Müller D.J., Fotiadis D., Scheuring S., Müller S.A., Engel A. 1999. Electrostatically balanced subnanometer imaging of biological specimens by atomic force microscope. Biophys. J. 76, 1101–1111.
Israelachvili J. 2011. Intermolecular and Surface Forces. London: Acad. Press.
LeNeveu D.M., Rand R.P., Parsegian V.A. 1976. Measurement of forces between lecithin bilayers. Nature. 259, 601–603.
Lipowsky R., Sackmann E. 1995. Handbook of biological physics. Chapter 11. Generic interactions of flexible membranes. Amsterdam: Elsevier Science, p. 521–602.
Акимов С.А., Фролов В.А., Кузьмин П.И. 2005. Линейное натяжение и функция распределения нанорафтов по размерам в бислойных липидных мембранах. Биол. мембраны. 22, 413–426.
Hamm M., Kozlov M.M. 2000. Elastic energy of tilt and bending of fluid membranes. Eur. Phys. J. E. 3, 323–335.
Rawicz W., Olbrich K.C., McIntosh T., Needham D., Evans E. 2000. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophys. J. 79, 328–339.
Galimzyanov T.R., Lyushnyak A.S., Aleksandrova V.V., Shilova L.A., Mikhalyov I.I., Molotkovskaya I.M., Akimov S.A., Batishchev O.V. 2017. Line activity of ganglioside GM1 regulates raft size distribution in a cholesterol-dependent manner. Langmuir. 33, 3517–3524.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


