Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 5, стр. 393-398
Оценка селективности взаимодействия фосфолипазы А2 с мембранами из POPC/POPG с помощью построения карт взаимодействия
А. С. Алексеева a, П. Е. Волынский a, И. А. Болдырев a, *
a Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
* E-mail: ivan@lipids.ibch.ru
Поступила в редакцию 23.04.2021
После доработки 12.05.2021
Принята к публикации 13.05.2021
Аннотация
Регулирование активности и селективности фосфолипазы А2 (ФЛА2), способной отщеплять жирную кислоту из второго положения (sn-2) фосфолипида, осуществляется через мембраносвязывающий и каталитический сайты фермента. Для осуществления гидролитической активности ФЛА2 сначала должна связаться с фосфолипидной мембраной, при этом эффективность связывания зависит от состава мембраны. Мембраносвязывающий участок ФЛА2 сформирован несколькими десятками аминокислот, и его состав различается от фермента к ферменту, ключевую роль во взаимодействии играют гидрофобные и положительно заряженные аминокислоты. В данной работе мы исследовали взаимодействие ФЛА2 из яда пчелы с фосфолипидными бислоями из пальмитоил-олеоилфосфатидилхолина (POPC), содержащими различное количество пальмитоилолеоилфосфатидилглицерина (POPG). На основании измерения собственной флуоресценции белка и анизотропии флуоресценции липидного зонда мы предлагаем построение карт взаимодействия липид–белок, которые отражают как эффективность связывания белка, так и изменения строения мембраны. В последних учитывается изменение анизотропии флуоресценции метки, которая в свою очередь является мерой подвижности липидного окружения флуоресцентного зонда. Анализ карт взаимодействия показал, что есть связь между подвижностью липидов и эффективностью связывания фермента – оптимум взаимодействия ФЛА2 с мембранами из смеси POPC/POPG лежит в области наибольшей подвижности липидов, а не в области наибольшего отрицательного заряда. Такая зависимость дополняет существующие представления о процессе распознавания ферментом поверхности мембраны и селекции липидов уже связанным с мембраной ферментом. Предлагаемый метод построения карт может быть распространен на другие мембраноактивные белки.
ВВЕДЕНИЕ
Секреторная фосфолипаза А2 (сФЛА2) – интерфейсный белок, способный гидролизовать липиды на поверхности биологической мембраны и селективно отщеплять жирную кислоту из второго положения (sn-2) фосфолипида. Участок белка контактирующий с поверхностью мембраны принято называть мембраносвязывающим сайтом (в англоязычной литературе – interfacial binding site, IBS). Он отвечает за удержание фермента на поверхности мембраны. Каталитический сайт сФЛА2 отвечает непосредственно за гидролиз отдельной молекулы субстрата. Строение каталитического сайта высококонсервативно и для разных представителей сФЛА2 уже достаточно хорошо изучено (ключевую роль играют остатки His и Asp в каталитическом кармане) [1]. Мембраносвязывающий сайт формируется несколькими десятками аминокислот, и его строение варьируется от фермента к ферменту [2]. Для представительного набора сФЛА2 человека и мыши (всего 16 различных сФЛА2) [3] было показано, что гидролиз однокомпонентных липосом из фосфатидилхолина, фосфатидилсерина или фосфатидилглицерина проходит с разной эффективностью. В случае липосом из фосфатидилхолина развитие реакции (появление продукта) сопровождалось лаг-фазой для некоторых сФЛА2, в то время как отрицательно заряженные липиды гидролизовались без задержки всеми сФЛА2. В целом, скорость гидролиза липосом из фосфатидилглицерина была самой высокой. В то же время для многокомпонентных липосом из смеси фосфатидной кислоты, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилметанола, фосатидилсерина и фосфатидилинозита в эквимолярном соотношении, лизофосфатидилхолин обнаруживался в большем количестве, чем другие лизолипиды, т.е. из смеси липидов предпочтительнее гидролизуется именно фосфатидилхолин [3].
Таким образом, активность и селективность сФЛА2 определяется совместной работой сайта IBS и каталитического сайта. Для детектирования конечной гидролитической активности сФЛА2 разработан широкий набор методик [4, 5], но для более детального изучения функционирования интерфейсных белков применяется сложный комплекс экспериментальных подходов [6]. Невыясненным остается момент распознавания ферментом поверхности мембраны и процесс селекции липидов уже связанным с мембраной ферментом.
Для изучения селективности сФЛА2 предпринимаются исследования механизма взаимодействия фермента с мембраной. Так, с помощью молекулярной динамики было исследовало взаимодействие с мембранами различного состава синовиальной сФЛА2 человека [7] и показано, что около половины аминокислот фермента контактируют с поверхностью мембраны, обеспечивая частичное погружение белка в мембрану. С помощью молекулярной динамики, с привлечением масс-спектрометрии показано, что липидная мембрана работает как аллостерический активатор для сФЛА2 [8], т.е. связывание с мембраной приводит к конформационным изменениям и активирует фермент [9]. С помощью комбинации методов конфокальной микроскопии и ИК-спектрометрии было показано, что в связывании сФЛА2 с поверхностью мембраны может участвовать кальций [10], который ориентирует молекулы белка на поверхности мембраны и активирует фермент. Также с помощью флуоресцентной микроскопии и атомно-силовой микроскопии было показано, как по мере изменений в структуре мембраны, вызванных действием сФЛА2, количество адсорбированного белка увеличивается, т.е. формируются новые липидные сайты связывания сФЛА2 [11]. Изучалась и реакция липидного бислоя на связывание фермента. Так, гетеродимерная ФЛА2 из яда гадюки Никольского вызывает агрегацию липидного бислоя и образование мультислойных липидных частиц [12]. ФЛА2 из яда пчелы, встраиваясь в мембрану, образует углубление на ее поверхности, что приводит к появлению гидрофобного несоответствия между областями бислоя в зоне контакта и за ее пределами, следствием чего становится вытеснение головок фосфолипидов из области контакта с белком (образуется гидрофобное пятно) и утоньшение бислоя [13].
В данной работе мы анализируем сродство сФЛА2 из яда пчелы к фосфолипидным бислоям, состоящим из нейтрального POPC и отрицательно зараженного POPG в различных соотношениях, с помощью флуоресцентной спектроскопии. Сочетание измерений собственной флуоресценции белка и анизотропии флуоресценции липидного зонда, а также анализ данных с помощью построения карт взаимодействия позволяет получить новую информацию о взаимодействии фермента с мембраной.
МАТЕРИАЛЫ И МЕТОДЫ
Для получения липосом использовали пальмитоилолеоилфосфатидилхолин (POPC) и пальмитоилолеоилфосфатидилглицерин (POPG) (Avanti Polar Lipids, США); 1,3,5,7-тетраметил-BODIPY-меченый фосфатидилхолин (TMB-PC) был синтезирован ранее [14]. Фосфолипазу А2 из яда пчелы Apis mellifera (bvPLA2), 1.0 мМ, производства Sigma-Aldrich, растворяли в буфере 0.1 M Трис-HCl, 0.1 M NaCl (pH 8.5), концентрация фермента контролировалась по оптической плотности при 280 нм с помощью спектрофотометра Nano Drop OneC (Thermo Fisher).
Липосомы были получены методом гидратации липидной пленки и экструзии. Аликвоты фосфолипидов и флуоресцентный зонд упаривали из смеси хлороформ–метанол (2 : 1) и сушили при 7 Па не менее 40 мин. Липидную пленку гидратировали в течение 2 ч при комнатной температуре в 0.1 М Трис-HCl буфере, содержащем 0.1 М NaCl, рН 8.5, и проводили 6–10 циклов замораживания/оттаивания (жидкий азот/+40°C). Затем суспензию 10 раз пропускали через два поликарбонатных мембранных фильтра с размером пор 100 нм (Nucleopore, США) на мини-экструдере Avanti. Такой способ приготовления липосом позволяет получать преимущественно моноламеллярные липосомы с узким распределением по размерам [15, 16]. Были получены липосомы на основе POPC, содержащие 0, 10, 15, 20, 25, 30 мол. % POPG с добавлением 0.025 мол. % TMB-PC. При соотношении молекул зонда к липидам 1/4000 не наблюдается переноса энергии между соседними флуорофорами TMB, и анизотропия флуоресценции зависит только от подвижности флуорофора (см. также [17, 18]).
Спектры флуоресценции белка, а также анизотропию флуоресценции TMB-PC регистрировали на спектрометре F-4000 (Hitachi, Япония) при λex = 280 нм, λem = 340 нм и λex = 480 нм, λem = 510 нм, соответственно. Измерения проводили в кварцевой кювете 0.5 × 0.5 см, при постоянном перемешивании и термостатировании (25°С).
Анизотропию флуоресценции рассчитывали по формуле:
Для построения изотерм связывания регистрировали спектры флуоресценции bvPLA2 (1.2 мкМ) при изменяющейся концентрации липидов в системе. Ферментативная активность bvPLA2 была заблокирована добавлением 5 мМ EDTA (за счет удаления из системы необходимого кофактора, Са2+). Аликвоты липосом добавляли при постоянном перемешивании (конечные концентрации липидов 20, 38, 78, 150, 280, 460 и 800 мкМ) и термостатировании (25°С). Фоновый сигнал рассеяния липосом вычитали из спектров испускания белка.
Построение карты взаимодействия bvPLA2 с мембранами из POPC/POPG проводили с помощью программы Scilab. Сначала строили трехмерный график, где X – соотношение белок/липид, Y – соотношение липидов в смеси (липидный состав мембраны), Z – значение (F0 – F)/F0, где F0 – интенсивность флуоресценции белка до добавления липидов в систему, F – интенсивность флуоресценции белка после добавления липидов. Затем трехмерный график преобразовывали в набор изолиний (кривых на плоскости при Z = const, задаваемых пересечением этих плоскостей с трехмерной экспериментальной фигурой). Карта изменений мембраны была получена аналогичным образом, но для значений по оси Z использовали значение анизотропии флуоресценции мембранного зонда, R.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Связывание сФЛА2 на поверхности мембраны
Связывание bvPLA2 с мембранами липосом характеризовалось по собственной флуоресценции фермента при заблокированной ферментативной активности (за счет удаления из системы необходимого кофактора, Са2+, с помощью EDTA). сФЛА2 из яда пчелы имеет в своем составе два остатка триптофана, которые при изменении полярности окружения (связывании с мембраной) меняют квантовый выход. При титровании раствора белка эмульсией липосом меняется интенсивность собственной флуоресценции белка (рис. 1а), эти изменения можно представить в относительном виде:
Рис. 1.
Оценка специфичности взаимодействия сФЛА2 с фосфолипидными мембранами из POPC/POPG с помощью построения карт взаимодействия. a – Пример изменения собственной флуоресценции белка при титровании эмульсией липосом (1.2 мкM bvPLA2, λex = 280 нм, λem = 290–450 нм); стрелкой показано направление изменений при увеличении концентрации липосом в системе. б – Изотерма связывания сФЛА2 (λex = 280 нм, λem = 340 нм, сплошная линия) и анизотропия флуоресценции мембранного зонда TMB-PC (λex = 480 нм, λem = 510 нм, пунктирная линия). Подобные кривые были получены для разных составов липосом, для примера приведена изотерма связывания липосом из POPC. в – Карта связывания белка. г – Карта изменения мембраны. Цветом отмечены экстремумы значенй.
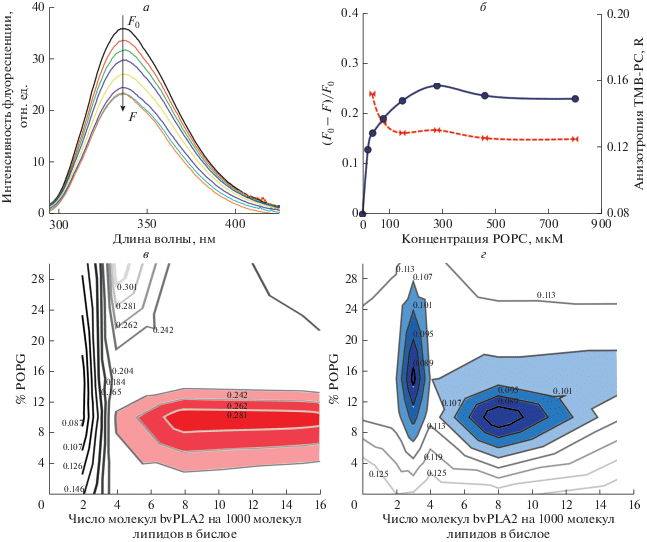
Кривые изменения (F0 – F)/F0 в зависимости от концентрации липидов можно использовать как изотермы связывания для определения сродства сФЛА2 к определенному липидному составу мембраны (рис. 1б). В настоящей работе набор изотерм связывания bvPLA2 для серии липидных смесей из POPC/POPG преобразован в карту (рис. 1в), где ордината – соотношение белок/липид, а абсцисса – соотношение липидов в смеси (состав мембраны). Значение (F0 – F)/F0 показано на карте в виде изолиний.
Регистрация изменений в мембране
Наблюдение за изменением состояния мембраны проводится с помощью флуоресцентных липидных зондов (по анизотропии флуоресценции). В данном случае используется TMB-PC (BODIPY-меченый фосфатидилхолин) [18], однако можно использовать и другие мембранные зонды. Например, для лаурдана и продана, возможно, удобнее будет регистрировать изменение спектра испускания [19]. Анизотропия флуоресценции представляет собой меру подвижности флуорофора: чем ниже анизотропия флуоресценции, тем подвижнее оказывается зонд (увеличивается вращательная и поступательная диффузия зонда). В мембранах анизотропия флуоресценции метки зависит от плотности упаковки липидов и их подвижности. Максимальное значение анизотропии TMB (в растворе пропиленгликоля при –70°С) – 0.39, что соответствует полностью заторможенному зонду [18]. Масштаб изменений анизотропии флуоресценции TMB-PC в липидной мембране от 0.18 (гелевая фаза) до 0.10 (жидкокристаллическая фаза) [18]. Таким образом, измерения значений анизотропии на сотые доли отражает значительные изменения в подвижности липидов мембраны.
На карте изменений мембраны ордината – соотношение белок/липид, абсцисса – содержание липидов в смеси, а значения анизотропии флуоресценции показаны на карте в виде изолиний (рис. 1г). На карте изменений мембраны (рис. 1г) наблюдалось два минимума анизотропии: при 10 и 15% POPG для соотношений белок/липид 8 и 3 соответственно (отмечено цветом). Минимальное значение анизотропии флуоресценции соответствует максимальной подвижности флуоресцентной метки, которая определяется плотностью упаковки липидов вокруг метки в мембране.
Совпадение рельефа карт связывания белка и изменений мембраны
На карте связывания белка (рис. 1в) наблюдался максимум связывания, который представляет собой хребет начинающийся в точке (x; y = 8.5; 10, участок отмечен цветом). В этой точке достигается насыщение мембраны белком. Дальнейшее увеличение соотношения белок/липиды не меняет значение (F0 – F)/F0.
Важно, что начало хребта на карте связывания белка (рис. 1в) и минимум на карте изменений мембраны (рис. 1г) совпадают: максимальное связывание белка соответствует максимальной подвижности липидов (минимуму анизотропии). В данном случае такое условие выполняется для липосом, содержащих 10% POPG. Такое совпадение имеет рациональное объяснение: для осуществления гидролиза сФЛА2 необходимо встроиться в мембрану, для этого белок раздвигает в стороны полярные головки липидов [13]. Соответственно, если диффузия липидов ограничена, это сделать сложнее, чем если липиды диффундируют свободно. Иными словами, скорость диффузии липидов влияет на константу связывания белка с мембраной,и таким образом меняет стационарное распределение “белок в растворе–белок на поверхности мембраны”, которое в свою очередь определяет значение (F0 – F)/F0. Рассматриваемый пример показывает, что не только в разных фазах, но и в рамках одной фазы подвижность липидов может влиять на фермента, что в конечном счете может определять скорость гидролиза липидов.
Обнаруженная нами связь между подвижностью липидов и эффективностью связывания фермента может быть ключом для понимания субстратной специфичности сФЛА2 в отношении мембран разного состава.
ЗАКЛЮЧЕНИЕ
В данной работе мы предложили новый метод исследования связывания сФЛА2 с липидным бислоем. Метод состоит в построении карты связывания белка и карты изменения мембраны. Карта связывания белка основана на данных изотерм связывания белка на липидных мембранах различного состава. Карта изменения мембраны основана на отслеживании изменения анизотропии флуоресценции липидного зонда при сорбции белка на мембрану для различных соотношений липид–белок. Сопоставление карт позволило обнаружить связь между подвижностью липидов и эффективностью связывания фермента. Это может быть ключом для понимания субстратной специфичности сФЛА2 в отношении мембран разного состава.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Исследование выполнено при финансовой поддержке Российского научного фонда, грант № 19-75-00101.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Dennis E.A., Cao J.,Hsu Y.-H., Magrioti V., Kokotos G. 2011. Phospholipase A2 enzymes: physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention., Chem. Rev. 111, 6130–6185. https://doi.org/10.1021/cr200085w
Winget J.M., Pan Y.H., Bahnson B.J. 2006. The interfacial binding surface of phospholipase A2s. Biochim. Biophys. Acta. 1761, 1260–1269. https://doi.org/10.1016/j.bbalip.2006.08.002
Singer A.G., Ghomashchi F., Calvez Le C., Bollinger J., Bezzine S.,Rouault M., Sadilek M., Nguyen E., Lazdunski M., Lambeau G., Gelb M.H. 2002. Interfacial kinetic and binding properties of the complete set of human and mouse groups I, II, V, X, and XII secreted phospholipases A2. J. Biol. Chem. 277, 48 535–48 549. https://doi.org/10.1074/jbc.M205855200
Алексеева А.С., Болдырев И.А. 2020. Фосфолипаза А2. Методы мониторинга активности. Биол. Мембраны. 37, 323–336. https://doi.org/10.31857/S0233475520050035
Alekseeva A.S., Korotaeva A.A., Samoilova E.V., Volynsky P.E., Vodovozova E.L., Boldyrev I.A. 2014. Secretory phospholipase A2 activity in blood serum: The challenge to sense. Biochem. Biophys. Res. Commun. 454, 178–182. https://doi.org/10.1016/j.bbrc.2014.10.069
Roberts M.F., Khan H.M., Goldstein R., Reuter N., Gershenson A. 2018. Search and subvert: Minimalist bacterial phosphatidylinositol-specific phospholipase C enzymes. Chem. Rev. 118, 8435–8473. https://doi.org/10.1021/acs.chemrev.8b00208
Qin S.S., Yu Y.X., Li Q.K., Yu Z.W. 2013. Interaction of human synovial phospholipase A2 with mixed lipid bilayers: A coarse-grain and all-atom molecular dynamics simulation study. Biochemistry. 52, 1477–1489. https://doi.org/10.1021/bi3012687
Mouchlis V.D., Bucher D., McCammon J.A., Dennis E.A. 2015. Membranes serve as allosteric activators of phospholipase A 2, enabling it to extract, bind, and hydrolyze phospholipid substrates. Proc. Natl. Acad. Sci. USA. 112, E516–E525. https://doi.org/10.1073/pnas.1424651112
Mouchlis V.D., Chen Y., McCammon A.J., Dennis E.A. 2018. Membrane allostery and unique hydrophobic sites promote enzyme substrate specificity. J. Am. Chem. Soc. 140, 3285–3291. https://doi.org/10.1021/jacs.7b12045
Kai S., Li X., Li B., Han B., Lu X. 2017. Calcium-dependent hydrolysis of supported planar lipids was triggered by honey bee venom phospholipase A2 with the right orientation at the interface. Phys. Chem. Chem. Phys. 20, 63–67. https://doi.org/10.1039/c7cp06344j
Hong C.Y., Han C.T., Chao L. 2016. Nonspecific binding domains in lipid membranes induced by phospholipase A2. Langmuir. 32, 6991–6999. https://doi.org/10.1021/acs.langmuir.5b03915
Alekseeva A.S., Tretiakova D.S., Chernikov V.P., Utkin Y.N., Molotkovsky J.G., Vodovozova E.L. Boldyrev I.A. 2017. Heterodimeric V. nikolskii phospholipases A2 induce aggregation of the lipid bilayer. Toxicon. 133, 169–179. https://doi.org/10.1016/j.toxicon.2017.05.015
Alekseeva A.S., Volynsky P.E., Krylov N.A., Chernikov V.P., Vodovozova E.L., Boldyrev I.A. 2021. Phospholipase A2 way to hydrolysis: Dint formation, hydrophobic mismatch, and lipid exclusion. Biochim. Biophys. Acta – Biomembr. 1863, 183481. https://doi.org/10.1016/j.bbamem.2020.183481
Boldyrev I.A., Zhai X., Momsen M.M., Brockman H.L., Brown R.E., Molotkovsky J.G. 2007. New BODIPY lipid probes for fluorescence studies of membranes. J. Lipid Res. 48, 1518–1532. https://doi.org/10.1194/jlr.M600459-JLR200
Olson F., Hunt C.A., Szoka F.C.,Vail W.J., Papahadjopoulos D. 1979. Preparation of liposomes of defined size distribution by extrusion through polycarbonate membranes. Biochim. Biophys. Acta – Biomembr. 557, 9–23. https://doi.org/10.1016/0005-2736(79)90085-3
Supaporn S. 2011. Effect of freeze-thawing process on the size and lamellarity of PEG-lipid liposomes. Open Colloid Sci. J. 4, 1–8. https://doi.org/10.2174/1876530001104010001
Sachl R., Boldyrev I.A., Johansson L.B. 2010. Localisation of BODIPY-labelled phosphatidylcholines in lipid bilayers. Phys. Chem. Chem. Phys. 12, 6027–6034. https://doi.org/10.1039/b926953c
Tretiakova D.S., Alekseeva A.S., Galimzyanov T.R., Boldyrev A.M., Chernyadyev A.Y., Ermakov Y.A., Batishchev O.V., Vodovozova E.L., Boldyrev I.A. 2018. Lateral stress profile and fluorescent lipid probes. FRET pair of probes that introduces minimal distortions into lipid packing, Biochim. Biophys. Acta – Biomembr. 1860, 2337–2347. https://doi.org/10.1016/j.bbamem.2018.05.020
Parasassi T., Krasnowska E.K., Bagatolli L., Gratton E. 1998. Laurdan and prodan as polarity-sensitive fluorescent membrane probes. J. Fluoresc. 8, 365–373. https://doi.org/10.1023/A:1020528716621
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


