Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 5, стр. 388-392
PI828 подавляет Ca2+-сигнализацию, инициируемую аминергическими агонистами, по механизму, независимому от ингибирования PI3-киназы
Е. А. Дымова a, О. А. Рогачевская a, Е. А. Воронова a, П. Д. Котова a, *
a Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Московская обл., Пущино, Россия
* E-mail: p.d.kotova@gmail.com
Поступила в редакцию 19.02.2021
После доработки 23.03.2021
Принята к публикации 26.03.2021
Аннотация
Самые разнообразные биологические процессы регулируются при участии гептаспиральных трансмембранных рецепторов (G-protein coupled receptor, GPCR-рецепторы), включая GPCR-рецепторы адреналина, ацетилхолина, гистамина, дофамина и серотонина. Многие из этих аминергических GPCR-рецепторов сопряжены с фосфоинозитидным каскадом и инициируют внутриклеточную Ca2+-сигнализацию, которая регулируется различными ферментами, в том числе фосфатидилинозитол-3-киназой (PI3-киназа). Известно, что некоторые ингибиторы PI3-киназы могут оказывать неспецифическое действие на внутриклеточные мишени, не относящиеся к семейству PI3-киназ. В данной работе с помощью мониторинга внутриклеточного Ca2+ в одиночных клетках нами показано, что ингибитор PI3-киназы PI828 блокирует мобилизацию внутриклеточного Ca2+, вызванную активацией мускариновых, гистаминовых и серотониновых рецепторов. Ряд полученных данных указывает на то, что этот эффект не связан с ингибированием PI3-киназы, а, скорее всего, обусловлен прямым действием PI828 на перечисленные аминергические GPCR-рецепторы.
ВВЕДЕНИЕ
Аминергические GPCR-рецепторы составляют группу гептаспиральных трансмембранных рецепторов (G-protein coupled receptor, GPCR-рецептор), активируемых биогенными аминами, включая адреналин, гистамин, дофамин и серотонин. Из структурных соображений в подсемейство аминергических GPCR-рецепторов также включены мускариновые рецепторы ацетилхолина [1]. Аминергические GPCR-рецепторы широко представлены в клетках различных типов и регулируют самые разнообразные физиологические процессы от передачи нервного возбуждения и сокращения мышечных волокон до пролиферации и дифференцировки клеток. Участие этих рецепторов в физиологических процессах обусловлено их сопряжением с различными внутриклеточными сигнальными системами, в частности с кальциевой (Ca2+) [2–4]. Все больше фактов указывают на то, что агонист-индуцированная Ca2+-сигнализация регулируется в том числе при участии фосфатидилинозитол-3-киназ класса I (PI3-киназ) – ферментов, катализирующих образование фосфолипида фосфатидилинозитол-3,4,5-триcфосфата (PIP3), который, в свою очередь, координирует локализацию и активность многих сигнальных белков [5, 6]. В некоторых работах показано, что ингибиторы PI3-киназ связываются с рядом внутриклеточных белков, не относящихся к семейству PI3-киназ [7, 8]. Ранее нами было продемонстрировано, что ингибитор PI3-киназы LY294002 и его неактивный аналог LY303511 подавляют внутриклеточные Ca2+-сигналы, инициируемые такими аминергическими агонистами, как ацетилхолин, гистамин и серотонин. Полученные данные свидетельствовали о том, что LY294002 и LY303511 влияли на Са2+-сигнализацию, инициируемую данными агонистами, независимым от PI3-киназ образом, скорее всего воздействуя на аминергические рецепторы напрямую [9]. Оставалось неясным, являются ли соединения LY294002 и LY303511 уникальными в этом отношении, или другие ингибиторы PI3-киназы также могут оказывать антагонистическое действие на аминергические рецепторы. В данной работе исследовали эффекты ингибитора PI3-киназы PI828 на Ca2+-сигналы, вызываемые агонистами аминергических рецепторов, в клетках различных линий.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование и трансфекция клеток. В работе использовали клетки почки эмбриона человека линии HEK 293, клетки глиомы мозга крысы линии С6 и клетки яичника китайского хомячка ранее полученной нами моноклональной линии CHO/5-HT2C, экспрессирующие рекомбинантный серотониновый рецептор 5-HT2C. Клетки используемых линий культивировали во влажной атмосфере c 5% CO2 в воздухе при 37°C. Клетки линии НЕК 293 культивировали в среде DMEM (Gibco), содержащей 4.5 г/л глюкозы, 10% эмбриональной бычьей сыворотки (HyClone), 100 мг/мл гентамицина (Sigma), 2 мМ глутамина (Sigma). Клетки линий С6 и CHO/5-HT2C культивировали в среде F12 (Gibco), содержащей 10% эмбриональной бычьей сыворотки (HyClone), 100 мг/мл гентамицина (Sigma), 2мМ глутамина (Sigma). Клетки всех используемых линий трансфицировали плазмидным вектором CMV-R-GECO1 (Addgene) с целью индукции экспрессии R-GECO1 – генетически кодируемого сенсора цитозольного Са2+. Для трансфекциии использовали набор для липофекции Lipofectamine 3000 (Invitrogen) по оптимизированному согласно рекомендациям производителя протоколу. Для физиологических экспериментов использовали клетки через 24–48 ч после трансфекции.
Мониторинг внутриклеточного Ca2+ в одиночных клетках. Клетки прикрепляли ко дну фотометрической камеры с помощью адгезивного материала Cell Tak (Corning) и выдерживали при комнатной температуре 30 мин. Внеклеточный раствор содержал (мМ): 130 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 10 HEPES, pH 7.4, 10 глюкозы. Фотометрические эксперименты проводили с использованием инвертированного флуоресцентного микроскопа Axiovert 135 (Zeiss), оборудованного объективом Plan NeoFluar 20×/0.75 и цифровой EMCCD камерой LucaR (Andor Technology). Флуоресценцию клеток возбуждали на длине волны 572 ± 17.5 нм, эмиссию регистрировали в области 634 ± 34 нм, что соответствует спектральным характеристикам R-GECO1. Изменение концентрации Са2+ в цитоплазме оценивали по относительному изменению интенсивности флуоресценции R-GECO1 ΔF/F0, где ΔF = F – F0, F и F0 – интенсивность эмиссии Са2+-индикатора в текущий момент времени и в начале регистрации, соответственно. Количественный фотометрический анализ изображений осуществляли с использованием программы NIS Elements (Nikon). Полученные экспериментальные данные обрабатывали с помощью программы Sigma Plot 12.5 (Systat Software).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для анализа влияния PI828 на Ca2+-сигналы, инициированные ацетилхолином и гистамином, использовали клетки, эндогенно экспрессирующие мускариновые или гистаминовые GPCR-рецепторы, а именно, клетки почки эмбриона человека HEK293 и клетки глиомы мозга крысы С6 соответственно. Кратковременная стимуляция соответствующих клеток ацетилхолином (1 мкМ) или гистамином (2 мкМ) инициировала в них Ca2+-ответы, которые полностью подавлялись в присутствии PI828 в концентрации 10–30 мкМ (рис. 1а, 1б). Для исследования влияния PI828 на серотонин-индуцированную Са2+-сигнализацию использовали моноклональную линию клеток яичника китайского хомячка CHO/5-HT2C, полученную нами ранее путем трансфекциии клеток CHO плазмидным вектором, несущим кДНК серотонинового рецептора 5-HT2C. Как и в случае Са2+-ответов на ацетилхолин и гистамин (рис. 1а, 1б), PI828 в концентрации 3 мкМ обратимо блокировал Ca2+-ответы клеток CHO/5-HT2C на серотонин (1 нМ) (рис. 1в).
Рис. 1.
PI828 ингибирует Ca2+-ответы клеток различных линий на аминергические агонисты. а–в – Репрезентативные регистрации Ca2+-ответов одиночных клеток на агонисты аминергических рецепторов и ATP в контроле и в присутствии PI828. Здесь и далее моменты и продолжительность аппликаций веществ обозначены горизонтальными линиями выше экспериментальной кривой. Изменение внутриклеточного Ca2+ характеризовали относительной флуоресценцией R-GECO1 ΔF/F0, где ΔF = F – F0, F и F0 – текущая интенсивность эмиссии индикатора и его эмиссия в начале регистрации соответственно. а – Ответы клетки HEK293 на ацетилхолин (АСh) (1 мкМ) и АТР (5 мкМ) (n = 147); б – ответы клетки С6 на гистамин (Hist) (2 мкМ) и АТР (5 мкМ) (n = 53); в – ответы клетки CHO/5-HT2C на серотонин (Ser) (1 нМ) и АТР (5 мкМ) (n = 108).
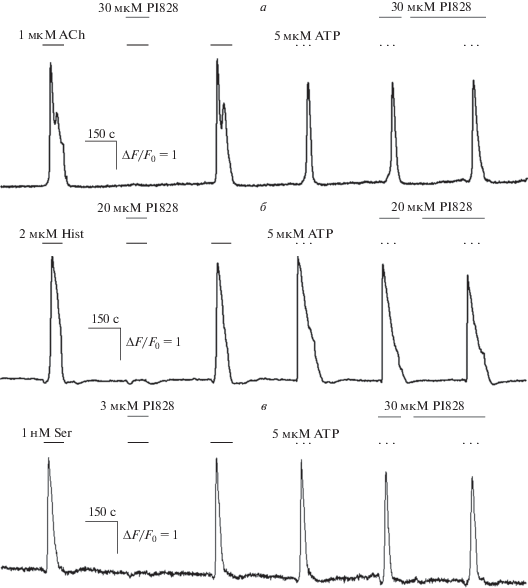
Формально, полученные результаты можно рассматривать как свидетельство участия PI3-киназы в генерации Ca2+-ответов на перечисленные агонисты аминергических рецепторов. Между тем ингибитор PI3-киназы другой химической природы вортманнин (wortmannin) (1–10 мкМ) не влиял на способность клеток генерировать Ca2+-ответы на те же агонисты (рис. 2). Поскольку вортманнин и PI828 вызывали различные физиологические эффекты, можно было думать, что эти соединения действовали на разные клеточные мишени. Иными словами, нечувствительность клеточных ответов к вортманнину указывала на то, что эффекты PI828, скорее всего, не были специфическими, т.е. не были опосредованы ингибированием PI3-киназы. В пользу такой точки зрения также свидетельствовал тот факт, что PI828 способен связываться не только с PI3-киназой, но и с рядом других внутриклеточных белков [7]. Кроме того, PI828 является структурным аналогом LY294002 – другого ингибитора PI3-киназы, который может влиять на Ca2+-сигнализацию независимым от PI3-киназы образом [9, 10]. Отметим в качестве дополнительного аргумента, что вортманнин ингибирует PI3-киназу необратимым образом [11], и поэтому способность PI828, апплицированного после вортманнина, ингибировать клеточные ответы (рис. 2) также не могла быть связана с его действием на PI3-киназу. Важно также отметить, что ингибирование Ca2+-ответов наблюдалось при аппликации PI828 одновременно с исследуемым агонистом (рис. 1, 2), хотя обычно ингибирование внутриклеточных мишеней в интактных клетках требует времени для проникновения ингибитора через плазматическую мембрану. При этом Са2+-ответы этих же клеток на агонист пуринергических рецепторов ATP (5 мкМ) не изменялись в присутствии PI828 даже в случае предынкубации с ним (рис. 1). Совокупность перечисленных особенностей феноменологии действия PI828 на Са2+-ответы, вызванные использованными в работе аминергическими агонистами, позволяет думать, что их подавление в данном случае вызвано не ингибированием PI3-киназы, а ранее не описанным экстраклеточным действием этого соединения.
Рис. 2.
Ca2+-ответы клеток различных линий на агонисты аминергических рецепторов в различных условиях. Репрезентативные регистрации Ca2+-ответов клетки HEK293 на 1 мкМ АСh (n = 54) (а), клетки глиомы С6 на 3 мкМ Hist (n = 27) (б) и клетки CHO/5-HT2C на 1 нМ Ser (n = 76) (в) в контроле и в присутствии вортманнина (Wortm) (10 мкМ) и PI828 (30 мкМ).
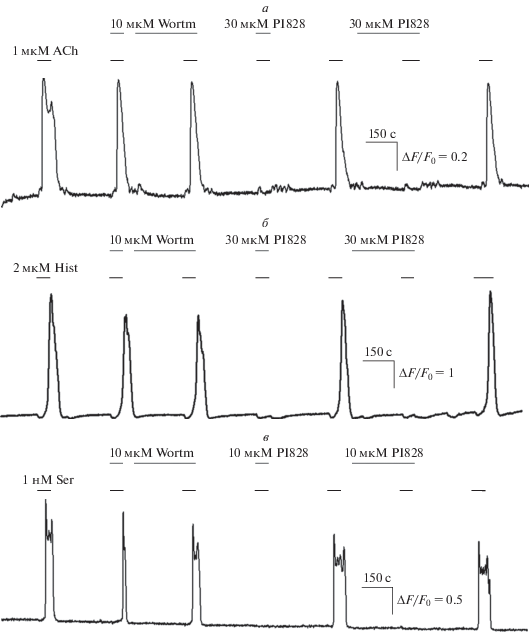
Таким образом, в данной работе нами показано, что ингибитор PI3-киназы PI828 блокирует мобилизацию внутриклеточного Ca2+, вызванную активацией мускариновых и гистаминовых рецепторов, и серотонинового рецептора 5-HT2C. Суммируя результаты, полученные при изучении Са2+-ответов клеток трех различных линий, можно утверждать, что эффект данного соединения не был связан с ингибированием PI3-киназы, а, скорее всего, был обусловлен его прямым действием на перечисленные аминергические GPCR-рецепторы, как и в случае соединений LY294002 и LY303511 [9]. Для подтверждения возможности связывания PI828 с различными аминергическими рецепторами в дальнейшем мы планируем использовать методы молекулярной динамики.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при поддержке гранта РНФ № 19-75-10 068 в части получения клеточных линий с экспрессией генетически-кодируемых сенсоров и проекта № 20-74-00056 в части физиологических экспериментов.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Vass M., Podlewska S., de Esch I.J.P., Bojarski A.J., Leurs R., Kooistra A.J., de Graaf C. 2019. Aminergic GPCR-ligand interactions: A chemical and structural map of receptor mutation data. J. Med. Chem. 62 (8), 3784–3839.
Moya-García A.A., Pino-Ángeles A., Sánchez-Jiménez F., Urdiales J.L., Medina M.Á. 2021. Histamine, metabolic remodelling and angiogenesis: A systems level approach. Biomolecules. 11 (3), 415.
Pytliak M., Vargová V., Mechírová V., Felšöci M. 2011. Serotonin receptors – from molecular biology to clinical applications. Physiol. Res. 60 (1), 15–25.
Brown D.A. 2019. Acetylcholine and cholinergic receptors. Brain Neurosci. Adv. 3, 2398212818820506.
Vanhaesebroeck B., Guillermet-Guibert J., Graupera M., Bilanges B. 2010. The emerging mechanisms of isoform-specific PI3K signalling. Nat. Rev. Mol. Cell Biol. 11, 329–341.
Jean S., Kiger A.A. 2014. Classes of phosphoinositide 3-kinases at a glance. J. Cell Sci. 127, 923–928.
Gharbi S.I., Zvelebil M.J., Shuttleworth S.J., Hancox T., Saghir N., Timms J.F., Waterfield M.D. 2007. Exploring the specificity of the PI3K family inhibitor LY294002. Biochem. J. 404 (1), 15–21.
Dittmann A., Werner T., Chung C.W., Savitski M.M., Fälth Savitski M., Grandi P., Hopf C., Lindon M., Neubauer G., Prinjha R.K., Bantscheff M., Drewes G. 2014. The commonly used PI3-kinase probe LY294002 is an inhibitor of BET bromodomains. ACS Chem. Biol. 9 (2), 495–502.
Kotova P.D., Kochkina E.N., Lyamin O.O., Rogachevskaja O.A., Kovalenko N.P., Ivashin D.S., Bystrova M.F., Enukashvily N.I., Kolesnikov S.S. 2020. Calcium signaling mediated by aminergic GPCRs is impaired by the PI3K inhibitor LY294002 and its analog LY303511 in a PI3K-independent manner. Eur. J. Pharmacol. 880, 173182.
Tolloczko B., Turkewitsch P., Al-Chalabi M., Martin J.G. 2004. LY-294002 [2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one] affects calcium signaling in airway smooth muscle cells independently of phosphoinositide 3-kinase inhibition. J. Pharmacol. Exp. Ther. 311 (2), 787–793.
Powis G., Bonjouklian R., Berggren M.M., Gallegos A., Abraham R., Ashendel C., Zalkow L., Matter W.F., Dodge J., Grindey G. 1994. Wortmannin, a potent and selective inhibitor of phosphatidylinositol-3-kinase. Cancer Res. 54 (9), 2419–2423.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


