Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 5, стр. 317-339
Перспективы и препятствия для клинического применения ингибиторов эффлюксных помп Mycobacterium tuberculosis
И. Г. Фелькер a, *, Е. И. Гордеева a, Н. В. Ставицкая a, В. А. Першина a, Я. Р. Батыршина a
a Новосибирский научно-исследовательский институт туберкулеза Минздрава России
630040 Новосибирск, Россия
* E-mail: felkeririna.nniit@gmail.com
Поступила в редакцию 04.03.2021
После доработки 22.04.2021
Принята к публикации 22.04.2021
Аннотация
Одним из механизмов формирования лекарственной устойчивости бактерий является экспорт лекарственных соединений эффлюксными помпами (ЭП) различных семейств. Интерес к изучению механизмов регуляции работы эффлюксных помп M. tuberculosis (МБТ), а в частности ингибирования, продиктован стремительным распространением лекарственно устойчивых штаммов, особенно у пациентов с иммунодефицитными состояниями. В обзоре подробно представлены все основные классы ЭП прокариотических клеток, особый раздел отведен описанию строения и механизмам ингибирования ЭП МБТ. Обобщены имеющиеся в литературе данные о генах, кодирующих ЭП МБТ, экспортируемых субстратах, а также об известных ингибиторах. Проведенный анализ позволяет сделать вывод о том, что использование ингибиторов ЭП МБТ в качестве терапевтических средств сопряжено с множеством сложных, в настоящее время не решенных вопросов, однако это никоим образом не должно влиять на понимание важности тех преимуществ, которые дает современной медицине использование данных соединений.
ВВЕДЕНИЕ
В современной литературе, посвященной исследованиям устойчивости бактерий к антибиотикам, большое внимание уделяется эффлюксным помпам (ЭП), как одному из основных механизмов формирования лекарственной резистентности. Интерес к их изучению продиктован стремительным распространением резистентных штаммов возбудителей инфекционных заболеваний у человека, особенно микроорганизмов с множественной лекарственной устойчивостью (МЛУ).
В настоящем обзоре представлены данные о существующей системе ЭП у бактерий в целом и у Mycobacterium tuberculosis (МБТ) в частности, обобщена информация об известных ингибиторах ЭП (ИЭП) и о перспективах их использования в клинической практике.
При подготовке настоящего обзора были использованы данные 224 литературных источников, из которых 223 представлены публикациями на английском, испанском и китайском языках и только 1 на русском, что может свидетельствовать о недостаточной освещенности проблемы эффлюксных помп в русскоязычной литературе. Также для анализа использовались международные базы данных белков-транспортеров: Transporter Classification Database, Uniprot, Mycobrowser, String.
СТРОЕНИЕ, ВИДЫ И ФУНКЦИИ ЭФФЛЮКСНЫХ ПОМП БАКТЕРИЙ
ЭП представляют собой комплексы белковых молекул, встроенных в клеточную стенку и способных транспортировать молекулы субстрата различных размеров (в том числе токсичные вещества, ксенобиотики, антибиотики большинства известных классов) из внутриклеточного пространства во внешнюю среду [1, 2]. Впервые описание ЭП в научной литературе появилось в 1990-х годах, к настоящему времени у прокариот описано пять основных семейств [3], хотя данный биохимический механизм формирования резистентности бактерий продолжает активно изучаться [1, 4–8].
Поскольку ЭП осуществляют транспорт субстрата против градиента концентрации, он является энергозависимым. В соответствии с типом энергообеспечения все помпы разделяются на две категории: получающие энергию путем активного гидролиза ATP (семейство ABC) и использующие энергию протон-движущей силы (семейства MFS, SMR, MATE и RND) [7].
Следует отметить, что ЭП грамотрицательных бактерий имеют более сложное строение, поскольку молекулы белков транспортной системы располагаются как во внешней, так и в цитоплазматической мембране и связаны между собой периплазматическим пространством, формируя трехкомпонентную структуру [7, 9]. ЭП могут быть как субстрат-специфичными транспортерами, экспортирующими только один вид/класс антибиотиков, так и транспортерами для широкого спектра субстратов.
Семейства эффлюксных помп прокариотических клеток
Семейство ЭП ATP-binding cassette (ABC). Трансмембранные белки данного семейства относятся к первично-активным транспортерам, использующим гидролиз ATP для осуществления переноса субстрата через мембрану против электрохимического градиента [10]. Впервые роль данного семейства транспортеров в формировании МЛУ была описана еще в 1986 году для клеток опухолевых тканей [11, 12]. В настоящее время хорошо изучена роль транспортеров этого семейства в формировании МЛУ как у грамположительных, так и грамотрицательных бактерий [13]. Структурно помпа представлена четырьмя белковыми субъединицами: две из них являются гидрофобными мембранными доменами, которые, как предполагают, формируют канал в цитоплазматической мембране; другие две субъединицы – цитоплазматические нуклеотид-связывающие домены, отвечают за энергообеспечение активного транспорта веществ путем связывания и гидролиза ATP (рис. 1) [14, 15]. У большинства бактерий данные четыре домена представлены независимыми полипептидами, кодируемыми генами одного оперона или генами, расположенными в одном и том же хромосомном регионе. Транспортеры семейства ABC могут осуществлять как экспорт, так и импорт веществ, однако способность импортировать вещества описана только для прокариотических клеток [15]. В литературе отмечена роль этого семейства в осуществлении импорта широкого спектра физиологически важных субстратов, среди которых питательные вещества, от небольших по размеру молекул углеводородов, аминокислот и пептидов до металлов, сидерофоров и витамина B12 [14, 16]. АВС-белки способны экспортировать различные соединения, такие как липиды, холестерин, стероидные гормоны, цитокины, хемокины, простагландины, ионы тяжелых металлов, пептиды, ксенобиотики и химиопрепараты [17]. Активный экспорт токсичных соединений ЭП семейства ABC играет важную роль в формировании вирулентности микроорганизмов [18].
Рис. 1.
Семейства эффлюксных помп прокариотических клеток на примере грамположительных бактерий. P – фосфат, ABC – ЭП семейства ATP-binding cassette, AcrA – периплазматический вспомогательный белок, AcrB – транспортный белок внутренней мембраны, MATE – ЭП семейства Multidrug and toxic compound extrusion, MFS –суперсемейство ЭП Major facilitator superfamily, NBD – нуклеотид-связывающий домен, RND – ЭП типа “Resistance-nodulation-cell division”, SMR – семейство ЭП Small Multidrug Resistance, TMD – гидрофобный трансмембранный домен, TolC – белковый канал внешней мембраны.
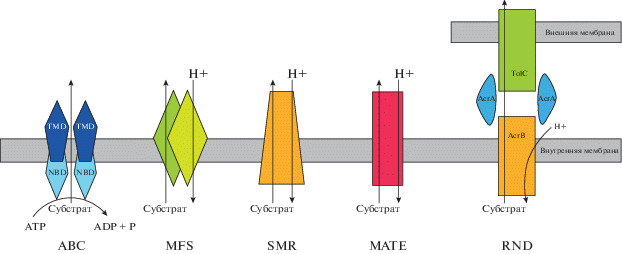
ЭП Major Facilitator superfamily (MFS). Трансмембранные белки суперсемейства MFS – самый большой класс вторично-активных транспортеров, широко представленный во всех живых клетках. Это суперсемейство включает более 70 различных подсемейств, каждое из которых связано с транспортом субстрата определенного типа [19]. В настоящее время описано более 15 000 генов, кодирующих трансмембранные белки этого семейства [20], в прокариотических клетках к данному семейству относится около 25% всех транспортных пептидов [21]. В человеческом геноме описаны гены, кодирующие, по меньшей мере, 110 транспортных белков MFS [22]. Несмотря на ограниченное сходство последовательностей, различную субстратную специфичность и механизмы связывания, структурно представители данного суперсемейства высоко консервативны. Помпа представлена двумя доменами, каждый из которых состоит из шести трансмембранных спиралей. Домены связаны между собой длинной цитоплазматической петлей или двумя трансмембранными спиралями в плоскости мембраны (рис. 1) [23–27]. Они состоят из 400–600 аминокислотных остатков, которые складываются в 12–14, иногда в 24 трансмембранных α-спирали [20, 28]. ЭП MFS необходимы бактериальной клетке как для экспорта, так и для импорта веществ. Первоначально считалось, что основная функция помп этого семейства – импорт олигосахаридов, но дальнейшие исследования показали их способность экспортировать лекарственные вещества, метаболиты, аминокислоты и оксианионы. Транспортеры MFS, участвующие в формировании МЛУ, широко распространены среди микроорганизмов и обычно функционируют как однокомпонентные помпы, способные переносить низкомолекулярные соединения. У грамотрицательных бактерий MFS-транспортеры представлены трехкомпонентным комплексом [19, 29, 30], кодирующие гены которого расположены в одном опероне. В частности, за геном, кодирующим белок внешней мембраны, следуют гены, кодирующие периплазматический адаптер и внутренний мембранный транспортер. Чаще всего регуляторный ген, активатор или репрессор, находится рядом и транскрибируется независимо от генов, кодирующих саму ЭП.
Белки семейства MFS демонстрируют три кинетически различных механизма осуществления транспорта субстратов: унипортеры – транспортируют только один тип субстрата и активируются исключительно за счет его трансмембранного градиента; симпортеры – перемещают два или более субстратов в одном направлении одновременно, используя электрохимический градиент одного из них в качестве движущей силы; антипортеры – транспортируют два или более субстратов через мембрану, но в противоположных направлениях [20, 31–35]. Таким образом, транспортеры данного семейства для осуществления экспорта могут использовать как трансмембранный ионный градиент, так и электрохимический протонный градиент.
Семейство ЭП Small Multidrug Resistance (SMR). ЭП этого семейства наименее изучены, ряд исследователей полагает, что это семейство эволюционно более молодое и сформировалось у бактерий в связи с началом активного использования антибактериальных препаратов [36, 37]. Структурно помпа представлена небольшим пептидом, состоящим из 100–200 аминокислот, уложенных в α-спираль с короткими гидрофильными петлями (рис. 1) [37].
Аминокислотный состав белков, формирующих помпы типа SMR, включает в себя глутамат, серин, триптофан и тирозин. Предполагается, что именно глутамат участвует в связывании протонов катионных субстратов при экспорте лекарственного вещества. В отличие от белков-транспортеров других семейств, SMR-пептиды осуществляют транспорт только липофильных субстратов, в первую очередь четвертичных аммониевых соединений, а также различных антибиотиков [38, 39], антисептиков и детергентов [36]. Подобно белкам суперсемейства MFS, транспортеры SMR для экспорта лекарственных соединений используют электрохимический протонный градиент [31].
ЭП семейства Multidrug and toxic compound extrusion (MATE). Помпы семейства MATE способны транспортировать по электрохимическому градиенту метаболиты и ксенобиотики в катионной форме. Интересным представляется способность этих ЭП переносить молекулы лекарственных препаратов разных типов, формируя лекарственную устойчивость бактерий к структурно разнообразным антибиотикам и химическим соединениям. Показано, что мутации в генах, отвечающих за работу помпы, ассоциированы с появлением резистентности к аминогликозидам, цетилпиридиния хлориду и сульфамидным препаратам [37, 40]. Известно, что у некоторых штаммов грамотрицательных бактерий ЭП MATE играют важную роль в формировании устойчивости к препаратам группы хинолонов [41, 42].
ЭП семейства Resistance-nodulation-cell division (RND). ЭП данного семейства представлены трехкомпонентной структурой, состоящей из транспортного белка внутренней мембраны (AcrB), периплазматического вспомогательного белка (AcrA) и белкового канала внешней мембраны (TolC) (рис. 1) [43]. Организация оперонов, кодирующих трехкомпонентные транспортеры RND, противоположна организации оперонов, кодирующих трехкомпонентные помпы семейства MFS: ген, кодирующий транспортер, всегда расположен в проксимальном к промотору положении, за ним следует ген, кодирующий периплазматический белок, а затем, если он присутствует, ген, кодирующий компонент внешней мембраны [44].
Трансмембранные белки этого семейства лучше всего описаны для грамотрицательных бактерий [45, 46], однако известны представители данного семейства и у микобактерий [47, 48]. Эффлюксные помпы семейства RND, так же как и белки семейств MFS, MATE и SMR, являются антипортерами, осуществляющими экспорт лекарственных соединений за счет использования электрохимического протонного градиента [49]. Среди всех семейств экспортеров RND обладают самой широкой субстратной специфичностью [50, 51]. Эти помпы способны экспортировать как гидрофильные, так и гидрофобные вещества, например, антибиотики, антисептики, токсичные красители, анионные, катионные, цвиттер-ионные и нейтральные соединения [9, 50, 52]. Интересно, что несмотря на широкую субстратную специфичность, помпы семейства RND не способны экспортировать питательные вещества или нетоксичные метаболиты, такие как глюкоза или аминокислоты [53]. Также имеются данные о том, что RND-экспортеры играют важную роль в осуществлении Quorum sensing – способности микроорганизмов взаимодействовать за счет секреции сигнальных молекул [54, 55].
Виды эффлюксных помп у M. tuberculosis
Согласно информации международных баз данных транспортных белков [56], геном M. tuberculosis референсного штамма H37Rv кодирует 267 различных трансмембранных белков и ионных каналов, из которых 129 – это ATP-зависимые транспортеры семейства ABC, 31 – помпы суперсемейства MFS, 14 – транспортеры семейства RND, и по одному трансмембранному каналу для семейств SMR и MATE [17, 57].
В ряде исследований было показано, что в клинических изолятах экспрессия генов, кодирующих ЭП, в несколько раз выше, чем в референсных штаммах, что объясняется экспозицией противотуберкулезных препаратов [47, 58].
Подавляющее большинство ЭП МБТ относится к семейству ABC [59], около 2.5% генома микобактерий отвечают за синтез и активность этих трансмембранных белков. Все ЭП данного семейства можно разделить на кодируемые одним, двумя или тремя генами (табл. 1).
Таблица 1.
Наиболее значимые при формировании МЛУ трансмембранные белки M. tuberculosis
| Семейство | Название гена | Номер Rv | Экспортируемый субстрат | Ссылка |
|---|---|---|---|---|
| ATP-binding cassette | ||||
| Семейство АВС-типа, кодируемое одним геном | bacA | Rv1819c | RIF, INH, BL, CHL, TET, VAN, MAC, NOV, AGs, AP | [83–89] |
| – | Rv0194 | BL, CHL, STR, TET, VAN, MAC, NOV, EMB, EtBr | [83, 89, 90] | |
| pstB | Rv0933 | FQS, INH, RIF, EMB | [84, 91–96] | |
| – | Rv 1473 | MAC | [57, 84] | |
| – | Rv2477c | MAC, FQs | [84, 89, 97] | |
| Семейство АВС-типа, кодируемое двумя генами | – | Rv1218c-Rv1217 | BL, NOV, BP, PD, PR, BSP, PA, INH, RIF | [84, 98–100] |
| – | Rv1668c-Rv1667c | MAC, Z | [101, 102] | |
| – | Rv1687c-Rv1686c | MAC | [14, 103] | |
| Семейство АВС-типа, кодируемое тремя генами | – | Rv1458c-Rv1457- Rv1456c |
RIF, INH, STR, EMB | [14, 103] |
| – | Rv2688c-
Rv2687c- Rv2686c |
FQs | [83, 89, 104] | |
| drrA- drrB- drrC |
Rv2936 Rv2937 Rv2938 |
TET, EMB, MAC, AGs, CHL,
RIF EtBr, NOR, PUR, BCEСF, DAU DOX |
[83, 105–107] | |
| Major Facilitator Superfamily | ||||
| MFS | – | Rv0191 | RIF | [84, 100, 108] |
| emrB | Rv0783 | Многие лекарственные препараты | [84, 88, 89, 96, 100, 109, 110] | |
| – | Rv0842 | RIF | [82, 106] | |
| – | Rv0849 | BL, INH, RIF | [82, 100, 111] | |
| – | Rv1250 | INH | [82, 90, 106] | |
| – | Rv1258c | TET, FQs, RIF, CFZ, INH, EMB, ERY, EtBr, SPE, Z | [82, 86, 93, 100, 112–115] | |
| P55 | Rv1410c | TET, AGs, RIF, INH, CFZ | [82, 86, 106, 110, 114, 116–119] | |
| – | Rv1634 | INH, FQs, SKI | [82, 88, 106, 120] | |
| – | Rv1877 | RIF, EtBr, ACR, ERY, KAN, TET | [82, 88, 121–123] | |
| Stp | Rv2333c | SPE, TET, RIF | [77, 82, 91] | |
| – | Rv2459 | INH, EMB, RIF, EtBr | [82, 84, 88, 106, 114, 124–126] | |
| efpA | Rv2846c | INH, RIF, EtBr, ACR, ERY, FQs | [82, 84, 106, 114, 121, 125–128] | |
| – | Rv2994 | STR, RIF | [82, 84, 122] | |
| – | Rv3728 | RIF | [82, 84, 126] | |
| Resistance-nodulation-cell division | ||||
| RND | mmpL3 | Rv0206c | SQ109, BM212, AU, IA | [77, 82, 104, 129] |
| mmpS4- mmpL4- |
Rv0451c- Rv0450c |
CMB, MB, RIF | [82, 130, 131] | |
| mmpS5- mmpL5 |
Rv0677c- Rv0676c- |
AZ, BDQ, CFZ, TET | [78, 82, 124, 132] | |
| mmpL7 | Rv2942 | INH | [72, 80, 82, 114, 127, 133] | |
| mmpL8 | Rv3823c | SQ109 | [77, 82, 134] | |
| mmpL9 | Rv2339 | SQ109 | [77, 82] | |
| Multidrug and toxic compound extrusion (MATE) | ||||
| dinF | – | Rv2836c | AGs, Phleo, CRC | [42, 82] |
| Small Multidrug Resistance (SMR) | ||||
| Mmr | – | Rv3065 | ACR, EtBr, INH, MAC, FQs, TPP, PY | [38, 82, 100, 114, 127, 135] |
Примечание. ACR – акрифлавин, AGs – аминогликозиды, AP – антимикробные пептиды, AZ – азолы, BCECF – 2,7-бис-(2-карбоксиэтил)-5(6)-карбоксифлуоресцеин, BDQ –бедаквилин, BL – β-лактамы, ВР – байрилпиперазин, BSP – бизанилинопиримидины, CFZ – клофазимин, СНL – хлорамфеникол,CMB – карбоксимикобактин, CPC – цетилпиридиниум хлорид, DAU – даунорубицин, DOX – доксорубицин, EMB – этамбутол, ERY – эритромицин, EtBr – этидиумбромид, FQs – фторхинолоны, IA – индоламины, INH – изониазид, KAN – канамицин, MAС – макролиды, MB – микобактин, NOR– норфлоксацин, NOV– новобицин, PA – пиразолоны, PD – пиридины, Phleo – флеомицин, PR – пирролы, PUR – пуромицин, PY – пиронин Y, RIF – рифампицин, SKI – имидазолин SKI-356313, SPE – спектиномицин, STR – стрептомицин, TET – тетрациклин, TPP – тетрафенилфосфоний, VAN – ванкомицин.
В сравнении с другими микроорганизмами для микобактерий характерно относительно небольшое количество помп-импортеров (за исключением импортеров фосфатов), что косвенно характеризует способность микобактерий сохранять жизнеспособность и полноценно функционировать в среде с низким содержанием питательных веществ. Интересно, что среди помп данного семейства были идентифицированы системы, отвечающие за экспорт факторов, необходимых для прикрепления микобактерий к клеткам хозяина [14, 59]. Также некоторые представители данного семейства играют немаловажную роль в регуляции активности роста микобактерий путем взаимодействия универсального стресс-белка Rv2623 с ЭП Rv1747, отвечающего за экспорт липоолигосахаридов, в частности обладающих иммуномодулирующим действием фосфатидил-мио-инозитол маннозидов [60–63]. Публикации 2021 года свидетельствуют о том, что трансмембранные белки данного семейства также содержат эпитопы цитотоксических Т-лимфоцитов, что в будущем может быть использовано при создании новой вакцины [64].
В табл. 1 представлены известные в настоящее время наиболее клинически значимые трансмембранные экспортеры всех семейств, играющие важную роль в формировании МЛУ МБТ.
Семейство помп “Major Facilitator superfamily” (MFS). В современной литературе для M. tuberculosis H37Rv описан и классифицирован 31 трансмембранный белок семейства MFS, все они сгруппированы в 9 подсемейств (Transporter Classification Database). Транспортеры данного семейства являются вторыми по численности и составляют около четверти всех трансмембранных белков микобактериальной клетки. Транспортеры каждого из подсемейств способны переносить как катионные, так и анионные молекулы (табл. 1). Известно, что белки различных помп подсемейств MFS могут функционировать как унипортеры, симпортеры и антипортеры, что обуславливает их высокую субстратную специфичность. В то же время основную роль в экспорте лекарственных веществ транспортерами MFS отводят системе сопряженного обмена с ионами H+ и/или Na+, при этом одновалентные катионные молекулы субстрата экспортируются из клетки в обмен на протоны [65–67]. Также имеются данные о значительном повышении уровня экспрессии мРНК помпы Rv1250 микобактерий на фоне противотуберкулезной терапии [68]. В последние годы появились публикации о том, что некоторые транспортеры данного семейства содержат эпитопы, однако, в отличие от белков семейства ABC, они взаимодействуют как с T-, так и с B-лимфоцитами [69], что позволяет рассматривать их в качестве потенциальных антигенов для создания поливалентной вакцины.
Resistance-nodulation-cell division (RND). Геном M. tuberculosis содержит 14 генов, кодирующих MmpL (микобактериальный мембранный белок большой) и пять вспомогательных белков MmpS (микобактериальный мембранный белок малый) (табл. 1). ЭП MmpL отвечают за транспорт липидов, в основном миколовых кислот, необходимых для построения уникальной клеточной стенки микобактерий и играющих ключевую роль в патогенезе туберкулеза, а также за транспорт гема [53, 70–74]. Экспрессия белков MmpL у M. tuberculosis контролируется сложной регуляторной сетью, которая включает регуляторы транскрипции TetR (Rv1816 и Rv3249c) и MarR (Rv0678) [53, 75, 76]. Из всех транспортеров семейства RND, описанных у M. tuberculosis, MmpL3 (Rv0206c) особенно важен с точки зрения выживания, поскольку именно он обеспечивает экспорт мономиколовых соединений [72]. Более того, MmpL3 рассматривается в качестве новой терапевтической мишени для таких антибактериальных препаратов как пиррольные производные BM212, SQ109, индолкарбоксамиды, тетрагидропиразоло-пиримидин-3-карбоксамид и адамантилмочевина [77]. Другими чрезвычайно важными для M. tuberculosis транспортерами лекарственных препаратов являются MmpS5-MmpL5, сверхэкспрессия которых ассоциирована с устойчивостью к азолам [78], бедаквилину и перекрестной устойчивостью к клофазимину [79], и MmpL7, отвечающий за экспорт изониазида [80]. Остальные трансмембранные белки данного класса участвуют в формировании вирулентности, обеспечении внутриклеточного выживания, а также вносят непосредственный вклад в диалог между иммунной системой организма хозяина и микобактерией [62].
Семейство помп “Multidrug and toxic compound extrusion” (MATE). DinF (Rv2836c) является единственным транспортером семейства MATE, представленном на мембране M. tuberculosis (табл. 1). Гомолог данной помпы присутствует у M. smegmatis (Mmp), но отсутствует в геноме M. leprae [81]. С суперэкспрессией гена Rv2836c связывают устойчивость M. tuberculosis к сульфамидным препаратам, аминогликозидам, флеомицину и цетилпиридин хлориду [81, 82].
Small Multidrug Resistance (small MDR, SMR). Геном M. tuberculosis содержит только один ген, кодирующий помпу семейства SMR – mmr (Rv3065). Mmr контролируется TetR-подобным репрессором транскрипции Rv3066 [83], расположенным сразу после гена mmr. Было доказано, что сверхэкспрессия Mmr снижает чувствительность M. smegmatis и M. tuberculosis к интеркалирующим красителям, соединениям четвертичного аммония и нескольким классам антибактериальных препаратов – изониазиду, макролидам, фторхинолонам, а также к этидию бромида (табл. 1) [84].
МЕХАНИЗМЫ ИНГИБИРОВАНИЯ ЭФФЛЮКСНЫХ ПОМП
Общая информация
Поскольку экспорт антибиотиков из бактериальной клетки является основным механизмом, способствующим формированию лекарственной устойчивости патогенных микроорганизмов, ингибирование ЭП, ведущее к накоплению антибактериальных препаратов (АБП) внутри возбудителя, может стать важным потенцирующим компонентом антибактериальной терапии.
Механизмы ингибирования ЭП можно подразделить на две большие группы:
– непрямые механизмы ингибирования, влияющие на энергозависимые химические процессы, необходимые для экспорта веществ ЭП;
– ингибирование путем прямого связывания с трансмембранными белками.
В первом случае ингибитор воздействует на энергозависимые процессы, обеспечивающие выброс веществ из бактериальной клетки (протонный градиент, гидролиз ATP). При этом прямого взаимодействия ингибитора с помпой нет. Поскольку для большинства помп экспорт веществ происходит за счет протонного градиента, этот механизм ингибирования считается универсальным.
Во втором случае ингибитор связывается с трансмембранными белками помпы, снижая их способность к взаимодействию с субстратом. Различают два вида связывания: конкурентное и неконкурентное [136].
Соединения, ингибирующие ЭП
Снижение активности или полное ингибирование трансмембранных транспортеров может быть достигнуто следующими способами:
• подавление экспрессии кодирующих генов;
• изменение строения антибиотика, приводящее к нарушению распознавания его как субстрата ЭП;
• ингибирование сборки трансмембранных пептидов в единую функционирующую систему;
• снижение активности насоса путем блокирования центра связывания;
• коллапс энергетического механизма, обеспечивающего работу помпы.
Реализация первых трех механизмов в настоящее время описана только в теории, нам не удалось найти практических подтверждений и примеров.
Поиск и изучение химических соединений, обладающих способностью ингибировать ЭП бактерий, начался еще 20 лет назад, когда был открыт пептидомиметик MC-207,110 (фенилаланил-аргинил-β-нафтиламид (PaβN)), потенцирующий эффекты левофлоксацина и эритромицина в отношении P. aeruginosa, сверхэкспрессирующих помпу MexAB-OprM19 [115]. Однако с тех пор ни один ИЭП так и не был внедрен в клиническую практику. Это обусловлено чрезвычайно высокими требованиями, предъявляемыми к ИЭП [7, 137]. Молекула не должна обладать антибактериальной активностью. Наличие данной активности в конечном итоге приведет к селекции мутантных штаммов, что серьезно снизит эффективность молекулы в качестве ИЭП. Соединение должно быть селективным и не взаимодействовать с какими-либо помпами клеток организма-хозяина. Поскольку ЭП распространены повсеместно и их основные функциональные аспекты, как правило, одинаковы для всех форм жизни, избирательное подавление экспорта из бактериальной клетки является сложной задачей.
Одним из самых известных ИЭП, влияющих на энергетическое обеспечение процесса экспорта АБП, является карбонил цианид м-хлорфенилгидразон (CCCP). Это ионофор, уменьшающий величину протон-движущей силы [138], что инактивирует не только ЭП, но и метаболические процессы клетки в целом. Есть данные о синергии CCCP с тетрациклинами и карбапенемами [139, 140], однако высокая токсичность вещества ограничивает его использование только лабораторными экспериментами.
Другим, более перспективным в отношении клинического использования ИЭП, влияющим на мембранный потенциал бактериальной клетки, является синтетическая молекула IITR08027. Группой ученых из Индии было доказано его потенцирующее действие при использовании совместно с ципрофлоксацином [138]. Поскольку данная молекула не имеет собственной антибактериальной активности и проявляет низкую токсичность по отношению к клеткам животных, исследователи считают IITR08027 перспективным для клинического использования.
Альтернативный механизм потенцирования действия АБП реализован через прямое связывание ингибитора с трансмембранными белками помпы, что приводит к снижению их способности взаимодействовать с субстратом. Однако в бактериальной популяции довольно быстро появляются мутантные штаммы с модифицированными сайтами связывания, что делает использование ИЭП малоэффективным.
К ИЭП, реализующим свою активность через связывание с помпой, относится уже упомянутое выше соединение PAβN (MC-207,110) – синтетический ИЭП, инактивирующий помпы семейства RND. Показано, что данная молекула способна потенцировать эффект левофлоксацина, эритромицина и хлорамфеникола и в меньшей степени тетрациклина и карбенициллина [137].
Верапамил – небольшая синтетическая молекула, блокатор кальциевых каналов, широко применяемый в кардиологии, одновременно является одним из самых изученных ИЭП. Механизм действия верапамила реализован через его конкурентное связывание с активным сайтом трансмембранных белков семейства MATE, что приводит к ингибированию экспорта ряда противотуберкулезных препаратов у M. tuberculosis [141, 142]. Было установлено, что верапамил по-разному взаимодействует с двумя типами транспортеров семейства MATE, DinF и NorM, однако общий эффект ингибирования активности помпы одинаковый [143]. Более подробно о данном ИЭП будет написано далее в разделе, посвященном M. tuberculosis.
Другое соединение данной подгруппы ИЭП – 1-(1-нафтилметил)-пиперазин (NMP). Этот ингибитор потенцирует действие оксациллина, рифампицина, хлорамфеникола и кларитромицина и, в меньшей степени, фторхинолонов, азитромицина, клиндамицина, нитрофуранов и доксициклина [144]. NMP вызывает конформационные изменения в транспортере AcrB, что ведет к неконкурентному ингибированию связывания [145]. Однако данная молекула также обладает собственной антибактериальной активностью в концентрации, в четыре раза превышающей ту, которая используется в качестве ИЭП, что позволяет предположить существование вторичной мишени.
Известно множество соединений, обладающих способностью ингибировать трансмембранные помпы, однако механизм действия большинства из них неизвестен, и их трудно отнести к тому или иному классу. Вследствие этого в литературе чаще можно встретить классификацию, базирующуюся на происхождении соединений: растительное, синтетическое и бактериальное.
ИЭП растительного происхождения. Химические соединения растительного происхождения включают широкий спектр адъювантов, повышающих эффективность антибактериальных препаратов в несколько раз [146]. Основные подклассы растительных ИЭП представлены ниже.
Алкалоиды. Резерпин, соединение, извлекаемое из корней Rauwolfia serpentina, ингибирующее ЭП суперсемейства MFS и RND [147]. Резерпин усиливает антимикробную активность антибиотиков за счет непосредственного взаимодействия с аминокислотными остатками белка-переносчика Bmr, который опосредует экспорт тетрациклина. Кроме того, было доказано, что резерпин полностью нивелирует NorA-опосредованную устойчивость S. aureus к норфлоксацину [147] и повышает чувствительность к тетрациклину [148]. Исследование Viveiros и соавторов показало, что резерпин повышает чувствительность M. tuberculosis к изониазиду в 100 раз, что свидетельствует о наличии у микобактерии системы (систем) эффлюкса, чувствительной к резерпину [149]. Однако в клинической практике резерпин пока не нашел применения в качестве ИЭП в связи с нежелательными нефротоксическими эффектами [150].
Пиперин, соединение, получаемое из Piper nigrum – алкалоид, ингибирующий человеческий P-гликопротеин трансмембранных белков суперсемейства ABC через цитохром P450-опосредованный путь. В литературе описана способность пиперина и его производного, пиперидина, ингибировать ЭП ряда патогенных микроорганизмов, включая S. aureus и Mycobacteria spp. [151]. Исследование, проведенное на S. aureus, показало, что пиперин усиливает накопление ципрофлоксацина, ингибируя NorA-опосредованный экспорт. Также сообщалось, что у M. tuberculosis H37Rv и некоторых клинических изолятов пиперин усиливает активность рифампицина, ингибируя транспортер Rv1258c (суперсемейство MFS) [152]. Другой потенциально полезный эффект использования пиперина связан с тем, что он способствует пролиферации T- и B-клеток, усиливая Th1-ответ и повышая активность макрофагов. Также пиперин индуцирует дифференцировку Т-клеток CD4/CD8, повышает секрецию интерферона-гамма и интерлейкина-2 у мышей, инфицированных МБТ. Это позволяет предположить, что пиперин может повышать эффективность противотуберкулезной терапии как за счет ингибирования ЭП МБТ, так и за счет иммуномодулирующего эффекта [153].
Флавоноиды. Байкалеин, выделенный из листьев тимьяна (Thymus vulgaris) 5,6,7-тригидрофлавон, обладающий слабой антибактериальной активностью, повышает чувствительность метицилин-резистентных штаммов S. aureus к ципрофлоксацину и β-лактамным антибиотикам, включая оксациллин, цефметазол тетрациклина и ампициллин [154, 155].
Имеются данные о том, что 5'-метоксигиднокарпин, флаволигнан, получаемый из Berberis fremontii, а также ряд изофлавонов, выделяемых из Lupinus argenteus, повышают эффективность норфлоксацина и берберина, путем ингибирования протонной помпы NorA у S. aureus и M. smegmatis. Однако вследствие токсичности данных соединений, перспективы их клинического применения весьма сомнительны [156, 157].
Полифенолы. Способность ингибировать ЭП была описана для группы фенольных метаболитов – катехин галлатов. Имеются данные о том, что эти полифенолы являются слабыми ингибиторами NorA-опосредованного экспорта. Интересно, что эти соединения обладают различными эффектами в зависимости от их концентрации. В низких концентрациях они усиливают экспорт субстратов, а в высокой – ингибируют [158]. В связи с этим было высказано предположение, что молекулы ИЭП имеют два разных сайта связывания с разной степенью сродства. При низких концентрациях катехины занимают сайты связывания с высокой аффинностью, что приводит к увеличению экспорта субстрата. Ингибирующая активность катехинов наблюдается только при высоких концентрациях. Также было доказано, что эпигаллокатехина галлат повышает эффективность тетрациклина, эритромицина и ципрофлоксацина в отношении грамположительных стафилококков, сверхэкспрессирующих TetK, и грамотрицательных Campylobacter spp. Однако из-за токсичности этих соединений дальнейшие исследования in vivo и доклинические испытания не проводились [159].
Фенольные дитерпены. Представителями данного класса соединений являются карнозная кислота и карнозол, выделенные из розмарина (Rosmarinus officinalis). Они повышают эффективность тетрациклина и эритромицина в отношении макролид-резистентного штамма S. aureus, сверхэкспрессирующего транспортеры суперсемейства ABC (MsrA) и эффлюксные помпы TetK [160]. Также есть данные о том, что гераниол (монотерпеноидный спирт), выделенный из Helichrysum italicum, модулирует лекарственную устойчивость у нескольких видов грамотрицательных бактерий путем ингибирования трансмембранной помпы AcrAB-TolC [161].
Основные подклассы ИЭП синтетического происхождения
Пептидомиметики. Дипептид-амидное соединение PAβN, уже упомянутое выше, было одним из первых синтетических ИЭП. В ряде исследований было показано, что данное соединение усиливает активность многих антибиотиков, включая фторхинолоны, макролиды и хлорамфеникол, в отношении грамотрицательных бактерий за счет ингибирования RND-опосредованного экспорта [137, 162]. В связи с высокой токсичностью соединения, клинического применения данная молекула не нашла, и был предпринят ряд попыток синтезировать менее токсичное, более стабильное производное; однако ни один из активных аналогов не смог значительно улучшить характеристики исходной молекулы. Таким образом, PAβN и его производные в настоящее время используются только в лабораторных условиях [163].
Производные хинолина. Производные хинолина, такие как пиридохинолоны, могут восстанавливать активность норфлоксацина в отношении штаммов E. aerogenes, сверхэкспрессирующих трансмембранные белки AcrAB-TolC посредством конкурентного связывания с активным центром помпы семейства RND [164]. Сообщалось, что некоторые другие синтетические аналоги, такие как 4-замещенный тиоалкил-, алкиламино- и алкокси-хинолон, усиливают активность тетрациклинов, норфлоксацина и хлорамфеникола в клинических изолятах K. pneumoniae и E. aerogenes [165]. Ряд производных, синтезированных путем модификации флавонового каркаса, являются мощными ингибиторами NorA-зависимого экспорта у S. aureus [166].
Арилпиперидины и производные арилпиперазина. Арилпиперидин и его производные, восстанавливают чувствительность к линезолиду и увеличивают его внутриклеточную концентрацию у E. coli [167]. Другие аналоги – фенилпиперидины, являющиеся селективными ингибиторами обратного захвата серотонина, подавляют экспорт лекарственных веществ у штаммов S. aureus и частично ингибируют активность транспортеров AcrAB-TolC у E. coli [168].
Одно из наиболее известных соединений данной группы, NMP, восстанавливает чувствительность штаммов E. coli, сверхэкспрессирующей AcrAB и AcrEF, к левофлоксацину и этидию бромида за счет ингибирования RND-опосредованного экспорта. Однако вследствие способности арилпиперазинов ингибировать обратный захват серотонина, данные соединения могут быть токсичными для клеток млекопитающих [144].
Производные пиридопиримидина и пиранопиридина. Соединения D2 и D13-9001, являющиеся специфическими ингибиторами эффлюксной помпы MexAB штаммов P. aeruginosa, проявляют свою активность как в условиях in vitro, так и in vivo [163, 169]. Другое соединение – MBX2319, синтетический пиразолопиридин, потенцирует активность ципрофлоксацина, левофлоксацина и пиперациллина до восьми раз на штаммах E. coli AB115729. Кроме того, MBX2319 также приводил к увеличению внутриклеточного накопления красителя Hoechst в E. coli как дикого типа, так и со сверхэкспрессией AcrAB-TolC [145].
В литературе описано множество синтетических и полусинтетических соединений, обладающих способностью ингибировать эффлюксные помпы. Sharma и соавторы в своей обзорной статье [7] отмечают, что таких соединений известно более сотни.
ИЭП бактериального происхождения. Хотя данный подкласс соединений довольно небольшой, однако мы считаем, что необходимо о нем упомянуть в связи с перспективностью его изучения. В настоящее время имеются данные о нескольких соединениях, бактериального происхождения, обладающих свойствами ИЭП: соединения EA-371α и EA-371d, полученные путем ферментации экстракта культуры Streptomyces spp., являются специфическими ингибиторами MexAB-OprM-опосредованного эффлюкса у P. Aeruginosa, грибковые метаболиты энниатины и боверицины ингибируют транспортеры семейства ABC, мильбемицины были повторно открыты как мощные ингибиторы CDRI-помпы C. Albicans, потенцируя, таким образом, действие флуконазола [170]. Структурно новые молекулы открывают возможности синтезировать более эффективные, биодоступные и менее токсичные производные.
ИЭП для M. tuberculosis
Для M. tuberculosis описаны ИЭП, реализующие свою работу через оба основных механизма ингибирования: путем воздействия на энергообеспечение работы помпы и путем прямого связывания с трансмембранными пептидами. При этом помпы суперсемейства АВС ингибируются преимущественно путем воздействия на энергозависимые процессы, а помпы семейств MFS, MATE и RND путем связывания с субстратом. Известны ИЭП МБТ как синтетического, так и растительного происхождения. Все основные соединения, обладающие способностью ингибировать трансмембранные помпы МБТ, их мишени и основные эффекты представлены в таблице 2.
Таблица 2.
Ингибиторы эффлюксных помп M. tuberculosis
| Ингибиторы ЭП | Ингибируемые ЭП | Основной эффект | Ссылка | |
|---|---|---|---|---|
| Ингибиторы синтетического происхождения | ||||
| Верапамил Норверапамил |
ABC: DrrAB, PstB Rv2686c-2687c-2688c MFS: lfrA, Rv1634, Rv1258c, Rv1877, Rv2846c RND: Rv1145, Rv1146, Rv0678 SMR: Rv3065 (mmr) |
– Снижает МИК ПТП – Снижает необходимую дозу ПТП – Синергический эффект с ПТП – Способствует накоплению ПТП в МБТ – Способствует элиминации МБТ из макрофагов – Подавляет рост и устойчивость МБТ – Сокращает продолжительность терапии |
[79, 106, 114, 141, 142, 171–175, 200, 201] | |
| Ионофоры | Карбонил-цианид-м-хлорфенилгидразон (CCCP) | ABC: Rv2936-Rv2937
(DrrAB), Rv0933 (PstB), Rv2686c-2687c-2688c MFS: lfrA, Rv2459 (jefA), Rv1410c(P55), Rv1634, Rv1258c, Rv1410c, Rv1877, Rv2846c RND: Rv1145, Rv1146, Rv0676c-Rv0677c(MmpS5-MmpL5) SMR: Rv3065(mmr) |
– Снижает МИК ПТП – Уменьшает дозировку АБП – Синергический эффект с ПТП |
[78, 84, 105, 106, 112, 117, 118, 142, 174, 177] |
| Валиномицин | MFS: Rv1410c (P55) | – Способствует
накоплению ПТП в МБТ – Повышает чувствительность МБТ к ПТП |
[118, 133, 179–181] | |
| 2,4-динитрофенол (DNP) |
ABC: Rv2936-Rv2937 (DrrAB), Rv2686c-2687c-2688c, Rv0933(PstB) |
– Снижает МИК ПТП | [117, 118, 142] | |
| MFS: lfrA, Rv1634, Rv1258c | ||||
| Фенотиазины | Хлорпромазин | RND: Rv1145, Rv1146
MFS: Rv1877, Rv2846c SMR: Rv3065 (mmr) |
– Бактерицидная активность
в отношении лекарственно чувствительных/
устойчивых МБТ – Синергический эффект с ПТП – Повышает чувствительность МБТ к ПТП |
[114, 182–188, 202] |
| Тиоридазин | RND: Rv3160c-Rv3161c | – Проявляет бактерицидную активность в отношении лекарственно-чувствительных/ устойчивых МБТ | [106, 114, 182–188, 202] | |
| Капурамицин и его аналоги | Транслоказа I (фосфор- N-ацетилмурамил-пентапептид-транслоказа) |
– Бактерицидная активность
в отношении МЛУ
и не МЛУ штаммов МБТ – Снижает бактериальную нагрузку – Синергический эффект с ПТП |
[190–195, 203] | |
| Genz-10850 (GEQ-соединение) | RND: Rv2942 (MmpL7) | Ингибирует рост МБТ | [196] | |
| Phe-Arg-β-
нафтиламид
MC-207110 MC-02595 MC-04124 BU-005 |
CmlA (cmlR1) FloR (cmlR2) RND-тип левофлоксацин-специфические эффлюксные помпы |
– Снижает МИК ПТП – Ингибирует резистентность штаммов МБТ к ПТП |
[198, 199] | |
| Спектинамиды | MFS: Rv1258c | – Синергический
эффект с ПТП – Снижает бактериальную нагрузку – Бактерицидное действие на МБТ при острой туберкулезной инфекции |
[197, 200] | |
| SILA-421 | mdr-1 | – Синергический
эффект с ПТП – Стимулирует бактерицидную активность макрофагов в отношении МБТ – Подавляет резистентность МБТ к ПТП |
[189–191] | |
| Тимкодар | ABC: DrrAB, PstB Rv2686c-2687c-2688c MFS: lfrA, Rv1634, Rv1258c P-гликопротеин и/или МЛУ-ассоциированный белок |
– Синергический
эффект с ПТП – Подавляет рост МБТ – Снижает бактериальную нагрузку |
[142, 204] | |
| Ингибиторы растительного происхождения | ||||
| Резерпин | ABC: Rv2936-Rv2937-
Rv2938 (DrrABC) Rv0933 (PstB) Rv2686c-Rv2687c-Rv2688c RND: Rv0678, Rv1145, Rv1146 Rv2942 (mmpL7) MFS: Rv1410c(P55), Rv1877 Rv2846c SMR: Rv3065 (mmr) |
– Снижает МИК ПТП – Снижает/устраняет устойчивость МБТ к ПТП – Повышает концентрацию ПТП в МБТ |
[79, 80, 146, 148, 149, 174, 189–191, 195, 204, 205] | |
| Пиперин | MFS: Rv1258c | – Снижает МИК ПТП – Снижает бактериальную нагрузку – Стимулирует клеточный иммунитет |
[152, 173, 205–207] | |
| Берберин | NorA, RamR | – Ингибирует резистентность МЛУ штаммов МБТ | [156, 208, 209] | |
| Кверцетин | SMR: Rv3065(mmr), изоцитратлиаза | – Подавляет рост МБТ | [208, 210–212] | |
| Тетрандрин | MFS: Rv2459(jefA), Rv3728 SMR: Rv3065 (mmr) |
– Синергический
эффект с ПТП – Снижает МИК ПТП |
[213, 214] | |
| Фарнезол | Не определены | – Синергический
эффект с ПТП – Повышает накопление ПТП внутри бактериальной клетки |
[215] | |
| Фенилпропаноиды | RND: Rv1145, Rv1146
MFS: Rv1877, Rv2846c SMR: Rv3065 (mmr) |
– Снижает МИК ПТП – Повышает накопление ПТП внутри бактериальной клетки |
[174, 216–218] | |
| Compound 1 | MurE-лигаза, NorA | – Подавляет рост МБТ | [219] | |
Верапамил является наиболее изученным ИЭП МБТ. Эксперименты с клиническими штаммами, устойчивыми к изониазиду и рифампицину показали, что комбинированное использование данных противотуберкулезных препаратов (ПТП) с верапамилом приводит к снижению минимальной ингибирующей концентрации (МИК) обоих препаратов, что ведет к реверсии лекарственной устойчивости возбудителя [106, 114, 171, 172].
Аналогичным образом показано, что при совместном применении верапамил снижает МИК левофлоксацина (в 2–8 раз), бедаквилина (в 8–16 раз), моксифлоксацина и клофаземина в клинических изолятах МБТ, устойчивых к данным препаратам, тогда как в чувствительных культурах никакого эффекта не наблюдается [79, 141, 142, 173]. Также показано, что верапамил способствует накоплению ПТП внутри МБТ и по своему эффекту он превосходит такие более токсичные соединения как CCCP, резерпин и хлорпромазин [174].
Кроме того, исследования на животных моделях показали, что верапамил ускоряет элиминацию МБТ из инфицированных макрофагов, ингибирует рост и резистентность внутриклеточно расположенных МБТ, позволяет снизить дозировку препарата и сократить продолжительность химиотерапии [171, 173, 175]. Так же использование верапамила в комбинированной химиотерапии было ассоциировано со снижением частоты рецидивов [175]. Полученные данные позволяют предположить, что верапамил может стать эффективным дополнением противотуберкулезной терапии.
Ионофоры представляют собой жирорастворимые комплексы, осуществляющие транспорт ионов через клеточную мембрану [176] путем активного переноса или посредством формирования канала. Поскольку трансмембранные градиенты концентраций ионов необходимы для поддержания мембранного потенциала, ионофоры играют важную физиологическую роль [177]. К числу ионофоров, обладающих потенциальной противотуберкулезной активностью, относятся CCCP, 2,4-динитрофенол (DNP) и валиномицин.
Изучение активности CCCP в качестве ИЭП МБТ начались еще 20 лет назад, Silva и соавторы стали первыми, кто описал эффективность СССР в комбинациях со стрептомицином и тетрациклином за счет ингибирования MFS-опосредованного экспорта [117]. Позднее ряд исследователей доказали его эффективность с точки зрения преодоления лекарственной устойчивости к изониазиду, рифампицину, этамбутолу, офлоксацину и клофазимину на различных штаммах микобактерий [106, 112, 125, 142, 178]. Кроме того, было доказано, что СССР ингибирует не только MFS-опосредованный экспорт, но и блокирует работу помп семейств ABC и RND [78, 105, 174]. DNP, как и СССР, активен в отношении эффлюксных помп семейств MFS и ABC и снижает МИК хинолоновых препаратов для резистентных клинических изолятов МБТ [142]. Несмотря на высокую активность данных соединений в качестве ИЭП, клиническое использование их не представляется возможным в связи с токсичностью в отношении клеток животных.
Валиномицин является высокоселективным переносчиком калия [179, 180]. Различными авторами было доказано, что он активен в отношении эффлюксной помпы P55, что ведет к внутриклеточному накоплению изониазида и пиразинамида [133, 181], а также повышает чувствительность МБТ к рифампицину и новобиоцину [118, 179].
Производные фенотиазина давно используются в психиатрической практике, однако с точки зрения антибактериальной активности в отношении МБТ хорошо изучены только два препарата – хлорпромазин и тиоридазин. Впервые ингибирующее действие хлорпромазина на МБТ было описано Crowle и соавторами еще в 1992 году. Было показано, что ингибирующая активность хлорпромазина в отношении МБТ, расположенных внутри макрофагов выше, чем в отношении внеклеточных бактерий [182]. Это наблюдение было подтверждено другими исследователями, описавшими схожую активность тиоридазина [183]. При этом эффективность оценивалась при концентрации препаратов более чем 1 мг/л, что не может быть достигнуто в клинической практике, однако, было доказано, что фенотиазины способны накапливаться в макрофагах, что позволяет получить необходимую концентрацию без каких-либо токсических эффектов на клеточные процессы in vitro [184, 185]. Дальнейшие исследования показали, что хлорпромазин также является синергистом многих противотуберкулезных препаратов, включая изониазид, рифампицин, рифабутин, стрептомицин, пиразинамид и потенцирует эффект этих препаратов в отношении расположенных внутриклеточно МБТ даже при наличии МЛУ [114, 183, 186]. Таким образом, фенотиазины (хлорпромазин и тиоридазин) имеют значительный потенциал для использования в комбинированной химиотерапии туберкулеза. В то же время их антипсихотические побочные эффекты и возможность сочетания с противотуберкулезными препаратами требуют дополнительных исследований [187, 188].
Запатентованный более 10 лет назад дисилоксан SILA-421 инициирует трансформацию макрофагов, инфицированных штаммом МБТ H37Rv с МЛУ, с появлением бактерицидной активности последних [189]. Эксперименты in vitro продемонстрировали, что данное соединение обладает собственной антимикробной активностью, зависящей от концентрации и времени воздействия, а механизм действия SILA-421 сходен с действием тиоридазина. Было доказано, что SILA-421 усиливает бактерицидную активность макрофагов в отношении МБТ, ингибируя Mdr-1-опосредованный экспорт, а также является синергистом изониазида и рифампицина, подавляя развитие устойчивости МБТ [190, 191].
Остальные ИЭП синтетического происхождения, представленные в таблице 2, в настоящее время активно изучаются, каждый из них обладает потенциалом в отношении МБТ, однако доказательная база и знания о механизмах их действия пока недостаточны, чтобы перейти к клиническим экспериментам [192–200].
ИЭП растительного происхождения, эффективные в отношении МБТ, представлены весьма широким спектром соединений. Резерпин и пиперин уже были описаны выше, и мы не станем на них останавливаться. Прямых доказательств активности берберина в отношении МБТ в современной литературе найти не удалось, однако с высокой долей вероятности можно предполагать ее наличие, поскольку доказано, что берберин ингибирует NorA- и RamR-опосредованный экспорт у МЛУ штаммов S. aureus. Аналогичные ЭП присутствуют на мембране МБТ, что позволяет считать берберин перспективным соединением, требующим дальнейшего изучения [156, 208, 209].
Кверцетин относится к флавоноидам и присутствует во многих овощах, фруктах и листьях, используется в качестве биологически активной добавки, обладающей антиоксидантными свойствами. Последние исследования показали, что кверцетин способен связываться с ЭП микобактерий (Mmr) и E. coli (EmrE), и молекулярное взаимодействие между ним и трансмембранными белками оказалось более стабильным, чем с верапамилом, резерпином и хлорпромазином [210]. Другими авторами было доказано, что кверцетин блокирует глиоксилатный шунт МБТ H37Rv путем ингибирования изоцитратлиазы [211, 212].
Ряд других растительных ИЭП, таких как тетрандрин, фарнезол и фенилпропаноиды представлены в таблице 2 [213–219].
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ С ИЭП IN VIVO
Имеющиеся данные об активности всех вышеперечисленных соединений в качестве ИЭП в основном базируются на результатах экспериментов in vitro, в то время как данные об эффективности ИЭП in vivo немногочисленны. Зачастую авторам не удается зарегистрировать повышения эффективности противотуберкулезных препаратов при добавлении в схему лечения ИЭП на экспериментальных моделях у животных. Так авторы, изучавшие активность соединения SILA-421 в качестве компонента комплексной терапии, включающей изониазид, рифампицин и пиразинамид, констатировали отсутствие повышения терапевтической эффективности химиотерапии при моделировании туберкулезного процесса у мышей [190]. Группа исследователей, изучающих потенциал использования спектинамидов в комплексной противотуберкулезной терапии смогла доказать эффективность одного из представителей данного класса (соединение 1599) при моделировании острой туберкулезной инфекции у мышей. В то же время, в модели с хронической туберкулезной инфекцией повышение бактерицидной активности противотуберкулезных препаратов зарегистрировано не было [200].
Тем не менее, группа ученых из Китая и США в совместном исследовании показала, что верапамил повышает биодоступность бедаквилина и его антибактериальную активность в отношении M. tuberculosis в экспериментальной модели туберкулеза у мышей. Однако сами авторы отмечают, что достигнутый эффект вероятнее всего был связан именно с повышением биодостопности бедаквилина после перорального приема, а не с его воздействием на бактериальные ЭП [220]. Группа других исследователей смогла доказать потенцирование бактерицидной активности бедаквилина в сочетании с верапамилом в эксперименте на мышах, они также установили, что комбинированная терапия ассоциирована с меньшим числом лекарственно-устойчивых штаммов и более ранней бактерицидной активностью бедаквилина [221].
ПЕРСПЕКТИВЫ И ПРЕПЯТСТВИЯ КЛИНИЧЕСКОГО ИСПОЛЬЗОВАНИЯ ИЭП
В эпоху стремительного распространения множественной лекарственной устойчивости M. tuberculosis фармацевтическая индустрия катастрофически не успевает восполнять растущую потребность в новых противотуберкулезных препаратах. В тот же день, когда вновь созданное соединение появляется на рынке, начинается селекция лекарственно-устойчивых штаммов, и эту гонку человечеству никогда не выиграть. Использование ИЭП дает шанс использовать давно известные АБП, восстанавливая восприимчивость патогенов к ним [222]. Эта стратегия позволит экономить время, усилия и финансы, а клиницистам – использовать уже хорошо изученные АБП.
Одним из преимуществ ИЭП является чрезвычайно низкая частота генерации устойчивых штаммов. Таким образом, комбинация антибиотика и ИЭП эффективна не только для борьбы с уже устойчивыми бактериями, но также предотвращает дальнейшее развитие резистентности.
Однако необходимо отметить и препятствия, связанные с внедрением ИЭП в широкую клиническую практику, как научные, так административные и экономические.
Соединения растительного происхождения имеют сложную и громоздкую структуру, что затрудняет их синтез и масштабное производство, а синтетические молекулы зачастую характеризуются токсичностью, плохой растворимостью или низким уровнем проникновения в клетки. Терапия с использованием ИЭП является комбинированной, что ставит еще один вопрос о совместимости ИЭП и партнера-антибиотика. Для успешной терапевтической комбинации необходимо одновременное достижение высоких концентраций обоих препаратов в тканях органов-мишеней, но при этом не должно происходить потенцирования токсических эффектов [223]. Одним из примеров является совместное использования верапамила и кларитромицина, ведущее к развитию почечной недостаточности, гипотонии и возможному летальному исходу в связи с тем, что мишенью кларитромицина является цитохром, который отвечает за метаболизм верапамила. Совместное использование обоих препаратов может привести к накоплению верапамила в чрезвычайно токсичных концентрациях [224]. Другим примером может быть возможное потенцирование кардиотоксических эффектов при совместном использовании верапамила и бедаквилина, поскольку оба эти соединения ведут к удлинению интервала QT.
Однако основная проблема самих ИЭП, как терапевтических агентов, заключается в их мишенях. ЭП являются одним из механизмов формирования лекарственной устойчивости, но далеко не всегда это единственный механизм. Помимо эффлюкс-опосредованной резистентности существует ряд других путей, реализуемых, например, посредством возникновения точечных мутаций или формирования обходного метаболического пути [225]. Также необходимо учитывать тот факт, что потенцирование эффекта одного АБП в присутствии ИЭП не означает, что такой же эффект будет достигнут и для других АБП, даже если они экспортируются той же самой ЭП, они могут иметь разные сайты связывания [137]. Это значительно сужает спектр применения ИЭП, делая его специфичным для ограниченного числа соединений. При этом комбинированная терапия АБП + ИЭП становится индивидуализированной, что ставит под сомнение ее эффективность на популяционном уровне.
Другой проблемой, стоящей на пути широкого внедрения ИЭП в клиническую практику, является отсутствие достаточного количества доклинических и клинических данных, формирующих доказательную базу. Доступных в настоящее время публикаций об использовании ИЭП на моделях у животных очень мало, а данных об использовании у пациентов практически нет. Необходима огромная дополнительная работа, которая позволит вывести исследования ИЭП на новую ступень.
Хотя использование ИЭП в качестве терапевтических средств сопряжено с множеством сложных, в настоящее время не решенных вопросов, это никоим образом не должно влиять на понимание важности тех преимуществ, которые они имеют.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Marquez B. 2005. Bacterial efflux systems and efflux pumps inhibitors. Biochimie. 87, 1137–1147.
Blair J.M., Webber M.A., Baylay A.J., Ogbolu D.O., Piddock L.J. 2015. Molecular mechanisms of antibiotic resistance. Nat. Rev. Microbiol. 13 (1), 42–51.
Blair J.M., Richmond G.E., Piddock L.J. 2014. Multidrug efflux pumps in Gram-negative bacteria and their role in antibiotic resistance. Future Microbiol. 9 (10), 1165–1177.
Biswas S., Raoult D., Rolain J.-M. 2008. A bioinformatic approach to understanding antibiotic resistance in intracellular bacteria through whole genome analysis. Int. J. Antimicrob. Agents. 32, 207–220.
Li X.Z., Nikaido H. 2009. Efflux mediated resistance in bacteria. Drugs. 69 (12), 1555–1623.
Schindler B.D., Kaatz G.W. 2016. Multidrug efflux pumps of Gram-positive bacteria. Drug. Resist. Updat. 27, 1–13.
Sharma A., Gupta V.K., Pathania R. 2019. Efflux pump inhibitors for bacterial pathogens: From bench to bedside. Indian J. Med. Res. 149 (2), 129–145.
Сидоренко С.В., Тишков В.И. 2004. Молекулярные основы резистентности к антибиотикам. Усп. биол. химии. 44, 263–306.
Yamaguchi A., Nakashima R., Sakurai K. 2015. Structural basis of RND-type multidrug exporters. Front. Microbiol. 6, 1–19.
Venter H., Shilling R.A., Velamakanni S., Balakrishnan L., Van Veen H.W. 2003. An ABC transporter with a secondary-active multidrug translocator domain. Nature. 426 (6968), 866-870.
Chen C.J., Chin J.E., Ueda K., Clark D.P., Pastan I., Gottesman M.M., Roninson I.B. 1986. Internal duplication and homology with bacterial transport proteins in the mdr1 (P-glycoprotein) gene from multidrug-resistant human cells. Cell. 47 (3), 381–389.
Gerlach J.H., Kartner N., Bell D.R., Ling V. 1986. Multidrug resistance. Cancer. Surv. 5 (1), 25–46.
Lubelski J., Konings W.N., Driessen A.J. 2007. Distribution and physiology of ABC-type transporters contributing to multidrug resistance in bacteria. Microbiol. Mol. Biol. Rev. 71 (3), 463–476.
Braibant M., Gilot P., Content J. 2000. The ATP binding cassette (ABC) transport systems of Mycobacterium tuberculosis. FEMS Microbiol. Rev. 24 (4), 449–467.
Davidson A.L., Chen J. 2004. ATP-binding cassette transporters in bacteria. Annu. Rev. Biochem. 73, 241–268.
Bloise E., Ortiga-Carvalho T.M., Reis F.M., Lye S.J., Gibb W., Matthews S.G. 2016. ATP-binding cassette transporters in reproduction: A new frontier. Hum. Reprod. Update. 22 (2), 164–181.
Rees D.C., Johnson E., Lewinson O. 2009. ABC transporters: The power to change. Nat. Rev. Mol. Cell Biol. 10 (3), 218–227.
Zhihong X., Aiping Z.,Yufeng Y. 2014. ATP-binding cassette transporters and transmembrane transport in Mycobacterium tuberculosis – a review. Wei. Sheng. Wu. Xue. Bao. 54 (6), 608–615. https://pubmed.ncbi.nlm.nih.gov/25272808/
Reddy V.S., Shlykov M.A., Castillo R., Sun E.I., Saier Jr.M.H. 2012. The major facilitator superfamily (MFS) revisited. FEBS J. 279 (11), 2022–2035.
Law C.J., Maloney P.C., Wang D.N. 2008. Ins and outs of major facilitator superfamily antiporters. Annu. Rev. Microbiol. 62, 289–305.
Saier M.H. Jr., Beatty J.T., Goffeau A., Harley K.T., Heijne W.H., Huang S.C., Jack D.L., Jahn P.S., Lew K., Liu J., Pao S.S., Paulsen I.T., Tseng T.T., Virk P.S. 1999. The major facilitator superfamily. J. Mol. Microbiol. Biotechnol. 1, 257–279.
Brown S., Chang J.L., Sadee W., Babbitt P.C. 2003. A semiautomated approach to gene discovery through expressed sequence tag data mining: discovery of new human transporter genes. J. AAPS Pharm. Sci. 5, 1–18.
Abramson J., Smirnova I., Kasho V., Verner G., Kaback H.R., Iwata S. 2003. Structure and mechanism of the lactose permease of Escherichia coli. Science. 301 (5633), 610–615.
Kumar H., Kasho V., Smirnova I., Finer-Moore J.S., Kaback R.H., Stroud R.M. 2014. Structure of sugar-bound Lac Y. Proc. Natl. Acad. Sci. USA. 111 (5), 1784–1788.
Wisedchaisri G., Park M.S., Iadanza M., Zheng H., Gonen T. 2014. Proton-coupled sugar transport in the prototypical major facilitator superfamily protein XylE. Nat. Commun. 5 (1), 1–11.
Sun J., Bankston J.R., Payandeh J., Hinds T.R., Zagotta W.N., Zheng N. 2014. Crystal structure of the plant dual-affinity nitrate transporter NRT1.1. J. Nature. 507, 73–77.
Deng D., Xu C., Sun P., Wu J., Yan C., Hu M., Yan N. 2014. Crystal structure of the human glucose transporter GLUT1. Nature. 510, 121–125.
Henderson P.J.F. 1993. The 12-transmembrane helix transporters. Curr. Opin. Cell Biol. 5 (4), 708–721.
Neuberger A., Du D., Luisi B.F. 2018. Structure and mechanism of bacterial tripartite efflux pumps. Res. Microbiol. 169 (7–8), 401–413.
Hinchliffe P., Symmons M.F., Hughes C., Koronakis V. 2013. Structure and operation of bacterial tripartite pumps. Annu. Rev. Microbiol. 67, 221–242.
Paulsen I.T., Brown M.H., Skurray R.A. 1996. Proton-dependent multidrug efflux systems. Microbiol. Rev. 60, 575–608.
Zhang X.C., Zhao Y., Heng J., Jiang D. 2015. Energy coupling mechanisms of MFS transporters. Protein Sci. 24 (10), 1560–1579.
Levy S.B. 2002. Active efflux, a common mechanism for biocide and antibiotic resistance. J. Appl. Microbiol. 31, 65–71.
Kumar S., Lekshmi M., Parvathi A., Ojha M., Wenzel N., Varela M.F. 2020. Functional and structural roles of the major facilitator superfamily bacterial multidrug efflux pumps. Microorganisms. Microorganisms. 8 (2), 266.
Kumar S., He G., Kakarla P., Shrestha U., Ranjana K.C., Ranaweera I., Willmon T.M., Barr S.R., Hernandez A.J., Varela M.F. 2016. Bacterial multidrug efflux pumps of the major facilitator superfamily as targets for modulation. Infect. Disord. Drug. Targets. 16 (1), 28–43.
Jack D.L., Storms M.L., Tchieu J.H., Paulsen I.T., Saier M.H. 2000. A broad-specificity multidrug efflux pump requiring a pair of homologous SMR-type proteins. J. Bacteriology. 182 (8), 2311–2313.
Paulsen I.T., Skurray R.A., Tam R., Saier M.H. Turner Jr.R.J., Weiner J.H., Goldberg E.B., Grinius L.L. 1996. The SMR family: A novel family of multidrug efflux proteins involved with the efflux of lipophilic drugs. Mol. Microbiol. 19, 1167–1175.
Bay D.C., Rommens K.L., Turner R.J. 2008. Small multidrug resistance proteins: A multidrug transporter family that continues to grow. Biochim. Biophys. Acta. 1778 (9), 1814–1838.
He G.X., Zhang C., Crow R.R., Thorpe C., Chen H., Kumar S., Tsuchiya T., Varela M.F. 2011. SugE, a new member of the SMR family of transporters, contributes to antimicrobial resistance in Enterobacter cloacae. Antimicrob. Agents Chemother. 55 (8), 3954–3957.
Motohashi H., Inui K. 2013. Multidrug and toxin extrusion family SLC47: Physiological, pharmacokinetic and toxicokinetic importance of MATE1 and MATE2-K. Mol. Aspects Med. 34 (2–3), 661–668.
Kuroda T., Tsuchiya T. 2009. Multidrug efflux transporters in the MATE family. Biochim. Biophys. Acta. 1794 (5), 763–768.
Mishra M.N., Daniels L. 2013. Characterization of the MSMEG_2631 gene (mmp) encoding a multidrug and toxic compound extrusion (MATE) family protein in Mycobacterium smegmatis and exploration of its polyspecific nature using biolog phenotype microarray. J. Bacteriol. 195 (7), 1610–1621.
Koronakis V., Eswaran J., Hughes C. 2004. Structure and function of TolC: The bacterial exit duct for proteins and drugs. Annu. Rev. Biochem. 73, 467–489.
Alvarez-Ortega C., Olivares J., Martínez J.L. 2013. RND multidrug efflux pumps: What are they good for? Front. Microbiol. 4, 7. https://doi.org/10.3389/fmicb.2013.00007
Blair J.M.A., Piddock L.J.V. 2016. How to measure export via bacterial multidrug resistance efflux pumps. mBio. 7 (4), e00840-16. https://doi.org/10.1128/mBio.00840-16
Guérin F., Lallement C., Isnard C., Dhalluin A., Cattoir V., Giard J.C. 2016. Landscape of resistance-nodulation- cell division (rnd)-type efflux pumps in Enterobacter cloacae complex. Antimicrob. Agents Chemother. 60 (4), 2373–2382.
Calgin M.K., Sahin F., Turegun B., Gerceker D., Atasever M., Koksal D., Kiyan M. 2013. Expression analysis of efflux pump genes among drug-susceptible and multidrug-resistant Mycobacterium tuberculosis clinical isolates and reference strains. Diagnost. Microbiol. Infect. Dis. 76 (3), 291–297.
Ren Q., Chen K., Paulsen I.T. 2007. Transport DB: A comprehensive database resource for cytoplasmic membrane transport systems and outer membrane channels. Nucleic Acids Res. 35 (1), 274–279.
Thanassi D.G., Cheng L.W., Nikaido H. 1997. Active efflux of bile salts by Escherichia coli. J. Bacteriol. 179, 2512–2518.
Elkins C.A., Nikaido H. 2002. Substrate specificity of the RND-type multidrug efflux pumps AcrB and AcrD of Escherichia coli is determined predominantly by two large periplasmic loops. J. Bacteriol. 184 (23), 6490–6498.
Tseng T.T., Gratwick K.S., Kollman J., Park D., Nies D.H., Goffeau A., Saier M.H. Jr. 1999. The RND permease superfamily: an ancient, ubiquitous and diverse family that includes human disease and development proteins. J. Mol. Microbiol. Biotechnol. 1 (1), 107–125.
Masuda N., Sakagawa E., Ohya S., Gotoh N., Tsujimoto H., Nishino T. 2000. Substrate specificities of MexAB-OprM, MexCD-OprJ, and MexXY-OprM efflux pumps in Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 44, 3322–3327.
Melly G., Purdy G.E. 2019. MmpL Proteins in physiology and pathogenesis of M. tuberculosis. Microorganisms. 7 (3), 70. https://doi.org/10.3390/microorganisms7030070
Hodgkinson J.T., Gross J., Baker Y.R., Spring D.R., Welch M. 2016. A new Pseudomonas quinolone signal (PQS) binding partner: MexG. J. Chem. Sci. 7, 2553–2562.
Minagawa S., Inami H., Kato T., Sawada S., Yasuki T., Miyairi S., Horikawa M., Okuda J., Gotoh N. 2012. RND-type efflux pump system MexAB-OprM of Pseudomonas aeruginosa selects bacterial languages, 3-oxo-acyl-homoserine lactones, for sell-to-cell communication. BMC Microbiol. 12, 70. https://doi.org/10.1186/1471-2180-12-70
Elbourne L.D., Tetu S., Hassan K., Paulsen I. 2017. Transport DB 2.0: A database for exploring membrane transporters in sequenced genomes from all domains of life. Nucleic Acids Res. 45, 320–324.
Duan W., Li X., Ge Y., Yu Z., Li P., Li J., Qin L., Xie J. 2019. Mycobacterium tuberculosis Rv1473 is a novel macrolides ABC efflux pump regulated by WhiB7. Future Microbiol. 14 (1), 47–59.
Silva P.E.A., Von Groll A., Martin A., Palomino J.C. 2011. Efflux as a mechanism for drug resistance in Mycobacterium tuberculosis. FEMS Immunol. Med. Microbiol. 63 (1), 1–9.
Lingjun Z., Wang J., Wang L., Qin C. 2020. The correlation of drug resistance and virulence in Mycobacterium tuberculosis. Biosaf. Health. 2 (1), 18–24.
Soni D.K., Dubey S.K., Bhatnagar R. 2020. ATP-binding cassette (ABC) import systems of Mycobacterium tuberculosis: Target for drug and vaccine development. Emerg. Microbes Infect. 9(1), 207–220.
Cassio Barreto de Oliveira M., Balan A. 2020 The ATP-Binding Cassette (ABC) transport systems in Mycobacterium tuberculosis: structure, function, and possible targets for therapeutics. Biology (Basel). 9 (12), 443. https://doi.org/10.3390/biology9120443
Jackson M., Stevens C. M., Zhang L., Zgurskaya H. I., Niederweis M. 2021. Transporters involved in the biogenesis and functionalization of the mycobacterial cell envelope chemical. Chem Rev. 121 (9), 5124–5157.
Glass L.N., Swapna G., Chavadi S.S., Tufariello J.M., Mi K., Drumm J.E., Chan J. 2017. Mycobacterium tuberculosis universal stress protein Rv2623 interacts with the putative ATP binding cassette (ABC) transporter Rv1747 to regulate mycobacterial growth. PLoS Pathog. 13 (7), e1006515. https://doi.org/10.1371/journal.ppat.1006515
Lin Y., Dong Y., Gao Y., Shi R., Li Y., Zhou X., Liu W., Li G., Qi Y., Wu Y. 2021. Identification of CTL epitopes on efflux pumps of the atp-binding cassette and the major facilitator superfamily of Mycobacterium tuberculosis. J. Immunol. Res. 2021, 8899674. https://doi.org/10.1155/2021/8899674
Van Veen H.W., Konings W.N. 1997. Multidrug transporters from bacteria to man: Similarities in structure and function. Semin. Cancer Biol. 8, 183–191.
Bapna A., Federici L., Venter H., Velamakanni S., Luisi B., Fan T.-P., van Veen H.W. 2007. Two proton translocation pathways in a secondary active multidrug transporter. J. Mol. Microbiol. Biotechnol. 12, 197–209.
Mazurkiewicz P., Poelarends G.J., Driessen A.J., Konings W.N. 2004. Facilitated drug influx by an energy-uncoupled secondary multidrug transporter. J. Biol. Chem. 279, 103–108.
Umar F., Hatta M., Husain D.R., Natzir R., Dwiyanti R., Junita A.R., Primaguna M.R. 2019. The effect of anti-tuberculosis drugs therapy on mRNA efflux pump gene expression of Rv1250 in Mycobacterium tuberculosis collected from tuberculosis patients. J. New Microbes New Infect. 32, 100609. https://doi.org/10.1016/j.nmni.2019.100609
Li J., Bai X., Liang Y., Zhang J., Yang Y., Zhao W., Wu X. 2015. Prediction of epitopes of Rv1410c Mycobacterium tuberculosis protein using DNA Star software. Xi. Bao. Yu. Fen. Zi. Mian. Yi. Xue. Za. Zhi. 31 (4), 474–477.
Cox J.S., Chen B., McNeil M., Jacobs W.R.Jr. 1999. Complex lipid determines tissue-specific replication of Mycobacterium tuberculosis in mice. Nature. 402, 79–83.
Converse S.E., Mougous J., Leavell M., Leary J., Bertozzi C., Cox J. 2003. MmpL8 is required for sulfolipid-1 biosynthesis and Mycobacterium tuberculosis virulence. Proc. Natl. Acad. Sci. USA. 100, 6121–6126.
Domenech P., Reed M., Barry C. 2005. Contribution of the Mycobacterium tuberculosis MmpL protein family to virulence and drug resistance. Infect. Immun. 73, 3492–3501.
Grzegorzewicz A.E., Pham H., Gundi V., Scherman M., North E., Hess T. Jones V. Gruppo V., Born S.E.M., Korduláková J., Chavadi S.S., Morisseau Ch., Lenaerts A.J., Lee E.R., McNeil M.R., Jackson M. 2012. Inhibition of mycolic acid transport across the Mycobacterium tuberculosis plasma membrane. Nat. Chem. Biol. 8, 334–341.
Rodríguez J.E., Ramírez A., Salas L., Helguera-Repetto C., Gonzalez-y-Merchand J., Soto C., Hernández-Pando R. 2013. Transcription of genes involved in sulfolipid and polyacyltrehalose biosynthesis of Mycobacterium tuberculosis in experimental latent tuberculosis infection. PLoS One. 8 (3), e58378. https://doi.org/10.1371/journal.pone.0058378
Radhakrishnan A., Kumar N., Wright C.C., Chou T.H. Bolla J.R., Tringides M.L., Reddy Bolla J., Hsiang-Ting L., Kanagalaghatta R., Rajashankar Ch.-Ch., Purdy G.E., Yu E.W. 2014. Crystal structure of the transcriptional regulator Rv0678 of Mycobacterium tuberculosis. J. Biol. Chem. 289 (23), 16 526–16 540.
Delmar J., Chou T., Wright C., Licon M., Doh J., Radhakrishnan A., Kumar N., Hsiang-Ting L., Reddy Bolla J., Kanagalaghatta R., Rajashankar Ch.-Ch., Purdy G.E., Yu E.W. 2015. Structural basis for the regulation of the MmpL transporters of Mycobacterium tuberculosis. J. Biol. Chem. 290 (47), 28559–28574.
Li W., Upadhyay A., Fontes F., North E., Wang Y., Crans D. Grzegorzewicz A.E., Jones V., Franzblau S.G., Lee R.E., Crick D.C., Jackson M. 2014. Novel insights into the mechanism of inhibition of MmpL3, a target of multiple pharmacophores in Mycobacterium tuberculosis. Antimicrob. Agent. Chemother. 58 (11), 6413–6423.
Milano A., Pasca M., Provvedi R., Lucarelli A., Manina G., Ribeiro A., Manganellic R., Riccardia G. 2009. Azole resistance in Mycobacterium tuberculosis is mediated by the MmpS5-MmpL5 efflux system. Tuberculosis (Edinb). 89 (1), 84–90.
Andries K., Villellas C., Coeck N., Thys K., Gevers T., Vranckx L., Lounis N., Bouke C. de J., Koul A. 2014. Acquired resistance of Mycobacterium tuberculosis to bedaquiline. PLoS One. 9 (7), e102135. https://doi.org/10.1371/journal.pone.0102135
Pasca M.R., Guglierame P., De Rossi E., Zara F., Riccardi G. 2005. mmpL7 gene of Mycobacterium tuberculosis is responsible for isoniazid efflux in Mycobacterium smegmatis. Antimicrob. Agents Chemother. 49 (11), 4775–4777.
Machado D., Lecorche E., Mougari F., Cambau E., Viveiros M. 2018. Insights on Mycobacterium leprae efflux pumps and their implications in drug resistance and virulence. Front. Microbiol. 9, 3072.
Kapopoulou A., Lew J., Cole S. 2011. The MycoBrowser portal: A comprehensive and manually annotated resource for mycobacterial genomes. Tuberculosis (Edinb). 91 (1), 8–13.
Bolla J.R., Do S., Long F., Dai L., Su C., Lei H., Chen X., Gerkey J.E., Murphy D.C., Kanagalaghatta R., Zhang Q., Yu E.W. 2012. Structural and functional analysis of the transcriptional regulator Rv3066 of Mycobacterium tuberculosis. Nucleic Acids Res. 40 (18), 9340–9355.
Gupta A.K., Vishwa M.K., Devendra S.C., Rahul S., Mradula S., Krishnamurthy V., Vishnu D.S. 2010. Microarray analysis of efflux pump genes in multidrug-resistant Mycobacterium tuberculosis during stress induced by common anti-tuberculous. Microb. Drug Resist. 16 (1), 21–28.
Rempel S., Gati C., Nijland M., Thangaratnarajah C., Karyolaimos A., de Gier J.W., Guskov A., Slotboom D.J. 2020. A mycobacterial ABC transporter mediates the uptake of hydrophilic compounds. Nature. 580, 409–412.
Jiang X., Zhang W., Zhang Y., Gao F., Lu C., Zhang X., Wang H. 2008. Assessment of efflux pump gene expression in a clinical isolate Mycobacterium tuberculosis by real-time reverse transcription PCR. Microb. Drug Resist. 14 (1), 7–11.
Narang A., Garima K., Porwal S., Bhandekar A., Shrivastava K., Giri A., Sharma N.K., Bose M., Varma-Basil M. 2019. Potential impact of efflux pump genes in mediating rifampicin resistance in clinical isolates of Mycobacterium tuberculosis from India. PLoS One. 14 (9), e0223163. https://doi.org/10.1371/journal.pone.0223163
De Rossi E., Arrigo P., Bellinzoni M., da Silva P., Martin C., Ainsa J., Guglierame P., Riccardi G. 2002. The multidrug transporters belonging to major facilitator superfamily in Mycobacterium tuberculosis. Mol. Med. 8 (11), 714–724.
Danilchanka O., Mailaender C., Niederweis M. 2008. Identification of a novel multidrug efflux pump of Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 52 (7), 2503–2511.
Garima K., Pathak R., Tandon R., Rathor N., Sinha R., Bose M., Varma-Basil M. 2015. Differential expression of efflux pump genes of Mycobacterium tuberculosis in response to varied subinhibitory concentrations of antituberculosis agents. Tuberculosis (Edinb). 95 (2), 155–161.
Ramón-García S., Martín C., De Rossi E., Aínsa J.A. 2007. Contribution of the Rv2333c efflux pump (the Stp protein) from Mycobacterium tuberculosis to intrinsic antibiotic resistance in Mycobacterium bovis BCG. J. Antimicrob. Chemother. 59 (3), 544–547.
Khosravi A.D., Sirous M., Absalan Z., Tabandeh M.R., Savari M. 2019. Comparison of drrA and drrB efflux pump genes expression in drug-susceptible and-resistant Mycobacterium tuberculosis strains isolated from tuberculosis patients in Iran. Infect. Drug. Resist. 12, 3437–3444.
Gupta A.K., Chauhan D., Srivastava K., Das R., Batra S., Mittal M., Goswami P., Singhal N., Sharma V.D., Venkatesan K., Hasnain S.E., Katoch V.M. 2006. Estimation of efflux mediated multi-drug resistance and its correlation with expression levels of two major efflux pumps and mycobacterium. J. Commun. Dis. 38 (3), 246–254.
Srivastava S., Musuka S., Sherman C., Meek C., Leff R., Gumbo T. 2010. Efflux-pump-derived multiple drug resistance to ethambutol monotherapy in Mycobacterium tuberculosis and the pharmacokinetics and pharmacodynamics of ethambutol. J. Infect. Dis. 201 (8), 1225–1231.
Brandis G., Hughes D. 2013. Genetic characterization of compensatory evolution in strains carrying rpoB Ser531Leu, the rifampicin resistance mutation most frequently found in clinical isolates. J. Antimicrob. Chemother. 68 (11), 2493–2497.
Lu J., Liu M., Wang Y., Pang Y., Zhao Z. 2014. Mechanisms of fluoroquinolone monoresistance in Mycobacterium tuberculosis. FEMS Microbiol. Lett. 353 (1), 40–48.
Daniel J., Abraham L., Martin A., Pablo X., Reyes S. 2018. Rv2477c is an antibiotic-sensitive manganese-dependent ABC-F ATPase in Mycobacterium tuberculosis. Biochem. Biophys. Res. Commun. 495 (1), 35–40.
Balganesh M., Kuruppath S., Marcel N., Sharma S., Nair A., Sharma U. 2010. Rv1218c, an ABC transporter of Mycobacterium tuberculosis with implications in drug discovery. J. Antimicrob. Agents. Chemother. 54, 5167–5172.
Dinesh N., Sharma S., Balganesh M. 2013. Involvement of efflux pumps in the resistance to peptidoglycan synthesis inhibitors in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 57, 1941–1943.
Balganesh M., Dinesh N., Sharma S., Kuruppath S., Nair A.V., Sharma U. 2012. Efflux pumps of Mycobacterium tuberculosis play a significant role in antituberculosis activity of potential drug candidates. Antimicrob. Agents Chemother. 56, 2643–2651.
Sahin F., Kiyan M. 2017. The Roles of efflux systems in extensively drug-resistant Mycobacterium Tuberculosis. Turkish J. Mol. Biol. Biotech. 2, 71–81.
Zhang Y., Zhang J., Cui P., Zhang Y., Zhang W. 2017. Identification of novel efflux proteins Rv0191, Rv3756c, Rv3008, and Rv1667c involved in pyrazinamide resistance in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 61 (8), e00940-17. https://doi.org/10.1128/AAC.00940-17
Gomez C.A., Andreu N., Ferrer-Navarro M., Yero D., Gibert I. 2016. Triclosan-induced genes Rv1686c-Rv1687c and Rv3161c are not involved in triclosan resistance in Mycobacterium tuberculosis. Sci. Rep. 6, 26221. https://doi.org/10.1038/srep26221
Pang Y., Lu J., Wang Y., Song Y., Wang S., Zhao Y. 2013. Study of the rifampin monoresistance mechanism in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 57 (2), 893–900.
Pasca M.R., Guglierame P., Arcesi F., Bellinzoni M., De Rossi E., Riccardi G. 2004. Rv2686c-Rv2687c-Rv2688c, an ABC fluoroquinolone efflux pump in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 48 (3), 3175–3178.
Li G., Zhang J., Guo Q., Wei J., Jiang Y., Zhao X., Zhao L., Liu Z., Lu J., Wan K. 2015. Study of efflux pump gene expression in rifampicin-monoresistant Mycobacterium tuberculosis clinical isolates. J. Antibiot. (Tokyo). 68 (7), 431–435.
Ghajavand H., Kargarpour K.M., Khanipour S., Shahin P.D., Masoumi M., Jamnani F.R., Fateh A., Yaseri M., Siadat S. D., Vaziri F. 2019. Scrutinizing the drug resistance mechanism of multi- and extensively-drug resistant Mycobacterium tuberculosis: mutations versus efflux pumps. Antimicrob. Resist. Infect. Control. 8, 70. https://doi.org/10.1186/s13756-019-0516-4
Li X., Li P., Ruan C., Xie L.X., Gu Y., Li J., Yi Q., Lv X., Xie J. 2019. Mycobacterium tuberculosis Rv0191 is an efflux pump of major facilitator superfamily transporter regulated by Rv1353c. Arch. Biochem. Biophys. 30, 59–66.
Khanna A., Raj V.S., Tarai B., Sood R., Kumar P.P., Dilip J.U., Sharma P., Rattan A., Kulvinder S.S., Singh H. 2010. Emergence and molecular characterization of extensively drug-resistant Mycobacterium tuberculosis clinical isolates from the Delhi Region in India. Antimicrob. Agents Chemother. 54 (11), 4789–4793.
Pang Y., Lu J., Wang Y., Song Y., Wang S. Zhao Y. 2013. Study of the rifampin monoresistance mechanism in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 57 (2), 893–900.
Ioerger T.R., Koo S., No E.G., Chen X., Larsen M.H., Jacobs W.R., Jr., Pillay M., Sturm A.W., Sacchettini J.S. 2009. Genome analysis of multi- and extensively-drug-resistant tuberculosis from kwazulu-natal South Africa. PLoS One. 4 (11), e7778. https://doi.org/10.1371/journal.pone.0007778
Ramón-García S., Martín C., Aínsa J.A., de Rossi E. 2006. Characterization of tetracycline resistance mediated by the efflux pump Tap from Mycobacterium fortuitum. J. Antimicrob. Chemother. 57 (2), 252–259.
Ramón-García S., Mick V., Dainese E., Martin C., Thompson C., De Rossi E., Manganelli R., Aínsa J.A. 2012. Functional and genetic characterization of the Tap efflux pump in Mycobacterium bovis BCG. Antimicrob. Agents Chemother. 56 (4), 2074–2083.
Machado D., Couto I., Perdigao J., Rodrigues L., Portugal I., Baptista P., Veigas B., Amaral L., Viveiros M. 2012. Contribution of efflux to the emergence of isoniazid and multidrug resistance in Mycobacterium tuberculosis. PLoS One. 7 (4), e34538. https://doi.org/10.1371/journal.pone.0034538
Liu J., Shi W., Zhang S., Hao X., Maslov D.A., Shur K.V., Bekker O.B., Danilenko V.N., Zhang Y. 2019. Mutations in efflux pump Rv1258c (Tap) cause resistance to pyrazinamide, isoniazid, and streptomycin in M. tuberculosis. Front. Microbiol. 10, 216. https://doi.org/10.3389/fmicb.2019.00216
Machado D., Coelho T., Perdigão J., Pereira C., Couto I., Portugal I., Maschmann R. De A., Ramos D.F., von Groll A., Rossetti M.L.R., Silva P.A., Viveiros M. 2017. Interplay between mutations and efflux in drug resistant clinical isolates of Mycobacterium tuberculosis. Front. Microbiol. 8, 711. https://doi.org/10.3389/fmicb.2017.00711
Silva P.E. A., Bigi F., de la Paz Santangelo M., Romano M.I., Martin C., Cataldi A., Ainsa J.A. 2001. Characterization of P55, a multidrug efflux pump in Mycobacterium bovis and Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 45 (3), 800–804.
Ramón-García S., Martín C., Thompson C.J., Aínsa J.A. 2009. Role of the Mycobacterium tuberculosis P55 efflux pump in intrinsic drug resistance, oxidative stress responses, and growth. Antimicrob. Agents Chemother. 53 (9), 3675-82. https://doi.org/10.1128/AAC.00550-09
Bianco M.V., Blanco F.C., Imperiale B., Forrellad M.A., Rocha R.V., Klepp L.I., Cataldi A.A., Morcillo N., Bigi F. 2011b. Role of P27–P55 operon from Mycobacterium tuberculosis in the resistance to toxic compounds. BMC Infect. Dis. 11, 195. https://doi.org/10.1186/1471-2334-11-195
Harris K.K., Fay A., Yan G.H., Kunwar P., Socci N.D., Pottabathini N., Juventhala R.R., Djaballah H., Glickman M.S. 2014. Novel imidazoline antimicrobial scaffold that inhibits DNA replication with activity against mycobacteria and drug resistant Gram-positive cocci. ACS Chem. Biol. 9 (11), 2572–2583.
Li X.Z., Zhang L., Nikaido H. 2004. Efflux pump-mediated intrinsic drug resistance in Mycobacterium smegmatis. Antimicrob. Agents Chemother. 48 (7), 2415–2423.
Louw G.E., Warren R., van Pittius N., Leon R., Jimenez A., Hernandez-Pando R., Ch. R.E. McEvoy, Grobbelaar M., Murray M., van Helden P.D., Victor T.C. 2011. Rifampicin reduces susceptibility to ofloxacin in rifampicin-resistant Mycobacterium tuberculosis through efflux. Am. J. Respir. Crit. Care Med. 184 (2), 269–276.
Kanji A., Hasan R., Ali A., Zaver A., Zhang Y., Imtiaz K., Shi W., Clark T.G., McNerney R., Phelan J., Rao S., Shafiq S., Hasan Z. 2017. Single nucleotide polymorphisms in efflux pumps genes in extensively drug resistant Mycobacterium tuberculosis isolates from Pakistan. Tuberculosis (Edinb). 107, 20–30.
Black P.A., Warren R.M., Louw G.E., van Helden P.D., Victor T.C., Kana B.D. 2014. Energy metabolism and drug efflux in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 58 (5), 249–2503.
Gupta A.K., Reddy V.P., Lavania M., Chauhan D., Venkatesan K., Sharma V., Tyagi A., Katoch V. 2010. JefA (Rv2459), a drug efflux gene in Mycobacterium tuberculosis confers resistance to isoniazid and ethambutol. Indian. Med. Res. 132, 176–188.
Gupta A.K., Katoch V.M., Chauhan D.S., Sharma R., Singh M., Venkatesan K., Sharma V.D. 2010. Microarray analysis of efflux pump genes in multidrug-resistant Mycobacterium tuberculosis during stress induced by common anti-tuberculous drugs. Microb. Drug Resist. 16 (1), 21–28.
Machado D., Coelho T., Perdigão J., Pereira C., Couto I., Portugal I., Maschmann R. De A., Ramos D.F., von Groll A., Rossetti M.L.R., Silva P.A., Viveiros M. 2017. Interplay between mutations and efflux in drug resistant clinical isolates of Mycobacterium tuberculosis. Front. Microbiol. 8, 711. https://doi.org/10.3389/fmicb.2017.00711
Doran J.L., Pang Y., Mdluli K., Moran A., Victor T., Stokes R., Mahenthiralingam E., Kreiswirth B.N., Butt J.L., Baron G.S., Treit J.D., Kerr V.J., van Helden P.D., Roberts M. C., Nano F.E. 1997. Mycobacterium tuberculosis efpA encodes an efflux protein of the QacA transporter family. Clin. Diagn. Lab. Immunol. 4, 23–32.
La Rosa V., Poce G., Canseco J.O., Buroni S., Pasca M.R., Biava M. Ravikiran M.R., Porretta G.C., Alfonso S., Battilocchio C., Babak J., Sorrentino F., Ioerger T.R., Sacchettini J.C., Manetti F., Botta M., De Logu A., Rubin E.J., de Rossi E. 2012. MmpL3 is the cellular target of the antitubercular pyrrole derivative BM212. Antimicrob. Agents Chemother. 56 (1), 324–331.
De Knegt G. J., Bruning O., Marian T., de Jong M., van Belkum A., Endtz H.P., BreitbIrma T. M., Bakker-Woudenberga A.J.M., de Steenwinkela J.E.M. 2013. Rifampicin-induced transcriptome response in rifampicin-resistant Mycobacterium tuberculosis. Tuberculosis (Edinb). 93 (1), 96–101.
Wells R.M., Jones C., Xi Z., Speer A., Danilchanka O., Doornbos K., Sun P., Fangming W., Changlin T., Niederweis M. 2013. Discovery of a siderophore export system essential for virulence of Mycobacterium tuberculosis. PLoS Pathog. 9 (1), e1003120.
Hartkoorn R.C., Uplekar S., Cole S. 2014. Cross-resistance between clofazimine and bedaquiline through upregulation of MmpL5 in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 58 (5), 2979–2981.
Choudhuri B.S., Sen S., Chakrabarti P. 1999. Isoniazid accumulation in Mycobacterium smegmatis is modulated by proton motive force-driven and ATP-dependent extrusion systems. Biochem. Biophys. Res. Commun. 256, 682–684.
Domenech P., Reed M., Dowd C., Manca C., Kaplan G., Barry C. 2004. The role of MmpL8 in sulfatide biogenesis and virulence of Mycobacterium tuberculosis. Biol. Chem. 279, 21257–21265.
Rodrigues L., Villellas C., Bailo R., Viveiros M., Ainsa J. 2013. Role of the Mmr efflux pump in drug resistance in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 57 (2), 751–757.
Bhardwaj A.K., Mohanty P. 2012. Bacterial efflux pumps involved in multidrug resistance and their inhibitors: rejuvinating the antimicrobial chemotherapy. Recent. Pat. Antiinfect. Drug Discov. 7 (1), 73–89.
Lomovskaya O., Warren M.S., Lee A., Galazzo J., Fronko R., Lee M., Blais J., Cho D., Chamberland S., Renau T., Leger R., Hecker S., Watkins W., Hoshino K., Ishida H., Lee V.J. 2001. Identification and characterization of inhibitors of multidrug resistance efflux pumps in Pseudomonas aeruginosa: Novel agents for combination therapy. Antimicrob. Agents Chemother. 45 (1), 105–116.
Bhattacharyya T., Sharma A., Akhter J., Pathania R. 2017. The small molecule IITR08027 restores the antibacterial activity of fluoroquinolones against multidrug-resistant Acinetobacter baumannii by efflux inhibition. Int. J. Antimicrob. Agents. 50 (2), 219 –226.
Anoushiravani M., Falsafi T., Niknam V. 2009. Proton motive force-dependent efflux of tetracycline in clinical isolates of Helicobacter pylori. J. Med. Microbiol. 58 (10), 1309–1313.
Osei S.J., Amoako D.G. 2017. Carbonyl cyanide m-chlorophenylhydrazine (CCCP) reverses resistance to colistin, but not to carbapenems and tigecycline in multidrug-resistant Enterobacteriaceae. Front Microbiol. 8, 228. https://doi.org/10.3389/fmicb.2017.00228
Gupta S., Cohen K.A., Winglee K., Maiga M., Diarra B., Bishai W.R. 2014. Efflux inhibition with verapamil potentiates bedaquiline in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 58 (1), 574–576.
Singh M., Jadaun G.P., Srivastava K., Chauhan V., Mishra R., Gupta K., Nair S., Chauhan D.S., Sharma V.D., Venkatesan K., Katoch V.M. 2011. Effect of efflux pump inhibitors on drug susceptibility of ofloxacin resistant Mycobacterium tuberculosis isolates. Indian. J. Med. Res. 133 (5), 535–540.
Radchenko M., Symersky J., Nie R., Lu M. 2015. Structural basis for the blockade of MATE multidrug efflux pumps. Nat. Commun. 6, 7995. https://doi.org/10.1038/ncomms8995
Bohnert J.A., Kern W.V. 2005. Selected arylpiperazines are capable of reversing multidrug resistance in Escherichia coli overexpressing RND efflux pumps. Antimicrob. Agents Chemother. 49 (2), 849–852.
Vargiu A.V., Ruggerone P., Opperman T.J., Nguyen S.T., Nikaido H. 2014. Molecular mechanism of MBX2319 inhibition of Escherichia coli AcrB multidrug efflux pump and comparison with other inhibitors. Antimicrob. Agents Chemother. 58 (10), 6224–6234.
Stavri M., Piddock L.J., Gibbons S. 2007. Bacterial efflux pump inhibitors from natural sources. J. Antimicrob. Chemother. 59 (6), 1247–1260.
Gibbons S., Oluwatuyi M., Kaatz G.W. 2003. A novel inhibitor of multidrug efflux pumps in Staphylococcus aureus. J. Antimicrob. Chemother. 51 (1), 13–17.
Gibbons S., Udo E.E. 2000. The effect of reserpine, a modulator of multidrug efflux pumps, on the in vitro activity of tetracycline against clinical isolates of methicillin resistant Staphylococcus aureus (MRSA) possessing the tet(K) determinant. Phytother. Res. 14 (2), 139–140.
Viveiros M., Portugal I., Bettencourt R., Victor T.C., Jordaan A.M., Leandro C., Ordway D., Amaral L. 2002. Isoniazid-induced transient high-level resistance in Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 46 (9), 2804–2810.
Pfeifer H.J., Greenblatt D.K., Koch-Wester J. 1976. Clinical toxicity of reserpine in hospitalized patients: A report from the Boston collaborative drug surveillance program. Am. J. Med. Sci. 271 (3), 269–276.
Kumar A., Khan I.A., Koul S., Koul J.L., Taneja S.C., Ali I., Sharma S., Kumar Z.M.M., Sangwan P.L., Gupta P., Thota N., Ghulam N.Q. 2008. Novel structural analogues of piperine as inhibitors of the NorA efflux pump of Staphylococcus aureus. J. Antimicrob. Chemother. 61 (6), 1270–1276.
Sharma S., Kumar M., Sharma S., Nargotra A., Koul S., Khan I.A. 2010. Piperine as an inhibitor of Rv1258c, a putative multidrug efflux pump of Mycobacterium tuberculosis. J. Antimicrob. Chemother. 65 (8), 1694–1701.
Sharma S., Kalia N.P., Suden P., Chauhan P.S., Kumar M., Ram A.B., Khajuriab A., Banib S., AliKhana I. 2014. Protective efficacy of piperine against Mycobacterium tuberculosis. Tuberculosis (Edinb). 94, 389–396.
Chan B.C., Ip M., Lau C.B., Lui S.L, Jolivalt C., Ganem-Elbaz C., Litaudong N.M.E., Gongh R.H., Raymond H., Seeh K.P., Leungad P.C. 2011. Synergistic effects of baicalein with ciprofloxacin against NorA over-expressed methicillin-resistant Staphylococcus aureus (MRSA) and inhibition of MRSA pyruvate kinase. J. Ethnopharmacol. 137, 767–773.
Fujita M., Shiota S., Kuroda T., Hatano T., Yoshida T., Mizushima T., Tomofusa T. 2005. Remarkable synergies between baicalein and tetracycline, and baicalein and beta-lactams against methicillin-resistant Staphylococcus aureus. Microbiol. Immunol. 49 (4), 391–396.
Stermitz F.R., Lorenz P., Tawara J.N., Zenewicz L.A., Lewis K. 2000. Synergy in a medicinal plant: Antimicrobial action of berberine potentiated by 5'-methoxyhydnocarpin, a multidrug pump inhibitor. Proc. Natl. Acad. Sci. USA. 97, 1433–1437.
Morel C., Stermitz F.R., Tegos G., Lewis K. 2003. Isoflavones as potentiators of antibacterial activity. J. Agric. Food Chem. 51 (19), 5677–5679.
Gibbons S., Moser E., Kaatz G.W. 2004. Catechin gallates inhibit multidrug resistance (MDR) in Staphylococcus aureus. Planta Med. 70 (12), 1240–1242.
Sudano Roccaro A., Blanco A.R., Giuliano F., Rusciano D., Enea V. 2004. Epigallocatechin-gallate enhances the activity of tetracycline in staphylococci by inhibiting its efflux from bacterial cells. Antimicrob. Agents Chemother. 48 (6), 1968–1973.
Oluwatuyi M., Kaatz G.W., Gibbons S. 2004. Antibacterial and resistance modifying activity of Rosmarinus officinalis. Phytochemistry. 65 (24), 3249–3254.
Lorenzi V., Muselli A., Bernardini A.F., Berti L., Pagès J.M., Amaral L., Bolla J.-M. 2009. Geraniol restores antibiotic activities against multidrug-resistant isolates from Gram-negative species. Antimicrob. Agents Chemother. 53 (5), 2209–2211.
Vargiu A.V., Nikaido H. 2012. Multidrug binding properties of the AcrB efflux pump characterized by molecular dynamics simulations. Proc. Natl. Acad. Sci. USA. 109, 20637–20642.
Opperman T.J., Nguyen S.T. 2015. Recent advances toward a molecular mechanism of efflux pump inhibition. Front. Microbiol. 6, 421. https://doi.org/10.3389/fmicb.2015.00421
Chevalier J., Atifi S., Eyraud A., Mahamoud A., Barbe J., Pagès J.M. 2001. New pyridoquinoline derivatives as potential inhibitors of the fluoroquinolone efflux pump in resistant Enterobacter aerogenes strains. J. Med. Chem. 44 (23), 4023–4026.
Pradel E., Pagès J.M. 2002. The AcrAB-tolC efflux pump contributes to multidrug resistance in the nosocomial pathogen Enterobacter aerogenes. Antimicrob Agents Chemother. 46 (8), 2640–2643.
Sabatini S., Gosetto F., Manfroni G., Tabarrini O., Kaatz G.W., Patel D., Cecchetti V. 2011. Evolution from a natural flavones nucleus to obtain 2-(4-propoxyphenyl) quinoline derivatives as potent inhibitors of the S. aureus NorA efflux pump. J. Med. Chem. 54 (16), 5722–5736.
Thorarensen A., Presley-Bodnar A.L., Marotti K.R., Boyle T.P., Heckaman C.L., Bohanon M.J., Tomichc P.K., Zurenkob G.E., Sweeneyb M.T., Betty H.Y. 2001. 3-arylpiperidines as potentiators of existing antibacterial agents. Bioorg. Med. Chem. Lett. 11 (14), 1903–1906.
Kaatz G.W., Moudgal V.V., Seo S.M., Hansen J.B., Kristiansen J.E. 2003. Phenylpiperidine selective serotonin reuptake inhibitors interfere with multidrug efflux pump activity in Staphylococcus aureus. Int. J. Antimicrob. Agents. 22 (3), 254–261.
Mahmood H.Y., Jamshidi S., Sutton J.M., Rahman K.M. 2016. Current advances in developing inhibitors of bacterial multidrug efflux pumps. Curr. Med. Chem. 23 (10), 1062–1081.
Lee M.D., Galazzo J.L., Staley A.L., Lee J.C., Warren M.S., Fuernkranz H., Chamberland S., Lomovskaya O., Miller G.H. 2001. Microbial fermentation-derived inhibitors of efflux-pump-mediated drug resistance. Farmaco. 56 (1–2), 81–85.
Gupta S., Tyagi S., Almeida D.V., Maiga M.C., Ammerman N.C., Bishai W.R. 2013. Acceleration of tuberculosis treatment by adjunctive therapy with verapamil as an efflux inhibitor. Am. J. Respir. Crit. Care Med. 188 (5), 600–607.
Singh K., Kumar M., Pavadai E., Naran K., Warner D.F., Ruminski P.G., Chibale K. 2014. Synthesis of new verapamil analogues and their evaluation in combination with rifampicin against Mycobacterium tuberculosis and molecular docking studies in the binding site of efflux protein Rv1258c. Bioorg. Med. Chem. Lett. 24 (14), 2985–2990.
Adams K.N., Szumowski J.D., Ramakrishnan L. 2014. Verapamil and Its metabolite norverapamil, inhibit macrophage-induced, bacterial efflux pump-mediated tolerance to multiple anti-tubercular drugs. J. Infect. Dis. 210 (3), 456–466.
Roy S.K., Pahwa S., Nandanwar H., Jachak S.M. 2012. Phenylpropanoids of Alpinia galanga as efflux pump inhibitors in Mycobacterium smegmatis mc2 155. Fitoterapia. 83 (7), 1248–1255.
Adams K.N., Takaki K., Connolly L.E., Wiedenhoft H., Winglee K., Humbert O., Edelstein P.H., Cosma C.L., Ramakrishnan L. 2011. Drug tolerance in replicating mycobacteria mediated by a macrophage-induced efflux mechanism. Cell. 145 (1), 39–53.
Bakker E., Bühlmann P., Pretsch E. 1997. Carrier-based ion-selective electrodes and bulk optodes. 1. General characteristics. Chem. Rev. 97 (8), 3083–3132.
Bühlmann P., Pretsch E., Bakker E. 1998. Carrier-based ion-selective electrodes and bulk optodes. 2. Ionophores for potentiometric and optical sensors. Chem. Rev. 98 (4), 1593–1688.
Li G., Zhang J., Guo Q., Jiang Y., Wei J., Zhao L.L., Zhao X., Lu J., Wan K. 2015. Efflux pump gene expression in multidrug-resistant Mycobacterium tuberculosis clinical isolates. PLoS One. 10 (2), e0119013.
Rose L., Jenkins A.T. 2007. The effect of the ionophore valinomycin on biomimetic solid supported lipid DPPTE/EPC membranes. Bioelectrochemistry. 70 (2), 387–393.
Thompson M., Krull U.J. 1982. The electroanalytical response of the bilayer lipid membrane to valinomycin: membrane cholesterol content. Anal. Chim. Acta. 141, 33–47.
Zhang Y., Scorpio A., Nikaido H., Sun Z. 1999. Role of acid pH and deficient efflux of pyrazinoic acid in unique susceptibility of Mycobacterium tuberculosis to pyrazinamide. J. Bacteriol. 181 (7), 2044–2049.
Crowle A.J., Douvas G.S., May M.H. 1992. Chlorpromazine: a drug potentially useful for treating mycobacterial infections. Chemotherapy. 38 (6), 410–419.
Amaral L., Kristiansen J.E., Abebe L.S., Millett W. 1996. Inhibition of the respiration of multi-drug resistant clinical isolates of Mycobacterium tuberculosis by thioridazine: Potential use for initial therapy of freshly diagnosed tuberculosis. J. Antimicrob. Chemother. 38 (6), 1049–1053.
Bettencourt M.V., Bosne-David S., Amaral L. 2000. Comparative in vitro activity of phenothiazines against multidrug-resistant Mycobacterium tuberculosis. Int. J. Antimicrob. Agents. 16 (1), 69–71.
Ordway D., Viveiros M., Leandro C., Bettencourt R., Almeida J., Martins M., Jette E. K., Molnar J., Amaral L. 2003. Clinical concentrations of thioridazine kill intracellular multidrug-resistant Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 47 (3), 917–922.
Martins M., Schelz Z., Martins A., Molnar J., Hajös G., Riedl Z., Viveirosa M.I., Aki-Senerd Y.E., Amaral L. 2007. In vitro and ex vivo activity of thioridazine derivatives against Mycobacterium tuberculosis. Int. J. Antimicrob. Agents. 29 (3), 338–340.
Amaral L., Martins M., Viveiros M., Molnar J., Kristiansen J.E. 2008. Promising therapy of XDR-TB/MDR-TB with thioridazine an inhibitor of bacterial efflux pumps. Curr. Drug. Targets. 9 (9), 816–819.
Dutta N.K., Karakousis P.C. 2014. Thioridazine for treatment of tuberculosis: promises and pitfalls. Tuberculosis (Edinb). 94 (6), 708–711.
Martins M., Viveiros M., Ramos J., Couto I., Molnar J., Boeree M., Amaral L. 2009. SILA 421, an inhibitor of efflux pumps of cancer cells, enhances the killing of intracellular extensively drug-resistant tuberculosis (XDR-TB). Int. J. Antimicrob. Agents. 33 (5), 479–482.
De Knegt G.J., Bakker-Woudenberg I.A., van Soolingen D., Aarnoutse R., Boeree M.J., de Steenwinkel J.E. 2015. SILA-421 activity in vitro against rifampicin-susceptible and rifampicin-resistant Mycobacterium tuberculosis, and in vivo in a murine tuberculosis model. Int. J. Antimicrob. Agents. 46 (1), 66–72.
Simons S.O., Kristiansen J.E., Hajos G., van der Laan T., Molnár J., Boeree M.J., Ingen M., Jakko J., van Christensen J. B., Viveiros M., Riedl Z., Amaral L.S. 2013. Activity of the efflux pump inhibitor SILA 421 against drug-resistant tuberculosis. Int. J. Antimicrob. Agents. 41 (5), 488–489.
Bogatcheva E., Dubuisson T., Protopopova M., Einck L., Nacy C.A., Reddy V.M. 2011. Chemical modification of capuramycins to enhance antibacterial activity. J. Antimicrob. Chemother. 66 (3), 578–587.
Reddy V.M., Einck L., Nacy C.A. 2008. In vitro antimycobacterial activities of capuramycin analogues. Antimicrob. Agents Chemother. 52 (2), 719–721.
Siricilla S., Mitachi K., Wan B., Franzblau S.G., Kurosu M. 2015. Discovery of a capuramycin analog that kills nonreplicating Mycobacterium tuberculosis and its synergistic effects with translocase I inhibitors. J. Antibiot. (Tokyo). 68 (4), 271–278.
Wang Y., Siricilla S., Aleiwi B.A., Kurosu M. 2013. Improved synthesis of capuramycin and its analogues. Chemistry. 19 (41), 3847–3858.
Chollet A., Mori G., Menendez C., Rodriguez F., Fabing I., Pasca M.R., Madackif J., Kordulákováf J., Constantgh P., Quémardgh A., Bernardes-Génissoncd V., Baltasab C.L.M. 2015. Design, synthesis and evaluation of new GEQ derivatives as inhibitors of InhA enzyme and Mycobacterium tuberculosis growth. Eur. J. Med. Chem 101, 218–235.
Lee R.E., Hurdle J.G., Liu J., Bruhn D.F., Matt T., Scherman M.S., Vaddady P.K., Zhong Z., Qi J., Akbergenov R., Das S., Madhura D.B., Rathi C., Trivedi A., Villellas C., Lee R.B., Rakesh S.L.W., Sun D., McNeil M.R., Ainsa A.J., Boshoff H.I., Gonzalez-Juarrero M., Meibohm B., Böttger E.C., Lenaerts A.J. 2014. Spectinamides: a new class of semisynthetic antituberculosis agents that overcome native drug efflux. Nat. Med. 20 (2), 152–158.
Okandeji B.O., Greenwald D.M., Wroten J., Sello J.K. 2011. Synthesis and evaluation of inhibitors of bacterial drug efflux pumps of the major facilitator superfamily. Bioorg. Med. Chem. 19 (24), 7679–7689.
Vecchione J.J., Alexander B., Sello J.K. 2009. Two distinct major facilitator superfamily drug efflux pumps mediate chloramphenicol resistance in Streptomyces coelicolor. Antimicrob. Agents Chemother. 53 (11), 4673–4677.
Bruhn D.F., Scherman M.S., Liu J., Scherbakov D., Meibohm B., Böttger E.C., Lenaerts A.J., Lee R.E. 2015. In vitro and in vivo evaluation of synergism between anti-tubercular spectinamides and non-classical tuberculosis antibiotics. Sci. Rep. 5, 13985. https://doi.org/10.1038/srep13985
Rayasam G.V., Balganesh T.S. 2015. Exploring the potential of adjunct therapy in tuberculosis. Trends. Pharmacol. Sci. 36 (8), 506–513.
Amaral L., Martins M., Viveiros M. 2007. Enhanced killing of intracellular multidrug-resistant Mycobacterium tuberculosis by compounds that affect the activity of efflux pumps. J. Antimicrob. Chemother. 59 (6), 1237–1246.
Muramatsu Y., Miyakoshi S., Ogawa Y., Ohnuki T., Ishii M.M., Arai M., Takatsu T., Inukai M. 2003. Studies on novel bacterial translocase I inhibitors, A-500359s. II. Deaminocaprolactam derivatives of capuramycin: A-500359 E, F, H; M-1 and M-2. J. Antibiot. (Tokyo). 56 (3), 253–258.
Grossman T.H., Shoen C.M., Jones S.M., Jones P.L., Cynamon M.H., Locher C.P. 2015. The efflux pump inhibitor timcodar improves the potency of antimycobacterial agents. Antimicrob. Agents Chemother. 59 (3), 1534–1541.
Pule C.M., Sampson S.L., Warren R.M., Black P.A., van Helden P.D., Victor T.C., Louw G. E. 2016. Efflux pump inhibitors: targeting mycobacterial efflux systems to enhance TB therapy. J. Antimicrob. Chemother. 71 (1), 17–26.
Bhardwaj R.K., Glaeser H., Becquemont L., Klotz U., Gupta S.K., Fromm M.F. 2002. Piperine, a major constituent of black pepper, inhibits human P-glycoprotein and CYP3A4. J. Pharmacol. Exp. Ther. 302 (2), 43–73.
Jin J., Zhang J., Guo N., Feng H., Li L., Liang J., Kai S., Wu X., Wang X., Liu M., Deng X., Lu Y. 2011. The plant alkaloid piperine as a potential inhibitor of ethidium bromide efflux in Mycobacterium smegmatis. J. Med. Microbiol. 60 (2), 223–229.
Thai K.M., Ngo T.D., Phan T.V., Tran T.D., Nguyen N.V., Nguyen T.H., Minh-Tri L., Ngoc-Vinh N., Thien-Hai N. 2015. Virtual screening for novel Staphylococcus aureus NorA efflux pump inhibitors from natural products. Med. Chem. 11 (2), 135–155.
Yamasaki S., Nikaido E., Nakashima R., Sakurai K., Fujiwara D., Fujii I., Kunihiko N. 2013. The crystal structure of multidrug-resistance regulator RamR with multiple drugs. Nat. Commun. 4, 2078. https://doi.org/10.1038/ncomms3078
Suriyanarayanan B., Sarojini Santhosh R. 2015. Docking analysis insights quercetin can be a non-antibiotic adjuvant by inhibiting Mmr drug efflux pump in Mycobacterium sp. and its homologue EmrE in Escherichia coli. J. Biomol. Struct. Dyn. 33 (8), 1819–1834.
Dey D., Ray R., Hazra B. 2015. Antimicrobial activity of pomegranate fruit constituents against drug-resistant Mycobacterium tuberculosis and β-lactamase producing Klebsiella pneumoniae. Pharm. Biol. 53 (10), 1474–1480.
Shukla H., Kumar V., Singh A.K., Rastogi S., Khan S.R., Siddiqi M.I., Manju Y. K. Md., Sohail A. 2015. Isocitrate lyase of Mycobacterium tuberculosis is inhibited by quercetin through binding at N-terminus. Int. J. Biol. Macromol. 78, 137–141.
Sutter M.C., Wang Y.X. 1993. Recent cardiovascular drugs from Chinese medicinal plants. Cardiovasc Res. 27 (11), 1891–1901.
Zhang Z., Yan J., Xu K., Ji Z., Li L. 2015. Tetrandrine reverses drug resistance in isoniazid and ethambutol dual drug-resistant Mycobacterium tuberculosis clinical isolates. BMC Infect. Dis.15, 153. https://doi.org/10.1186/s12879-015-0905-0
Jin J., Zhang J.Y., Guo N., Sheng H., Li L., Liang J.C., Wang X.-L., Yang L., Liu M.-Y., Xiu-Ping W., Lu Y. 2010. Farnesol, a potential efflux pump inhibitor in Mycobacterium smegmatis. Molecules. 15 (11), 7750–7762.
Chen S., Huang H.Y., Cheng M.J., Wu C.C., Ishikawa T., Peng C.F., Hsun-Shou Ch., Chyi-Jia W., Ling W., Chenaf Sh. 2013. Neolignans and phenylpropanoids from the roots of Piper taiwanense and their antiplatelet and antitubercular activities. Phytochemistry. 93, 203–209.
Chinsembu K.C. 2016. Tuberculosis and nature’s pharmacy of putative anti-tuberculosis agents. Acta. Trop. 153, 46–56.
Chen S., Cheng M.J., Wu C.C., Peng C.F., Huang H.Y., Chang H.S., Wang C.-J., Ih.-Sh. Chen. 2014. Three new phenylpropanoids from the roots of Piper taiwanense and their inhibitory activities on platelet aggregation and Mycobacterium tuberculosis. Chem. Biodivers. 11 (5), 792–799.
Shiu W.K., Malkinson J.P., Rahman M.M., Curry J., Stapleton P., Gunaratnam M., Neidlea S., Mushtaqc S., Warnerc M., Dimitrios L., Basavannacharyae C., Bhaktae S., Schindlerf B.D., Seof S.M., Colemanf D., Kaatzfg G.W., Gibbonsa S. 2013. A new plant-derived antibacterial is an inhibitor of efflux pumps in Staphylococcus aureus. Int. J. Antimicrob. Agents. 42 (6), 513–518.
Xu J., Tasneen R., Peloquin C.A., Almeida D.V., Li S.-Y., Barnes-Boyle K., Lu Y., Nuermberger E. 2017. Verapamil increases the bioavailability and efficacy of bedaquiline but not clofazimine in a murine model of tuberculosis. Antimicrob. Agents Chemother. 62 (1), e01692-17. https://doi.org/10.1128/AAC.01692-17
Gupta S., Tyagi S., Bishai W.R. 2015. Verapamil increases the bactericidal activity of bedaquiline against Mycobacterium tuberculosis in a mouse model. Antimicrob. Agents Chemother. 59 (1), 673–676.
Kardan-Yamchi J., Kazemian H., Haeili M., Harati A.A., Amini S., Feizabadi M.M. 2018. Expression analysis of 10 efflux pump genes in multidrug-resistant and extensively drug-resistant Mycobacterium tuberculosis clinical isolates. J. Glob. Antimicrob. Resist. 17, 201–208.
Lomovskaya O., Bostian K.A. 2006. Practical applications and feasibility of efflux pump inhibitors in the clinic – A vision for applied use. Biochem. Pharmacol. 71 (7), 910–918.
Gandhi S., Fleet J.L., Bailey D.G., McArthur E., Wald R., Rehman F. 2013. Calcium-channel blocker-clarithromycin drug interactions and acute kidney injury. JAMA. 310 (23), 2544–2553.
Nakajima A., Sugimoto Y., Yoneyama H., Nakae T. 2002. High-level fluoroquinolone resistance in Pseudomonas aeruginosa due to interplay of the MexAB-oprM efflux pump and the DNA gyrase mutation. Microbiol. Immunol. 46 (6), 391–395.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


