Биологические мембраны: Журнал мембранной и клеточной биологии, 2021, T. 38, № 5, стр. 340-350
Особенности распределения трансмембранного белка TMEM-119 в микроглиоцитах коры головного мозга человека при формировании амилоидных бляшек
В. В. Гусельникова a, *, Е. А. Федорова a, А. Е. Сафрай b, А. А. Рукавишникова b, Д. Э. Коржевский a
a Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
b Первый Санкт-Петербургский государственный медицинский университет
имени академика И.П. Павлова Министерства здравоохранения Российской Федерации
197022 Санкт-Петербург, Россия
* E-mail: Guselnicova.Valeriia@yandex.ru
Поступила в редакцию 28.01.2021
После доработки 25.03.2021
Принята к публикации 26.03.2021
Аннотация
Трансмембранный белок 119 (TMEM-119) – охарактеризованный сравнительно недавно белок плазматической мембраны микроглиальных клеток с неизвестными функциями. Целью работы стало изучение особенностей распределения TMEM-119 в микроглиоцитах коры головного мозга человека при развитии патологии альцгеймеровского типа. Материалом для исследования служили образцы коры головного мозга людей (мужчин и женщин) в возрасте от 85 до 98 лет (n = 7) с наличием амилоидных бляшек. С применением методов световой и конфокальной лазерной микроскопии показано, что в условиях формирования амилоидных бляшек популяция микроглиоцитов характеризуется морфологической гетерогенностью при иммуноокрашивании на TMEM-119. Большинство клеток имеет выраженную дискретность распределения TMEM-119 в отростках, что придает последним характерный вид “бусин на нитке”. Часть микроглиоцитов коры вне амилоидных бляшек имеет признаки активации, такие как увеличение тела и утолщение отростков, которые утрачивают дискретность распределения TMEM-119, но приобретают нитевидные выросты – филоподии. В области амилоидных бляшек выявляются преимущественно отростки микроглиоцитов, которые плотно оплетают бляшку, частично заходя в нее и формируя интенсивно окрашенные утолщения в области центрального кора. Проявлением фагоцитарной активности микроглии является наличие “фагоцитарных мешочков”, обнаруженных на концах отростков клеток с помощью конфокальной лазерной микроскопии и метода трехмерной реконструкции. При иммунофлуоресцентном выявлении TMEM-119 эти структуры выглядят как булавовидные расширения, часто содержащие неокрашенную область в центре. С применением функции сверхвысокого разрешения Airyscan показано, что TMEM-119 присутствует в мембране тела и отростков микроглиоцитов в виде дискретных микроструктур. С использованием двойной иммунофлуоресцентной реакции на TMEM-119 и GFAP (маркерный белок астроглии) отмечено, что во всех исследованных образцах коры головного мозга присутствует астроглиальная реакция. Она выражается в накоплении GFAP в астроцитах, ассоциированных с амилоидными бляшками, и утолщении их отростков, что свидетельствует в пользу нейровоспалительной активации. Обнаруженная пространственная ассоциация реактивных астроцитов и активированных микроглиоцитов может быть морфологическим свидетельством сложного функционального взаимодействия этих клеток и их взаимного влияния, вносящего вклад в развитие нейровоспаления.
ВВЕДЕНИЕ
Микроглиальные клетки (или микроглия) – это особая популяция клеток центральной нервной системы (ЦНС), которые выполняют в ЦНС множество функций, связанных с поддержанием гомеостаза, развитием иммунного ответа и локального воспалительного процесса [1]. В настоящее время очевидна важная роль микроглии в регуляции состояния и работы нервной системы в норме и при патологии, в том числе при развитии нейродегенеративных заболеваний [2]. Результаты многочисленных исследований свидетельствуют о ключевой роли микроглии в патогенезе болезни Альцгеймера – хронического прогрессирующего нейродегенеративного заболевания, характерным гистопатологическим признаком которого является накопление в тканях головного мозга амилоидных (сенильных) бляшек. Сходные патоморфологические изменения могут наблюдаться в головном мозге человека при нормальном старении [3]. Формирование амилоидных бляшек как в ходе старения, так и при развитии болезни Альцгеймера сопровождается активацией микроглии, функции которой в этом случае остаются предметом дискуссий [4].
Одной из существенных проблем, возникающих при исследовании микроглии в условиях развития нейродегенерации, является правильная идентификация микроглиоцитов и корректная оценка их функционального статуса. Наиболее широко используемым иммуногистохимическим маркером микроглии сегодня остается кальций-связывающий белок Iba-1 (Iionized calcium-binding adapter molecule 1) [5, 6]. Недостатком этого маркера является то, что, помимо микроглии, Iba-1 присутствует также в тканевых макрофагах мозга – менингеальных макрофагах, периваскулярных макрофагах и макрофагах сосудистого сплетения, которые отличаются от микроглии происхождением и функциями [7]. При развитии патологии мозга и повреждении гемато-энцефалического барьера макрофаги мигрируют в очаг воспаления и способны привлекать в него циркулирующие моноциты, которые впоследствии дифференцируются в новые макрофаги, также экспрессирующие Iba-1. Это сильно затрудняет исследование микроглии в условиях развития патологии мозга, так как с помощью иммуногистохимического окрашивания на Iba-1 различить между собой клетки активированной (амебоидной) микроглии и моноциты/макрофаги не представляется возможным.
В 2016 г. был предложен новый высокоспецифичный микроглиальный маркер – TMEM-119 (transmembrane protein 119), представляющий собой трансмембранный белок с неизвестными функциями [8, 9]. В отличие от Iba-1, TMEM-119 входит в состав плазматической мембраны исключительно микроглиальных клеток и не синтезируется макрофагами или другими типами иммунных клеток, а также отсутствует в нервных клетках, астроцитах и олигодендроцитах. Это делает TMEM-119 удобным и надежным маркером для исследования микроглии в норме и при патологии [8, 9]. Целью представленной работы стало изучение особенностей распределения трансмембранного белка ТМЕМ-119 в микроглиоцитах коры головного мозга человека при развитии патологии альцгеймеровского типа.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования служили образцы коры головного мозга людей (мужчин и женщин) в возрасте от 85 до 98 лет (n = 7) с наличием амилоидных бляшек. Патоморфологическая диагностика болезни Альцгеймера в соответствии с рекомендациями Национального института старения и Альцгеймеровской ассоциации [10] не проводилась. Образцы были получены в результате аутопсии, зафиксированы в 10% забуференном формалине и залиты в парафин по стандартной методике. Парафиновые блоки получены из архива Отдела общей и частной морфологии ФГБНУ “ИЭМ”. На проведение исследования имеется разрешение локального этического комитета ФГБНУ “ИЭМ” (№ 3/18 от 22.11.2018 г). Иммуногистохимическое выявление TMEM-119 проводили с использованием кроличьих поликлональных антител против этого белка (Abcam, Великобритания). Для светооптического исследования препараты инкубировали в растворе первичных антител (разведение 1 : 1000) в течение 60 ч при температуре 27°С, после чего применяли вторичные антитела против иммуноглобулинов кролика, конъюгированные с пероксидазой хрена (из набора Reveal Polyvalent HPR DAB Detection System, SpringBioscience, США). Визуализацию продукта реакции осуществляли с помощью 3,3-диаминобензидина (DAB). Часть срезов подкрашивали альциановым синим (BioVitrum, Россия) в течение 20 мин при комнатной температуре.
Для постановки иммунофлуоресцентной монореакции на TMEM–119 после инкубации с первичными антителами (разведение 1 : 1000) и вторичными антителами, конъюгированными с пероксидазой хрена (из набора Reveal Polyvalent HPR DAB Detection System, SpringBioscience, разведение производителя), применяли антитела против пероксидазы хрена, конъюгированные с флуорохромом Cy3 (разведение 1 : 100, Jackson ImmunoResearch, США). Ядра клеток подкрашивали ядерным флуоресцентным красителем SYTOX Green (разведение 1 : 100, Invitrogen, США).
Для одновременного выявления микроглии и амилоидных бляшек ставили двойную иммунофлуоресцентную реакцию с использованием смеси (1 : 1) кроличьих поликлональных антител против TMEM-119 (разведение 1 : 500, Abcam) и мышиных моноклональных (клон DE2B4) антител против бета-амилоидного пептида (разведение 1 : 100, Abcam). Для одновременного выявления микроглии и астроцитов применяли смесь (1 : 1) кроличьих поликлональных антител против TMEM-119 (разведение 1 : 500, Abcam) и мышиных моноклональных (клон GA5) антител против глиального фибриллярного кислого белка (GFAP), являющегося маркером астроглии (разведение 1 : 100, Biocare Medical, США). В качестве вторичных реагентов использовали смесь (1 : 1) антител против иммуноглобулинов кролика, конъюгированных с пероксидазой хрена (из набора Reveal Polyvalent HPR DAB Detection System, SpringBioscience, разведение производителя), и биотинилированных антител против иммуноглобулинов мыши (разведение 1 : 100, Jackson ImmunoResearch). Для визуализации реакций на срезы наносили смесь (1 : 1) антител против пероксидазы хрена, конъюгированных с флуорохромом Cy3 (разведение 1 : 50, Jackson ImmunoResearch), и стрептавидина, конъюгированного с флуорохромом Cy2 (разведение 1 : 50, Jackson ImmunoResearch).
Анализ и фотографирование полученных препаратов проводили с использованием светового микроскопа Leica DM750 (Leica Microsystems, Германия) и конфокального лазерного микроскопа LSM800 с системой сверхвысокого разрешения Airyscan (Zeiss, Германия), а также компьютерных программ LAS EZ (Leica Microsystems) и ZEN2012 (Zeiss). Для возбуждения флуоресценции Cy2 и SYTOX Green применяли диодный лазер с длиной волны 488 нм, для Cy3 – диодный лазер с длиной волны 561 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При анализе полученных препаратов в проходящем свете было отмечено, что постановка иммунопероксидазной реакции на TMEM-119 позволяет селективно выявлять отростчатые клетки с морфологическими признаками микроглиоцитов (рис. 1). Было показало, что популяция микроглиоцитов в коре головного мозга человека при развитии патологии альцгеймеровского типа характеризуется морфологической гетерогенностью при иммуноокрашивании на TMEM-119. Для большинства выявленных клеток характерна выраженная дискретность распределения TMEM-119 в отростках (рис. 1а), которая отчетливо видна даже на малом увеличении микроскопа (×10). Отростки таких микроглиоцитов имеют вид “бусин на нитке” – они состоят из округлых темноокрашенных скоплений разного размера, соединенных более светлыми и тонкими участками (рис. 1а). Тела микроглиоцитов, попавшие в плоскость среза, характеризуются равномерной интенсивной окраской при реакции на TMEM-119. Иногда в центральной области тела клетки просматривается светлая зона – это место локализации ядра (рис. 1а, стрелка). На некоторых участках среза визуализируются только отростки микроглиоцитов. При этом не вполне понятно, от каких микроглиальных клеток они отходят, так как тела клеток не попадают в плоскость среза.
Рис. 1.
Микроглия коры головного мозга человека при патологии альцгеймеровского типа (световая микроскопия). Иммуногистохимическая реакция на TMEM-119 с подкраской альциановым синим. Покоящаяся микроглия (а) и микроглия с признаками активации (б) в участках коры, не содержащих амилоидных скоплений. в, г – Микроглия в области амилоидной бляшки. Стрелка указывает на тело микроглиоцита. Масштабный отрезок равен 50 мкм.
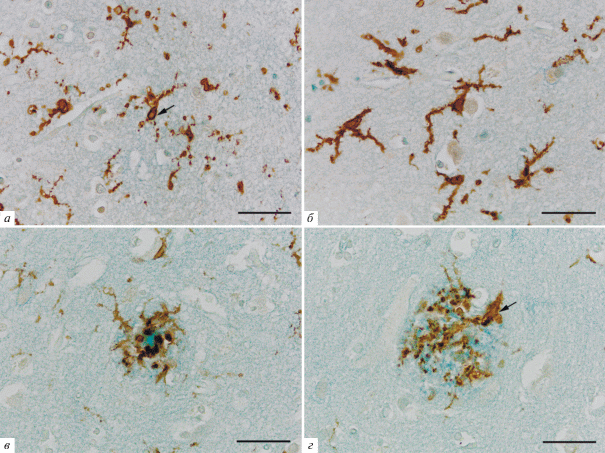
Ранее было показано, что при иммуноокрашивании на TMEM-119 микроглия с аналогичной морфологией преобладает в коре головного мозга людей без неврологических заболеваний [9]. Это позволяет сделать вывод, что описанная морфология соответствует рамифицированной (покоящейся) микроглии. Косвенно это подтверждается тем, что в участках коры, содержащих такой морфологический тип микроглии, нами не было обнаружено скоплений амилоида. Открытым остается вопрос о том, с чем связаны наблюдаемые особенности распределения продукта иммуногистохимической реакции на TMEM-119 в микроглиоцитах. Однородное окрашивание тела клеток, вероятно, обусловлено равномерным распределением и высокой плотностью молекул TMEM-119 в этой локализации. Морфологическая картина “бусин на нитке”, характерная для отростков этих клеток, может быть следствием концентрирования TMEM-119 в определенных участках мембраны отростков микроглиальных клеток. Возможно, TMEM-119 является одним из белков, ассоциированных с липидными рафтами, как это показано для некоторых других белков мембраны микроглиоцитов [11]. Вероятно, характер распределения TMEM-119 в мембране тел и отростков микроглиальных клеток определяется функциями этого белка, которые в настоящее время остаются неизвестными.
При дальнейшем анализе полученных препаратов было отмечено, что часть выявленных микроглиоцитов коры по морфологическим характеристикам отличается от описанных выше (рис. 1б). Размеры этих клеток визуально больше, тело увеличено, отростки длинные, утолщенные и умеренно ветвящиеся. На их поверхности присутствуют многочисленные нитевидные выросты – филоподии, которые придают отросткам характерный “мохнатый” вид (рис. 1б). И тела, и отростки выявленных микроглиоцитов характеризуются высокоинтенсивной окраской при постановке иммуногистохимической реакции на TMEM-119. Причем окраска отростков выглядит сплошной – дискретность распределения TMEM-119 (“бусины на нитке”) в данном случае не просматривается. Клетки с такой морфологией были выявлены в разных участках коры как поодиночке, так и в виде небольших скоплений (рис. 1б).
Утолщение отростков и увеличение размеров тела клетки являются известными признаками активации микроглии [5]. Филоподии, описанные ранее при проведении электронно-микроскопических исследований, необходимы микроглиоцитам для прикрепления к субстрату и последующей миграции, что также характерно для активированной микроглии [12–14]. Эти данные позволяют заключить, что выявленные нами микроглиальные клетки находятся в активированном состоянии. Классическим проявлением активации считается формирование амебоидной микроглии [5]. Описанные нами микроглиоциты не могут быть отнесены к такому типу клеток, так как имеют длинные ветвящиеся отростки. Возможно, они являются одной из переходных форм микроглии. Это согласуется с литературными данными, согласно которым активация и инактивация микроглии сопровождаются формированием разнообразных переходных форм микроглиальных клеток, имеющих по одному или по два утолщенных и в разной степени разветвленных отростка [6]. Такие микроглиоциты принято считать клетками с разной степенью активации. При этом связь между определенной морфологией и функциональной активностью микроглии остается не до конца изученной, поэтому судить о степени активации микроглии только по морфологическим признакам не представляется возможным [6].
Важно отметить, что скопления микроглиоцитов с признаками активации были выявлены в тех участках коры, где отсутствовали сформированные амилоидные бляшки (рис. 1б). Это указывает на то, что активация микроглии в данном случае происходит не напрямую (через непосредственный контакт клеток с фибриллами амилоида), а опосредованно (например, через сигнальные молекулы, синтезируемые другими клетками глии, или вследствие потери контактов микроглиоцитов с нейронами из-за гибели последних).
Подкраска альциановым синим, использованная нами после постановки иммуногистохимической реакции на TMEM-119, дает возможность идентифицировать скопления амилоида в коре. В данном случае они приобретают синее окрашивание за счет взаимодействия молекул красителя с полианионами кислых гликозамингликанов, которые вовлечены в процесс агрегации бета-амилоида в нерастворимые фибриллы [15]. При изучении участков коры, содержащих амилоидные бляшки, было отмечено, что для одних скоплений характерно наличие интенсивно окрашенной центральной области (кора) и волокнистого ореола, расположенного вокруг нее (рис. 1в). Другие скопления сформированы только волокнистыми структурами (без выраженной центральной области) (рис. 1г). Наблюдаемые морфологические различия связаны, вероятно, с различиями в плотности упаковки бета-амилоидных фибрилл, которая определяет разницу в количестве и плотности ассоциированных с этими фибриллами гликозамингликанов.
При анализе взаимного расположения микроглии и скоплений амилоида в коре головного мозга было отмечено, что в области амилоидных бляшек присутствуют крупные ТМЕМ-119-иммунопозитивные структуры (рис. 1в, 1г). В большинстве случаев эти структуры выглядят как сильно утолщенные и укороченные отростки микроглиальных клеток, тянущиеся в направлении амилоидной бляшки и окружающие ее по периферии. В центральной области бляшки отростки микроглиоцитов формируют крупные расширения, темноокрашенные в черно-коричневый цвет. Эти расширения заходят в область центрального кора, окружая его (рис. 1в). Интересным наблюдением стало то, что на препаратах, подкрашенных альциановым синим, те части отростков микроглиоцитов, которые непосредственно заходят в область центрального кора бляшки, выглядят значительно более темноокрашенными по сравнению с аналогичными участками на препаратах без подкраски альциановым синим. Это может объясняться тем, что краситель альциановый синий содержит в своем составе ионы меди, а медь, в свою очередь, является известным усилителем хромогена DAB, использованного в данном исследовании для визуализации продукта иммуногистохимической реакции. Добавление металла повышает осаждение продукта реакции DAB и придает осадку более темный цвет [16]. В тех случаях, когда у бляшки отсутствует выраженный центральный кор, продукт иммуногистохимической реакции выглядит более рассредоточенным – отростки микроглии оплетают волокнистый компонент бляшки наподобие клубка с формированием небольших варикозностей (рис. 1г).
Важно отметить, что при анализе препаратов различить тела клеток микроглии, отростки которых окружают амилоидные бляшки, удается лишь в единичных случаях. Иногда создается впечатление, что тело клетки присутствует на периферии бляшки, но имеет амебоидную форму (рис. 1г, стрелка), вследствие чего оно плохо различимо среди многочисленных плотно расположенных утолщенных отростков микроглии. В большинстве таких случаев выявить удается тело лишь одной клетки, в то время как иммунопозитивные отростки микроглиоцитов оплетают бляшку со всех сторон. Определить, от каких клеток эти отростки тянутся, не представляется возможным (рис. 1в, 1г).
Постановка иммунофлуоресцентной реакции на TMEM-119 и последующий анализ препаратов методом конфокальной лазерной микроскопии позволили более детально изучить особенности распределения этого белка в микроглиальных клетках. Как и в случае светооптического исследования, было отмечено присутствие в коре головного мозга человека двух морфологически различных типов микроглиальных клеток. Для большинства обнаруженных микроглиоцитов была характерна дискретность распределения TMEM-119 в отростках (рис. 2а, стрелка), что придавало им вид “бусин на нитке”, описанный при использовании светового микроскопа. Другие микроглиоциты характеризовались относительно равномерным распределением ТМЕМ-119 в теле и отростках (рис. 2б).
Рис. 2.
Микроглия коры головного мозга человека при патологии альцгеймеровского типа (конфокальная микроскопия). Иммунофлуоресцентная реакция на TMEM-119 (красная флуоресценция) с подкраской ядерным флуоресцентным красителем SYTOX Green (зеленая флуоресценция). Трехмерная реконструкция серии оптических срезов. Стрелка указывает на участок отростка микроглиоцита с выраженным дискретным распределением TMEM-119, головка стрелки – на фагоцитарный мешочек. Размер ячеек масштабной сетки составляет 20 × 20 мкм (а) и 10 × 10 мкм (б).
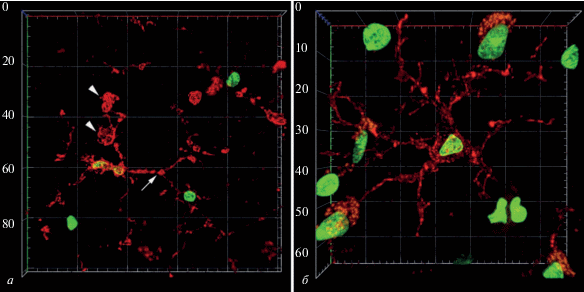
В отростках некоторых клеток было отмечено присутствие выраженных расширений, содержащих ТМЕМ-119 (рис. 2а, головка стрелки). Эти структуры присутствовали преимущественно на концах отростков микроглиоцитов и характеризовались округлой или булавовидной формой. TMEM-119 в этих расширениях часто был распределен по периферии, а в центральной области не выявлялся. Сходные структуры были описаны Sierra и соавт. [17] в исследовании, посвященном изучению роли микроглии в процессах нейрогенеза в гиппокампе мыши. Авторы указывают на то, что при активации некоторые микроглиальные клетки формируют т.н. “фагоцитарные мешочки” (phagocytic pouch), которые на представленных Sierra и соавт. трехмерных реконструкциях выглядят аналогично структурам, обнаруженным нами в мозге человека. Согласно Sierra и соавт., такие “мешочки” являются особой модификацией отростков микроглии и предназначены для осуществления этими клетками фагоцитоза [17]. “Мешочки” представляют собой расширения на концах отростков микроглиоцитов, которые вплотную примыкают к апоптотическому тельцу с целью его последующего фагоцитирования [18]. Результаты проведенных иммуноэлектронно-микроскопических исследований показали, что “мешочки” формируются в результате скопления в этих участках отростков цитоплазмы и органелл (преимущественно, аппарата Гольджи и лизосом). Органеллы занимают центральную область расширения, в результате чего она оказывается неокрашенной при постановке иммуногистохимической реакции на Iba-1. Продукт реакции в данном случае сконцентрирован на периферии “мешочка” [18]. Аналогичные данные были получены нами при постановке иммуногистохимической реакции на TMEM-119. “Фагоцитарные мешочки” в отростках микроглиоцитов коры головного мозга человека при развитии патологии альцгеймеровского типа описаны впервые. Их образование, вероятно, связано с необходимостью очистки нервной ткани от остатков нервных клеток, массово гибнущих при развитии процесса нейродегенерации, ассоциированного с накоплением в тканях мозга амилоида.
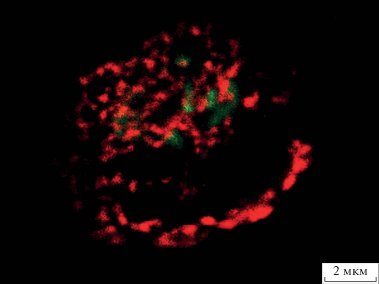
С применением системы сверхвысокого разрешения Airyscan было показано, что TMEM-119 присутствует в мембране тела и отростков микроглиоцитов в виде дискретных микроструктур. Выявленные агрегаты белка имеют размеры менее 1 мкм и относительно равномерно распределены в мембране микроглиоцитов (рис. 3, красная флуоресценция).
Рис. 3.
Распределение TMEM-119 в мембране тела микроглиоцита. Иммунофлуоресцентная реакция на TMEM-119 с подкраской ядерным флуоресцентным красителем SYTOX Green. Агрегаты ТМЕМ-119 – красная флуоресценция, ядро микроглиоцита – зеленая флуоресценция. Конфокальная лазерная микроскопия с использованием системы сверхвысокого разрешения Airyscan. Одиночный оптический срез. Масштабный отрезок равен 2 мкм.
На препаратах, полученных после постановки двойной иммунофлуоресцентной реакции на TMEM-119 и бета-амилоид, были проанализированы морфологические особенности микроглиоцитов, окружающих амилоидные бляшки (рис. 4). В телах и отростках микроглиоцитов, ассоциированных с амилоидными бляшками, TMEM-119 распределен относительно равномерно и с высокой плотностью. Отростки этих клеток утолщены и умеренно ветвятся. Морфологическая картина “бусин на нитке” в данном случае не просматривается. На полученных трехмерных реконструкциях хорошо прослеживаются ветвление и пространственная ориентация отростков микроглиоцитов (рис. 4, красная флуоресценция). Как и при проведении светооптического исследования, в большинстве случаев вблизи амилоидной бляшки (рис. 4, зеленая флуоресценция) удается визуализировать тело только одной микроглиальной клетки. От него отходят отростки, которые оплетают бляшку по периферии и дают ответвления как в глубь бляшки, так и в противоположную сторону (в окружающий нейропиль) (рис. 4, красная флуоресценция).
Рис. 4.
Микроглиоцит вблизи амилоидной бляшки в коре головного мозга человека. Двойная иммунофлуоресцентная реакция на TMEM-119 (красная флуоресценция) и бета-амилоид (зеленая флуоресценция). Конфокальная лазерная микроскопия. Трехмерная реконструкция серии оптических срезов. Масштабный отрезок равен 10 мкм.
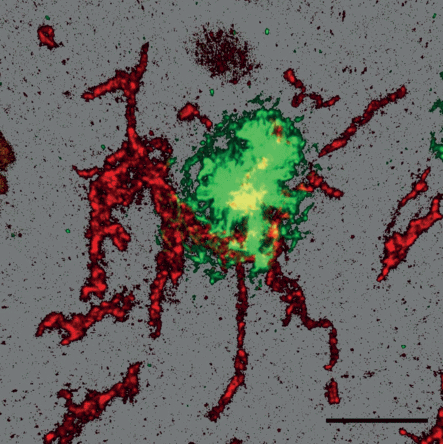
В большинстве случаев с амилоидной бляшкой ассоциирован лишь один микроглиоцит, тело которого локализовано вблизи бляшки, а отходящие от него отростки ветвятся и охватывают бляшку со всех сторон, проходя между амилоидными фибриллами к центральному кору и давая ответвления в окружающую ткань. Вероятно, именно это создает впечатление отростков, тянущихся к бляшке с разных сторон, наблюдаемое при светооптическом исследовании. И именно этим объясняется тот факт, что на светооптическом уровне бляшка выглядит окруженной только отростками (но не телами) микроглиоцитов.
Функциональное значение ассоциации микроглии с амилоидными бляшками остается предметом дискуссий. Ранее было показано, что появление в тканях мозга скоплений бета-амилоида индуцирует активацию микроглиальных клеток, что запускает процесс нейровоспаления. В ходе развития патологии активированная микроглия может приобретать разные фенотипы – провоспалительный (М1) или противовоспалительный (М2). Считается, что М2 микроглия выполняет нейропротекторную функцию – она способна поглощать и утилизировать растворимые формы бета-амилоида, фагоцитировать нерастворимые фибриллярные отложения, уплотнять протофибриллярные формы бета-амилоида в центральный кор бляшки, уменьшая таким образом количество олигомерного бета-амилоида, который оказывает наибольшее токсическое воздействие на нейроны [19, 20]. За счет этого микроглия ограничивает нейротоксичность амилоидных отложений и уменьшает аксональную дистрофию в соседнем нейропиле. Возрастное увеличение количества и размеров амилоидных бляшек, а также воздействие провоспалительных цитокинов, таких как IFN-γ, IL-1β и TNF-α, переводят микроглию в провоспалительное состояние (M1 фенотип). М1 микроглия синтезирует оксид азота и провоспалительные цитокины (TNF-α, IL-1β, IL-12), которые потенциально токсичны для нейронов [19–21]. Согласно современным представлениям, поляризация микроглии при развитии нейродегенеративных заболеваний представляет собой сложный динамичный процесс, сопровождающийся постоянной сменой фенотипов микроглии в зависимости от стадии и тяжести течения заболевания. Вероятно, существует целый ряд промежуточных (между М1 и М2) состояний активации микроглии, каждое из которых характеризуется экспрессией разных маркеров, секрецией разных молекул и выполнением разных функций [21–23]. Возможно, именно этим объясняется тот факт, что TMEM-119-иммунопозитивная микроглия в головном мозге людей с болезнью Альцгеймера стабильно не экспрессирует маркеры поляризации, строго специфичные для М1 или M2 фенотипа [9].
Процесс нейровоспаления связан с активацией еще одной популяции глиальных клеток – астроцитов. После постановки двойной иммунофлуоресцентной реакции на TMEM-119 и GFAP, являющийся маркерным белком астроглии, нами было отмечено присутствие в коре головного мозга как нормальных (неактивированных) астроцитов, так и клеток с признаками реактивной активации (рис. 5, зеленая флуоресценция). Реактивные астроциты характеризуются гипертрофией тел и отростков и высокоинтенсивной реакцией на GFAP. Они формируют выраженные скопления, состоящие из тел астроцитарных клеток, локализованных по периферии, и их отростков, образующих центральную область скопления (рис. 5, зеленая флуоресценция). Согласно литературным данным, такие астроцитарные скопления формируются в коре головного мозга вокруг амилоидных бляшек [23–25].
Рис. 5.
Микроглия и астроциты в области амилоидной бляшки при патологии альцгеймеровского типа. Двойная иммунофлуоресцентная реакция на TMEM-119 (красная флуоресценция) и GFAP (зеленая флуоресценция). Стрелка указывает на микроглиоцит с разветвленной морфологией, головка стрелки – на микроглиоцит с амебоидной морфологией. Конфокальная лазерная микроскопия. Одиночный оптический срез. Масштабный отрезок равен 20 мкм.
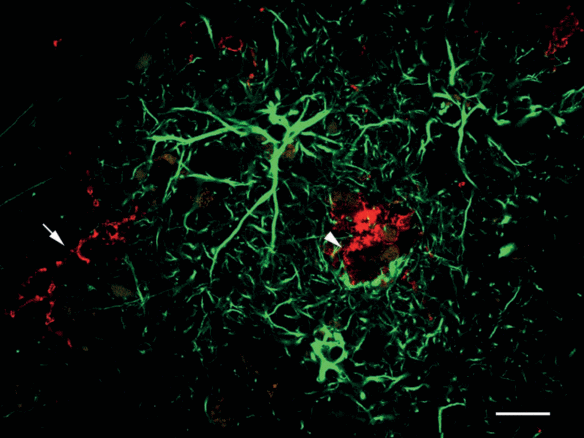
В проведенных нами исследованиях скопления реактивных астроцитов были обнаружены во всех изученных образцах коры. В ряде случаев нами было отмечено присутствие в центральной области таких скоплений (т.е. в предполагаемом месте локализации амилоидной бляшки) микроглиоцита с морфологическими признаками активации (рис. 5, красная флуоресценция, головка стрелки). Такая микроглиальная клетка характеризуется амебоидной формой тела и отсутствием ветвящихся отростков, а также высокоинтенсивной реакцией на TMEM-119. В цитоплазме микроглиоцита присутствуют обширные “пустоты” – области, лишенные TMEM-119, формирование которых может быть следствием фагоцитарной активности этой клетки. На периферии скопления присутствуют микроглиоциты с разветвленной морфологией (рис. 5, красная флуоресценция, стрелка), находящиеся в пространственной взаимосвязи с отростками астроглиальных клеток, окружающих амилоидную бляшку.
Как и в случае с микроглией, пространственная ассоциация реактивных астроцитов с амилоидными бляшками имеет двойственную роль. С одной стороны, показано, что активированные астроциты могут участвовать в деградации и удалении бета-амилоида. С другой стороны, многочисленные экспериментальные данные свидетельствуют о том, что при определенных условиях (под влиянием TGF-1β, IFN-γ, TNF-α, IL-1β) астроциты сами способны продуцировать бета-амилоид, внося тем самым существенный вклад в общее количество амилоида в мозге. Наконец, имеются свидетельства того, что реактивные астроциты, окружающие амилоидные бляшки, утрачивают свои нейротрофические функции и приобретают нейротоксические свойства за счет синтеза ряда цитокинов (IL-1, IL-6, TNF-α и др.), продукция которых усиливает нейродегенерацию [24, 25].
Наблюдаемая пространственная ассоциация реактивных астроцитов и активированных микроглиоцитов является морфологическим свидетельством сложного функционального взаимодействия этих клеток и их взаимного влияния, вносящего вклад в развитие нейровоспаления [23].
Таким образом, в ходе проведенного исследования нами впервые были изучены особенности распределения трансмембранного белка ТМЕМ-119 в микроглиоцитах коры головного мозга человека при патологии альцгеймеровского типа и описаны морфофункциональные характеристики этих клеток при использовании иммуноокрашивания на TMEM-119. Было показано, что популяция микроглиоцитов характеризуется гетерогенностью в отношении распределения TMEM-119 в телах и отростках клеток, что может быть связано со степенью активации микроглии, а также с функциями TMEM-119 в норме и при патологии.
Часть представленных изображений получена с помощью оборудования Центра коллективного пользования научным оборудованием “Микробиом человека” при Федеральном государственном бюджетном научном учреждении “Институт экспериментальной медицины”.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Источники финансирования. Работа В.В. Гусельниковой поддержана грантом Президента Российской Федерации для поддержки молодых российских ученых – кандидатов наук (МК-560.2020.7).
Соответствие принципам этики. Работа выполнена в соответствии с этическими нормами (заключение локального этического комитета ФГБНУ “ИЭМ” № 3/18 от 22.11.2018 г.).
Список литературы
Villani A., Peri F. Microglia: Picky brain eaters. Dev. Cell. 2019. 48 (1), 3–4. https://doi.org/10.1016/j.devcel.2018.12.013
Chowen J.A., Garcia-Segura L.M. 2020. Microglia, neurodegeneration and loss of neuroendocrine control. Prog Neurobiol. 184, 101720. https://doi.org/10.1016/j.pneurobio.2019.101720
Kumar A., Singh A., Ekavali E. 2015. A review on Alzheimer’s disease pathophysiology and its management: An update. Pharmacol. Rep. 67 (2), 195–203. https://doi.org/10.1016/j.pharep.2014.09.004
Hemonnot A.-L., Hua J., Ulmann L., Hirbec H. Microglia in Alzheimer disease: Well-known targets and new opportunities. 2019. Front. Aging Neurosci. 11, 233. https://doi.org/10.3389/fnagi.2019.00233
Alekseeva O.S., Kirik O.V., Gilerovich E.G., Korzhevskii D.E. Microglia of the brain: Origin, structure, functions. 2019. J. Evol. Biochem. Phys. 55, 257–268. https://doi.org/10.1134/S002209301904001X
Kolos E., Korzhevsky D. Spinal cord microglia in health and disease. 2020. Acta Naturae. 12 (1), 4–17.
Bennett M.L., Bennett F.C. 2020. The influence of environment and origin on brain resident macrophages and implications for therapy. Nature Neuroscience. 23, 157–166. https://doi.org/10.1038/s41593-019-0545-6
Bennett M., Bennett F., Liddelow S., Ajami B., Zamanian J., Fernhoff N., Mulinyawe S., Bohlen C., Adil A., Tucker A., Weissman I., Chang E., Li G., Grant G., Gephart M., Barres B. 2016. New tools for studying microglia in the mouse and human CNS. Proc. Natl. Acad. Sci. USA. 113, E1738–E1746. https://doi.org/10.1073/pnas.1525528113
Satoh J., Kino Y., Asahina N., Takitani M., Miyoshi J., Ishida T., Saito Y. 2016. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36, 39–49. https://doi.org/10.1111/neup.12235
Montine T.J., Phelps C. H., Beach T.G., Bigio E.H., Cairns N.J., Dickson D.W., Duyckaerts C., Frosch M.P., Masliah E., Mirra S.S., Nelson P.T., Schneider J.A., Thal D., Trojanowski J.Q., Vinters H.V., Hyman B.T. 2012. National institute on aging–Alzheimer’s association guidelines for the neuropathologic assessment of Alzheimer’s disease: A practical approach. Acta Neuropathologica. 123, 1–11. https://doi.org/10.1007/s00401-011-0910-3
Miller Y., Navia-Pelaez J., Corr M., Yaksh T. 2020. Lipid rafts in glial cells: Role in neuroinflammation and pain processing. J. Lipid Res. 61 (5), 655–666. https://doi.org/10.1194/jlr.TR119000468
Sturrock R.R. Microglia in the prenatal mouse neostriatum and spinal cord. 1981. J. Anat. 133 (Pt4), 499–512.
Tseng C.Y., Ling E.A., Wong W.C. Scanning electron microscopy of amoeboid microglial cells in the transient cavum septum pellucidum in pre- and postnatal rats. 1983. J. Anat. 136 (Pt2), 251–163.
Ghosh P., Ghosh A. Morphological and behavioural variation in CNS innate defence cell microglia is development and age sensitive. 2016. Neuroimmunology and Neuroinflammation. 2 (3), 38–47. https://doi.org/10.20517/2347-8659.2015.32
Snow A.D., Willmer J.P., Kisilevsky R. 1987. Sulfated glycosaminoglycans in Alzheimer’s disease. Hum Pathol. 18 (5), 506–510. https://doi.org/10.1016/s0046-8177(87)80036-9
Kumar G.L., Rudbeck L. 2009. Education guide: Immunohistochemical staining methods: Pathology. Dako North America, 160 p.
Sierra A., Encinas J., Deudero J., Chancey J., Enikolopov G., Overstreet-Wadiche L., Tsirka S., Maletic-Savatic M. Microglia shape adult hippocampal neurogenesis through apoptosis-coupled phagocytosis. 2010. Cell Stem Cell. 7 (4), 483–495. https://doi.org/10.1016/j.stem.2010.08.014
Liaury K., Miyaoka T., Tsumori T., Furuya M., Wake R., Ieda M., Tsuchie K., Taki M., Ishihara K., Tanra A.J., Horiguchi J. Morphological features of microglial cells in the hippocampal dentate gyrus of Gunn rat: A possible schizophrenia animal model. J Neuroinflammation. 9, 56. https://doi.org/10.1186/1742-2094-9-56
Condello C., Yuan P., Schain A., Grutzendler J. 2015. Microglia constitute a barrier that prevents neurotoxic protofibrillar Aβ42 hotspots around plaques. J. Nat. Commun. 6, 6176. https://doi.org/10.1038/ncomms7176
Hansen D., Hanson J., Sheng M. 2018. Microglia in Alzheimer’s disease. J. Cell Biol. 217 (2), 459–472. https://doi.org/10.1083/jcb.201709069
Tang Y., Le W. 2016. Differential roles of M1 and M2 microglia in neurodegenerative diseases. Mol. Neurobiol. 53 (2), 1181–1194. https://doi.org/10.1007/s12035-014-9070-5
Yao K., Zu H.-B. 2020. Microglial polarization: Novel therapeutic mechanism against Alzheimer’s disease. Inflammopharmacology. 28 (1), 95–110. https://doi.org/10.1007/s10787-019-00613-5
Kwon H.S., Koh S.H. Neuroinflammation in neurodegenerative disorders: The roles of microglia and astrocytes. 2020. Transl. Neurodegener. 9, 42. https://doi.org/10.1186/s40035-020-00221-2
González-Reyes E.R., Nava-Mesa M.O., Vargas-Sánchez K., Ariza-Salamanca D., Mora-Muñoz L. 2017. Involvement of astrocytes in Alzheimer’s disease from a neuroinflammatory and oxidative stress perspective. Front. Mol. Neurosci. 10, 427. https://doi.org/10.3389/fnmol.2017.00427
Perez-Nievas G.B., Serrano-Pozo A. 2018. Deciphering the astrocyte reaction in Alzheimer’s disease. Front. Aging Neurosci. 10, 114. https://doi.org/10.3389/fnagi.2018.00114
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


