Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 2, стр. 146-153
Микрореологические ответы эритроцитов на доноры оксида азота, монооксида углерода и сульфида водорода: взаимодействие между газотрансмиттерами
А. В. Муравьев a, *, П. В. Михайлов a, С. В. Булаева a, Е. П. Петроченко a, Ю. В. Малышева a, И. А. Тихомирова a
a Ярославский государственный педагогический университет им. К.Д. Ушинского
150000 Ярославль, Россия
* E-mail: alexei.47@mail.ru
Поступила в редакцию 15.09.2021
После доработки 30.10.2021
Принята к публикации 01.11.2021
- EDN: LZOEMU
- DOI: 10.31857/S0233475522020050
Аннотация
Зрелые эритроциты, несмотря на простоту своей структуры и функции, сохранили многие элементы сигнальных каскадов. Для выполнения своей основной функции – транспорта и доставки кислорода – эритроциты должны проходить через обменные капилляры, диаметр которых меньше размера клетки. При этом эритроциты подвергаются деформации, которая модулируется многими сигналиными молекулами, в том числе такими газотрансмиттерами (ГТ), как NO, CO и H2S. Микрореологические ответы эритроцитов на ГТ и сигнальные пути, обеспечивающие эти ответы, исследованы недостаточно. Цель данной работы состояла в изучении эффектов отдельных ГТ и их механизмов на моделях микрореологических ответов эритроцитов на доноры ГТ. Для достижения этой цели регистрировали деформируемость эритроцитов на основе определения индекса удлинения клеток (ИУЭ) в проточной микрокамере после инкубации эритроцитов с донорами ГТ: нитропруссидом натрия (донор NO), NaHS (донор H2S) и CORM-3 (донор СО), а также с ингибитором растворимой гуанилатциклазы (р-ГЦ) – ODQ, субстратом NO-синтазы (NOS) – L-аргинином, ее ингибитором – L-NAME, с блокатором KATP-каналов – глибенкламидом и с блокатором KCa-каналов – тетраэтиламмонием. Все три донора ГТ достоверно повышали ИУЭ на 7–10% (p < 0.01). Хотя KATP-каналы известны как молекулярные мишени для H2S, их блокирование глибенкламидом не устраняло повышение деформируемости эритроцитов под влиянием NaHS. Блокирование KCa-каналов – основных молекулярных мишеней CO – не устраняло полностью микрореологического эффекта CORM-3. С другой стороны, ингибирование элементов NO-сигнального пути полностью удаляло прирост ИУЭ как под влиянием всех трех ГТ, так и при ингибировании р-ГЦ с помощью ODQ. Полученные данные позволяют заключить, что микрореологические ответы эритроцитов на такие газотрансмиттеры, как NO, CO и H2S, сходны, и во всех этих ответах может использоваться общий молекулярный NO-ассоциированный сигнальный путь, включающий NOS и р-ГЦ.
ВВЕДЕНИЕ
Эритроциты обеспечивают транспорт кислорода в клеточные микрорайоны в соответствии с метаболическими запросами тканей [1]. При этом они не только переносят дыхательные газы, но и активно участвуют в регуляции кровотока, путем позитивного изменения своих микрореологических характеристик [2], а также синтезируют и выделяют сигнальные молекулы, адресованные эндотелиальным и гладкомышечным клеткам. Последнее приводит к вазодилатации и приросту объемного кровотока [3, 4]. Поэтому эритроциты рассматривают как важное звено регуляции локального кровотока, обеспечивающего эффективную тканевую перфузию. Эти клетки проявляют свойства “сенсора” гипоксии и механического напряжения на мембране, а также “регулятора” тонуса сосудов. Для этого они в ответ на гипоксический стимул или на повышение напряжения сдвига, продуцируют ATP и оксид азота [5, 6]. Несмотря на простоту конструкции, зрелые эритроциты сохранили многие элементы молекулярных сигнальных каскадов, включая ионные каналы, мембранные рецепторы и ферменты [7–9]. В этой связи важно заметить, что эритроциты синтезируют NO из L-аргинина с помощью NO-синтазы эндотелиального типа [10, 11]. В эритроцитах NOS активируется под влиянием напряжения сдвига или гипоксическим стимулом [12, 13]. При этом с высокой активностью NOS сочетается прирост деформируемости эритроцитов и улучшение транспорта кислорода [14, 15]. Наряду с NO как газотрансмиттером в сосудистой системе синтезируются и два других газовых медиатора: сульфид водорода H2S и монооксид углерода СО [16]. Они поступают в кровоток и становятся доступны клеткам крови. Это сопровождается угнетением агрегации тромбоцитов и адгезии лейкоцитов [17, 18]. Однако данные, свидетельствующие о положительном влиянии ГТ на микрореологические характеристики эритроцитов, относятся только к NO [19, 20]. Сходный характер сосудистых ответов на все три газотрансмиттера, а также наличие компонентов молекулярного сигнального каскада в эритроцитах, ассоциированных c оксидом азота (растворимой гуанилатциклазой, cGMP, PKG) [21], может указывать на взаимодействие всех трех ГТ при решении общих регуляторах задач по оптимизации транспорта кислорода в тканевые микрорайоны. Об этом свидетельствуют данные о том, что NO, CO и H2S взаимодействуют в клетках: изменяют функциональное состояние р-ГЦ и NOS [22–24].
С учетом вышесказанного была сформулирована цель исследования: изучение эффектов отдельных газотрансмиттеров и механизмов их взаимодействия на моделях микрореологических ответов эритроцитов на доноры трех ГТ.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы цельной крови (9 мл) здоровых доноров (n = 20) получали венопункцией в вакуумные пробирки (вакутайнеры с EDTA). Проведение исследования одобрено местным этическим комитетом Ярославского государственного педагогического университета (протокол № 2 от 08.02.2021 г.). Получено информированное согласие всех субъектов в соответствии с рекомендациями Хельсинкской декларации (Хельсинкская декларация WMA об этике. Принципы медицинских исследований с участием людей, с поправками, внесенными 64-й Генеральной Ассамблеей WMA, Форталеза, Бразилия, октябрь 2013 г.). Эритроциты отделяли от плазмы центрифугированием (15 мин, 1500 g), трижды отмывали в изотоническом растворе хлорида натрия и ресуспендировали в буферном растворе (138 мМ NaCl, 3 мМ KCl, 1 мМ K2SO4, 7.5 мМ Na2HPO4, 1 мМ MgSO4, 5 мМ глюкозы, pH 7.4). Поскольку эндотелиальная NOS является кальций-зависимым ферментом, то в среду инкубации эритроцитов добавляли CaCl2 до его конечной концентрации 150 мкМ. Осмолярность составляла 300 мОсм/л (определяли на осмометре Fogel ОМ-801, Германия). Суспензию эритроцитов (Hct = 40%) делили на несколько аликвот и клетки инкубировали при 37°С в течение 30 мин с каждым соединением:
1) с донором NO – нитропруссидом натрия (НПН, 100 мкМ);
2) с донором H2S – гидросульфидом натрия (NaHS, 100 мкМ);
3) с донором СО – трикарбонилхлоро(глицинато)рутений (II) (CORM-3, 100 мкМ),
4) с субстратом NOS – L-аргинином (100 мкМ);
5) с ингибитором р-ГЦ – 1H-[1, 2, 4]-оксадиазоло[4,3-a]хиноксалин-l-он, (ODQ, 0.5 мкМ);
6) с ингибитором активности NOS – метиловым эфиром N-метил-L-аргинина (L-NAME, 200 мкМ);
7) с блокатором KATP-каналов – глибенкламидом (ГлК, 50 мкМ);
8) с блокатором KСa-каналов – тетраметиламмонием (ТЕА, 50 мкМ).
В каждом опыте в качестве контроля использовали суспензию эритроцитов, инкубируемых в течение 30 мин при 37°С в буферном растворе без добавления указанных выше препаратов. В опыте и в контроле проводилось по 20 параллельных измерений микрореологических характеристик эритроцитов. Все препараты и соединения получены от фирмы Sigma-Aldrich (США). Их растворяли в соответствии с рекомендациями производителя препаратов в дистиллированной воде, за исключением глибенкламида, матричный раствор которого готовили сначала в диметилсульфоксиде, с последующим доведением рабочего раствора этого препарата (в конечной концентрации 50 мкМ) разбавлением в дистиллированной воде в 103 раз. В предварительных опытах было установлено, что такое разведение глибенкламида не вызывала никаких микрореологических ответов эритроцитов на это соединение. Все эксперименты проводили в течение 4 ч после взятия крови. После инкубации суспензий эритроцитов с указанными выше соединениями регистрировали их деформируемость.
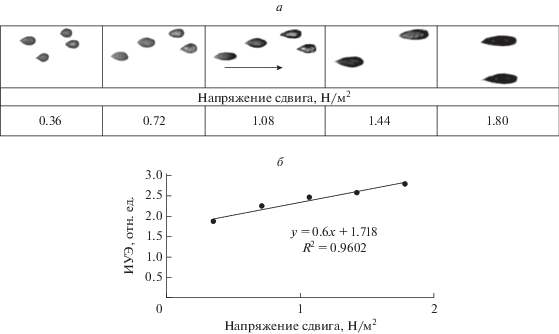
Для измерения деформируемости эритроцитов использовали методику удлинения эритроцитов в проточной микрокамере под действием напряжения сдвига текущей жидкости [25]. Этот метод позволяет регистрировать важнейший параметр деформируемости эритроцитов – модуль сдвиговой эластичности мембраны [26]. Для этого в проточной микрокамере создавали постоянное течение суспензии эритроцитов (Hct = 0.5%), которое генерировало напряжение сдвига 0.54 Н/м2 и вытягивало клетки, прикрепленные ко дну камеры (рис. 1а). На основе измерения длины (L) и ширины (W) вытянутых потоком клеток рассчитывали индекс их удлинения (ИУЭ), как показатель деформируемости эритроцитов: ИУЭ = = L/W (отн. ед.) [25]. Поскольку отношение L/W линейно увеличивается с приростом напряжения сдвига, то наклон линии регрессии в уравнении (рис. 1б) пропорционален модулю упругости мембраны при сдвиге. Таким образом, измерения L/W могут характеризовать модуль упругости мембраны при сдвиге [27].
Рис. 1.
Изменение удлинения эритроцитов при приложении нарастающей величины напряжения сдвига (а), которое хорошо описывается линейным регрессионным уравнением (б) вида: y = 0.6x + 1.72, при надежности аппроксимации экспериментальных данных 96% (R 2 = 0.96).
Статистическая обработка. Статистическую обработку результатов проводили с использованием программы Statistica 6.0. Проверку выборочного распределения выполняли с помощью теста Шапиро–Уилка. Значимость различий определяли, используя непараметричский критерий Краскела–Уоллиса. За уровень статистически значимых различий принимали изменения при p < 0.05 и p < < 0.01. Данные в тексте представлены как М ± σ (среднее ± стандартное отклонение).
РЕЗУЛЬТАТЫ
Три донора газотрансмиттеров (НПН, NaHS и CORM-3) и субстрат для NO-синтазы, L-аргинин, повышали деформируемость эритроцитов на сходную величину (на 8–10%, p < 0.01), относительно контрольного образца (рис. 2).
Рис. 2.
Относительные изменения деформируемости эритроцитов (в % к контролю) под влиянием доноров газотрансмиттеров (НПН, NaHS и CORM-3) и субстрата синтеза оксида азота (L-аргинина). * Отличие от контроля статистически значимо (p < 0.01).
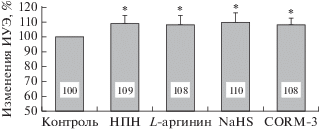
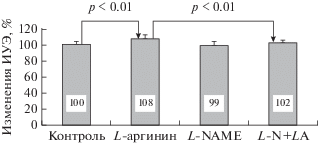
Как показано на рис. 2, L-аргинин достоверно повышал деформируемость эритроцитов на 8% (с 1.95 ± 0.07 отн. ед. до 2.10 ± 0.06 отн. ед., p < < 0.01) по сравнению с контролем. Однако при предварительном ингибировании NOS с помощью L-NAME была выявлена достоверная разница (p < 0.01) деформируемости эритроцитов после их инкубации с L-аргинином и его совместным действием с L-NAME (L-N + LA, рис. 3). Это свидетельствует о том, что ингибирование активности NOS практически полностью устраняет положительный эффект L-аргинина.
Рис. 3.
Относительные (в % к контролю) изменения деформируемости эритроцитов под влиянием L-аргинина, L-NAME по отдельности и при их одновременном добавлении в среду инкубации. L-NAME + L-аргинин (L-N + LA).
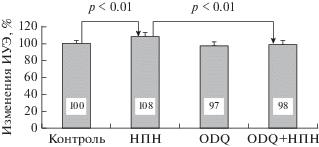
Донор NO, нитропруссид натрия, повышал ИУЭ на 8% (p < 0.01). Известно, что р-ГЦ является основной молекулярной мишенью для NO [28]. Если ее предварительно ингибировать с помощью ODQ, то повышение ИУЭ под влиянием НПН не происходит. На это указывало отсутствие достоверных различий величины ИУЭ в контроле (без препарата) и после инкубации с комбинацией двух соединений ODQ и НПН (2.00 ± 0.06 отн. ед. – контроль и 1.98 ± 0.07 отн. ед. – ODQ + НПН), а также достоверная разница между величинами ИУЭ после инкубации клеток с НПН и его сочетанным воздействием с ODQ (рис. 4).
Рис. 4.
Относительные (в % к контролю) изменения деформируемости эритроцитов под влиянием НПН, ODQ по отдельности и при их одновременном добавлении в среду инкубации (ODQ + НПН).
В другой серии опытов донор сульфида водорода NaHS достоверно увеличивал ИУЭ более чем на 8% относительно контроля, и этот эффект не устранялся блокированием KATP-каналов ГлК. После инкубации эритроцитов с комбинацией препаратов ГлК + NaHS ИУЭ увеличивался с 1.96 ± 0.07 отн. ед. (Контроль) до 2.11 ± 0.08 отн. ед. (ГлК + NaHS), что составило 8% (p < 0.01). Тогда как при ингибировании NOS с помощью L-NAME донор сульфида водорода не изменял ИУЭ относительно контроля и, кроме того, была выявлена существенная разница (p < 0.01) в изменениях ИУЭ при инкубации клеток только с NaHS (2.12 ± ± 0.06 отн. ед.) и его совместном действии с L-NAME (1.89 ± 0.05 отн. ед., рис. 5).
Рис. 5.
Относительные (в % к контролю) изменения деформируемости эритроцитов под влиянием NaHS, L-NAME и их одновременном добавлении в среду инкубации (L-N + NaHS).
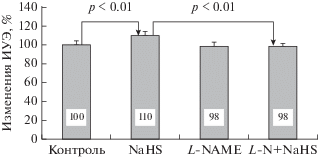
Известно, что для СО молекулярной клеточной мишенью являются Ca2+-зависимые K+-каналы (KCa-каналы) [29]. Они блокируются ТЕА. После предварительной инкубации с ТЕА ИУЭ почти не изменялся при добавлении CORM-3. Различие с контролем не превышало 2% (1.93 ± ± 0.06 отн. ед. – контроль и 1.97 ± 0.08 отн. ед. – ТЕА + CORM-3). Тогда как увеличение ИУЭ под влиянием только CORM-3 было большим (2.06 ± ± 0.06 отн. ед.) и составило 7% (рис. 6, p < 0.01).
Рис. 6.
Относительные (в % к контролю) изменения деформируемости эритроцитов под влиянием CORM-3, L-NAME и при их одновременном добавлении в среду инкубации (L-N + CORM-3).
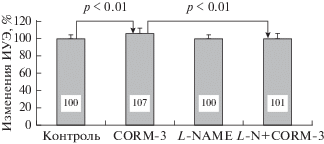
Существуют данные, свидетельствующие о том, что СО может активировать NOS, а последующий синтез NO модулирует клеточные ответы [30]. Ингибирование NOS с помощью L-NAME полностью устраняло повышение деформируемости эритроцитов под влиянием донора СО. При этом выявлена достоверная разница между средними величинами ИУЭ после воздействия CORM-3 и комбинации L-NAME + CORM-3 (p < 0.01).
О возможности использования внутриклеточного NO-сигнального каскада при изменении микромеханических свойств мембран эритроцитов другими ГТ (СО и H2S) свидетельствуют опыты с ингибированием первого звена этого сигнального пути – р-ГЦ. Так, ингибитор р-ГЦ ODQ препятствовал повышению ИУЭ под влиянием NaHS. Если при его совместном воздействии с ODQ (ODQ + NaHS) наблюдали даже некоторое снижение ИУЭ по сравнению с контролем (с 1.96 ± ± 0.06 отн. ед. до 1.93 ± 0.08 отн. ед.), то относительно уровня, достигнутого под влиянием этого донора отдельно, была выявлена разница в 9% (p < 0.01, рис. 7 а).
Рис. 7.
Относительные (в % к контролю) изменения деформируемости эритроцитов под влиянием: а – NaHS, ODQ по отдельности и при их одновременном добавлении в среду инкубации (ODQ + NaHS); б – CORM-3, ODQ отдельно и при их одновременном добавлении в среду инкубации (ODQ + CORM-3).
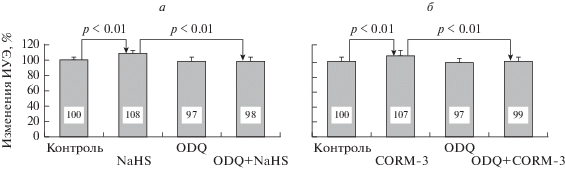
Аналогичную картину наблюдали в опытах с применением донора СО, CORM-3, в условиях ингибирования р-ГЦ с помощью ODQ. Ингибитор р-ГЦ устранял повышающий деформируемость эффект CORM-3. Об этом свидетельствовало отсутствие достоверных изменений ИУЭ относительно контроля в ответ на сочетанное действие ODQ + CORM-3 и достоверная разница в 8% (p < 0.01) между ИУЭ, увеличенным под влиянием CORM-3 (2.16 ± 0.07 отн. ед.), и его сниженным значением (2.00 ± 0.06 отн. ед.) в условиях сочетанного действия ODQ + CORM-3, рис. 7 б).
ОБСУЖДЕНИЕ
Три донора газотрансмиттеров (НПН, NaHS и CORM-3) и субстрат для NOS L-аргинин повышали деформируемость эритроцитов на сходную величину (7–10%, p < 0.01), относительно контрольной суспензии (без препаратов). Таким образом, результаты исследования свидетельствуют о положительном влиянии доноров всех трех ГТ на микромеханические свойства мембраны эритроцитов, что проявляется в достоверном повышении деформируемости клеток в целом. В литературе имеются данные, свидетельствующие о том, что стимулирование NOS в эритроцитах или инкубация клеток с донором NO нитропруссидом натрия сопровождается приростом деформируемости эритроцитов на сходную величину, что было показано и в нашей работе [10, 31]. NO регулирует механические свойства мембран, тем самым модулируя деформируемость эритроцитов и эффективность транспорта O2. Так, например, адаптация эритроцитов к гипоксии, сопровождается NO-зависимым S-нитрозилированием мембранных белков и гемоглобина [32]. При этом происходит восстановление нитрита до NO, которое усиливает S-нитрозилирование α- и β-спектринов цитоскелета эритроцитов, что является существенным фактором для улучшения деформируемости эритроцитов [33]. Следовательно, можно полагать, что активно продуцируемый NO в эритроцитах человека имеет решающее значение для поддержания их оптимальной деформируемости [12].
В условиях in vivo напряжение сдвига действует на мембрану эритроцитов при их движении в потоке. Было показано, что этот механический стимул дозозависимо инициирует образование оксида азота, который используется пара- и аутокринно для решения регуляторных задач [34]. На это указывает и тот факт, что NOS, которая расположена как в мембране эритроцитов, так и в цитоплазме, может быть активирована как химическими, так и механическими факторами [35]. Воздействие напряжения сдвига значительно увеличивает фосфорилирование серина 1177 NOS эритроцитов с участием PI3-киназы/Akt-киназы [31, 36]. В наших опытах ингибирование NOS с помощью L-NAME полностью устраняло повышение деформируемости эритроцитов под влиянием L-аргинина. Другие авторы подтверждают, что L-NAME приводит к нарушению деформируемости эритроцитов [10]. Что касается других газотрансмиттеров, CO и H2S, то хотя и указывается на наличие собственных молекулярных мишеней для этих ГТ, однако многие авторы сообщают о том, что все три ГТ имеют сходные механизмы действия, параллельные регуляторные мишени и оказывают взаимное влияние друг на друга (cross-talk) [16, 37]. Было получено ряд доказательств участия NO-опосредованного сигнально пути в эритроцитах при реализации их микрореологических ответов на доноры СО и H2S. Так, ингибирование NOS с помощью L-NAME полностью элиминировало прирост деформируемости эритроцитов под влиянием этого СО-донора. Блокирование KCa-каналов с помощью ТЕА существенно меньше сказалось на микрореологической реакции эритроцитов на донор СО.
Когда для оценки роли известной молекулярной мишени для H2S, KATP-каналов, блокировали их ГлК [29], то это совершенно не повлияло на повышение деформируемости эритроцитов при воздействии NaHS. С другой стороны, ингибирование NOS сопровождалось полным устранением повышающего влияния на эту микрореологическую характеристику донора H2S. Кроме того, было найдено, что прирост деформируемости эритроцитов под влиянием всех трех доноров ГТ не проявлялся, если в среду инкубации к этим соединениям добавляли ингибитор р-ГЦ ODQ. Известно, что H2S и CO активируют р-ГЦ, что сопровождается повышением микрососудистой перфузии и уменьшением тканевой гипоксии [30]. Было установлено, что H2S регулирует локальную концентрацию NO [38] и повышает доступность оксида азота молекулярным мишеням клетки [39]. О взаимодействии ГТ говорит и тот факт, что NaHS и донор монооксида углерода повышали эффективность микроциркуляции [40]. Химическое взаимодействие между NO и H2S может генерировать нитроксил (HNO), который обладает положительным инотропным эффектом в сердечно-сосудистой системе [41]. Необходимо дополнить, что фермент цистатионин-β-синтаза, продуцирующий H2S, поддерживает клеточную биоэнергетику и играет важную роль во взаимодействии между ГТ. Недавно было показано, что фермент отрицательно модулируется физиологическими концентрациями CO и NO, особенно в присутствии его аллостерического активатора S-аденозил-1-метионина (AdoMet) [42].
В ходе многочисленных исследований биологических эффектов газотрансмиттеров на несколько системах изучалось взаимодействие между H2S и другими ГТ. При этом было показано, что, например, H2S не только взаимодействует с NO с образованием нитроксила, но также регулирует сигнальные пути гемоксигеназы/CO [43]. Следовательно, можно заключить, что, во-первых, эритроциты синтезируют NO с помощью биологически активной NOS [33, 36, 44], во-вторых, H2S модулирует активность NOS [38], в-третьих, H2S и CO активируют ключевой фермент NO-регуляторного каскада, р-ГЦ [22, 30, 38]. Все это сопровождается приростом деформируемости эритроцитов, повышением микрососудистой перфузии и оксигенации тканей [4, 9, 31].
Фосфорилирование комплекса интегральных белков мембраны (гликофорин С, белок полосы 3), а также анкирина, белка полосы 4.1 и белков цитоскелета, актина и спектрина, ведет к временной диссоциации компонентов цитоскелета мембраны с ее интегральными белками. Это сопровождается повышением эластичности мембраны и деформируемости клетки в целом [45]. В этом случае NO-ассоциированный молекулярный сигнальный каскад является вполне реальным регулятором микромеханических свойств мембраны эритроцитов. Этот сигнальный путь связан с изменением эластичности мембран эритроцитов при воздействии NO. Он включает: р-ГЦ, cGMP и PKG. Протеинкиназа G может фосфорилировать актин и α- и β-спектрины цитоскелета клеток, что приводит к улучшению деформируемости эритроцитов [31].
Таким образом, полученные данные позволяют обобщить ряд доказательств того, что микрореологические ответы эритроцитов на газотрансмиттеры: оксида азота, монооксида углерода и сульфида водорода, сходны и могут использовать общий молекулярный сигнальный путь, связанный с синтезом NO, с помощью активной NOS в этих клетках.
Конфликт интересов. Авторы зявляют об остутствии конфликта интересов.
Источники финансирования. Исследование выполнено при финансовой поддержке РФФИ и БРФФИ в рамках научного проекта № 20-515-00019 Бел_а.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Tsai A.G., Johnson P.C., Intaglietta M. 2003. Oxygen gradients in the microcirculation. Physiol. Rev. 83, 933–963. https://doi.org/10.1152/physrev.00034.2002
Smith J.A., Martin D.T. Telford R.D., Ballas S.K. 1999. Greater erythrocyte deformability in world-class endurance athletes. Am. J. Physiol. 276 (6), H2188–193. https://doi.org/10.1152/ajpheart.1999.276.6.H2188
Ellsworth M.L., Ellis C.G., Goldman D., Alan H., Stephenson A.H., Hans H., Dietrich H.H., Sprague R.S. 2009. Erythrocytes: Oxygen sensors and modulators of vascular tone. Physiology. 24, 107–116. https://doi.org/10.1152/physiol.00038.2008
Simmonds M.J., Detterich J.A., Connes Ph. 2014. Nitric oxide, vasodilation and the red blood cell. Biorheo-logy. 51 (2–3), 121–134. https://doi.org/10.3233/BIR-140653
Sprague R.S. Ellsworth M.L. 2012. Erythrocyte-derived ATP and perfusion distribution: Role of intracellular and intercellular communication. Microcirculation. 19 (5), 430–439. https://doi.org/10.1111/j.1549-8719.2011.00158.x
Grau M., Cremer J.M., Schmeichel S., Kunkel M., Bloch W. 2018. Comparisons of blood parameters, red blood cell deformability and circulating nitric oxide between males and females considering hormonal contraception: A longitudinal gender study. Front. Physiol. 9, 1835. https://doi.org/10.3389/fphys.2018.01835
Oonishi T., Sakashita K., Uyesaka N. 1997. Regulation of red blood cell filterability by Ca2+ influx and cAMPx-mediated signaling pathways. Am. J. Physiol. Cell Physiol. 273 (42), 1828–1834. https://doi.org/10.1152/ajpcell.1997.273.6.C1828
Minetti G., Ciana A., Balduini C. 2004. Differential sorting of tyrosine kinases and phosphotyrosine phosphatases acting on band 3 during vesiculation of human erythrocytes. Biochem. J. 377 (Pt 2), 489–497. https://doi.org/10.1042/BJ20031401
Bizjak D.A., Brinkmann C., Bloch W., Grau M. 2015. Increase in red blood cell-nitric oxide synthase dependent nitric oxide production during red blood cell aging in health and disease: A study on age dependent changes of rheologic and enzymatic properties in red blood cells. PLoS ONE. 10 (4), e0125206. https://doi.org/10.1371/journal.pone.0125206
Uyuklu M., Meiselman H.J., Baskurt O.K. 2009. Role of hemoglobin oxygenation in the modulation of red blood cell mechanical properties by nitric oxide. Nitric Oxide. 21 (1), 20–26. https://doi.org/10.1016/j.niox.2009.03.004
Zhao Y., Wang X., Noviana M., Hou M. 2018. Nitric oxide in red blood cell adaptation to hypoxia. Acta Biochim. Biophys. Sin. (Shanghai). 50 (7), 621–634. https://doi.org/10.1093/abbs/gmy055
Suhr F., Brenig J., Müller R., Behrens H., Bloch W., Grau M. 2012. Moderate exercise promotes human RBC-NOS activity, NO production and deformability through Akt kinase pathway. PLoS One. 7 (9), e45982. https://doi.org/10.1371/journal.pone.0045982
Grau M., Kuck L., Dietz Th., Bloch W., Simmonds M.J. 2021. Sub-fractions of red blood cells respond differently to shear exposure following superoxide treatment. Biology (Basel). 10 (1), 47. https://doi.org/10.3390/biology10010047
Baskurt O.K., Ulker P., Meiselman H.J. 2011. Nitric oxide, erythrocytes and exercise. Clin. Hemorheol. Microcirc. 49 (1–4), 175–181. https://doi.org/10.3233/CH-2011-1467
Koliamitra Ch., Holtkamp B., Zimmer Ph., Bloch W., Grau M. 2017. Impact of training volume and intensity on RBC-NOS/NO pathway and endurance capacity. Biorheology. 54 (1), 37–50. https://doi.org/10.3233/BIR-16121
Olas B. 2015. Gasomediators (NO, CO, and H2S) and their role in hemostasis and thrombosis. Clin. Chim. Acta. 445, 115–121. https://doi.org/10.1016/j.cca.2015.03.027
Kleinbongard P., Keymel S., Kelm M. 2007. New functional aspects of the L-arginine-nitric oxide metabolism within the circulating blood. Thromb. Haemost. 98 (5), 970–974.
Truss N.J., Warner T.D. 2011. Gasotransmitters and platelets. Pharmacol Ther. 132, 196–203. https://doi.org/10.1016/j.pharmthera.2011.07.001
Bor-Kucukatay M., Wenby R.B., Meiselman H.J., Baskurt O.K. 2003. Effects of nitric oxide on red blood cell deformability. Am. J. Physiol. Heart. Circ. Physiol. 284, H1577–584. https://doi.org/10.1152/ajpheart.00665.2002
Mozar A., Connes P., Collins B., Hardy-Dessources M.D., Romana M., Lemonne N., Bloch W., Grau M. 2016. Red blood cell nitric oxide synthase modulates red blood cell deformability in sickle cell anemia. Clin. Hemorheol. Microcirc. 64, 47–53. https://doi.org/10.3233/CH-162042
Wang R. 2014. Gasotransmitters: Growing pains and joys. Trends Biochem. Sci. 39 (5), 227–232. https://doi.org/10.1016/j.tibs.2014.03.003
Bełtowski J., Jamroz A., Borkowska E. 2004. Heme oxygenase and carbon monoxide in the physiology and pathology of the cardiovascular system. Postepy Hig. Med. Dosw. (Online). 58, 83–99.
Salomone S., Foresti R., Villari A., Giurdanella G., Drago F., Bucolo C. 2014. Regulation of vascular tone in rabbit ophthalmic artery: Cross talk of endogenous and exogenous gas mediators. Biochem. Pharmacol. 92 (4), 661–668. https://doi.org/10.1016/j.bcp.2014.10.011
Giuffrè A., Vicente J.B. 2018. Hydrogen sulfide biochemistry and interplay with other gaseous mediators in mammalian physiology. Oxid. Med. Cell Longev. 27, 6290931. https://doi.org/10.1155/2018/6290931
Artmann G.M. 1995. Microscopic photometric quantification of stiffness and relaxation time of red blood cells in a flow chamber. Biorheology. 32, 553–570. https://doi.org/10.1016/0006-355X(95)00032-5
Hochmuth R.M., Mohandas N., Blackshear P.L. 1973. Measurement of the elastic modulus for red cell membrane using a fluid mechanical technique. Biophys. J. 13, 747–762.
Chien S., Sung L.F., Lee V.V., Skalak R. 1992. Red cell membrane elasticity as determined by flow channel technique. Biorheology. 29, 467–478. https://doi.org/10.3233/bir-1992-295-607
Lucas K.A., Pitary G.M., Park J. 2000. Guanylyl cyclase and signaling by cyclic GMP. Pharmocol. Rev. 52, 375–413.
Green B.D., Hand K.V., Dougan J.E., McDonnell B.M., Cassidy R.S., Grieve D.J. 2008. GLP-1 and related peptides cause concentration-dependent relaxation of rat aorta through a pathway involving KATP and cAMP. Arch. Biochem. Biophys. 478, 136–142. https://doi.org/10.1016/j.abb.2008.08.001
Magierowski M., Magierowska K., Hubalewska-Mazgaj M., Adamski Ju., Bakalarz D., Sliwowski Z., Pajdo R., Kwiecien S., Brzozowski T. 2016. Interaction between endogenous carbon monoxide and hydrogen sulfide in the mechanism of gastroprotection against acute aspirin-induced gastric damage. Pharmacol. Res. 114, 235–250. https://doi.org/10.1016/j.phrs.2016.11.001
Grau M., Pauly S., Ali J., Walpurgis K., Thevis M., Bloch W. 2013. RBC-NOS dependent S-nitrosylation of cytoskeletal proteins improves RBC deformability. PLoS One. 8 (2), e56759. https://doi.org/10.1371/journal.pone.0056759
Zhao Y., Wang X., Noviana M., Hou M. 2018. Nitric oxide in red blood cell adaptation to hypoxia. Acta Biochim. Biophys. Sin. (Shanghai). 50 (7), 621–634. https://doi.org/10.1093/abbs/gmy055
Grau M., Lauten A., Hoeppener S., Goebel B., Brenig Ju., Jung Ch., Bloch W., Suhr F. 2016. Regulation of red blood cell deformability is independent of red blood cell-nitric oxide synthase under hypoxia. Clin. Hemorheol. Microcirc. 63 (3), 199–215. https://doi.org/10.3233/CH-162044
Horobin J.T., Watanabe N., Hakozaki M., Sabapathy S., Kuck L., Simmonds M.J. 2019. Shear-stress mediated nitric oxide production within red blood cells: A dose-response. Clin. Hemorheol. Microcirc. 71 (2), 203–214. https://doi.org/10.3233/CH-189412
Ulker P., Sati L., Celik-Ozenci C., Meiselman H.J., Baskurt O.K. 2009. Mechanical stimulation of nitric oxide synthesizing mechanisms in erythrocytes. Biorheology. 46 (2), 121–132. https://doi.org/10.3233/BIR-2009-0532
Horobin J.T., Sabapathy S., Kuck L., Simmonds M.J. 2021. Shear stress and RBC-NOS serine1177 phosphorylation in humans: A dose response. Life (Basel). 11 (1), 36. https://doi.org/10.3390/life11010036
Giuffrè A., Vicente J.B. 2018. Hydrogen sulfide biochemistry and interplay with other gaseous mediators in mammalian physiology. Oxid. Med. Cell. Longev. 2018, 6290931. https://doi.org/10.1155/2018/6290931
Ustunova S., Takir S., Yilmazer N., Bulut H., Altindirek D., Hatirnaz O., ihan emirci Tansel C. D., Sonmez Uydes Dogan S.U., Ozbek U., Armutak E.I., Gurevin E.G. 2020. Hydrogen sulphide and nitric oxide cooperate in cardioprotection against ischemia/reperfusion injury in isolated rat Heart. In Vivo. 34 (5), 507–516. https://doi.org/10.21873/invivo.12067
Ali M.Y., Ping C.Y., Mok Y.Y., Ling L., Whiteman M., Bhatia M. 2006. Regulation of vascular nitric oxide in vitro and in vivo; a new role for endogenous hydrogen sulphide? Brit. J. Pharmacol. 149, 625–634. https://doi.org/10.1038/sj.bjp.0706906
Magierowski M., Magierowska K., Hubalewska-Mazgaj M., Surmiak M., Sliwowski Z., Mateusz Wierdak M., Kwiecien S., Chmura A., Brzozowski T. 2018. Cross-talk between hydrogen sulfide and carbon monoxide in the mechanism of experimental gastric ulcers healing, regulation of gastric blood flow and accompanying inflammation. Biochem. Pharmacol. 149, 131–142. https://doi.org/10.1016/j.bcp.2017.11.020
Nagpure B.V., Bian Jin-Song. 2016. Interaction of hydrogen sulfide with nitric oxide in the cardiovascular system. Oxid. Med. Cell. Longev. 2016, 6904327. https://doi.org/10.1155/2016/6904327
Vicente J.B., Malagrinò F., Arese M., Forte E., Sarti P., Giuffrè A. 2016. Bioenergetic relevance of hydrogen sulfide and the interplay between gasotransmitters at human cystathionine β-synthase. Biochim. Biophys. Acta. 1857 (8), 1127–1138. https://doi.org/10.1016/j.bbabio.2016.03.030
Huang Ya-Qian, Jin Hong-Fang, Zhang Heng, Tang Chao-Shu, Du Jun-Bao. 2021. Interaction among hydrogen sulfide and other gasotransmitters in mammalian physiology and pathophysiology. Adv. Exp. Med. Biol. 1315, 205–236. https://doi.org/10.1007/978-981-16-0991-6_9
Kleinbongard P., Schulz R., Rassaf T., Lauer T., Dejam A., Jax T. 2006. Red blood cells express a functional endothelial nitric oxide synthase. Blood. 107 (7), 2943–2951. https://doi.org/10.1182/blood-2005-10-3992
Mohandas N., Gallagher P.G. 2008. Red cell membrane: Past, present, and future. Blood. 112 (10), 3939–3948. https://doi.org/10.1182/blood-2008-07-161166
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


