Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 2, стр. 138-145
Зависимость каналообразующей способности лантибиотиков от липидного состава мембран
С. С. Ефимова a, *, Е. В. Шекунов a, Д. Н. Чернышова a, А. А. Захарова a, О. С. Остроумова a
a Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: efimova@incras.ru
Поступила в редакцию 28.08.2021
После доработки 22.10.2021
Принята к публикации 23.10.2021
- EDN: KXWKRM
- DOI: 10.31857/S0233475522020037
Аннотация
В работе исследована роль различных мембранных компонентов, фосфолипидов и липополисахаридов, в процессах формирования и функционирования ионных каналов, образуемых лантибиотиками класса А, низином, и класса В, циннамицином и дурамицином. Определены пороговые концентрации образования ионных каналов и разрушения плоских липидных бислоев под действием тестируемых лантибиотиков. Обнаружено, что низин способен формировать ионные каналы с проводимостью в диапазоне от 2 до 600 пСм при концентрации более 40 мкМ как в отрицательно заряженных липидных бислоях, включающих специфический адъювант мембран грамотрицательных бактерий, Кdo2–липид A, так и в кардиолипин-содержащих мембранах. Полученные результаты позволили выдвинуть предположение, что в модельных липидных мембранах без специфического рецептора низина, предшественника пептидогликана грамположительных бактерий, липида II, его роль способны выполнять Кdo2–липид A и кардиолипин. Установлено, что в концентрациях 1.5–3 мкМ циннамицин и его близкий аналог дурамицин индуцируют появление скачкообразных флуктуаций тока, соответствующих функционированию одиночных ионных каналов с амплитудой от 5 до 30 и от 50 до 900 пСм в мембранах из фосфатидилэтаноламина и кардиолипин-обогащенных бислоях соответственно. На основании полученных результатов сделан вывод о зависимости каналообразующей способности циннамицина и дурамицина от присутствия в мембране липидов, склонных к формированию инвертированных гексагональных фаз и индуцирующих отрицательную спонтанную кривизну липидных монослоев.
ВВЕДЕНИЕ
Лантибиотики – это высокоактивные небольшие (до 5 кДа) термостабильные пептиды бактериального происхождения. К настоящему моменту описано уже более 100 пептидов, и их число продолжает увеличиваться. Пептиды синтезируются на рибосомах в неактивной форме “пре-пептидов”, содержащих N-концевой “лидерный пептид”, который далее подвергается интенсивной посттрансляционной модификации с образованием биологически активных пептидов [1, 2]. В ходе посттрансляционной модификации лантибиотики приобретают уникальную структуру: в составе появляются редкие аминокислоты, такие как 2,3-дидегидроаланин (Dha), 2,3-дидегидробутирин (Dhb) и α-аминомасляная кислота (Abu), и образуются лантиониновые (Lan, между аминокислотными остатками Ala–Ala) и метиллантиониновые (β-MeLan, между аминокислотными остатками Ala–Abu) мостики [3, 4]. Наличие редких аминокислотных остатков и кольцевых структур в молекулах пептидов и придает лантибиотикам их уникальные свойства, включая антимикробную активность и термоустойчивость.
Современная классификация лантибиотиков включает три класса, отличающиеся друг от друга последовательностью лидерного пептида и механизмом посттрансляционных модификаций: А, В и двупептидные лантибиотики [5, 6]. На основе заряда и размера молекул, а также последовательности лидерного пептида лантибиотики класса A дополнительно разделяют на группы АI и AII [4]. Лантибиотики группы AI содержат в своем лидерном пептиде высококонсервативный домен из аминокислот “Phe–Asn–Leu–Asp”. Посттрансляционные модификации данной группы пептидов выполняют белки LanB (дегидратация) и LanC (замыкание в цикл) [7]. Лантибиотики группы AII характеризуется наличием в лидерном пептиде консервативной последовательности “Glu–Val–х–х–х–Val–Leu”, где x – любая аминокислота. В составе пептидных молекул этой группы также отмечается большое количество остатков аспарагиновой кислоты (Asp). Процесс посттрансляционной модификации этих пептидов зависит от фермента LanM, который отвечает за активацию как реакций дегидратации, так и замыкания в цикл [7]. Лантибиотики класса B характеризуются глобулярной и компактной структурой и не имеют отрицательного заряда при нейтральных значениях pH [7]. Третьим классом являются двупептидные лантибиотики, состоящие из двух отдельных пептидов, каждый из которых обладает слабой антибактериальной активностью или вообще ее не имеет, а при совместном применении становятся высоко эффективными [7, 8]. К настоящему времени среди лантибиотиков класса A и B наиболее подробно изучены низин и циннамицин/дурамицин соответственно.
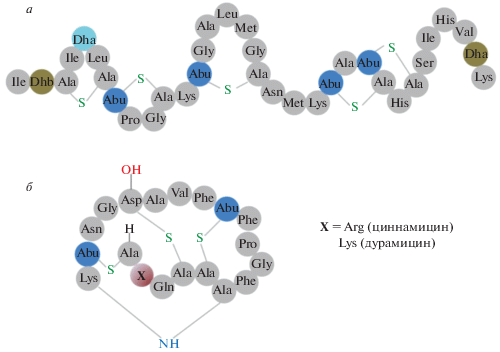
Низин – катионный термостабильный и гидрофобный лантибиотик группы АI, который состоит из 34 аминокислот [9]. Низин является примером лантибиотика “широкого спектра действия”, эффективного в отношении многих грамположительных организмов, включая Listeria monocytogenes, Staphylococcus aureus, Bacillus cereus [10, 11]. Грамотрицательные бактерии защищены своей внешней мембраной, но могут стать восприимчивыми к действию низина после теплового шока или в сочетании с хелатором EDTA [12, 13]. Низин содержит в своей структуре четыре нестандартных аминокислотных остатка Dha и Dhb и 5 колец (А, B, C, D, E), образованных одним Lan и четырьмя β-MeLan мостиками (рис. 1а) [14]. Введение в кольцо A дополнительного положительного заряда или удаление D- и E-колец уменьшает антимикробную активность пептида в несколько сотен раз [14, 15]. “Шарнирный участок”, который находится в области между кольцами C и D [16], изменяет параллельную ориентацию N-концевого участка низина на перпендикулярную при наличии в мембране молекул липида II [17], с которым преимущественно связывается низин.
Рис. 1.
Структуры тестируемых лантибиотиков: низина (а) и циннамицина/дурамицина (б). Обозначения редких аминокислот: Dha – 2,3-дидегидроаланин, Dhb – 2,3-дидегидробутирин, Abu – α-аминомасляная кислота.
В литературе широко обсуждается гипотеза о том, что при взаимодействии низина с липидом II в мембране образуются сквозные поры со стехиометрией пептид : липид 2 : 1 [18, 19]. Показано, что присутствие липида II в диолеоилфосфатидилхолиновых мембранах стабилизирует низиновые поры [16]. Введение низина в анионные мембраны из пальмитоилолеоилфосфатидилсерина вызывает увеличение локальной концентрации положительно заряженного пептида, по сравнению с нейтральными бислоями из пальмитоилолеоилфосфатидилхолина. Это приводит к возникновению напряжения в мембране, изменению кривизны в этой области и, как следствие, образованию трансмембранных пор без участия липида II [20]. Согласно литературным данным, низин может избирательно подавлять рост опухолевых клеток, индуцируя усиленный апоптоз клеток и уменьшая их пролиферацию [21].
Циннамицин и дурамицин – лантибиотики класса B, состоящие из 19 аминокислотных остатков и отличающиеся по единственному остатку во втором положении (Arg вместо Lys соответственно) (рис. 1б). Молекулы пептидов содержат одно Lan и два β-MeLan кольца, а также кольцевую структуру между аминокислотными остатками в положении 6 и 19 [22]. Укладка молекулы предполагает пространственное разделение гидрофобного (включающего три остатка Phe) и гидрофильного участков [22]. Конформация гидрофобного участка молекулы в липидном микроокружении меняется вследствие взаимодействия с гидрофобными частями липидных молекул. Циннамицин и дурамицин способны эффективно подавлять рост B. subtilis, анаэробных бактерий, грибов, а также некоторые вирусные инфекции [23].
Считается, что механизм действия циннамицина и дурамицина связан с их способностью избирательно связываться с фосфатидилэтаноламином в обогащенных этим липидом мембранах бактериальных клеток [24–26]. При связывании пептида и фосфатидилэтаноламина полярная “головка” этого липида, независимо от вида присоединенных к липиду жирнокислотных остатков, взаимодействует с карманом молекулы лантибиотика между 7 и 15 аминокислотными остатками, содержащими липофильные боковые цепи [22, 27]. Стабилизация такого комплекса происходит за счет электростатического взаимодействия между аммониевой группой этаноламина и карбоксильной группой Asp в 15 положении. Образование комплексов фосфатидилэтаноламин–лантибиотик вызывает нарушение трансмембранного транспорта белков [28], индукцию проницаемости мембраны для ионов, в том числе за счет образования ионных каналов [29], а также снижение уровня внутриклеточного кальция [30].
Учитывая, что липидное микроокружение в процессах формирования и функционирования различных каналов, образованных антимикробными пептидами, является ключевым фактором [31–38], целью этой работы являлось изучение липидной специфичности действия лантибиотиков, низина, циннамицина и дурамицина. Обнаружено, что низин способен формировать ионные каналы в мембранах, включающих Кdo2–липид A или кардиолипин. Сделан вывод о зависимости каналообразующей способности циннамицина и дурамицина от присутствия в мембране липидов, склонных к формированию инвертированных гексагональных фаз и индуцирующих отрицательную спонтанную кривизну липидных монослоев. Полученные результаты расширяют представления о молекулярных механизмах взаимодействия лантибиотиков с липидными мембранами как первичной мишенью их антимикробного действия.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали: 1,2-диолеоил-sn-глицеро-3-фосфохолин (ДОФХ), 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (ДОФЭ), 1,2-диолеоил-sn-глицеро-3-фосфосерин (ДОФС), 1,2-диолеоил-sn-глицеро-3-фосфо-(1′-rac-глицерин) (ДОФГ), 1',3'-бис-[1,2-диолеоил-sn-глицеро-3-фосфо]-1',3'-глицерин (ТОКЛ), ди[3-дезокси-D-манно-октулозонил]-липид A (Кdo2-липид A), низин из Lactococcus lactis, циннамицин из Streptomyces cinnamoneus, дурамицин из Streptoverticillium cinnamoneus, KCl, KOH, HEPES, пентан, этанол (Sigma-Aldrich).
Формирование плоских липидных бислоев проводили по методу Монтала и Мюллера путем сведения конденсированных липидных монослоев на отверстии в тефлоной пленке, разделяющей экспериментальную камеру на два отделения [39]. Монослои формировали из ДОФХ или ДОФЭ, эквимолярных смесей ДОФХ/ДОФС, ДОФЭ/ ДОФС, ДОФЭ/ДОФГ, ДОФХ/ТОКЛ или ДОФЭ/ ТОКЛ, а также смесей ДОФХ/ДОФС и ДОФХ/ ДОФГ, включающих 1 мол. % Кdo2–липида A. Липидные бислои омывались 0.1 M раствором KCl (5 мM HEPES, рH 7.4). Лантибиотики (низин, дурамицин и циннамицин) добавляли к водной фазе одного (цис-) отделения камеры из водного раствора до концентраций, указанных в табл. 1. Электрофизиологические измерения проводили при комнатной температуре.
Таблица 1.
Пороговые концентрации тестируемых лантибиотиков, характеризующие их каналообразующую (СC, мкМ) или детергентную активность (СB, мкМ) в модельных липидных мембранах различного состава
| Состав мембраны | Низин | Циннамицин | Дурамицин | |||
|---|---|---|---|---|---|---|
| СC | СB | СC | СB | СC | СB | |
| ДОФХ | – | >2000 | – | >10 | – | >12 |
| ДОФХ/ДОФС | – | >700 | – | >14 | – | >13 |
| ДОФХ/ДОФС/Кdo2–липид A | 50 ± 10 | >300 | – | – | – | – |
| ДОФХ/ДОФГ/Кdo2–липид A | 55 ± 15 | >300 | – | – | – | – |
| ДОФХ/ТОКЛ | 40 ± 10 | >500 | 1.7 ± 0.6 | 10 ± 2 | 1.9 ± 0.5 | 12 ± 2 |
| ДОФЭ | – | >2200 | 1.9 ± 0.5 | 10 ± 2 | 2.2 ± 0.6 | 15 ± 2 |
| ДОФЭ/ДОФС | – | >600 | 1.6 ± 0.4 | 9 ± 1 | 2.8 ± 0.4 | 14 ± 1 |
| ДОФЭ/ДОФГ | – | >700 | 1.5 ± 0.6 | 10 ± 2 | 2.9 ± 0.5 | 10 ± 2 |
| ДОФЭ/ТОКЛ | 35 ± 5 | >600 | 1.5 ± 0.5 | 9 ± 2 | 2.1 ± 0.6 | 12 ± 2 |
Измерение токов проводимости выполняли в режиме фиксации потенциала на липидном бислое. Подачу трансмембранного напряжения и отведение сигнала с мембраны осуществляли с помощью хлорсеребряных электродов, соединенных с растворами камеры через агарозные мостики (1.5% агарозы в 2 М KCl). Трансмембранное напряжение, вызывающее поток катионов из цис- в транс-отделение камеры, считали положительным.
Регистрацию токов в режиме фиксации потенциала проводили с помощью Axopatch 200B (частота фильтрации 1 кГц) и Digidata 1440A (Axon Instruments, США). Обработку записей трансмембранных токов осуществляли с применением программного пакета Clampfit 9.0 (Axon Instruments, США). Статистический анализ полученных данных проводили при помощи программы Origin 8.0 (OriginLab, США).
В мембранах различного состава определены пороговые концентрации лантибиотиков, приводящие к появлению скачкообразных флуктуаций тока (CC), и их концентрации, оказывающие детергентное действие на бислой (CB). Проводимость каналов вычисляли как отношение тока, протекающего через одиночный ионный канал, к приложенному трансмембранному напряжению. Эксперименты выполнены в 4–10 независимых повторностях, средние величины представлены в виде среднее ± стандартное отклонение (среднее ± SE).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 представлены характеристические параметры действия тестируемых лантибиотиков на липидные бислои различного состава. Установлено, что в мембранах из ДОФХ низин не способен формировать ионные каналы, а увеличение концентрации лантибиотика до 2 мМ приводит к разрушению (дезинтеграции) ДОФХ бислоев (табл. 1). Замена ДОФХ на ДОФЭ не сопровождается появлением скачкообразных флуктуаций тока, разрушение ДОФЭ мембран происходит при концентрациях более 2.2 мМ. Аналогичная картина (отсутствие скачкообразных флуктуаций тока) наблюдается при введении в состав ДОФХ или ДОФЭ мембран различных отрицательно заряженных липидов, ДОФС или ДОФГ. Однако присутствие в мембране отрицательно заряженных липидов снижает пороговую концентрацию детергентного действия низина до 0.6–0.7 мМ (табл. 1). Возможной причиной является наличие положительного заряда у низина, способствующего сорбции пептида на отрицательно заряженных мембранах.
Обнаружено, что введение в ДОФХ/ДОФС или ДОФХ/ДОФГ бислои 1 мол. % Кdo2–липид A, липополисахарида, характерного для наружной мембраны грамотрицательных бактерий, приводит к появлению скачкообразных флуктуаций трансмембранного тока при концентрации лантибиотика около 50 мкМ. На рис. 2а, 2б представлены примеры записей флуктуаций трансмембранного низин-индуцированного тока, протекающего через ДОФХ/ДОФС и ДОФХ/ДОФГ бислои, включающие 1 мол. % Кdo2–липида A, при трансмембранном напряжении 100 мВ. Видно, что низин индуцирует образование ионных каналов различной амплитуды. Их проводимость при трансмембранном напряжении 100 мВ варьирует в диапазоне от 2 до 600 пСм. Нарушение электрической стабильности ДОФХ/ДОФС или ДОФХ/ДОФГ мембран, содержащих 1 мол. % Кdo2–липида A, под действием низина происходит при концентрациях лантибиотика более 0.3 мМ (табл. 1).
Рис. 2.
Записи флуктуаций трансмембранного тока, протекающего через образованные низином ионные каналы в липидных бислоях из ДОФХ/ДОФС/Кdo2–липид A (а), ДОФХ/ДОФГ/Кdo2–липид A (б), ДОФХ/ТОКЛ (в) и ДОФЭ/ТОКЛ (г). Мембраны омываются 0.1 M раствором KCl (5 мМ HEPES, рH 7.4). Штриховые линии соответствуют 0 пА. Трансмембранное напряжение составляет 100 мВ.
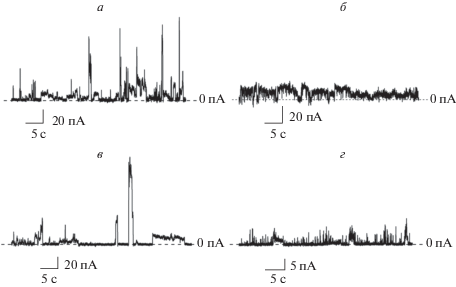
Обнаружено, что в концентрациях 35–40 мкМ низин также способен формировать ионные каналы в мембранах, обогащенных кардиолипином. На рис. 2в, 2г показаны примеры записей ступенеобразных флуктуаций тока, протекающего через ДОФХ/ТОКЛ и ДОФЭ/ТОКЛ мембраны в присутствии низина. Анализ наблюдаемых скачкообразных флуктуаций трансмембранного тока свидетельствует о каналах с проводимостью в диапазоне от 5 до 500 пСм при трансмембранном напряжении 100 мВ. Дальнейшее повышение концентрации лантибиотика вызывает рост числа скачкообразных флуктуаций трансмембранного тока, а при повышении концентрации до 0.5 мМ наблюдается разрушение бислоев (табл. 1).
Сопоставление результатов измерения способности низина индуцировать скачкообразные флуктуации тока, соответствующие функционированию одиночных ионных каналов, в мембранах различного состава позволило сделать заключение, что в отсутствие в мембране липида II (предшественника пептидогликана грамположительных бактерий), специфическими рецепторами низина могут выступать отрицательно заряженные липиды, имеющие более четырех углеводородных цепей, а именно Кdo2–липид A (липополисахарид грамотрицательных бактерий) и ТОКЛ (распространенный компонент бактериальных и митохондриальных мембран).
Установлено, что циннамицин при введении в омывающий мембрану раствор до концентрации 10 и 14 мкМ не увеличивает ионную проницаемость ДОФХ и ДОФХ/ДОФС бислоев соответственно (табл. 1). Дальнейшее увеличение концентрации лантибиотика вызывает дестабилизацию мембран указанного состава. Аналогичная ситуация наблюдается и для близкого аналога циннамицина, дурамицина. Увеличение отрицательной кривизны при замене ДОФХ на ДОФЭ [40, 41] (как в однокомпонентных мембранах, так и в бислоях, сформированных из бинарных смесей с отрицательно заряженными липидами ДОФС или ДОФГ) сопровождается появлением ионных каналов, образованных лантибиотиками. Скачкообразные флуктуации трансмембранного тока в ДОФЭ мембранах наблюдаются при концентрации циннамицина/дурамицина около 2 мкМ, а разрушение ДОФЭ бислоев происходит при увеличении концентрации лантибиотиков до 10–15 мкМ (табл. 1). Записи флуктуаций тока, соответствующих открыванию и закрыванию индуцированных циннамицином и дурамицином одиночных ионных каналов в ДОФЭ бислоях, представлены на рис. 3а, 3г соответственно. Анализ большого числа скачкообразных флуктуаций тока демонстрирует, что при трансмембранном напряжении 100 мВ проводимость ионных каналов варьирует от 5 до 30 пСм. В случае ДОФЭ/ ДОФС и ДОФЭ/ДОФГ бислоев скачкообразные флуктуации наблюдаются при концентрации около 1.5 и 3 мкМ для циннамицина и дурамицина соответственно, а разрыв мембраны происходит при концентрациях пептидов более 10 мкМ.
Рис. 3.
Записи флуктуаций трансмембранного тока, протекающего через образованные циннамицином (верхняя панель) и дурамицином (нижняя панель) ионные каналы в липидных бислоях из ДОФЭ (а, г), ДОФХ/ТОКЛ (б, д) и ДОФЭ/ТОКЛ (в, е). Мембраны омываются 0.1 M раствором KCl (5 мM HEPES, рH 7.4). Штриховые линии соответствуют 0 пА. Трансмембранное напряжение составляет 100 мВ.
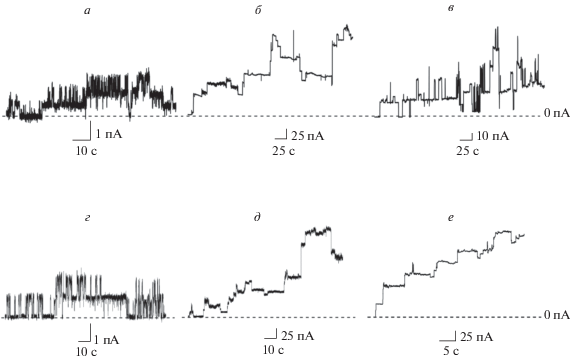
Обнаружено, что введение ТОКЛ в состав бислоев из ДОФХ также сопровождается появлением ионных каналов. В мембранах указанного состава скачкообразные флуктуации тока наблюдаются при концентрации циннамицина и дурамицина 1.7 и 1.9 мкМ соответственно (табл. 1). В близких концентрациях (от 1.5 до 2.0 мкМ) циннамицин и дурамицин проявляют каналообразующую способность в ДОФЭ/ТОКЛ бислоях. На рис. 3б, 3в, 3д, 3е показаны примеры записей ступенеобразных флуктуаций трансмембранного тока, протекающего через ДОФХ/ТОКЛ и ДОФЭ/ТОКЛ мембраны в присутствии тестируемых лантибиотиков. Из рис. 3б, 3в, 3д, 3е видно, что флуктуации тока характеризуются различной амплитудой, и проводимость циннамицин- и дурамицин-индуцированных ионных каналов при трансмембранном напряжении 100 мВ варьирует от 50 до 900 пСм соответственно. Как и в случаях мембран другого липидного состава, разрушение ТОКЛ-содержащих бислоев происходит при достижении циннамицином и дурамицином концентрации более 10–12 мкМ.
Как следует из табл. 1, циннамицин и дурамицин не проявляют активности в отношении бислоев, которые не включают липиды, характеризующиеся формой инвертированного конуса и индуцирующие отрицательную спонтанную кривизну липидных монослоев, в частности, фосфатидилэтаноламин и кардиолипин.
Таким образом, полученные в работе результаты указывают на вероятность формирования ионных каналов низином в отсутствие липида II. В этом случае ключевым фактором формирования ионных каналов лантибиотиком может являться специфическое взаимодействие низина с Кdo2–липид A или ТОКЛ. Обнаруженное преимущественное взаимодействие низина с кардиолипином может объяснять противоопухолевое действие этого лантибиотика. Каналообразующая активность циннамицина и дурамицина зависит от формы мембранообразующих липидов: обязательным условием формирования ионных каналов является наличие липидов, характеризующихся формой инвертированного конуса и индуцирующих отрицательную спонтанную кривизну липидных монослоев, в частности, ДОФЭ и ТОКЛ. Полученные результаты расширяют представления о молекулярных механизмах взаимодействия лантибиотиков с липидными мембранами как первичной мишенью их антибактериального и противоопухолевого действия.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-14-00110).
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Sahl H.G., Jack R.W., Bierbaum G. 1995. Biosynthesis and biological activities of lantibiotics with unique post-translational modifications. Eur. J. Biochem. 230, 827–853.
Sahl H.G., Bierbaum G. 1998. Lantibiotics: Biosynthesis and biological activities of uniquely modified peptides from gram-positive bacteria. Annu. Rev. Microbiol. 52, 41–79.
Jack R.W., Sahl H.G. 1995. Unique peptide modifications involved in the biosynthesis of lantibiotics. Trends Biotechnol. 13, 269–278.
McAuliffe O., Ross R.P., Hill C. 2001. Lantibiotics: Structure, biosynthesis and mode of action. FEMS Microbiol. Rev. 25, 285–308.
Willey J.M., van der Donk W.A. 2007. Lantibiotics: Peptides of diverse structure and function. Annu. Rev. Microbiol. 61, 477–501.
Knerr P.J., van der Donk W.A. 2012. Discovery, biosynthesis, and engineering of lantipeptides. Annu. Rev. Biochem. 81, 479–505.
Chatterjee C., Paul M., Xie L., van der Donk W.A. 2005. Biosynthesis and mode of action of lantibiotics. Chem. Rev. 105, 633–684.
Pag U., Sahl H.G. 2002. Multiple activities in lantibiotics – models for the design of novel antibiotics? Curr. Pharm. Des. 8, 815–833.
Gross E., Morell J.L. 1971. The structure of nisin. J. Am. Chem. Soc. 93, 4634–4635.
Li B., Yu J.P., Brunzelle J.S., Moll G.N., van der Donk W.A., Nair S.K. 2006. Structure and mechanism of the lantibiotic cyclase involved in nisin biosynthesis. Science. 311, 1464–1467.
Lubelski J., Rink R., Khusainov R., Moll G.N., Kuipers O.P. 2008. Biosynthesis, immunity, regulation, mode of action and engineering of the model lantibiotic nisin. Cell Mol. Life Sci. 65, 455–476.
Stevens K., Sheldon B., Klapes N., Klaenhammer T. 1991. Nisin treatment for inactivation of Salmonella species and other Gram-negative bacteria. Appl. Environ. Microbiol. 57, 3613–3615.
Boziaris I., Adams M. 1999. Effect of chelators and nisin produced in situ on inhibition and inactivation of Gram-negatives. Int. J. Food Microbiol. 53, 105–113.
Chan W.C., Bycroft B.W., Lian L.Y., Roberts G.C. 1989. Isolation and characterisation of two degradation products derived from the peptide antibiotic nisin. FEBS Lett. 252, 29–36.
Draper L.A., Cotter P.D., Hill C., Ross R.P. 2015. Lantibiotic resistance. Microbiol. Mol. Biol. Rev. 79, 171–191.
Wiedemann I., Breukink E., van Kraaij C., Kuipers O.P., Bierbaum G., de Kruijff B., Sahl H.G. 2001. Specific binding of nisin to the peptidoglycan precursor lipid II combines pore formation and inhibition of cell wall biosynthesis for potent antibiotic activity. J. Biol. Chem. 276, 1772–1779.
Van Heusden H.E., de Kruijff B., Breukink E. 2002. Lipid II induces a transmembrane orientation of the pore-forming peptide lantibiotic nisin. Biochem. 41, 12171–12178.
Brötz H., Josten M., Wiedemann I., Schneider U., Götz F., Bierbaum G., Sahl H.G. 1998. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics. Mol. Microbiol. 30, 317–327.
Breukink E., Wiedemann I., van Kraaij C., Kuipers O.P., Sahl H.G., de Kruijff B. 1999. Use of the cell wall precursor lipid II by a pore-forming peptide antibiotic. Science. 286, 2361–2364.
Prince A., Sandhu P., Ror P., Dash E., Sharma S., Arakha M., Jha S., Akhter Y., Saleem M. 2017. Lipid-II independent antimicrobial mechanism of nisin depends on its crowding and degree of oligomerization. Sci. Rep. 6, 37908.
Joo N.E., Ritchie K., Kamarajan P., Miao D., Kapila Y.L. 2012. Nisin, an apoptogenic bacteriocin and food preservative, attenuates HNSCC tumorigenesis via CHAC1. Cancer Med. 1, 295–305.
Rzeźnicka I.I., Sovago M., Backus E.H., Bonn M., Yamada T., Kobayashi T., Kawai M. 2010. Duramycin-induced destabilization of a phosphatidylethanolamine monolayer at the air-water interface observed by vibrational sum-frequency generation spectroscopy. Langmuir. 26, 16055–16062.
Gomes K.M., Duarte R.S., de Freire Bastos M.D.C. 2017. Lantibiotics produced by Actinobacteria and their potential applications. Microbiology (Reading). 163, 109–121.
Dunkley E.A.Jr, Clejan S., Guffanti A.A., Krulwich T.A. 1988. Large decreases in membrane phosphatidylethanolamine and diphosphatidylglycerol upon mutation to duramycin resistance do not change the protonophore resistance of Bacillus subtilis. Biochim. Biophys. Acta. 943, 13–18.
Machaidze G., Ziegler A., Seelig J. 2002. Specific binding of Ro 09-0198 (cinnamycin) to phosphatidylethanolamine: A thermodynamic analysis. Biochem. 41, 1965–1971.
Kim S.E., Park J.W. 2019. Analysis of interactions between cinnamycin and biomimetic membranes. Colloids Surf. B Biointerfaces. 185, 110595.
Iwamoto K., Hayakawa T., Murate M., Makino A., Ito K., Fujisawa T., Kobayashi T. 2007. Curvature-dependent recognition of ethanolamine phospholipids by duramycin and cinnamycin. Biophys. J. 93, 1608–1619.
Chen L., Tai P.C. 1987. Effects of antibiotics and other inhibitors on ATP-dependent protein translocation into membrane vesicles. J. Bacteriol. 169, 2373–2379.
Sheth T.R., Henderson R.M., Hladky S.B., Cuthbert A.W. 1992. Ion channel formation by duramycin. Biochim. Biophys. Acta. 1107, 179–185.
Grasemann H., Stehling F., Brunar H., Widmann R., Laliberte T.W., Molina L., Döring G., Ratjen F. 2007. Inhalation of Moli1901 in patients with cystic fibrosis. Chest. 131, 1461–1466.
Ostroumova O.S., Efimova S.S., Schagina L.V. 2012. Probing amphotericin B single channel activity by membrane dipole modifiers. PLoS One 7, e30261.
Ostroumova O.S., Efimova S.S., Chulkov E.G., Schagina L.V. 2012. The interaction of dipole modifiers with polyene-sterol complexes. PLoS One 7, e45135.
Ostroumova O.S., Efimova S.S., Mikhailova E.V., Schagina L.V. 2014. The interaction of dipole modifiers with amphotericin-ergosterol complexes. Effects of phospholipid and sphingolipid membrane composition. Eur. Biophys. J. 43, 207–215.
Ефимова С.С., Щагина Л.В., Остроумова О.С. 2014. Исследование каналообразующей активности полиеновых антибиотиков в липидных бислоях с использованием дипольных модификаторов. Acta Naturae. 6 (4), 72–85.
Efimova S.S., Zakharova A.A., Schagina L.V., Ostroumova O.S. 2016. Two types of syringomycin E channels in sphingomyelin-containing bilayers. Eur. Biophys. J. 45, 91–98.
Efimova S.S., Zakharova A.A., Ismagilov A.A., Schagina L.V., Malev V.V., Bashkoriv P.V., Ostroumova O.S. 2018. Lipid-mediated regulation of pore-forming activity of syringomycin E by thyroid hormones and xanthene dyes. Biochim. Biophys. Acta. 1860, 691–699.
Efimova S.S., Zakharova A.A., Medvedev R.Ya., Ostroumova O.S. 2018. Ion channels induced by antimicrobial agents in model lipid membranes are modulated by plant polyphenols through surrounding lipid media. J. Membr. Biol. 251, 551–562.
Zakharova A.A., Efimova S.S., Malev V.V., Ostroumova O.S. 2019. Fengycin induced ion channels on lipid bilayers mimicking target fungal cell membrane. Sci. Rep. 9, 16034.
Montal M., Muller P. 1972. Formation of bimolecular membranes from lipid monolayers and study of their electrical properties. Proc. Nat. Acad. Sci. USA. 65, 3561–3566.
Gawrisch K., Holte L.L. 1996. NMR investigations of nonlamellar phase promoters in the lamellar phase state. Chem. Phys. Lipids. 81, 105–116.
Kollmitzer B., Heftberger P., Rappolt M., Pabst G. 2013. Monolayer spontaneous curvature of raft-forming membrane lipids. Soft Matter. 9, 10 877–10 884.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


