Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 2, стр. 85-106
Липосомы как адъюванты и системы доставки вакцин
Д. С. Третьякова a, Е. Л. Водовозова a, *
a Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
* E-mail: elvod@lipids.ibch.ru
Поступила в редакцию 19.09.2021
После доработки 22.09.2021
Принята к публикации 24.09.2021
- EDN: PIEYIW
- DOI: 10.31857/S0233475522020074
Аннотация
Обзор посвящен липосомам как системам, представляющим значительный интерес в качестве адъювантных носителей в вакцинологии благодаря своей многофункциональности и максимальной биосовместимости. Исследования и разработки по применению липосом и липидных наночастиц для создания субъединичных вакцин с целью профилактики и лечения в первую очередь инфекционных заболеваний развиваются уже несколько десятилетий. В последние годы в этой области достигнут серьезный прогресс благодаря совершенствованию технологии промышленного производства разнообразных липидов высокого класса чистоты, пригодных для парентерального введения, и появлению новых технологий и оборудования для производства липосомальных препаратов. При разработке вакцин необходимо учитывать особенности функционирования иммунной системы организма (врожденный и адаптивный иммунитет). В обзоре кратко рассмотрены некоторые фундаментальные механизмы, лежащие в основе мобилизации иммунитета при встрече с антигеном, а также влияние липосом-носителей на процессы интернализации антигенов иммунокомпетентными клетками и пути индукции иммунного ответа. Результаты исследований влияния размера липосом, их заряда, фазового состояния бислоя, которое зависит от липидного состава, на взаимодействия липосом с антиген-презентирующими клетками зачастую противоречивы, поэтому в каждом конкретном случае следует проводить специальные исследования. Введение в состав липосомальных вакцинных комплексов иммуностимуляторных компонентов – лигандов рецепторов патоген-ассоциированных молекулярных паттернов – позволяет модулировать силу и тип иммунного ответа. В обзоре кратко рассмотрены одобренные для применения в клинике вакцины на основе липосом для терапии и профилактики инфекционных заболеваний, в том числе липидные наночастицы с мРНК. Приведены примеры липосомальных вакцин, которые проходят различные стадии клинических исследований.
ВВЕДЕНИЕ
Актуальность разработки эффективных и безопасных средств для лечения и профилактики вирусных инфекций в настоящее время обозначилась с особой силой в связи с осознанием рисков возникновения пандемий и их разрушительных последствий для социально-экономического состояния отдельных государств и мира в целом. Мировое научное сообщество приступило к ускоренной разработке вакцин, способных активировать как клеточное, так и гуморальное звенья иммунитета и формировать долговременную иммунологическую память. Традиционные вакцины представляют собой живые ослабленные или инактивированные/убитые патогены. Они не нуждаются в адъювантах, так как содержат не только антигены, но и другие компоненты бактериального или вирусного происхождения, которые эффективно активируют сразу несколько компонентов врожденной иммунной системы. Однако риск развития аллергических и аутоиммунных реакций в ответ на введение таких агентов, а также трудности создания, производства и транспортировки вакцин на их основе для некоторых заболеваний стимулировали развитие других вакцинных стратегий [1]. Субъединичные вакцины содержат, как правило, только поверхностные антигены (белки или пептиды), что уменьшает содержание белка в вакцине и таким образом снижает ее аллергенность, однако такие вакцины менее иммуногенны. Упаковка антигенов в частицы сравнимых с вирусами или бактериями размеров (от сотен нанометров до нескольких микрометров) позволяет преодолеть недостатки этих вакцин и дает дополнительные преимущества [2, 3]: антигены защищены от преждевременной деградации, стимулируется их захват антиген-презентирующими клетками посредством пассивного или направленного транспорта, обеспечивается депо для пролонгированной презентации антигенов, появляется возможность одновременной доставки в клетку антигенов и адъювантов-иммуностимуляторов, что позволяет управлять типом иммунного ответа (гуморальным или клеточным). В данном обзоре рассмотрены липосомы как системы, представляющие значительный интерес в качестве адъювантных носителей в вакцинологии благодаря своей многофункциональности и высокой биосовместимости. Способность липосом индуцировать иммунный ответ на антигены, инкапсулированные во внутренний объем или ассоциированные с поверхностью, впервые была описана Аллисон и Грегориадисом [4, 5]. С тех пор развиваются исследования и разработки по применению липосом и липидных наночастиц (ЛНЧ, невезикулярных надмолекулярных систем, в отличие от классических липосом) для создания вакцин с целью профилактики и лечения инфекционных и онкологических заболеваний (обзоры [2, 6–9]). В настоящее время коммерчески доступны липосомальные вакцины против вирусов гриппа и гепатита А, малярии и вируса Varicella zoster (Inflexal®, Epaxal®, Mosquirix® и Shingrix® соответственно); целый ряд липосомальных препаратов проходит клинические испытания в качестве профилактических и лечебных вакцин против малярии, гриппа, туберкулеза, ВИЧ, лихорадки Денге [6–10] и др. Вакцины на основе липосом отличаются безопасностью и зачастую высокой эффективностью. Например, Epaxal® при однократном введении грудным детям продемонстрировал 100% защиту при отсутствии побочных эффектов, в отличие от традиционных прививок алюминий-содержащими вакцинами, при которых обеспечивается защита лишь на 66.6% и требуется повторная вакцинация [11]. Профилактическая вакцина Shingrix® (GlaxoSmithKline) на 90% защищает от опоясывающего лишая [12]. Наконец, пандемия вируса SARS-CoV-2, охватившая мир в последние 2 года, способствовала интенсивной разработке, стремительной коммерциализации и внедрению в клинику высокоэффективных профилактических вакцин на основе липидных наночастиц и мРНК вирусного S-белка (Pfizer/BioNTech и Moderna).
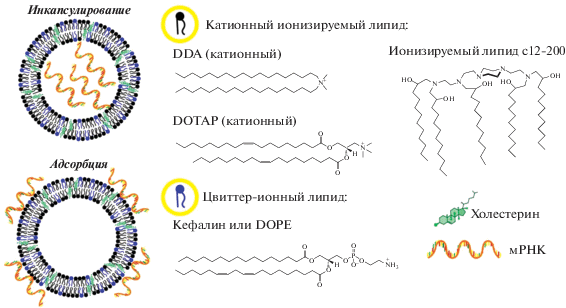
Преимущество липосомальных систем доставки заключается в их пластичности, то есть возможности создания самых разнообразных конструкций в зависимости от химических свойств молекул антигенов и требуемого типа иммунного ответа. Можно варьировать состав липидов, заряд и размер липосом или ЛНЧ, локализацию антигенов или адъювантов в супрамолекулярном комплексе вакцины. Водорастворимые антигены – белки, пептиды, нуклеиновые кислоты, углеводы – инкапсулируют во внутренний водный объем липосом, а липофильные/амфифильные субстанции, в том числе липопептиды, гликолипиды, адъюванты и др., встраивают в липидный бислой. Антигены также ассоциируют с поверхностью липосом путем адсорбции или ковалентного связывания, и в одном препарате можно сочетать различные типы антигенов и адъювантов-иммуностимуляторов [13, 14]. Тем не менее необходимо учитывать, что липосомы, как и другие вакцинные препараты, в зависимости, например, от способа введения в организм могут вызывать и нежелательные эффекты, опосредованные иммунной системой, такие как гиперчувствительность, иммуносупрессию и др. [15, 16].
В настоящем обзоре кратко рассмотрены некоторые фундаментальные механизмы, лежащие в основе мобилизации иммунной системы организма при встрече с антигеном, и влияние липосом-носителей на процессы интернализации антигенов иммунокомпетентными клетками, и пути индукции иммунного ответа. Затем приведены примеры вакцин на основе липосом для терапии и профилактики инфекционных заболеваний.
ФАКТОРЫ ВРОЖДЕННОГО И АДАПТИВНОГО ИММУНИТЕТА
Врожденный иммунитет – первую линию системы защиты организма от патогенов – составляют белки системы комплемента и фагоциты, которые экспрессируют рецепторы (pattern recognition receptors, PRR), распознающие патоген-ассоциированные молекулярные паттерны (pathogen-associated molecular patterns, РАМР), активируются и запускают иммунный ответ путем презентации антигенов Т-лимфоцитам. Главными антиген-презентирующими клетками (antigene-presenting cells, APCs) являются дендритные клетки, хотя макрофаги также могут выполнять эту функцию [17]. Толл-подобные рецепторы (TLRs) на поверхности APCs распознают РАМР патогенов. Активация TLRs играет ключевую роль в развитии врожденного иммунного ответа и является его отличительным признаком [18].
Вторая линия защиты – адаптивный иммунитет – осуществляется посредством специфических иммунных ответов на молекулярные детерминанты патогенов в результате активации Т-лимфоцитов – CD4+ Т-хелперных (TН) клеток и CD8+ цитотоксических Т-лимфоцитов (CTLs) – и В-лимфоцитов, несущих на поверхности антиген-специфические рецепторы (BCR). Наиболее значимые субпопуляции TН-лимфоцитов представляют клетки TH1 и TH2 [18].
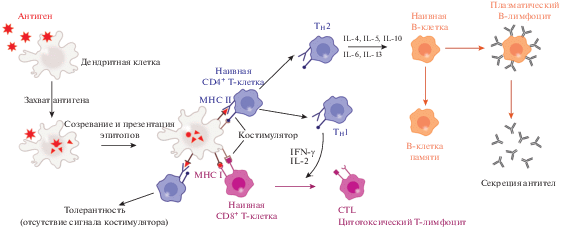
Источником дендритных клеток (DCs) являются клетки-предшественники костного мозга. Незрелые DCs циркулируют в периферических тканях до момента распознавания чужеродного антигена посредством PRR, после чего происходит фагоцитоз или рецептор-опосредованный эндоцитоз антигена и миграция (homing) DCs в лимфатические узлы. В процессе миграции DCs созревают, что сопровождается увеличением презентации на их поверхности молекул главного комплекса гистосовместимости (МНС), изменением паттерна экспрессии хемокиновых рецепторов, повышенной регуляцией костимуляторных молекул (CD80, CD86) и молекул адгезии Т-клеток (CD48, CD58) и продукцией ключевых цитокинов, таких как интерлейкин-12 (IL-12). В ходе созревания DCs расщепляют патогены до состояния малых пептидов – эпитопов, которые презентируются на поверхности APCs посредством молекул MHC класса I или класса II [19]. Презентация комплекса эпитопов с молекулами MHC наивным Т-клеткам происходит в лимфатических узлах.
При контакте DC и Т-клетки комплекс “пептид–молекула МНС” распознается Т-клеточными рецепторами (TCRs) (рис. 1). В дополнение к стимуляции TCR, для индукции клональной экспансии и дифференцировки в эффекторные клетки и клетки памяти Т-клетка должна получить второй, костимуляторный сигнал. Отсутствие последнего приводит к иммунологической толерантности [2]. Комплексы “пептид–молекула MHC класса I” стимулируют наивные CD8+ Т-лимфоциты, превращая их в CTLs, ответственные за клеточный иммунитет и уничтожение инфицированных клеток. Комплексы “пептид–молекула МНС класса II” активируют наивные CD4+ Т-лимфоциты, которые пролиферируют и дифференцируются в субпопуляции TH1 и TH2 в зависимости от типа инфекции. Клетки TH1 секретируют цитокины интерферон гамма (IFN-γ) и фактор некроза опухоли альфа (TNF-α), активирующие и регулирующие CTLs. Клетки TH2 взаимодействуют с В-лимфоцитами и вызывают их дифференцировку в плазматические клетки и клетки памяти. Плазматические В-клетки секретируют антитела, нейтрализующие антигены/патогены (гуморальный иммунитет), а В-клетки памяти формируют иммунологическую память, которая позволяет быстро распознавать патоген в случае повторного инфицирования.
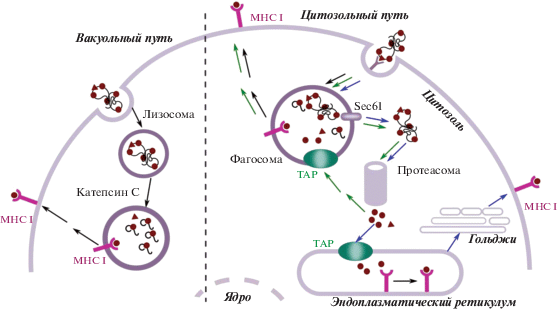
Как правило, экзогенные антигены после попадания в фаголизосомы APCs направляются в компартменты клетки, экспрессирующие молекулы МНС класса II, где образующиеся в результате протеолиза пептиды загружаются на новообразованные молекулы MHC класса II, и далее этот комплекс презентируется на клеточной мембране, в то время как эндогенные пептиды, которые протеасома генерирует из внутриклеточных белков, презентируются в комплексе с молекулами MHC класса I. Однако феномен кросс-презентации – пути презентации экзогенных антигенов, ведущего к нагрузке на молекулы MHC класса I – позволяет стимулировать цитотоксические Т-клетки в ответ на экзогенный антиген. Уникальная способность DCs и макрофагов осуществлять кросс-презентацию была обнаружена давно [20], однако точного представления о внутриклеточном механизме этого процесса до сих пор нет. Кросс-презентация может идти по вакуольному и цитозольному путям (рис. 2). Вакуольный путь опосредован лизосомальными протеазами и включает стадию пептидного обмена для перезагрузки эндосомальных комплексов с молекулами MHC класса I, которые затем перенаправляются непосредственно обратно на плазматическую мембрану [21]. Цитозольный путь, считающийся наиболее важным, зависит от транспортера, ассоциированного с процессингом антигена (ТАР), и протеасомы (антиген экспортируется в цитозоль за счет транслокона SEC61, который поступает в мембрану антиген-содержащих эндосом из эндоплазматического ретикулума [22]). Накоплено немало данных о кросс-презентации антигенов после захвата разнообразных наночастиц-носителей дендритными клетками, что свидетельствует о перспективности таких вакцинных систем, в том числе липосомальных, для индукции клеточного иммунитета [2, 3, 6].
ЛИПОСОМЫ И ВРОЖДЕННЫЙ ИММУНИТЕТ
Липосомы, как и любые частицы размеров вирусов и бактерий, фактически являются адъювантами: они распознаются APCs, циркулирующими в периферических тканях, и подвергаются фагоцитозу или рецепторно-опосредованному эндоцитозу. Механизм действия липосом как непосредственных активаторов врожденного иммунного ответа всесторонне рассмотрен в обзоре [9]. Отмечается важная роль некоторых фосфолипидов – главных компонентов мембраны липосом – в качестве предшественников ряда вторичных медиаторов при модуляции врожденных и адаптивных иммунных реакций посредством различных механизмов. Фосфолипиды играют важнейшую роль в физиологии и патологии фагоцитоза – критической стадии в ходе проявления врожденного иммунитета. Фагоцитоз начинается с распознавания частицы соответствующими рецепторами и образования фагоцитарной чаши, затем следует замыкание фагосомы и ее интернализация (рис. 2). Формирование и созревание фагосомы сопровождается скоординированными процессами сигнализации и внутриклеточного направленного транспорта, которые регулируются липидами [23, 24]. Липиды нескольких классов (см. далее) концентрируются в микродоменах клеточной мембраны и участвуют в трансдукции внешних сигналов [9, 25]. Кроме того, некоторые липиды влияют на кривизну мембраны, способствуя (в случае положительной кривизны) формированию фагосомы или, наоборот, затрудняя (в случае отрицательной кривизны) его, а также вовлекают в процесс сигнальные белки за счет формирования специфических липид-связывающих доменов и обеспечивают электростатический потенциал на поверхности мембраны для привлечения противоположно заряженных ключевых сигнальных и эффекторных белков [23–25]. Внутриклеточный везикулярный трафик регулируется контролируемой экспрессией липидов, роль которых в случае фагоцитоза заключается в содействии актам слияния/разделения мембран, что влияет на созревание бактерицидной фаголизосомы и/или путь презентации антигена на поверхности APCs [26].
В регуляцию реорганизации цитоскелета на ранних этапах фагоцитоза c участием актин-миозиновой системы вовлечены фосфоинозитиды [23]. Другие липиды, такие как арахидоновая кислота, церамиды, сфингозин, сфингомиелин и сфингозин-1-фосфат (S1P) активируют сборку актина и созревание фагосомы [27]. С учетом роли определенных липидов в физиологии фагоцитоза была предложена стратегия повышения эффективности врожденного иммунитета против бактериального инфицирования путем регуляции процесса созревания фагосомы с помощью биоактивных липидов. Так, в экспериментах in vitro S1P и лизофосфатидная кислота активировали ответ на микобактерии, опосредованный фосфолипазой D и зависимый от созревания фаголизосомы, в макрофагах человека [28, 29] и в альвеолярных эпителиальных клетках 2 типа [30]. Для целевой доставки таких липидов (вторичных мессенджеров) были разработаны липосомы с асимметричным распределением фосфолипидов в бислое, где внутренний монослой содержит биоактивные липиды, регулирующие созревание фагосомы, а наружный – фосфатидилсерин (PS), который характерен для апоптотических телец и презентирует сигнал “съешь меня” макрофагам. Доставка таким способом фосфатидной кислоты (РА) позволила повысить ответ на микобактериальную инфекцию в макрофагах и в клетках бронхоальвеолярного лаважа туберкулезных больных и пациентов с бактериальной пневмонией с множественной лекарственной устойчивостью [31, 32]. В модели муковисцидоза in vitro при использовании макрофагов, экспрессирующих фармакологически подавленный или мутантный трансмембранный регулятор муковисцидоза, для которых характерно нарушение созревания фагосомы, с помощью доставки PA или PI(5)P (фосфатидилинозит-5-фосфат) такими “двуликими” липосомами удалось повысить антибактериальный ответ против Pseudomonas aeruginosa [32]. Приведенные результаты демонстрируют возможность применения липосом для доставки биоактивных липидов с целью усиления антибактериального ответа за счет ускорения созревания фагосомы или же восстановления этого процесса в случае его нарушения специфическими патогенами [32].
Холестерин способствует уплотнению и стабилизации липидного бислоя, поэтому его часто вводят в состав липосом. В ранних исследованиях показано, что при иммунизации мышей путем внутривенного введения увеличение доли холестерина в липосомах с различными функционализированными производными липидов по полярным головным группам усиливает гуморальный иммунный ответ, что, очевидно, связано с большей стабильностью липосом в кровотоке [33]. Влияние холестерина на адъювантные свойства липосом неоднозначно, оно зависит от ряда характеристик липосом. Так, малые нейтральные моноламеллярные липосомы и крупные отрицательно заряженные мультиламеллярные липосомы при увеличении содержания холестерина вызывали активацию каскада комплемента в меньшей и большей степени соответственно [34]. В случае заражения лейшманиозом липосомальная доставка холестерина путем однократной внутрисердечной инъекции инфицированным хомячкам обеспечила сильный защитный терапевтический эффект [35]. Одним из факторов ослабления иммунного ответа хозяина на инвазию протозойных паразитов является истощение запасов холестерина в инфицированных макрофагах и последующее нарушение презентации антигенов из-за уменьшения вязкости мембран. Те же авторы показали, что холестерин в липосомальной форме реактивирует инфицированные Leishmania макрофаги и стимулирует врожденное звено иммунитета [36].
ЛИПОСОМЫ И АДАПТИВНЫЙ ИММУНИТЕТ
В отличие от внутренне присущего липосомам свойства активировать врожденный иммунитет, последующая индукция APCs секреции цитокинов, запускающих дифференцировку наивных Т-лимфоцитов в различные субпопуляции CD4+ и/или CD8+ Т-клеток, зависит от физико-химических характеристик липосом, таких как размер и липидный состав, определяющий фазовое состояние бислоя и их заряд, а также наличия костимуляторных молекул (иммуностимуляторов/ иммуномодуляторов). Сконструированные определенным образом липосомы, несущие антигены, могут одновременно активировать различные пути трансдукции сигнала и вызывать специфический Т- и/или В-клеточный ответ. Антигены, экспонированные на поверхности липосом, могут стимулировать В-лимфоциты, вызывая гуморальный иммунный ответ, а также индуцировать Т-клеточные реакции. Инкапсулированные антигены, для которых требуется внутриклеточное разрушение липосом, способны индуцировать CTLs [9]. Сведения о влиянии размера и состава липосом на их иммуногенность противоречивы. Кроме того, поскольку большинство липосом неспособны спонтанно проникать в лимфоузлы и могут транспортироваться в них только после интернализации периферическими APCs, способ введения препаратов (подкожно, внутрикожно, внутримышечно, внутривенно и др.) оказывает большое влияние на тип иммунного ответа [37]. Таким образом, в каждом конкретном случае при разработке липосомальной вакцины необходимо проводить специальное исследование.
Влияние размера частиц
Размер частиц может влиять на скорость их выведения из зоны инъекции и, следовательно, на кинетику накопления в лимфатических узлах. Он должен быть достаточно маленьким, чтобы частицы могли мигрировать через водные каналы интерстициальной ткани. Так, значительно большая часть липосом крупного размера задерживалась в месте введения при подкожной иммунизации, причем независимо от состава жидкофазного липидного бислоя – липосомы из яичного фосфатидилхолина–яичного фосфатидилглицерина–холестерина (еPC : еPG : Chol, 10 : 1 : 4; средние размеры 40, 70, 170, 400 нм и более) [38] или липосомы из еPC–диолеоилфосфатидилэтаноламина–диолеоилтриметиламмонийпропана (еРС : DOPE : DOTAP, 8 : 4 : 2; средние размеры 140 и 560 нм, индекс полидисперсносности, PDI, 0.15 и 0.6 соответственно) [39]. Однако разницы между накоплением липосом в дренирующих лимфатических узлах в течение 52 ч [38] или 8 дней [39] после инъекции не было. Авторы [38] предположили, что это связано с более эффективным удерживанием крупных липосом в лимфатических узлах, по сравнению с более мелкими липосомами, которые мигрируют далее в кровоток. Результаты этих исследований неоднозначны, так как не учитывалось влияние состава и заряда липосом. Кроме того, липосомальные дисперсии гетерогенны по размерам, и указанные значения являются средними по распределению, то есть образцы содержат достаточное количество частиц большего и меньшего размеров.
Крупные липосомы (>500 нм) преимущественно поглощаются макрофагами посредством макропиноцитоза, в то время как липосомы меньшего размера мигрируют в лимфоузлы путем пассивного транспорта и захватываются DCs, причем в обоих случаях может индуцироваться сильный иммунный ответ [40]. Соответственно размер липосом может определять его тип: для малых липосом более характерна стимуляция клеток TH1, а для крупных – TH2. Есть мнение, что для получения сильного иммунного ответа оптимальной является смесь частиц различного размера (обзор [41] и цит. лит.). Предпосылки для различной презентации антигена в зависимости от размера везикул наблюдали и после интернализации фагоцитами: антиген, инкапсулированный в крупные (560 нм) везикулы локализовался в ранних незрелых фагосомах, где превалирует захват молекулами МНС класса II для последующей презентации CD4+ T-клеткам, в то время как антиген в малых (155 нм) липосомах быстро попадал в поздние эндосомы/лизосомы, что уменьшало эффективность его рестриктирования молекулами MHC класса II [42]. Однако экспериментальные данные по вопросу зависимости “размер липосом–тип иммунного ответа” противоречивы. Кроме того, поскольку крупные липосомы способны задерживать антиген в месте инъекции, они поддерживают его концентрацию, обеспечивая постепенное высвобождение (эффект депо). Например, при изучении связи между размером липосом и эффективностью стимулирования гуморального иммунного ответа, мышей иммунизировали интраназально катионными моноламеллярными липосомами размера 70, 140 и 400 нм и мультиламеллярными гигантскими (без экструзии) липосомами [43]; при этом наивысшие титры иммуноглобулинов класса G (IgG) стимулировали самые малые моноламеллярные липосомы и гигантские мультиламеллярные; авторы полагают, что мультиламеллярные липосомы могут стимулировать сильный иммунный ответ за счет более надежной защиты антигена в многослойной конструкции от деградации.
В ряде работ показана зависимость типа иммунного ответа – TH1 или TH2 – от размера липосом [44, 45]. Например, при включении в качестве модельного антигена овальбумина (OVA) в липосомы размера ≥225 нм (состав 1-монопальмитоилглицерин–холестерин–дицетилфосфат, 5 : 4 : 1) подкожная вакцинация стимулировала у мышей сильный TH1-ответ, судя по уровню секреции IFN-γ и высокому титру сывороточного IgG2a. В то же время, тот же антиген, инкапсулированный в липосомы меньшего размера (≤155 нм), индуцировал ответ преимущественно по пути TH2-активации, о чем свидетельствовал уровень IgG1 и увеличение продукции IL-5 в лимфоузлах [45]. Аналогично, липосомы из дипальмитоилфосфатидилхолина–холестерина (DPPC–Chol, 2 : 1) размера ≥400 нм (вплоть до 1100 нм) индуцировали более сильный TH1-ответ, чем липосомы со средним размером 120 нм при подкожной иммунизации инкапсулированным главным поверхностным гликопротеином Leishmania rgp63 [46]. Такое влияние размера липосом связывают с различиями в трафике частиц в лимфоузлы: малые частицы (20–200 нм) свободно мигрируют в дренирующие лимфоузлы, где их захватывают резидентные DCs, в то время как крупные везикулы (более 500 нм) интернализуются тканеспецифическими DCs [47].
Однако в случае катионных липосом с бислоем в гелевой фазе (состав диоктадецилдиметиламмонийбромид–трегалоза-6,6'-дибегенат, DDA–TDB, получил коммерческое название CAF01; TDB – синтетический гликолипидный аналог фактора шнура (cord factor) микобактерий, активирует макрофаги и DCs), при сравнении влияния на иммунный ответ липосом со средними размерами 200, 700, 1500 и 2500 нм разницы обнаружено не было. Все препараты вводились внутримышечно и стимулировали TH1-ответ [48]. Возможно, это объясняется положительным зарядом поверхности, который позволяет даже малым липосомам образовать депо в месте введения за счет взаимодействия, например, с отрицательно заряженными интерстициальными белками.
Влияние состава липосом
Липидный состав бислоя определяет фазовое состояние мембраны липосом, которое, в свою очередь, существенно влияет на процессы слияния с цитоплазматической мембраной и мембранами органелл APCs и, следовательно, на пути презентации доставленного антигена. Показано, что жидкофазные липосомы с разупорядоченным липидным бислоем (liquid disordered phase, Ld) способствуют кросс-презентации антигенов молекулами MHC класса I в большей степени, чем липосомы с гелевым бислоем, построенным из насыщенных алифатических цепей (solid ordered phase, So) [49]. В то же время в экспериментах in vivo катионные твердофазные липосомы, полученные на основе DDA, индуцировали в 100 раз более сильный ответ ТН1-клеток по сравнению с жидкофазными липосомами из диметилдиолеоилламмоний(бромида) [50]. Твердофазный катионный адъювант CAF01 (см. выше) при введении в комбинации с субъединичной вакциной против Mycobacterium tuberculosis (Mtb) вызывал устойчивый антиген-специфический комплексный TH1/ TH17-ответ и частичную защиту от заражения Mtb [51]. Также и в ранней работе на примере жидкофазных липосом, чувствительных и нечувствитеьных к рН среды (DOPE–пальмитоилгомоцистеин и диолеоилфосфатидилхолин(DOPC)–диолеоилфосфатидилсерин соответственно), с различными инкапсулированными белковыми антигенами (OVA, мышиный гемоглобин, бычья рибонуклеаза или лизоцим куриного яйца) показано, что макрофаги эффективно процессируют антиген и представляют его продукты молекулам МНС класса II [52].
Липидный состав бислоя определяет и заряд поверхности липосом, который может кардинально повлиять на адъювантные свойства. Как правило, положительно заряженные липосомы поглощаются APCs в гораздо большей степени, чем отрицательно заряженные или нейтральные [53, 54]. Катионные липосомы могут взаимодействовать с отрицательно заряженными поверхностями слизистых, что пролонгирует время экспозиции антигена (эффект депо), усиливает эндоцитоз антиген-презентирующими клетками и клеточно-опосредованный иммунный ответ [10, 53–56] по сравнению с нейтральными липосомами, которые, как правило, индуцируют антитела [57]. Так, после внутримышечной иммунизации практически нейтральные липосомы из дистеароилфосфатидилхолина(DSPC)–TDB (дзета-потенциал –8 мВ) гораздо быстрее поступали в лимфу, чем катионные липосомы CAF01 (дзета-потенциал +50 мВ), несмотря на большие размеры (1620 нм против 475 нм соответственно) [54]. Причем только липосомы CAF01 вызывали клеточный иммунный ответ, судя по экспрессии IFN-γ и IL-17 активированными Т-клетками, которой могла также способствовать индукция провоспалительного микроокружения в месте инъекции под действием DDA, сопровождающаяся притоком APCs [54, 58]. Еще пример из ветеринарии: катионные липосомы DPPC–диолеоилтриметиламмонийпропан (DOTAP) в качестве адъюванта при вакцинации ослабленным вирионом значительно усиливали выработку антител против инфекционного бурсита (болезнь Гамборо) у кур при минимальном поражении бурсальной области [59].
Анионные липосомы также могут модулировать иммунный ответ. Как уже упоминалось выше, PS, презентированный на поверхности апоптотических телец, является сигналом для атаки макрофагов и DCs, экспрессирующих рецепторы PS. После интернализации апоптотических телец фагоциты становятся иммунотолерантны [60]. Но если распознавание происходит в присутствии определенных PAMPs (о костимуляторных компонентах вакцин см. далее), продуцируется цитокиновый профиль лимфоцитов субпопуляций TH17 [47], и презентация антигенов, рестриктированных молекулами MHC класса I и класса II, идет одинаково эффективно [61]. Другой пример – анионные липосомы с фосфатидилглицерином (PG), нагруженные пептидным антигеном, вызывали сильный специфический ответ регуляторных Т-лимфоцитов (Tregs) [62]. Жизненно-важная роль Tregs – контроль степени и продолжительности иммунного ответа через регуляцию функции эффекторных Т-лимфоцитов (ТH-клеток и CTLs); дисфункция Tregs часто ассоциирована с аутоиммунными заболеваниями. В своей следующей работе авторы варьировали вязкость бислоя липосом состава PC–PG–(Chol), 4 : 1(: 2), за счет длины, степени насыщенности ацильных цепей и присутствия холестерина и показали in vitro на мышиных DCs из костного мозга и in vivo на мышах, что жесткость бислоя положительно коррелирует с ответом Tregs [63].
Влияние иммуностимуляторов – лигандов PRR
Адъювантные свойства липосом можно усилить или направить по пути того или иного типа иммунного ответа с помощью специфических лигандов, вызывающих активацию определенных рецепторов APCs. Открытие рецепторов (PRRs), распознающих патоген-ассоциированные молекулярные паттерны PAMPs, оказало огромное влияние на развитие вакцинологии [64, 65]. Специфическими лигандами PRRs, обладающими иммуномодулирующими свойствами, могут быть самые различные классы молекул – ДНК, РНК, липиды, углеводы, белки, пептиды, низкомолекулярные вещества. В число PRRs входят TLRs, NOD рецепторы (nucleotide-binding oligomerization domain receptors), NOD-подобные рецепторы (NLRs), RIG (retinoic acid-inducible gene)-подобные хеликазы (RLHs) [66], рецепторы лектинов С-типа (CLRs) [67]. Активация этих рецепторов играет ключевую роль в созревании DCs и продукции цитокинов. PRRs располагаются в различных клеточных компартментах: на поверхности плазмалеммы (например, TLR1, -2, -4, -5, -6, CLRs), в эндосомах (TLR3, -7, -8, -9) или цитоплазме (NLRs, RLНs) [66–68]. Локализация рецепторов отражает локализацию соответствующих PAMPs. Так, лиганды PRRs, ассоциированных с клеточной поверхностью, экспрессированы на поверхности патогенов, в то время как для эндосомальных PRRs лигандами являются, например, нуклеотиды [67, 69]. Активация PRRs, как правило, вызывает провоспалительные реакции и/или выработку интерферонов I типа. Однако различные PRRs индуцируют различные сигнальные пути и таким образом модулируют путь иммунного ответа [67, 70].
Направление типа иммунного ответа по тому или иному пути может соответствовать происхождению PAMP, например, PRRs, распознающие лиганды бактериальной природы часто запускают ТН1-ответ, эффективный для борьбы с определенными микробными инфекциями [71]. Аналогично, двухцепочечная вирусная РНК вызывает активацию CTLs, способных подавить вирусную инфекцию [72]. В бактериальных ДНК неметилированные цитозин-гуаниновые мотивы встречаются гораздо чаще, чем в хромосомах эукариот, поэтому синтетические олигодезоксирибонуклеотиды, содержащие мотивы CpG (CpG-ODN), представляют собой РАМР и обладают иммуностимулирующей активностью. СpG-мотивы распознаются рецептором TLR9, который экспрессируется в мембранах эндосомальных компартментов множества иммунокомпетентных клеток, включая В-клетки, моноциты, NK-клетки, DCs и макрофаги [73]. В результате стимулируется выработка провоспалительных цитокинов (TNF-α, IL-1, IL-6, IL-12, IFN-α и др.), хемокинов (MIP-2, MCP-1, RANTES, IP-10 и др.), молекул МНС II класса и костимуляторных молекул (CD40, CD80, CD83, CD86) [74]. В ранней работе [75] показано, что иммунизация мышей смесью СpG-ODN и липосом (PC–PG–Chol, 2 : 0.2 : 1) с инкапсулированными пептидными эпитопами OVA и gp33, рестриктированными молекулами MHC класса I, активировала созревание DCs, способствовала кросс-презентации и индукции иммунного ответа по ТН1-пути. Синтетические СpG-ODN с успехом применяются при конструировании липосомальных вакцин, причем иммуностимулятор коинкапсулируют во внутренний водный объем липосом, либо адсорбируют на катионных липосомах [74, 76, 77]. Недавно предложена новая платформа для создания вакцин: ковалентный конъюгат СpG-ODN с консервативным белком пили из Streptococcus agalactiae (стрептококк группы В) адсорбировали на катионных липосомах; по сравнению с иммунизацией простой смесью СpG-ODN и липосомами с ассоциированным белком, внутримышечное введение целостной конструкции способствовало формированию депо в месте инъекции и стимулировало многоэтапный разносторонний иммунный ответ [77].
Среди изученных на предмет влияния на иммунный ответ рецепторов TLRs, наиболее значимыми считаются TLR3, TLR7, TRL9 и TLR4 [2]. Последний локализован на поверхности APCs и, следовательно, более доступен, в отличие от эндосомальных TLR3, TLR7 и TRL9. Системы доставки на основе наночастиц, в том числе липосомы, способны обеспечить эффективную интернализацию, необходимую для доступа к внутриклеточным рецепторам. Например, иммунизация липосомами (нейтральными) с инкапсулированным CpG-ODN вместе с антигеном (столбнячным анатоксином) дала высокий титр защитных антител, но такого ответа не было при использовании липосом с одним только антигеном [78]. В модели трансгенных мышей, экспрессирующих вирус гепатита В, комплекс катионных липосом с CpG-ODN, ассоциированный с поверхностным антигеном гепатита В (HBsAg), индуцировал Т- и B-клеточные иммунные ответы, в то время как HBsAg сам по себе вызвал только В-клеточный [79]. Другой пример: при добавлении в состав липосом с антигеном HBsAg липофильных производных мурамилдипептида (MDP, распознается внутриклеточными NOD2-подобными рецепторами) – конъюгатов с фосфатидилэтаноламином и дипальмитоилглицерином – титры антител и уровни выработки IFN-γ (ответ по ТН1-пути) повышались по сравнению с составами без аналогов MDP [80]. Одноцепочечные РНК (лиганды TLR7), инкапсулированные в липосомы с антигенами, опосредовали сильные клеточные ответы при иммунизации мышей [81]. Синтетический аналог двухцепочечной РНК полиинозиновая кислота–полицитидиловая кислота (поли(I:C), лиганд TLR3) усиливает кросс-презентацию [82] и при комплексовании с катионными липосомами способствовал индукции СТLs [83]. Причем объединение в одном комплексе антигена и лиганда к внутриклеточным рецепторам позволяет значительно усилить иммунный ответ, в отличие от применения простой смеси этих компонентов. Очевидно, что иммобилизация на поверхности носителя-адъюванта лиганда (иммуностимулятора) к PRRs, локализованным на клеточной поверхности, также должна способствовать более эффективной стимуляции APCs.
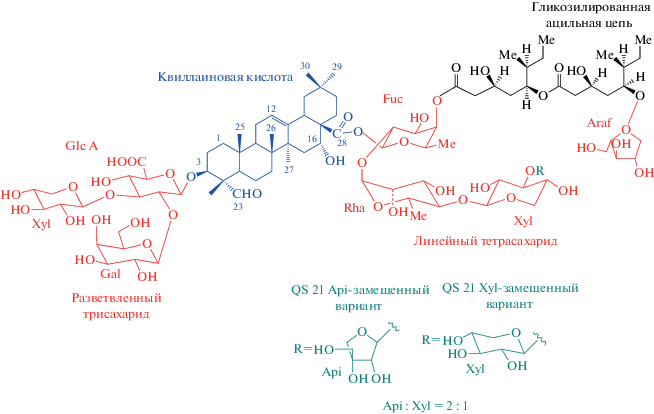
Монофосфорил липид А (MPLA, детоксифицированная фракция эндотоксинового липида А, лиганд TLR4) – безопасный и эффективный липосомальный адъювант, который применялся в сочетании с многими кандидатными антигенами при разработке новых вакцин для борьбы с малярией, ВИЧ-1 и другими инфекциями (а также с рядом онкологических заболеваний) [84, 85]. Например, антиген RTS.S (вирион гепатита В, экспрессирующий эпитопы основного поверхностного белка циркумспорозоит (CS) малярийного плазмодия P. falciparum) вызывал in vivo ответ СТLs и дозозависимое повышение титра специфических IgG при включении в липосомы с MPLA; без MPLA липосомальная форма была неэффективна [86]. На стадии спорозоита плазмодий P. falciparum покрыт белком CS, обеспечивающим инвазию в гепатоциты. Первой высокопротективной рекомбинантной вакциной против малярии был комплекс RTS.S с MPLA и QS-21 – тритерпеновым гликозидом из дерева Quillaja saponaria [87, 88] (рис. 3). В отличие от MPLA, механизм действия QS-21 полностью не выяснен. Этот сапонин известен своей гемолитической активностью, которая подавляется при включении в липосомы с холестерином (как в комплексе AS01). Недавно показано, что QS-21 активирует специфический сигнальный путь в моноцитах (образование инфламмасомы ASC-NLRP3 – мультибелкового комплекса, который вызывает высвобождение интерлейкинов IL-1β/IL-18 [89]), но роль этого пути в организме пока неясна. Недавно показано, что генно-инженерный растворимый белок CS P. falciparum (FMP013) может вызывать пожизненный стерилизующий иммунитет при введении в липосомальной форме, содержащей синтетический аналог MPLA 3D-PHAD® и сапонин QS-21 (ALFQ, Army Liposomal Formulation adjuvant) [90–92]. В настоящее время вакцина проходит I фазу клинических исследований [93]. Другой пример: инкапсулированный в липосомы 78 кДа антиген Leishmania donovani в сочетании с MPLA индуцировал ответ по ТН1-пути и понижал паразитарную нагрузку у иммунизированных мышей после заражения [94].
Рис. 3.
Структура QS-21 – тритерпенового гликозида из дерева Quillaja saponaria (адаптировано из [88]). Glc A: β-D-глюкуронопиранозил; Glc: β-D-глюкопиранозил; Gal: β-D-галактопиранозил; Xyl: β-D-ксилопиранозил; Fuc: β-D-фукопиранозил; Api: β-D-апиофуранозил; Rha: α-L-рамнопиранозил; Araf : α-L-арабинофуранозил.
За счет варьирования иммуностимуляторов можно модулировать тип иммунного ответа на один и тот же антиген. Например, иммунизация мышей липосомами, содержащими OVA и CpG-ODN, вызвала ответ ТН1-типа с продукцией IFN-γ и IgG2a, в то время как тот же антиген в составе липосом с Pam3CSK4 (PAM, синтетический липопептид, состоящий из конъюгата трипальмитоил-S-глицерилцистеина с пентапептидом SKKKK; лиганд TLR2, локализованного на поверхности APCs) индуцировал секрецию IgG1, что соответствует ответу по пути ТН2 [95, 96].
Адъювант CAF09 для индукции CD8+ Т-клеточного ответа состоит из катионных DDA-липосом, стабилизированных мономиколоил-1-глицерином (синтетический аналог липида клеточной стенки микобактерий, мощный стимулятор DCs человека), и TLR3 лиганда поли(I:C) [97, 98]. CAF09 показал высокую частоту антиген-специфических CTLs против модельного антигена OVA, а также против антигенов Mtb (TB10.3, H56), HIV (Gag p24) и папилломавируса человека HPV (E7) при тестировании на мышах [97, 98]. В мышиной модели опухоли кожи TC-1 (подкожная инокуляция HPV-16, экспрессирующего Е-7) иммунизация антигеном Е-7 с адъювантом CAF09 значительно ингибировала рост опухоли [97].
ЛИПОСОМАЛЬНЫЕ ВАКЦИНЫ, НЕСУЩИЕ КОНЪЮГАТЫ АНТИГЕН–ЛИПИД
Инкапсулирование антигенов во внутренний водный объем липосом часто сопровождается низкой эффективностью загрузки и потерями в процессе получения и очистки вакцин. С другой стороны, адсорбированные на поверхности антигены (такой способ обычно применяется в случае катионных липосом) могут быстро десорбироваться в физиологических условиях. Включение антигенов – в данном случае речь идет о пептидах – в виде конъюгатов с липидами в мембрану липосом позволяет преодолеть эти проблемы. В последние годы интерес к пептидным вакцинам на основе липосом вырос [41, 43, 74, 99]. Это связано как с развитием мощных биоинформационных ресурсов, позволяющих значительно сократить затраты времени и труда для поиска новых эпитопов биологических мишеней, так и с совершенствованием технологий твердофазного химического синтеза пептидов. Приведем примеры работ нескольких групп исследователей.
Авторы [100] конъюгировали с поверхностью функционализированных жидкофазных анионных липосом состава DOPC–Chol–диолеоилфосфатидилглицерин–дисукцинимидилсуберат DOPE (мольное отношение примерно 6 : 7 : 2 : 1) нонамерные Т-клеточные эпитопы коронавируса SARS (SARS-CoV). Четыре CTL-эпитопа вирусного нуклеокапсида, рестриктированные HLA-A*0201 (серотип человеческого лейкоцитарного антигена, один из аллелей MHC класса I; группа аллелей HLA-A*02 широко распространена в мире), были идентифицированы экспериментально с использованием трансгенных мышей и рекомбинантного аденовируса, экспрессирующего 8 предсказанных in silico эпитопов. При подкожной иммунизации два липосомальных пептида в сочетании с СpG-ODN стимулировали специфический Т-клеточный ответ, а одна из этих вакцин вызвала у мышей клиренс вируса осповакцины, экспрессирующего эпитопы SARS-CoV [100]. Аналогичный подход те же авторы [101] использовали для конструирования пептидных вакцин с CTL-эпитопами полипротеина 1a SARS-CoV (крупнейший консервативный белок вируса, 4382 а.о.; белок-предшественник неструктурных белков). Из 30 предсказанных иммуноинформатическими методами пептидов восемь стимулировали значительный ответ CTL и были конъюгированы с липосомами. Из них 7 показали активность против вируса in vivo, причем один вариант вакцины индуцировал образование клеток памяти [101].
Toth c сотр. разработали другой подход к получению иммуногенных пептид-липидных конъюгатов [41]. Они предложили конструировать систему “пептид на липидной основе”: молекулу, построенную из липоаминокислот c модулем разветвления для модификации несколькими пептидными эпитопами (рис. 4) [102]. C помощью твердофазного пептидного синтеза были получены конъюгаты с эпитопами разнообразных патогенов, в том числе паразитарных (хламидии, гельминты) и стрептококков группы А [103]. Такие системы сами по себе образуют наночастицы в водной среде, и они показали способность индуцировать антительный иммунный ответ без дополнительного введения адъюванта. При включении в липосомы гуморальный ответ усиливался: липопептид, содержащий В-клеточный эпитоп и Т-хелперный эпитоп стрептококков группы А, в составе липосом DPPC–DDA–Chol при иммунизации мышей индуцировал более высокие титры IgG и IgA, чем сам по себе вне липосом [104].
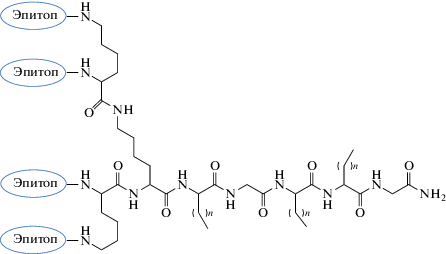
Рис. 4.
Конъюгат липоаминокислот c модулем разветвления для модификации несколькими пептидными эпитопами [102].
Еще один метод иммобилизации пептидных антигенов на поверхности липосом основан на комплементарном взаимодействии гетеродимерных пептидных пар, содержащих остатки лизинов (PepK) и глутаминовой кислоты (pepE) и образующих койл-структуру [105, 106]. PepK конъюгировали с холестерином (PepK–Сhol) и включали в бислой катионных липосом, с которыми эффективно связывался конъюгат pepE с модельным антигеном OVA323 (константа диссоциации Kd = 166 нM). Колокализация антигена и липосом с PepK–Сhol in vivo повышалась с 35% до 80% по сравнению с нефункционализированными липосомами, в 5 раз усиливалась пролиферация CD4+ T-клеток in vitro, и при иммунизации мышей индуцировался более сильный ответ этих клеток (повышалась продукция IFN-γ и IL-10) [106].
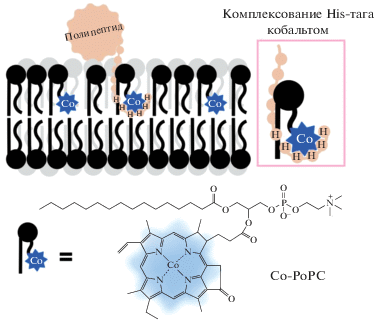
Интересный (и неожиданный) способ связывания антигенов с липосомами основан на комплексообразовании между полигистидиновым фрагментом (His-тагом) рекомбинантных белков или пептидов и фосфолипидом, модифицированным по терминальному углероду ацильного остатка в sn-2 положении порфирином с хелатированным кобальтом (Со-РоРС) [107] (рис. 5). Взаимодействие His-тага с порфириновой группой при погружении в липидный бислой сопровождается переходом Co(II) → Co(III), и внутри гидрофобной области бислоя образуется достаточно прочный комплекс, который необратимо удерживает белок (пептид) в сыворотке крови и в конкурентной среде с избытком (106) имидазола. Липосомы, несущие привитый таким образом фрагмент белка gp41 оболочки ВИЧ, при иммунизации мышей вызывали выработку специфических антител [107].
Рис. 5.
Включение His-таг-полипептида в монослой липидного бислоя, содержащий Со-РоРС. Имидазольные группы остатков гистидина координируются с кобальтом в гидрофобной фазе бислоя [107].
Авторы предложили тот же подход для разработки противомалярийной вакцины, блокирующей передачу инфекции (transmission-blocking vaccine, TBD) путем иммунизации москита в процессе кровососания (развитие паразита блокируется в кишечнике насекомого) [108]. Создание TBD – одно из важнейших направлений, развиваемых ВОЗ по борьбе с малярией. Белок малярийного плазмодия P. falciparum Pfs25 (25 кДа, 11 дисульфидных связей) является хорошим кандидатным антигеном для TBD [109], однако, например, с алюминиевым адъювантом Pfs25 не показал достаточной иммуногенности в клинических исследованиях [110]. В работе [108] липосомы состава DPPC–Chol–PHAD (синтетический аналог MPLA, фосфорилированный гексаацилдисахарид)–Co-PоPС, 4 : 2 : 1 : 1, перед иммунизацией инкубировали с рекомбинантным His-таг-Pfs25 и затем вводили внутримышечно совместно с адъювантом QS-21 мышам и кроликам; стабильные комплексы антиген-липосома транспортировались в лимфоузлы, что способствовало эффективному захвату АРСs, генерации долгоживущих антиген-специфических плазматических клеток и гораздо более интенсивной выработке функциональных антител (на порядки выше), по сравнению с другими адъювантными препаратами, которые получают смешиванием компонентов перед иммунизацией. Так, липосомы, содержащие липиды с комплексом никель-нитрилотриацетат (Ni-NTA) в головной группе, неспособны удерживать His-таг-лиганды в биологических средах [111] (что также показано и для липосомальных комплексов Со-NTA [107]). Те же авторы показали эффективность применения липосомальной платформы Co-PоPС/PHAD для получения противомалярийной вакцины на основе другого кандидатного TBD-антигена – His-таг-фрагмента белка Pfs230 (а.о. 443–731), который экспрессируется на поверхности гаметоцит P. falciparum в эритроцитах человека [112]. Наконец, эта платформа в применении к рецептор-связывающему домену (RBD) спайк-белка вируса SARS-CoV-2 позволила получить высокие титры антител при иммунизации мышей (за счет блокирования взаимодействия с рецептором − ангиотензин-превращающим ферментом 2 (АСЕ2) − и ингибирования репликации вируса), а добавление в препарат QS-21 повышало специфический полифункциональный Т-клеточный ответ [113].
ЛИПОСОМЫ В КАЧЕСТВЕ АДЪЮВАНТОВ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ В КЛИНИКЕ
Достаточно структурированные обзоры липосомальных вакцин, как исследуемых в лабораториях, так и применяемых в клинике для профилактики серьезных вирусных, бактериальных, грибковых и паразитарных инфекций, в том числе туберкулеза, опубликованы недавно [9, 10, 114–116]. На сегодняшний день несколько профилактических вакцин на основе адъювантных липидных комплексов – липосом и липидных наночастиц – лицензированы на фармацевтическом рынке. Целый ряд проходит различные стадии клинических исследований, несколько примеров приведено в табл. 1. Epaxal [117] и Inflexal вводятся внутримышечно для защиты от гепатита А и сезонного гриппа, соответственно (причем Inf-lexal – трехвалентная вакцина) [118, 119]. В 2000 г. в ЕЭС была одобрена к применению противогриппозная вакцина на основе липосом в виде интраназального спрея Nasalflu, но через год ее изъяли из употребления из-за случаев пареза лицевого нерва (паралич Белла) [120]. Epaxal и Inflexal представляют собой дисперсии готовых липосом, которые несут антигены, адсорбированные на поверхности. Противомалярийная вакцина Mosquirix [86, 121] и вакцина против Zoster-герпеса Shringrix готовятся путем смешивания липосом, содержащих соответствующие иммуностимуляторы, с антигенами. Следует отметить, что вакцина Shringrix демонстрирует не только высокий профиль безопасности, но и более сильный протективный эффект по сравнению с традиционными вакцинами на основе целых патогенов (минимум 4 года защиты от рецидивов даже среди пациентов старше 70 лет) [122, 123]. Очевидно, такой результат объясняется рациональным дизайном: правильным выбором антигена – гликопротеин оболочки gE играет определяющую роль в репликации вируса и его межклеточной передаче; QS-21 гарантирует активацию врожденного иммунного ответа, а липосомальный MPLA посредством TLR4 активирует TH1-путь, в итоге развивается сильный клеточный иммунитет; стабильность липосом также является важным фактором [115, 124, 125].
Таблица 1.
Вакцины на основе липидных адъювантов на фармацевтическом рынке и примеры в клинических исследованиях
| Показания к применению | Антиген | Иммуностимулятор | Липидный состав | Размер частицы, нм | Фаза/NCT* | Год, страна |
|---|---|---|---|---|---|---|
| Гепатит А | Инактивированный вирус | HA + NA вируса гриппа | Лецитины/ кефалины [117] | ~150 | Лицензирована (Epaxal®, Crucell, Швейцария) | 1994, ЕЭС |
| Грипп | HA тип А (H1N1) + HA тип А (H3N2) + HA тип В + NA | Нет | PC 70%, суммарные липиды вируса гриппа 30% [118] |
~150 | Лицензирована (Inflexal®, Crucell, Швейцария) | 1997, ЕЭС |
| Малярия | HBsAg + белок CS (RTS.S) |
MPLA | DOPC/Сhol [121] | Лицензирована Mosquirix® (GlaxoSmithKline) | 2015, EЭC, США | |
| Герпес, вирус
Zoster varicella, опоясывающий лишай |
gE | MPLA/QS-21 (AS01) | DOPC/Сhol | 50–100 | Лицензирована Shringrix® (GlaxoSmithKline) | 2017, EЭC, США |
| Туберкулез | Ag85b + ESAT6 | TDB (CAF01) | DDA/TDB | – | I/NCT00922363 [126] | 2011, Нидерланды |
| Анти-ВИЧ-1 (СПИД) | Коктейль 18-ти пептидов, эпитопов CD4+/CD8+ Т-клеток | TDB (CAF01) | DDA/TDB | – | I/NCT01141205 [127] | 2013, Гвинея-Биссау |
| Малярия | RTS.S | MPLA/QS-21 (AS01) | DOPC/Сhol (?) | – | III/NCT00872963 [128] | 2016, Кения |
| Малярия | FMP012 | MPLA/QS-21 (AS01) | DOPC/Сhol(?) | – | I/NCT02174978 | 2017, США |
| Малярия | RH5.1 | MPLA/QS-21 (AS01) | DOPC/Сhol(?) | – | II/NCT02927145 | 2019, Великобритания |
| Малярия | Pfs25M + Pfs230D1 | EPA/AS01 | – | – | I/NCT02942277 | 2020, Мали |
| COVID-19 | м-РНК S-белка SARS-CoV-2 | Нет | ALC-0315/ ALC-0159/DSPC/Chol | 60–100 | Лицензирована, Pfizer/BioNTech | 2020, CША |
| COVID-19 | м-РНК S-белка SARS-CoV-2 | Нет | SM-102/ DMG-PEG2000/ DSPC/Chol | 60–100 | Лицензирована, Moderna |
2020, США |
* Номер в реестре клинических испытаний (National Clinical Trial number, https://clinicaltrials.gov). Примечание. НА – гемагглютинин; NA – нейраминидаза; gE – гликопротеин оболочки вируса гепатита А; Ag85B – 30 кДа экстрацеллюлярный белок, экспрессируемый в больших количествах Mycobacterium tuberculosis; ESAT6 – 6 кДа белок, секретируемый на ранних стадиях роста всеми патогенными микобактериями; FMP012 – белок плазмодия P. falciparum; EPA – экзобелок А, детоксифицированная форма экзотоксина А из Pseudomonas aeruginosa; ALC-0315 – 6-[6-(2-гексилдеканоилокси)гексил-(4-гидроксибутил)амино]гексил 2-гексилдеканоат; ALC-0159 – 2-[(полиэтиленгликоль)-2000]-N,N-дитетрадецилацетамид; SM-102 – гептадекан-9-ил-8-[2-гидроксиэтил-(6-оксо-6-ундецилоксигексил)амино]октаноат; DMG-PEG2000 – 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000; “—” – сведения не найдены.
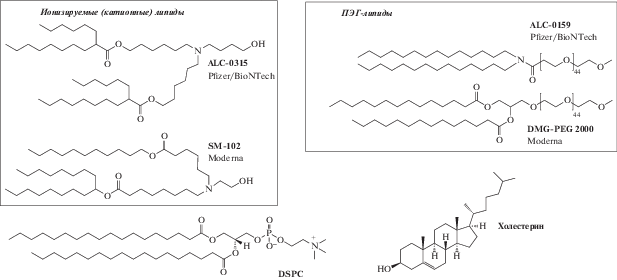
В 2020 г. на фоне пандемии вируса SARS-CoV-2 были стремительно внедрены в клинику первые вакцины на основе липидных наночастиц и мРНК полноразмерного белка шипа вируса – S-белка (Pfizer/BioNTech и Moderna). Здесь стоит отметить, что наноразмерные липосомы можно вполне правомерно классифицировать как раннюю генерацию липидных наночастиц [129]. В данном случае роль молекул липидов заключается в обеспечении компактизации длинноцепных молекул нуклеиновой кислоты, защите ее от деградации под действием внеклеточных ферментов, обеспечении транспорта наночастицы в клетку за счет эндоцитоза (фагоцитоза или пиноцитоза) и последующего выхода мРНК из эндосомы (фагосомы) в цитоплазму для осуществления трансляции и экспрессии белка с иммуногенными эпитопами. Предположительно, выход мРНК из эндосомы в цитоплазму осуществляется за счет перехода липидов ЛНЧ при закислении в катионную форму, что способствует их контакту с анионными липидами периплазматического монослоя мембраны эндосом, образованию небислойных структур и дестабилизации мембраны [130]. В связи с таким разнообразием требований к организации ЛНЧ с мРНК, липидная платформа должна включать несколько классов липидов. Структуры ионизируемых (катионных) липидов, которые обеспечивают компактизацию молекул мРНК, в вакцинах обоих производителей очень близки (рис. 6) [131].
Рис. 6.
Липидные компоненты мРНК-вакцин Pfizer/BioNTech и Moderna (по материалам обзора [131] и интернет-ресурса https://www.cas.org/resource/blog/understanding-nanotechnology-covid-19-vaccines).
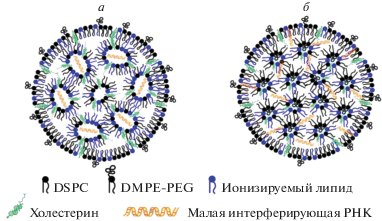
Точная структурная организация мРНК–ЛНЧ неизвестна, но на основании данных ЯМР-спектроскопии наиболее вероятной считается модель “аморфный кор–оболочка”, аналогичная упаковке малых интерферирующих РНК (миРНК) в ЛНЧ, где РНК находится либо в водных порах внутри инвертированных мицелл из катионных липидов (рис. 7а), либо в маленьких водных “карманах” между гомогенно диспергированными в коре липидами (рис. 7б) [132]. Второй вариант больше соответствует экспериментальным данным [131].
Рис. 7.
Варианты структур ЛНЧ с малыми интерферирующими РНК (по материалам обзора [131] и интернет-ресурса https://www.cas.org/resource/blog/understanding-nanotechnology-covid-19-vaccines). Аналогичные структуры предполагаются и для ЛНЧ с мРНК.
В то же время, по данным исследований с помощью криоэлектронной микроскопии, упакованная в ЛНЧ мРНК длиной 4000 нуклеотидов (примерно соответствует размеру мРНК в вакцинах Pfizer/BioNTech и Moderna) может преимущественно локализоваться в относительно крупных водных блебах [133]. Асимметрия структуры мРНК–ЛНЧ вполне объяснима: молекулы мРНК в сотни раз больше молекул миРНК.
Мы лишь очень кратко остановились на злободневной и прорывной тематике мРНК–ЛНЧ вакцин, которой посвящено уже немало публикаций как обзорного характера, так и по результатам экспериментальных исследований. Например, в обзоре [134] обсуждается, что механизм действия мРНК–ЛНЧ вакцин до конца не изучен, рассматриваются иммунологические аспекты нецелевого действия компонентов вакцин, способные спровоцировать нежелательные побочные эффекты, и возможные пути преодоления этих рисков, в том числе за счет нацеливания на дендритные клетки. Появление первых мРНК-вакцин стимулировало исследования по разработке других конструкций липидных комплексов с РНК, обладающих потенциальными преимуществами. Например, с целью оптимизации технологии получения и хранения вакцин предложено комплексовать РНК с подготовленными липосомами непосредственно перед иммунизацией, причем показано, что такие комплексы по иммуногенности не уступают липосомам с инкапсулированными РНК [135, 136] (рис. 8).
ЗАКЛЮЧЕНИЕ
После долгих лет экспериментов липосомы в качестве систем доставки вакцин и адъювантов широко используются как в доклинических, так и в клинических исследованиях благодаря таким уникальным свойствам как биосовместимость, высокий уровень безопасности и возможность создания разнообразных конструкций за счет варьирования компонентов липидной матрицы. В последние годы интерес к разработкам вакцин на основе липосом вырос, что связано с совершенствованием технологии промышленного производства разнообразных липидов высокого класса чистоты, пригодных для парентерального введения [137]. Принципиально важно и то, что появились новые технологии и оборудование для промышленного производства липосомальных препаратов [7, 116].
При разработке липосомальных вакцин необходимо учитывать механизмы функционирования иммунной системы организма (врожденный и адаптивный иммунитет). Введение в конструкции лигандов к соответствующим рецепторам, участвующим в распознавании PAMPs (врожденный иммунитет), позволяет значительно усилить иммунный ответ на антиген, доставленный липосомами. Рецепторы PRRs вносят свой специфический вклад в процессы сигнализации, ведущие к активации и дифференцировке Т-хелперных клеток, что в конечном итоге индуцирует адаптивный иммунный ответ, опосредованный CD8+ Т-лимфоцитами и В-клетками, продуцирующими антитела. Размер липосом, их заряд, морфология (ламеллярность), фазовое состояние бислоя, которое зависит от липидного состава, могут влиять на презентацию антигена и взаимодействия с APCs, хотя результаты исследований закономерностей этого влияния зачастую противоречивы. Поэтому в каждом конкретном случае следует проводить специальные исследования. Дополнительные возможности усиления или корректирования молекулярных путей активации иммунного ответа дает использование вторичных липидных мессенджеров в составе липидной матрицы. Что касается локализации антигена в вакцине – инкапсулирован он в липосомы или адсорбирован на поверхности – однозначного ответа здесь нет. Результаты многих доклинических (например, [138]) и клинических исследований свидетельствуют о том, что даже простое смешивание антигена с липосомами способствует усилению иммунореактивности. Действительно, применяемые в клинике вакцины Mosquirix® и Shingrix® (как и многочисленные алюминий-содержащие вакцины) получаются путем простого смешивания антигенов с липосомальным комплексом AS01 [139]. Тем не менее сложно отрицать тот факт, что такой способ получения вакцинных препаратов скорее всего продиктован необходимостью упрощения технологии их производства и последующего хранения (и снижения их стоимости). Вполне вероятно, что иммуногенность названных вакцин была бы еще повышена в случае применения стабильных препаратов с инкапсулированными или адсорбированными антигенами.
И все-таки, несмотря на сложности производства таких комплексных препаратов, как липосомальные, многие проблемы создания стабильных и воспроизводимых конструкций уже решены, согласованы требования к ним со стороны регуляторных органов. Можно ожидать, что в ближайшие годы появится много новых вакцин на основе липидных комплексов для борьбы с опасными инфекционными заболеваниями.
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.
Источники финансирования. Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 20-04-60 478) и в рамках программы исследований по теме номер FM4FM-2019-0026, запланированных в ИБХ РАН.
Соответствие принципам этики. Настоящая статья является обзором публикаций других авторов по исследованиям, проведенным с соблюдением всех применимых международных, национальных и/или институциональных принципов ухода и использования животных. Данный обзор не содержит описания каких-либо собственных исследований с участием людей или животных в качестве объектов.
Список литературы
Delany I., Rappuoli R., De Gregorio E. 2014. Vaccines for the 21st century. EMBO Mol. Med. 6 (6), 708–720.
De Temmerman M-L., Rejman J., Demeester J., Irvine D.J., Gander B., De Smedt S.C. 2011. Particulate vaccines: on the quest for optimal delivery and immune response. Drug Discov. Today. 16 (13–14), 569–582.
Reed S., Orr M. and Fox C. 2013. Key roles of adjuvants in modern vaccines. Nat. Med. 19, 1597–1608.
Allison A., Gregoriadis G. 1974. Liposomes as immunological adjuvants. Nature. 252 (5480), 252.
Allison A., Gregoriadis G. 1976. Liposomes as immunological adjuvants. Recent Results Cancer Res. 56, 58–64.
Schwendener R.A. 2014. Liposomes as vaccine delivery systems: A review of the recent advances. Ther. Adv. Vaccines. 2 (6), 159–182.
Perrie Y., Crofts F., Devitt A., Griffiths H.R., Kastner E., Nadella V. 2016. Designing liposomal adjuvants for the next generation of vaccines. Adv. Drug. Deliv. Rev. 99 (Pt A), 85–96.
Tandrup Schmidt S., Foged C., Korsholm K.S., Rades T., Christensen D. 2016. Liposome-based adjuvants for subunit vaccines: formulation strategies for subunit antigens and immunostimulators. Pharmaceutics. 8 (1), 7.
Nisini R., Poerio N., Mariotti S., De Santis F., Fraziano M. 2018. The multirole of liposomes in therapy and prevention of infectious diseases. Front. Immunol. 9, 155.
Bernasconi V., Norling K., Bally M., Höök F., Lycke N.Y. 2016. Mucosal vaccine development based on liposome technology. J. Immunol. Res. 2016, 5482087.
Usonis V., Bakasénas V., Valentelis R., Katiliene G., Vidzeniene D., Herzog, C. 2003. Antibody titres after primary and booster vaccination of infants and young children with a virosomal hepatitis A vaccine (Epaxal). Vaccine. 21 (31), 4588–4592.
https://www.shingrix.com/index.html
Torchilin V.P. 2005. Recent advances with liposomes as pharmaceutical carriers. Nat. Rev. Drug Discov. 4 (2), 145–160.
Watson D., Endsley A., Huang L. 2012. Design considerations for liposomal vaccines: Influence of formulation parameters on antibody and cell-mediated immune responses to liposome associated antigens. Vaccine. 30, 2256–2272.
Zahednezhad F., Saadat M., Valizadeh H., Zakeri-Milani P., Baradaran B. 2019. Liposome and immune system interplay: Challenges and potentials. J. Control. Release. 305, 194–209.
Szebeni J., Muggia F., Gabizon A., Barenholz Y. 2011. Activation of complement by therapeutic liposomes and other lipid excipient-based therapeutic products: prediction and prevention. Adv. Drug Deliv. Rev. 63, 1020–1030.
Jung S., Unutmaz D., Wong P., Sano G., De los Santos K., Sparwasser T., Wu S., Vuthoori S., Ko K., Zavala F., Pamer E.G., Littman D.R., Lang R.A. 2002. In vivo depletion of CD11c+ dendritic cells abrogates priming of CD8+ T cells by exogenous cell-associated antigens. Immunity, 17 (2), 211–220.
Kawai T., Akira S. 2010. The role of patternrecognition receptors in innate immunity: update on Toll-like receptors. Nat. Immunol. 11, 373–384.
Banchereau J., Palucka A.K. 2005. Dendritic cells as therapeutic vaccines against cancer. Nat. Rev. Immunol. 5 (4), 296–306.
Bevan M.J. 1976. Cross-priming for a secondary cytotoxic response to minor H-antigens with H-2 congenic cells which do not cross-react in cytotoxic assay. J. Exp. Med. 143, 1283–1288.
Joffre O.P., Segura E., Savina A., Amigorena S. 2012. Cross-presentation by dendritic cells. Nat. Rev. Immunol. 12 (8), 557–569.
Zehner M., Marschall A.L., Bos E., Schloetel J.G., Kreer C., Fehrenschild D., Limmer A., Ossendorp F., Lang T., Koster A. J., Dübel S., Burgdorf S. 2015. The translocon protein Sec61 mediates antigen transport from endosomes in the cytosol for cross-presentation to CD8+ T cells. Immunity. 42 (5), 850–863.
Yeung T., Ozdamar B., Paroutis P., Grinstein S. 2006. Lipid metabolism and dynamics during phagocytosis. Curr. Opin. Cell. Biol. 18 (4), 429–437.
Yeung T., Grinstein S. 2007. Lipid signaling and the modulation of surface charge during phagocytosis. Immunol. Rev. 219, 17–36.
Bohdanowicz M., Grinstein S. 2013. Role of phospholipids in endocytosis, phagocytosis, and macropinocytosis. Physiol. Rev. 93 (1), 69–106.
Steinberg B.E., Grinstein S. 2008. Pathogen destruction versus intracellular survival: The role of lipids as phagosomal fate determinants. J. Clin. Invest. 118 (6), 2002–2011.
Anes E., Kuhnel M.P., Bos E., Moniz-Pereira J., Habermann A., Griffiths G. 2003. Selected lipids activate phagosome actin assembly and maturation resulting in killing of pathogenic mycobacteria. Nat. Cell Biol. 5 (9), 793–802.
Garg S.K., Valente E., Greco E., Santucci M.B., De Spirito M., Papi M., Bocchino M., Saltini C., Fraziano M. 2006. Lysophosphatidic acid enhances antimycobacterial activity both in vitro and ex vivo. Clin. Immunol. 121 (1), 23–28.
Garg S.K., Volpe E., Palmieri G., Mattei M., Galati D., Martino A., Piccioni M.S., Valente E., Bonanno E., De Vito P., Baldini P.M., Spagnoli L.G., Colizzi V., Fraziano M. 2004. Sphingosine 1-phosphate induces antimicrobial activity both in vitro and in vivo. J. Infect. Dis. 189 (11), 2129–2138.
Greco E., Santucci M.B., Sali M., De Angelis F.R., Papi M., De Spirito M., Delogu G., Colizzi V., Fraziano M. 2010. Natural lysophospholipids reduce Mycobacterium tuberculosis-induced cytotoxicity and induce anti-mycobacterial activity by a phagolysosome maturation-dependent mechanism in A549 type II alveolar epithelial cells. Immunology. 129 (1), 125–132.
Greco E., Quintiliani G., Santucci M.B., Serafino A., Ciccaglione A.R., Marcantonio C., Papi M., Maulucci G., Delogu G., Martino A., Goletti D., Sarmati L., Andreoni M., Altieri A., Alma M., Caccamo N., Di Liberto D., De Spirito M., Savage N.D., Nisini R., Fraziano M. 2012. Janus-faced liposomes enhance antimicrobial innate immune response in Mycobacterium tuberculosis infection. Proc. Natl. Acad. Sci. USA. 109 (21), E1360–E1368.
Poerio N., Bugli F., Taus F., Santucci M.B., Rodolfo C., Cecconi F., Torelli R., Varone F., Inchingolo R., Majo F., Lucidi V., Mariotti S., Nisini R., Sanguinetti M., Fraziano M. 2017. Liposomes loaded with bioactive lipids enhance antibacterial innate immunity irrespective of drug resistance. Sci. Rep. 7, 45120.
van Houte A.J., Snippe H., Schmitz M.G., Willers J.M. 1981. Characterization of immunogenic properties of haptenated liposomal model membranes in mice. V. Effect of membrane composition on humoral and cellular immunogenicity. Immunology. 44 (3), 561–568.
Szebeni J., Baranyi L., Savay S., Milosevits J., Bodo M., Bunger R., Alving C.R. 2003. The interaction of liposomes with the complement system: In vitro and in vivo assays. Methods Enzymol. 373,136–154.
Banerjee S., Ghosh J., Sen S., Guha R., Dhar R., Ghosh M., Datta S., Raychaudhury B., Naskar K., Haldar A.K., Lal C.S., Pandey K., Das V.N., Das P., Roy S. 2009. Designing therapies against experimental visceral leishmaniasis by modulating the membrane fluidity of antigen-presenting cells. Infect. Immun. 77, 2330–2342.
Ghosh J., Guha R., Das S., Roy S. 2014. Liposomal cholesterol delivery activates the macrophage innate immune arm to facilitate intracellular Leishmania donovani killing. Infect. Immun. 82 (2), 607–617.
Mohanan D., Slütter B., Henriksen-Lacey M., Jiskoot W., Bouwstra J.A., Perrie Y., Kündig T.M., Gander B., Johansen P. 2010. Administration routes affect the quality of immune responses: A cross-sectional evaluation of particulate antigen-delivery systems. J. Control. Release. 147, 342–349.
Oussoren C., Zuidema J., Crommelin D.J.A., Storm G. 1997. Lymphatic uptake and biodistribution of liposomes after subcutaneous injection. II. Influence of liposomal size, lipid composition and lipid dose. Biochim. Biophys. Acta. 1328, 261–272.
Carstens M.G., Camps M.G.M., Henriksen-Lacey M., Franken K., Ottenhoff T.H.M., Perrie Y., Bouwstra J.A., Ossendorp F., Jiskoot W. 2011. Effect of vesicle size on tissue localization and immunogenicity of liposomal DNA vaccines. Vaccine. 29, 4761–4770.
Ghaffar K.A., Giddam A.K., Zaman M., Skwarczynski M., Toth I. 2014. Liposomes as nanovaccine delivery systems. Curr. Top. Med. Chem. 14 (9), 1194–1208.
Bartlett S, Skwarczynski M, Toth I. 2020. Lipids as activators of innate immunity in peptide vaccine delivery. Curr. Med. Chem. 27 (17), 2887–2901.
Brewer J.M., Pollock K.G., Tetley L., Russell D.G. 2004. Vesicle size influences the trafficking, processing, and presentation of antigens in lipid vesicles. J. Immunol. 173 (10), 6143–6150.
Ghaffar K.A., Marasini N., Giddam A.K., Batzloff M.R., Good M.F., Skwarczynski M., Toth I. 2016. The role of size in development of mucosal liposome-lipopeptide vaccine candidates against group A Streptococcus. Med. Chem. 13 (1), 22–27.
Mann J.F., Shakir E., Carter K.C., Mullen A.B., Alexander J., Ferro V.A. 2009. Lipid vesicle size of an oral influenza vaccine delivery vehicle influences the Th1/ Th2 bias in the immune response and protection against infection. Vaccine. 27 (27), 3643–3649.
Brewer J.M., Tetley L., Richmond J., Liew F.Y., Alexander J. 1998. Lipid vesicle size determines the th1 or th2 response to entrapped antigen. J. Immunol. 161, 4000–4007.
Badiee A., Khamesipour A., Samiei A., Soroush D., Shargh V.H., Kheiri M.T., Barkhordari F., Robert Mc Master W., Mahboudi F., Jaafari M.R. 2012. The role of liposome size on the type of immune response induced in balb/c mice against leishmaniasis: Rgp63 as a model antigen. Exp. Parasitol. 132, 403–409.
Manolova V., Flace A., Bauer M., Schwarz K., Saudan P., Bachmann M.F. 2008. Nanoparticles target distinct dendritic cell populations according to their size. Eur. J. Immunol. 38 (5), 1404–1413.
Henriksen-Lacey M., Devitt A., Perrie Y. 2011. The vesicle size of dda:Tdb liposomal adjuvants plays a role in the cell-mediated immune response but has no significant effect on antibody production. J. Control. Release. 154, 131–137.
Tanaka Y., Taneichi M., Kasai M., Kakiuchi T., Uchida T. 2010. Liposome-coupled antigens are internalized by antigen-presenting cells via pinocytosis and cross-presented to CD8 T cells. PLoS One. 5 (12), e15225.
Christensen D., Henriksen-Lacey M., Kamath A.T., Lindenstrøm T., Korsholm K.S., Christensen J.P., Rochat A.F., Lambert P.H., Andersen P., Siegrist C.A., Perrie Y., Agger E.M. 2012. A cationic vaccine adjuvant based on a saturated quaternary ammonium lipid have different in vivo distribution kinetics and display a distinct CD4 T cell-inducing capacity compared to its unsaturated analog. J. Control. Release. 160 (3), 468–476.
Werninghaus K., Babiak A., Gross O., Hölscher C., Dietrich H., Agger E.M., Mages J., Mocsai A., Schoenen H., Finger K., Nimmerjahn F., Brown G.D., Kirschning C., Heit A., Andersen P., Wagner H., Ruland J., Lang R. 2009. Adjuvanticity of a synthetic cord factor analogue for subunit Mycobacterium tuberculosis vaccination requires FcRgamma-Syk-Card9-dependent innate immune activation. J. Exp. Med. 206 (1), 89–97.
Harding C.V., Collins D.S., Kanagawa O., Unanue E.R. 1991. Liposome-encapsulated antigens engender lysosomal processing for class II MHC presentation and cytosolic processing for class I presentation. J. Immunol. 147 (9), 2860–2863.
Miller C.R., Bondurant B., McLean S.D., McGo-vern K.A., O’Brien D.F. 1998. Liposome-cell interactions in vitro: Effect of liposome surface charge on the binding and endocytosis of conventional and sterically stabilized liposomes. Biochemistry. 37, 12 875–12 883.
Henriksen-Lacey M., Christensen D., Bramwell V.W., Lindenstrøm T., Agger E.M., Andersen P., Perrie Y. 2010. Liposomal cationic charge and antigen adsorption are important properties for the efficient deposition of antigen at the injection site and ability of the vaccine to induce a CMI response. J. Control. Release. 145 (2), 102–108.
Perrie Y., Obrenovic M., McCarthy D., Gregoriadis G. 2002. Liposome (Lipodine)-mediated DNA vaccination by the oral route. J. Liposome Res. 12 (1–2), 185–197.
Nel A.E., Madler L., Velegol D., Xia T., Hoek E.M.V., Somasundaran P., Klaessig F., Castranova V., Thompson M. 2009. Understanding biophysicochemical interactions at the nano-bio interface. Nat. Mater. 8, 543–557.
Hussain M.J., Wilkinson A., Bramwell V.W., Christensen D., Perrie Y. 2014. Th1 immune responses can be modulated by varying dimethyldioctadecylammonium and distearoyl-sn-glycero-3-phosphocholine content in liposomal adjuvants. J. Pharm. Pharmacol. 66 (3), 358–366.
Korsholm K.S., Petersen R.V., Agger E.M., Andersen P. 2010. T-helper 1 and t-helper 2 adjuvants induce distinct differences in the magnitude, quality and kinetics of the early inflammatory response at the site of injection. Immunology. 129, 75–86.
Wahab M.S., Hair-Bejo M., Omar A.R., Ideris A. 2017. Hatchery vaccination using liposomes as vaccine delivery against infectious bursal disease in broiler chickens. J. Anim. Vet. Adv. 16, 122–128.
Hoffmann P.R., Kench J.A., Vondracek A., Kruk E., Daleke D.L., Jordan M., Marrack P., Henson P.M., Fadok V.A. 2005. Interaction between phosphatidylserine and the phosphatidylserine receptor inhibits immune responses in vivo. J. Immunol. 174 (3), 1393–1404.
Ichihashi T., Satoh T., Sugimoto C., Kajino K. 2013. Emulsified phosphatidylserine, simple and effective peptide carrier for induction of potent epitope-specific T cell responses. PLoS One. 8 (3), e60068.
Benne N., van Duijn J., Lozano Vigario F., Leboux R.J.T., van Veelen P., Kuiper J., Jiskoot W., Slütter B. 2018. Anionic 1,2-distearoyl-sn-glycero-3-phosphoglycerol (DSPG) liposomes induce antigen-specific regulatory T cells and prevent atherosclerosis in mice. J. Control. Release. 291, 135–146.
Benne N., Leboux R.J.T., Glandrup M., van Duijn J., Lozano Vigario F., Neustrup M.A., Romeijn S., Galli F., Kuiper J., Jiskoot W., Slütter B. 2020. Atomic force microscopy measurements of anionic liposomes reveal the effect of liposomal rigidity on antigen-specific regulatory T cell responses. J. Control. Release. 318, 246–255.
Liu Y., Janeway C.A. 1991. Microbial induction of co-stimulatory activity for CD4 T-cell growth. Int. Immunol. 3 (4), 323–332.
Gayed P.M. 2011. Toward a modern synthesis of immunity: Charles A. Janeway Jr. and the immunologist’s dirty little secret. Yale J. Biol. Med. 84 (2), 131–138.
Guy B. 2007. The perfect mix: recent progress in adjuvant research. Nat. Rev. Microbiol. 5, 505–517.
Geijtenbeek T.B.H., Gringhuis S.I. 2009. Signalling through c-type lectin receptors: Shaping immune responses. Nat. Rev. Immunol. 9, 465–479.
Maisonneuve C., Bertholet S., Philpott D.J., De Gregorio E. 2014. Unleashing the potential of nod- and toll-like agonists as vaccine adjuvants. Proc. Natl. Acad. Sci. USA. 111, 12294–12299.
Akira S., Uematsu S., Takeuchi O. 2006. Pathogen recognition and innate immunity. Cell. 124, 783–801.
Agrawal S., Agrawal A., Doughty B., Gerwitz A., Blenis J., Van Dyke T., Pulendran B. 2003. Cutting edge: Different toll-like receptor agonists instruct dendritic cells to induce distinct Th responses via differential modulation of extracellular signal-regulated kinase-mitogen-activated protein kinase and c-fos. J. Immunol. 171, 4984–4989.
Medzhitov R. 2001. Toll-like receptors and innate immunity. Nat. Rev. Immunol. 1, 135–145.
Jin B., Sun T., Yu X.-H., Liu C.-Q., Yang Y.-X., Lu P., Fu S.-F., Qiu H.-B., Yeo A.E.T. 2010. Immunomodulatory effects of dsrna and its potential as vaccine adjuvant. J. Biomed. Biotechnol. 2010, 690438.
Hemmi H., Takeuchi O., Kawai T., Kaisho T., Sato S., Sanjo H., Matsumoto M., Hoshino K., Wagner H., Takeda K., Akira S. 2000. A Toll-like receptor recognizes bacterial DNA. Nature. 408, 740–745.
Lee Y., Lee Y.S., Cho S.Y., Kwon H.J. 2015. Perspective of peptide vaccine composed of epitope peptide, CpG-DNA, and liposome complex without carriers. Adv. Protein Chem. Struct. Biol. 99, 75–97.
Vabulas R.M., Pircher H., Lipford G.B., Häcker H., Wagner H. 2000. CpG-DNA activates in vivo T cell epitope presenting dendritic cells to trigger protective antiviral cytotoxic T cell responses. J. Immunol. 164, 2372–2378.
Nikoofal-Sahlabadi S., Matbou Riahi M., Sadri K., Badiee A., Nikpoor A.R., Jaafari M.R. 2018. Liposomal CpG-ODN: An in vitro and in vivo study on macrophage subtypes responses, biodistribution and subsequent therapeutic efficacy in mice models of cancers. Eur. J. Pharm. Sci. 119, 159–170.
Chatzikleanthous D., Schmidt S.T., Buffi G., Paciello I., Cunliffe R., Carboni F., Romano M.R., O’Hagan D.T., D’Oro U., Woods S., Roberts C.W., Perrie Y., Adamo R. 2020. Design of a novel vaccine nanotechnology-based delivery system comprising CpGODN-protein conjugate anchored to liposomes. J. Control. Release. 323, 125–137.
Tafaghodi M., Jaafari M.R., Sajadi Tabassi S.A. 2006. Nasal immunization studies using liposomes loaded with tetanus toxoid and CpG-ODN. Eur. J. Pharm. Biopharm. 64, 138–145.
Morrey J.D., Motter N.E., Chang S., Fairman J. 2011. Breaking B and T cell tolerance using cationic lipid–DNA complexes (CLDC) as a vaccine adjuvant with hepatitis B virus (HBV) surface antigen in transgenic mice expressing HBV. Antiviral Res. 90 (3), 227–230.
Jain V., Vyas S.P., Kohli D.V. 2009. Well-defined and potent liposomal hepatitis B vaccines adjuvanted with lipophilic MDP derivatives. Nanomedicine. 5 (3), 334–344.
Johnston D., Zaidi B., Bystryn J.C. 2007. TLR7 imidazoquinoline ligand 3M-019 is a potent adjuvant for pure protein prototype vaccines. Cancer Immunol. Immun. 56, 1133–1141.
Schulz O., Diebold S.S., Chen M., Näslund T.I., Nolte M.A., Alexopoulou L., Azuma Y.T., Flavell R.A., Liljeström P., Reis e Sousa C. 2005. Toll-like receptor 3 promotes cross-priming to virus infected cells. Nature. 433, 887–892.
Zaks K., Jordan M., Guth A., Sellins K., Kedl R., Izzo A., Bosio C., Dow S. 2006. Efficient immunization and cross-priming by vaccine adjuvants containing TLR3 or TLR9 agonists complexed to cationic liposomes. J. Immunol. 176, 7335–7345.
Alving C.R., Rao M., Steers N.J., Matyas G.R., Mayorov A.V. 2012. Liposomes contain ing lipid A: An effective, safe, generic adjuvant system for synthetic vaccines. Expert Rev. Vaccines. 11 (6), 733–744.
Vandepapelière P., Horsmans Y., Moris P., Van Mechelen M., Janssens M., Koutsoukos M., Van Belle P., Clement F., Hanon E., Wettendorff M., Garçon N., Leroux-Roels G. 2008. Vaccine adjuvant systems containing monophosphoryl lipid A and QS-21 induce strong and persistent humoral and T cell responses against hepatitis B surface antigen in healthy adult volunteers. Vaccine. 26, 1375–1386.
Richards R.L., Rao M., Wassef N.M., Glenn G.M., Rothwell S.W., Alving C.R. 1998. Liposomes containing lipid A serve as an adjuvant for induction of antibody and cytotoxic T-cell responses against RTS,S malaria antigen. Infect. Immun. 66 (6), 2859–2865.
Stoute J.A., Slaoui M., Heppner D.G., Momin P., Kester K.E., Desmons P., Wellde B.T., Garçon N., Krzych U., Marchand M. 1997. A preliminary evaluation of a recombinant circumsporozoite protein vaccine against Plasmodium falciparum malaria. N. Engl. J. Med. 336, 86–91.
Lacaille-Dubois M.A. 2019. Updated insights into the mechanism of action and clinical profile of the immunoadjuvant QS-21: A review. Phytomedicine. 60, 152905.
Marty-Roix R., Vladimer G.I., Pouliot K., Weng D., Buglione-Corbett R., West K., MacMicking J.D., Chee J.D., Wang S., Lu S., Lien E. 2016. Identification of QS-21 as an Inflammasome-activating molecular component of saponin adjuvants. J. Biol. Chem. 291 (3), 1123–1136.
Genito C.J., Beck Z., Phares T.W., Kalle F., Limbach K.J., Stefaniak M.E., Patterson N.B., Bergmann-Leitner E.S., Waters N.C., Matyas G.R., Alving C.R., Dutta S. 2017. Liposomes containing monophosphoryl lipid A and QS-21 serve as an effect tive adjuvant for soluble circumsporozoite protein malaria vaccine FMP013. Vaccine. 35 (31), 3865–3874.
Cawlfield A., Genito C.J., Beck Z., Bergmann-Leitner E.S., Bitzer A.A., Soto K., Zou X., Hadiwidjojo S.H., Gerbasi R.V., Mullins A.B., Noe A., Waters N.C., Alving C.R., Matyas G.R., Dutta S. 2019. Safety, toxicity and immunogenicity of a malaria vaccine based on the circumsporozoite protein (FMP013) with the adjuvant army liposome formulation containing QS-21 (ALFQ). Vaccine. 37, 3793–3803.
Martin M.L., Bitzer A.A., Schrader A., Bergmann-Leitner E.S., Soto K., Zou X., Beck Z., Matyas G.R., Dutta S. 2019. Comparison of immunogenicity and safety outcomes of a malaria vaccine FMP013/ALFQ in rhesus macaques (Macaca mulatta) of Indian and Chinese origin. Malar. J. 18 (1), 377.
A trial for the study of falciparum malaria protein 013 administered via intramuscular injection in healthy adults. https://clinicaltrials.gov/ct2/show/NCT04268420.
Nagill R., Kaur S. 2010. Enhanced efficacy and immunogenicity of 78kDa antigen formulated in various adjuvants against murine visceral leishmaniasis. Vaccine. 28 (23), 4002–4012.
Bal S.M., Hortensius S., Ding Z., Jiskoot W., Bouwstra J.A. 2011. Co-encapsulation of antigen and toll-like receptor ligand in cationic liposomes affects the quality of the immune response in mice after intradermal vaccination. Vaccine. 29 (5), 1045–1052.
Giddam A.K., Zaman M., Skwarczynski M., Toth I. 2012. Liposome-based delivery system for vaccine candidates: Constructing an effective formulation. Nanomedicine (Lond). 7 (12), 1877–1893.
Korsholm K.S., Hansen J., Karlsen K., Filskov J., Mikkelsen M., Lindenstrøm T., Schmidt S.T., Andersen P., Christensen D. 2014. Induction of CD8+ T-cell responses against subunit antigens by the novel cationic liposomal CAF09 adjuvant. Vaccine. 32 (31), 3927–3935.
Martin-Bertelsen B., Korsholm K.S., Roces C.B., Nielsen M.H., Christensen D., Franzyk H., Yaghmur A., Foged C. 2016. Nano-self-assemblies based on synthetic analogues of mycobacterial monomycoloyl glycerol and DDA: Supramolecular structure and adjuvant efficacy. Mol. Pharmaceutics. 13 (8), 2771–2781.
Purcell A.W., McCluskey J., Rossjohn J. 2007. More than one reason to rethink the use of peptides in vaccine design. Nat. Rev. Drug. Discov. 6 (5), 404–414.
Ohno S., Kohyama S., Taneichi M., Moriya O., Hayashi H., Oda H., Mori M., Kobayashi A., Akatsuka T., Uchida T., Matsui M. 2009. Synthetic peptides coupled to the surface of liposomes effectively induce SARS coronavirus-specific cytotoxic T lymphocytes and viral clearance in HLA-A*0201 transgenic mice. Vaccine. 27, 3912–3920.
Kohyama S., Ohno S., Suda T., Taneichi M., Yokoyama S., Mori M., Kobayashi A., Hayashi H., Uchida T., Matsui M. 2009. Efficient induction of cytotoxic T lymphocytes specific for severe acute respiratory syndrome (SARS)-associated coronavirus by immunization with surface-linked liposomal peptides derived from a non-structural polyprotein 1a. Antiviral Res. 84, 168–177.
Toth I., Danton M., Flinn N., Gibbons W.A. 1993. A combined adjuvant and carrier system for enhancing synthetic peptides immunogenicity utilising lipidic amino acids. Tetrahedron Lett. 34 (24), 3925–3928.
Zaman M., Chandrudu S., Giddam A.K., Reiman J., Skwarczynski M., McPhun V., Moyle P.M., Batz-loff M.R., Good M.F., Toth I. 2014. Group A streptococcal vaccine candidate: Contribution of epitope to size, antigen presenting cell interaction and immunogenicity. Nanomedicine (Lond.). 9 (17), 2613–2624.
Ghaffar K.A., Marasini N., Giddam A.K., Batzloff M.R., Good M.F., Skwarczynski M., Toth I. 2016. Liposome-based intranasal delivery of lipopeptide vaccine candidates against group A streptococcus. Acta Biomater. 41, 161–168.
Beesley J.L., Woolfson D.N. 2019. The de novo design of α-helical peptides for supramolecular self-assembly. Curr. Opin. Biotechnol. 58, 175–182.
Leboux R.J.T., Benne N., van Os W.L., Bussmann J., Kros A., Jiskoot W., Slütter B. 2021. High-affinity antigen association to cationic liposomes via coiled coil-forming peptides induces a strong antigen-specific CD4+ T-cell response. Eur. J. Pharm. Biopharm. 158, 96–105.
Shao S., Geng J., Ah Yi H., Gogia S., Neelamegham S., Jacobs A., Lovell J.F. 2015. Functionalization of cobalt porphyrin-phospholipid bilayers with His-tagged ligands and antigens. Nat. Chem. 7 (5), 438–446.
Huang W.C., Deng B., Lin C., Carter K.A., Geng J., Razi A., He X., Chitgupi U., Federizon J., Sun B., Long C.A., Ortega J., Dutta S., King C.R., Miura K., Lee S.M., Lovell J.F. 2018. A malaria vaccine adjuvant based on recombinant antigen binding to liposomes. Nat. Nanotechnol. 13 (12), 1174–1181.
Kaslow D.C., Bathurst I.C., Lensen T., Ponnudurai T., Barr P.J., Keister D.B. 1994. Saccharomyces cerevisiae recombinant Pfs25 adsorbed to alum elicits antibodies that block transmission of Plasmodium falciparum. Infect. Immun. 62, 5576–5580.
Wu Y., Ellis R.D., Shaffer D., Fontes E., Malkin E.M., Mahanty S., Fay M.P., Narum D., Rausch K., Miles A.P., Aebig J., Orcutt A., Muratova O., Song G., Lambert L., Zhu D., Miura K., Long C., Saul A., Miller L.H., Durbin A.P. 2008. Phase 1 trial of malaria transmission blocking vaccine candidates Pfs25 and Pvs25 formulated with montanide ISA 51. PLoS One. 3, e2636.
Platt V., Huang Z., Cao L., Tiffany M., Riviere K., Szoka F.C. 2010. Influence of multivalent nitrilotriacetic acid lipid−ligand affinity on the circulation half-life in mice of a liposome-attached His6-protein. Bioconj. Chem. 21, 892–902.
Huang W.C., Deng B., Seffouh A., Ortega J., Long C.A., Suresh R.V., He X., Miura K., Lee S.M., Wu Y., Lovell J.F. 2020. Antibody response of a particle-inducing, liposome vaccine adjuvant admixed with a Pfs230 fragment. NPJ Vaccines. 5 (1), 23.
Huang W.C., Zhou S., He X., Chiem K., Mabrouk M.T., Nissly R.H., Bird I.M., Strauss M., Sambhara S., Ortega J., Wohlfert E.A., Martinez-Sobrido L., Kuchipudi S.V., Davidson B.A., Lovell J.F. 2020. SARS-CoV-2 RBD neutralizing antibody induction is enhanced by particulate vaccination. Adv. Mater. 32, 2005637.
De Serrano L.O., Burkhart D.J. 2017. Liposomal vaccine formulations as prophylactic agents: Design considerations for modern vaccines. J. Nanobiotechnology. 15 (1), 83.
Wang N., Chen M., Wang T. 2019. Liposomes used as a vaccine adjuvant-delivery system: From basics to clinical immunization. J. Control. Release. 303, 130–150.
Crommelin D.J.A., van Hoogevest P., Storm G. 2020. The role of liposomes in clinical nanomedicine development. What now? Now what? J. Control. Release. 318, 256–263.
Bovier P.A. 2008. Epaxal®: A virosomal vaccine to prevent hepatitis A infection. Expert Rev. Vac. 7 (8), 1141–1150.
Mischler R., Metcalfe I.C. 2002. Inflexal V a trivalent virosome subunit influenza vaccine: Production. Vaccine. 20 (Suppl 5), B17–B23.
Moser C., Muller M., Kaeser M.D., Weydemann U., Amacker M. 2013. Influenza virosomes as vaccine adjuvant and carrier system. Expert Rev. Vac. 12 (7), 779–791.
Glueck R. Review of intranasal influenza vaccine. 2001. Adv. Drug Deliv. Rev. 51 (1–3), 203–211.
Alving C.R., Beck Z., Matyas G.R., Rao M. 2016. Liposomal adjuvants for human vaccines. Expert Opin. Drug Deliv. 13 (6), 807–816.
Syed Y.Y. 2018. Recombinant zoster vaccine (Shingrix®): A review in herpes zoster. Drugs Aging. 35, 1031–1040.
Cunningham A.L., Lal H., Kovac M., Chlibek R., Hwang S.J., Diez-Domingo J., Godeaux O., Levin M.J., McElhaney J.E., Puig-Barbera J., Abeele C.V., Vesikari T., Watanabe D., Zahaf T., Ahonen A., Athan E., Barba-Gomez J.F., Campora L., de Looze F., Downey H.J., Ghesquiere W., Gorfinkel I., Korhonen T., Leung E., McNeil S.A., Oostvogels L., Rombo L., Smetana J., Weckx L., Yeo W., Heineman T.C., Z.O.E.S. Group. 2016. Efficacy of the herpes zoster subunit vaccine in adults 70 years of age or older. N. Engl. J. Med. 375 (11), 1019–1032.
Dendouga N., Fochesato M., Lockman L., Mossman S., Giannini S.L. 2012. Cell-mediated immune responses to a varicella-zoster virus glycoprotein E vaccine using both a TLR agonist and QS-21 in mice. Vaccine 30 (20), 3126–3135.
James S.F., Chahine E.B., Sucher A.J., Hanna C. 2018. Shingrix: The new adjuvanted recombinant herpes zoster vaccine. Ann. Pharmacother. 52 (7), 673–680.
van Dissel J.T., Joosten S.A., Hoff S.T., Soonawala D., Prins C., Hokey D.A., O’Dee D.M., Graves A., Thierry-Carstensen B., Andreasen L.V., Ruhwald M., de Visser A.W., Agger E.M., Ottenhoff T.H., Kromann I., Andersen P. 2014. A novel liposomal adjuvant system, caf01, promotes long-lived mycobacterium tuberculosis-specific t-cell responses in human. Vaccine. 32, 7098–7107.
Román V.R., Jensen K.J., Jensen S.S., Leo-Hansen C., Jespersen S., da Silva Té D., Rodrigues C.M., Janitzek C.M., Vinner L., Katzenstein T.L., Andersen P., Kromann I., Andreasen L.V., Karlsson I., Fomsgaard A. 2013. Therapeutic vaccination using cationic liposome-adjuvanted hiv type 1 peptides representing hla-supertype-restricted subdominant t cell epitopes: Safety, immunogenicity, and feasibility in guinea-bissau. AIDS Res. Hum. Retrovir. 29, 1504–1512.
Olotu A., Fegan G., Wambua J., Nyangweso G., Leach A., Lievens M., Kaslow D.C., Njuguna P., Marsh K., Bejon P. 2016. Seven-year efficacy of RTS,S/AS01 malaria vaccine among young african children. N. Engl. J. Med. 374 (26), 2519–2529.
Tenchov R., Bird R., Curtze A.E., Zhou Q. 2021. Lipid nanoparticles – from liposomes to mRNA vaccine delivery, a landscape of research diversity and advancement. ACS Nano. https://doi.org/10.1021/acsnano.1c04996
Szoka F.C., Xu Y., Zelphati O. 1997. How are nucleic acids released in cells from cationic lipid-nucleic acid complexes? Adv. Drug Deliv. Rev. 24 (2–3), 291–291.
Schoenmaker L., Witzigmann D., Kulkarni J.A., Verbeke R., Kersten G., Jiskoot W., Crommelin D.J.A. 2021. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. Int. J. Pharm. 601, 120586.
Viger-Gravel J., Schantz A., Pinon A.C., Rossini A.J., Schantz S., Emsley L. 2018. Structure of lipid nanoparticles containing siRNA or mRNA by dynamic nuclear polarization-enhanced NMR spectroscopy. J. Phys. Chem. B. 122 (7), 2073–2081.
Brader M.L., Williams S.J., Banks J.M., Hui W.H., Zhou Z.H., Jin L. 2021. Encapsulation state of messenger RNA inside lipid nanoparticles. Biophys. J. https://doi.org/10.1016/j.bpj.2021.03.012
Igyártó B.Z., Jacobsen S., Ndeupen S. 2021. Future considerations for the mRNA-lipid nanoparticle vaccine platform. Curr. Opin. Virol., 48, 65–72.
Blakney A.K., McKay P.F., Yus B.I., Aldon Y., Shattock R.J. 2019. Inside out: optimization of lipid nanoparticle formulations for exterior complexation and in vivo delivery of saRNA. Gene Therapy. 26, 363–372.
Blakney A.K., Deletic P., McKay P.F., Bouton C.R., Ashford M., Shattock R.J., Sabirsh A. 2021. Effect of complexing lipids on cellular uptake and expression of messenger RNA in human skin explants. J. Control. Release. 330, 1250–1261.
Drescher S., van Hoogevest P. 2020. The phospholipid research center: Current research in phospholipids and their use in drug delivery. Pharmaceutics. 12 (12), 1235.
Yanasarn N., Sloat B.R., Cui Z. 2011. Negatively charged liposomes show potent adjuvant activity when simply admixed with protein antigens. Mol. Pharm. 8 (4), 1174–1185.
Weinberger B. 2018. Adjuvant strategies to improve vaccination of the elderly population. Curr. Opin. Pharmacol. 41, 34–41.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии