Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 2, стр. 107-115
Функционирование прегнан Х рецептора в условиях окислительного стресса
Ю. В. Абаленихина a, *, Е. А. Судакова a, А. А. Слепнев a, А. А. Сеидкулиева a, П. Д. Ерохина a, А. В. Щулькин a, Е. Н. Якушева a
a Рязанский государственный медицинский университет
имени академика И.П. Павлова Минздрава России
390026 Рязань, Россия
* E-mail: abalenihina88@mail.ru
Поступила в редакцию 07.04.2021
После доработки 05.07.2021
Принята к публикации 06.07.2021
- EDN: NVNAIZ
- DOI: 10.31857/S0233475522010030
Аннотация
Прегнан Х рецептор (PXR) – ядерный рецептор, играющий важную роль в регуляции экспрессии ферментов биотрансформации и обмена веществ, а также белков-транспортеров. В литературе имеются противоречивые данные о влиянии окислительного стресса на количество PXR. Цель настоящего исследования – оценить влияние окислительного стресса на функционирование PXR. Работа выполнена на клетках линии Caco-2. Окислительный стресс моделировали пероксидом водорода в концентрациях 0.1, 0.5, 1, 5, 10, 50 и 100 мкМ и длительностью инкубации 3, 24 и 72 ч. Количество PXR оценивали методом вестерн-блот. H2O2 во всех концентрациях при инкубации 3 ч достоверно не влиял на количество PXR. Увеличение экспозиции до 24 ч в концентрации прооксиданта 10, 50 и 100 мкМ приводило к повышению количества PXR, что сочеталось с увеличением концентрации продуктов перекисного окисления липидов (ПОЛ). Продолжение воздействия пероксида водорода до 72 ч сопровождалось нарастанием концентрации продуктов ПОЛ и снижением количества PXR до показателей контроля (при концентрации H2O2 10 мкМ) или ниже него (при концентрации H2O2 50 и 100 мкМ). Инкубирование клеток с малоновым диальдегидом, конечным продуктом ПОЛ, в концентрации 10 мкМ в течение 24 ч приводило к увеличению содержания PXR. Таким образом, воздействие пероксида водорода в течение 24 ч приводит к повышению количества PXR и связано с индуцирующим воздействием продуктов ПОЛ. Увеличение длительности экспозиции до 72 ч нивелирует индуцирующее действие перокисида водорода.
ВВЕДЕНИЕ
Прегнан Х рецептор (PXR, steroid and xenobio-tic receptor – SXR, NR1I2 – Nuclear Receptor Subfamily 1, Group I, Member 2) является членом суперсемейства ядерных рецепторов, которое в основном включает факторы транскрипции [1].
Впервые PXR был независимо клонирован в лабораториях Kliewer в Glaxo Wellcome и Evans в Salk Institute в 1998 году [2, 3]. PXR был назван Kliewer на основании его активации 21-углеродными стероидами прегнанами. В лаборатории Evans данный рецептор получил наименование стероидный и ксенобиотический рецептор (SXR) из-за его активации широким спектром природных и синтетических стероидов, а также ксенобиотиков [3].
PXR экспрессируется преимущественно в печени и кишечнике. Первоначально было выявлено, что PXR регулирует экспрессию ферментов I фазы биотрансформации, таких как изоферменты цитохрома P450 CYP3A и CYP2B. Последующие исследования, выполненные во многих лабораториях, показали, что PXR является одним из главных регуляторов ксенобиотического ответа, регулируя экспрессию ферментов, также II фазы биотрансформации UDP-глюкуронозилтрансферазы 1A1 и сульфотрансферазы, а также переносчиков лекарственных веществ MDR1 и MRP2 [4].
PXR контролирует экспрессию генов через модуль PXR-чувствительного элемента в промоторной области генов-мишеней. Основными индукторами PXR являются рифампицин, рифаксимин, ампренавир, литохолевая кислота, соломстерол A и B, дексаметазон, никардипин и др. [5].
Совсем недавно было показано, что PXR-опосредованная регуляция ферментов и переносчиков может принимать участие во многих физиологических и патологических процессах, например, обмене желчных кислот, билирубина, стероидных гормонов, глюкозы и липидов. Эти новые данные предполагают, что функции PXR выходят за рамки “рецептора ксенобиотиков” [4].
Активные формы кислорода (АФК) образуются во время физиологических процессов и, взаимодействуя с белками, жирами, нуклеиновыми кислотами, играют значимую роль в регуляции клеточных функций. Однако избыточная продукция АФК может приводить к структурным и функциональным изменениям, вызывающим повреждение клеток. Эти потенциально токсические эффекты компенсируются в нормальных условиях внутренними антиоксидантными механизмами, которые участвуют в физиологическом и/или патологическом метаболизме АФК [6].
Окислительный стресс, который возникает в результате повышенной продукции АФК и/или снижения емкости антиоксидантной защиты, может вызывать повреждение клеточных компонентов, аутоиммунные реакции и, в конечном итоге, способствовать нарушению биохимических и физиологических процессов [7].
В ряде исследований оценивалось влияние окислительного стресса на количество PXR. В опытах in vivo на мышах и крысах выявлено, что развитие воспаления и окислительного стресса, вызванных введением липополисахарида или наночастиц меди, сопровождается снижением количества PXR в печени животных [8, 9]. В то же время в опытах in vitro на эндотелиальных клетках HUVEC показано, что воздействие H2O2 в концентрации 400 мкМ и длительностью экспозиции 3 ч не влияет на уровень PXR [10].
Таким образом, данные о функционировании PXR в условиях окислительного стресса носят противоречивый характер. Поэтому целью настоящего исследования было оценить влияние окислительного стресса на функционирование PXR.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование клеток. Исследование выполнено на линии клеток аденокарциномы ободочной кишки человека (Caco-2) (ЦКП “Коллекция культур клеток позвоночных”, Санкт-Петербург, Россия). Клетки культивировали при 37°C и 5% содержании СО2 в инкубаторе WS-189C (World Science, Корея) в Дульбекко модифицированной среде Игла (DMEM) с высоким содержанием глюкозы (4500 мг/л) (Sigma-Aldrich, США), с добавлением L-глутамина (4 мМ) (Sigma-Aldrich), 15% эмбриональной бычьей сыворотки (Sigma-Aldrich), 100 ед/мл и 100 мкг/мл пенициллина и стрептомицина (Sigma-Aldrich) соответственно.
Клетки культивировали в течение 21 сут, поскольку при данном сроке происходит их спонтанная дифференцировка в энтероцитоподобные клетки, экспрессирующие PXR [11].
Окислительный стресс моделировали добавлением в культуральную среду пероксида водорода Н2О2 (Sigma-Aldrich) в конечных концентрациях 0.1, 0.5, 1, 5, 10, 50 и 100 мкМ и инкубацией в течение 3, 24 и 72 ч.
Контрольным клеткам в эквивалентном объеме в культуральную среду добавляли воду для инъекций (растворитель для H2O2). На каждый эксперимент было выполнено по 3 повторения. При инкубации 72 ч смену питательной среды проводили каждые 24 ч. В качестве контроля индукции PXR дополнительно проводили инкубирование клеток Сасо-2 с рифампицином (Sigma-Aldrich) в концентрации 10 мкМ в течение 24 ч.
Дополнительно для изучения механизма влияния окислительного стресса на количество PXR были выполнены серии экспериментов с оценкой влияния продукта перекисного окисления липидов (ПОЛ) – малонового диальдегида (МДА, Sigma- Aldrich) – в концентрациях 10, 100 и 150 мкМ и экспозицией 24 ч на содержание PXR (n = 3 для каждой концентрации).
Для исследования цитотоксичности пероксида водорода и МДА клетки высевали в 96-луночный планшет (Сorning, США), для изучения влияния данных веществ на концентрацию продуктов ПОЛ и количество PXR клетки культивировали в 6-луночных планшетах (Сorning).
Цитотоксический тест (МТТ-тест). Клетки засевали в 96-луночный планшет из расчета 104 клеток на каждую лунку и культивировали в течение 21 сут, затем добавляли питательную среду с Н2О2 или МДА. После окончания инкубации в каждую лунку добавляли по 20 мкл 0.5% раствора бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил тетразолия (МТТ, ПанЭко, Россия) и инкубировали в течение 2 ч, затем раствор МТТ удаляли и добавляли 200 мкл 1% раствора диметилсульфоксида (ПанЭко) [12]. Поглощение измеряли через 10 мин при 530 нм на спектрофотометре для планшетов Stat Fax 2100 (Awareness Technology, США).
Жизнеспособность клеток Сасо-2 рассчитывали по формуле: (ОП опытных лунок – ОП среды)/ (ОП контрольных лунок – ОП среды) × 100%, где ОП — оптическая плотность.
Получение тотальных клеточных лизатов. Клетки засевали в 6-луночные планшеты из расчета 105 клеток на каждую лунку и культивировали в течение 21 сут, затем добавляли питательную среду с Н2О2 или МДА в соответствующие планшеты. После окончания экспозиции с пероксидом водорода или МДА клетки снимали с лунок раствором трипсин–EDTA (0.25% трипсина и 0.2% EDTA, Sigma-Aldrich).
Клетки из расчета 1 × 106 промывали изотоническим солевым раствором (Медпро, Россия) и лизировали в 150 мкл ледяного буфера (50 мМ, pH 7.4 трис-HCl, 150 мМ KCl, 0.5% тритон X-100, смесь ингибиторов протеиназ (аминоэтилбензенсульфонил флуорида гидрохлорид (AEBSF) 2 мМ, апротинин 0.3 мкМ, бестатин 130 мкМ, EDTA 1 мМ, эпоксисукциниллейцингуанидинобутиламид (Е-64) 14 мкМ, лейпептин 1 мкМ, Sigma-Aldrich), встряхивали на шейкере и инкубировали на льду в течение 10 мин. Затем центрифугировали в течение 10 мин при 5000 g (СМ-50, Eppendorf, Германия). Цитоплазматическую (экстраядерную) фракцию переносили в отдельные пробирки и использовали для определения концентрации продуктов ПОЛ (МДА и 4-гидрокси-олефины).
Определение концентрации продуктов перекисного окисления липидов. В лизате клеток с помощью коммерческого набора определяли концентрацию продуктов ПОЛ (Elabscience, Китай). Метод определения продуктов ПОЛ – МДА и 4-гидрокси-олефинов (4-гидрокси-2-ноненаля и 4-гидрокси-2-гексеналя) основан на их взаимодействии с 1-метил-2-фенилиндолом с образованием стабильного хромофора, который имеет максимум поглощения при 586 нм [13]. Полученные результаты выражали в мкмоль/мг белка. Анализ выполняли на спектрофотометре для планшетов Stat Fax 2100 (Awareness Technology).
Количество белка в пробах анализировали методом Бредфорда (Pierce Coomassie Plus (Bradford) Assay Kit, Thermo Fisher Scientific, США) [14].
Определение количества PXR в клетках линии Сасо-2 проводили методом вестерн-блот. После окончания экспозиции с пероксидом водорода и МДА, клетки снимали с лунок раствором трипсин–EDTA (Sigma-Aldrich), трижды промывали раствором фосфатного буфера (BioRad, США) и лизировали в NP40 Cell Lysis Buffer Thermo (Thermo Fisher Scientific) c добавлением смеси ингибиторов протеиназ (Sigma-Aldrich) в течение 30 мин при +4°C и постоянном перемешивании из расчета 107 клеток на 100 мкл буфера. Полученный лизат центрифугировали при 22 440 g в течение 10 мин (AvantiJXN-3, Beckman Coulter, США). Цитоплазматические белки (30 мкг) подвергали электрофорезу с использованием TGX Stain-Free FastCast Acrylamide Kit (Bio-Rad) в буферной системе Лэммли (BioRad). Перед загрузкой образцы обрабатывались в соответствии с протоколом Bio-Rad. Их смешивали с буфером для образцов Лэммли (Bio-Rad), содержащем 2.5% 2-меркаптоэтанола (Bio-Rad) в соотношении 1 : 3, инкубировали 5 мин при температуре 95°C. Гели прогоняли при 100 В в течение 90 мин. Для определения относительного количество PXR методом вестерн-блот использовали первичные мышиные моноклональные антитела (MA5-31808 PXR Monoclonal Antibody (1D12G1, Invitrogen, США) в концентрации 1 : 200. Визуализацию первичных антител осуществляли с использованием вторичных кроличьих антител (Rabbit anti-Mouse IgG (H + L) Secondary Antibody, HRP, Invitrogen) в разведении 1 : 4000. Белки визуализировали хемилюминесценцией с помощью Chemi Doc XRS+ (Bio-Rad). Интенсивность полученных полос (бэндов) анализировали денситометрически с помощью программного обеспечения ImageLab (Bio-Rad). Количество PXR оценивали относительно содержания белка домашнего хозяйства GAPDH (первичные антитела к GAPDH – Loading Control Monoclonal Antibody (GA1R), DyLight 68, Invitrogen, разведение 1 : 1000, вторичные кроличьи антитела к первичным антителам GAPDH – Rabbitanti-Mouse IgG (H + L) Secondary Antibody, HRP, Invitrogen, разведение 1 : 4000).
Статистический анализ. Полученные результаты анализировали с помощью программ StatSoft Statistica 13.0 (США) и Microsoft Excel for MAC ver. 16.24. Результаты представлены в виде M ± SD. Для оценки статистической значимости различий использовали дисперсионный анализ (ANOVA), попарные сравнения выполняли с помощью критерия Ньюмена–Кейлса. Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАЫ
Цитотоксическое действие H2O2 и МДА на клетки линии Caco-2. Цитотоксическое действие H2O2 и МДА оценивалось по результатам МТТ-теста. В контрольной группе жизнеспособность клеток составила 100%. При воздействии пероксида водорода в концентрациях 0.1–10 мкМ и сроках инкубации 3, 24 и 72 ч жизнеспособность клеток не изменялась и составляла в среднем 87.6 ± 9.3%.
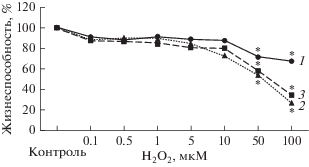
При инкубации клеток с H2O2 в течение 3, 24 и 72 ч при концентрации прооксиданта 50 мкМ жизнеспособность клеток снижалась до 71.3 ± ± 12.1% (p = 0.01), 54.1 ± 9.5% (p = 0.001) и 58.8 ± ± 11.5 (p = 0.02), а при концентрации 100 мкМ – до 70.9 ± 12.2% (p = 0.006), 26.8 ± 14.3% (p = = 0.0003) и 34.3 ± 11.1% (p = 0.002) соответственно (рис. 1).
Рис. 1.
Изменение жизнеспособности клеток линии Сасо-2 в зависимости от концентрации пероксида водорода при инкубации 3 (1), 24 (2) и 72 ч (3) (n = 3). Жизнеспособность клеток оценивали с помощью МТТ-теста. *p < 0.05 по сравнению с контролем.
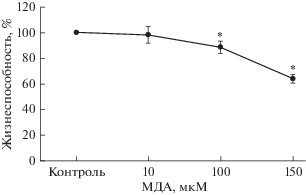
При воздействии МДА на клеточную линию Сасо-2 их жизнеспособность снижалась при концентрации субстанции 100 и 150 мкМ до 88.5 ± ± 4.6% (p = 0.028) и 63.9 ± 3.1% (p = 0.0003), а при концентрации 10 мкМ статистически значимо не отличались от значений контрольной группы и составила 98.1 ± 6.5% (рис. 2).
Рис. 2.
Изменение жизнеспособности клеток линии Сасо-2 в зависимости от концентрации МДА при инкубации 24 ч (M ± SD, n = 3). Жизнеспособность клеток оценивали с помощью МТТ-теста. *p < 0.01 по сравнению с контролем.
Концентрация продуктов ПОЛ в клетках Caco-2 после инкубации с H2O2 и МДА. Воздействие пероксида водорода на клетки линии Caco-2 в течение 3 ч приводило к увеличению уровня продуктов ПОЛ лишь в концентрации 100 мкМ на 35.7% (p = 0.04) по сравнению с контролем. Увеличение длительности экспозиции Н2О2 до 24 ч сопровождалось повышением содержания МДА и 4-гидроксиолефинов уже при двух концентрациях прооксиданта: 50 мкМ – на 42.1% (p = 0.006) и 100 мкМ – на 57.1% (p = 0.0007) соответственно (рис. 3). При увеличении длительности воздействия пероксида водорода до 72 ч отмечалось дальнейшее нарастание уровня продуктов ПОЛ при концентрациях Н2О2 50 и 100 мкМ, данные показатели превышали значение контроля на 194.9% (p = 0.0002) и 323.4% (p = 0.0003) соответственно.
Рис. 3.
Изменение концентрации продуктов перекисного окисления липидов (МДА и 4-гидроксиолефинов) при индукции окислительного стресса пероксидом водорода в концентрациях 0.1–100 мкМ в течение 3, 24 и 72 ч. Количественное определение продуктов ПОЛ проводили фотометрическим методом в лизате клеток линии Сасо-2 (M ± SD, n = 3). *p < 0.05 по сравнению с контролем. #p < 0.01 по сравнению с группой 24 ч.
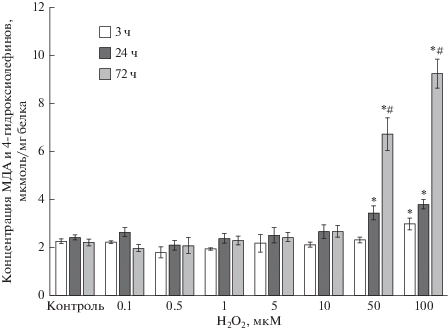
Важно отметить, что при увеличении срока инкубации до 72 ч концентрация продуктов ПОЛ возрастала также относительно значений при сроке инкубации 24 ч на 87.6% (p = 0.002) при концентрации 50 мкМ и на 144.8% (p = 0.0004) при концентрации 100 мкМ.
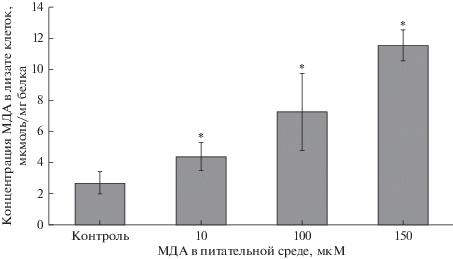
Добавление МДА в питательную среду к клеткам линии Сасо-2 в концентрации 10, 100 и 150 мкМ приводило к статистически значимому увеличению количества МДА в лизате клеток на 63.8% (p = 0.03), 168.3% (p = 0.02), 325.1% (p = = 0.0008) соответственно, что свидетельствует о проникновении продукта ПОЛ в цитоплазму клеток (рис. 4).
Рис. 4.
Изменение концентрации МДА в лизате клеток линии Сасо-2 после инкубации в питательной среде с добавлением МДА в концентрациях 10, 100 и 150 мкМ в течение 24 ч (M ± SD, n = 3). *p < 0.05 по сравнению с контролем.
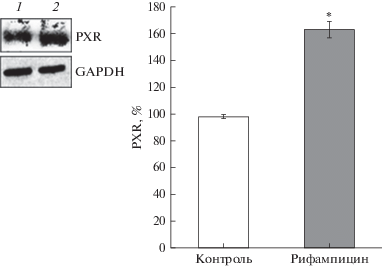
Влияние H2O2 и МДА на количество PXR. Классический индуктор PXR – рифампицин в концентрации 10 мкМ и длительностью воздействия 24 ч вызывал увеличение количества PXR на 64.6% (p = 0.0003) по сравнению с контролем (рис. 5), что подтверждает адекватность метода оценки регуляции данного транскрипционного фактора и согласуется с данными литературы [15].
Рис. 5.
Относительное количество PXR в клетках линии Сасо-2 при воздействии рифампицина в концентрации 10 мкМ в течение 24 ч. Относительное количество PXR определяли методом вестерн-блот с последующим денситометрическим анализом с помощью программного обеспечения ImageLab. 1 – контроль; 2 – рифампицин; *p < 0.05 по сравнению с контролем (дисперсионный анализ).
Воздействие пероксида водорода на клетки линии Caco-2 в течение 3 ч не влияло на количество PXR, данный показатель достоверно не отличался от значений контроля (рис. 6).
Рис. 6.
Относительное количество PXR в клетках линии Сасо-2 при индукции окислительного стресса пероксидом водорода в концентрациях 0.1–100 мкМ в течение 3, 24 и 72 ч (M ± SD, n = 3). Относительное количество PXR определяли методом вестерн-блот с последующим денситометрическим анализом с помощью программного обеспечения ImageLab. К – контроль; *p < 0.05 по сравнению с контролем.
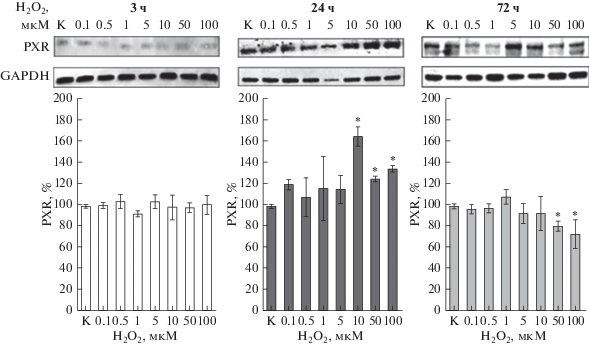
Увеличение длительности экспозиции с прооксидантом до 24 ч вызывало повышение количества PXR при концентрации H2O2 10, 50 и 100 мкМ на 67.1% (p = 0.03), 25.9% (p = 0.0003) и 35.9% (p = = 0.0003) соответственно (рис. 6).
Увеличение длительности воздействия до 72 ч сопровождалось нормализацией уровня PXR при концентрации H2O2 0.1–10 мкМ и его снижением при концентрации 50 мкМ на 18.6% (p = 0.0003) и при концентрации 100 мкМ на 26.9% (p = 0.03) по сравнению с контролем (рис. 6).
При концентрации пероксида водорода 100 мкМ и длительности инкубации 72 ч отмечалось расщепление бэнда PXR, что скорее всего, связано с повреждением молекулы транскрипционного фактора за счет окислительного повреждения или действием протеолитических ферментов.
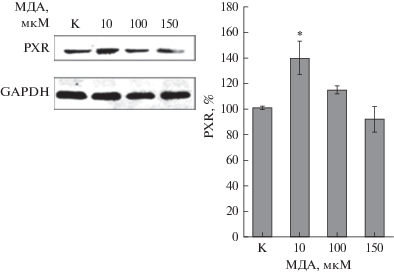
Инкубирование клеток с МДА также приводило к индукции PXR: при концентрации МДА 10 мкМ количество PXR возрастало на 38.6% (p = = 0.007), 100 мкМ – на 20.8% (p = 0.07), а при 150 мкМ – снизилось на 8.9% (p = 0.21) (рис. 7).
Рис. 7.
Относительное количество PXR в клетках линии Сасо-2 при воздействии МДА в концентрациях 10, 100 и 150 мкМ в течение 24 ч (M ± SD, n = 3). Относительное количество PXR определяли методом вестерн-блот с последующим денситометрическим анализом с помощью программного обеспечения ImageLab. К – контроль; *p < 0.05 по сравнению с контролем.
ОБСУЖДЕНИЕ
Активные формы кислорода (АФК) постоянно образуются в ходе жизнедеятельности клеток. При этом их избыточное образование может вызывать окислительное повреждение биомакромолекул клеток и способствовать развитию заболеваний и старению [16]. Между тем, АФК могут играть и регуляторную роль [17]. В настоящее время принято считать, что в функции АФК как сигнальной молекулы главную роль играет цистеин [18]. Тиолы белков образуют различные окислительные модификации, такие как сульфеновая кислота, сульфиновая кислота, сульфоновая кислота, дисульфидные связи, S-глутатионилированные и S-нитрозилированные производные. Эти окислительные модификации тиолов участвуют во множестве клеточных процессов, таких как экспрессия генов, энергетический метаболизм, фосфорилирование белков [19]. Кроме этого, известно, что изучаемые нами показатели – малоновый диальдегид и 4-гидроксиолефины – могут выступать в качестве сигнальных молекул, а именно доказана их цитотоксическая роль в подавлении экспрессии генов, что способствует гибели клеток [20].
В ходе настоящего исследования было показано, что воздействие пероксида водорода на клетки линии Caco-2 в течение 3 ч не влияло на количество PXR, увеличение длительности экспозиции с прооксидантом до 24 ч вызывало повышение количества PXR при концентрации H2O2 10, 50 и 100 мкМ. При длительности экспозиции 72 ч отмечалась нормализация уровня PXR при концентрации H2O2 0.1–10 мкМ и его снижение в концентрации 50 и 100 мкМ. Снижение количества изучаемого транскрипционного фактора, скорее всего, связано с усилением окислительного стресса: при данных концентрациях и длительности воздействия отмечалось максимальное увеличение уровня МДА и снижение жизнеспособности клеток. Кроме этого, в условиях окислительного стресса происходит активация протеолитических ферментов, что может приводить к протеазному расщеплению PXR и вследствие этого снижать его количество.
Для исследования механизма повышения количества PXR при развитии окислительного стресса были выполнены эксперименты по оценке влияния МДА-конечного продукта ПОЛ на уровень изучаемого транскрипционного фактора. В ходе эксперимента было установлено, что инкубация клеток линии Caco-2 с МДА в течение 24 ч приводила к повышению его концентрации внутри клеток. По данным литературы известно, что МДА может растворяться в билипидной мембране клеток и проникать внутрь клеток [21], тем самым оказывая внутриклеточные эффекты.
МДА в концентрации 10 мкМ вызывал повышение содержания PXR, а увеличение концентрации МДА до 100 и 150 мкМ приводило к проявлению его цитотоксических свойств и снижению содержания PXR.
В совокупности данные результаты свидетельствуют о том, что индукция PXR при развитии окислительного стресса обусловлена влиянием продуктов пероксидации (в частности МДА) на данный транскрипционный фактор.
Сделанный вывод согласуется с данными литературы. Известно, что короткоцепочечные жирные кислоты, например бутират натрия, могут вызывать индукцию экспрессии гена PXR на клетках линии Caco-2 [22].
На данный момент механизмы индукции PXR продолжают активно изучаться [4]. Для низкомолекулярных веществ наиболее вероятным механизмом является их связывание с аналогичными рецепторами ксенобиотиков (например, Farnesoid X receptor) и повышение транскрипции гена PXR.
Повышение количества PXR при развитии окислительного стресса может иметь двоякое значение. С одной стороны, PXR может способствовать генерации АФК и повреждению клеток за счет индукции изоферментов цитохрома Р450 (CYP2B1/2B2, CYP3A1/3A2 и CYP2C6) и интенсификации метаболизма ксенобиотиков [23]. С другой – PXR может иметь приспособительную функцию, так как данный транскрипционный фактор стимулирует экспрессию антиоксидантного фермента глутатион-S-трансферазы [24].
ЗАКЛЮЧЕНИЕ
Таким образом, в ходе исследования на клетках линии Caco-2 было показано, что H2O2 в концентрациях при 10, 50 и 100 мкМ при длительности экспозиции 24 ч вызывает повышение количества PXR, что сочетается с увеличением концентрации продуктов липопероксидации (ПОЛ). Продолжение воздействия пероксида водорода до 72 ч сопровождается нарастанием концентрации продуктов ПОЛ и снижением количества PXR до показателей контроля (10 мкМ) или ниже него (50 и 100 мкМ). Инкубирование клеток с МДА в концентрации 10 мкМ также приводит к индукции PXR, что свидетельствуют о том, что индукция PXR при развитии окислительного стресса обусловлена влиянием продуктов пероксидации (в частности МДА) на данный транскрипционный фактор.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Исследование выполнено при финансовой поддержке гранта Президента Российской Федерации для государственной поддержки молодых российских ученых – кандидатов наук МК-1856.2020.7.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Yan J., Xie W. 2016. A brief history of the discovery of PXR and CAR as xenobiotic receptors. Acta Pharm. Sin. 6, 450–452. https://doi.org/10.1016/j.apsb.2016.06.011
Kliewer S.A., Moore J.T., Wade L., Staudinger J.L., Watson M.A., Jones S.A., McKee D.D., Oliver B.B., Willson T.M., Zetterström R.H., Perlmann T., Lehmann J.M. 1998. An orphan nuclear receptor activated by pregnanes defines a novel steroid signaling pathway. Cell. 92 (1), 73–82. http://doi.org/10.1016/s0092-8674(00)80900-9
Blumberg B., Sabbagh Jr.W., Juguilon H., Bolado Jr.J., Meter C.M., Ong E.S., Evans R.M. 1998. SXR, a novel steroid and xenobiotic-sensing nuclear receptor. Genes Dev. 12 (20), 3195–205. http://doi.org/10.1101/gad.12.20.3195
Daujat-Chavanieu M., Gerbal-Chaloin S. 2020. Regulation of CAR and PXR expression in health and disease. Cells. 9, 2395. https://doi.org/10.3390/cells9112395
Chai S.C., Lin W., Li Y., Chen T. 2019. Drug discovery technologies to identify and characterize modulators of the pregnane X receptor and the constitutive androstane receptor. Drug Discov. Today. 24 (3), 906–915. http://doi.org/10.1016/j.drudis.2019.01.021
Rajendran P., Nandakumar N., Rengarajan T., Palaniswami R., Gnanadhas E.N., Lakshminarasaiah U., Gopas J., Nishigaki I. 2014. Antioxidants and human diseases. Clinica Chimica Acta. 436, 332–347. http://doi.org/10.1016/j.cca.2014.06.004
Zhang Y., Tocchetti C.G., Krieg T., Moens A.L. 2012. Oxidative and nitrosative stress in the maintenance of myocardial function. Free Radic. Biol. Med. 53 (8), 1531–1540. http://doi.org/10.1016/j.freeradbiomed.2012.07.010
Xu D.-X., Wei W., Sun M.-F., Wu C.-Y., Wang J.-P., Wei L.-Z., Zhou C.-F. 2004. Kuper cells and reactive oxygen species partially mediate lipopolysaccharide-induced downregulation of nuclear receptor pregnane x receptor and its target gene CYP3a in mouse liver. Free. Radic. Biol. Med. 37, 10–22. http://dx.doi.org/10.1084/jem.20140654
Tang H., Xu M., Shi F., Ye G., Lv C., Luo J., Zhao L., Li Y. 2018. Effects and mechanism of nano-copper exposure on hepatic cytochrome P450 enzymes in rats. Int. J. Mol. Sci. 19, 2140. https://doi.org/10.3390/ijms19072140
Zhu H., Chen Z., Ma Z., Tan H., Xiao C., Tang X., Zhang B., Wang Y., Gao Y. 2017. Tanshinone IIA protects endothelial cells from H2O2-induced injuries via PXR activation. Biomol. Ther. (Seoul). 25 (6), 599–608. https://doi.org/10.4062/biomolther.2016.179
Garg A., Zhao A., Erickson S.L., Mukherjee S., Lau A.J., Alston L., Chang T.K., Mani S., Hirota S.A. 2016. Pregnane X receptor activation attenuates inflammation-associated intestinal epithelial barrier dysfunction by inhibiting cytokine-induced myosin light-chain kinase expression and c-Jun N-terminal kinase 1/2 activation. J. Pharmacol. Exp. Ther. 359 (1), 91–101. https://doi.org/10.1124/jpet.116.234096
Tolosa L., Donato M.T., Gómez-Lechón M.J. 2015. General cytotoxicity assessment by means of the MTT assay. Methods Mol. Biol. 1250, 333–348. https://doi.org/10.1007/978-1-4939-2074-7_26
Gérard-Monnier D., Erdelmeier I., Régnard K., Moze-Henry N., Yadan J.C., Chaudière J. 1998. Reactions of 1-methyl-2-phenylindole with malondialdehyde and 4-hydroxyalkenals. Analytical applications to a colorimetric assay of lipid peroxidation. Chem. Res. Toxicol. 11 (10), 1176–1183. http://doi.org/10.1021/tx9701790
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 7 (72), 248–254. https://doi.org/10.1006/abio.1976.9999
Lemmen J., Tozakidis I. E.P., Galla H.-J. 2013. Pregnane X receptor upregulates ABC-transporter Abcg2 and Abcb1 at the blood-brain barrier. Brain Research. 1491, 1–13. https://doi.org/10.1016/j.brainres.2012.10.060
Valko M., Leibfritz D., Moncol J., Cronin M.T., Mazur M., Telser J. 2007. Free radicals and antioxidants in normal physiological functions and human disease. Int. J. Biochem. Cell Biol. 39, 44–84. https://doi.org/1016/j.biocel.2006.07.001
Camello-Almaraz C., Gomez-Pinilla P.J., Pozo M.J., Camello P.J. 2006. Mitochondrial reactive oxygen species and Ca2+ signaling. Am. J. Physiol. 291, 1082–1088. https://doi.org/10.1152/ajpcell.00217.2006
Garcia-Garcia, A., Zavala-Flores L., Rodriguez-Rocha H., Franco R. 2012. Thiol-redox signaling, dopaminergic cell death, and Parkinson’s Disease. Antioxidants Redox Signal. 17, 1764–1784. https://doi.org/10.1089/ars.2011.4501
Takata T., Araki S., Tsuchiya Y., Watanabe Y. 2020. Oxidative stress orchestrates MAPK and nitric-oxide synthase signal. Int. J. Mol. Sci. 21 (22), 8750. https://doi.org/10.3390/ijms21228750
Ayala A., Muñoz M.F., Argüelles S. 2014. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal. Oxid. Med. Cell Longev. 2014, 360438. https://doi.org/10.1155/2014/360438
Debouzy J.-C., Fauvelle F., Vezin H., Brasme B., Chancerelle Y. 1992. Interaction of the malonyldialdehyde molecule with membranes: A differential scanning calorimetry, 1H-, 31P-NMR and ESR study. Biochem. Pharmacol. 44 (9), 1787–1793. https://doi.org/10.1016/0006-2952(92)90073-r
Ranhotra H.S., Flannigan K.L., Brave M., Mukherjee S., Lukin D.J., Hirota S.A., Mani S. 2016. Xenobiotic receptor-mediated regulation of intestinal barrier function and innate immunity. Nucl. Receptor Res. 3, 101199. https://doi.org/10.11131/2016/101199
Kakehashi A., Hagiwara A., Imai N., Nagano K., Nishimaki F., Banton M., Wei M., Fukushima S., Wanibuchi H. 2013. Mode of action of ethyl tertiary-butyl ether hepatotumorigenicity in the rat: Evidence for a role of oxidative stress via activation of CAR, PXR and PPAR signaling pathways. Toxicol. Appl. Pharmacol. 273, 390–400. https://doi.org/10.1016/j.taap.2013.09.016
Aleksunes L.M., Klaassen C.D. 2012. Coordinated regulation of hepatic phase I and II drug-metabolizing genes and transporters using AhR-, CAR-, PXR-, PPAR-, and Nrf2-null mice. Drug Metab. Dispos. 740 (7), 1366–1379. https://doi.org/10.1124/dmd.112.045112
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


