Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 3, стр. 235-239
Особенности структуры и электрофизиологических свойств нового порина из морской бактерии Marinomonas primoryensis
Д. К. Чистюлин a, *, Е. А. Зелепуга a, В. А. Хоменко a, О. Ю. Портнягина a, О. Д. Новикова a
a Тихоокеанский институт биоорганической химии ДВО РАН им. Г.Б. Елякова
690022 Владивосток, Россия
* E-mail: cdk27@mail.ru
Поступила в редакцию 18.11.2021
После доработки 13.12.2021
Принята к публикации 14.12.2021
- EDN: LCBSRR
- DOI: 10.31857/S0233475522030045
Аннотация
С помощью метода реконструкции белка в плоские бислойные липидные мембраны охарактеризованы электрофизиологические свойства канала нового порина из морской бактерии Marinomonas primoryensis (MpOmp). Определены основные характеристики: величина проводимости одиночного канала MpOmp, его селективность и значения критического потенциала закрытия в различных средах (нейтральной, слабокислой, щелочной). С помощью in silico подхода предсказаны геометрические характеристики поры MpOmp и распределение зарядов в устье и внутри поринового канала.
ВВЕДЕНИЕ
Молекулярные механизмы адаптации живых организмов, которые обеспечивают их существование в экстремальных условиях, очень плохо изучены. Многие процессы в океанических экосистемах напрямую связаны с морскими бактериями: регуляция скорости минерализации органических источников, круговорот питательных веществ и перенос энергии [1]. В свою очередь, различные факторы окружающей среды, такие как осмолярность, температура и дефицит фосфата, могут существенно влиять на изменения в геноме морских бактерий, в том числе на экспрессию порообразующих белков наружной мембраны бактерий, осуществляющих в клетке транспортную функцию [2, 3].
В отличие от неспецифических поринов наземных бактерий [4] транспортные белки морских микроорганизмов изучены недостаточно. Остаются невыясненными многие аспекты функционирования морских поринов, в частности механизм потенциал-зависимого стробирования канала и/или его закрытия при увеличении кислотности среды, что характерно для поринов наземных бактерий. В отсутствии теоретических моделей морских поринов не известны особенности распределения зарядов внутри поры этих белков, напрямую связанные с проводимостью бактериальной мембраны.
Исследование свойств порообразующих белков является важным не только для расширения фундаментальных знаний в области биофизики белка, но и может представлять интерес для биоинженерии, поскольку открывают возможность создания новых сенсорных систем на основе искусственных пор с уникальными свойствами.
В данной работе с помощью методов, основанных на использовании бислойных липидных мембран (БЛМ) определены электрофизиологические характеристики канала, образованного порином из психрофильной морской бактерии Marinomonas primoryensis KMM 3633T (MpOmp). Белок получен из бактерии, выделенной из природного резервуара в Тихом океане [5].
Как показали наши исследования [6], в соответствии с анализом консервативных доменов MpOmp был классифицирован как Porin_4. Он является единственным порином в геноме бактерии M. primoryensis KMM 3633T, подобным неспецифическим поринам наземных грамотрицательных бактерий. Однако аминокислотный состав MpOmp отличается более высоким содержанием кислых аминокислот и отсутствием остатков триптофана. Нативный MpOmp существует в виде тримера с молекулярной массой около 94 кДа, что близко по значению к таковой других поринов морских протеобактерий. Обнаружено, что олигомерная структура MpOmp, в отличие от поринов наземных бактерий, чрезвычайно нестабильна к действию температуры. Диссоциация тримеров белка наблюдается уже при 30°C [6]. Эти особенности структуры и физико-химических свойств делают MpOmp интересным объектом для электрофизиологических исследований.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение и очистка порина. Для получения олигомерной формы MpOmp были использованы микробные клетки M. primoryensis KMM 3633T, выращенные при температуре 6–8°C. Процедура выделения клеточных оболочек и получения целевого белка в виде нерастворимого в саркозиле осадка в деталях описана в работе [6].
Электрофизиологические эксперименты. Ячейку заполняли буферным раствором, содержащим 10 мМ Трис, 10 мМ MES, 10 мM бета-аланина и 1 или 0.1 M KCl, оттитрованным разбавленной HCl до рН 8.5, 7.0 и 5.5. БЛМ формировали по методу Мюллера–Рудина [7] из раствора дифитаноилфосфатидилхолина (DPhPC) в н-гептане (5 мг/мл) в тефлоновых ячейках, разделенных перегородкой с отверстием диаметром 0.25 мм. Для детекции ионного тока использовали пару электродов Ag/AgCl в режиме фиксации напряжения. Электрод на цис-стороне от мембраны был заземлен, на транс-стороне – подключен к усилителю BBA-02 (Eastern Scientific LLC, США) со встроенным LP 5 kHz фильтром сигнала. Белок добавляли в концентрации 20 нг/мл для одиночных каналов и 200 нг/мл для суммарного тока с цис-стороны ячейки. Измерения проводили при комнатной температуре.
Для определения потенциала нулевого тока ячейку с транс-стороны (с заземленным электродом) заполняли буферным раствором с 1 М КСI, а с цис-стороны (электрод с положительным потенциалом) буферным раствором, содержащим 0.1 М или 1M KCl. Электроды подключали через агаровые мостики с 3 М KCl. В ячейку с цис-стороны вносили образец порина, ожидали встраивания одиночного канала и затем, регулируя величину потенциала, добивались прекращения тока через мембрану. Эксперимент проводили при pH 7.0.
Для всех приведенных экспериментальных данных были рассчитаны 95% доверительные интервалы и указано n – количество каналов, использованное для подсчета значений проводимости и селективности каналов, либо общее число экспериментов при определения потенциала закрытия.
Моделирование пространственной структуры. 3D-модель MpOmp построена методом гомологичного моделирования с помощью программы МОЕ2019.01 CCG (МОЕ2019.01 (Chemical Computing Group ULC, Canada)) на основании кристаллических структур поринов OmpF (из Salmonella enterica subsp, PDB 4KR8, и из Enterobacter cloacae (OmpE35) PDB 6ENE), OmpC (из Enterobacter cloacae (OmpE36 porin), PDB 5fvn) и осмопорина OMPK36 (из Klebsiella pneumoniae PDB 1OSM), перекрывающих различные участки последовательности MpOmp и различающихся конформационным состоянием петель. Peмоделирование конформации наиболее вариабельных петель L3, L4 и L8, а также последующая минимизация энергии модели тримера MpOmp и симуляция молекулярной динамики в силовом поле Amber 14:EHT продолжительностью 50 нс для оптимизации полученной структуры выполнены в программе МОЕ2019.01 CCG. Анализ карты Рамачандрана показал, что 98.67% остатков находятся в благоприятном и допустимом состояниях, что свидетельствует о качестве полученной модели.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Электрическая проводимость канала MpOmp. Запись флуктуаций тока при введении MpOmp (200 нг/мл) в буферный раствор свидетельствовала о ступенчатом увеличении проводимости мембраны. Такие дискретные флуктуации тока характерны для каналообразующих белков, однако исследуемый белок проявлял существенно меньшую (на два порядка) активность по сравнению с поринами наружной мембраны наземных грамотрицательных бактерий [8]. Обнаружено, что по сравнению с каналами поринов наземных бактерий (E. coli и Yersinia ruckeri) [9], каналы MpOmp отличались нестабильностью, повышенным уровнем шумов в записях тока, относительно коротким временем “жизни” и спонтанным переходом из открытого состояния в закрытое (рис. 1а). Зависимость тока от напряжения на мембране в присутствии исследуемого порина линейна в диапазоне 30–180 мВ (данные не приведены).
Рис. 1.
Электрофизиологические характеристики и структурные особенности канала порина из M. primoryensis. а–в – Записи тока через мембрану из DPhPC при добавлении MpOmp, инкубированного в разных условиях: а – pH 7.0, б – pH 5.5, в – pH 8.5. Концентрация белка 200 нг/мл. Мембранный потенциал 35 мВ. г – Определение критического потенциала закрытия MpOmp: ток через мембрану в пА, потенциал на мембране в мВ. д – Распределение значений проводимости канала MpOmp при различных значениях рН. Экспериментальные данные для каждого значения рН были получены минимум на 10 мембранах; количество исследованных каналов: pH 7.0 – 101 канал, pH 8.5 – 45 каналов, pH 5.5 – 32 канала. е – Ленточная диаграмма структуры мономеров MpOmp, YrOmpF, EcOmpF и распределение заряженных АК остатков, представленных в виде поверхностей, окрашенных согласно заряду: основные – синим, кислые – красным. ж – Геометрические характеристики поры MpOmp, YrOmpF, EcOmpF и распределение зарядов в интерьере поры.
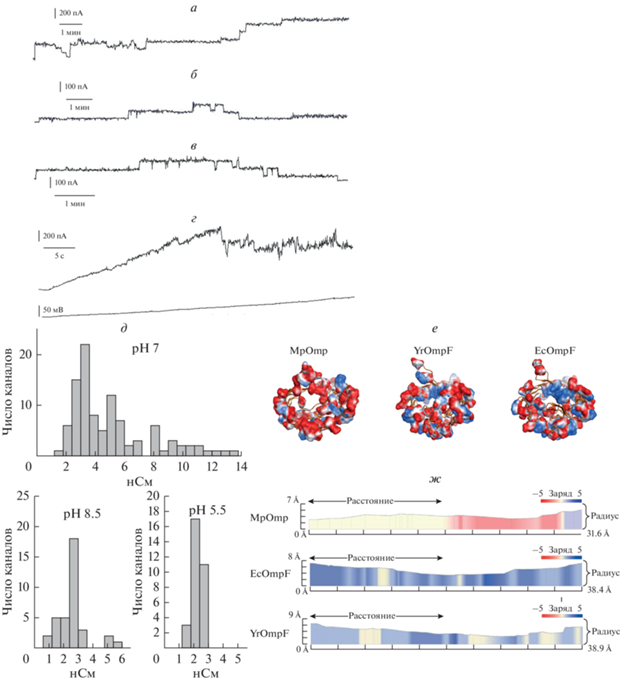
Для определения величины проводимости одиночного канала MpOmp были собраны более 100 показаний при потенциалах от 30 до 50 мВ. Полученное распределение величин проводимости имело три заметных максимума, для каждого из которых было рассчитано среднее значение проводимости (рис. 1д, рН 7.0). Эти данные позволяют предположить, что наиболее вероятный уровень проводимости одиночного канала порина M. primoryensis при pH 7.0 в 1 М KCl составляет 3.0 ± 0.2 нСм (n = 101), а кратные ему значения соответствуют олигомерным агрегатам порина.
Критический потенциал закрытия канала MpOmp. Для определения критического потенциала закрытия канала MpOmp при мембранном потенциале 50 мВ добивались встраивания некоторого количества каналов (более 10), затем потенциал уменьшали до нуля и проводили его постепенное повышение (со скоростью 1.8 мВ/с) от 0 до 150 мВ. Точку экстремума функции тока (в которой увеличение потенциала приводит к снижению тока) считали критическим потенциалом закрытия (рис. 1г). В нейтральной среде (рН 7.0) для канала MpOmp оно составило 43.8 ± 4.8 мВ (n = 4).
Влияние рН среды на электрофизиологические характеристики канала MpOmp. Изменение кислотности среды может значительно изменять свойства поринового канала. Это происходит за счет электростатического поля, сформированного заряженными аминокислотами в вестибюле и внутри поры. Как известно, стенка β-цилиндра поринов сформирована преимущественно положительно заряженными аминокислотными (АК) остатками, а петля L3, погруженная в полость поры, напротив, содержит большое количество кислых остатков. На размер и селективность по отношению к зарядам проникающих ионов и гидрофильных соединений влияет также пространственная конфигурация заряженных АК остатков внутри канала [10].
При добавлении к мембране белка MpOmp, инкубированного в буферном растворе при pH 5.5 (рис. 1б) и 8.5 (рис. 1в), наблюдалось ступенчатое увеличение проводимости, аналогичное эффекту, описанному для нейтральной среды.
Для оценки влияния кислотности среды на функциональную активность MpOmp были определены величины проводимости канала MpOmp и значение критического потенциала закрытия в этих условиях. Установлено, что увеличение pH среды практически не влияет на среднюю проводимость поринового канала и составляет 2.6 ± 0.3 нСм (n = 45). Напротив, в кислой области наблюдается ее достоверное уменьшение до 2.3 ± 0.1 нСм (n = 32) (рис. 1д).
Оказалось, что значение критического потенциала закрытия канала также изменяется только в кислой среде. При рН 8.5 оно имеет величину 41 ± 6 мВ (n = 4) (сравнимую с таковой в нейтральной среде), а в кислой среде наблюдается существенное увеличение этого значения до 81 ± ± 6 мВ (n = 4).
Селективность канала MpOmp. Экспериментальный потенциал нулевого тока сначала измеряли в симметричных условиях, а затем в условиях ионного градиента. Разность этих величин является объективной характеристикой ионной проницаемости в терминах модели Гольдмана–Ходжкина–Катца (ГКХ). Потенциал в симметричных условиях (1 M KCl/1 M KCl) оказался равен 0 мВ (n = 6), а потенциал в условиях градиента (1 M KCl/0.1 M KCl) равен 12.5 ± 2.7 мВ (n = 6). С помощью уравнения ГХК, которое связывает величину потенциала с проницаемостью мембраны и концентрацией ионов (использован калькулятор сервера https://www.physiologyweb.com/calculators/ghk_equation_calculator.html), была рассчитана величина селективности канала MpOmp (PK/PCl), она составила 1.8. Таким образом, канал MpOmp обладает слабой катионной селективностью в отношении ионов K+ по сравнению с таковой поринов наземных бактерий, которые являются катион-селективными, поскольку их проницаемость для ионов калия в 3–40 раз превышает проницаемость для ионов хлора [8]. Например, PK/PCl каналов E. сoli, Salmonella typhi-murium и Pseudomonas aeruginosa равны 3.9, 14.0 и 2.7 соответственно [8].
Структурные особенности канала MpOmp, исходя из теоретической модели порина. Анализ распределения зарядов, выполненный методом MOLE [11], выявил существенные различия между MpOmp и поринами наземных бактерий по количеству и локализации основных и кислых АК остатков в области устья и внутри канала (рис. 1е, 1ж). Несмотря на меньшее количество заряженных остатков в последовательности исследуемого порина по сравнению с поринами Е. coli (EcOmpF) и Y. ruckeri (YrOmpF) (67 против 71 и 76 соответственно), MpOmp характеризуется аномально высоким относительным содержанием кислых остатков. Количество АК остатков, несущих положительный заряд, в молекуле MpOmp составляет 19, что значительно меньше, чем у EcOmpF и YrOmpF, имеющих в своей последовательности соответственно 30 и 32 основных остатка. Более того, анализ распределения электростатического потенциала по молекулярной поверхности 3D-модели MpOmp [12] показывает, что область поры кардинально отличается по распределению зарядов от такового у вышеупомянутых поринов (рис. 1ж). Эти области сформированы преимущественно кислыми остатками за исключением Lys21, Lys59, Arg176, Arg221, которые участвуют в стабилизации конформации петель L2, L3 и во взаимодействии между отдельными тяжами β-листа. Исключительно важными для формирования конформации петли L3 и соответственно определяющими электрофизиологические особенности канала MpOmp являются Arg176 и Arg221. Оценка энергетического вклада водородных связей и ионных взаимодействий этих остатков в стабилизацию конформации L3 с помощью соответствующего приложения программы МОЕ CCG [13] позволяет предполагать, что Arg176 “задает” направление петле L3 внутрь поры (вклад ‒5.57 ккал/моль). А множественные взаимодействия между вариабельными остатками последовательности MpOmp Arg221 β-кора и Asp100 петли L3 прочно связывают верхушку петли с внутренней поверхностью β-цилиндра. Их суммарный вклад в потенциальную энергию системы составил: –21.87 ккал/моль.
Выявленные особенности внутренней организации поры MpOmp могут определять необычный характер функционирования пориновых каналов морских бактерий, поскольку известно, что чувствительность каналов к напряжению на мембране в значительной степени определяется как силой электростатического взаимодействия внутри поры [14], так и конформационной подвижностью петли L3 [15].
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена при финансовой поддержке гранта РФФИ, проект № 19-04-00318.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Radjasa O.K. 2004. Deep-sea bacteria and their biotechnological potentials. J. Coast. Develop. 7 (3), 109–118.
Vezzi A., Campanaro S., D’Angelo M., Simonato F., Vitulo N., Lauro F. M., Cestaro A., Malacrida G., Simionati B., Cannata N., Romualdi C., Bartlett D.H., Valle G. 2005. Life at depth: Photobacterium profundum genome sequence and expression analysis. Science. 307 (5714), 1459–1461.
Wang F., Wang J., Jian H., Zhang B., Li S., Wang F., Zeng X., Gao L., Bartlett D.H., Yu J., Hu S., Xiao X. 2008. Environmental adaptation: Genomic analysis of the piezotolerant and psychrotolerant deep-sea iron reducing bacterium Shewanella piezotolerans WP3. PLoS One. 3 (4), e1937. https://doi.org/10.1371/journal.pone.0001937
Nikaido H. 2003. Molecular basis of bacterial outer membrane permeability revisited. Microbiol. Mol. Biol. Rev. 676, 593–656.
Romanenko L.A., Uchino M., Mikhailov V.V., Zhukova N.V., Uchimura T. 2003. Marinomonas primoryensis sp. nov., a novel psychrophile isolated from coastal sea-ice in the Sea of Japan. Int. J. Syst. Evol. Microbiol. 53, 829–832.
Novikova O.D., Khomenko V.A., Kim N.Y., Likhats-kaya G.N., Romanenko L.A., Aksenova E.I., Kunda M.S., Ryzhova N.N., Portnyagina O.Y., Solov’eva T.F., Voronina O.L. 2020. Porin from marine bacterium Marinomonas primoryensis KMM 3633T: Isolation, physico-chemical properties, and functional activity. Molecules, 25 (14), 3131.
Mueller P., Rudin D.O., Ti Tien H., Wescott W.O. 1962. Reconstitution of cell membrane structure in vitro and its transformation into an excitable system. Nature. 194, 979–980.
Benz R., Schmid A., Hancock R.W. 1985. Ion selectivity of gram-negative bacterial porins. J. Bacteriol. 162, 722–727.
Чистюлин Д. К., Новикова О.Д., Зелепуга Е.А., Хоменко В.А., Лихацкая Г.Н., Портнягина О.Ю., Антоненко Ю.Н. 2019. Аномально высокий потенциал закрытия канала порина OmpF из Yersinia ruckeri: роль заряженных остатков и внутримолекулярных связей. Acta Naturae. 11 (3), 89–98.
Cowan S.W., Schirmer T., Rummel G., Steiert M., Ghosh R., Pauptit R.A., Jansonius J.N., Rosenbusch J.P. 1992. Crystal structure explain functional properties of two Escherichia coli porins. Nature. 358 (6389), 727–733.
Pravda L., Sehnal D., Toušek D., Navrátilová V., Bazgier V., Berka K., Svobodová Vařeková R., Koča J., Otyepka M. 2018. MOLEonline: A web-based tool for analyzing channels, tunnels and pores (2018 update). Nucl. Acids Res. 46 (W1), W368–W373.
Novikova O.D., Uversky V.N, Zelepuga E.A. 2021. Non-specific porins of Gram-negative bacteria as proteins containing intrinsically disordered regions with amyloidogenic potential. Prog. Mol. Biol. Transl. Sci. 183, 75–99.
Clark A.M., Labute P. 2007. 2D depiction of protein–ligand complexes. J. Chem. Inf. Model. 47, 1933–1944.
Song W., Bajaj H., Nasrallah C., Jiang H., Winterhalter M., Colletier J.P., Xu Y. 2015. Understanding voltage gating of Providencia stuartii porins at atomic level. PLoS Comput Biol. 11(5), e1004255. https://doi.org/10.1371/journal.pcbi.1004255
Karshikoff A., Spassov V., Cowan S.W., Ladenstein R., Schirmer T. 1994. Electrostatic properties of two porin channels from Escherichia coli. J. Mol. Biol. 240 (4), 372–384.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


