Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 3, стр. 224-234
Использование хинолизидиновых производных кумарина при изучении механизмов действия комплекса цитохрома c с кардиолипином
Л. А. Ромодин a, c, *, Н. П. Лысенко a, Т. Н. Пашовкин a, b
a Московская государственная академия ветеринарной медицины и биотехнологии –
МВА имени К.И. Скрябина
109472 Москва, Россия
b Институт биофизики клетки РАН, ФИЦ ПНЦБИ РАН
142290 Пущино, Московская обл., Россия
c Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр
имени А.И. Бурназяна Федерального медико-биологического агентства России
Москва, Россия
* E-mail: rla2904@mail.ru
Поступила в редакцию 13.04.2021
После доработки 01.07.2021
Принята к публикации 02.07.2021
- EDN: BYJCIR
- DOI: 10.31857/S0233475522020062
Аннотация
Комплекс цитохрома c с кардиолипином играет ключевую роль при запуске апоптоза по митохондриальному пути за счет липопероксидазной и квазилипоксигеназной активностей цитохрома c. В результате образования этого комплекса изменяется конформация цитохрома c, который приобретает свойства ферментов-пероксидаз, способных запустить реакции перекисного окисления липидов. Функции комплекса цитохрома c с кардиолипином принято изучать с помощью метода регистрации усиленной (активированной) хемилюминесценции. Усилитель, или активатор, хемилюминесценции увеличивает интенсивность свечения за счет миграции энергии электронного возбуждения с возбужденных продуктов липидной пероксидации на молекулы активатора с последующим ее высвечиванием с бо́льшим квантовым выходом. При проведении исследований целесообразно использовать активаторы, усиливающие свечение без химической реакции с компонентами исследуемой системы и сохраняющие свою концентрацию неизменной в течение времени реакции. В конце прошлого века на системе Fe2+-индуцированной липидной пероксидации показали, что таковыми являются хинолизидиновые производные кумарина. При этом представления о неизменности их концентрации без дополнительных исследований переносились и на системы, в которых перекисное окисление липидов запускается ферментом-пероксидазой. Однако в настоящей работе методом спектрофотометрии на примере реакции, катализируемой комплексом цитохрома c с кардиолипином, было установлено, что хинолизидиновые производные кумарина: кумарин-314 (хинолизидин[5,6,7-gh]3-этоксикарбонилкумарин) и кумарин-334 (хинолизидин[5,6,7-gh]3-ацетилкумарин), являются непосредственными участниками ферментативной липопероксидазной реакции. На основании сравнения изменения концентрации производных кумарина в присутствии и отсутствие фосфатидной кислоты нами установлено, что производные кумарина преимущественно являются субстратами второй реакции пероксидазного каталитического цикла: восстановления ферриформы пероксидазы с двумя окисленными эквивалентами (компаунда 1) до ферриформы пероксидазы с одним окисленным эквивалентом (компаунда 2). Также мы показали, что при катализе квазилипоксигеназной реакции (в случае отсутствия H2O2 в системе) пероксидаза проходит через каталитический цикл по механизму одноэлектронного окисления с последующим восстановлением, при этом отсутствует стадия ферриформы пероксидазы с двумя окисленными эквивалентами (компаунда 1). Были определены константы скорости реакции первого порядка разрушения производных кумарина в ходе ферментативной липопероксидазной реакции, и на их основе выведены функции для вычисления поправочных коэффициентов, учитывающих разрушение кумариновых производных, для корректировки хемилюминограмм, полученных при изучении комплекса цитохрома c с кардиолипином.
ВВЕДЕНИЕ
Апоптоз – запрограммированная клеточная гибель, характерная для многоклеточных организмов [1]. Программа апоптоза запускается в клетке двумя путями: внутренним (с участием митохондрий) и внешним (с участием рецепторов клеточной гибели). Митохондриальный механизм развития апоптоза приводит к нарушению целостности митохондриальных мембран и выходу в цитозоль цитохрома c (CytC) [2], который выполняет роль переносчика электронов между III и IV комплексами дыхательной цепи митохондрий [3]. При попадании в цитоплазму CytC связывается с белком Apaf-1 (Apoptotic protease activating factor-1), что приводит к развитию каскада каспазных реакций через инициаторную каспазу-9 и эффекторные каспазы-3 и -7 и в конечном итоге – к гибели клетки [6]. Помимо CytC из митохондрий выходят другие проапоптотические факторы, способствующие развитию каспаза-независимого пути развития апоптоза, такие как флавопротеин AIF (Apoptosis-inducing factor) [7] и эндонуклеаза G (EndoG) [8], вызывающие фрагментацию ядерной ДНК [9].
Следует отметить, что на начальной стадии процесса апоптоза происходит образование комплекса CytC с кардиолипином, обладающего липопероксидазной активностью, которая появляется в результате разрыва связи между гемовым железом и аминокислотным остатком Met80 при изменении конформации белка во время связывания с молекулами кардиолипина [10–12]. CytC следует называть факультативной пероксидазой, так как свойства фермента-пероксидазы он проявляет только в определенных условиях, например, в составе комплекса с кардиолипином. Комплекс способен катализировать ряд реакций, называемых пероксидазным циклом. При этом сам механизм катализируемых в этом состоянии реакций характерен для классических пероксидаз [13]. Подробно альтернативные варианты этого механизма описаны в работах [14, 15], а основные реакции пероксидазного цикла, представлены на рис. 1а.
Рис. 1.
Схемы основных реакций каталитического пероксидазного цикла и квазилипоксигеназной реакции. а – Основные реакции пероксидазного цикла с квазилипоксигеназной реакцией, предположительно протекающей посредством двухэлектронного окисления пероксидазы [14]. б – Квазилипоксигеназная реакция по механизму одноэлектронного окисления пероксидазы. X – атом галогена, R – апофермент, L – липид, Por – порфириновая группировка гема.
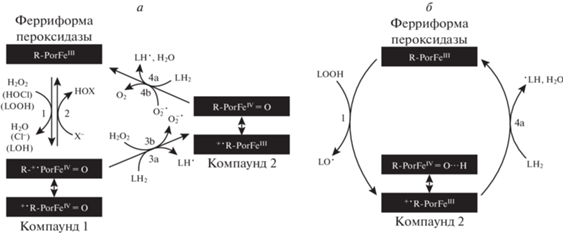
Окисленные состояния фермента-пероксидазы, в том числе и CytC в составе комплекса с кардиолипином, называются компаундом 1 (содержит два окисленных эквивалента) и компаундом 2 (содержит один окисленный эквивалент). Восстановление окисленных форм CytC за счет последовательных реакций одноэлектронного окисления молекул липидов приводит к образованию липидных радикалов и последующему запуску каскада реакций перекисного окисления липидов, что приводит к разрыву митохондриальной фосфолипидной мембраны [10–13].
Первой реакцией каталитического пероксидазного цикла может быть не только реакция разложения пероксида водорода, но и реакция разложения липидного гидропероксида (рис. 1а, реакция 1). Этот процесс носит название квазилипоксигеназной реакции. Однако возможен и альтернативный механизм течения квазилипоксигеназной реакции, в результате которой происходит одноэлектронное восстановление субстрата – липидного гидропероксида (рис. 1б). Следует отметить, что во время настоящей липоксигеназной реакции происходит образование пероксидов полиненасыщенных жирных кислот, катализируемое ферментами-липоксигеназами, содержащими железо, но не имеющими порфиринового кольца [16].
Помимо запуска перекисного окисления липидов митохондриальных мембран, осуществляемого CytC, имеет место и неферментативный процесс, запускаемый свободными ионами железа через реакцию Фентона с последующей атакой гидроксильных радикалов на молекулы липидов [17]. Это является одним из сценариев развития некрозоподобной гибели клетки, называемой ферроптозом, и впервые описанной в 2012 году в работе [18]. По данным авторов [19], именно по механизму ферроптоза происходит гибель стволовых клеток костного мозга при действии на них ионизирующей радиации.
Процесс перекисного окисления липидов изучают методом регистрации хемилюминесценции [20]. Метод заключается в регистрации сверхслабого свечения, образующегося при реакции диспропорционирования липопероксильных радикалов [21, 22] по механизмам, представленным на рис. 2.
Рис. 2.
Собственная (а, б) и активированная (в) хемилюминесценция. а – Реакция диспропорционирования пероксильных радикалов [21, 22]. б – Образование и распад диоксетановой структуры на примере диоксетанона [23]. в – Механизм активированной хемилюминесценции [22]. * – электронное возбужденное состояние.
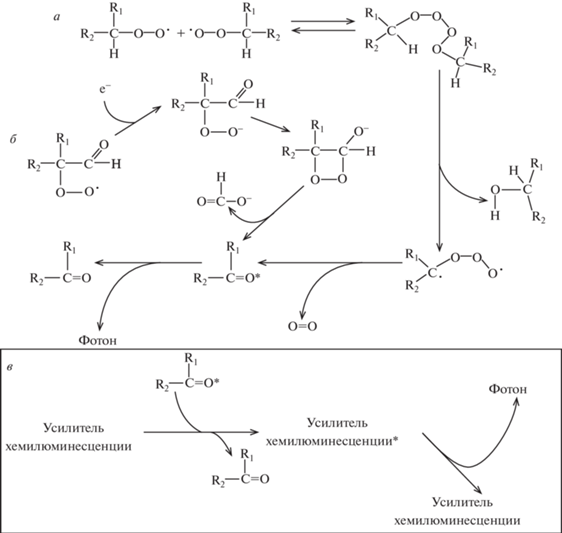
Внесение в систему вещества, называемого усилителем, или активатором, хемилюминесценции, перехватывающего электронные возбужденные состояния у продуктов реакции и испускающего фотоны с более высоким квантовым выходом, облегчает изучение процесса перекисного окисления липидов, в особенности, если электронное возбуждение на молекулу активатора хемилюминесценции переносится без химического взаимодействия с компонентом системы, а также, если этот активатор усиливает только хемилюминесценцию, которая возникает при реакциях с участием именно радикалов липидов.
В 1990-х годах на модельной системе, в которой происходило перекисное окисление липидов, катализируемое свободными ионами Fe2+, в качестве усилителей хемилюминесценции использовались хинолизидиновые производные кумарина, которые не расходовались в ходе реакции [24, 25]. Вывод о химической инертности по отношению к компонентам системы переносился без дополнительной проверки на системы, где пероксидация липидов запускалась ферментативно [20].
Поэтому мы исследовали свойства хинолизидиновых производных кумарина в системе, в которой происходит пероксидазная реакция, катализируемая комплексом цитохрома c с кардиолипином. В этой работе изучались хинолизидин[5,6,7-gh]3-этоксикарбонилкумарин, называемый кумарин-314 (C-314), и хинолизидин[5,6,7-gh]3-ацетилкумарин, называемый кумарин-334 (C-334), в системе, в которой катализ квазилипоксигеназной и липопероксидазной реакций осуществлялся комплексом цитохрома c с тетраолеоилкардиолипином (CytC–TOCL). Ранее авторы [26] отмечали, что другое производное кумарина – хинолизидин[5,6,7-gh]3,2'-бензимидазолилкумарин (известный как кумарин-525) – является нестабильным при ферментативной липидной пероксидации.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящей работе использовались следующие реактивы: КH2PO4 (Реахим, Россия), 20 мM (рН 7.4); пероксид водорода, 8.6 М водный раствор (Sigma-Aldrich, США); C-314, 500 мкM метанольный раствор (Sigma-Aldrich); C-334, 500 мкM метанольный раствор (Sigma-Aldrich); CytC, 1 мM раствор в фосфатном буфере (Sigma-Aldrich); 1,1',2,2'-тетраолеоилкардиолипин (TOCL), 6 мM метанольный раствор (Avanti Polar Lipids, США); дилинолеоилфосфатидная кислота (PA), 12 мM метанольный раствор (Avanti Polar Lipids).
Регистрация серии спектров поглощения смеси. Спектры поглощения регистрировались с использованием аппаратно-программного комплекса на основе спектрофотометра СФ-10 (ЛОМО, Россия). В кювету спектрофотометра были добавлены растворы: CytC, TOCL, C-314 или С-334, PA. Для изучения пероксидазной реакции в последнюю очередь вносили раствор пероксида водорода. Общий объем пробы составлял 3 мл, до нужного объема раствор доводился добавлением 20 мM фосфатного буфера. Параметры регистрации спектров поглощения: диапазон измерения 300–600 нм, скорость измерения 5 нм/с, шаг сканирования (∆λ) 0.5 нм, ширина щели 5 нм.
Концентрации веществ в начале квазилипоксигеназной реакции составляли: 11.1 мкМ CytC, 333.3 мкМ TOCL, 666.7 мкМ PA, 50 мкМ C-314 или 30 мкМ С-334. В начале липопероксидазной реакции: 10 мкМ CytC, 300 мкМ TOCL, 45 мкМ C-314 или 25 мкМ С-334, начальная концентрация пероксида водорода в экспериментах с C-314 составляла 380 мкМ, с С-334 – 215 мкМ, концентрация PA в начале липопероксидазной реакции составляла ≈550 мкМ.
Объемы растворов и данные концентрации PA и пероксида водорода были подобраны нами по результатам подготовительных экспериментов, а концентрации CytC и TOCL взяты с расчетом на оптимальное их соотношение, равное 1 : 30, показанное в работе [13].
Алгоритм спектрофотометрических измерений и выведение концентраций производного кумарина и цитохрома c соответствует запатентованной методике [27], которая заключается в регистрации серии спектров в диапазоне длин волн 300–600 нм со следующими временными промежутками между измерениями: с первого по шестое измерения – 10 с, с 6-го по 29-е – 60 с и с 29 по 55-е – 120 с. При этом в эксперименте по изучению участия C-334 в липопероксидазной реакции интервал между первым и вторым измерениями был увеличен, что видно из данных на рис. 3г. Впоследствии на основании полученных спектров были вычислены концентрации веществ в соответствующие моменты времени реакции.
Рис. 3.
Изменения концентраций производных кумарина (1) и интенсивности хемилюминесценции (J) в системе CytC–TOCL (2). а – С-314 в присутствии PA, б – в присутствии PA и H2O2, в – С-334 в присутствии PA, г – С-334 в присутствии PA и H2O2.
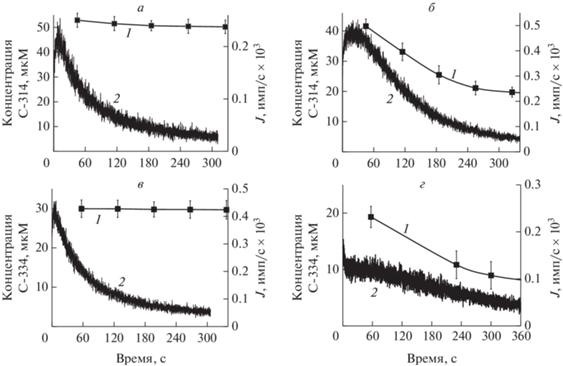
Вычисление концентраций проводилось для смеси, состоящей только из двух веществ: производного кумарина и CytC. Однако такое упрощение не вносит искажения в результат вычисления, так как на рассматриваемых длинах волн TOCL, PA и пероксид водорода имеют низкие значения оптической плотности, и практически весь вклад в общее поглощение смеси в диапазоне длин волн 405–465 нм вносят CytC и кумариновое производное.
Регистрация хемилюминесценции. Исследования по измерению хемилюминесценции проводились на хемилюминометре Lum-100 (DISoft, Россия), подключенном к компьютеру с программным обеспечением PowerGraph. Состав реакционной смеси был идентичен приведенному для спектрофотометрических измерений, но общий объем смеси в экспериментах по регистрации хемилюминесценции был равен 1 мл.
Статистика. Статистическая обработка результатов эксперимента производилась средствами MS Excel с использованием t-критерия Стьюдента. Статистически значимыми считаются различия при p = 0.95; n = 5, где n – количество повторений для каждой серии экспериментов. Данные представлены в виде: среднее арифметическое результатов ± предельная ошибка среднего.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе экспериментов было показано, что хинолизидиновые производные кумарина являются субстратами CytC, проявляющего пероксидазную активность в результате образования комплекса с кардиолипином. На рис. 3 приведены результаты измерения хемилюминесценции и графики изменения концентрации производных кумарина. Значения концентрации вычислены на основании величины оптической плотности реакционной смеси в соответствии с уравнением закона Бугера–Ламберта–Бера для смеси веществ при применении метода Фирордта – вычисления концентраций на основании значений оптической плотности смеси при двух длинах волн: 409 нм (εCytC = 90740 л/моль см, εC-314 = = 12 562 л/моль см, εC-334 = 9240 л/моль см) и в экспериментах с C-314: 447.5 нм (εCytC = = 13 890 л/моль см, εC-314 = 32 360 л/моль см), в экспериментах с C-334: 460 нм (εCytC = = 8620 л/моль см, εC-334 = 44012 л/моль см). Указанные коэффициенты молярного поглощения определены нами для среды 20 мМ фосфатного буфера на предварительном этапе исследования.
На рис. 3 показано, что концентрация хинолизидиновых производных кумарина не уменьшается в процессе квазилипоксигеназной реакции (рис. 3а, 3в). При этом происходит разрушение C-314 и C-334 в присутствии пероксида водорода, что может быть вызвано действием CytC–TOCL (рис. 3б, 3г), поскольку производные кумарина не разрушаются при действии H2O2 [28] и во время неферментативной реакции перекисного окисления липидов [24–26].
Спад вспышки люминесценции, наблюдаемой во время квазилипоксигеназной реакции, не сопровождается уменьшением концентрации кумариновых производных. Это говорит о том, что уменьшение интенсивности хемилюминесценции в данном случае обусловлено прекращением радикальной реакции в системе, а не расходованием усилителя хемилюминесценции. Можно предположить, что хемилюминесценция вызвана не разрушением активатора, а физическим процессом миграции электронного возбуждения с возбужденных кетонов – продуктов перекисного окисления липидов [21, 22] – на молекулы C-314 и C-334.
В случае липопероксидазной реакции (рис. 3б, 3г), руководствуясь только спадом вспышки хемилюминесценции, нельзя говорить о снижении интенсивности реакции перекисного окисления липидов, так как при этом происходит резкое снижение концентрации усилителя хемилюминесценции, что ведет за собой и спад люминесценции. Хотя при этом интенсивность липидной пероксидации в образце может оставаться по-прежнему на высоком уровне.
Для интерпретации данных о скорости запускаемой ферментом-пероксидазой реакции перекисного окисления липидов необходимо корректировать хемилюминограмму. Для этого была выведена корректирующая функция, учитывающая уменьшение концентрации кумариновых производных в ходе ферментативной липидной пероксидации. В первую очередь были определены константы скорости реакции разрушения этих веществ.
Несмотря на то, что непосредственного взаимодействия производных кумарина с H2O2 нет [28], рассматриваемую реакцию можно в упрощенном виде представить как окисление производного кумарина пероксидом водорода, которое катализирует CytC–TOCL:
Упрощенно рассматривая CytC как катализатор, пренебрегая его участием в данной реакции, константу скорости окисления производного кумарина можно вычислять как константу скорости реакции первого порядка, так как концентрация пероксида водорода в нашей системе более чем в 8 раз превосходит концентрацию производного кумарина.
Константы скорости реакции первого порядка для разрушения C-314 и C-334 под действием CytC–TOCL (соотношение белок : липид равно 1 : 30), катализирующего реакцию окисления PA под действием H2O2, в начале реакции составляют 0.0027 ± 0.0006 с−1 и 0.0044 ± 0.0027 с−1 соответственно. Однако в силу того, что моделирование кинетики расходования производных кумарина как реакции первого порядка условно, с течением времени происходит расхождение между теоретическими и эмпирическими значениями концентрации производных кумарина в системе. Поэтому указанные выше значения констант скорости разрушения производных кумарина адекватны только для первых 300 с в случае с C-314 и 230 с в случае с C-334. Мы определили технические константы скорости разрушения производных кумарина в процессе катализируемой CytC–TOCL липопероксидазной реакции и для других временны́х отрезков. Для С-314 – это 0.00039 ± ± 0.00012 с−1 на временном промежутке от 300 до 570 с и 0.00014 ± 0.00002 с−1 на промежутке от 570 до 1200 с. Для C-334 – это 0.0013 ± 0.0002 с−1 на временнóм промежутке от 230 до 580 с и 0.0006 ± ± 0.0001 с−1 на промежутке от 580 до 930 с.
По причине снижения концентрации производных кумарина в системе, в которой происходит катализируемое комплексом CytC с кардиолипином перекисное окисление липидов, интенсивность хемилюминесценции падает. Вследствие этого может быть сделан ложный вывод о снижении интенсивности свободнорадикальных реакций. И в случае, к примеру, изучения влияния на этот процесс антиоксидантов, можно прийти к ошибочному представлению об их эффективности. Во избежание этого следует умножать значения интенсивности хемилюминесценции, зарегистрированные прибором, на специальные поправочные коэффициенты. Тогда интенсивность свечения приобретет такое значение, какое бы у нее было в случае химической инертности производного кумарина.
Данные поправочные коэффициенты равны отношению единицы и значения доли концентрации усилителя хемилюминесценции, остающейся в системе в конкретный момент времени. Функция для их вычисления таким образом получается равной обратной функции необратимой химической реакции первого порядка, где начальная концентрация принята за единицу:
где KCor – поправочный коэффициент, t – время от начала реакции, C0 – начальное значение концентрации производного кумарина, C – значение концентрации производного кумарина в момент времени t, k – константа скорости первого порядка разрушения кумаринового производного, e – основание натурального логарифма.Для получения откорректированного значения интенсивности хемилюминесценции (JCor) в момент времени t следует умножить зарегистрированные значения интенсивности хемилюминесценции (JEx) на поправочные коэффициенты для соответствующих моментов времени:
Однако в связи с тем, что различным временны́м диапазонам от начала реакции соответствуют различные значения эффективной константы скорости разрушения усилителя хемилюминесценции, в уравнение, описывающее общий вид поправочной функции, необходимо также ввести дополнительный коэффициент А. Он равен отношению единицы к значению доли концентрации усилителя хемилюминесценции, остающейся в системе в момент времени, равный первому значению временно́го диапазона, для которого актуальна эффективная техническая константа скорости реакции разрушения производного кумарина k. Поэтому в общем виде уравнение поправочной функции будет выглядеть следующим образом:
Корректирующие функции для обработки результатов измерения интенсивности хемилюминесценции в системе CytC–TOCL–H2O2–PA при соотношении CytC–TOCL 1 : 30 имеют следующий вид:
Для C-314:
Для C-334:
При этом вместо использования корректирующей функции также возможно использовать таблицу поправочных коэффициентов, соответствующих определенным моментам времени от начала реакции и вычисленных как отношение начальной концентрации производного кумарина к значению концентрации в соответствующее время от начала реакции. Однако в этом случае станет возможной лишь корректировка значений интенсивности хемилюминесценции в те конкретные моменты времени, для которых известно значение поправочного коэффициента.
Применение представленных выше корректирующих функций подразумевает линейную зависимость интенсивности хемилюминесценции от концентрации производных кумарина. Нелинейный характер этой зависимости может наблюдаться в случае, если взаимодействие производного кумарина с пероксидазой, в роли которой выступает связанный с кардиолипином CytC, сопровождается люминесценцией. Подобное свечение имеет место в случае люминола – наиболее часто используемого хемилюминесцентного зонда [29].
Однако в работе Г.К. Владимирова описывается, что окисление производного кумарина пероксидазой, в роли которой выступает CytC, люминесценцией не сопровождается [30]. Поэтому взаимодействие кумариновых красителей с CytC вызывает снижение интенсивности хемилюминесценции, которое адекватно корректируется поправочной функцией, предлагаемой нами.
При этом вся люминесценция обусловлена процессом липидной пероксидации. Во время взаимодействия производного кумарина с возбужденным продуктом перекисного окисления липидов происходит только миграция энергии электронного возбуждения на молекулу кумаринового красителя без химической деградации последней с последующем высвечиванием этой энергии в виде фотона. Усиление свечения достигается за счет того, что квантовый выход люминесценции при переходе молекулы кумаринового красителя из возбужденного состояния в основное намного выше, чем для аналогичного процесса у возбужденных продуктов липидной пероксидации – по механизму усиления свечения производные кумарина являются физическими усилителями (активаторами) хемилюминесценции [29]. Для данных веществ действует правило, описанное в работах А.И. Журавлёва [31, 32], согласно которому, в присутствии активатора хемилюминесценции свечение усиливается в такое число раз, которому соответствует величина, равная произведению концентрации усилителя хемилюминесценции на коэффициент усиления, зависящий от природы вещества. Формула действует лишь в случаях, если экспериментальная модельная система легко проницаема для света и фотоны активно не поглощаются ее компонентами или стенками кюветы.
Таким образом, производные кумарина являются средством, увеличивающим интенсивность хемилюминесценции, сопровождающей перекисное окисление липидов. Но в случае, если этот процесс запускается ферментом-пероксидазой, в том числе и CytC, связанным с кардиолипином, под его действием происходит снижение концентрации производных кумарина. Так как взаимодействие производных кумарина с CytC не сопровождается свечением [30], то для приведения хемилюминограммы в вид, какой бы она имела в случае полной химической инертности производных кумарина в системе, достаточно лишь умножить фактическое значение интенсивности свечения на поправку на снижение концентрации усилителя хемилюминесценции.
На рис. 4а сравнивается хемилюминесцентная кривая, зарегистрированная на хемилюминометре, с хемилюминесцентной кривой, полученной путем ее корректировки с учетом расходования усилителя хемилюминесценции. Кривая 2 – это интенсивность хемилюминесценции в случае, если бы концентрация активатора хемилюминесценции не уменьшалась в ходе реакции. Кривая 2 позволяет оценить реальную скорость липидной пероксидации реакции, протекающей в образце.
Рис. 4.
Интенсивность хемилюминесценции и схема пероксидазного каталитического цикла в присутствии производного кумарина. а – Интенсивность хемилюминесценции (J) в системе начального состава: 10 мкM CytC, 300 мкM TOCL, 550 мкM PA, 25 мкM C-314, 215 мкМ H2O2, измеренная хемилюминометром (1) и откорректированная с учетом поправки на уменьшение концентрации C-314 (2). б – Пероксидазный каталитический цикл в присутствии производного кумарина: хинолизидиновое производное кумарина подвергается окислению под действием компаунда 1, а при превращении компаунда 2 в феррицитохром c окислению подвергается молекула липида. L – липид, R – апофермент-пероксидаза, Por – порфириновая группировка гема в составе пероксидазы.
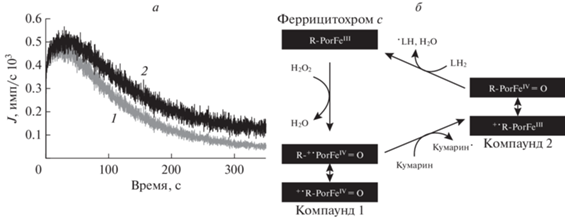
Указанные выше корректирующие функции необходимо применять в исследованиях, связанных с активностью комплекса цитохрома c кардиолипином, к примеру, при исследовании действия антиоксидантов на катализируемую им липидную пероксидацию. Так как в противном случае уменьшение интенсивности хемилюминесценции, происходящее по причине расходования ее усилителя, можно ошибочно расценить как результат действия антиоксиданта.
Для ответа на вопрос, на какой стадии пероксидазного каталитического цикла происходит реакция производного кумарина с пероксидазой, были проведены эксперименты совместно с коллегами из МГУ имени М.В. Ломоносова: Ю.А. Владимировым, Г.К. Владимировым и Е.И. Демиховым. На основании этих экспериментов была выдвинута гипотеза, согласно которой хинолизидиновые производные кумарина являются восстанавливающими субстратами формы феррицитохрома c с двумя и с одним окисленным эквивалентом (компаунда 1 и компаунда 2) [33]. Однако вывод был сделан при изучении пероксидазной реакции без внесения в систему легкоокисляемого липидного субстрата.
На графиках, представленных на рис. 3, видно, что в ходе квазилипоксигеназной реакции производное кумарина практически не расходуется, однако его концентрация существенно снижается в ходе липопероксидазной реакции. На основании этого было сделано два вывода. Первый вывод: производное кумарина взаимодействует только с феррицитохромом c с двумя окисленными эквивалентами (компаундом 1), а феррицитохром c с одним окисленным эквивалентом (компаунд 2) реагирует только с липидными молекулами. Второй вывод: квазилипоксигеназная реакция катализируется ферментом-пероксидазой посредством не двухэлектронного, а одноэлектронного окисления феррицитохрома c (образуется сразу компаунд 2, а стадия компаунда 1 минуется) с последующим восстановлением посредством радикального окисления липидной молекулы. Графически предполагаемый нами механизм катализа квазилипоксигеназной реакции представлен на рис. 1б. Основной механизм участия производного кумарина в пероксидазном цикле представлен на рис. 4б.
ЗАКЛЮЧЕНИЕ
Таким образом, установлено, что хинолизидиновые производные кумарина в системах, в которых протекает ферментативная липопероксидазная реакция, являются субстратами фермента-пероксидазы, в роли которого в нашей работе выступал комплекс цитохрома c с кардиолипином. Причем производное кумарина окисляется во время реакции превращения ферриформы пероксидазы с двумя окисленными эквивалентами в форму с одним окисленным эквивалентом – компаунда 1 в компаунд 2. Определены константы скорости псевдопервого порядка для реакций разрушения C-314 и C-334 под действием CytC–TOCL в присутствии H2O2, составившие для первых минут реакции 0.0027 ± 0.0006 с−1 и 0.0044 ± ± 0.0027 с−1 соответственно.
Используя поправку на разрушение производных кумарина, можно обрабатывать хемилюминограммы, придавая им такой вид, как если бы кумариновые производные не расходовались в процессе реакции. В настоящей работе нами были выведены эти поправочные функции, при использовании которых станет возможно адекватно интерпретировать данные о скорости радикальных реакций с участием липидов, в том числе и при воздействии на систему различными факторами, например, антиоксидантами.
Также была выдвинута гипотеза, согласно которой квазилипоксигеназную реакцию фермент-пероксидаза катализирует через механизм одноэлектронного окисления фермента (через превращение ферриформы пероксидазы в компаунд 2, отличающийся от нее одним окисленным эквивалентом).
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источники финансирования. Работа выполнена с использованием средств базового бюджетного финансирования и личных средств авторов.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Kerr J.F., Wyllie A.H., Currie A.R. 1972. Apoptosis: A basic biological phenomenon with wide-ranging implications in tissue kinetics. Br. J. Cancer. 26 (4), 239–257. https://doi.org/10.1038/bjc.1972.33
Skulachev V.P. 1996. Why are mitochondria involved in apoptosis? Permeability transition pores and apoptosis as selective mechanisms to eliminate superoxide-producing mitochondria and cell. FEBS Lett. 397 (1), 7–10.
Kalpage H.A., Bazylianska V., Recanati M.A., Fite A., Liu J., Wan J., Mantena N., Malek M.H., Podgorski I., Heath E.I., Vaishnav A., Edwards B.F., Grossman L.I., Sanderson T.H., Lee I., Huttemann M. 2019. Tissue-specific regulation of cytochrome c by post-translational modifications: Respiration, the mitochondrial membrane potential, ROS, and apoptosis. FASEB J. 33 (2), 1540–1553. https://doi.org/10.1096/fj.201801417R
Cain K., Bratton S.B., Langlais C., Walker G., Brown D.G., Sun X.M., Cohen G.M. 2000. Apaf-1 oligomerizes into biologically active approximately 700-kDa and inactive approximately 1.4-MDa apoptosome complexes. J. Biol. Chem. 275 (9), 6067–6070.
Shakeri R., Kheirollahi A., Davoodi J. 2017. Apaf-1: Regulation and function in cell death. Biochimie. 135, 111–125. https://doi.org/10.1016/j.biochi.2017.02.001
McComb S., Chan P.K., Guinot A., Hartmannsdottir H., Jenni S., Dobay M.P., Bourquin J.P., Bornhauser B.C. 2019. Efficient apoptosis requires feedback amplification of upstream apoptotic signals by effector caspase-3 or -7. Sci. Adv. 5 (7), eaau9433. https://doi.org/10.1126/sciadv.aau9433
Susin S.A., Daugas E., Ravagnan L., Samejima K., Zamzami N., Loeffler M., Costantini P., Ferri K.F., Irinopoulou T., Prevost M.C., Brothers G., Mak T.W., Penninger J., Earnshaw W.C., Kroemer G. 2000. Two distinct pathways leading to nuclear apoptosis. J. Exp. Med. 192 (4), 571–580.
Bemani P., Mohammadi M., Hakakian A. 2018. Anti-ROR1 scFv-EndoG as a novel anti-cancer therapeutic drug. Asian Pac. J. Cancer Prev. 19 (1), 97–102. https://doi.org/10.22034/APJCP.2018.19.1.97
Li S., Wang T., Zhai L., Ge K., Zhao J., Cong W., Guo Y. 2018. Picroside II exerts a neuroprotective effect by inhibiting mPTP permeability and EndoG release after cerebral ischemia/reperfusion injury in rats. J. Mol. Neurosci. 64 (1), 144–155. https://doi.org/10.1007/s12031-017-1012-z
Kagan V.E., Tyurin V.A., Jiang J., Tyurina Y.Y., Ritov V.B., Amoscato A.A., Osipov A.N., Belikova N.A., Kapralov A.A., Kini V.V., Vlasova I.I., Zhao Q., Zou M., Di P., Svistunenko D.A., Kurnikov I.V., Borisenko G.G. 2005. Cytochrome c acts as a cardiolipin oxygenase required for release of proapoptotic factors. Nature Chem. Biol. 1, 223–232.
Kobayashi H., Nagao S., Hirota S. 2016. Characterization of the cytochrome c membrane-binding site using cardiolipin-containing bicelles with NMR. Angew. Chem. Int. Ed. Engl. 55 (45), 14019–14022. https://doi.org/10.1002/anie.201607419
Li M., Mandal A., Tyurin V.A., DeLucia M., Ahn J., Kagan V.E., P.C.A. van der Wel. 2019. Surface-binding to cardiolipin nanodomains triggers cytochrome c pro-apoptotic peroxidase activity via localized dynamics. Structure. 27 (5), 806–815. https://doi.org/10.1016/j.str.2019.02.007
Владимиров Ю.А., Проскурнина Е.В., Алексеев А.В. 2013. Молекулярные механизмы апоптоза. Структура комплекса цитохрома c с кардиолипином. Биохимия. 78 (10), 1391–1404.
Furtmuller P.G., Jantschko W., Zederbauer M., Jakopitsch C., Arnhold J., Obinger C. 2004. Kinetics of interconversion of redox intermediates of lactoperoxidase, eosinophil peroxidase and myeloperoxidase. Jpn. J. Infect. Dis. 57 (5), 830–831.
Rodriguez-Lopez J.N., Lowe D.J., Hernandez-Ruiz J., Hiner A.N., Garcia-Canovas F., Thorneley R.N. 2001. Mechanism of reaction of hydrogen peroxide with horseradish peroxidase: Identification of intermediates in the catalytic cycle. J. Amer. Chem. Soc. 123 (48), 11 838–11 847.
Nelson M.J., Seitz S.P. 1994. The structure and function of lipoxygenase. Curr. Opin. Struct. Biol. 4 (6), 878–884. https://doi.org/10.1016/0959-440x(94)90270-4
Chen G., Guo G., Zhou X., Chen H. 2020. Potential mechanism of ferroptosis in pancreatic cancer. Oncol. Lett. 19 (1), 579–587. https://doi.org/10.3892/ol.2019.11159
Dixon S.J., Lemberg K.M., Lamprecht M.R., Skouta R., Zaitsev E.M., Gleason C.E., Patel D.N., Bauer A.J., Cantley A.M., Yang W.S., Morrison B., Stockwell B.R. 2012. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 149 (5), 1060–1072. https://doi.org/10.1016/j.cell.2012.03.042
Zhang X., Xing X., Liu H., Feng J., Tian M., Chang S., Liu P., Zhang H. 2020. Ionizing radiation induces ferroptosis in granulocyte-macrophage hematopoietic progenitor cells of murine bone marrow. Int. J. Radiat. Biol. 96 (5), 584–595. https://doi.org/10.1080/09553002.2020.1708993
Дёмин Е.М., Проскурнина Е.В., Владимиров Ю.А. 2008. Антиоксидантное действие дигидрокверцетина и рутина в пероксидазных реакциях, катализируемых цитохромом с. Вестник Московского университета. Сер. 2. Химия. 49 (5), 354–360.
Russell G.A. 1957. Deuterium-isotope effects in the autoxidation of aralkyl hydrocarbons. Mechanism of the interaction of peroxy radicals. J. Amer. Chem. Soc. 79 (14), 3871–3877. https://doi.org/10.1021/ja01571a068
Belyakov V.A., Vassil’ev R.F. 1970.Chemiluminescence in hydrocarbon oxidation in solution. A quantitative study of the excitation and emission steps. Photochem. Photobiol. 11 (3), 179–192. https://doi.org/10.1111/j.1751-1097.1970.tb05986.x
Cilento G., Adam W. 1995. From free radicals to electronically excited species. Free Radic. Biol. Med. 19 (1), 103–114. https://doi.org/10.1016/0891-5849(95)00002-f
Владимиров Ю.А., Шерстнёв М.П., Азимбаев Т.К. 1995. Активированная кумарином хемилюминесценция липопротеидов низкой плотности в присутствии ионов двухвалентного железа. Биофизика. 40 (2), 323–327.
Vladimirov Yu.A., Sharov V.S., Driomina E.S., Reznitchenko A.V., Gashev S.B. 1995. Coumarin derivatives enhance the chemiluminescence accompanying lipid peroxidation. Free Radic. Biol. Med. 18 (4), 739–745.
Sharov V.S., Briviba K., Sies H. 1996. Assessment of the C-525 laser dye as a chemiluminescence sensitizer for lipid peroxidation in biological membranes: A comparison with chlorophyll-a. Free Radic. Biol. Med. 21 (6), 833–843.
Ромодин Л.А., Трифонова М.Ф., Лысенко Н.П., Бекузарова С.А. 2020. Способ определения химического участия активатора хемилюминесценции в липопероксидазной реакции. Патент РФ № 2 720 807. Заявл. 04.06.2019, опубл. 13.05.2020.
Ромодин Л.А., Владимиров Ю.А., Лысенко Н.П. 2019. Качественная оценка взаимодействия между различными компонентами реакционной смеси, используемой для изучения липопероксидазной активности комплекса цитохрома c с кардиолипином. Матер. XI Межд. научно-практической конф. “Трансформация опыта менеджмента агробизнеса Европейского Союза в Казахстан и страны Центральной Азии”, “Дулатовские чтения – 2019”, с. 61–68.
Владимиров Ю.А., Проскурнина Е.В. 2009. Свободные радикалы и клеточная хемилюминесценция. Усп. биол. химии. 49, 341–388.
Владимиров Г.К. 2018. Структура и пероксидазная функция комплекса цитохрома c с кардиолипином в водной среде и в неполярном окружении. Дис. … канд. биол. наук. М.: РНИМУ им. П.И. Пирогова МЗ РФ. 2018. 125 с.
Журавлёв А.И. 2009. Квантовая биофизика животных и человека: Учебное пособие. 3-е издание. М.: МГАВМиБ. 474 с.
Журавлёв А.И., Зубкова С.М. 2014. Антиоксиданты. Свободнорадикальная патология, старение. 2-е издание. М.: Белые альвы. 304 с.
Ромодин Л.А., Владимиров Ю.А., Шангин С.В., Владимиров Г.К., Лысенко Н.П., Демихов Е.И. 2020. Изохинолизиновые производные кумарина в качестве активаторов хемилюминесценции в реакциях липидной пероксидации. Биофизика. 65 (4), 680–690. https://doi.org/10.31857/S0006302920040080
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


