Биологические мембраны: Журнал мембранной и клеточной биологии, 2022, T. 39, № 4, стр. 251-270
Cтруктурные основы функционирования глутаматных рецепторов
М. В. Елшанская a, А. И. Соболевский a, *
a Department of Biochemistry and Molecular Biophysics, Columbia University
10032 New York, NY, USA
* E-mail: as4005@cumc.columbia.edu
Поступила в редакцию 14.01.2022
После доработки 24.01.2022
Принята к публикации 25.01.2022
- EDN: POHOYT
- DOI: 10.31857/S0233475522040053
Аннотация
Ионотропные глутаматные рецепторы (iGluRs) опосредуют основную часть быстрой возбуждающей нейротрансмиссии. Они участвуют в развитии и функционировании нервной системы, причем нарушение их функции связано с неврологическими и психиатрическими заболеваниями. В этом обзоре представлены последние достижения структурных исследований iGluRs. Данные, полученные с помощью методов кристаллографии и криоэлектронной микроскопии (крио-ЭМ), помогают определить архитектурные принципы сборки и компоновки глутаматных рецепторов, а также механизмы их активации, десенситизации и регуляции с помощью вспомогательных субъединиц, положительных и отрицательных аллостерических модуляторов и блокаторов ионных каналов. Исследования молекулярной структуры глутаматных рецепторов способствуют лучшему пониманию их физиологической и патофизиологической роли в работе ЦНС, а также предоставляют ценную информацию для создания новых лекарственных препаратов.
ВВЕДЕНИЕ
Ионотропные глутаматные рецепторы (iGluRs) являются лиганд-управляемыми ионными каналами, опосредующими самую значительную часть возбуждающей нейротрансмиссии в ЦНС [1]. Поскольку глутаматные рецепторы вовлечены практически во все процессы получения и обработки информации в мозге, нарушения их функции связаны с хроническими нейродегенеративными заболеваниями и психиатрическими расстройствами [1–4]. Существует четыре подвида iGluRs, включая AMPA-, каинатные, NMDA- и дельта-рецепторы, которые различаются своими аминокислотными последовательностями, а также активацией специфическими молекулами агонистов. Представителей семейства глутаматных рецепторов можно встретить в различных живых организмах от бактерий до насекомых и от растений до человека [5]. Во многих случаях функциональные роли представителей такого многообразия глутаматных рецепторов неизвестны, однако они не ограничиваются нейропередачей, поскольку нервная система отсутствует как у бактерий, так и у растений. Представители глутаматных рецепторов могут принимать участие в других видах передачи информации, реализованными, например, кальциевыми сигналами в растениях, передающихся с помощью специальных растительных глутаматных рецепторов (GLRs), которые, в свою очередь, вовлечены в процессы реагирования растений на порезы, регуляции раскрытия устьица, прорастания семени, развития корневой системы и морфогенеза [6–12]. Свойства ионных каналов значительно различаются среди представителей глутаматных рецепторов, поскольку в это семейство входят как рецепторы, которые образуют комплексы со вспомогательными субъединицами, структурирующими или регуляторными белками, влияющими на амплитуду и кинетику ионных токов, так и рецепторы, которые активируются с разной степенью специфичности аминокислотами и небольшими молекулами, сходными по размеру с аминокислотами [13–17]. В данной работе мы анализируем основные подвиды глутаматных рецепторов и обсуждаем общие принципы влияния структурной организации рецепторов на их функцию.
ФУНКЦИЯ iGluR
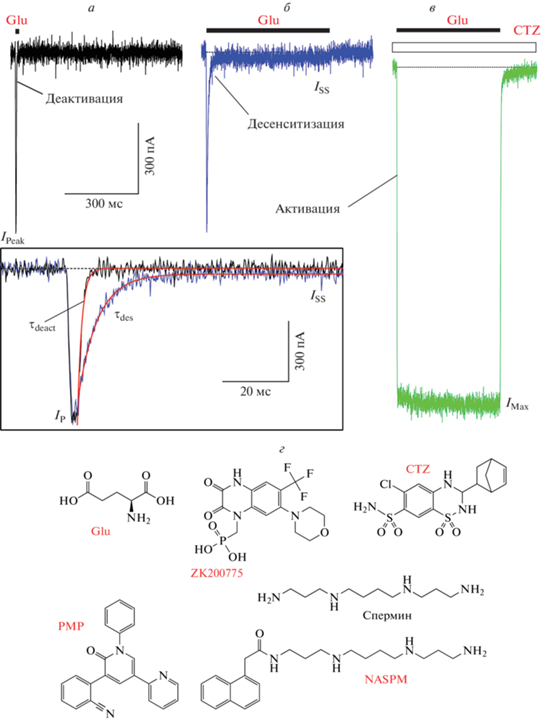
Функция глутаматных рецепторов описана в многочисленных публикациях, ссылки на которые даны в трех подробных обзорах, обобщающих результаты исследований iGluRs трех последних десятилетий [1, 18, 19]. Существуют три основных подвида глутаматных рецепторов: AMPA-, каинатные и NMDA-рецепторы, которые активируются агонистом глутаматом, что приводит к открыванию катион-селективного ионного канала (рис. 1). В ответ на короткую (~1 мс) аппликацию глутамата AMPA-подвид глутаматных рецепторов проводит ток, который быстро (<1 мс) возрастает до максимальной величины (Ipeak) в результате активации, а затем также быстро (1–2 мс) снижается до нуля в ходе деактивации (рис. 1а). В ответ на длительное применение глутамата ток через глутаматные рецепторы начинает снижаться, несмотря на постоянное присутствие агониста (рис. 1б). Это относительно медленное (> 5 мс) снижение тока отражает процесс десенситизации, который необходим нейронам для защиты от токсического действия избыточного количества ионов кальция, входящего в клетку через кальций-проницаемые каналы глутаматных рецепторов. В процессе десенситизации ток достигает стационарной величины (ISS). Сравнительно небольшая величина ISS, характерная для AMPA- и каинатных рецепторов, является признаком выраженной десенситизации и означает, что в условиях равновесия большинство (95–99%) рецепторов оказываются в непроводящем десенситизированном состоянии. Скорость и степень десенситизации различаются в зависимости от подвида iGluRs, будучи самой медленной и наименее выраженной у NMDA-рецепторов. Десенситизация может быть блокирована фармакологически. Например, положительные аллостерические модуляторы, такие как циклотиазид (CTZ), блокируют десенситизацию AMPA-рецепторов и препятствуют снижению тока во время продолжительной аппликации глутамата (рис. 1в). С другой стороны, можно добиться уменьшения токов через каналы глутаматных рецепторов в результате действия 1) конкурентных антагонистов, которые связываются с теми же участками на рецепторе, что и агонисты, 2) блокаторов, закупоривающих пору ионного канала, или 3) отрицательных аллостерических модуляторов (или неконкурентных ингибиторов), связывающихся с другими участками на поверхности iGluR (рис. 1г).
Рис. 1.
Функция и лиганды глутаматного рецептора. а–в – Примеры записей тока при мембранном потенциале –60 мВ от клетки HEK 293, экспрессирующей GluA2-рецепторы AMPA-подвида, в ответ на 2 мс (черная кривая, а) или 1 с (синяя кривая, б) аппликацию 3 мМ глутамата (Glu) или его аппликацию при непрерывном присутствии 30 мкМ циклотиазида (CTZ, зеленая кривая, в). На вставке показаны нормализованные токи в ответ на 2 мс и 1 с применения Glu, нисходящая фаза которых аппроксимирована экспоненциальными функциями (красные кривые) с постоянными времени деактивации τdeact = 1.2 мс и десенситизации τdes = 5.7 мс. Записи были сделаны методом пэтч-кламп [132]. г – Химические структуры агониста глутамата (Glu), конкурентного антагониста ZK200775, положительного аллостерического модулятора циклотиазида (CTZ), неконкурентного ингибитора перампанела (PMP) и блокаторов ионных каналов полиамина, спермина и синтетического аналога токсина паука Joro (1-нафтилацетилспермин, NASPM).
СТРУКТУРА iGluR
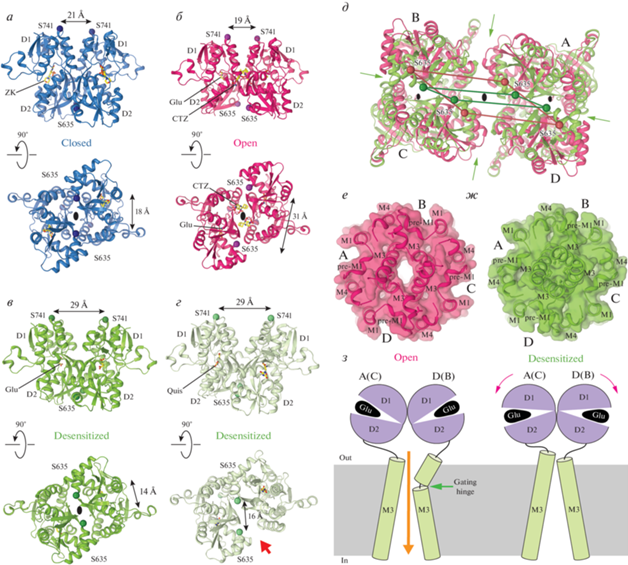
Несмотря на то, что разные представители iGluRs различаются по своим кинетическим и фармакологическим свойствам, структурный дизайн у них общий (рис. 2). Каждая субъединица состоит из нескольких частей (доменов) и включает в себя 1) аминоконцевой домен (АКД), вовлеченный в процессы транспортировки, регуляции и сборки рецепторов; 2) лиганд-связывающий домен (ЛСД), состоящий из двух полипептидных участков S1 и S2, которые формируют двустворчатую структуру с верхней D1- и нижней D2-долями, и включающий связывающие участки для агонистов, конкурентных антагонистов и положительных аллостерических модуляторов (рис. 1г); 3) трансмембранный домен (ТМД), состоящий из элементов М1–М4 и образующий ионопроводящий канал, а также 4) внутриклеточный карбоксильно-концевой домен (CTD), вовлеченный в процессы доставки и распределения рецепторов в постсинаптической мембране, структура которого пока еще не была определена (рис. 2а, 2б). Четыре субъединицы (A–D) вместе формируют один тетрамерный рецептор, где две диагональные субъединицы находятся в прямых (A и C), а две другие (B и D) – в изогнутых конформациях (рис. 2в). В гомотетрамерных iGluRs эти две отличные друг от друга конформации химически идентичных субъединиц возникают вследствие различного расположения доменов относительно друг друга. Несмотря на то, что каждый из доменов принимает одинаковую конформацию в прямых и изогнутых субъединицах, домены связаны друг с другом посредством гибких линкеров, принимающих различные конформации.
Рис. 2.
Структура и симметрия глутаматного рецептора. а – Линейная структура субъединицы iGluR с доменами, обозначенными различным цветом и подписанными стандартными аббревиатурами. б – Мембранная топология субъединицы iGluR. в – Структуры субъединиц A и C (слева), а также B и D (справа) AMPA-рецептора с доменами, окрашенными так же, как в а и б: аминоконцевой домен (АКД, ATD) – голубым, лиганд-связывающий домен (ЛСД, LBD) – фиолетовым, трансмембранный домен (ТМД, TMD) – зеленым, линкеры, связывающие АКД с ЛСД, а также ЛСД с ТМД, – черным. Молекулы ZK (ZK200775) показаны в виде объемных моделей. Различные конформации химически идентичных субъединиц A (C) и B (D) подчеркнуты одинаковой ориентацией ЛСД-доменов и отличающимися ориентациями доменов АКД и ТМД, для совмещения которых требуются повороты на 161° и 104° соответственно. г – Структура тетрамера AMPA-рецептора (PDB ID: 3KG2) с четырьмя субъединицами, окрашенными в разные цвета. Центральная и локальные оси симметрии второго порядка обозначены пунктирной и сплошными черными линиями соответственно. д – Слои структуры (вид сверху) параллельно центральной оси симметрии. Центральная и локальные оси симметрии второго порядка обозначены большими и маленькими овалами, в то время как ось симметрии ТМД четвертого порядка обозначена черным квадратом.
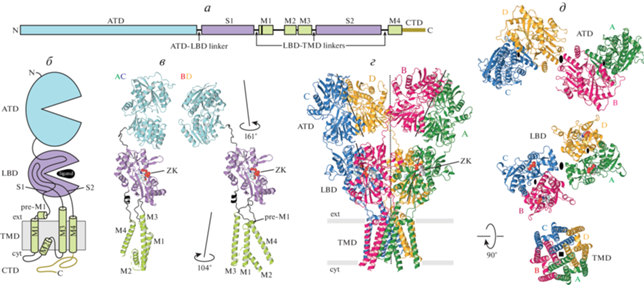
В структуре iGluR домены организованы слоями (рис. 2г). AMPA-рецептор напоминает по форме букву Y, и ее самый верхний внеклеточный слой состоит из доменов АКД. Домены ТМД формируют ионный канал внутри мембраны. Слой ЛСД, зажатый между слоями АКД и ТМД, соединен с АКД-слоем четырьмя линкерами (АКД–ЛСД), а со слоем ТМД тремя группами ЛСД–ТМД линкеров, включая S1–M1, M3–S2 и S2–M4. Поскольку относительные расположения доменов в двух парах конформационно идентичных субъединиц отличаются друг от друга (рис. 2в), рецептор в целом обладает вращательной симметрией второго порядка (рис. 2г, 2д). Слои АКД и ЛСД представляют собой димеры димеров, причем все димеры обладают локальной вращательной симметрией второго порядка с осями, ориентированными в пространстве отличным образом от центральной оси симметрии рецептора. Такое относительное расположение доменов приводит к трансформации симметрии между слоями АКД и ЛСД и, более того, между ЛСД и ТМД, последний из которых обладает приблизительной вращательной симметрией четвертого порядка. Кроме этого, такое расположение доменов обусловливает перехлест аминокислотных цепей между слоями АКД и ЛСД, который приводит к различной компоновке индивидуальных доменов в димеры (рис. 2д). Действительно, в то время как димеры АКД образованы субъединицами A и B, а также C и D, димеры ЛСД составлены из субъединиц A и D, а также B и C. Перехлест аминокислотных цепей также приводит к разному расположению доменов в слоях АКД и ЛСД относительно центральной оси симметрии рецептора, согласно которому АКД домены в субъединицах В и D располагаются близко к оси, а в субъединицах А и С находятся на периферии, в то время как ЛСД домены в субъединицах А и С находятся близко к оси, а в субъединицах В и D они располагаются на периферии (рис. 2д).
Несмотря на то, что структура AMPA-рецепторов (в особенности в слое АКД) похожа на структуры других глутаматных рецепторов, между ними существуют различия, которые определяют взаимодействия доменов и субъединиц, которые, в свою очередь, наделяют представителей iGluR уникальными функциональными свойствами (рис. 3). Например, ЛСД-слой в десенситизированных каинатных рецепторах обладает вращательной симметрией, которая близка к симметрии четвертого порядка, что свидетельствует о диссоциации ЛСД-димеров на мономеры (рис. 3б) [20]. Интересно отметить, что существуют структуры, соответствующие закрытому состоянию каинатных рецепторов, в которых доменная организация очень похожа на структуры AMPA-рецепторов и в которых ЛСД-слой представляет собой димер димеров [20, 21]. Предстоит выяснить, существует ли в физиологических условиях отмечаемая в структуре каинатных рецепторов разница в симметрии и насколько она может быть важна для процессов активации и десенситизации рецептора. NMDA-рецепторы принимают особо компактную и округлую форму, что является результатом более плотного взаимодействия между слоями АКД и ЛСД (рис. 3в) [22, 23]. Именно плотная упаковка доменов делает возможной аллостерическую регуляцию NMDA-рецепторов молекулами, которые связываются с АКД [24–27]. В то же время в большинстве других глутаматных рецепторов слой АКД относительно слабо крепится к слою ЛСД и в основном участвует в процессах сборки рецептора, а не в регуляции его функции. Исключением являются GluD2 дельта-рецепторы, в которых перекрестное связывание АКД-доменов или связывание их с внеклеточным структурирующим белком церебелином-1 и пресинаптическим трансмембранным белком нейрексином-1β переводит этот “молчащий” рецептор в рецептор, активируемый глицином или D-серином [13].
Рис. 3.
Структуры представителей различных подвидов глутаматных рецепторов. В верхнем ряду изображены структуры AMPA- (a, PDB ID: 3KG2), каинатного (б, PDB ID: 5KUF), NMDA- (в, PDB ID: 4PE5), дельта (г, PDB ID: 6KSS) и GLR (д, PDB ID: 7LZH) рецепторов (вид сбоку параллельно мембране). Нижний ряд показывает ЛСД-слой в тех же структурах (вид сверху параллельно центральной оси симметрии рецептора). Центральная и локальные оси симметрии второго порядка обозначены большими и маленькими овалами, в то время как ось симметрии четвертого порядка в каинатном рецепторе обозначена черным квадратом. Молекулы ZK (ZK200775), SYM (SYM2081), глутамата (Glu), глицина (Gly), ифенпродила и глутатиона показаны в виде объемных моделей. Важно отметить перехлест субъединиц, участвующих в формировании АКД- и ЛСД-димеров AMPA- и NMDA-рецепторов, отсутствие такого перехлеста в дельта-рецепторах и GLR, а также полное отсутствие ЛСД-димеров в каинатных рецепторах.
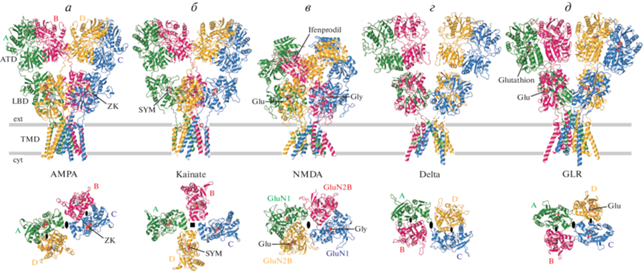
Перехлест аминокислотных цепей между слоями АКД и ЛСД, существующий в AMPA-, каинатных и NMDA-рецепторах, не наблюдается в известных структурах дельта-рецепторов (рис. 3г) [28, 29] и GLR (рис. 3д) [16]. Несмотря на то, что АКД и ЛСД-димеры компонуются из одних и тех же субъединиц A и B или C и D, ближние и периферийные пары субъединиц остаются теми же по отношению к центральной оси симметрии рецепторов, как и в основных подтипах глутаматных рецепторов. Действительно, АКД-домены в субъединицах А и С остаются периферийными, а в субъединицах В и D находятся близко к центральной оси симметрии, в то время как ЛСД-домены в субъединицах В и D становятся периферийным, а в субъединицах А и С располагаются ближе к оси (рис. 3г, 3д). Такое расположение субъединиц в дельта-рецепторах и GLRs является следствием поворота плоскости димера АКД на ~90° относительно плоскости димера ЛСД, что, в свою очередь, приводит к обратному порядку следования субъединиц вокруг центральной оси симметрии второго порядка. Действительно, если смотреть с внеклеточной стороны мембраны, субъединицы A, B, C и D отсчитываются по часовой стрелке в каждом доменном слое основных глутаматных рецепторов, в то время как в дельта-рецепторах и в GLRs они отсчитываются точно так же в слое АКД, но против часовой стрелки в слоях ЛСД и ТМД (рис. 3г, 3д).
ВСПОМОГАТЕЛЬНЫЕ СУБЪЕДИНИЦЫ
Со времени обнаружения первой вспомогательной субъединицы γ2 (старгазин) [30] стало ясно, что большинство глутаматных рецепторов вносят вклад в синаптическую передачу не как одиночные рецепторы, а скорее как центральные компоненты синаптических комплексов. В качестве других компонентов синаптических комплексов AMPA-рецепторов было обнаружено большое разнообразие вспомогательных субъединиц, включая трансмембранные регуляторные субъединицы AMPA-рецепторов (TARPs) [30–33]; корнишоны (cornichons, CNIHs) [34]; модулирующие AMPA-рецептор цистеиновые узлы (CKAMPs) [35]; специфический для стволовых клеток гомолог клаудина белок GSG1L [36, 37]; насыщенный пролинами трансмембранный белок PRRT1 (SynDIG4), кодируемый геном SynDIG1 и индуцируемым синаптической дифференцировкой [38]; трансмембранный нейрональный белок с насыщенными лейциновыми повторами (LRRT4); представители семейства MAGUK; большие дисковые гомологи (DLG1,3,4); белки поркупин (PORCN) и C9orf4; ноэлины 1–3; брорины и нейритин [36, 39–41]. Для многих из этих белков известно, что они регулируют воротные функции, доставку и распределение AMPA-рецепторов в синапсах [39, 41, 42], в то время как для некоторых из них функциональная роль и структурные механизмы взаимодействия с AMPA-рецепторами остаются неизвестными. Для каинатных рецепторов единственным типом до сих пор обнаруженных вспомогательных белков являются подобные нейрофилину и толлоиду белки Neto [43, 44]. Для NMDA- и дельта-рецепторов вспомогательных белков пока не обнаружено, однако в работах по изучению GLRs высказано предположение, что эти рецепторы образуют комплексы с растительными мембранными белками CNIHs [45].
К настоящему времени с помощью структурного анализа было охарактеризовано несколько вспомогательных субъединиц AMPA-рецепторов (рис. 4). Они включают TARPs, GSG1L и CNIH2/3. В крио-ЭМ реконструкциях AMPA-рецепторов из мышиного гиппокампа обнаружили плотность кулоновского потенциала, возможно, представляющую трансмембранную альфа-спираль SynDIG4 [46], однако не было построено никакой структурной модели из-за слишком плохого качества полученных снимков.
Рис. 4.
Вспомогательные субъединицы AMPA-рецепторов. а–г – Мембранная топология с элементами вторичной структуры, изображенных цилиндрами (α-спирали) и стрелками (β-полоски), а также молекулярные структуры вспомогательных субъединиц TARP первого типа γ2 (а, голубая структура, PDB ID: 5WEO), TARP второго типа γ5 (б, зеленая структура, PDB ID: 7RZ8), GSG1L (в, фиолетовая структура, PDB ID: 7RYZ) и CNIH3 (г, красная структура, PDB ID: 6PEQ). д–з – Структуры AMPA-рецепторов в комплексе с вспомогательными субъединицами, в которых субъединицы AMPA-рецепторов показаны желтым (A и C) и светло-голубым (B и D), а вспомогательные субъединицы теми же цветами, что в а–г. АКД-домены не показаны. Обращает на себя внимание максимальная стехиометрия четырех вспомогательных субъединиц, приходящихся на один AMPA-тетрамер для γ2 и CNIH3, а также стехиометрия двух вспомогательных субъединиц, приходящихся на один AMPA-тетрамер для γ5 и GSG1L.
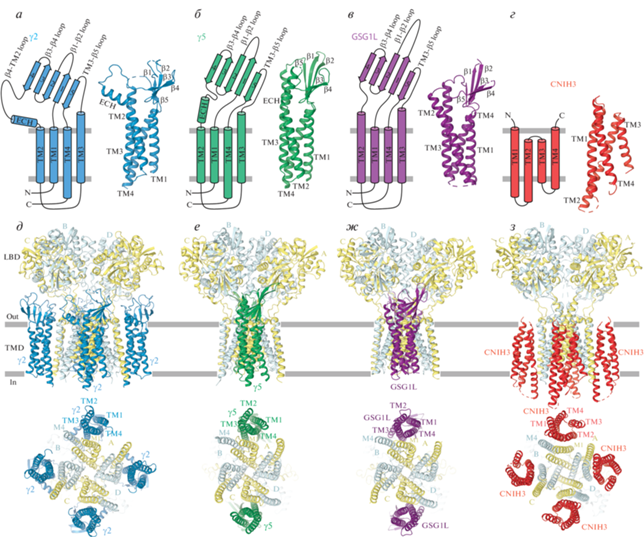
Структуры TARPs, которые изначально были названы γ-субъединицами в силу схожести по аминокислотному составу с субъединицей кальциевого канала γ1 [47], разделяют на два типа на основании функциональных свойств и аминокислотных последовательностей. Эти структуры включают четыре γ-субъединицы, которые относятся к типу I (γ2, γ3, γ4 и γ8), и две γ-субъединицы, которые относятся к типу II (γ5 и γ7) [30–33, 39, 48]. Оба типа γ-субъединиц увеличивают проводимость и ослабляют полиаминный блок проницаемых для кальция AMPA-рецепторов [49, 50]. Как правило, TARP-белки первого типа способствуют активации, увеличивая поверхностную экспрессию AMPA-рецепторов, замедляя кинетику десенситизации и деактивации, а также повышая вероятность открывания канала и амплитуду стационарного тока [30–33, 48, 50–54]. В отличие от белков первого типа, TARP-белки второго типа обычно приводят к уменьшению активности AMPA-рецепторов. Например, субъединица γ5 либо уменьшает, либо не изменяет поверхностную экспрессию AMPA-рецепторов, не вызывает замедления скоростей десенситизации и деактивации, однако понижает сродство к глутамату, вероятность открывания канала и амплитуду стационарного тока [33, 48, 50].
Молекулярные структуры были определены для двух TARP-белков первого типа (старгазин γ2 и γ8), а также для одного TARP-белка второго типа (γ5) [55–60]. Каждый из этих белков имеет структурную укладку, похожую на таковую белка клаудина, которая состоит из связки четырех трансмембранных альфа-спиралей (TM1–TM4) и внеклеточного домена, собранного из полипептидов, соединяющих TM1-TM2 и TM3-TM4, а также включает пятицепочечный β-лист, расположенный над связкой из этих четырех альфа-спиралей (рис. 4а, 4б). В этой структуре также имеется внеклеточная альфа-спираль (extracellular helix, ECH), которая предшествует TM2 и отличает TARP-белки первого и второго типа. В TARPs первого типа ECH располагается практически параллельно мембране, в то время как в TARP второго типа (γ5) она располагается перпендикулярно мембране и является естественным продолжением TM2. Пространственная ориентация ECH определяет форму внеклеточного домена и тип его взаимодействия с AMPA-рецептором. Например, петля β4–TM2, которая предшествует горизонтально ориентированной в γ2 и γ8 спирали ECH, заметно выпячивается в сторону лиганд-связывающих доменов ЛСД. Эта петля содержит несколько консервативных отрицательно заряженных аминокислотных остатков, которые предположительно взаимодействуют с положительно заряженными остатками в ЛСД-мотиве “KGK”, и таким образом модулирует функцию AMPA-рецептора [61, 62]. Подобные отрицательно заряженные аминокислотные остатки отсутствуют в TARPs второго типа, где удлиненный внеклеточный домен γ5 с вертикально ориентированной спиралью ECH взаимодействует только с одним из двух ближайших доменов ЛСД, в то время как внеклеточный домен в TARPs первого типа взаимодействует с обоими доменами.
Подобно TARPs, белок GSG1L отличается структурной укладкой, типичной для белка клаудина (рис. 4в). Этот белок участвует в долговременной синаптической потенциации, формировании синапсов и синаптической пластичности, а также в процессах, связанных с развитием болезни Хантингтона [42, 63, 64]. Кроме того, GSG1L вызывает умеренное замедление кинетики деактивации и десенситизации AMPA-рецепторов, подобное наблюдаемому для TARPs первого типа [36, 37]. В то же время GSG1L значительно замедляет кинетику выхода из десенситизации и способствует переходу в десенситизированное состояние [36, 37], что более характерно для TARPs второго типа. Действительно, структура GSG1L (рис. 4в) гораздо больше похожа на структуру TARP второго типа γ5 (рис. 4б), нежели на структуры TARP первого типа γ2 и γ8 (рис. 4а). Так, внеклеточная спираль ECH, которая отсутствует в GSG1L, заменена в этой субъединице более длинной трансмембранной спиралью TM2, которая выходит во внеклеточное пространство и придает внеклеточному домену GSG1L форму, похожую на γ5. Длинная петля β1–β2 из GSG1L достигает одного из двух соседних слоев ЛСД и модулирует функцию AMPA-рецептора через образовавшийся контакт. Интересно, что субъединица γ5 также использует петлю β1–β2 для замедления скорости выхода AMPA-рецептора из десенситизации, но гораздо больший размер этой петли в GSG1L объясняет ее значительно более выраженное действие на скорость выхода из десенситизации.
Субъединицы CNIH2 и CNIH3, которые контролируют сборку AMPA-рецепторов в эндоплазматическом ретикулуме, замедляют кинетику деактивации и десенситизации рецептора, ослабляют полиаминный блок и увеличивают проводимость одиночного канала [34, 39, 65–68], включают в себя связку четырех альфа-спиралей подобно TARPs и GSG1L (рис. 4г). Более того, все три вида вспомогательных субъединиц связываются с теми же самыми участками на поверхности ТМД AMPA-рецептора, образованными сегментом M1 из одной субъединицы и сегментом M4 из соседней субъединицы (рис. 4д–4з). В противоположность TARPs и GSG1L, у которых амино- и карбокси-концы находятся во внутриклеточном пространстве, оба полипептидных конца в связывающих белках CNIHs смотрят во внеклеточное пространство. Существенно, что у CNIHs полностью отсутствуют внеклеточные петли, но зато присутствуют длинные внутриклеточные петли, которые пока не удалось четко выявить в соответствующих структурах, но которые, по-видимому, играют важную роль в транспортировке AMPA-рецепторов.
Несмотря на то, что все вспомогательные субъединицы, содержащие связку четырех альфа-спиралей, связываются с теми же (указанными выше) участками на поверхности AMPA-рецептора, для них характерна различная стехиометрия (рис. 4д–4з). В зависимости от белковой конструкции и типа реагентов, заменяющих клеточную мембрану во время очистки белка, структуры гомотетрамерных рецепторов, собранных из GluA2-субъединиц в комплексе с вспомогательными субъединицами γ2, выявили различную стехиометрию, включая четыре, две, одну, а также ни одной γ2-субъединицы на тетрамер AMPA-рецептора [55–59]. Максимальная стехиометрия с четырьмя вспомогательными субъединицами на тетрамер AMPA-рецептора наблюдалась также у CNIH3 [69]. Для остальных вспомогательных субъединиц, включающих в себя связку четырех альфа-спиралей, γ5, γ8 и GSG1L, максимальная стехиометрия предполагает связывание только двух вспомогательных субъединиц на один тетрамер AMPA-рецептора [46, 60, 70–72], что вероятнее всего определяется размером внеклеточного домена вспомогательной субъединицы [72]. Действительно, субъединицы γ5, γ8 и GSG1L обладают большими внеклеточными доменами и длинными петлями β1–β2 по сравнению с γ2, в то время как в CNIHs внеклеточный домен отсутствует.
Поскольку вспомогательные субъединицы, включающие в себя связку четырех альфа-спиралей, часто изменяют функцию AMPA-рецепторов, они активно используются для того, чтобы зафиксировать рецептор в определенных функциональных конформациях. Кроме того, ТМД, у которого образующий проводящую пору домен M2 в изолированных рецепторных структурах дезорганизован, приобретает надлежащую конфигурацию в различных комплексах рецептора со вспомогательными субъединицами, что позволяет детально изучать ионную проводимость, канальный блок и структурную динамику, связанную с воротными функциями канала. ТМД был относительно хорошо выявлен и в структурах гомотетрамерного каинатного рецептора GluK2 в комплексе с вспомогательной субъединицей Neto2 [73]. Весьма вероятно, что субъединица Neto2, у которой имеется только одна трансмембранная спираль, регулирует воротную функцию каинатного рецептора посредством связывания нижних долей доменов АКД и ЛСД, используя свои внеклеточные структурные мотивы CUB.
ВОРОТНЫЙ МЕХАНИЗМ АКТИВАЦИИ
Изучение структуры воротного механизма активации (активационного гейтинга) началось с выявления структур изолированного ЛСД-домена AMPA-рецепторов [74]. Более глубокое понимание механизма гейтинга пришло с получением первых структур полноразмерного AMPA-рецептора в комплексе со вспомогательными TARP-субъединицами первого типа γ2 [56, 59]. Установлено, что активация iGluR вызывается связыванием молекулы агониста с участком внутри двустворчатой структуры индивидуального ЛСД. В ответ на связывание агониста двустворчатая структура ЛСД закрывается, создавая движущую силу для всего процесса активации рецептора [56, 59, 74]. Для перехода от закрывания ЛСД-доменов к открыванию канала, индивидуальные ЛСД организованы в димеры, каждый из которых принимает конфигурацию “спина-к-спине”. Во время активации закрывание димеров (“створок раковины”) индивидуальных ЛСД, удерживаемых посредством интерфейса D1–D1 между верхними долями, приводит к разведению нижних долей D2 (рис. 5а). В свою очередь, разведение нижних долей D2, связанных с ТМД посредством линкеров S1–M1, M3–S2 и S2–M4, приводит к открыванию ионного канала. Учитывая димер-димерную организацию слоя ЛСД, при рассмотрении структуры рецептора со стороны ионного канала разведение D2-долей выглядит как расширение ЛСД-тетрамера (рис. 5б) [56, 59]. Структурные изменения, которые предопределены геометрией димер-димерной организации ЛСД-слоя и связью ЛСД и ТМД посредством двенадцати линкеров, выявляют асимметричный вклад двух пар диагональных субъединиц в активацию iGluR (рис. 5в, 5г). Действительно, закрывание двустворчатых ЛСД субъединиц A и C прилагает вертикально направленную силу, которая тянет линкеры M3–S2 вверх и приводит к расплетению одного витка альфа-спиралей M3 (рис. 5в). Напротив, закрывание двустворчатых ЛСД-субъединиц B и D прилагает горизонтально направленную силу, которая разводит линкеры M3–S2 в стороны, изгибает альфа-спирали M3 по гейтинговому шарниру, находящемуся в районе аланина A618, и отодвигает в стороны те части M3, которые формируют гидрофобные ворота в закрытом состоянии канала (рис. 5г). В результате скоординированных конформационных изменений, происходящих во время активации, пора ионного канала, которая большую часть времени гидрофобно закупорена для пропускания ионов и воды связкой спиралей M3 (рис. 5д), открывается для проводимости ионов и воды (рис. 5е) [56, 59, 75]. Таким образом, открывание канала является кульминацией и представляет собой завершающий момент механизма активации глутаматного рецептора (рис. 5ж).
Рис. 5.
Механизм активации. а – Суперпозиция ЛСД-димеров из структуры GluA2–GSG1L-комплекса, связанного с ZK, в закрытом состоянии (голубой димер, PDB ID: 5WEK) и из структуры GluA2–STZ-комплекса, связанного с Glu и CTZ, в открытом состоянии (розовый димер, PDB ID: 5WEO). Молекулы глутамата (Glu) показаны в виде палочковых моделей. Движение нижних долей D2 во время открывания канала показано розовыми стрелками. Cα-атомы остатков S635 и S741 показаны шариками соответствующего цвета с обозначенными между ними расстояниями. б – Суперпозиция ЛСД-тетрамеров из тех же структур, если смотреть на них со стороны ТМД, параллельно центральной оси симметрии рецептора (большой черный овал в середине). Cα-атомы остатков S635 соединены сплошными линиями соответствующего цвета. Расширение ЛСД-слоя, сопровождающее открывание канала, обозначено розовыми стрелками. в, г – Суперпозиция доменов M2 и M3, выстилающих пору, M3–S2 линкеров и ЛСД из субъединиц A и C (в), а также B и D (г), где остатки, образующие ворота (T617, A621, T625 и M629), Q586 и аланин воротного шарнира A618 показаны в виде палочковых моделей. Расстояния между Cα-атомами остатков S635 обозначены стрелками. Обращает на себя внимание сопровождающее открывание канала расплетение одного витка спирали M3 в субъединицах A и C, а также изгиб M3 по воротному шарниру (зеленые стрелки) в субъединицах B и D. д, е – Вид сверху на ионный канал с полупрозрачной поверхностью в закрытом (д) и открытом (е) состояниях. Обращает на себя внимание увеличение размера поры, сопровождающее открывание канала. ж – Иллюстрация механизма активации iGluR. Показаны только две из четырех субъединиц iGluR. Оранжевая стрелка иллюстрирует ионный ток через открытый канал.
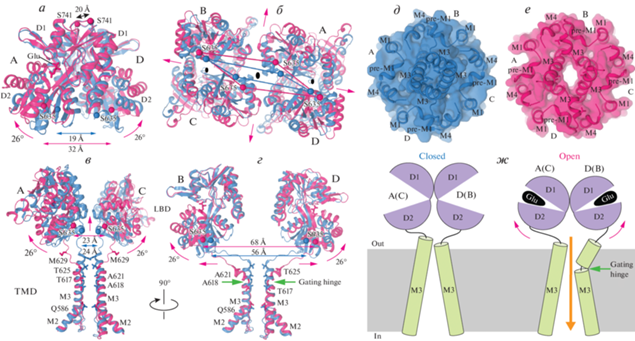
НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
В противоположность конкурентным ингибиторам, которые связываются с тем же участком внутри ЛСД, что и агонисты, и работают как распорки, препятствующие закрыванию его двустворчатой структуры [74, 76], неконкурентные ингибиторы связываются с другими участками на поверхности iGluR и взаимодействуют с механизмом активации рецептора аллостерически. Неконкурентные ингибиторы AMPA-рецепторов, которые включают в себя прототипы антагонистов, такие как GYKI 52466 [77, 78], высокоэффективные селективные молекулы, такие как 2,3-бензодиазепины GYKI 53655 [79, 80] и CP 465022 [79, 81, 82], а также новый противоэпилептический препарат перампанел (perampanel, PMP, рис. 1г) [83–85], взаимодействуют с рецептором без лиганда более эффективно, чем с лиганд-активированным рецептором. Действительно, в ответ на совместное применение с глутаматом PMP вызывает постепенное снижение тока, проводимого каналами AMPA-рецепторов, от изначальной максимальной величины, IMax, до некоторого стационарного значения, IPMP (рис. 6а). Если же PMP постоянно находится в растворе без глутамата, то последующее применение глутамата вызывает ток небольшой начальной величины IIni, который постепенно увеличивается и асимптотически достигает того же стационарного уровня IPMP (рис. 6а). Меньшая по сравнению с IPMP величина IIni показывает, что PMP связывается с рецептором в неактивированном состоянии более эффективно, чем в активированном состоянии.
Рис. 6.
Неконкурентное ингибирование. а – Примеры записей тока при мембранном потенциале –60 мВ от клетки HEK 293, экспрессирующей GluA2-рецепторы AMPA-подвида, в ответ на 1-с аппликацию 3 мМ глутамата (Glu), его одновременного применения с 2 мкМ перампанела (PMP) и применения глутамата на фоне PMP. Во время этого эксперимента циклотиазид (CTZ, 30 мкМ) присутствовал во всех растворах для того, чтобы заблокировать десенситизацию. Существенно, что начальная амплитуда тока в ответ на применение Glu на фоне PMP (IIni) гораздо меньше, чем стационарный уровень тока в ответ на совместное применение Glu и PMP, IPMP; это указывает на то, что PMP связывается с закрытым каналом лучше, чем с открытым каналом. Записи сделаны методом пэтч-кламп [86]. б – Центральный срез поверхности канала, покрашенный в соответствии с электростатическим потенциалом, где синий цвет обозначает положительный заряд, красный цвет – отрицательный заряд, а белый цвет – нейтральные участки в закрытом (PDB ID: 7RZ5), связанном с PMP (PDB ID: 5L1F) и открытом (PDB ID: 5WEO) состояниях. Молекулы PMP изображены в виде объемных моделей. Изгибание M3-спиралей в субъединицах B и D, сопровождающее открывание канала, блокирует участки связывания с PMP. Соответственно, PMP не может связаться с каналом в открытом состоянии и наоборот, закрытый канал со связанным с ним PMP не может открыться, потому что PMP препятствует сгибанию M3-спиралей (красный крест).
Кристаллические структуры рецепторов, связанных с неконкурентными ингибиторами, проливают свет на зависимость ингибирования от состояния рецептора [86]. Подобно другим неконкурентным ингибиторам, PMP связывается с гидрофобными карманами, находящимися непосредственно за короткими горизонтальными спиралями пре-M1-сегментов в так называемом внеклеточном “воротнике”, окружающем канал (рис. 6б). В закрытом состоянии эти гидрофобные карманы открыты для связывания с малыми гидрофобными молекулами неконкурентных ингибиторов. При открывании канала M3-спирали субъединиц B и D сгибаются по воротному шарниру, находящемуся в районе аланина A618, так что их верхние части попадают в гидрофобные карманы, тем самым препятствуя связыванию неконкурентных ингибиторов. Напротив, если неконкурентные ингибиторы связаны с закрытым каналом, то они препятствуют сгибанию M3-спиралей. Соответственно, неконкурентные ингибиторы действуют как клинья, которые удерживают канал в закрытом состоянии и препятствуют его открыванию [86]. Внеклеточный “воротник” канала представляет собой центр, в котором сосредоточены участки связывания для множества положительных и отрицательных аллостерических модуляторов, а также место в iGluRs, где чаще всего возникают мутации, связанные с неврологическими болезнями [87], многие из которых, по-видимому, нарушают равновесие между закрытыми и открытыми состояниями рецептора вследствие механизмов, подобных механизму неконкурентного ингибирования AMPA-рецепторов.
БЛОКАТОРЫ ИОННЫХ КАНАЛОВ
Блок ионных каналов представляет собой еще один вид взаимодействия глутаматных рецепторов с небольшими молекулами, приводящий к ингибированию функции iGluRs и позволяющий глубже изучить их воротные системы [88]. Блокаторы ионных каналов NMDA-рецепторов включают в себя огромное разнообразие химически отличных друг от друга небольших молекул, которые можно разделить на две большие группы в зависимости от их взаимодействия с воротным механизмом канала: последовательные (“нога-в-двери”, “foot-in-the-door”) и “захватываемые-в-ловушку” (trapping). Блокаторы “нога-в-двери”, такие как 1,2,3,4-тетрагидро-9-аминоакридин, 9-аминоакридин и тетрапентиламмоний, закупоривают ионный канал в открытом состоянии и препятствуют его закрыванию; канал может закрыться снова только после того, как блокатор покинет канальную пору [89–94]. Напротив, захватываемые блокаторы, включающие в себя ионы Mg2+, тетраэтиламмоний, мемантин, кетамин, фенциклидин и MK-801, не взаимодействуют с воротами канала, но могут быть заперты внутри канала при его закрывании [92, 93, 95–102]. Недавно полученные структуры NMDA-рецепторов, связанных с молекулами захватываемых блокаторов кетамина и MK-801, выявили место связывания этих блокаторов в центральной полости канальной поры [103, 104], как и было изначально предсказано [88, 105]. Остаются еще не расшифрованными структуры открытых NMDA-рецепторов в комплексе с последовательными блокаторами.
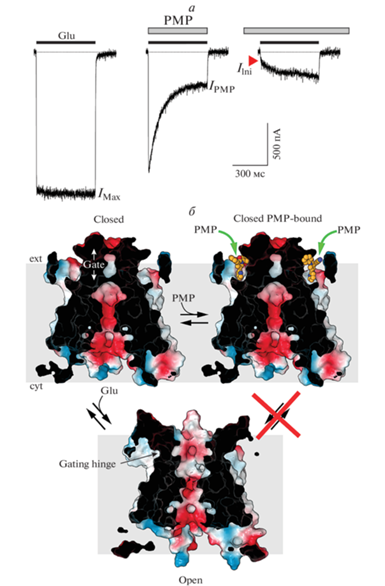
Блокаторы ионных каналов AMPA- и каинатных рецепторов обладают более консервативной химической структурой по сравнению с таковыми NMDA-рецепторов и включают в себя полиамины, а также полиамин- и ацилполиамин-содержащие токсины и их натуральные и синтетические аналоги (рис. 1г) [106–113]. Положительный заряд этих блокаторов делает их эффективными только по отношению к кальций-проницаемым каналам, которые не содержат положительно заряженный аргинин в редактируемом Q/R-сайте на вершине M2-петли. Известно, что полиамины спермин, спермидин и путресцин присутствуют внутри живых клеток и блокируют выходящие токи при положительных мембранных потенциалах, протекающие через поры кальций-проницаемых AMPA- и каинатных рецепторов, приводя тем самым к выпрямлению входящих ионных токов (“inward rectification”, рис. 7а). С другой стороны, токсины и подобные им молекулы, применяемые внеклеточно, ингибируют входящие токи при отрицательных мембранных потенциалах и соответственно вызывают выпрямление ионных токов, направленных в противоположную сторону (“outward rectification”).
Рис. 7.
Блок ионного канала. а – Зависимость нормализованных токов, записанных от клеток HEK 293, экспрессирующих проницаемые для кальция AMPA-рецепторы (GluA2Q), от мембранного потенциала. Записи сделаны методом пэтч-кламп в ответ на 1-с аппликацию 3 мМ глутамата (Glu) в отсутствие (черная кривая) или в присутствии (красная кривая) 4.8 мкМ NASPM и при разных мембранных потенциалах [57]. Во время этого эксперимента циклотиазид (CTZ, 30 мкМ) присутствовал во всех растворах для блокирования десенситизации. б, в – Центральный срез поверхности канала, окрашенный в соответствии с электростатическим потенциалом, где синий цвет обозначает положительный заряд, красный цвет обозначает отрицательный заряд, а белый цвет обозначает нейтральные участки в открытом (PDB ID: 6DM1) и закрытом (PDB ID: 7RZ5) состояниях, связанных с NASPM (б) или спермином (в). Молекулы NASPM и спермина изображены в виде объемных моделей.
Большинство блокаторов ионных каналов не-NMDA-рецепторов действуют в соответствии с механизмом захватываемых в ловушку блокаторов. К настоящему времени получены структуры комплексов AMPA-рецепторов с вспомогательной субъединицей γ2 [57], связанные с 1) блокатором IEM-1460, который облегчает эпилептические эпизоды, снижает висцеральную боль и ингибирует активность рецепторов, относящуюся к шизофрении [114–119]; 2) синтетическим аналогом токсина из паука Joro (1-нафтилацетилспермин, NASPM), уменьшающего окислительный стресс и защищающего нейроны от ишемии [120–123]; и 3) нейропротекторным токсином AgTx-636 из паука-кругопряда Argiope lobata [124–128]. Все три блокатора имеют консервативную химическую структуру, которая включает длинный и узкий полиаминный хвост и большую гидрофобную голову. Все они входят в канал как ключ в замок: их положительно заряженный хвост помещается в узкий отрицательно заряженный селективный фильтр канала, образованный расплетенными участками петель M2, в то время как их гидрофобные головы помещаются в гидрофобном окружении центральной полости канальной поры (рис. 7б). Несмотря на то, что все структуры, связанные с блокаторами, были получены для открытой конформации канала, многочисленные структуры канала, полученные в закрытом состоянии без блокаторов, позволяют предсказать структуру рецептора с блокатором, захваченным внутри закрытого канала (рис. 7б). Представляется очевидным, что закрывание ворот, осуществляемое посредством смыкания M3-спиралей в плотный пучок, не приводит к существенным изменениям центральной полости канала и его селективного фильтра, в результате чего блокатор остается захваченным внутри канала и запертым с одной стороны воротами, которые не позволяют ему выйти во внеклеточное пространство, а с другой стороны – селективным фильтром, который является слишком узким для того, чтобы гидрофобная голова блокатора могла с легкостью протиснуться во внутриклеточное пространство. Тем не менее, медленный выход блокаторов вследствие просачивания в цитоплазму был замечен для двухкатионных производных адамантана, дифенила и фенилциклогексила [129]. В целом, однако, структурный механизм активации и идентифицированные места связывания блокаторов дают весьма правдоподобное объяснение феномена захватываемых в ловушку блокаторов iGluR-каналов.
Несмотря на то, что структуры AMPA-рецепторов в комплексе с полиаминами не были получены экспериментально, расположение полиаминных хвостов канальных блокаторов позволяет предположить характер связывания полиаминов в ионной поре (рис. 7в) [57]. Отсутствие у полиаминов большой гидрофобной “головы” объясняет их низкое сродство к каналу по сравнению с токсинами и подобными токсинам молекулами. При высоких положительных потенциалах на мембране электрохимическая движущая сила может преодолеть низкоаффинное связывание полиаминов и позволить им пройти через канальную пору, тем самым увеличивая величину ионного тока (рис. 7а).
ДЕСЕНСИТИЗАЦИЯ
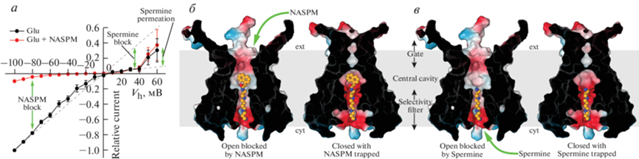
Десенситизация выражается спадом тока в присутствии агониста (рис. 1б) и представляет собой воротный процесс, во время которого рецептор, связанный с агонистом, переходит в состояние с непроводящим ионным каналом. На уровне индивидуальных ЛСД, конформации двустворчатых структур десенситизированного состояния отличаются от полностью открытых конформаций непроводящего (закрытого) состояния (рис. 8а), однако они идентичны полностью закрытым двустворчатым структурам активированного (открытого) состояния (рис. 8б). Энергия закрывания двустворчатой структуры, которая во время активации используется для разведения нижних D2-долей организованного “спина-к-спине” димера (рис. 5а, 8а, 8б), во время десенситизации используется для разрыва D1–D1-интерфейса (рис. 8в, 8г) [59, 70, 72, 130, 131]. Это приводит к изменению относительного расположения индивидуальных двустворчатых структур в ЛСД димерах, в результате чего D2-доли возвращаются приблизительно на те же позиции, что и в непроводящем закрытом состоянии канала. Таким образом, несмотря на то, что все индивидуальные двустворчатые ЛСД-структуры остаются в агонист-связанном активированном состоянии, димер-димерная организация D2-долей, претерпевающая значительное расширение при переходе в открытое состояние, возвращается в схлопнутую конфигурацию при переходе в десенситизированное состояние (рис. 8д). Соответственно, пора канала, которая проводит ионы и воду в открытом состоянии (рис. 8е), в десенситизированном состоянии принимает конформацию, подобную конформации закрытого неактивированного канала (рис. 8ж). Эта трансформация завершает механизм десенситизации, который начинается с разрыва D1–D1-интерфейса в ЛСД-димере (рис. 8з).
Рис. 8.
Механизм десенситизации. а–г – Димеры ЛСД в закрытом (а – GluA2–γ5ZK, PDB ID: 7RZ5, синий димер), открытом (б – GluA2–γ2Glu-CTZ, PDB ID: 5WEO, розовый димер) и десенситизированном (в – GluA2–γ5Glu, PDB ID: 7RZ5, зеленый димер; г – GluA2–GSG1LQuis, PDB ID: 7RZ5, светло-зеленый димер) состояниях, если смотреть на них сбоку (первый ряд) или снизу (второй ряд). Молекулы лигандов показаны в виде палочковых моделей. Cα-атомы остатков S635 и S741 показаны в виде шариков, с указанием расстояний между ними. Черные овалы обозначают локальные оси симметрии второго порядка. Красная стрелка обозначает щель между GluA2–GSG1LQuis-протомерами, свидетельствующую о потере ЛСД-димером вращательной симметрии второго порядка. д – Суперпозиция ЛСД-тетрамеров из структур открытого (GluA2–γ2Glu-CTZ, PDB ID: 5WEO, розовый тетрамер) и десенситизированного (GluA2–γ5Glu, PDB ID: 7RZ5, зеленый тетрамер) состояний, если смотреть на них со стороны ТМД, параллельно центральной оси симметрии рецептора (большой черный овал в середине). Cα-атомы остатков S635 соединены сплошными линиями соответствующего цвета. Сужение ЛСД-слоя, сопровождающее десенситизацию, обозначено зелеными стрелками. е, ж – Вид сверху на ионный канал с полупрозрачной поверхностью в открытом (е, GluA2–γ2Glu-CTZ, PDB ID: 5WEO, розовый канал) и десенситизированном (ж, GluA2–γ5Glu, PDB ID: 7RZ5, зеленый канал) состояниях. Обратите внимание на полное закрывание канальной поры в десенситизированном состоянии. з – Схема, иллюстрирующая механизм десенситизации iGluR. Показаны только две из четырех iGluR-субъединиц, две другие для простоты не показаны. Оранжевая стрелка иллюстрирует ионный ток через открытый канал. Зеленая стрелка указывает на воротный шарнир. Розовые стрелки показывают движение ЛСД-мономеров, входящих в состав ЛСД-димера, сопровождающее разрыв D1–D1-интерфейса во время десенситизации.
Интересно, что в ранних кристаллографических исследованиях изолированных ЛСД обнаружено, что разрыв D1–D1-интерфейса сопровождался потерей димером ЛСД вращательной симметрии второго порядка [131]. Такой же тип разрыва интерфейса D1–D1 был позже обнаружен в структурах десенситизированного состояния полноразмерного рецептора GluA2 в комплексе с GSG1L [70, 72]. Потеря вращательной симметрии второго порядка димерами ЛСД в этих структурах сопровождается появлением боковой щели в каждом ЛСД-димере (рис. 8г). Очевидно, что такой тип разрыва D1–D1-интерфейса в ЛСД-димерах не является единственно возможным. Например, в структурах полноразмерного рецептора GluA2 в десенситизированном состоянии в комплексе с вспомогательными TARP субъединицами γ2 и γ5 разрыв интерфейса D1–D1 происходит с сохранением димерами ЛСД вращательной симметрии второго порядка (рис. 8в) [59, 72].
ЗАКЛЮЧЕНИЕ
Структурные исследования последних лет позволили сделать гигантские шаги вперед на пути достижения прогресса в изучении структуры и функции глутаматных рецепторов. Однако такой прогресс был бы невозможен, если бы анализ молекулярной структуры не сопровождался исследованиями с использованием других подходов, включая электрофизиологию, биохимию белка, протеомику, фармакологию, кинетическое и молекулярное моделирование. Параллельная работа многих лабораторий по всему миру сделала возможным более глубокое понимание молекулярных принципов сборки глутаматных рецепторов, их активации, десенситизации и регуляции небольшими молекулами и вспомогательными субъединицами. Тем не менее, многие вопросы пока остаются без ответов. До сих пор непонятно, что лежит в основе 1) сходства и различия между воротными и регуляторными механизмами различных подвидов глутаматных рецепторов, 2) молекулярных составов и принципов сборки синаптических комплексов iGluR в различных областях мозга, а также в нейронах разного типа и возраста, 3) вклада индивидуальных субъединиц iGluR в воротные и регуляторные функции тетрамерных сборок и 4) зависимости функции iGluR от окружающей среды, включая липиды мембраны, белки внутриклеточного и внеклеточного матрикса, а также участки белка, такие как карбокси-терминали и внутриклеточные петли, структура которых до сих пор неизвестна. Можно надеяться, что эти и другие вопросы привлекут внимание будущих исследователей, которым ответы на эти вопросы будут снова и снова приносить радость открытия.
Вклад авторов. M.В.Е. и А.И.С. участвовали в написании этой статьи.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Источники финансирования. Работа выполнена в рамках проектов Национального Института Здоровья (NIH CA206573, NS083660, NS107253) и Национального Научного Фонда (NSF 1 818 086).
Этические принципы. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Hansen K.B., Wollmuth L.P., Bowie D., Furukawa H., Menniti F.S., Sobolevsky A.I., Swanson G.T., Swanger S.A., Greger I.H., Nakagawa T., McBain C.J., Jayaraman V., Low C.M., Dell’Acqua M.L., Diamond J.S., Camp C.R., Perszyk R.E., Yuan H., Traynelis S.F. 2021. Structure, function, and pharmacology of glutamate receptor ion channels. Pharmacol. Rev. 73 (4), 298–487.
Bowie D. 2008. Ionotropic glutamate receptors & CNS disorders. CNS Neurol. Disord. Drug Targets. 7 (2), 129–143.
Paoletti P., Bellone C., Zhou Q. 2013. NMDA receptor subunit diversity: impact on receptor properties, synaptic plasticity and disease. Nat. Rev. Neurosci. 14 (6), 383–400.
Moretto E., Murru L., Martano G., Sassone J., Passafaro M. 2018. Glutamatergic synapses in neurodevelopmental disorders. Prog. Neuropsychopharmacol. Biol. Psychiatry. 84 (Pt B), 328–342.
Moroz L.L., Nikitin M.A., Policar P.G., Kohn A.B., Romanova D.Y. 2021. Evolution of glutamatergic signaling and synapses. Neuropharmacology. 199, 108740.
Kong D., Hu H.C., Okuma E., Lee Y., Lee H.S., Munemasa S., Cho D., Ju C., Pedoeim L., Rodriguez B., Wang J., Im W., Murata Y., Pei Z.M., Kwak J.M. 2016. L-Met activates arabidopsis GLR Ca. Cell Rep. 17 (10), 2553–2561.
Michard E., Lima P.T., Borges F., Silva A.C., Portes M.T., Carvalho J.E., Gilliham M., Liu L.H., Obermeyer G., Feijó J.A. 2011. Glutamate receptor-like genes form Ca2+ channels in pollen tubes and are regulated by pistil D-serine. Science. 332 (6028), 434–437.
Mousavi S.A., Chauvin A., Pascaud F., Kellenberger S., Farmer E.E. 2013. Glutamate receptor-like genes mediate leaf-to-leaf wound signalling. Nature. 500 (7463), 422–426.
Wudick M.M., Michard E., Oliveira Nunes C., Feijo J.A. 2018. Comparing plant and animal glutamate receptors: Common traits but different fates? J. Exp. Bot. 69 (17), 4151–4163.
Kong D., Ju C., Parihar A., Kim S., Cho D., Kwak J.M. 2015. Arabidopsis glutamate receptor homolog3.5 modulates cytosolic Ca2+ level to counteract effect of abscisic acid in seed germination. Plant Physiol. 167 (4), 1630–1642.
Li F., Wang J., Ma C., Zhao Y., Wang Y., Hasi A., Qi Z. 2013. Glutamate receptor-like channel3.3 is involved in mediating glutathione-triggered cytosolic calcium transients, transcriptional changes, and innate immunity responses in Arabidopsis. Plant Physiol. 162 (3), 1497–1509.
Singh S.K., Chien C.T., Chang I.F. 2016. The Arabidopsis glutamate receptor-like gene GLR3.6 controls root development by repressing the Kip-related protein gene KRP4. J. Exp. Bot. 67 (6), 1853–1869.
Carrillo E., Gonzalez C.U., Berka V., Jayaraman V. 2021. Delta glutamate receptors are functional glycine- and serine-gated cation channels in situ. Sci. Adv. 7 (52), eabk2200.
Gangwar S.P., Green M.N., Michard E., Simon A.A., Feijo J.A., Sobolevsky A.I. 2021. Structure of the Arabidopsis glutamate receptor-like channel GLR3.2 ligand-binding domain. Structure. 29 (2), 161–169.
Alfieri A., Doccula F.G., Pederzoli R., Grenzi M., Bonza M.C., Luoni L., Candeo A., Romano Armada N., Barbiroli A., Valentini G., Schneider T.R., Bassi A., Bolognesi M., Nardini M., Costa A. 2020. The structural bases for agonist diversity in an Arabidopsis thaliana glutamate receptor-like channel. Proc. Natl. Acad. Sci. USA. 117 (1), 752–760.
Green M.N., Gangwar S.P., Michard E., Simon A.A., Portes M.T., Barbosa-Caro J., Wudick M.M., Lizzio M.A., Klykov O., Yelshanskaya M.V., Feijo J.A., Sobolevsky A.I. 2021. Structure of the Arabidopsis thaliana glutamate receptor-like channel GLR3.4. Mol. Cell. 81 (15), 3216–3226.
Lomash S., Chittori S., Brown P., Mayer M.L. 2013. Anions mediate ligand binding in Adineta vaga glutamate receptor ion channels. Structure. 21 (3), 414–425.
Dingledine R., Borges K., Bowie D., Traynelis S.F. 1999. The glutamate receptor ion channels. Pharmacol. Rev. 51 (1), 7–61.
Traynelis S.F., Wollmuth L.P., McBain C.J., Menniti F.S., Vance K.M., Ogden K.K., Hansen K.B., Yuan H., Myers S.J., Dingledine R., Sibley D. 2010. Glutamate receptor ion channels: Structure, regulation, and function. Pharmacol. Rev. 62 (3), 405–496.
Meyerson J.R., Chittori S., Merk A., Rao P., Han T.H., Serpe M., Mayer M.L., Subramaniam S. 2016. Structural basis of kainate subtype glutamate receptor desensitization. Nature. 537 (7621), 567–571.
Khanra N., Brown P.M., Perozzo A.M., Bowie D., Meyerson J.R. 2021. Architecture and structural dynamics of the heteromeric GluK2/K5 kainate receptor. Elife. 10, e66097.
Karakas E., Furukawa H. 2014. Crystal structure of a heterotetrameric NMDA receptor ion channel. Science. 344 (6187), 992–997.
Lee C.H., Lu W., Michel J.C., Goehring A., Du J., Song X., Gouaux E. 2014. NMDA receptor structures reveal subunit arrangement and pore architecture. Nature. 511 (7508), 191–197.
Hansen K.B., Yi F., Perszyk R.E., Furukawa H., Wollmuth L.P., Gibb A.J., Traynelis S.F. 2018. Structure, function, and allosteric modulation of NMDA receptors. J. Gen. Physiol. 150 (8), 1081–1105.
Wang J.X., Furukawa H. 2019. Dissecting diverse functions of NMDA receptors by structural biology. Curr. Opin. Struct. Biol. 54, 34–42.
Stroebel D., Paoletti P. 2021. Architecture and function of NMDA receptors: An evolutionary perspective. J. Physiol. 599 (10), 2615–2638.
Geoffroy C., Paoletti P., Mony L. 2021. Positive allosteric modulation of NMDA receptors: Mechanisms, physiological impact and therapeutic potential. J. Physiol. 600 (2), 233–259.
Burada A.P., Vinnakota R., Kumar J. 2020. The architecture of GluD2 ionotropic delta glutamate receptor elucidated by cryo-EM. J. Struct. Biol. 211 (2), 107546.
Burada A.P., Vinnakota R., Kumar J. 2020. Cryo-EM structures of the ionotropic glutamate receptor GluD1 reveal a non-swapped architecture. Nat. Struct. Mol. Biol. 27 (1), 84–91.
Chen L., Chetkovich D.M., Petralia R.S., Sweeney N.T., Kawasaki Y., Wenthold R.J., Bredt D.S., Nicoll R.A. 2000. Stargazin regulates synaptic targeting of AMPA receptors by two distinct mechanisms. Nature. 408, 936–943.
Tomita S., Adesnik H., Sekiguchi M., Zhang W., Wada K., Howe J.R., Nicoll R.A., Bredt D.S. 2005. Stargazin modulates AMPA receptor gating and trafficking by distinct domains. Nature. 435 (7045), 1052–1058.
Tomita S., Chen L., Kawasaki Y., Petralia R.S., Wenthold R.J., Nicoll R.A., Bredt D.S. 2003. Functional studies and distribution define a family of transmembrane AMPA receptor regulatory proteins. J. Cell Biol. 161 (4), 805–816.
Kato A.S., Siuda E.R., Nisenbaum E.S., Bredt D.S. 2008. AMPA receptor subunit-specific regulation by a distinct family of type II TARPs. Neuron. 59 (6), 986–996.
Schwenk J., Harmel N., Zolles G., Bildl W., Kulik A., Heimrich B., Chisaka O., Jonas P., Schulte U., Fakler B., Klöcker N. 2009. Functional proteomics identify cornichon proteins as auxiliary subunits of AMPA receptors. Science. 323, 1313–1319.
von Engelhardt J., Mack V., Sprengel R., Kavenstock N., Li K.W., Stern-Bach Y., Smit A.B., Seeburg P.H., Monyer H. 2010. CKAMP44: A brain-specific protein attenuating short-term synaptic plasticity in the dentate gyrus. Science. 327 (5972), 1518–1522.
Schwenk J., Harmel N., Brechet A., Zolles G., Berkefeld H., Muller C.S., Bildl W., Baehrens D., Huber B., Kulik A., Klocker N., Schulte U., Fakler B. 2012. High-resolution proteomics unravel architecture and molecular diversity of native AMPA receptor complexes. Neuron. 74 (4), 621–633.
Shanks N.F., Savas J.N., Maruo T., Cais O., Hirao A., Oe S., Ghosh A., Noda Y., Greger I.H., Yates J.R.3rd, Nakagawa T. 2012. Differences in AMPA and kainate receptor interactomes facilitate identification of AMPA receptor auxiliary subunit GSG1L. Cell Rep. 1 (6), 590–598.
Matt L., Kirk L.M., Chenaux G., Speca D.J., Puhger K.R., Pride M.C., Qneibi M., Haham T., Plambeck K.E., Stern-Bach Y., Silverman J.L., Crawley J.N., Hell J.W., Diaz E. 2018. SynDIG4/Prrt1 is required for excitatory synapse development and plasticity underlying cognitive function. Cell Rep. 22 (9), 2246–2253.
Jackson A.C., Nicoll R.A. 2011. The expanding social network of ionotropic glutamate receptors: TARPs and other transmembrane auxiliary subunits. Neuron. 70 (2), 178–199.
Schwenk J., Baehrens D., Haupt A., Bildl W., Boudkkazi S., Roeper J., Fakler B., Schulte U. 2014. Regional diversity and developmental dynamics of the AMPA-receptor proteome in the mammalian brain. Neuron. 84 (1), 41–54.
Schwenk J., Fakler B. 2021. Building of AMPA-type glutamate receptors in the endoplasmic reticulum and its implication for excitatory neurotransmission. J. Physiol. 599 (10), 2639–2653.
Gu X., Mao X., Lussier M.P., Hutchison M.A., Zhou L., Hamra F.K., Roche K.W., Lu W. 2016. GSG1L suppresses AMPA receptor-mediated synaptic transmission and uniquely modulates AMPA receptor kinetics in hippocampal neurons. Nat. Commun. 7, 10873.
Tang M., Pelkey K.A., Ng D., Ivakine E., McBain C.J., Salter M.W., McInnes R.R. 2011. Neto1 is an auxiliary subunit of native synaptic kainate receptors. J. Neurosci. 31 (27), 10009–10018.
Zhang W., St-Gelais F., Grabner C.P., Trinidad J.C., Sumioka A., Morimoto-Tomita M., Kim K.S., Straub C., Burlingame A.L., Howe J.R., Tomita S. 2009. A transmembrane accessory subunit that modulates kainate-type glutamate receptors. Neuron. 61 (3), 385–396.
Wudick M.M., Portes M.T., Michard E., Rosas-Santiago P., Lizzio M.A., Nunes C.O., Campos C., Santa Cruz Damineli D., Carvalho J.C., Lima P.T., Pantoja O., Feijó J.A. 2018. CORNICHON sorting and regulation of GLR channels underlie pollen tube Ca. Science. 360 (6388), 533–536.
Yu J., Rao P., Clark S., Mitra J., Ha T., Gouaux E. 2021. Hippocampal AMPA receptor assemblies and mechanism of allosteric inhibition. Nature. 594 (7863), 448–453.
Jay S.D., Ellis S.B., McCue A.F., Williams M.E., Vedvick T.S., Harpold M.M., Campbell K.P. 1990. Primary structure of the gamma subunit of the DHP-sensitive calcium channel from skeletal muscle. Science. 248 (4954), 490–492.
Kato A.S., Zhou W., Milstein A.D., Knierman M.D., Siuda E.R., Dotzlaf J.E., Yu H., Hale J.E., Nisenbaum E.S., Nicoll R.A., Bredt D.S. 2007. New transmembrane AMPA receptor regulatory protein isoform, gamma-7, differentially regulates AMPA receptors. J. Neurosci. 27 (18), 4969–4977.
Shelley C., Farrant M., Cull-Candy S.G. 2012. TARP-associated AMPA receptors display an increased maximum channel conductance and multiple kinetically distinct open states. J. Physiol. 590 (22), 5723–5738.
Soto D., Coombs I.D., Renzi M, Zonouzi M., Farrant M., Cull-Candy S.G. 2009. Selective regulation of long-form calcium-permeable AMPA receptors by an atypical TARP, gamma-5. Nat. Neurosci. 12 (3), 277–285.
Soto D., Coombs I.D., Kelly L., Farrant M., Cull-Candy S.G. 2007. Stargazin attenuates intracellular polyamine block of calcium-permeable AMPA receptors. Nat. Neurosci. 10, 1260–1270.
Carrillo E., Shaikh S.A., Berka V., Durham R.J., Litwin D.B., Lee G., MacLean D.M., Nowak L.M., Jayaraman V. 2020. Mechanism of modulation of AMPA receptors by TARP-gamma8. J. Gen. Physiol. 152 (1), e201912451.
Priel A., Kolleker A., Ayalon G., Gillor M., Osten P., Stern-Bach Y. 2005. Stargazin reduces desensitization and slows deactivation of the AMPA-type glutamate receptors. J. Neurosci. 25 (10), 2682–2686.
Ben-Yaacov A., Gillor M., Haham T., Parsai A., Qneibi M., Stern-Bach Y. 2017. Molecular mechanism of AMPA receptor modulation by TARP/Stargazin. Neuron. 93 (5), 1126–1137.
Twomey E.C., Yelshanskaya M.V., Grassucci R.A., Frank J., Sobolevsky A.I. 2016. Elucidation of AMPA receptor-stargazin complexes by cryo-electron microscopy. Science. 353 (6294), 83–86.
Twomey E.C., Yelshanskaya M.V., Grassucci R.A., Frank J., Sobolevsky A.I. 2017. Channel opening and gating mechanism in AMPA-subtype glutamate receptors. Nature. 549 (7670), 60–65.
Twomey E.C., Yelshanskaya M.V., Vassilevski A.A., Sobolevsky A.I. 2018. Mechanisms of channel block in calcium-permeable AMPA receptors. Neuron. 99 (5), 956–968.
Zhao Y., Chen S., Yoshioka C., Baconguis I., Gouaux E. 2016. Architecture of fully occupied GluA2 AMPA receptor-TARP complex elucidated by cryo-EM. Nature. 536 (7614), 108–111.
Chen S., Zhao Y., Wang Y., Shekhar M., Tajkhorshid E., Gouaux E. 2017. Activation and desensitization mechanism of AMPA receptor-TARP complex by Cryo-EM. Cell. 170 (6), 1234–1246.
Herguedas B., Watson J.F., Ho H., Cais O., Garcia-Nafria J., Greger I.H. 2019. Architecture of the heteromeric GluA1/2 AMPA receptor in complex with the auxiliary subunit TARP gamma8. Science. 364 (6438), eaav9011.
Dawe G.B., Musgaard M., Aurousseau M.R., Nayeem N., Green T., Biggin P.C., Bowie D. 2016. Distinct structural pathways coordinate the activation of AMPA receptor-auxiliary subunit complexes. Neuron. 89 (6), 1264–1276.
Riva I., Eibl C., Volkmer R., Carbone A.L., Plested A.J. 2017. Control of AMPA receptor activity by the extracellular loops of auxiliary proteins. Elife. 6, e28680.
Mao X., Gu X., Lu W. 2017. GSG1L regulates the strength of AMPA receptor-mediated synaptic transmission but not AMPA receptor kinetics in hippocampal dentate granule neurons. J. Neurophysiol. 117 (1), 28–35.
Becanovic K., Pouladi M.A., Lim R.S., Kuhn A., Pavlidis P., Luthi-Carter R., Hayden M.R., Leavitt B.R. 2010. Transcriptional changes in Huntington disease identified using genome-wide expression profiling and cross-platform analysis. Hum. Mol. Genet. 19 (8), 1438–1452.
Brockie P.J., Jensen M., Mellem J.E., Jensen E., Yamasaki T., Wang R., Maxfield D., Thacker C., Hoerndli F., Dunn P.J., Tomita S., Madsen D.M., Maricq A.V. 2013. Cornichons control ER export of AMPA receptors to regulate synaptic excitability. Neuron. 80 (1), 129–142.
Herring B.E., Shi Y., Suh Y.H., Zheng C.Y., Blankenship S.M., Roche K.W., Nicoll R.A. 2013. Cornichon proteins determine the subunit composition of synaptic AMPA receptors. Neuron. 77 (6), 1083–1096.
Gill M.B., Kato A.S., Roberts M.F., Yu H., Wang H., Tomita S., Bredt D.S. 2011. Cornichon-2 modulates AMPA receptor-transmembrane AMPA receptor regulatory protein assembly to dictate gating and pharmacology. J. Neurosci. 31 (18), 6928–6938.
Coombs I.D., Soto D., Zonouzi M., Renzi M., Shelley C., Farrant M., Cull-Candy S.G. 2012. Cornichons modify channel properties of recombinant and glial AMPA receptors. J. Neurosci. 32 (29), 9796–9804.
Nakagawa T. 2019. Structures of the AMPA receptor in complex with its auxiliary subunit cornichon. Science. 366 (6470), 1259–1263.
Twomey E.C., Yelshanskaya M.V., Grassucci R.A., Frank J., Sobolevsky A.I. 2017. Structural bases of desensitization in AMPA receptor-auxiliary subunit complexes. Neuron. 94 (3), 569–580.
Zhang D., Watson J.F., Matthews P.M., Cais O., Greger I.H. 2021. Gating and modulation of a hetero-octameric AMPA glutamate receptor. Nature. 594 (7863), 454–458.
Klykov O., Gangwar S.P., Yelshanskaya M.V., Yen L., Sobolevsky A.I. 2021. Structure and desensitization of AMPA receptor complexes with type II TARP gamma5 and GSG1L. Mol. Cell. 8 1(23), 4771–4783.
He L., Sun J., Gao Y., Li B., Wang Y., Dong Y., An W., Li H., Yang B., Ge Y., Zhang X.C., Shi Y.S., Zhao Y. 2021. Kainate receptor modulation by NETO2. Nature. 599 (7884), 325–329.
Armstrong N., Gouaux E. 2000. Mechanisms for activation and antagonism of an AMPA-sensitive glutamate receptor: Crystal structures of the GluR2 ligand binding core. Neuron. 28 (1), 165–181.
Biedermann J., Braunbeck S., Plested A.J.R., Sun H. 2021. Nonselective cation permeation in an AMPA-type glutamate receptor. Proc. Natl. Acad. Sci. USA. 118 (8), e2012843118.
Sobolevsky A.I., Rosconi M.P., Gouaux E. 2009. X-ray structure, symmetry and mechanism of an AMPA-subtype glutamate receptor. Nature. 462 (7274), 745–756.
Donevan S.D., Rogawski M.A. 1993. GYKI 52466, a 2,3-benzodiazepine, is a highly selective, noncompetitive antagonist of AMPA/kainate receptor responses. Neuron. 10, 51–59.
Tarnawa I., Farkas S., Berzsenyi P., Pataki A., Andrasi F. 1989. Electrophysiological studies with a 2,3-benzodiazepine muscle relaxant: GYKI 52466. Eur. J. Pharmacol. 167 (2), 193–199.
Balannik V., Menniti F.S., Paternain A.V., Lerma J., Stern-Bach Y. 2005. Molecular mechanisms of AMPA receptor noncompetitive antagonism. Neuron. 48, 279–288.
Donevan S.D., Yamaguchi S., Rogawski M.A. 1994. Non-N-methyl-D-aspartate receptor antagonism by 3-N-substituted 2,3-benzodiazepines: Relationship to anticonvulsant activity. J. Pharmacol. Exp. Ther. 271 (1), 25–29.
Lazzaro J.T., Paternain A.V., Lerma J., Chenard B.L., Ewing F.E., Huang J., Welch W.M., Ganong A.H., Menniti F.S. 2002. Functional characterization of CP-465,022, a selective, noncompetitive AMPA receptor antagonist. Neuropharmacology. 42 (2), 143–153.
Menniti F.S., Chenard B.L., Collins M.B., Ducat M.F., Elliott M.L., Ewing F.E., Huang J.I., Kelly K.A., Lazzaro J.T., Pagnozzi M.J., Weeks J.L., Welch W.M., White W.F. 2000. Characterization of the binding site for a novel class of noncompetitive alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor antagonists. Mol. Pharmacol. 58 (6), 1310–1317.
Chen C.Y., Matt L., Hell J.W., Rogawski M.A. 2014. Perampanel inhibition of AMPA receptor currents in cultured hippocampal neurons. PLoS One. 9 (9), e108021.
Hibi S., Ueno K., Nagato S., Kawano K., Ito K., Norimine Y., Takenaka O., Hanada T., Yonaga M. 2012. Discovery of 2-(2-oxo-1-phenyl-5-pyridin-2-yl-1,2-dihydropyridin-3-yl)benzonitrile (perampanel): A novel, noncompetitive alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropanoic acid (AMPA) receptor antagonist. J. Med. Chem. 55 (23), 10584–10600.
Bialer M., Johannessen S.I., Levy R.H., Perucca E., Tomson T., White H.S. 2010. Progress report on new antiepileptic drugs: A summary of the Tenth Eilat conference (EILAT X). Epilepsy Res. 92 (2–3), 89–124.
Yelshanskaya M.V., Singh A.K., Sampson J.M., Narangoda C., Kurnikova M., Sobolevsky A.I. 2016. Structural bases of noncompetitive inhibition of AMPA subtype ionotropic glutamate receptors by antiepileptic drugs. Neuron. 91 (6), 1305–1315.
Perszyk R.E., Myers S.J., Yuan H., Gibb A.J., Furukawa H., Sobolevsky A.I., Traynelis S.F. 2020. Hodgkin-Huxley-Katz prize lecture: Genetic and pharmacological control of glutamate receptor channel through a highly conserved gating motif. J. Physiol. 598 (15), 3071–3083.
Sobolevsky A.I. 2003. Channel block of glutamate receptors. In: Recent Research Developments in Physiology. Ed. Pandalai S.G. Research Signpost, Trivandrum. p. 1–38.
Costa A.C., Albuquerque E.X. 1994. Dynamics of the actions of tetrahydro-9-aminoacridine and 9-aminoacridine on glutamatergic currents: Concentration-jump studies in cultured rat hippocampal neurons. J. Pharmacol. Exp. Ther. 268 (1), 503–514.
Benveniste M., Mayer M.L. 1995. Trapping of glutamate and glycine during open channel block of rat hippocampal neuron NMDA receptors by 9-aminoacridine. J. Physiol. 483 (2), 367–384.
Koshelev S.G., Khodorov B.I. 1995. Blockade of open NMDA channel by tetrabutylammonium, 9-aminoacridine and tacrine prevents channels closing and desensitization. Membr. Cell Biol. 9, 93–109.
Sobolevsky A.I. 1999. Two-component blocking kinetics of open NMDA channels by organic cations. Biochim. Biophys. Acta. 1416 (1–2), 69–91.
Sobolevsky A.I., Koshelev S.G., Khodorov B.I. 1999. Probing of NMDA channels with fast blockers. J. Neurosci. 19 (24), 10611–10626.
Sobolevsky A.I. 2000. Quantitative analysis of tetrapentylammonium-induced blockade of open N-methyl-D-aspartate channels. Biophys. J. 79 (3), 1324–1335.
Huettner J.E., Bean B.P. 1988. Block of N-methyl-D-aspartate-activated current by the anticonvulsant MK-801: Selective binding to open channels. Proc. Natl. Acad. Sci. USA. 85 (4), 1307–1311.
MacDonald J.F., Bartlett M.C., Mody I., Pahapill P., Reynolds J.N., Salter M.W., Schneiderman J.H., Pennefather P.S. 1991. Actions of ketamine, phencyclidine and MK-801 on NMDA receptor currents in cultured mouse hippocampal neurones. J. Physiol. 432, 483–508.
Parsons C.G., Quack G., Bresink I., Baran L., Przegalinski E., Kostowski W., Krzascik P., Hartmann S., Danysz W. 1995. Comparison of the potency, kinetics and voltage-dependency of a series of uncompetitive NMDA receptor antagonists in vitro with anticonvulsive and motor impairment activity in vivo. Neuropharmacology. 34 (10), 1239–1258.
Blanpied T.A., Boeckman F.A., Aizenman E., Johnson J.W. 1997. Trapping channel block of NMDA-activated responses by amantadine and memantine. J. Neurophysiol. 77 (1), 309–323.
Chen H.S., Lipton S.A. 1997. Mechanism of memantine block of NMDA-activated channels in rat retinal ganglion cells: Uncompetitive antagonism. J. Physiol. 499 (1), 27–46.
Dilmore J.G., Johnson J.W. 1998. Open channel block and alteration of N-methyl-D-aspartic acid receptor gating by an analog of phencyclidine. Biophys. J. 75 (4), 1801–1816.
Sobolevsky A.I., Yelshansky M.V. 2000. The trapping block of NMDA receptor channels in acutely isolated rat hippocampal neurones. J. Physiol. 526 (3), 493–506.
Sobolevsky A.I., Koshelev S.G., Khodorov B.I. 1998. Interaction of memantine and amantadine with agonist-unbound NMDA-receptor channels in acutely isolated rat hippocampal neurons. J. Physiol. 512 (1), 47–60.
Song X., Jensen M.O., Jogini V., Stein R.A., Lee C.H., McHaourab H.S., Shaw D.E., Gouaux E. 2018. Mechanism of NMDA receptor channel block by MK-801 and memantine. Nature. 556 (7702), 515–519.
Zhang Y., Ye F., Zhang T., Lv S., Zhou L., Du D., Lin H., Guo F., Luo C., Zhu S. 2021. Structural basis of ketamine action on human NMDA receptors. Nature. 596 (7871), 301–305.
Sobolevsky A.I., Beck C., Wollmuth L.P. 2002. Molecular rearrangements of the extracellular vestibule in NMDAR channels during gating. Neuron. 33 (1), 75–85.
Bowie D., Mayer M.L. 1995. Inward rectification of both AMPA and kainate subtype glutamate receptors generated by polyamine-mediated ion channel block. Neuron. 15 (2), 453–462.
Koh D.S., Burnashev N., Jonas P. 1995. Block of native Ca2+-permeable AMPA receptors in rat brain by intracellular polyamines generates double rectification. J. Physiol. 486, 305–312.
Kamboj S.K., Swanson G.T., Cull-Candy S.G. 1995. Intracellular spermine confers rectification on rat calcium-permeable AMPA and kainate receptors. J. Physiol. 486, 297–303.
Donevan S.D., Rogawski M.A. 1995. Intracellular polyamines mediate inward rectification of Ca2+-permeable alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptors. Proc. Natl. Acad. Sci. USA. 92 (20), 9298–9302.
Antonov S.M., Grishin E.V., Magazanik L.G., Shupliakov O.V., Vesselkin N.P., Volkova T.M. 1987. Argiopin blocks the glutamate responses and sensorimotor transmission in motoneurones of isolated frog spinal cord. Neurosci. Lett. 83 (1–2), 179–184.
Гришин Е.В., Волкова Т.М., Арсеньев А.С., Решетова О.С., Оноприенко В.В. 1986. Структурно-функциональная характеристика аргиопина – блокатора ионных каналов из яда паука Argiope lobata. Биоорган. химия. 12 (8), 1121–1124.
Shudo K., Endo Y., Hashimoto Y., Aramaki Y., Nakajima T., Kawai N. 1987. Newly synthesized analogues of the spider toxin block the crustacean glutamate receptor. Neurosci. Res. 5 (1), 82–85.
Eldefrawi A.T., Eldefrawi M.E., Konno K., Mansour N.A., Nakanishi K., Oltz E., Usherwood P.N. 1988. Structure and synthesis of a potent glutamate receptor antagonist in wasp venom. Proc. Natl. Acad. Sci. USA. 85 (13), 4910–4913.
Kopach O., Krotov V., Goncharenko J., Voitenko N. 2016. Inhibition of spinal Ca2+-permeable AMPA receptors with dicationic compounds alleviates persistent inflammatory pain without adverse effects. Front. Cell Neurosci. 10, 50.
Liu S.B., Zhang M.M., Cheng L.F., Shi J., Lu J.S., Zhuo M. 2015. Long-term upregulation of cortical glutamatergic AMPA receptors in a mouse model of chronic visceral pain. Mol. Brain. 8 (1), 76.
Szczurowska E., Mares P. 2015. An antagonist of calcium permeable AMPA receptors, IEM1460: Anticonvulsant action in immature rats? Epilepsy Res. 109, 106–113.
Gmiro V.E., Serdyuk S.E. 2008. Combined blockade of AMPA and NMDA receptors in the brain of rats prevents pentylenetetrazole-induced clonic and tonic-clonic seizures without ataxia. Bull. Exp. Biol. Med. 145 (6), 728–730.
Umino M., Umino A., Nishikawa T. 2018. Effects of selective calcium-permeable AMPA receptor blockade by IEM 1460 on psychotomimetic-induced hyperactivity in the mouse. J. Neural. Transm. (Vienna). 125 (4), 705–711.
Magazanik L.G., Buldakova S.L., Samoilova M.V., Gmiro V.E., Mellor I.R., Usherwood P.N. 1997. Block of open channels of recombinant AMPA receptors and native AMPA/kainate receptors by adamantane derivatives. J. Physiol. 505, 655–663.
Noh K.M., Yokota H., Mashiko T., Castillo P.E., Zukin R.S., Bennett M.V. 2005. Blockade of calcium-permeable AMPA receptors protects hippocampal neurons against global ischemia-induced death. Proc. Natl. Acad. Sci. USA. 102 (34), 12230–12235.
Zhang Q., Zhang G., Meng F., Tian H. 2003. Biphasic activation of apoptosis signal-regulating kinase 1-stress-activated protein kinase 1-c-Jun N-terminal protein kinase pathway is selectively mediated by Ca2+-permeable alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionate receptors involving oxidative stress following brain ischemia in rat hippocampus. Neurosci. Lett. 337 (1), 51–55.
Koike M., Iino M., Ozawa S. 1997. Blocking effect of 1-naphthyl acetyl spermine on Ca2+-permeable AMPA receptors in cultured rat hippocampal neurons. Neurosci. Res. 29 (1), 27–36.
Takazawa A., Yamazaki O., Kanai H., Ishida N., Kato N., Yamauchi T. 1996. Potent and long-lasting anticonvulsant effects of 1-naphthylacetyl spermine, an analogue of Joro spider toxin, against amygdaloid kindled seizures in rats. Brain Res. 706 (1), 173–176.
Herlitze S., Raditsch M., Ruppersberg J.P., Jahn W., Monyer H., Schoepfer R., Witzemann V. 1993. Argiotoxin detects molecular differences in AMPA receptor channels. Neuron. 10 (6), 1131–1140.
Grishin E.V., Volkova T.M., Arseniev A.S. 1989. Isolation and structure analysis of components from venom of the spider Argiope lobata. Toxicon. 27 (5), 541–549.
Poulsen M.H., Lucas S., Bach T.B., Barslund A.F., Wenzler C., Jensen C.B., Kristensen A.S., Stromgaard K. 2013. Structure-activity relationship studies of argiotoxins: Selective and potent inhibitors of ionotropic glutamate receptors. J. Med. Chem. 56 (3), 1171–1181.
Barygin O.I., Grishin E.V., Tikhonov D.B. 2011. Argiotoxin in the closed AMPA receptor channel: Experimental and modeling study. Biochemistry. 50 (38), 8213–8220.
Green A.C., Nakanishi K., Usherwood P.N. 1996. Polyamine amides are neuroprotective in cerebellar granule cell cultures challenged with excitatory amino acids. Brain Res. 717 (1–2), 135–146.
Tikhonova T.B., Barygin O.I., Gmiro V.E., Tikhonov D.B., Magazanik L.G. 2008. Organic blockers escape from trapping in the AMPA receptor channels by leaking into the cytoplasm. Neuropharmacology. 54 (4), 653–664.
Sun Y., Olson R., Horning M., Armstrong N., Mayer M., Gouaux E. 2002. Mechanism of glutamate receptor desensitization. Nature. 417 (6886), 245–253.
Armstrong N., Jasti J., Beich-Frandsen M., Gouaux E. 2006. Measurement of conformational changes accompanying desensitization in an ionotropic glutamate receptor. Cell. 127 (1), 85–97.
Yelshanskaya M.V., Li M., Sobolevsky A.I. 2014. Structure of an agonist-bound ionotropic glutamate receptor. Science. 345 (6200), 1070–1074.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


