Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 1, стр. 71-80
Влияние ауксина на жирнокислотный состав и активность АЦИЛ-липидных десатураз в проростках яровой пшеницы Triticum aestivum L.
Н. П. Ковалевская *
Институт экологии и генетики микроорганизмов –
филиал Пермского федерального исследовательского центра УрО РАН
614081 Пермь, Россия
* E-mail: nina_kov@mail.ru
Поступила в редакцию 29.12.2021
После доработки 08.04.2022
Принята к публикации 20.04.2022
- EDN: NSIESM
- DOI: 10.31857/S0233475522060081
Аннотация
Исследовано влияние экзогенного ауксина на изменения жирнокислотного состава суммарных липидов листьев и корней проростков яровой пшеницы (Triticum aestivum L.). Установлено, что разнообразие жирных кислот в вегетативных органах (лист или корень) зависит не только от концентрации ауксина, а также от донора оксида азота (N2, NO3). Отмечено, что при повышении концентрации экзогенного ауксина происходит увеличение микровязкости и уменьшение проницаемости мембран вегетативных органов пшеницы, что подтверждается снижением индекса двойных связей (ИДС). При этом происходит увеличение концентрации насыщенных жирных кислот (пальмитиновой и стеариновой), которые используются в качестве предшественников для образования жирных кислот с очень длинной цепью (ЖКОДЦ). Установлено, что экзогенный ауксин приводит к увеличению суммарного содержания ЖКОДЦ в листьях при дефиците (8.4%) и избытке доноров NO (12.3%). Внесение экзогенного ауксина нивелирует значительные различия активности десатураз в корнях пшеницы при разных уровнях доноров оксида азота. Высказано предположение, что биосинтез докозадиеновой кислоты (С22:2) в листьях является одним из ключевых этапов в формировании адаптивного ответа клеточных мембран на воздействие абиотических стрессов при онтогенезе растений. Повышение уровня NO способствует перемещению от корней к побегам ауксина, который может служить регулятором активности элонгаз и денатураз при синтезе ЖКОДЦ.
ВВЕДЕНИЕ
В растительных клетках обмен с окружающей средой сигналами и веществами регулируется через плазматическую мембрану, состоящую из двойного слоя липидов со встроенными в него белками. Физико-химические свойства мембран, в том числе температура фазовых переходов, в значительной степени определяются составом жирных кислот (ЖК) их липидов. Рассматривая изменения процентного содержания ЖК в общих мембранных липидах растений, авторы [1] выделили две стратегии адаптивных реакций, связанных с увеличением содержания или насыщенных, или ненасыщенных ЖК и, соответственно, с противоположными изменениями микровязкости клеточных мембран при стрессовых воздействиях. Первая стратегия отличается увеличением содержания ненасыщенных ЖК в составе общих липидов клеточных мембран. Она характерна для биотического [2] и температурного [3] стресса, а также для стрессов, вызванных высокими концентрациями тяжелых металлов [4]. Вторая стратегия, связанная с увеличением содержания насыщенных ЖК, осуществляется при окислительном и солевом стрессе (который также является и гиперосмотическим) [1].
В клетках растений при окислительном стрессе усиливается образование активных форм кислорода (АФК) [5]. Для своей стабилизации АФК активно захватывают электроны из молекул липидов, белков и нуклеиновых кислот, дестабилизируя макромолекулы и надмолекулярные структуры. Одной из основных мишеней АФК являются остатки ненасыщенных жирных кислот в составе липидов мембран, подвергающиеся свободнорадикальному окислению по месту двойных связей с образованием гидроперекисей и диеновых конъюгатов, которые быстро метаболизируются, превращаясь в альдегиды и диальдегиды. У высших растений наиболее распространенными полиненасыщенными жирными кислотами (ПНЖК) являются три 18-углеродных вида, а именно олеиновая (С18:1), линолевая (С18:2) и α-линоленовая (С18:3) кислоты. Примечательной особенностью является то, что химическая природа двойной связи, по-видимому, делает их датчиками окислительно-восстановительного потенциала в растениях [6].
Главным фактором, позволяющим клетке поддерживать текучесть мембран в условиях стресса, является эффективная работа клеточных десатураз, обеспечивающая изменение уровня ненасыщенности мембранных липидов [7]. В настоящее время убедительно продемонстрировано, что экспрессия генов десатураз регулируется действием различных стрессовых факторов и гормонов. Это позволяет внести их в список ключевых участников как процессов сигнализации, так и механизмов защиты и адаптации растений к биотическим и абиотическим факторам [8]. Установлено, что наличие в мембранных липидах линолевой (С18:2) кислоты, а следовательно, и активность ∆12-десатуразы являются критическими факторами для формирования характерной для организма структуры мембраны [9, 10].
В последнее время помимо регулярных публикаций исследований окислительного стресса стали появляться сообщения о нитрозильном/нитроокислительном стрессе [11–14]. Из литературы известно, что увеличение NO часто сопровождается накоплением других реактивных молекул, таких как H2O2 и H2S. Так, в некоторых исследованиях показано, что при введении нитратов в клетках растений образуется пероксид водорода [15, 16]. Наряду с АФК и H2S, NO потенциально может способствовать общему внутриклеточному окислительно-восстановительному потенциалу клетки [6]. В зависимости от соотношения внутриклеточных концентраций NO и АФК могут взаимно как усиливать, так и ослаблять действие друг друга на клетки. NO может также влиять на биосинтез, катаболизм/конъюгацию, транспорт, восприятие и/или трансдукцию различных фитогормонов, таких как ауксины, гиббереллины, цитокинины, абсцизовая кислота, этилен, салициловая кислота, жасмонаты и брассиностероиды. Механизмы, лежащие в основе взаимодействия между NO и растительными гормонами, до сих пор полностью не выяснены [17].
В случае некоторых стрессовых ситуаций в тканях растений возрастает количество насыщенных ЖК с очень длинной (более 20 атомов углерода) цепью (ЖКОДЦ) [18–21]. Синтез ЖКОДЦ играет важную роль в направлении и степени растяжения клеток растений в ходе морфогенеза [22]. В работе [23] показано, что ЖКОДЦ являются незаменимыми регуляторами дифференциации клеток за счет регуляции полярного распределения ауксина. Растительный гормон ауксин (преобладающая форма – индол-3-уксусная кислота; ИУК) является основным координирующим сигналом в регуляции развития растений. Многие аспекты действия ауксина зависят от его дифференциального распределения в тканях растения, где он образует локальные максимумы или градиенты между клетками [24]. Ранее в работе [25] было показано, что снижение уровня NO3 способствовало перемещению ауксина от побегов к корням. Интересно, что о взаимодействии между сигналом нитрата и транспортом ауксина также сообщает тот факт, что нитратные транспортеры способны переносить ауксин. Изучение физиологической роли ЖКОДЦ находится в настоящее время лишь на начальной стадии накопления фактического материала. Таким образом, дальнейшие исследования ЖКОДЦ как компонентов липидного микроокружения ферментов биомембран, несомненно, позволят получить новые данные об их функционировании.
Цель данной работы – выяснить направленность изменений, происходящих в липидном метаболизме проростков яровой пшеницы (Triticum aestivum L.) под влиянием экзогенного ауксина. В задачи работы входило определить активность ацил-липидных десатураз в листьях и корнях проростков пшеницы под действием экзогенного ауксина и выявить изменения жирнокислотного состава вегетативных органов в ответ на повышение концентрации ауксина.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали яровую пшеницу Triticum aestivum L. сорта Экада 70. Семена проращивали 3 сут на фильтрах, смоченных дистиллированной водой в лабораторных условиях при 16-часовом дневном освещении и 20°С/24°С (ночь/день). Затем проростки помещали на 7 дней в кюветы со средой Громова [26]. В половину кювет дополнительно не вносили азотные соли (N-дефицитные варианты, окислительный стресс). Во вторую половину кювет добавляли 20 мМ NaNO3 (NO3-варианты, нитрозильный стресс). В качестве фитогормона ауксина использовали β-индолилуксусную кислоту (ИУК) в концентрациях 5, 25, 50, 100 мкг/мл.
Экстракцию липидов из вегетативных органов пшеницы проводили с использованием системы растворителей хлороформ–метанол–вода (1 : 2 : 0.8, по объему). Для удаления хлороформа из экстракта липидов использовали роторный испаритель RVO-64 (Чехия). Для получения метиловых эфиров жирных кислот к экстракту липидов после удаления растворителя добавляли 1% метанольный раствор Н2SO4 и нагревали на водяной бане при 60°С в течение 30 мин. После охлаждения метиловые эфиры жирных кислот трижды экстрагировали гексаном. Анализ полученных метиловых эфиров жирных кислот проводили методом газожидкостной хроматографии с использованием хроматомасс-спектрометра 5973N/ 6890N MSD/DS AgilentTechnology (США). Капиллярная колонка HP-INNOWAX (30 м × 250 мк × × 0.50 мм), градиент температуры: от 100 до 150°С со скоростью 10°С в мин от 150 до 255°С со скоростью 3°С в мин. Для расчета эквивалентной длины цепи использовали изократический режим, температура колонки – 200°С. Газ-носитель – гелий, скорость потока газа – 1 мл/мин. Масс-спектрометр – квадруполь, способ ионизации – электронный удар (EI, энергия ионизации: 70 эВ). Для идентификации пиков метиловых эфиров ЖК использовали стандартные метиловые эфиры (Sigma, США) и метод масс-спектрометрии с использованием библиотеки масс-спектров NIST 05 [27].
Для оценки ненасыщенности ЖК в тканях листьев использовали индекс двойных связей (ИДС): ИДС = ∑Pj n/100, где Pj – содержание ЖК (вес. %) и n – количество двойных связей в каждой кислоте [28]. Также использовали коэффициент ненасыщенности жирных кислот (КН) как отношение суммы ненасыщенных ЖК к сумме насыщенных. Расчетная активность ацил-липидных ∆9-, ∆12- и ω3-десатураз, катализирующих введение двойных связей в алифатические углеродные цепи олеиновой (С18:1), линолевой (С18:2) и линоленовой (С18:3) ЖК, определялась как стеароил-, олеоил- и линолеоил-десатуразные отношения (SDR, ODR, LDR соответственно), рассчитанные на основании содержания отдельных компонентов суммы С18–ЖК [10]:
(1)
${\text{SDR}} = {{({{{\text{С}}}_{{18{\kern 1pt} :{\kern 1pt} 1}}})} \mathord{\left/ {\vphantom {{({{{\text{С}}}_{{18{\kern 1pt} :{\kern 1pt} 1}}})} {{\text{(}}{{{\text{С}}}_{{18{\kern 1pt} :{\kern 1pt} 0}}} + {{{\text{С}}}_{{18{\kern 1pt} :{\kern 1pt} 1}}}{\text{)}}}}} \right. \kern-0em} {{\text{(}}{{{\text{С}}}_{{18{\kern 1pt} :{\kern 1pt} 0}}} + {{{\text{С}}}_{{18{\kern 1pt} :{\kern 1pt} 1}}}{\text{)}}}},$(2)
${\text{ODR}} = {{({{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 2}}} + {{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 3}}})} \mathord{\left/ {\vphantom {{({{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 2}}} + {{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 3}}})} {({{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 1}}} + {{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 2}}} + {{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 3}}}),}}} \right. \kern-0em} {({{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 1}}} + {{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 2}}} + {{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 3}}}),}}$(3)
${\text{LDR}} = {{({{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 3}}})} \mathord{\left/ {\vphantom {{({{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 3}}})} {({{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 2}}} + {{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 3}}}),}}} \right. \kern-0em} {({{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 2}}} + {{{\text{C}}}_{{18{\kern 1pt} :{\kern 1pt} 3}}}),}}$Полученные данные обрабатывались с использованием стандартных пакетов компьютерных программ Microsoft Excel. Эксперименты проводились не менее, чем в трехкратной повторности. Данные табл. 1 и 2 представлены в виде медианы, а разброс значений – в виде интерквартильной широты (25 и 75 процентиль).
Таблица 1.
Состав жирных кислот с mC ≤ 18 из суммарных липидов вегетативных органов яровой пшеницы при абиотических стрессах, % от суммы всех ЖК
| ЖК | ИУК, мкг/мл | ||||
|---|---|---|---|---|---|
| 0 | 5 | 25 | 50 | 100 | |
| N-дефицитные варианты | |||||
| С16:0 | 24.6 | 35.5 | 23.7 | 28.2 | 22.3 |
| [24.2; 25.4] | [34.5; 37.7] | [22.9; 24.5] | [26.2; 29.0] | [19.5; 23.1] | |
| 29.0 | 25.9 | 34.6 | 72.5 | 31.8 | |
| [27.2; 29.6] | [25.4; 26.8] | [32.5; 36.7] | [71.4; 73.3] | [29.6; 32.6] | |
| С18:0 | 9.9 | 15.5 | 11.4 | 17.4 | 10.4 |
| [9.5; 10.1] | [15.0; 16.0] | [11.0; 11.6] | [16.9; 17.7] | [10.1; 10.9] | |
| н/о | 7.5 | 7.9 | н/о | 7.5 | |
| [7.1; 7.9] | [7.2; 8.2] | [7.2; 7.6] | |||
| С16:1 | 5.1 | 4.9 | 3.7 | 3.0 | 5.1 |
| [4.4; 5.4] | [4.6; 5.2] | [2.8; 4.0] | [2.8; 3.7] | [4.9; 5.3] | |
| 19.9 | 16.2 | 14.4 | н/о | 17.4 | |
| [19.0; 20.8] | [15.3; 16.5] | [14.1; 14.5] | [16.3; 17.9] | ||
| C18:1 | н/о | н/о | н/о | н/о | н/о |
| 18.8 | 19.0 | 18.3 | н/о | 18.8 | |
| [18.1; 19.5] | [17.9; 19.7] | [17.7; 18.6] | [18.5; 19.3] | ||
| C18:2 | 2.0 | 14.2 | 1.5 | 10.5 | н/о |
| [1.4; 2.6] | [13.4; 15.0] | [1.1; 1.7] | [10.0; 10.8] | ||
| 16.9 | 10.4 | 10.2 | 26.2 | 6.9 | |
| [16.4; 17.4] | [9.7; 11.1] | [9.5; 10.9] | [25.6; 26.4] | [6.8; 7.6] | |
| C18:3 | 48.3 | 8.7 | 40.7 | 25.7 | 30.6 |
| [47.2; 49.7] | [8.6; 8.8] | [39.5; 41.7] | [25.5; 25.9] | [30.4; 31.8] | |
| н/о | н/о | н/о | н/о | н/о | |
| ∑ | 89.9 | 78.8 | 81.0 | 84.8 | 68.4 |
| [88.5; 91.4] | [78.3; 80.5] | [79.5; 81.3] | [83.5; 85.0] | [66.7; 69.3] | |
| 84.6 | 79.0 | 85.4 | 98.7 | 82.4 | |
| [83.1; 84.9] | [77.6; 79.8] | [83.7; 86.2] | [97.8; 98.9] | [80.0; 83.4] | |
| NO3-варианты | |||||
| С16:0 | 25.5 | 31.3 | 32.1 | 28.7 | 32.6 |
| [24.7; 26.1] | [30.3; 31.6] | [31.4; 32.6] | [28.1; 29.5] | [31.5; 33.4] | |
| 24.5 | 25.6 | 27.6 | 10.9 | 44.1 | |
| [23.8; 24.9] | [24.2; 26.1] | [27.0; 28.3] | [10.3; 11.2] | [43.5; 45.1] | |
| С18:0 | 11.5 | 14.7 | 10.4 | 11.3 | 14.4 |
| [10.8; 11.9] | [14.2; 15.3] | [10.0; 10.6] | [10.8; 11.6] | [13.5; 14.7] | |
| 8.5 | 4.7 | 8.3 | 3.6 | н/о | |
| [8.3; 8.9] | [4.4; 4.8] | [7.7; 8.6] | [3.5; 3.9] | ||
| С16:1 | 3.3 | 3.1 | 2.3 | 2.6 | 1.9 |
| [2.9; 3.6] | [2.7; 3.2] | [2.2; 2.5] | [2.4; 2.7] | [1.8; 2.1] | |
| 10.4 | 13.3 | 8.7 | 5.0 | н/о | |
| [9.4; 10.9] | [12.6; 13.8] | [8.0; 9.4] | [4.5; 5.3] | ||
| C18:1 | н/о | н/о | н/о | н/о | н/о |
| 20.0 | 5.6 | 30.5 | 17.8 | 38.2 | |
| [18.9; 21.1] | [4.9; 6.1] | [29.9; 31.5] | [17.1; 18.9] | [37.7; 39.1] | |
| C18:2 | 2.2 | 16.7 | 21.3 | 10.6 | 18.9 |
| [1.7; 2.6] | [16.3; 17.1] | [20.8; 22.2] | [10.3; 11.1] | [18.4; 19.7] | |
| 16.3 | 15.9 | 9.5 | 11.1 | 7.0 | |
| [15.9; 17.1] | [15.0; 16.3] | [9.1; 10.6] | [10.6; 11.2] | [6.3; 7.5] | |
| C18:3 | 44.8 | 13.3 | 15.5 | 24.4 | н/о |
| [44.4; 45.8] | [12.5; 13.9] | [15.3; 15.9] | [23.4; 24.9] | ||
| н/о | н/о | н/о | н/о | 2.8 | |
| [1.7; 2.9] | |||||
| ∑ | 87.3 | 79.1 | 81.7 | 77.6 | 67.8 |
| [86.1; 88.4] | [77.1; 80.0] | [80.3; 83.2] | [76.1; 78.7] | [66.8; 68.3] | |
| 79.7 | 65.1 | 84.5 | 48.4 | 92.1 | |
| [78.0; 81.2] | [62.3; 65.9] | [83.1; 87.0] | [47.2; 49.3] | [90.6; 93.2] | |
Таблица 2.
Состав ЖКОДЦ из суммарных липидов вегетативных органов яровой пшеницы при абиотических стрессах, % от суммы всех ЖК
| ЖК | ИУК, мкг/мл | ||||
|---|---|---|---|---|---|
| 0 | 5 | 25 | 50 | 100 | |
| N-дефицитные варианты | |||||
| C20:0 | н/о | н/о | н/о | 1.1 | н/о |
| [1.0; 1.2] | |||||
| н/о | н/о | н/о | н/о | 1.5 | |
| [1.4; 1.6] | |||||
| C22:0 | н/о | 1.2 | 1.9 | 3.0 | 1.6 |
| [0.7; 1.7] | [1.6; 2.0] | [2.7; 3.3] | [1.5; 1.7] | ||
| н/о | 0.6 | 1.6 | н/о | 2.1 | |
| [0.5; 0.7] | [1.2; 2.0] | [2.0; 2.2] | |||
| C24:0 | н/о | 1.2 | н/о | н/о | н/о |
| [1.1; 1.5] | |||||
| н/о | н/о | н/о | н/о | 1.0 | |
| [0.8; 1.2] | |||||
| C24:1 | н/о | н/о | 2.1 | 1.1 | н/о |
| [1.6; 2.6] | [1.0; 1.4] | ||||
| н/о | н/о | н/о | н/о | н/о | |
| C22:2 | 1.7 | 1.8 | 3.4 | 3.2 | 1.5 |
| [1.6; 1.8] | [1.5; 1.9] | [2.8; 3.6] | [2.6; 3.6] | [1.3; 1.8] | |
| н/о | н/о | н/о | н/о | н/о | |
| КН | ННЖК | 0.75 | 2.90 | 1.05 | 0.92 |
| – | [0.47; 1.06] | [2.20; 3.88] | [0.80; 1.35] | [0.87; 1.06] | |
| НЖК | НЖК | – | НЖК | ||
| ∑ ЖКОДЦ |
1.7 | 4.2 | 7.4 | 8.4 | 3.1 |
| [1.6; 1.8] | [3.7; 4.7] | [6.4; 7.8] | [8.1; 8.7] | [2.8; 3.5] | |
| н/о | 0.6 | 1.6 | н/о | 4.6 | |
| [0.5; 0.7] | [1.2; 2.0] | [4.2; 5.0] | |||
| NO3-варианты | |||||
| C20:0 | н/о | 2.3 | 1.3 | 3.0 | 4.8 |
| [2.0; 2.5] | [1.2; 1.4] | [2.4; 3.6] | [4.2; 5.1] | ||
| н/о | н/о | н/о | н/о | н/о | |
| C22:0 | н/о | 1.4 | 0.6 | 1.3 | 3.4 |
| [1.3; 1.6] | [0.5; 0.7] | [1.1; 1.6] | [3.3; 3.9] | ||
| н/о | н/о | н/о | н/о | н/о | |
| C22:2 | 2.1 | 2.8 | 1.9 | 1.8 | 4.1 |
| [2.0; 2.2] | [2.5; 3.2] | [1.7; 2.2] | [1.6; 2.2] | [3.5; 4.4] | |
| н/о | н/о | н/о | н/о | н/о | |
| КН | ННЖК | 0.76 | 1.00 | 0.42 | 0.50 |
| [0.69; 0.84] | [0.90; 1.16] | [0.40; 0.47] | [0.43; 0.52] | ||
| – | – | – | – | – | |
| ∑ ЖКОДЦ |
2.1 | 6.5 | 3.8 | 6.1 | 12.3 |
| [2.0; 2.2] | [6.1; 7.0] | [3.6; 4.1] | [5.6; 6.9] | [11.6; 12.8] | |
| н/о | н/о | н/о | н/о | н/о | |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Методом хромато-масс-спектрометрии проанализирован жирнокислотный состав суммарных липидов вегетативных органов проростков яровой пшеницы Triticum aestivum L. (табл. 1). Установлено, что внесение экзогенного ИУК (5–50 мкг/мл) приводит к повышению разнообразия ЖК в вегетативных органах проростков пшеницы. Отмечена зависимость повышения разнообразия ЖК не только от концентрации ИУК, а также от вегетативного органа (лист или корень) и наличия доноров оксида азота (N2, NO3). Разнообразие ЖК в листьях и корнях контрольных образцов N-дефицитных вариантов было ниже (13 и 15 ЖК соответственно), чем в вегетативных органах NO3-вариантов (14 и 24 ЖК соответственно). При внесении ИУК (5–50 мкг/мл) количество ЖК увеличивалось и в NO3-вариантах достигало максимума в листьях 26 ЖК (25 мкг/мл ИУК), а в корнях – 34 ЖК (5 мкг/мл ИУК). Примечательно, что в листьях и корнях при 100 мкг/мл ИУК количество ЖК в N-дефицитных вариантах было выше (26 и 21 ЖК соответственно), чем в NO3-вариантах (22 и 10 ЖК соответственно). Установлено, что для синтеза максимального количества ЖК в корнях пшеницы необходима меньшая концентрация ИУК (5 мкг/мл), чем в листьях (25 мкг/мл). Таким образом, есть основания полагать, что сведения о разнообразии ЖК могут использоваться как для изучения влияния этих параметров на дифференцировку клеток и тканей, так и для ранней диагностики стрессоустойчивости вегетативных органов.
Из результатов, представленных в табл. 1, видно, что длина углеродных цепей ЖК варьирует от 12 до 24 атомов. Значительную часть составляют кислоты с длиной цепи 16 и 18 атомов углерода. В большинстве вариантов проростков с экзогенной ИУК зафиксировано снижение суммарного содержания этих ЖК в листьях и корнях.
Из табл. 1 видно, что пальмитиновая кислота (С16:0) среди насыщенных ЖК занимает доминирующее место, ее содержание в вегетативных органах (лист/корень) контрольных образцов в N-дефицитных вариантах соответствует 24.6/ 29.0%, а в ${\text{NO}}_{3}^{ - }$-вариантах – 25.5/24.5%. Распределение ненасыщенных ЖК в листьях и корнях значительно различается: в листьях доминируют суммарно полиеновые кислоты – α-линоленовая (С18:3) и линолевая (С18:2), а в корнях – моноеновые (олеиновая (С18:1) и пальмитолеиновая (С16:1). В листьях пшеницы отмечено отсутствие олеиновой кислоты, другие ненасыщенные ЖК располагаются в следующий ряд: α-линоленовая кислота, пальмитолеиновая кислота, линолевая кислота. При этом содержание этих ЖК в N-дефицитных вариантах (48.3, 5.1, 2.0%) и в NO3-вариантах (44.8, 3.3, 2.2%) отличается незначительно. В корнях проростков пшеницы отмечено снижение процесса десатурации ненасыщенных ЖК и полное отсутствие триеновой α-линоленовой кислоты в обоих вариантах. Суммарное содержание пальмитолеиновой и олеиновой кислот составило в N-дефицитных вариантах 38.7% и снижается в NO3-вариантах до 30.4%. Содержание диеновой линолевой кислоты в корнях контрольных образцов при отсутствии и наличии минерального азота практически не различается и соответствует 16.9 и 16.3% (табл. 1).
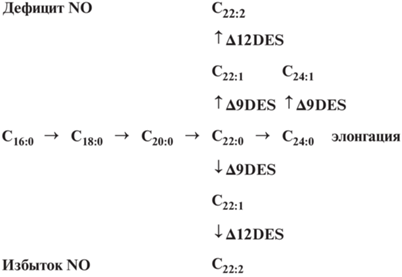
Соотношение насыщенных и ненасыщенных ЖК изменялось при внесении разных концентраций ИУК (табл. 1). Если в контрольных образцах суммарное содержание полиеновых линолевой и α-линоленовой кислот в листьях в N-дефицитных/NO3-вариантах составляло 50.3/47.0%, то при концентрации ИУК 5 мкг/мл происходило резкое снижение до 22.9/30.0%. При концентрации ИУК 25 мкг/мл происходило увеличение суммарного содержания этих ЖК в листьях в N-дефицитных/NO3-вариантах до 42.2/36.8%. Примечательно, что если в отсутствие минерального азота это увеличение происходило в основном за счет возрастания α-линоленовой кислоты до 40.7%, то в присутствии нитратов доли линолевой и α-линоленовой кислоты соответствовали 21.3 и 15.5% (табл.1). В корнях в N-дефицитных и ${\text{NO}}_{3}^{ - }$-вариантов при концентрации 5–50 мкг/мл ИУК происходило снижение содержания пальмитолеиновой кислоты. Известно, что обычно в клеточных мембранах при разных видах стресса увеличивается процентное содержание ненасыщенных ЖК, что делает мембрану более текучей. Исключение составляет солевой стресс, при котором защитные механизмы связаны с увеличением процентного содержания насыщенных ЖК [1]. Более жесткая мембранная структура значительно эффективнее препятствует проникновению солей внутрь клетки [29]. Увеличение суммы насыщенных ЖК в липидах вакуолярной мембраны и понижение показателя ИДС ранее уже были отмечены при окислительном стрессе [1]. Отмеченные изменения жирнокислотного состава, вызванные повышением концентрации ИУК, вероятно приводят к запуску биосинтеза ЖКОДЦ и других метаболитов липидного обмена. ЖКОДЦ, образующиеся в растениях, являются компонентами или предшественниками многочисленных специализированных метаболитов, синтезируемых в отдельных типах клеток [8]. Следует отметить, что к настоящему времени выявлена существенная роль длинноцепочечных жирных кислот в росте и развитии растений, например, показано их участие в контроле клеточного деления [30]. Установлено, что ткани морфогенных каллусов пшеницы имеют более высокое относительное содержание длинноцепочечных жирных кислот (6.8%) по сравнению с неморфогенными (4.4%) и колеоптилями (4.9%). Большая часть этих кислот в каллусах пшеницы сосредоточена во фракции нейтральных липидов. При этом выявлена только одна мононенасыщенная кислота – эйкозеновая (C20:1), содержание которой повышается в тканях каллусов при формировании зон вторичной дифференцировки (от 0.2 до 1.7%) [31]. Представленные в табл. 2 данные показывают, что в контроле обоих вариантов в корнях отсутствовали ЖК с длинной цепи более 20 атомов углерода. Концентрация ЖКОДЦ в сумме ЖК липидов проростков пшеницы зависела не только от вегетативного органа (корень или лист), но и от уровня оксида азота. Примечательно, что в листьях контрольных проростков присутствовала только одна докозадиеновая кислота (С22:2), концентрация которой в NO3-вариантах была в 1.2 раза выше, чем в N-дефицитных вариантах. Насыщенные ЖКОДЦ (C20:0, C22:0, C24:0), содержание которых возрастало (от 0.6 до 4.6) с увеличением концентрации ИУК (5–100 мкг/мл) были зафиксированы только в корнях проростков N-дефицитных вариантов. Ненасыщенные ЖКОДЦ в корнях проростков обоих вариантов не были обнаружены. На основании проведенных исследований предложена гипотетическая схема (рис. 1) влияния уровня оксида азота (NO) на биосинтез ЖКОДЦ в вегетативных органах растений. На схеме видно, что докозадиеновая ЖК (С22:2) является конечным продуктом в биосинтезе ЖКОДЦ как при дефиците, так и при избытке оксида азота.
Рис. 1.
Гипотетическая схема влияния уровня оксида азота (NO) на биосинтез ЖКОДЦ в вегетативных органах растений. ∆9DES – ∆9-десатурация; ∆12DES – ∆12-десатурация. Жирные кислоты: С16:0 – пальмитиновая; С18:0 – стеариновая; C20:0 – арахиновая (эйкозановая); C22:0 – бегеновая (докозановая); C24:0 – лигноцериновая (тетракозановая); C22:1 – эруковая, C24:1 – нервоновая, C22:2 – докозадиеновая.
Выращивание растений в присутствии экзогенного ауксина вызывало изменения в активности ацил-липидных десатураз, степень изменения активности в большей степени зависела от вегетативного органа (табл. 3). Рассчитанные значения десатуразных SDR, ODR, LDR соотношений, характеризующих активность ацил-липидных ∆9-, ∆12- и ω3-десатураз, показали, что в опытных и контрольных вариантах наблюдалось отсутствие активности ∆9-десатуразы в листьях и ω3-десатуразы в корнях. Следует отметить, что величина олеатного десатуразного отношения в листьях проростков в контроле и опыте в N-дефицитных и NO3–-вариантах оставалась на одинаковом уровне (ODR = 1.0). Ранее было высказано предположение, что активность ∆12-десатуразы может служить критерием устойчивости организма к воздействию стрессоров [2, 10]. Повышение концентрации экзогенного ИУК с 5 до 50 мкг/мл приводило к снижению активности ∆12-десатуразы в корнях. При концентрации 100 мкг/мл ИУК в листьях и корнях было отмечено значительное снижение активности этой десатуразы как в N-дефицитном варианте (0.26), так и в NO3-варианте (0.21). Из табл. 3 видно, что суммарная активность ∆9-, ∆12- и ω3-десатураз (LDR + ODR + SDR) в корнях ниже, чем в листьях. Повышение концентрации экзогенного ауксина с 5 до 50 мкг/мл (табл. 3) приводит в основном к повышению суммарной активности десатураз в листьях. В NO3-вариантах активность десатураз в листьях и корнях различается меньше, чем в N-дефицитных вариантах. Можно предположить, что нитраты в вегетативных органах растений через регуляцию концентрации ауксина в тканях контролируют активность ферментов липидного обмена (десатураз и элонгаз).
Таблица 3.
Влияние ауксина на коэффициенты ненасыщенности жирных кислот (КН), индексы двойных связей (ИДС), стеароил-десатуразное (SDR), олеоил-десатуразное (ODR) и линолеил-десатуразное (LDR) отношения в вегетативных органах яровой пшеницы
| Орган | ИУК, мкг/мл | ΣSFA | ΣUFA | КН | ИДС | Десатуразные отношения | |||
|---|---|---|---|---|---|---|---|---|---|
| SDR | ODR | LDR | ΣSOL | ||||||
| N-дефицитные варианты | |||||||||
| Лист | 0 | 42.94 | 57.06 | 1.33 | 1.57 | – | 1.0 | 0.96 | 1.96 |
| Корень | 44.44 | 55.56 | 1.25 | 0.72 | – | 0.47 | – | 0.47 | |
| Лист | 5 | 70.37 | 29.63 | 0.42 | 0.63 | – | 1.0 | 0.38 | 1.38 |
| Корень | 54.47 | 45.53 | 0.84 | 0.56 | 0.72 | 0.36 | – | 1.08 | |
| Лист | 25 | 48.60 | 51.40 | 1.06 | 1.38 | – | 1.0 | 0.96 | 1.96 |
| Корень | 57.18 | 42.82 | 0.75 | 0.53 | 0.70 | 0.36 | – | 1.06 | |
| Лист | 50 | 56.63 | 43.37 | 0.77 | 1.08 | – | 1.0 | 0.71 | 1.71 |
| Корень | 73.78 | 26.22 | 0.36 | 0.52 | – | – | – | – | |
| Лист | 100 | 62.75 | 37.25 | 0.60 | 1.00 | – | – | – | – |
| Корень | 56.91 | 43.09 | 0.76 | 0.50 | 0.71 | 0.26 | – | 0.98 | |
| NO3-варианты | |||||||||
| Лист | 0 | 47.62 | 52.38 | 1.10 | 1.46 | – | 1.0 | 0.95 | 1.95 |
| Корень | 53.29 | 46.71 | 0.88 | 0.63 | 0.7 | 0.45 | – | 1.15 | |
| Лист | 5 | 64.12 | 35.88 | 0.56 | 0.82 | – | 1.0 | 0.44 | 1.44 |
| Корень | 65.24 | 34.76 | 0.53 | 0.51 | 0.55 | 0.74 | – | 1.29 | |
| Лист | 25 | 59.07 | 40.93 | 0.70 | 0.95 | – | 1.0 | 0.42 | 1.42 |
| Корень | 51.39 | 48.61 | 0.95 | 0.58 | 0.79 | 0.24 | – | 1.23 | |
| Лист | 50 | 60.51 | 39.49 | 0.65 | 1.01 | – | 1.0 | 0.70 | 1.70 |
| Корень | 66.20 | 33.80 | 0.51 | 0.45 | 0.83 | 0.43 | – | 1.26 | |
| Лист | 100 | 75.19 | 24.81 | 0.33 | 0.48 | – | 0.20 | – | 0.20 |
| Корень | 51.97 | 48.03 | 0.92 | 0.61 | – | 0.21 | – | 0.21 | |
ЗАКЛЮЧЕНИЕ
При разных видах стрессового воздействия на клетки проростков пшеницы, согласованное функционирование мембранных систем и транспортных механизмов помогает не только поддерживать гомеостаз клеток, но и быстро реагировать на изменения внешней среды. Закономерности изменений в жирнокислотном составе мембран различных вегетативных органов проростков пшеницы при внесении экзогенного фитогормона ауксина имеют сходные черты, выявлено снижение содержания насыщенных и увеличение содержания ненасыщенных жирных кислот. Под воздействием экзогенного ауксина в листьях и корнях проростков происходит снижение индекса ненасыщенности жирных кислот. Распределение ненасыщенных ЖК в листьях и корнях значительно различается: в листьях доминируют полиеновые кислоты (линолевая, α-линоленовая), а в корнях – моноеновые (олеиновая, пальмитолеиновая). При возрастании концентрации экзогенного ауксина до 100 мкг/мл, в клеточных мембранах одновременно происходит снижение суммарного содержания жирных кислот с длиной цепи 16 и 18 атомов углерода и увеличение концентрации жирных кислот с длиной цепи более 20 атомов углерода (ЖКОДЦ). Повышение уровня оксида азота (NO3-варианты) влияет не только на полярное распределение ауксина, но и на повышение содержания ЖКОДЦ в листьях проростков пшеницы (до 12.3%). Наибольшая активность ∆9- и ∆12-десатураз при синтезе ненасыщенных ЖКОДЦ в листьях отмечена при 25 мкг/мл ИУК. Таким образом, можно сделать заключение о том, что оксид азота координирует распределение в вегетативных органах фитогормона ауксина, который контролирует активность десатураз и жирнокислотный состав клеточных мембран растений. Вероятно, что биосинтез докозадиеновой кислоты (С22:2) в листьях является одним из ключевых этапов в формировании адаптивного ответа клеточных мембран на воздействие абиотических стрессов при онтогенезе растений.
Благодарности. Автор признательна сотрудникам аналитической лаборатории ИЭГМ УрО РАН В.А. Гусеву, Н.П. Шерстобитовой, М.А. Шишкину за идентификацию метиловых эфиров жирных кислот.
Конфликт интересов. Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена в рамках государственного задания (№ госрегистрации темы НИОКТР АААА-А19-119112290008-4) с использованием оборудования ЦКП “Исследование материалов и веществ” ПФИЦ УрО РАН (г. Пермь).
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Озолина Н.В., Гурина В.В., Нестеркина И.С., Дударева Л.В., Катышев А.И., Нурминский В.Н. 2017. Жирнокислотный состав общих липидов вакуолярной мембраны при абиотическом стрессе. Биол. мембраны. 34 (1), 63–69.
Дёмин И.Н., Нарайкина Н.В., Цыдендамбаев В.Д., Мошков И.Е., Трунова Т.И. 2008. Введение гена desA Δ12-ацил-липидной десатуразы цианобактерий повышают устойчивость растений картофеля к окислительному стрессу, вызванному гипотермией. Физиол. растений. 55 (5), 710–720.
Макаренко С.П., Дударева Л.В., Катышев А.И., Коненкина Т.А., Назарова А.В., Рудиковская Е.Г., Соколова Н.А., Черникова В.В., Константинов Ю.М. 2010. Влияние низких температур на жирнокислотный состав контрастных по холодоустойчивости видов злаков. Биол. мембраны. 27 (6), 482–488.
Zemanova V., Pavlik M., Kyjakova P., Pavlikova D. 2015. Fatty acid profiles of ecotypes of hyperaccumulator Noccaea caerulescens growing under cadmium stress. J. Plant Physiol. 180, 27–34.
Dat J., Vandenabeele S., Vranjva E., van Montagu M., Inze D., van Breusegem F. 2000. Dual action of the active oxygen species during plant stress responses. Cell Mol. Life Sci. 57, 779–795.
He M., Ding N.-Z. 2020. Plant unsaturated fatty acids: Multiple roles in stress response. Front. Plant Sci. 11, 562785.
Лось Д.А. 2014. Десатуразы жирных кислот. М.: Научный мир, 372 с.
Берестовой М.А., Павленко О.С., Голденкова-Павлова И.В. 2019. Десатуразы жирных кислот растений: роль в жизнедеятельности растений и биотехнологический потенциал. Успехи соврем. биологии. 139 (4), 338–351.
Лось Д.А. 1997. Десатуразы жирных кислот: адаптивная экспрессия и принципы регуляции. Физиол. растений. 44 (4), 528–540.
Нарайкина Н.В., Пчелкин В.П., Цыдендамбаев В.Д., Трунова Т.И. 2020. Изменения в жирнокислотном составе и в содержании липидов листьев картофеля при низкотемпературном закаливании: роль Δ12-ацил-липидной десатуразы. Физиол. растений. 67 (2), 149–156.
Corpas F.J., del Río L.A., Barroso J.B. 2007. Need of biomarkers of nitrosative stress in plants. Trends in Plant Science. 12, 436–438.
Gupta K.J., Mur L.A.J., Wany A., Kumari A., Fernie A.R., Ratcliffe R.G. 2020. The role of nitrite and nitric oxide under low oxygen conditions in plants. New Phytologist. 225 (3), 1143–1151.
Gupta K.J., Hancock J.T., Petrivalsky M., Kolbert Z., Lindermayr C., Durner J., Barroso J.B., Palma J.M., Brouquisse R., Wendehenne D., Corpas F. J., Loake G.J. 2020. Recommendations on terminology and experimental best practice associated with plant nitric oxide research. New Phytologist. 225 (5), 1828–1834.
Hancock J.T., Veal D. 2021. Nitric oxide, other reactive signalling compounds, redox, and reductive stress. J. Experim. Botany. 72(3), 819–829.
Викторова Л.В., Максютова Н.Н., Трифонова Т.В., Андрианов В.В. 2010. Образование пероксида водорода и оксида азота при введении нитрата и нитрита в апопласт листьев пшеницы. Биохимия. 75 (1), 117–124.
Никерова К.М., Галибина Н.А. 2017. Влияние нитратного азота на пероксидазную активность в тканях Betula pendula Roth var. pendula и B. pendula var. carelica (Mercklin). Сибирский лесной журнал. 1, 15–24.
Freschi L. 2013. Nitric oxide and phytohormone interactions: Current status and perspectives. Front. Plant Sci. 4, 398.
Жигачева И.В., Бурлакова Е.Б. Мишарина Т.А., Теренина М.Б., Крикунова Н.И., Генерозова И.П., Шугаев А.Г., Фаттохов С.Г. 2013. Жирнокислотный состав липидов мембран и энергетика митохондрий проростков гороха в условиях дефицита воды. Физиол. растений. 60 (2), 205−213.
Жуков А.В. 2018. Жирные кислоты с очень длинной цепью в составе мембранных липидов растений. Физиол. растений. 65 (6), 418–437.
Попов В.Н., Антипина О.В., Пчелкин В.П., Цыдендамбаев В.Д. 2012. Изменения содержания и жирнокислотного состава липидов листьев и корней табака при низкотемпературном закаливании. Физиол. растений. 59 (2), 203−208.
Макаренко С.П., Коненкина Т.А., Хотимченко С.В. 2007. Жирнокислотный состав липидов вакуолярных мембран корнеплодов. Физиол. растений. 54 (2), 223–228.
Zheng H., Rowland O., Kunst L. 2005. Disruptions of the Arabidopsis Enoil-CoA reductase gene reveal an essential role for very-long-chain fatty acid synthesis in cell expansion during plant morphogenesis. Plant Cell.17 (5), 1467−1481.
Roudier F., Gissot L., Beaudoin F., Haslam R., Michaelson L., Marion J., Molino D., Lima A., Bach L., Morin H.,Tellier F., Palauqui J.-C., Bellec Y., Renne C., Miquel M., DaCosta M., Vignard J., Rochat C., Markham J.E., Moreau P., Napier J., Faure J.-D. 2010. Very-long-chain fatty acids involved in polar auxin transport and developmental patterning in Arabidopsis. Plant Cell. 22 (2), 364−375.
Petrášek J., Friml J. 2009. Auxin transport routes in plant development. Development. 136 (16), 2675–2688.
Krouk G. 2016. Hormones and nitrate: A two-way connection. Plant Mol. Biol. 91 (6), 599–606.
Нетрусов А.И., Егорова М.А., Захарчук Л.М., Колотилова Н.Н, Котова И.Б., Семенова Е.В., Татаринова Н.Ю., Уголькова Н.В., Цавкелова Е.А., Бобкова А.Ф., Богданов А.Г., Данилова И.В., Динареева Т.Ю., Зинченко В.В., Исмаилов А.Д., Кураков А.В., Максимов В.Н., Милько Е.С., Никитина Е.П., Рыжкова Е.П., Семенов А.М., Хомякова Д.В., Чердынцева Т.А., Юдина Т.Г. 2005. Практикум по микробиологии. М.: Издательский центр “Академия”, 608 с.
Dobson G., Christie W.W. 2002. Mass spectrometry of fatty acid derivatives. Eur. J. Lipid Sci. Tech. 104, 36–43.
Christie W.W. 1988. Equivalent chain lengths of methyl ester derivatives of fatty acids on gas chromatography: A reappraisal. J. Chromatogr. 447, 305–314.
Wu J., Seliskar D., Gallagher J. 2005. The response of plasma membrane lipid composition in callus of the halophyte Spartina patens (Poaceae) to salinity stress. Am. J. Bot. 92 (5), 852–858.
Nobusawa T., Umeda M. 2012. Very-long-chain fatty acids have an essential role in plastid division by controlling Z-ring formation in Arabidopsis thaliana. Genes Cells. 17 (8), 709–719.
Дударева Л.В., Рудиковская Е.Г., Ланкевич С.В. 2016. Липидный и жирнокислотный состав морфогенных и неморфогенных каллусов пшеницы Triticum aestivum L. Биол. мембраны. 33 (2), 133–139.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


