Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 1, стр. 66-70
Таргетные липосомы, нагруженные ДНК-миметиками, для направленной элиминации опухолевых клеток
Е. И. Шрамова a, *, Г. М. Прошкина a, С. М. Деев a, b
a Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
b Первый Московский государственный медицинский университет
им. И.М. Сеченова Минздрава России (Сеченовский университет)
119991 Москва, Россия
* E-mail: shramova.e.i@gmail.com
Поступила в редакцию 01.09.2022
После доработки 28.09.2022
Принята к публикации 05.10.2022
- EDN: NTWQTL
- DOI: 10.31857/S0233475523010097
Аннотация
В работе представлен инновационный метод направленной элиминации опухолевых клеток определенного молекулярного профиля путем инактивации транскрипции генов общих субъединиц ядерных ДНК-зависимых РНК-полимераз человека. Для инактивации генов общих субъединиц РНК-полимераз использовали комплементарные им ДНК-миметики, которые доставляли к клеткам в составе липосом, модифицированных по внешней поверхности адресными молекулами. Было показано, что инактивация генов общих субъединиц РНК-полимераз Rpb5, Rpb6 или Rpb8 в зависимости от выбранной мишени вызывает гибель до 50% HER2- положительных клеток рака молочной железы человека в культуре.
ВВЕДЕНИЕ
Проблема поиска новых высокотехнологичных подходов к терапии злокачественных новообразований особенно остро стоит на фоне ежегодного прироста новых случаев онкологических заболеваний и увеличения летальных исходов. Несмотря на значительные успехи в усовершенствовании методов лечения рака, не существует надежных универсальных подходов, позволяющих одновременно элиминировать первичный узел и отдаленные метастазы, зачастую оказывающиеся более устойчивыми к терапии. Наряду с эффективностью разрабатываемых препаратов важную роль играет избирательность доставки терапевтического агента к клеткам-мишеням с целью снижения общей токсической нагрузки на организм. Нами предлагается метод направленной элиминации опухолевых клеток путем инактивации транскрипции генов общих субъединиц ядерных ДНК-зависимых РНК-полимераз человека. Инактивация генов общих субъединиц РНК-полимераз осуществляется комплементарными им ДНК-миметиками, которые доставляются к клеткам определенного молекулярного профиля в составе липосом. Избирательность доставки осуществляется модификацией липосом по внешней поверхности адресными модулями неиммуноглобулиновой природы.
Известно, что ядра всех эукариотических организмов содержат три формы ядерных ДНК-зависимых РНК-полимераз, которые обладают общей структурной организацией и отвечают за транскрипцию разных наборов генов [1, 2]. Отличительной чертой ядерных РНК-полимераз является наличие пяти незаменимых общих субъединиц, входящих в состав всех трех ферментов [3–5]. Таким образом, если в раковой клетке подавить экспрессию генов, кодирующих хотя бы одну из пяти общих субъединиц, то, теоретически, удастся лишить клетку всего транскрипционного аппарата.
Антисмысловая терапия (antisense therapy) представляет собой метод лечения, основанный на выключении/остановке синтеза белка, участвующего в патогенезе заболевания, путем ингибирования трансляции его мРНК с помощью комплементарных коротких нуклеотидных последовательностей (антисмысловых олигонуклеотидов, АО). В последние годы антисмысловая технология стала одной из многообещающих стратегий лечения рака [6]. Различные гены, известные как ключевые регуляторы апоптоза, клеточного роста, метастазирования и ангиогенеза, с различным успехом были исследованы в качестве молекулярных мишеней для антисмысловой терапии.
Основываясь на принципе антисмысловой терапии, для подавления экспрессии генов общих субъединиц РНК-полимераз нами был осуществлен дизайн ДНК-миметиков на основе тиофосфатных олигонуклеотидов, содержащих на 5'- и 3'-концах по два или три “защелкнутых” рибонуклеотида (Locked Nucleic Acid, LNA). Тиофосфатные олигонуклеотиды широко используются в антисенсовой биотехнологии как регуляторы экспрессии генов [7–9], поскольку обладают повышенной устойчивостью к действию клеточных нуклеаз и повышенным сродством к ДНК- и РНК-мишеням.
Ранее в нашей лаборатории была разработана методика синтеза адресных моноламеллярных липосом диаметром 100 нм, нагруженных цитотоксическими белковыми компонентами [10, 11]. Применение данной методики для загрузки липосом ДНК-миметиками позволило получить адресные липосомы, содержащие большое количество молекул АО, оказывающих избирательный цитотоксический эффект в отношении HER2+ клеток in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Анализ последовательностей вариантов транскриптов общих субъединиц ядерных ДНК-зависимых РНК-полимераз Rpb5, Rpb6 и Rpb8, доступных в базе данных NCBI (https://www.ncbi. nlm.nih.gov), проводили с помощью программы Blast (https://blast.ncbi.nlm.nih.gov/ Blast.cgi). Последовательности для синтеза модифицированных олигонуклеотидов (20–22 п.о.) выбирали в областях, консервативных для всех имеющихся в базе данных изоформ какой-либо субъединицы. Выбранную последовательность скринировали на уникальность в геноме человека. Синтез тиофосфатных олигонуклеотидов с концевыми LNA-нуклеотидами (ТФ-LNA) и с цианиновой меткой на 5'-конце заказывали на фирме Синтол (Москва, Россия).
Для приготовления липосом использовали суспензию фосфолипидов сои, содержащую 40% L-α-фосфатидилхолина (Avanti Polar Lipids, США), с конечной концентрацией 4 г/л. ТФ-LNA растворяли в воде до конечной концентрации 100 пмоль/мкл. Загрузку проводили в присутствии 150 мМ KCl в 20 мМ калий-фосфатном буфере при pH 7.5. Смесь фосфолипидов и ТФ-LNA подвергали 5-кратной процедуре замораживания при температуре –150°С и оттаивания, после чего многократно (19 раз) продавливали через 100-нм фильтр с помощью экструдера, получая липосомы со средним размером 100 нм. Для устранения невключившегося ДНК-миметика проводили хроматографию на колонке CL-2B в том же буфере.
Наработку адресного модуля DARPin_9-29 для конъюгации с поверхностью липосом осуществляли в бактериальной системе экспрессии (штамм Escherichia coli BL21(DE3)) методом автоиндукции с последующей очисткой белка с помощью металл-хелатной аффинной хроматографии, как было описано нами ранее [10]. Функционализацию ТФ-LNA-нагруженных липосом адресным модулем осуществляли согласно ранее разработанному протоколу [10].
Размер и поверхностный заряд загруженных липосом определяли методом динамического и электрофоретического светорассеяния с использованием анализатора Zetasizer Nano ZS (Malvern Instruments Ltd., Великобритания). Для расчета количества молекул ТФ-LNA, включившихся в состав одной липосомы, использовали метод, описанный в работе [10]. Вычисления проводили, используя спектр поглощения липосом, коэффициент молярной экстинкции для Cy5.5 (~250 000 М–1см–1). Концентрацию ненагруженных липосом, используемых в работе, в суспензии 1 мг/мл считали равной 1.1 нМ [10].
Клетки рака молочной железы человека BT-474 (ATCC HTB-20), гиперэкспрессирующие рецептор HER2, и MDA-MB-231 (ATCC HTB-26) c уровнем экспрессии HER2, характерным для нормальных эпителиальных тканей, растили в среде RPMI 1640 (ПанЭко, Россия), содержащей 10% эмбриональной бычьей сыворотки (Gibco, Германия), 2 мМ L-глутамин и антибиотики пенициллин (50 ед/мл), стрептомицин (50 мкг/мл) (ПанЭко), при 37°C в атмосфере 5% CO2 и повышенной влажности.
Цитотоксическое действие липосомальных препаратов ДНК-миметиков оценивали с помощью стандартного МТТ-теста [12]. Измерение оптического поглощения растворенного формазана на длине волны 570 нм проводили на планшетном спектрофотометре Infinite M1000 (Tecan, Швейцария). Относительную жизнеспособность клеток рассчитывали делением значения поглощения на 570 нм на величину поглощения, измеренную для контрольных клеток, инкубировавшихся в тех же условиях в отсутствие токсических препаратов. Все эксперименты были выполнены в трех повторах.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В качестве мишени для подавления экспрессии генов общих субъединиц РНК-полимераз были выбраны гены субъединиц Rpb5, Rpb6, Rpb8 РНК-полимераз I-III. На основе анализа изоформ генов общих субъединиц, доступных в PubMed, были выбраны последовательности ДНК, отвечающие двум условиям: 1) последовательность консервативна для всех изоформ какой-либо субъединицы РНК-полимераз; 2) последовательность уникальна для генома человека. Сконструированные последовательности АО представлены в табл. 1. АО загружали в липосомы, внешняя поверхность которых содержала HER2-специфичный модуль на основе белка с анкириновыми повторами DARPin_9-29 (Designed Ankyrin Repeat Protein), являющимся инновационным полипептидом неиммуноглобулинового скаффолда и обладающим высокой аффинностью к субдомену I рецептора HER2 [13]. Гидродинамический размер липосом, загруженных ТФ-LNA и функционализированных DARPin_9-29, и ζ-потенциал составляли около 105 нм и –30 мВ соответственно. Для расчета количества молекул ТФ-LNA, включившихся в состав одной липосомы, использовали спектры поглощения липосомальных препаратов и метод, описанный в работе [10]. Было установлено, что среднее количество молекул ТФ-LNA, включившихся в одну липосому, составило около 880 молекул (табл. 1).
Таблица 1.
Характеристики использованных в работе тиофосфатных олигонуклеотидов с концевыми LNA-нуклеотидами (ТФ-LNA)
| Название | Последовательность | Общая субъединица | Гидродинамический размер нагруженных липосом, нм | ζ-потенциал, мВ | Расчетное количество молекул ТФ-LNA, включившихся в одну липосому |
|---|---|---|---|---|---|
| Rpb5.1 | 5'Cy5.5-mCsTscstsgsgsasasasastscscsgscsasasgsAsCm | Rpb5 | 95 ± 19 | –28.2 ± 1.3 | ~829 |
| Rpb5.2 | 5’Cy5.5-mCsTsmCstsgsgsasasasastscscsgscsasasGsAsCm | Rpb5 | 97 ± 17 | –27.8 ± 1.4 | ~960 |
| Rpb6.1 | 5'Cy5.5-mCsGsasgscsgsasgscscscsgscsgstsgscstsgsgsGsmC | Rpb6 | 102 ± 24 | –32.6 ± 0.6 | ~770 |
| Rpb6.2 | 5'Cy5.5-mCsAsGsmcsgsgsgsgstscsgscstsgsasgsgscsgsAsGsG | Rpb6 | 108 ± 25 | –34.5 ± 0.8 | ~1060 |
| Rpb8.1 | 5'Cy5.5-mCsCsсscststscstsgscstsgscstscstscsgstsgsGsCm | Rpb8 | 105 ± 27 | –30.7 ± 1.2 | ~800 |
| Rpb8.2 | 5'Cy5.5-mCsCstsgsasgstsgsgscsasgscscsgscstscststsGsCm | Rpb8 | 117 ± 31 | –29.8 ± 0.8 | ~880 |
Оценку цитотоксического действия адресных липосом, нагруженных ТФ-LNA, проводили методом стандартного МТТ-теста (рис. 1). Стартовая концентрация адресных липосом составляла 300 нМ. Оказалось, что при максимальной концентрации адресных липосом, нагруженных ТФ-LNA, специфически связывающимися с общей субъединицей Rpb5, ТФ-LNARpb5.1 и ТФ-LNARpb5.2, цитотоксический эффект для клеток BT-474 с высоким уровнем экспрессии рецепторов HER2, составил ~31 и 20% соответственно. Эти же липосомы вызывали гибель соответственно лишь ~8 и 5% клеток MDA-MB-231 с нормальным уровнем экспрессии HER2. Для липосом, нагруженных ТФ-LNA, специфичных к общей субъединице Rpb6, цитотоксический эффект для гиперэкспрессирующих HER2 клеток BT-474, составил ~49% для ТФ-LNARpb6.1 и 51% ТФ-LNARpb6.2, а для клеток MDA-MB-231 цитотоксический эффект оказался на уровне ~9 и 10% соответственно. Цитотоксическое действие в отношении клеток BT-474 адресных липосом, нагруженных ТФ-LNARpb8.1 и ТФ-LNARpb8.2, составило около 48 и 53%, для клеток MDA-MB-231 ~10 и 12% соответственно. Отметим, что ненагруженные липосомы не оказывали на клетки цитотоксического действия, что было показано нами ранее [10, 11].
Рис. 1.
Цитотоксическое действие адресных липосом, нагруженных специфичными к различным общим субъединицам РНК-полимераз ТФ-LNA, в отношении HER2+ клеток BT-474 и HER2– клеток MDA-MB-231. Названия липосом соответствуют номеру загруженных ТФ-LNA из табл. 1: 5.1 – LipRpb5.1, 5.2 – LipRpb5.2, 6.1 – LipRpb6.1, 6.2 – LipRpb6.2, 8.1 – LipRpb8.1, 8.2 – LipRpb8.2. Смесь — содержит смесь ТФ-LNA 6.2 и 8.2.
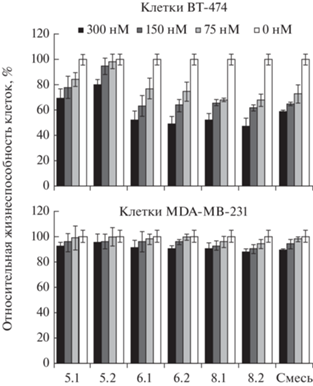
Также было исследовано сочетанное цитотоксическое действие смеси эквимолярных количеств адресных липосом, нагруженных ТФ-LNA, комплементарных участкам разных общих субъединиц РНК-полимераз. Для загрузки были выбраны ТФ-LNA, оказавшие максимальное токсическое воздействие на HER2+ клетки в отдельности. Результаты МТТ-теста приведены на рис. 1 (столбец “Смесь”). Было показано, что при максимальной концентрации адресных липосом, нагруженных смесью ТФ-LNARpb6.2 и ТФ-LNARpb8.2, цитотоксический эффект для клеток ВТ-474 составил 42 и 11% для клеток MDA-MB-231.
Достигнутый цитотоксический эффект в отношении HER2+ клеток позволяет предположить перспективность предлагаемого подхода. Наиболее подходящими мишенями для ингибирования транскрипции оказались общие субъединицы Rpb6 и Rpb8. При этом оптимизация последовательностей ТФ-LNA может внести вклад в возрастание цитотоксического воздействия. Однако факт, что усиление эффекта от смешивания адресных липосом, нагруженных смесью ТФ-LNA к разным мишеням, не наблюдалось, может говорить об активации клетками “запасных путей” поддержания транскрипции на уровне, необходимом для жизнеобеспечения клетки. Поэтому более эффективным может оказаться сочетанное воздействие предлагаемых липосом с известными токсическими веществами другого механизма действия [14, 15].
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Источник финансирования. Работа выполнена при финансовой поддержке гранта Министерства науки и высшего образования Российской Федерации, соглашение № 075-15-2021-1049.
Соответствие принципам этики. Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Список литературы
Werner F., Grohmann D. 2011. Evolution of multisubunit RNA polymerases in the three domains of life. Nat. Rev. Microbiol. 9, 85–98.
Cuevas-Bermúdez A., Martínez-Fernández V., Garrido-Godino A.I., Navarro F. 2017. Subunits common to RNA polymerases. In: The Yeast Role in Medical Applications. Ed Abdulkhair W. M. H. London: IntechOpen, p. 151–165. https://doi.org/10.5772/intechopen.70936
Zaros C., Briand J.F., Boulard Y., Labarre-Mariotte S., Garcia-Lopez M.C., Thuriaux P., Navarro F. 2007. Functional organization of the Rpb5 subunit shared by the three yeast RNA polymerases. Nucl. Acids Research. 35 (2), 634–647.
Garrido-Godino A.I., Garcia-Lopez M.C., Navarro F. 2013. Correct assembly of RNA polymerase II depends on the foot domain and is required for multiple steps of transcription in Saccharomyces cerevisiae. Mol. Cell. Biol. 33, 3611–3626.
Woychik N.A., Liao S.-M., Kolodziej P.A., Young R.A. 1990. Subunits shared by eukaryotic nuclear RNA polymerases. Genes Dev. 4, 313–323.
Stahel R.A., Zangemeister-Wittke U. 2003. Antisense oligonucleotides for cancer therapy-an overview. Lung Cancer. 41 (Suppl 1), S81–S88.https://doi.org/10.1016/s0169-5002(03)00147-8
Cohen J.S. 1993. Phosphorothioate oligonucleotides. In: Antisense Research and Applications. Eds Crooke S.T., Lebleu B. Florida: CRC Press, p. 205–223.
Wengel J. 2001. LNA (locked nucleic acid). In: Antisense Drug Technology; Principles, Strategies, and Applications. Ed. Crooke, S.T. New York: Marcel Dekker, p. 339–357.
Hagedorn P.H., Persson R., Funder E.D., Albæk N., Diemer S.L., Hansen D.J., Møller M.R., Papargyri N., Christiansen H., Hansen B.R., Hansen H.F., Jensen M.A., Koch T. 2018. Locked nucleic acid: Modality, diversity, and drug discovery. Drug Discov. Today. 23 (1), 101–114.
Deyev S., Proshkina G., Baryshnikova O., Ryabova A., Avishai G., Katrivas L., Giannini C., Levi-Kalisman Y., Kotlyar A. 2018. Selective staining and eradication of cancer cells by protein-carrying DARPin-functionalized liposomes. Eur. J. Pharm. Biopharm. 130, 296–305.
Shramova E.I., Shilova M.V., Ryabova A.V., Dzhalilova D.S., Zolotova N.A., Telegin G.B., Deyev S.M., Proshkina G.M. 2021. Barnase*Barstar-guided two-step targeting approach for drug delivery to tumor cells in vivo. J. Control. Release. 340, 200–208. https://doi.org/10.1016/j.jconrel.2021.11.001
Mosmann T. 1983. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. J. Immunol. Methods. 65 (1–2), 55–63.
Steiner D., Forrer P., Plückthun A. 2008. Efficient selection of DARPins with sub-nanomolar affinities using SRP phage display. J. Mol. Biol. 382 (5), 1211–1227. https://doi.org/10.1016/j.jmb.2008.07.085
Shilova O., Shramova E., Proshkina G., Deyev S. 2021. Natural and designed toxins for precise therapy: Modern approaches in experimental oncology. Int. J. Mol. Sci. 22 (9), 4975. https://doi.org/10.3390/ijms22094975
Tolmachev V.M., Chernov V.I., Deyev S.M. 2022. Targeted nuclear mediine. Seek and destroy. Russ. Chem. Rev. 91, RCR5034. https://doi.org/10.1070/RCR5034
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


