Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 2, стр. 83-91
Влияние наночастиц перфторуглеродов на кровь как клеточную систему
И. Н. Кузнецова a, *, А. Ю. Лянгузов b
a Российский научно-исследовательский институт гематологии и трансфузиологии
Федерального медико-биологического агентства
191024 Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: kuz-ir@inbox.ru
Поступила в редакцию 24.03.2022
После доработки 09.09.2022
Принята к публикации 13.09.2022
- EDN: CNUXXW
- DOI: 10.31857/S0233475523010061
Аннотация
Рассмотрено влияние наночастиц перфторуглеродов (ПФУ) на функционирование клеток крови. Показано, что эмульгированные наночастицы ПФУ в малых объемах влияют на газотранспортную функцию крови, увеличивая скорость диффузии кислорода от эритроцитов к тканям. Обнаружено, что наночастицы ПФУ оказывают влияние и на состояние клеток крови (эритроциты, лейкоциты, тромбоциты) дозозависимым способом. Предполагается, что в зависимости от дозы эмульсии, т.е. плотности наночастиц в окружающем пространстве клеток, реакция рецепторного аппарата может вызвать активацию или ухудшение их функционирования.
ВВЕДЕНИЕ
Наночастицы на основе перфторуглеродов (ПФУ) и фосфолипидов (ФЛ) являются активным началом эмульсионных препаратов, которые рассматривают как кровезаменители, способные переносить кислород. Создание инфузионных сред данного типа является социально значимой задачей, решение которой позволит снизить потребность в донорской крови, особенно в условиях критических ситуаций. Создание и изучение сред данного типа было начато в 60–70 гг. прошлого века. За сравнительно небольшой срок, к началу следующего тысячелетия, проблема прошла несколько этапов: от выбора объекта исследования (ПФУ, эмульгаторы) и решения ряда технологических вопросов получения эмульсий до создания эмульсионных препаратов и их изучения в эксперименте и клинике.
В табл. 1 приведены сводные данные по составу препаратов, разрешенных к клиническому применению, представленные в работе [1] (расшифровка названий ПФУ см. в примечании к табл. 1).
Таблица 1.
Состав препаратов Флюосол-ДА (Япония), Перфторан (Россия), Оксигент (США) [1]
| Составные части препаратов | Флюосол ДА | Перфторан | Оксигент | ||
|---|---|---|---|---|---|
| AF0104 | AF0143 | AF0144 | |||
| концентрация, % вес/объем | |||||
| ПФД | 14 | 13 | – | – | – |
| ПФТПА | 6 | – | – | – | – |
| ПМЦП | – | 6.5 | – | – | – |
| ПФОБ | – | – | 90 | 87 | 58 |
| ПФДБ | – | – | – | 3 | 2 |
| Плюроник F-68 (проксанол-268) | 2.72 | 4 | – | – | – |
| Фосфолипиды | 0.4 | – | 4 | 5.4 | 3.6 |
| Калия олеат | 0.032 | – | – | – | – |
| Буфер | ${\text{СО}}_{3}^{{2 - }}$ | ${\text{СО}}_{3}^{{2 - }}$ | ${\text{РО}}_{4}^{{3 - }}$ | ${\text{РО}}_{4}^{{3 - }}$ | ${\text{РО}}_{4}^{{3 - }}$ |
| Двухвалентные катионы | + | + | – | – | – |
Для первых двух препаратов к перфтордекалину (ПФД), составляющему большую часть масляной фазы, введены добавки перфторированных соединений ПФТПА и ПФМЦП, более высококипящих и менее растворимых в воде. В качестве эмульгатора для Флюосола и Перфторана использован водорастворимый плюроник F-68 или проксанол 268 соответственно. По физико-химическим свойствам препараты незначительно отличаются друг от друга. Их общий недостаток заключается в необходимости хранения в замороженном состоянии из-за недостаточной стабильности. В случае препарата Оксигент к его фторуглеродной основе ПФОБ добавлен ПФДБ, который имеет более высокую температуру кипения и менее растворим в воде. Преимуществом препарата Оксигент является возможность его хранения в незамороженном состоянии. Кроме того, ПФОБ быстро выводится из организма, примерно с той же скоростью, что и ПФД. Для всех ПФУ характерно отсутствие химической связи с газами крови. Различия эмульсионных препаратов, наряду с ПФУ-фазой, касаются в основном водно-солевого состава. Однако до настоящего времени ни один из названных препаратов (табл. 1) не вышел на рынок лекарственных средств, предназначенных для внутривенного введения.
Общей причиной неудач разработчиков и исследователей этих препаратов является наличие побочных реакций системного характера (реактогенность) разной степени тяжести и выраженности [2–4]. Причиной проявления реактогенности является активация системы комплемента [5, 6]. Комплемент – это сложно организованная система белковых агрегатов. Его активация вызывает изменения в микроциркуляторном звене, нарушает процессы тромбоцитарного и коагуляционного гомеостаза и оказывает влияние на функциональную активность и кооперацию клеток [7]. Причины проявления реактогенности эмульсионных препаратов при введении их пациентам до конца не установлены.
Согласно документам фармкомитета, предусмотрена оценка эффективности и безвредности препарата в условиях целостного организма.
По отношению к целому организму наночастицы эмульгированных ПФУ выступают как “биоматериал”. Биоматериал рассматривается как “нежизнеспособное вещество, используемое для взаимодействия с биологической системой в медицинских целях” [8]. Исследования таких взаимодействий с биологической системой требуют развития новых методологических подходов для создания эффективных инфузионных сред на основе ПФУ. Реальные условия применения эмульсий ПФУ в клинике предполагают совместную циркуляцию частиц ПФУ с большим количеством эритроцитов, поэтому функциональную активность эмульсий необходимо рассматривать в связи с газотранспортными и другими функциональными свойствами крови.
Отсюда вытекает постановка двух вопросов. Во-первых, каковы должны быть свойства наночастиц как биоматериала для доставки газов тканям при совместной циркуляции с кровью. Во-вторых, каким образом можно оценить взаимодействие биоматериала на основе ПФУ с кровью. Сложная организация крови как клеточной системы предполагает поэтапное изучение влияния наночастиц на функции клеток крови в модельных условиях in vitro. Анализ этих взаимодействий позволит оценить биологическую активность наночастиц, используемых для создания новых ПФУ-биопрепаратов.
В настоящем обзоре рассмотрены следующие вопросы:
– особенности газотранспортных свойств наночастиц в смешанной системе кровь/наночастицы эмульгированных ПФУ (эмульсия), а также методы контроля стабильности их структуры, т.е. качества ПФУ-препаратов;
– влияние наночастиц ПФУ на физиологический процесс доставки газов эритроцитами;
– анализ влияния наночастиц в различных дозах на морфофункциональные показатели клеток крови (эритроцитов, нейтрофилов, тромбоцитов);
– теоретическое обоснование и практическая значимость предложенных методических подходов.
ОСОБЕННОСТИ ГАЗОТРАНСПОРТНЫХ СВОЙСТВ НАНОЧАСТИЦ ПФУ ПРИ ЦИРКУЛЯЦИИ В УСЛОВИЯХ in vivo
ПФУ, используемые для медико-биологических целей – это прозрачные жидкости, по удельному весу в 2 раза тяжелее воды, практически не растворимые в воде и и плохо растворимые в других растворителях. Для использования в качестве инфузионной среды их диспергируют в водном эмульгирующем растворе ПАВ. Дисперсные наночастицы ПФУ представляют двухслойный шар, в центре которого находится жидкий ПФУ, а на его поверхности – структурно-механический барьер ПАВ, который обеспечивает стабильность частиц [9]. Толщина оболочки ПАВ составляет 5–10% от размера частиц [9, 10]. В настоящее время перспективным эмульгатором в составе ПФУ-препарата принято считать природные фосфолипиды (ФЛ), использование которых обеспечивает тепловую стерилизацию конечной лекарственной продукции препарата (требование GMP). Для частиц размером 100–200 нм толщина фосфолипидной оболочки будет сопоставима с размером бислойных мембран [11].
Из-за отсутствия химической связи “ПФУ ↔ О2 и СО2” частицы при внутривенном введении сохраняют способность к транспорту газов при обязательном сохранении своей корпускулярной природы. Способность к доставке газов частицами при совместной циркуляции с эритроцитами определяется временем их пребывания в сосудистом русле. Это требует высокой стабильности этих сред, т.е. длительного сохранения целостности структуры частиц ПФУ.
До практического использования эмульсионных ПФУ-препаратов в качестве инфузионной среды необходимо иметь критерии их стабильности in vitro более информативные, чем просто сохранение размера частиц [12].
МЕТОДЫ ОЦЕНКИ ЦЕЛОСТНОСТИ СТРУКТУРЫ НАНОЧАСТИЦ
Стабильность эмульсионной инфузионной среды определяется сохранностью структуры частиц, их размера и прочности оболочки.
Тонкодисперсные эмульсии ПФУ являются мутными средами. ФЛ плохо растворимы в Н2О и в ПФУ. Поэтому в процессе диспергирования ПФУ наряду с двухслойными частицами ПФУ/ФЛ с прочно прикрепленным слоем эмульгатора могут находиться свободные липосомальные или мицеллярные структуры эмульгирующего компонента.
Качество эмульсии может быть охарактеризовано комплексом параметров. Разработаны методические подходы, которые позволяют получить информацию о прочности структуры частиц эмульгированных ПФУ [12]. Для определения размера и распределения частиц по размерам используют различные методы. Для оценки дисперсности коллоидных мутных сред наиболее быстрым и информативным является метод спектра мутности (СМ) [13]. В работе [14] были рассмотрены особенности метода СМ применительно к тонкодисперсным эмульсиям ПФУ и подобраны условия для определения среднего диаметра частиц. Метод не требует дополнительного определения концентрации частиц в исследуемом образце. В силу этого данный метод использовался также для оценки распределения частиц по размерам в эмульсиях после их центрифугирования и фракционирования.
Поверхностные свойства частиц характеризовали с помощью индекса взаимодействия Kτ эмульсии с модифицированной сывороткой крови как модельной средой. В работе [15] обнаружены различия в реакции сыворотки крови при добавлении к ней эмульсии или ее эмульгатора в эквивалентных количествах. Добавление эмульсии к сыворотке вызывало резкое увеличение мутности τ. При введении тех же объемов эмульгатора значения τ не менялись. Разница в ответной реакции сыворотки на введение эмульсии ПФУ и эмульгатора связана с особенностями структуры частиц эмульсии ПФУ. При одинаковой исходной концентрации ПАВ в эмульсии и эмульгаторе его распределение в объеме этих сред различно. В растворе эмульгатора молекулы ПАВ распределены равномерно. В эмульсиях эмульгатор, стабилизируя частицы, находится в основном на их поверхности, образуя структурно-механический барьер с повышенной концентрацией молекул ПАВ. Макромолекулы плазмы могут легко сорбироваться на такой поверхности, изменяя ее оптические свойства. Предложен критерий Kτ, который позволяет количественно определить степень выраженности реакции сыворотки крови на введение эмульсии с помощью определения индекса взаимодействия или относительной мутности: Kτ = τ1/τ2, где τ1 – мутность исследуемой смеси сыворотка/эмульсия ПФУ (опыт); τ2 – мутность смеси сыворотка/физиологический раствор при соответствующих соотношениях компонентов (контроль).
В данном случае Kτ выступает в качестве меры сохранения или изменения поверхностных свойств частиц. Сохранение индекса в узком интервале значений свидетельствует о том, что поверхностные свойства частиц остаются на одном и том же уровне при различных воздействиях (при хранении в различных условиях, стерилизации, изменении топографии поверхности при введении различных добавок в эмульгирующий состав и др.).
ПФУ практически нерастворимы в воде и являются плохими растворителями для большинства веществ, в том числе и для ФЛ. Поэтому в эмульсии могут присутствовать два типа частиц: частицы с прочной связью ФЛ с фторуглеродным ядром частиц и свободные или липосомальные ФЛ. Присутствие частиц другой природы, свободных или липосомальных форм эмульгирующего ФЛ агента, определяют с помощью центрифугирования исследуемого образца эмульсии ПФУ/ФЛ. Для эмульсии, содержащей только однородные по своей природе частицы ПФУ/ФЛ, при центрифугировании наблюдается равномерное оседание частиц. На присутствие в эмульсии свободных ФЛ, не связанных с ядром частиц, как более легких форм по удельному весу, указывает присутствие верхней фракции в пробе исследуемого препарата. Оптические свойства этой части эмульсии отличаются от остальных фракций. Для подтверждения отсутствия в эмульсии свободных ФЛ методом спектрофотометрии-определяют экспериментальные и расчетные значения мутности (τ) эмульсий в разные сроки наблюдений:
Совпадение значений τэксп и τрасч свидетельствует о сохранении связи эмульгирующего ФЛ агента с фторуглеродным ядром частиц, т.е. о сохранении корпускулярной природы частиц (τэксп и τрасч) [15–17].
Анализ всего комплекса указанных биофизических параметров представляет новую методологию оценки качества наночастиц эмульгированных ПФУ/ФЛ. Ее можно обозначить как “ПФУ-биоинформатика” и рассматривать как необходимый этап тестирования качества эмульсионных ПФУ препаратов медико-биологического назначения до начала их доклинического и клинического исследования.
ВЛИЯНИЕ НАНОЧАСТИЦ ПФУ НА ФИЗИОЛОГИЧЕСКИЙ ПРОЦЕСС ДОСТАВКИ КИСЛОРОДА ЭРИТРОЦИТАМИ
Целью использования эмульсионных ПФУ препаратов является снижение гипоксии за счет улучшения доставки кислорода тканям. Поэтому их функциональную активность необходимо рассматривать в связи с газотранспортными свойствами крови.
Процесс доставки газов кровью определяется скоростью диффузии молекул О2 от эритроцитов к тканям и молекул СО2 в противоположном направлении. Схематически этот процесс представлен на рис. 1 [12, 18].
Рис. 1.
Иллюстрация биофизического процесса доставки О2 и СО2 кровью при совместной циркуляции наночастиц ПФУ и эритроцитов.
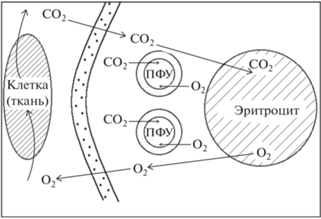
Частицы ПФУ находятся на пути диффузии молекул О2 и СО2 и могут оказывать влияние на этот процесс, ускоряя поток кислорода от эритроцитов к тканям. Поскольку слой ПАВ вокруг частиц ПФУ не играет существенной роли для проницаемости газов [19], присутствие частиц ПФУ в токе крови должно сказаться на скоростях оксигенации и деоксигенации эритроцитов.
Этот процесс был изучен на установке, моделирующей циркуляцию крови при гемодилюции. В ней кровь циркулировала по замкнутому контуру, содержащему газообменник, помещенный в закрытый бокс, который заполняли воздухом (оксигенация) или аргоном (деоксигенация). Степень оксигенации эритроцитов определялась с помощью оптического оксиметра. Условия проведения эксперимента: гематокрит Гт = 25–30%, содержание фторуглеродной эмульсии Сv~ 1% по объему, средний диаметр частиц а ~ 100 нм [20].
Согласно полученным данным, эмульсии ПФУ при совместной циркуляции с кровью увеличивали как скорость оксигенации (dα/dt), так и скорость деоксигсигенации (рис. 2а и 2б).
Рис. 2.
Зависимости скорости оксигенации (а) и деоксигенации (б) dα/dt от степени оксигенации α при добавлении к крови (гематокрит Гт = 25–30) физиологического раствора (1), эмульсий ПФУ (2) и раствора эмульгатора П-268 (3) с учетом дополнительного сигнала вследствие рассеяния света эмульсией. Объемная доля фторуглеродной фазы Сv = 0.6–1.0 об. %; средний диаметр частиц а = 0.05–0.14 мкм).
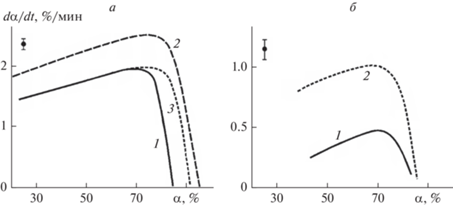
Таким образом, было установлено увеличение скоростей оксигенации и деоксигенации эритроцитов при их совместной циркуляции с частицами ПФУ в результате увеличения скорости диффузии кислорода, т.е. доказан эффект изменения условий транспорта кислорода эритроцитами в присутствии небольшого объема эмульгированных наночастиц ПФУ.
Доставка кислорода тканям определяется также скоростью кровотока. Частицы ПФУ в токе крови являются новыми гетерогенными включениями и могут изменить пространственную структуру движущейся крови [21]. На примере препарата Флюозол ДА [10] было показано, что эмульсии ПФУ, так же как и кровь, являются неньютоновскими жидкостями. Их вязкость зависит от напряжения сдвига. Показано, что асимптотическая вязкость (Па) в смесях кровь/эмульсия нелинейно меняется с увеличением фторуглеродной фазы в смеси [22]. Для смеси плазма/эмульсия эта зависимость была линейной. Обнаруженное различие свидетельствовало о выраженных взаимодействиях наночастиц ПФУ с эритроцитами. Для оценки этого взаимодействия определяли “коэффициент агрегации” А (Па), который характеризует способность клеток к агрегации и их прочность [10, 22]. Было обнаружено, что в смешанной среде кровь/эмульсия величины А сопоставимы с такими же значениями для смеси кровь/эмульгатор при содержании наночастиц эмульсии не более 2–3% (по объему). С увеличением содержания фторуглеродной эмульсии (более ~5%) было отмечено возрастание А, что свидетельствует об образовании новых структур, обусловленных дополнительным взаимодействием частиц и эритроцитов.
ВЛИЯНИЕ РАЗЛИЧНЫХ ДОЗ НАНОЧАСТИЦ ПФУ НА КЛЕТКИ КРОВИ
Средний диаметр частиц ПФУ препаратов составляет 0.1 мкм, что более чем на порядок меньше размера клеток: эритроцитов (5.5–9.5 мкм), лейкоцитов (10–20 мкм) и тромбоцитов (2.5–3 мкм). Согласно проведенным расчетам [23], при внутривенном введении 10% (по объему) эмульсии ПФУ в дозе 5–10 мл/кг массы тела число частиц в единице объема 1 мм3 составляет (2.5–1.2) × 1010. Это количество частиц ПФУ на 4 порядка превышает число эритроцитов (~5 × × 106) и почти на 7 порядков превышает число лейкоцитов (~9 × 103) и тромбоцитов (~3 × 103) в том же объеме 1 мм3. Таким образом, на каждую клетку, циркулирующую в сосудистом русле, приходится от одной тысячи до одного миллиона наночастиц эмульгированных ПФУ, которые могут оказывать влияние на их функциональную активность.
Проведен анализ результатов экспериментальных работ [24–26]. Дозозависимое влияние эмульгированных наночастиц ПФУ на состояние клеток крови оценивали по изменению ряда параметров (состояние мембраны эритроцитов, функциональная активность нейтрофильных гранулоцитов, фагоцитарная активность нейтрофильных гранулоцитов, процесс агрегации тромбоцитов) при различных соотношениях кровь/эмульсия от 100/1 до 1/1. Число наблюдений в каждом исследуемом образце варьировали от 5 до 17.
Для оценки влияния эмульсии на состояние мембраны эритроцитов подсчитывали число эхиноцитов в мазке крови или кровь/эмульсия на 1000 эритроцитов по методике, описанной в работе [27].
Функциональная активность нейтрофильных гранулоцитов определялась по их способности восстанавливать бесцветный краситель нитросиний тетразолий до диформазана, окрашенного в синий цвет (НСТ-тест) [28] Определялась доля из 100 клеток (в мазке) нейтрофильных гранулоцитов, содержащих гранулы восстановленного диформазана (НСТ-позитивные клетки).
Фагоцитарная активность нейтрофильных гранулоцитов в исходном состоянии (контроль) определялась по методике [29, 30] с микробной культурой S. aureus P-209. Аналогичным образом ее оценивали в смеси кровь/эмульсия (опыт).
Гемолиз эритроцитов после инкубации крови с эмульсией АТ оценивали в соответствии с инструкцией, принятой в Службе крови, предусматривающей “отсутствие видимого гемолиза”. В норме свободный гемоглобин составляет не более 0.1 г/л.
Результаты экспериментальных данных работ [24–26] представлены в настоящей работе на рис. 3–6 в новом графическом отображении.
Рис. 3.
Изменение числа эхиноцитов (1) и содержания МДА (2) с увеличением доли эмульгированных наночастиц ПФУ в смеси кровь/эмульсия.
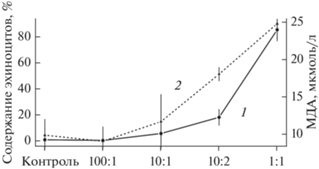
Рис. 4.
Изменение метаболической активности нейтрофилов (ломаная кривая) согласно значениям НСТ-теста и уровни фагоцитарной активности ФА (“ящик-с-усами”) нейтрофилов с увеличением доли наночастиц эмульгированных ПФУ в смеси кровь/эмульсия. Значение ФА в контроле 72 ± 8 (95% уровень), средневзвешенное значение для соотношений кровь/эмульсия 100 : 1 и 10 : 1 составляет 64 ± 4. Эти значения статистически неотличимы (доверительные интервалы пересекаются).
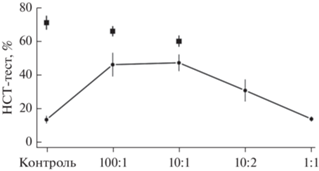
Рис. 5.
Пример регистрации агрегатограмм при введении разных доз эмульсии в плазму одного донора: 1 – исходное состояние; 2 – содержание эмульсии в плазме 4%; 3 – содержание эмульсии в плазме 15%. Запись проводили на агрегометре SolarAC 2110 c программным обеспечением для анализа агрегационных свойств тромбоцитов. По оси ординат – коэффициент светопропускания (%), по оси абсцисс – время протекания индуцируемого процесса агрегации (мин).
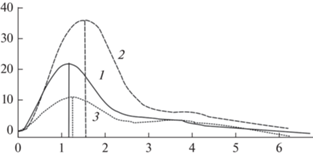
Рис. 6.
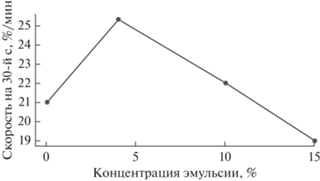
Изменение усредненных значений регистрируемых параметров: скорости агрегации тромбоцитов на 30-й с в зависимости от введенной дозы эмульсии (получено для 10 опытов).
Статистический анализ экспериментальных данных и представление результатов в графической форме были выполнены посредством скриптов на открытом языке программирования R [31] на базе ресурсного центра “Обсерватория экологической безопасности” Научного парка СПбГУ.
На рис. 3 показано влияние эмульгированных наночастиц на состояние мембраны эритроцитов [24, 25]. С увеличением доли эмульсии в смеси кровь/эмульсия в образце отмечается увеличение числа эхиноцитов (кривая 1), т.е. шиповидных эритроцитов. При этом наблюдается увеличение содержания малонового диальдегида (МДА) (кривая 2), который является маркером процесса перекисного окисления липидов. Таким образом, происходит однонаправленное изменение двух независимых параметров (числа эхиноцитов и МДА) с увеличением числа частиц ПФУ, контактирующих с эритроцитами, что свидетельствует о нарушении целостности плазматической мембраны клеток. Подтверждением этого являлось появление свободного гемоглобина в плазме, т.е. проявление видимого гемолиза эритроцитов при соотношении кровь/эмульсия 1/1 и 1/2. Содержание свободного гемоглобина при этом составляло 0.925 и 3.42 г/л, что в несколько раз превышает предельно допустимые нормы ~ 0.1 г/л.
Рисунок 4 демонстрирует изменения метаболической активности нейтрофилов, о которой судили по способности этих клеток восстанавливать краситель нитросиний тетразолий (НСТ-тест) и фагоцитарной активности нейтрофильных гранулоцитов. Первоначальное резкое увеличение значений НСТ-теста отражает активацию кислород-зависимого метаболизма нейтрофилов. Этот процесс является закономерной реакцией на появление чужеродного агента, т.е. частиц ПФУ, в смеси кровь/эмульсия. При увеличении содержания эмульсии (соотношение кровь/эмульсия 10/2 и более) отмечается снижение способности нейтрофилов восстанавливать бесцветный краситель нитросиний тетразолий до диформазана, что может быть связано с блокированием механизмов фагоцитоза.
Однако оказалось, что средние значения фагоцитарной активности (ФА) нейтрофилов в области возросших значений НСТ теста при низком содержании эмульсии (соотношение кровь/эмульсия 100/1 и 10/1) статистически неотличимы от контроля (рис. 4, фигуры “ящик с усами”) и составляют 66.6 ± 2.9 согласно проведенному расчету.
В работе [26] было изучено влияние эмульгированных наночастиц на процесс агрегации тромбоцитов, индуктором которого являлся АДФ в концентрации 1 мкМ. Использовали фотометрический метод Борна, основанный на непрерывном измерении изменения коэффициента светопропускания перемешиваемой и термостатируемой суспензии тромбоцитов [32]. Запись процесса индуцируемой агрегации тромбоцитов в плазме здоровых лиц проводили на агрегометре Solar2110 c программным обеспечением для регистрации и анализа результатов. Изменение агрегационной функции тромбоцитов оценивали по определенным параметрам кривой агрегации: максимальная амплитуда, %; скорость агрегации, %/мин; процент дезагрегации тромбоцитов, %; время процесса агрегации, с.
Предварительные исследования показали, что исследуемые наночастицы эмульгированных ПФУ не являются индуктором агрегации нормальных тромбоцитов, что и позволило провести настоящие исследования.
На рис. 5 приведены примеры записи агрегатограмм тромбоцитов при введении различных доз эмульгированных ПФУ в плазму одного донора.
Выявлено разнонаправленное влияние эмульгированных ПФУ на индуцируемую агрегацию тромбоцитов. При низком содержании эмульсии (4% от общего объема, кривая 2) наночастицы усиливали исходно нормальную агрегацию (кривая 1). С увеличением содержания эмульсии ПФУ в пробе до 10% отмечено снижение индуцируемой агрегации по сравнению с нормой.
На рис. 6 представлено изменение усредненных (из 10 опытов) значений параметров агрегации тромбоцитов в зависимости от введенной дозы эмульсий ПФУ. При низких концентрациях (4% от общего объема образца) эмульгированные частицы усиливают исходно нормальную агрегацию тромбоцитов. С увеличением содержания эмульсии (до 10 и 15%) отмечено снижение индуцируемой агрегации кровяных пластинок ниже исходного уровня.
ЗАКЛЮЧЕНИЕ
В представленном аналитическом обзоре рассматривается механизм взаимодействия биопрепарата эмульсионного типа на основе наночастиц ПФУ/ФЛ с живой системой. Показано, что стабильность эмульсионной инфузионной среды ПФУ/ФЛ обеспечивается сохранением структуры частиц, их размера и прочности оболочки. Обоснована необходимость стабильности структуры биопрепарата для выполнения им газотранспортной функции in vivo. Комплекс физико-химических методов контроля целостности структуры наночастиц послужил информационной базой для отработки воспроизводимой технологии диспергирования ПФУ. Использование такого инновационного подхода позволило получить эмульсии ПФУ/ФЛ, в которых сохранялась однородность частиц ПФУ/ФЛ, их поверхностные свойства, средний диаметр и раcпределение частиц по размерам в течение одного-двух лет хранения [33, 34]. В проанализированных работах во всех экспериментах были использованы стабильные однотипные (по составу и способу получения) эмульсии.
Интерпретировать полученные результаты необходимо как воздействие наночастиц ПФУ на функционирование сложной системы крови. В первую очередь, это воздействие касается изменения условий доставки газов крови О2 и СО2 в смешанной системе кровь/эмульсия. Оказалось, что небольшое количество эмульсии в крови улучшает условия доставки О2 эритроцитами за счет увеличения скорости диффузии молекул кислорода от эритроцитов к тканям, а также путем нормализации кровотока за счет снижения агрегации эритроцитов (реология крови).
Приведенные экспериментальные и теоретические результаты позволяют расширить представление о механизме газотранспортной активности наночастиц эмульгированных ПФУ. При совместной циркуляции с эритроцитами частицы ПФУ выполняют, во-первых, роль пассивного переносчика газов О2 и СО2 пропорционально перепаду парциального давления соответствующего газа; во-вторых, роль усилителя потока О2 и СО2 за счет увеличения их скорости диффузии, обусловленного повышенной растворимостью газов в ПФУ и возможностью свободного прохождения газов через частицы; в третьих, роль демпфера за счет образования дополнительной емкости для газов в плазме.
Реализация названных механизмов в условиях in vivo означает, что небольшой объем наночастиц, циркулирующих вместе с эритроцитами, несмотря на небольшое количество растворенного в них кислорода, может обеспечить большую скорость его поступления в ткани и органы за счет ускоренной диффузии молекул О2 через плазму и тем самым способствовать развитию компенсаторных механизмов пациента.
Это воздействие наночастиц на газотранспортную функцию эритроцитов следует рассматривать как макроуровень регуляции газотранспортной функции системы крови.
Другой аспект влияния наночастиц на клетки крови – микроуровень, который обусловлен взаимодействием поверхностей двух дисперсных систем – клеток крови и чужеродных организму наночастиц. Важным обстоятельством в данном случае являются свойства поверхности и клеток, и наночастиц. Рецепторный аппарат плазматической мембраны клеток запускает определенные биохимические процессы внутри клеток. Контакт наночастиц с рецепторным аппаратом можно рассматривать как приходящий извне сигнал. Соотношение размеров рецептор/частица составляет ~10 нм/100 нм. На начальном этапе в результате слабого сигнала или малого информационного воздействия, при низкой плотности частиц вокруг клеток, происходит изменение конфигурации рецептора, которое может вызвать или слабую реакцию клетки (активация нейтрофилов, НСТ-тест; активация тромбоцитов) или отсутствие внутреннего реагирования клетки и сохранение ее стационарного состояния (сохранение фагоцитарной активности нейтрофилов; отсутствие эхиноцитов и гемолиза у эритроцитов). Увеличение доли эмульгированных наночастиц в образце и, тем самым, увеличение плотности частиц вокруг клетки, приводит к увеличению контактных взаимодействий клетка/частицы. В результате происходит “контактное торможение” и ухудшение функционирования клетки. Подобная реакция отмечена для всех типов исследованных форменных элементов крови, несмотря на специфику их рецепторного аппарата. Такое торможение, или “контактное ингибирование”, присуще всем живым системам и является регуляторным механизмом роста клеток или тканей.
Исследование влияния эмульсионных ПФУ-препаратов на различные клеточные системы в предыдущие годы проводили в опытах на животных. По аналогии с живыми системами, влияние наночастиц ПФУ на функционирование клеток крови можно рассматривать как “микроуровень” регуляции биологических свойств системы крови. Взаимодействие наночастиц с плазматической мембраной клеток открывает возможность их направленного воздействия на специфическую активность форменных элементов крови. В частности, поскольку нейтрофилы относятся к клеткам врожденного иммунитета, особый интерес представляет активация этих клеток при контакте с малой дозой наночастиц. Это явление заслуживает отдельного исследования. Подтверждение и уточнение этой реакции в живом организме на введение малых доз наночастиц ПФУ позволит использовать это явление для усиления иммунного ответа при вакцинировании пациентов для активации ответной реакции против патогенов (вирусов и бактерий).
Приведенные результаты свидетельствуют о целесообразности использования малых доз при лечении гипоксических состояний, а также о целесообразности снижения содержания ПФУ фазы, т.е. кислородной емкости, при создании новых инфузионных сред данного типа.
Авторы настоящего аналитического обзора благодарны всем авторам опубликованных ранее работ. Благодарны за понимание новых идей, которые были положены в свое время в основу постановки эксперимента, благодарны за профессионализм при их осуществлении и обсуждение при подготовке публикации. Несмотря на то, что исследования были проведены почти 10 лет тому назад, дополнительный их анализ показал актуальность поставленных задач. В результате расширены представления о биологической активности наночастиц ПФУ, и это обстоятельство открывает перспективы создания новых эффективных ПФУ-препаратов.
Список литературы
Riess J.G., Flaim S.F., Klein D.H., Weers J.G. 1995. The relative physicochemical and biological atrtributes of perflubron emulsions. В сб.: Физиологическая активность фторсодержащих соединений (эксперимент и клиника). Ред. Воробьев С.И., Иваницкий Г.Р. Пущино, с. 73–90.
Coch C.S., Cushing M.M. 2009. Oxygen therapeutics: Perfluorocarbons and blood substitute safety. Crit. Care Clin. 25, 399–414. https://doi.org/1016/j/ccc. 2008.12.007
Henkel-Hanke T., Oleck M. 2007. Artificial oxygen carriers: A current review. Am. As. Nurse Anest. J. 75 (3), 205–211.
Маевский Е.И., Аксёнова О.Г., Богданова Л.А., Иваницкий Г.Р. 2004. Анализ побочных клинических эффектов, выявленных в ходе I–II фазы клинических исследований Перфторана. Вестник службы крови России. (4), 23–29.
Vercellotti G.M., Hammerschmidt D.E., Craddock P.R., Jacob H.S. 1982. Activation of plasma complement by perfluorocarbon artificial blood: Probable mechanism of adverse pulmonery reactions in treated patients and rationale corticosteroids prophylaxis. Blood. 59, 1299–1304.
Flaim S.F. 1994. Pharmacokinetics and side effects of perfluorocarbon-based blood substitutes (review). Artif. Cells, Blood Substit. Immobil. Biotechnol. 22, 1043–1054.
Ложкина А.Н. 1987. Участие системы комплемента в регуляции сиcтемы гомеостаза. Успехи современной биологии. 104 (4). 36–54.
Лысенок П.Н. 2005. Биоматериаловедение: вклад в прогресс современных медицинских технологий. Клеточная трансплантология и тканевая инженерия. (2), 56–61.
Кузнецова И.Н., Безрукова А.Г., Лопатин В.Н., Паршин А.В. 1988. Определение показателя преломления и толщины оболочки частиц дисперсного кровезаменителя на основе перфторсоединений. Биофизика. 33 (1), 126–129.
Naito R., Yokoyama K. 1978. Perfluorochemical blood substitutes. Technical Information Series No. 5. Chome, Joto-ku, Osaka, Japan: The Green Cross Corporation, p. 1–47.
Накагаки М. 1991. Физическая химия мембран. М.: Мир. 254 с.
Кузнецова И.Н. 1999. Функциональная активность и стабильность эмульсий перфторуглеродов. Автореф. дис. докт. биол. наук. С.-Петербург: РосНИИГТ. 38 с.
Кленин В.И., Щеголев С.Ю., Лаврушин В.И. 1977. Характеристические функции светорассеяния дисперсных систем. Саратов: Изд-во Саратовского ун-та. 177 с.
Кузнецова И.Н., Кругляк З.А. 1987. Определение размеров частиц водных дисперсных препаратов методом спектротурбидиметрии. Хим.-фарм. журн. 31 (12), 1492–1503.
Кузнецова И.Н., Гохман Н.С., Лаврова Ю.В. 1993. Взаимодействие частиц эмульсий перфторуглеродов с сывороткой крови. Журн. физ. химии. 67 (9), 1884–1888.
Кузнецова И.Н., Юрченко В.С. 2006. Стабильность структуры эмульсий на основе перфторуглеродов и фосфолипидов при хранении. Хим.-фарм. журн. 40 (12), 35–38.
Kuznetsova I.N. 2015. About mechanism of gas transport function and side reactions of perfluorocacbon nano-dispersions. Current Bionanotechnology. 1, 51–59.
Мусил Я., Новакова О., Кунц К. 1984. Современная биохимия в схемах. Пер. с англ. М.: Мир. 213 с.
Miuro K., Watanabe H., Kato H. 1983. Study of the behavior of uptake and release of oxygen into perfluorocarbon-water emulsion. Bull. Chem. Soc. Japan. 56 (2), 386–388.
3арицкий А.Р., Кузнецова И.Н., Переведенцева Е.В., Фок М.В. 1993. Влияние эмульсий перфторуглеродов на скорость оксигенации и деоксигенации крови. Журн. физ. химии. 67 (3), 591–594.
Чижевский А.Л. 1959. Структурный анализ движущейся крови. М.: АН СССР. 474 с.
Кузнецова И.Н. 2001. Влияние эмульсий перфторуглеродов на реологические параметры крови. Биофизика. 46 (4), 761–765.
Кузнецова И.Н. 2001. О воздействии эмульсий перфторуглеродов на организм. В сб. Перфторуглеродные соединения в биологии и медицине. Ред. Иваницкий Г.Р., Мороз В.В. Пущино, с. 70–76.
Кузнецова И.Н., Волкова С.Д., Рыбакова Л.П., Юрченко В.С., Кочеткова Г.А. 2009. Эмульсии перфторуглеродов влияют на морфофункциональное состояние клеток крови – эритроцитов и лейкоцитов in vitro. Вестн. службы крови России. (2), 23–26.
Волкова С.Д., Кузнецова И.Н., Бессемельцев С.С. 2014. Влияние эмульсий перфторуглеродов на фукциональное состояние клетки крови. Medline.ru (Биомедицинский журнал). 15 (статья 12), 117–133.
Тарковская Л. Р., Кузнецова И. Н., Морозова Т. В., Папаян Л. П. 2009. Дозозависимое влияние эмульсий перфторуглеродов на индуцируемую агрегацию тромбоцитов. Вестн. службы крови России. (3), 25–30.
Филёв Л.В., Захаров И.И., Селиванова Г.В. 1989 Цитоспектрофотометрическое исследование гемоглобина в эритроцитах человека. Цитология. 31 (3), 336–343.
Нагоев Б.С., Шубич М.Г. 1981. Значение теста восстановления нитросинего тетразолия для изучения функциональной активности лейкоцитов. Лаб. дело. (4), 195–198.
Егорова А.П., Лебединский В.А. 1949. Значение фагоцитарной реакции в определении инвазивности гемолитического стрептококка. Микробиол. и эпидемиол. (5), 8–9.
Савченко З.И., Ерасова В.И. 1981. Функциональное состояние нейтрофилов периферической крови у больных бронхиальной астмой. Лаб. дело. (11), 661–664.
The R Project for Statistical Computing. https://www.r-project.org.
Вавилова Т.В., Головина О.Г., Зайнулина М.С., Иванов И.В., Миндукшев И.В., Папаян Л.П., Петищев Н.Н., Шитикова А.С., Эмануэль В.Л. 1999. Гемостаз. Физиологические механизмы, принципы диагностики основных форм геморрагических заболеваний. Ред. Петрищев Н.Н., Папаян Л.П. С.-Петербург: Изд-во СПБГМУ. 117 с.
Кузнецова И.Н., Юрченко В.С., Кочеткова Г.А. 2012. Стабильные нанодисперсии на основе перфторуглеродов и фосфолипидов. Хим.-фарм. журн. 46 (2), 52–56. https://doi.org/10/1007/s 11094-0120-0745-9
Кузнецова И.Н., Старицына Н.Н., Лянгузов А.Ю. 2020. Биофизические свойства и стабильность наночастиц на основе перфторуглеродов и фосфолипидов. Журн. физ. химии. 94 (3), 443. https://doi.org/10.31857/S0044453720020211
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


