Биологические мембраны: Журнал мембранной и клеточной биологии, 2023, T. 40, № 2, стр. 92-104
Электронный транспорт в мембранах хлоропластов теневыносливого и светолюбивого видов традесканции
И. С. Сусличенко a, М. А. Беньков a, Д. А. Ковалишина a, М. О. Петрова a, Б. В. Трубицин a, А. Н. Тихонов a, *
a Московский государственный университет имени М.В. Ломоносова,
физический факультет
119991 Москва, Россия
* E-mail: an_tikhonov@mail.ru
Поступила в редакцию 07.11.2022
После доработки 01.12.2022
Принята к публикации 03.12.2022
- EDN: KWQRNW
- DOI: 10.31857/S023347552302007X
Аннотация
В работе исследованы процессы электронного транспорта в хлоропластах двух контрастных видов традесканции, теневыносливого вида Tradescantia fluminensis и светолюбивого вида T. sillamontana, выращенных в условиях умеренной или сильной освещенности. В качестве показателей, отражающих фотохимическую активность фотосистемы 2 (ФС2), использовали параметры быстрой (OJIP-тест) и медленной индукции флуоресценции (МИФ) хлорофилла а в хлоропластах in vivo и in situ. По кинетике МИФ определяли коэффициент нефотохимического тушения флуоресценции хлорофилла а, обеспечивающего защиту фотосинтетического аппарата от светового стресса. За функционированием фотосистемы 1 (ФС1) следили по кинетике фотоиндуцированных изменений редокс-состояния Р700 – реакционного центра ФС1, регистрируемой методом электронного парамагнитного резонанса. Показано существенное различие в динамике изменений фотосинтетических показателей теневыносливого и светолюбивого видов традесканции в условиях длительной акклимации растений (до 5 месяцев) к умеренной (50–125 мкмоль фотонов м−2 c−1) или сильной (850–1000 мкмоль фотонов м−2 c−1) освещенности фотосинтетически активным белым светом. У светолюбивого вида T. sillamontana фотосинтетические показатели хлоропластов при акклимации растений к умеренному и к сильному свету изменялись незначительно. Фотосинтетические характеристики листьев теневыносливого вида T. fluminenesis чувствительны к условиям освещения, что свидетельствует об ослаблении фотохимической активности при повышении интенсивности света при акклимации растений. Эффект ослабления фотосинтетических показателей листьев был обратимым – параметры флуоресценции возвращались к исходному уровню после ослабления света.
ВВЕДЕНИЕ
Фотосинтезирующие организмы оксигенного типа (растения, водоросли, цианобактерии) содержат пигмент-белковые комплексы двух типов – фотосистему 1 (ФС1) и фотосистему 2 (ФС2), которые поглощают свет и обеспечивают перенос электронов от воды, разлагаемой в ФС2, к NADP+ − конечному акцептору электронов в ФС1. Перенос электронов по цепи электронного транспорта (ЦЭТ) происходит с участием цитохромного b6 f-комплекса и подвижных электронных переносчиков – пластохинона и пластоцианина [1–6]. У растений переносчики ЦЭТ встроены в тилакоидные мембраны хлоропластов. Функционирование ЦЭТ приводит к генерации транс-тилакоидной разности электрохимических потенциалов ионов водорода (ΔμH+), являющейся источником энергии для работы АТР-синтазы [7–9]. ATP и NADPH – макроэргические продукты “световых” стадий фотосинтеза, используются в реакциях цикла Кальвина–Бенсона для фиксации СО2 и синтеза углеводов [10].
Структурная организация фотосинтетического аппарата (ФСА) растений хорошо изучена. В настоящее время одной из основных задач биофизики и биохимии фотосинтеза является выяснение механизмов регуляции электронного транспорта в хлоропластах. В природных условиях интенсивность и спектральный состав света меняются в течение суток и зависят от погодных условий. Недостаток света уменьшает продуктивность фотосинтеза. Избыток света может приводить к деструктивным процессам, например, вызывать окислительный стресс и нарушение работы ФСА растений [11, 12]. В ходе биологической эволюции фотосинтезирующие организмы выработали механизмы, позволяющие оптимизировать биоэнергетические процессы при варьировании внешних условий (освещение [13], температура [14–17]). Эти механизмы обеспечивают “быструю” (секунды-минуты) и “долгосрочную” (часы-сутки) регуляцию фотосинтеза. “Быстрые” процессы регуляции осуществляются за счет обратных связей, влияющих на: 1) активацию/деактивацию реакций ЦКБ [18, 19], 2) рН-зависимую регуляцию работы ЦЭТ [20–23], 3) перераспределение поглощаемой энергии света между ФС1 и ФС2 [24], 4) структурно-функциональные перестройки ФСА в мембранах [25–29]. “Долгосрочные” механизмы регуляции связаны с синтезом или деградацией тех составляющих ФСА (включая пигмент-белковые комплексы), которые влияют на “архитектуру” и функциональные свойства хлоропластов. Способность растений приспосабливаться к изменяющимся условиям внешней среды определяется видом растений [30].
В контексте задачи о механизмах акклимации11 растений к условиям обитания несомненный интерес представляет сравнительное исследование близкородственных видов растений, принадлежащих к “контрастным” видам (например, виды растений одного рода, приспособленные расти в теневых условиях или при интенсивном освещении). Ранее нами были изучены фотосинтетические показатели двух видов традесканции (Tradescantia) − теневыносливого вида T. fluminensis (эндемичный вид, произрастающий во влажных тропических лесах юго-востока Бразилии) и светолюбивого вида T. sillamontana [31–37], исторической родиной которого являются полупустынные районы Мексики и Перу [38]. Другой пример подобного рода исследований − сравнительное изучение свойств ФСА двух видов растений рода Cucumis, произрастающих в районах с жарким и умеренным климатом; к ним относятся C. melo (дыня) и C. sativum (огурец). С помощью липидорастворимых спиновых зондов ранее были изучены свойства мембран хлоропластов, выделенных из проростков дыни и огурца, выращенных в одинаковых экспериментальных условиях [39]. При этом, однако, оказалось, что термоиндуцированные структурные переходы в тилакоидных мембранах хлоропластов дыни происходят при более высоких температурах (≥35°С), чем в хлоропластах огурца (~20–25°С). Очевидно, что это наблюдение − отражение того факта, что дыня (C. melo) приспособилась произрастать при сравнительно высоких температурах, характерных для жаркого климата в местах происхождения этого вида.
В настоящей работе приведены результаты сравнительного исследования динамики акклимации листьев двух “контрастных” видов традесканции (T. fluminensis и T. sillamontana), происходящей при долговременном (месяцы) выращивании растений при высокой или низкой интенсивности света. Наиболее уязвимым пигмент-белковым комплексом ФСА растений, повреждаемым при световом стрессе или при повышении температуры, является ФС2 [40–44]. Для определения функциональных показателей, отражающих активность ФС2 в хлоропластах in situ (листья растений), мы изучали индукцию флуоресценции хлорофилла а (Хл а), испускаемой в основном пигментами светособирающей антенны ФС2 [45–48]. Оценивали также вклад нефотохимического тушения (НФТ) флуоресценции Хл а, отражающего эффективность защитных механизмов, обусловленных усилением диссипации избытка энергии в светособирающей антенне ФС2 [42, 49–53]. Используя флуоресцентные методы анализа, мы изучили изменения эффективности работы ФС2 и генерации НФТ в ходе длительной (несколько месяцев) акклимации T. fluminensis и T. sillamontana к свету высокой или низкой интенсивности. В дополнение к этому, мы исследовали функционирование ФС1, регистрируя редокс-превращения фотореакционных центров Р700 (первичный донор электрона в ФС1) методом электронного парамагнитного резонанса. Наши исследования показали, что с увеличением длительности акклимации теневыносливых растений T. fluminensis у них усиливается защитная реакция, проявляющаяся в генерация НФТ уже при умеренных потоках света (~200 мкмоль фотонов м−2 с−1). В результате длительной акклимации (более 2 месяцев) к свету высокой интенсивности (≥500 мкмоль фотонов м−2 с−1) хлоропласты T. fluminensis быстрее теряют фотохимическую активность, что не характерно для светолюбивого вида T. sillamontana. Ослабление фотохимической активности ФСА у T. fluminensis обратимо – после возвращения к свету умеренной интенсивности их фотохимическая активность восстанавливается до уровня, характерного для растений, акклимированных к умеренному свету.
МАТЕРИАЛЫ И МЕТОДЫ
Растения. Объектами исследования служили листья традесканции T. fluminensis и T. sillamontana, полученные из Главного ботанического сада Российской академии наук. Растения выращивали в почвенной культуре при комнатной температуре (24–26°C) и относительной влажности 40–60%. Горшки с растениями помещали в темную камеру, внутри которой были два освещаемых отсека, различающихся по интенсивности света. Источником света служила лампа “УСС 90 магистраль Ш” (ООО “ТД ФОКУС”, Россия), укомплектованная белыми светодиодами с цветовой температурой 5000 K (Nichia, Япония). Спектральный состав этой лампы включает компоненты синего, красного и дальнего красного света, необходимые для нормального роста и развития растений. Интенсивность освещения измеряли с помощью квантометра Li250A (LiCOR Biosciences, США). Длительность светового периода в дневное время составляла 14 ч. Потоки света были равны 800–1000 мкмоль фотонов м−2 с−1 (“сильный” свет, СС) или 50–125 мкмоль фотонов м−2 с−1 (“умеренный” свет, УС). Для измерений фотосинтетических показателей листьев использовали второй или третий зрелый лист, расположенный в верхней части побега. При измерениях характеристик листа биофизическими методами (флуоресцентный анализ и ЭПР) образец освещали с абаксиальной (дорзальной) стороны листа, обращенной в сторону верхнего эпидермиса. Было проведено несколько серий длительных экспериментов по акклимации для различных посадок растений в весенне-летне-осенний сезоны 2015–2022 гг. О-бщие закономерности динамики изменений биофизических показателей листьев двух видов традесканции, T. fluminenesis и T. sillamontana, изученные в разные сезоны, были одинаковыми. В настоящей работе для иллюстрации этих закономерностей мы приводим результаты исследований, проведенных в 2019–2021 гг.
Измерения флуоресценции, определение НФТ. Флуоресценцию Хл а in vivo измеряли с помощью PAM-флуориметра модели FluorPen FP100 (Photon Systems Instruments, Чешская республика), как описано ранее [32–37, 54]. Спектры непрерывного действующего (“актиничного”) света и слабого импульсного измерительного света, возбуждающего флуоресценцию Хл а, имели максимум при 475 нм и полуширину спектральной полосы Δλ1/2 = 25 нм. Перед началом измерений лист предварительно освещали актиничным светом в течение 1 мин (для стандартизации условий опыта), а затем выдерживали в темноте в течение 10 мин. Параметры кривых индукции флуоресценции Хл а и нефотохимического тушения флуоресценции определяли согласно традиционным протоколам, описанным в работах [46–48].
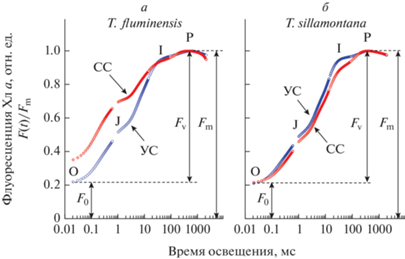
Характерные кинетические кривые быстрой индукции флуоресценции (БИФ) Хл а листьев у двух видов растений (T. fluminensis и T. sillamontana), произраставших в течение 2 месяцев на сильном (СС) или умеренном свету (УС ), показаны на рис. 1. Из кинетических кривых БИФ видно, как изменяется уровень флуоресценции во время действия насыщающей вспышки света длительностью 2 с (световой поток 3000 мкмоль фотонов м−2 с−1). Все эти кривые имеют характерные особенности (перегибы или локальные экстремумы), обозначенные символами O, J, I и P. Параметр F0 − начальный уровень флуоресценции Хл а листьев, адаптированных к темноте. Fm − максимальный уровень флуоресценции, измеренной в ответ на действие насыщающего импульса света. Параметр вариабельной флуоресценции (отношение Fv/Fm = (Fm − F0)/Fm) является мерой максимальной фотохимической активности ФС2 (относительным квантовым выходом) в листьях, адаптированных к темноте [46–48].
Рис. 1.
Кинетика быстрой индукции флуоресценции (БИФ) хлорофилла а в листьях T. fluminensis (а) и T. sillamontana (б), выращенных в течение 2 месяцев в условиях сильного (СС) и умеренного (УС) освещения. Измерения выполнены в соответствии с протоколом, описанным в разделе Материалы и методы. Началу измерений предшествовала адаптация образцов к темноте в течение 10 мин. Все кривые БИФ нормированы на максимальную интенсивность флуоресценции Fm.
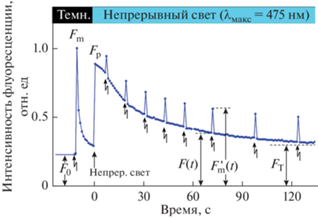
На рис. 2 показана типичная кинетика медленной индукции флуоресценции (МИФ) Хл а, вызванной действием непрерывного света (часто называемого в литературе актиничным светом, actinic light) и подаваемыми на его фоне короткими (1 с) вспышками света (λмакс = 475 нм) высокой интенсивности (3000 мкмоль фотонов м−2 с−1). Значения Fm и $F_{{\text{m}}}^{{\text{'}}}$ − уровни флуоресценции при действии интенсивных вспышек на образец листа, адаптированного к темноте (Fm) или во время его освещения актиничным светом ($F_{{\text{m}}}^{{\text{'}}}$). F(t) – интенсивность флуоресценции, измеренной непосредственно перед подачей интенсивной вспышки. Параметры ФPSII = 1 – F(t)/$F_{{\text{m}}}^{{\text{'}}}$ и qNPQ = = ${{F_{{\text{m}}}^{0}} \mathord{\left/ {\vphantom {{F_{{\text{m}}}^{0}} {F_{{\text{m}}}^{{\text{'}}}}}} \right. \kern-0em} {F_{{\text{m}}}^{{\text{'}}}}}$ – 1 характеризуют так называемую операционную эффективность срабатывания фотохимических центров ФС2 (ФPSII) и коэффициент НФТ (qNPQ), соответственно [46–48].
Рис. 2.
Кинетика индукции флуоресценции хлорофилла а в листьях T. fluminensis, выращенных в условиях освещения растений “сильным” светом. Измерения выполнены в соответствии с протоколом, описанным в разделе “Материалы и методы”. Зигзагообразными стрелками показаны моменты подачи коротких насыщающих вспышек света. Вертикальной стрелкой показан момент включения непрерывного (актиничного) света. Кинетическая кривая нормирована на величину Fm, определяемую уровнем флуоресценции на первую насыщающую вспышку, подаваемую после адаптации листа к темноте в течение 10 мин. FT – стационарный уровень флуоресценции, устанавливающийся после длительного (~10 мин) освещения листьев актиничным светом интенсивностью 800 мкмоль фотонов см–2 с–1.
Электронный парамагнитный резонанс. Наблюдая за характерным сигналом ЭПР от окисленных центров ${\text{P}}_{{700}}^{ + }$, можно следить за электронным транспортом в хлоропластах in situ [54, 55]. Образец (свежесрезанный кусочек листа размерами 4 × 25 мм) закрепляли в хорошо вентилируемом держателе и помещали в прямоугольный резонатор спектрометра ЭПР модели Е-4 (Varian, США). Мощность микроволнового излучения составляла 10 мВт, амплитуда ВЧ-модуляции была равна 0.4 мТ. Образцы освещали белым светом (БС, 320 Вт м−2), эффективно возбуждающим обе фотосистемы, или дальним красным светом (ДКС, λмакс = 707 нм, 8 Вт м−2), возбуждающим преимущественно ФС1. За кинетикой редокс-превращений P700 следили по изменениям величины низкополевого экстремума первой производной сигнала ЭПР от ${\text{P}}_{{700}}^{ + }$. Условия освещения и особенности регистрации сигналов ЭПР в листьях растений подробно описаны в работе [54].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Индукция флуоресценции хлорофилла а
Быстрая индукция флуоресценции. Показанные на рис. 1 кинетические кривые были получены на высечках из листьев растений, акклимированных к условиям “сильного” или “умеренного” освещения. Перед началом измерений каждый образец адаптировали к темноте в течение 10 мин. Все кривые БИФ нормированы на максимальную величину сигнала Fm. Эти кривые имеют общие закономерности: в ответ на короткую вспышку интенсивного света с λмакс = 475 нм флуоресценция Хл а быстро достигает уровня F0, а затем растет до максимального уровня Р, характеризуемого параметром Fm, проходя при этом через точки перегиба или локальные экстремумы, отмеченные символами J и I. После достижения максимального уровня Р наблюдается некоторый спад флуоресценции. Согласно общепринятой точке зрения, стадия роста O–J отражает восстановление первичного пластохинона PQA, прочно связанного с ФС2 [45–48]. Следующая фаза роста сигнала (участок J–I–P), называемая “тепловой фазой” флуоресценции [56, 57], отражает восстановление вторичного пластохинона PQB (перенос электрона PQА → PQB) и дальнейший перенос электронов в ЦЭТ между ФС2 и ФС1, а также перераспределение поглощенной энергии между ФС2 и ФС1 [58]. Сравнивая кинетику БИФ в листьях теневыносливого вида T. fluminensis для растений, акклимированных в течение 2 месяцев к сильному или к умеренному свету, можно заметить, что в первом случае начальный уровень флуоресценции F0 был выше, чем у листьев того же вида, акклимированных к “умеренной” интенсивности света. Учитывая, что параметр F0 отражает эффективность переноса энергии от светособирающей антенны к реакционному центру Р680 [48], можно предположить, что наблюдаемое различие является следствием повреждения антенны ФС2 при экспозиции листьев T. fluminensis к сильному свету (световой стресс). Этого не происходило в случае листьев светолюбивого вида T. sillamontana, что может свидетельствовать о сравнительно слабой восприимчивости растений этого вида к усилению интенсивности света при акклимации.
Параметры кривой БИФ зависят от длительности акклимации растений в условиях различной освещенности (рис. 3). Нами были проведены наблюдения за флуоресцентными показателями листьев in vivo (без отрыва листьев от стебля) при длительном культивировании растений (более 4 месяцев), начиная с двухнедельного возраста листьев, когда у растений уже сформировались листовые пластинки. На рис. 3а показаны результаты измерений в опыте, когда сначала в течение 80 суток растения росли на умеренном свету (50–125 мкмоль фотонов м−2 с−1), а затем их начали освещать сильным светом (850–1000 мкмоль фотонов м−2 с−1) того же спектрального состава. Видно, что при выращивании растений на свету умеренной интенсивности значения параметра F0 у обоих видов традесканции оставались практически неизменными. После существенного (на порядок) усиления светового потока зависимости F0 от времени акклимации листьев T. fluminensis и T. sillamontana изменились. В листьях T. fluminensis параметр F0 стал возрастать по мере увеличения длительности акклимации. В отличие от T. fluminensis, в листьях T. sillamontana статистически значимого роста F0 не наблюдалось (рис. 3а).
Рис. 3.
Динамика изменений параметра F0 кривой быстрой индукции флуоресценции, измеренного в листьях T. fluminensis и T. sillamontana, произраставших в условиях освещения “сильным” и “умеренным” светом. Вертикальные линии – стандартное отклонение от средних значений, полученных для n = 4–8 измерений.
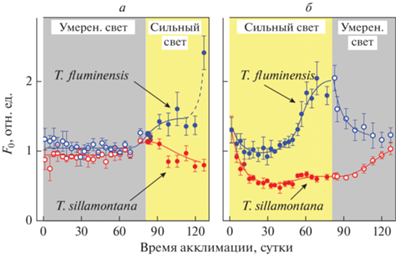
На рис. 3б приведены результаты другой серии измерений, в которой последовательность условий освещения была противоположной: растения сначала росли на сильным свету, а затем интенсивность света была ослаблена. У теневыносливых растений (T. fluminensis) в течение первых 50 суток роста на сильном свету параметр F0 изменялся, но незначительно. Затем параметр F0 начал заметно увеличиваться. Рост F0, наблюдавшийся при освещении растений сильным светом, был обратимым. После ослабления света на 80-е сутки величина F0 стала уменьшаться, возвращаясь к исходному уровню F0. В случае светолюбивого вида T. sillamontana, выращиваемого на сильном свету, вначале наблюдалось некоторое уменьшение F0. Можно думать, что это происходит потому, что при избытке света в условиях акклимации к сильному свету растениям хватает квантов света для оптимального функционирования, поэтому им “выгодно” уменьшить число пигмент-белковых комплексов, чтобы избежать негативных последствий от светового стресса. После ослабления света, по мере акклимации растений значение F0 возрастает, возвращаясь к исходному уровню F0. Описанные изменения параметра F0 отражают процессы структурно-функциональной реорганизации ФСА, происходящие в ходе акклимации растений. При этом, как показали результаты обеих серий экспериментов (рис. 3а и 3б), в листьях теневыносливого растения T. fluminensis флуоресцентный параметр F0 оказывается более чувствительным к вариациям интенсивности света при акклимации, чем в листьях светолюбивого вида T. sillamontana.
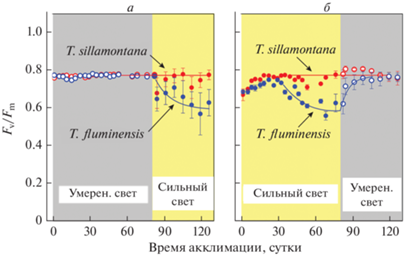
Межвидовое различие динамики изменений параметра F0 при акклимации характерно и для вариабельной флуоресценции Хл а, определяемой как отношение Fv/Fm = (Fm − F0)/Fm. Из рис. 4 видно, что в листьях T. sillamontana это отношение сохраняется на одном и том же уровне (Fv/Fm ≈ 0.78) независимо от условий произрастания растений (сильный или умеренный свет). Это указывает на то, что максимальный квантовый выход флуоресценции Хл а в хлоропластах T. sillamontana остается высоким как при умеренной, так и при высокой интенсивности света. В случае T. fluminensis наблюдалась другая картина: выращивание этих растений на сильном свету приводит к некоторому падению вариабельной флуоресценции Fv/Fm, что отражает уменьшение фотохимической активности ФС2. Уменьшение отношения Fv/Fm обратимо, после ослабления интенсивности света при акклимации T. fluminensis этот параметр возвращается к исходному значению Fv/Fm ≈ 0.78, характерному для растений, растущих при умеренных интенсивностях света (рис. 4б). Обратимость эффекта ослабления Fv/Fm, происходящего при выращивании T. fluminensis на сильном свету, может свидетельствовать о функциональной “гибкости” ФСА этих растений − фотохимическая активность хлоропластов сравнительно быстро (в течение нескольких суток) восстанавливается после ослабления освещенности.
Рис. 4.
Динамика изменений параметра вариабельной флуоресценции Fv/Fm кривой быстрой индукции флуоресценции, измеренного в листьях растений T. fluminensis и T. sillamontana, произраставших в условиях освещения “сильным” и “умеренным” светом. Вертикальные линии – стандартное отклонение от средних значений, полученных для n = 4–8 измерений.
Нефотохимическое тушение флуоресценции. Обратимость параметров БИФ в листьях T. fluminensis, происходящих при акклимации растений к свету различной интенсивности (рис. 3 и 4), свидетельствует о функциональной “гибкости” ФСА этих растений, которая позволяет защищать ФСА от светового стресса. Защита ФСА от повреждений при избыточном освещении (сильный свет) проявляется в усилении нефотохимического тушения возбуждения молекул Хл a в светособирающей антенне ФС2. Коэффициент нефотохимического тушения (величина НФТ) можно определить из параметров кривой медленной индукции флуоресценции (МИФ), показанных на рис. 2.
На рис. 5 показано как меняется параметр NPQ в ходе освещения листьев T. fluminensis непрерывным (актиничным) светом, у растений, акклимированных в течение разного времени при высокой (СС, рис. 5а) или умеренной (УС, рис. 5б) интенсивности света. Интенсивность актиничного света, используемого при регистрации МИФ, была достаточно высокой, 800 мкмоль фотонов м−2 с−1, что по порядку величины соответствует интенсивности сильного света, используемого при акклимации растений. В кинетике роста параметра NPQ, показанной на рис. 5, можно выделить несколько компонент, которые отражают разные механизмы регуляции световых стадий фотосинтеза. Обратимая компонента НФТ, обозначаемая как qE (так называемая энергетическая составляющая), характеризуется сравнительно быстрым ростом (~0.5−2 мин). Эта компонента обусловлена созданием транс-тилакоидной разности рН (ΔpH), когда в результате закисления внутритилакоидного пространства (люмена) активируется регуляторный белок PsbS, усиливающий НФТ [59]. Считается, что белок PsbS выполняет роль сенсора, обеспечивающего чувствительность к светоиндуцированному снижению внутритилакоидного pH (pHin). Вслед за быстрым ростом НФТ (компонента qE) часто наблюдается сравнительно медленное увеличение НФТ (обозначаемое как компонента qZ [50–52]). Эта стадия роста НФТ может быть обусловлена двумя основными причинами: 1) реакциями ксантофилового цикла (диэпоксидация виолаксантина и появление зеаксантина) и 2) перераспределением энергии между ФС2 и ФС1 (переходы состояние “1” ↔ ↔ состояние “2”) [24, 29]. Зеаксантин усиливает связь регуляторного белка PsbS со светособирающей антенной ФС2 (LHCII). Это вызывает агрегацию светособирающих комплексов ФС2 (LHCII), что приводит к росту НФТ − усиливается диссипация энергии возбужденных пигментов антенны ФС2 и уменьшается эффективность фотохимических процессов в ФС2 (см. подробнее обзор [29]). На основании наших предыдущих исследований [34], можно заключить, что в листьях традесканции рост НФТ связан с усилением экспрессии белка PsbS.
Рис. 5.
Влияние длительности акклимации растений T. fluminensis, выращиваемых на свету сильной (СС) и умеренной (УС) интенсивности, на кинетику светоиндуцированных изменений коэффициента нефотохимического тушения флуоресценции (NPQ). Кривые 1, 2 и 3 получены для растений, акклимированных к “сильному” свету в течение 8, 20 и 40 суток. Кривые 4 и 5 получены для листьев растений, акклимированных к “умеренному” свету в течение 8 и 45 суток. Интенсивность непрерывного (актиничного) света, действующего на измеряемый образец, составляла 800 мкмоль фотонов м−2 с−1.
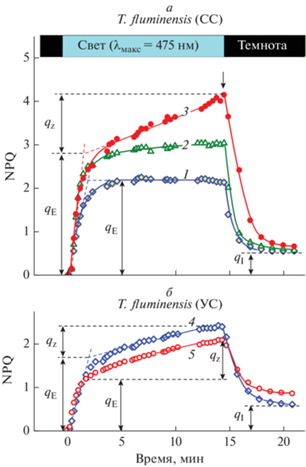
После выключения актиничного света наблюдается спад НФТ. Падение НФТ в темноте обратимо, но не полностью − достаточно долго (десятки минут) сохраняется остаточный уровень НФТ, характеризуемый параметром qI (рис. 5). Величина qI отражает, по крайней мере частично, степень инактивации части фотохимических центров ФС2 в результате действия достаточно интенсивного актиничного света [30, 48–53]. Ингибирование ФС2 происходит в основном из-за повреждения белка D1 в результате его фотоокисления при действии сильного света. Репарация ФС2 осуществляется за счет того, что поврежденный белок D1 удаляется из ФС2, а на его место встраивается заново синтезированный активный белок D1 [60].
Способность растений к усилению НФТ зависит от условий освещения при культивировании растений, а также от времени акклимации. Из рис. 5а видно, что с увеличением длительности акклимации растений T. fluminensis, произрастающих на сильном свету, наблюдается сравнительно небольшое увеличение обратимой (“энергетической”) составляющей qE. Следует обратить внимание на то, что по мере старения растений становится все более заметным вклад второй (медленной) компоненты НФТ (qZ). Это позволяет предположить, что по мере созревания листьев T. fluminensis их ФСА приобретает дополнительную способность защищаться от светового стресса. Заметим, что у растений, произраставших при умеренном освещении, также наблюдались две фазы роста НФТ (рис. 5б), но значения параметров qE и qZ, отражающих два механизма генерации НФТ, у них были несколько ниже, чем у растений, выращивавшихся на сильным свету (рис. 5а). Очевидно, что у растений, произраставших при умеренном освещении, усиление защитной реакции, обусловленное ростом НФТ, выражено слабее, чем у растений того же вида, произраставших на сильном свету. Естественно, что на сильном свету растения не испытывают дефицита в энергии для фотосинтеза, но при этом они должны защищаться от светового стресса.
Мы показали, что динамика изменений НФТ в ходе освещения листьев традесканции, адаптированных к темноте, зависит от длительности акклимации растений к свету высокой или умеренной интенсивности. Это особенно наглядно проявляется в опытах с тенелюбивым видом T. fluminensis. У растений, произрастающих на сильном свету, значение qE заметно возрастает по мере акклимации (рис. 5а). При этом становится более выраженной медленная компонента qZ. Это понятно, растения тенелюбивого вида T. fluminensis, растущего на сильном свету, приобретают в ходе акклимации дополнительную способность защищаться от светового стресса. По мере увеличения времени акклимации такая реакция ФСА растений становится более выраженной. В то же время при длительном нахождении растений на свету умеренной интенсивности этого не происходит, наблюдается даже небольшой спад qE по мере акклимации растений. Можно предположить, что спад qE вызван изменениями хлоропластов по мере старения растений, что может быть обусловлено, например, уменьшением биосинтеза и/или усилением деградации некоторых белков ФСА.
Электронный парамагнитный резонанс
Различия во флуоресцентных характеристиках листьев растений, выращенных при сильном и умеренном освещении, проявляются также в кинетике редокс-превращений Р700 − первичного донора электрона в реакционном центре ФС1. На рис. 6 показаны типичные кривые фотоиндуцированных изменений интенсивности сигнала ЭПР от ${\text{P}}_{{700}}^{ + }$ в листьях растений, адаптированных к темноте в течение 10 мин. Протокол измерений ${\text{P}}_{{700}}^{ + }$ был таким же, как в наших предыдущих работах [54, 55]: после предварительного освещения белым светом (БС) в течение 1 мин (для стандартизации условий эксперимента) образцы адаптировали к темноте в течение 10 мин. Видно, что в ответ на включение БС, возбуждающего обе фотосистемы, сигнал ЭПР от ${\text{Р}}_{{700}}^{ + }$ возрастает, достигая стационарного уровня. В листьях, адаптированных к темноте, наблюдается многофазная кинетика роста сигнала. Сразу после включения БС происходит небольшой скачок сигнала, потом наблюдается его сравнительно медленный рост к стационарному уровню АБС. Задержка роста сигнала, характеризуемая параметром τ1/2, обусловлена тем, что при адаптации листа к темноте реакции ЦКБ инактивируются, поэтому вследствие переизбытка NADPH затрудняется отток электронов от ФС1 к NADP+ [10, 61]. По мере освещения хлоропластов активируются реакции ЦКБ и отток электронов от ФС1 ускоряется; кроме этого, уменьшается скорость притока электронов от ФС2 к ${\text{P}}_{{700}}^{ + }$ в результате закисления люмена, а также ослабляется активность ФС2 вследствие генерации НФТ. Наряду с этим происходит перераспределение энергии поглощаемого света в пользу ФС1 (переход состояние “1” → состояние “2”), и наступает перераспределение электронных потоков (нециклический/циклический транспорт электронов) в пользу нециклического потока [61]. Все это должно способствовать росту сигнала ЭПР от ${\text{P}}_{{700}}^{ + }$.
Рис. 6.
Кинетика фотоиндуцированных изменений величины сигнала ЭПР от ${\text{P}}_{{700}}^{ + }$ в листьях T. fluminensis и T. sillamontana, выращенных при освещении “сильным” (СС) или “умеренным” (УС) светом. Перед началом включения белого света (БС) образцы адаптировали к темноте в течение 10 мин.
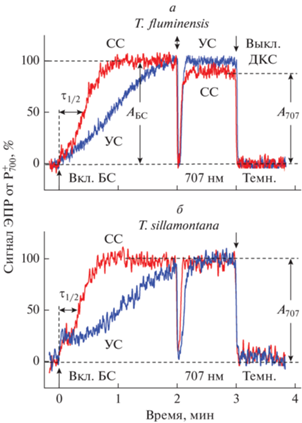
Из рис. 6 также видно, что скорость окисления Р700 при действии БС зависит от условий произрастания растений. У обоих видов традесканции, акклимированных к сильному свету, фотоокисление Р700 происходит заметно быстрее, чем у растений, произраставших при умеренном освещении.
После переключения БС на более слабый дальний красный свет (ДКС, λмакс = 707 нм), возбуждающий преимущественно ФС1, концентрация ${\text{P}}_{{700}}^{ + }$ сначала падает, а затем монотонно возрастает. Быстрое падение сигнала после переключения БС на ДКС объясняется притоком электронов к ${\text{Р}}_{{700}}^{ + }$ от пула восстановленных переносчиков (это в основном молекулы пластохинола), накопившихся в ЭТЦ между ФС2 и ФС1 во время действия БС. Характерное время спада сигнала от ${\text{Р}}_{{700}}^{ + }$ после отключения БС составляет t1/2 ~ ~ 5–30 мc (в зависимости от длительности действия БС, данные не приведены), что соответствует времени переноса электронов от пластохинола к ${\text{Р}}_{{700}}^{ + }$ [1, 4–6, 62–64]. В дальнейшем, после реокисления переносчиков ЦЭТ между ФС2 и ФС1 за счет работы ФС1, возбуждаемой при действии ДКС, сигнал от ${\text{Р}}_{{700}}^{ + }$ снова возрастает. После выключения ДКС окисленные центры ${\text{Р}}_{{700}}^{ + }$ восстанавливаются за счет эндогенных доноров электрона [48, 49]. Восстановление ${\text{Р}}_{{700}}^{ + }$ после выключения ДКС происходит на несколько порядков медленнее (t1/2 ~ 2−5 c), чем после выключения БС (см. подробнее результаты наших исследований, описанные в работе [64]).
Описанная выше закономерность – ускорение фотоокисления Р700 в листьях растений, выращенных при высокой интенсивности света, обычно проявляет себя и в кинетике МИФ листьев T. fluminensis и T. sillamontana. Ранее, изучая влияние условий произрастания (интенсивность света) на кинетику МИФ, мы установили, что в листьях этих растений, выросших на сильном свету, МИФ спадает быстрее, чем в листьях растений, выросших при умеренной интенсивности света [65]. Ускорение спада флуоресценции Хл а во время индукционного периода может быть обусловлено теми же регуляторными механизмами, что и ускорение фотоокисления Р700 при действии БС: светоиндуцированной активацией реакций ЦКБ, усилением НФТ, ионной регуляцией электронного транспорта между ФС2 и ФС1, переходами типа состояние “1” ↔ состояние “2” и др. (см. обзоры [66–68]). Очевидно, что закономерности, характерные для кинетики редокс-превращений Р700 и для МИФ в листьях растений, акклимированных к сильному и умеренному” свету, отражает то, что в результате акклимации растений к сильному свету их ФСА быстрее реагирует на флуктуации освещения, а потому эти растения могут успешно противостоять световому стрессу.
Следует обратить внимание на то, что отношение амплитуд сигналов ЭПР от окисленных центров ${\text{P}}_{{700}}^{ + }$, индуцированных при действии БС и ДКС (параметры АБС и А707), зависит от вида растений и условий их произрастания. Отношение АБС/А707 было несколько выше для листьев T. fluminensis, выращенных на сильном свету, по сравнению с растениями, выращенными на слабом свету (рис. 6а). Как мы предположили ранее [65], это может указывать на то, что в листьях T. fluminensis, акклимированных к сильному свету, возрастает вклад циклического транспорта электронов вокруг ФС1, что проявляется при действии ДКС, возбуждающего преимущественно ФС1. В случае листьев T. sillamontana подобного различия не наблюдалось. Точные причины этого пока остаются неизвестными.
Таким образом, листья обоих изученных нами видов традесканции, культивируемых при разных интенсивностях света, обнаруживают различия в кинетике фотоиндуцированных изменений Р700. Основное различие касается скорости окисления Р700 под действием БС. Так, например, по мере старения листьев теневыносливого вида T. fluminenesis, произрастающего при умеренном освещении, происходит замедление окисления Р700, индуцируемого при действии БС (рис. 7). При этом листья этого же вида растений, выращиваемые на сильном свету, показывают более быструю скорость фотоокисления Р700 по сравнению с растениями, акклимированными к умеренному свету. Это значит, что ФС1 растений, выращенных на сильном свету, быстрее “реагирует” на включение БС, что согласуется с данными флуоресцентных исследований.
Рис. 7.
Зависимость кинетического параметра τ1/2, характеризующего скорость фотоокисления Р700 под действием белого света (см. определение τ1/2 на рис. 6) в листьях T. fluminensis, в зависимости от длительности акклимации растений к свету “сильной” и “умеренной” интенсивности. Закрытые и открытые символы соответствуют данным, полученным для разных серий экспериментов.
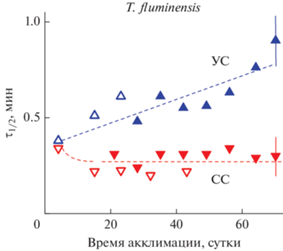
Вопрос о том, как в ходе длительной акклимации традесканций к свету различной интенсивности изменяется количественный состав электрон-транспортных комплексов и пигментов светособирающих антенн ФС1 и ФС2 требует специального анализа. По нашим предварительным данным, у обоих видов традесканций, акклимированных к сильному свету, суммарное содержание Хл а и Хл b, отнесенное к единице массы зеленого листа, уменьшается (данные не приведены, будут представлены в нашей следующей работе). Это наблюдение хорошо согласуется с известными литературными данными о том, что в листьях других видов растений относительные размеры светособирающей антенны ФС2 уменьшаются при акклимации растений к сильному свету [25–27, 33, 40, 66].
ЗАКЛЮЧЕНИЕ
Сравнительное исследование двух “контрастных” видов традесканции показало заметное различие в динамике изменений фотосинтетических показателей теневыносливых (T. fluminenesis) и светолюбивых (T. sillamontana) видов традесканции при длительной акклимации этих растений к свету сильной или умеренной интенсивности. Выявлено заметное различие в функционировании ФСА этих видов, проявляющееся при длительной акклимации растений (до 5 месяцев). У световыносливого вида T. sillamontana фотосинтетические показатели ФСА сравнительно слабо изменяются при акклимации растений к свету различной интенсивности. Фотосинтетические показатели хлоропластов теневыносливого вида T. fluminenesis обнаруживают более высокую лабильность. “Повреждаемость” их ФСА при повышении интенсивности света сопровождается усилением НФТ, что проявляется по мере увеличения длительности экспозиции листьев (рис. 6). Одним из наиболее эффективных механизмов усиления защиты ФСА листьев традесканции от светового стресса является усиление экспрессии регуляторного белка PsbS, приводящее к дополнительному росту НФТ [33].
Благодарности. Авторы признательны В.В. Птушенко за предоставленный нам осветительный прибор, использованный для выращивания растений, а также за ценные консультации, касающиеся различных аспектов биохимии и физиологии растений.
Вклад авторов. И.С. Сусличенко – проведение флуоресцентных измерений и получение данных методом ЭПР. М.А. Беньков, Д.А. Ковалишина, М.О. Петрова – участие в долгосрочных опытах по измерению флуоресцентных характеристик листьев. Б.В. Трубицин – приборное обеспечение работы и проведение ЭПР-измерений. А.Н. Тихонов – общий план работы, анализ литературных данных, подготовка графических материалов, написание статьи.
Финансирование. Работа выполнена при финансовой поддержке Российского научного фонда (грант № 21-74-20 047).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Соблюдение этических норм. Настоящая статья не содержит описания исследований с участием людей или использованием животных в качестве объектов.
Список литературы
Haehnel W. 1984. Photosynthetic electron transport in higher plants. Annu. Rev. Plant Physiol. Plant Mol. Biol. 35, 659–693.
Nelson N., Yocum C.F. 2006. Structure and function of photosystems I and II. Annu. Rev. Plant. Biol. 57, 521–565.
Mamedov M., Govindjee, Nadtochenko V., Semenov A. 2015. Primary electron transfer processes in photosynthetic reaction centers from oxygenic organisms. Photosynth. Res. 125, 51–63.
Tikhonov A.N. 2014. The cytochrome b6 f complex at the crossroad of photosynthetic electron transport pathways. Plant Physiol. Biochem. 81, 163–183.
Malone L.A., Proctor M.S., Hitchcock A., Hunter C.N., Johnson M.P. 2021.Cytochrome b6 f – Orchestrator of photosynthetic electron transfer. Biochim. Biophis. Acta. 1862, 148380. https://doi.org/10.1016/j.bbabio.2021.148380
Höhner R., Pribil M., Herbstová M., Lopez L.S., Kunz H.-H., Li M., Wood M., Svoboda V., Puthiyaveetil S., Leister D., Kirchhoff H. 2020. Plastocyanin is the long-range electron carrier between photosystem II and photosystem I in plants. Proc. Natl. Acad. Sci. USA. 117, 15 354–15 362.
Boyer P.D. 1997. The ATP synthase – a splendid molecular machine, Annu. Rev. Biochem. 66, 717–749.
Junge W., Nelson N. 2015. ATP synthase. Annu. Rev. Biochem. 83, 631–657.
Романовский Ю.М., Тихонов А.Н. 2010. Молекулярные преобразователи энергии живой клетки. Протонная АТР-синтаза – вращающийся молекулярный мотор. Успехи физических наук, 180, 931–956.
Эдвардс Дж., Уокер Д. 1986. Фотосинтез С3 и С4 растений: механизмы и регуляция. М.: Мир. 598 с.
Allakhverdiev S.I., Murata N. 2004. Environmental stress inhibits the synthesis de novo of proteins involved in the photodamage-repair cycle of photosystem II in Synechocystis sp. PCC 6803. Biochim. Biophis. Acta. 1657, 23–32.
Järvi S., Suorsa M., Aro E.-M. 2015. Photosystem II repair in plant chloroplasts — Regulation, assisting proteins and shared components with photosystem II biogenesis. Biochim. Biophys. Acta. 1847, 900–909.
Kono M., Terashima I. 2014. Long-term and short-term responses of the photosynthetic electron transport to fluctuating light. J. Photochem. Photobiol. B. 137, 89–99.
Berry J., Björkman O. 1980. Photosynthetic response and adaptation to temperature in higher plants. Annu. Rev. Plant Physiol. 31, 491–543.
Allakhverdiev S.I., Kreslavski V.D., Klimov V.V., Los D.A., Carpentier R., Mohanty P. 2008. Heat stress: An overview of molecular responses in photosynthesis. Photosynth. Res. 98, 541–550.
Allen D.J., Ort D.R. 2001. Impact of chilling temperatures on photosynthesis in warm climate plants. Trends Plant Sci. 6, 36–42.
Tikhonov A.N., Vershubskii A.V. 2020. Temperature‑dependent regulation of electron transport and ATP synthesis in chloroplasts in vitro and in silico. Photosynth. Res. 146, 299–329.
Michelet L., Zaffagnini M., Morisse S., Sparla F., Pérez-Pérez M.E., Francia F., Danon A., Marchand C.H., Fermani S., Trost P., Lemaire S.D. 2013. Redox regulation of the Calvin-Benson cycle: Something old, something new. Front. Plant Sci. 4, 470. https://doi.org/10.3389/fpls.2013.00470
Balsera M., Schumann P., Buchanan B.B. 2016. Redox regulation in chloroplasts. In: Chloroplasts. Current research and future trends. Ed. Kirchhoff H. Norfolk, UK: Caister Academic Press, p. 187–207.
Rumberg B., Siggel U. 1969. pH changes in the inner phase of the thylakoids during photosynthesis. Naturwissenschaften. 56, 130–132.
Kramer D.M., Sacksteder C.A., Cruz J.A. 1999. How acidic is the lumen? Photosynth. Res. 60, 151–163.
Tikhonov A.N. 2013. pH-Dependent regulation of electron transport and ATP synthesis in chloroplasts. Photosynth. Res. 116, 511–534.
Schansker G. 2022. Determining photosynthetic control, a probe for the balance between electron transport and Calvin–Benson cycle activity, with the DUA-L-KLAS-NIR. Photosynth. Res. 153, 191–204.
Lemeille S., Rochaix J.-D. 2010. State transitions at the crossroad of thylakoid signalling pathways. Photosynth. Res. 106, 33–46.
Lichtenthaler H.K., Babani F. 2004. Light adaptation and senescence of the photosynthetic apparatus. Changes in pigment composition, chlorophyll fluorescence parameters and photosynthetic activity. In: Chlorophyll a Fluorescence. Springer, p. 713–736.
Lichtenthaler H.K., Babani F., Navrátil M., Buschmann C. 2013. Chlorophyll fluorescence kinetics, photosynthetic activity, and pigment composition of blue-shade and half-shade leaves as compared to sun and shade leaves of different trees. Photosynth. Res. 117, 355–366.
Kirchhoff H. 2013. Architectural switches in plant thylakoid membranes. Photosynth. Res. 116, 481–487.
Tikkanen M., Jarvi S., Aro E.-M. 2015. Light acclimation involves dynamic re-organization of the pigment–protein megacomplexes in non-appressed thylakoid domains. The Plant J. 84, 360–373.
Puthiyaveetil S., Kirchhoff H., Höhner R. 2016. Structural and functional dynamics of the thylakoid membrane system. In: Chloroplasts. Current research and future trends. Ed. Kirchhoff H. Norfolk, UK: Caister Academic Press, p. 59–87.
Demmig-Adams B. 1998. Survey of thermal energy dissipation and pigment composition in sun and shade leaves. Plant Cell Physiol. 39, 474–482.
Samoilova O.P., Ptushenko V.V., Kuvykin I.V., Kiselev S.A., Ptushenko O.S., Tikhonov A.N. 2011. Effects of light environment on the induction of chlorophyll fluorescence in leaves: A comparative study of Tradescantia species of different ecotypes. BioSystems. 105, 41–48.
Ptushenko V.V., Ptushenko E.A., Samoilova O.P., Tikhonov A.N. 2013. Chlorophyll fluorescence in the leaves of Tradescantia species of different ecological groups: Induction events at different intensities of actinic light. Biosystems. 114, 85–97.
Mishanin V.I., Trubitsin B.V., Benkov M.A., Minin A.A., Tikhonov A.N. 2016. Light acclimation of shade-tolerant and light-resistant Tradescantia species: Induction of chlorophyll a fluorescence and P700 photooxidation, expression of PsbS and Lhcb1 proteins. Photosynth. Res. 130, 275–291.
Mishanin V.I., Trubitsin B.V., Patsaeva S.V., Ptushenko V.V., Solovchenko A.E., Tikhonov A.N. 2017. Acclimation of shade-tolerant and light-resistant Tradescantia species to growth light: Chlorophyll a fluorescence, electron transport, and xanthophyll content. Photosynth. Res. 133, 87–102.
Ptushenko V.V., Zhigalova T.V., Avercheva O.V., Tikhonov A.N. 2019. Three phases of energy-dependent induction of ${\text{P}}_{{700}}^{ + }$ and Chl a fluorescence in Tradescantia fluminensis leaves. Photosynth. Res. 139, 509–522.
Benkov M.A., Yatsenko A.M., Tikhonov A.N. 2019. Light acclimation of shade-tolerant and sun-resistant Tradescantia species: Photochemical activity of PSII and its sensitivity to heat treatment. Photosynth. Res. 139, 203–214.
Suslichenko I.S., Tikhonov A.N. 2019. Photo-reducible plastoquinone pools in chloroplasts of Tradescantia plants acclimated to high and low light. FEBS Lett. 593, 788–798.
Randall R.P. 2012. A global compendium of weeds. 2nd edn. Department of Agriculture and Food, Western Australia. 1125 p.
Лютова М.И., Тихонов А.Н. 1988. Сопоставление температурной зависимости подвижности липидо-растворимой спиновой метки в тилакоидных мембранах хлоропластов дыни и огурца. Биофизика. 33, 460–464.
Anderson J.M., Chow W.S., Park Y., Franklin L.A., Robinson S.P.-A., van Hasselt P.R. 2001. Response of Tradescantia albifora to growth irradiance: Change versus changeability. Photosynth. Res. 67, 103–112.
Gounaris K., Brain A.P.R., Quinn P.J., Williams W.P. 1984. Structural reorganization of chloroplast thylakoid membranes in response to heat-stress. Biochim. Biophys. Acta. 766, 198–208.
Li Z., Wakao S., Fischer B.B., Niyogi K.K. 2009. Sensing and responding to excess light. Annu. Rev. Plant B-iol. 60, 239–260.
Murata N., Takahashi S., Nishiyama Y., Allakhverdiev S.I. 2007. Photoinhibition of photosystem II under environmental stress. Biochim. Biophis. Acta. 1767, 414– 421.
Tikhonov A.N. 2020. Structure-function relationships in chloroplasts: EPR study of temperature-dependent regulation of photosynthesis, an overview. In Photosynthesis: molecular approaches to solar energy conversion. Eds. Shen J.R., Satoh K., Allakhverdiev S.I. p. 343–373, https://doi.org/10.1007/978-3-030-67407-6_13
Lazár D. 1999. Chlorophyll a fluorescence induction. Biochim. Biophys. Acta. 1412, 1–28.
Baker N.R. 2008. Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annu. Rev. Plant Biol. 59, 89–113.
Adams W.W. III, Demmig-Adams B. 2004. Chlorophyll fluorescence as a tool to monitor plant response to the environment. In: Chlorophyll a fuorescence: A signature of photosynthesis. Advances in photosynthesis and respiration. Eds. Papageorgiou G.C., Govindjee G. Springer, Dordrecht, p. 583–604.
Kalaji H.M., Schansker G., Ladle R.J., Goltsev V., Bosa K., Allakhverdiev S.I., Brestic M., Bussotti F., Calatayud A., Dąbrowski P., Elsheery N.I., Ferroni L., Guidi L., Hogewoning S.W, Jajoo A., Misra A.N., Nebauer S.G., Pancaldi S., Penella C., Poli D., Pollastrini M., Romanowska-Duda Z.B., Rutkowska B., Serôdio J., Suresh K., Szulc W., Tambussi E., Yanniccari M., Zivcak M. 2014. Frequently asked questions about in vivo chlorophyll fluorescence: Practical issues. Photosynth. Res. 122, 121–158.
Niyogi K.K., Truong T.B. 2013. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Curr. Opin. Plant Biol. 16, 307–314.
Nilkens M., Kress E., Lambrev P., Miloslavina Y., Müller M., Holzwarth A.R., Jahns P. 2010. Identification of a slowly inducible zeaxanthin-dependent component of non-photochemical quenching of chlorophyll fluorescence generated under steady-state conditions in Arabidopsis. Biochim. Biophys. Acta. 1797, 466–475.
Jahns P., Holzwarth A.R. 2012. The role of the xanthophyll cycle and of lutein in photoprotection of photosystem II. Biochim. Biophys. Acta. 1817, 182–193.
Ruban A.V. 2016. Nonphotochemical chlorophyll fluorescence quenching: mechanism and effectiveness in protecting plants from photodamage, Plant Physiol. 170, 1903–1916.
Murchie E.H., Ruban A.V. 2020. Dynamic non-photochemical quenching in plants: From molecular mechanism to productivity. Plant J. 101, 885-896.
Kuvykin I.V., Ptushenko V.V., Vershoubsky A.V., Tikhonov A.N. 2011. Regulation of electron transport in C3 plant chloroplasts in situ and in silico. Short-term effects of atmospheric CO2 and O2. Biochim. Biophys. Acta. 1807, 336–347.
Trubitsin B.V., Vershubskii A.V., Priklonskii V.I., Tikhonov A.N. 2015. Short-term regulation and alternative pathways of photosynthetic electron transport in Hibiscus rosa-sinensis leaves. J. Photochem. Photobiol. B. 152, 400–415.
Stirbet A. 2012. Chlorophyll a fluorescence induction: a personal perspective of the thermal phase, the J–I–P rise. Photosynth. Res. 113, 15–61.
Stirbet A., Govindjee G. 2011. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and photosystem II: Basics and applications of the OJIP fluorescence transient. J. Photoch. Photobiol. B. 104, 236–257.
Schansker G., Tóth S.Z., Strasser R.J. 2006. Dark recovery of the Chl a fluorescence transient (OJIP) after light adaptation: The qT-component of non-photochemical quenching is related to an activated photosystem I acceptor side. Biochim. Biophys. Acta. 1757, 787–797.
Jallet D., Cantrell M., Peers G. 2016. New players for photoprotection and light acclimation. In: Chloroplasts. Current research and future trends. Ed. Kirchhoff H. Norfolk, UK: Caister Academic Press, p. 133–159.
Tikkanen M., Mekala N.R., Aro E.-M. 2014. Photosystem II photoinhibition-repair cycle protects Photosystem I from irreversible damage. Biochim. Biophis. Acta. 1837, 210–215.
Strand D.D., Fisher N., Kramer D.M. 2016. Distinct energetics and regulatory functions of the two major cyclic electron flow pathways in chloroplasts. In: Chloroplasts: Current Research and Future Trends. Ed. Kirchhoff H. Norfolk, UK: Caister Academic Press, p. 89–100.
Stiehl H.H., Witt H.T. 1969. Quantitative treatment of the function of plastoquinone in photosynthesis. Z. Naturforsch. 24b, 1588–1598.
Рыжиков С.Б., Тихонов А.Н. 1988. Регуляция скорости переноса электрона в фотосинтетических мембранах высших растений. Биофизика. 33, 642–646.
Suslichenko I.S., Trubitsin B.V., Vershubskii A.V., Tikhonov A.N. 2022. The noninvasive monitoring of the redox status of photosynthetic electron transport chains in Hibiscus rosa-sinensis and Tradescantia leaves. Plant Physiol. Biochem. 185, 233–243.
Kalmatskaya O.A., Trubitsin B.V., Suslichenko I.S., Karavaev V.A., Tikhonov A.N. 2020. Electron transport in Tradescantia leaves acclimated to high and low light: Thermoluminescence, PAM‑fluorometry, and EPR studies. Photosynth. Res. 146, 123–141.
Eberhard S., Finazzi G., Wollman F.-A. 2008. The dynamics of photosynthesis. Annu. Rev. Genet. 42, 463–515.
Foyer C.H., Neukermans J., Queval G., Noctor G., Harbinson J. 2012. Photosynthetic control of electron transport and the regulation of gene expression. J. Exp. Bot. 63, 1637–1661.
Tikhonov A.N. 2015. Induction events and short-term regulation of electron transport in chloroplasts: An overview. Photosynth. Res. 125, 65–94.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


