Биология моря, 2019, T. 45, № 1, стр. 61-72
Молекулярно-генетическая дифференциация дальневосточной широколобки Megalocottus platycephalus (Pallas, 1814) (Scorpaeniformes: Cottidae)
О. А. Радченко 1, *, А. В. Петровская 1
1 Институт биологических проблем Севера ДВО РАН
685000 Магадан, Россия
* E-mail: radchenko@ibpn.ru
Поступила в редакцию 06.03.2018
После доработки 11.07.2018
Принята к публикации 18.10.2018
Аннотация
Впервые проведено сравнительное молекулярно-генетическое исследование дальневосточной широколобки Megalocottus platycephalus (Pallas, 1814) из Японского и Охотского морей. На основании анализа нуклеотидных последовательностей генов митохондриальной ДНК установлена гетерогенность вида, связанная с его географическим распространением. Показано, что представители M. platycephalus из разных морей образуют обособленные группы, дифференциация которых не превышает внутривидовые различия. Предполагается, что изученные географические группы дальневосточной широколобки принадлежат к южному M. platycephalus taeniopterus (Kner, 1868) и северному M. platycephalus platycephalus (Pallas, 1814) подвидам.
Дальневосточная широколобка Megalocottus platycephalus (Pallas, 1814) относится к семейству Cottidae. Этот вид широко распространен в морях северо-западной части Тихого океана – Японском (от зал. Петра Великого и севернее), Охотском и Беринговом, в районе юго-восточной Камчатки и Курильских островов; встречается в Чукотском море (до мыса Барроу) (Неелов, 1979; Федоров и др., 2003; Гудков, 2006; Mecklenburg et al., 2016).
M. platycephalus – обитатель морских прибрежных вод, лиманов, лагун и приустьевых участков, нередко заходит в устья рек. Характеризуется высокой экологической пластичностью, которая выражается в способности выдерживать различную соленость (от 34‰ до значительного опреснения) и температуру от –1.7 до 19°С, а также населять разнообразные биотопы (илистое, песчаное, галечное, крупнокаменистое дно, заросли водорослей), следствием чего является существенная вариабельность морфологических признаков (Неелов, 1979; Черешнев и др., 2001; Федоров и др., 2003; Гудков, 2006).
Первоначально в роде Megalocottus было описано два вида: Cottus platycephalus (Pallas, 1814), обнаруженный у Камчатки и Северной Америки, а также в Охотском море, и C. taeniopterus (Kner, 1868), пойманный в зал. Де-Кастри на севере Японского моря. Современные взгляды на систематическую структуру рода Megalocottus различаются. Одни исследователи считают его монотипическим, включающим вид M. platycephalus (Шмидт, 1950; Mecklenburg et al., 2002, 2016; Parin et al., 2002). Другие исследователи разделяют M. platycephalus на подвиды, выделяя северный M. platycephalus platycephalus, обитающий в северной части Охотского моря, у восточной Камчатки, в Беринговом и Чукотском морях, а также южный M. platycephalus taeniopterus, населяющий южную часть Охотского моря и северную часть Японского моря (Андрияшев, 1954; Неелов, 1979; Линдберг, Красюкова, 1987; Никифоров и др., 1997; Богуцкая, Насека, 2004; Гудков, 2004, 2006; Соколовский и др., 2011). В последних аннотированных каталогах и списках род Megalocottus вновь представлен двумя видами: M. platycephalus и M. taeniopterus (Bogutskaya et al., 2008; Parin et al., 2014; Dyldin, Orlov, 2017), но без ссылок на сравнительно-морфологические исследования, подтверждающие валидность этих видов.
Из восточной части Берингова моря, устья р. Нушагак, впадающей в Бристольский залив, а также из зал. Херендин (юго-западная Аляска) был описан вид Acanthocottus laticeps (Gilbert, 1896). В последующих работах он рассматривался как Megalocottus laticeps (Шмидт, 1904; Gilbert, Burke, 1912; Schmidt, 1929, цит. по: Parin et al., 2014, с. 258; Rendahl, 1931; Okada, Matsubara, 1938, цит. по: Шмидт, 1950, с. 154) или как Myoxocephalus laticeps (Таранец, 1937). На основании морфологических исследований статус M. laticeps был понижен до подвида – M. platycephalus laticeps (Шмидт, 1950; Андрияшев, 1954; Федоров, 1973), затем он был сведен в синонимию подвида M. p. platycephalus (Неелов, 1979).
Отсутствие единой точки зрения на состав рода Megalocottus можно объяснить не только сложностью определения таксономической принадлежности его представителей из-за значительной индивидуальной, возрастной и географической изменчивости, но и их недостаточной изученностью. Исследования морфологии, биологии и распространения широколобки немногочисленны, им посвящены лишь единичные работы; информация об остеологических особенностях практически отсутствует (Андрияшев, 1954; Неелов, 1979; Максименков, Токранов, 1992; Токранов, 1995; Гудков, 2004, 2006). Анализ генетического разнообразия M. platycephalus не проводили, молекулярно-генетические данные о виде ограничены нуклеотидными последовательностями участков двух генов митохондриальной ДНК (мтДНК) нескольких особей, представленными в GenBank (www.ncbi.nlm.nih.gov) и BOLD (www.barcodinglife.org).
Цель настоящего исследования заключалась в определении степени дифференциации и уточнении таксономического статуса дальневосточной широколобки M. platycephalus на основе анализа нуклеотидных последовательностей генов митохондриального генома.
МАТЕРИАЛ И МЕТОДИКА
Экземпляры Megalocottus platycephalus были выловлены в прибрежных водах Охотского и Японского морей (табл. 1). Для сравнительного анализа привлечены данные по нуклеотидным последовательностям гена COI мтДНК M. platycephalus из GenBank и BOLD.
Таблица 1.
Сведения об исследованной выборке Megalocottus platycephalus и о видах внешних групп
| Вид (номер образца) | Район сбора | Гены (номер в GenBank, *номер в BOLD) | ||
|---|---|---|---|---|
| COI | 16S рРНК | цитохром b | ||
| Megalocottus platycephalusplatycephalus (1790) | Охотское море, Тауйская губа, б. Шестакова | MH016197 | MH012123 | MH016217 |
| M. p. platycephalus (1791) | Там же | MH016198 | MH012124 | MH016218 |
| M. p. platycephalus (1800) | Охотское море, Тауйская губа, б. Токарева | MH016199 | MH012125 | MH016219 |
| M. p. taeniopterus (1896) | Японское море, зал. Восток | MH016200 | MH012126 | MH016220 |
| M. p. taeniopterus (1897) | Там же | MH016201 | MH012127 | MH016221 |
| M. p. taeniopterus (1986) | Японское море, о-в Сахалин, зал. Александровский |
MH016202 | MH012128 | MH016222 |
| M. p. taeniopterus (2004) | Японское море, зал. Ольги | MH016203 | MH012129 | MH016223 |
| M. p.taeniopterus (2005) | Там же | MH016204 | MH012130 | MH016224 |
| M. p.taeniopterus (2006) | » | MH016205 | MH012131 | MH016225 |
| M. p.taeniopterus (2007) | Японское море, б. Джигит | MH016206 | MH012132 | MH016226 |
| M. p.taeniopterus (2008) | Там же | MH016207 | MH012133 | MH016227 |
| M. p.taeniopterus (2009) | » | MH016208 | MH012134 | MH016228 |
| M. p. taeniopterus (2029) | Татарский пролив, зал. Чихачева | MH016209 | MH012135 | MH016229 |
| M. p.platycephalus (2032) | Охотское море, зал. Одян | MH016210 | MH012136 | MH016230 |
| M. p. platycephalus (2033) | Там же | MH016211 | MH012137 | MH016231 |
| M. p.platycephalus (2036) | » | MH016212 | MH012138 | MH016232 |
| M. p.platycephalus (2037) | » | MH016213 | MH012139 | MH016233 |
| M. p. platycephalus (2038) | » | MH016214 | MH012140 | MH016234 |
| M. p. platycephalus (2039) | » | MH016215 | MH012141 | MH016235 |
| M. p. platycephalus (2040) | » | MH016216 | MH012142 | MH016236 |
| M. p.taeniopterus (bg31) | Японское море, зал. Восток | EU200462 | – | – |
| M. p.taeniopterus (bg54) | Там же | EU200464 | – | – |
| M. platycephalus (MGLP42) | Охотское море, зал. Одян | JF278615 | – | – |
| M. platycephalus (MGLP27) | Там же | JF278613 | – | – |
| M. platycephalus (MGLP32) | » | JF278614 | – | – |
| M. platycephalus (KM019355) | О-в Сахалин, зал. Анива | KM019355 | – | – |
| M. platycephalus (UW046303) | Там же | DSFIB649-15* | – | – |
| M. platycephalus (UW150203) | Берингово море, зал. Нортон-Саунд | DSFIB551-14* | – | – |
| M. platycephalus (UW150204) | Там же | DSFIB560-14* | – | – |
| Myoxocephalus stelleri | Японское море, зал. Восток | KY062754 | KY062665 | MH595735 |
| M. ochotensis | Охотское море, зал. Одян | MH595733 | MH588265 | MH595734 |
| Enophrys diceraus | Охотское море, Тауйская губа, о-в Недоразумения | MH172280 | MH167476 | MH172298 |
| Porocottus minutus | Там же | MH172269 | MH167465 | MH172287 |
| P. japonicus | Японское море, б. Джигит | MH172274 | MH167470 | MH172292 |
| Gymnocanthus pistilliger | Японское море, Татарский пролив, зал. Ситуан | MH172281 | MH167477 | MH172299 |
Проведен анализ изменчивости нуклеотидных последовательностей генов COI, цитохрома b и 16S рРНК мтДНК. В качестве внешних групп использованы представители семейства Cottidae (табл. 1): для определения величины генетических дистанций между близкородственными таксонами – виды родов Myoxocephalus (M. stelleri Tilesius, 1811; M. ochotensis Schmidt, 1929), Porocottus [P. minutus (Pallas, 1814); P. japonicus Schmidt, 1935] и вид Enophrys diceraus (Pallas, 1787), для укоренения филогенетического дерева – значительно удаленный вид Gymnocanthus pistilliger (Pallas, 1814).
Геномная ДНК выделена из мышечной ткани по стандартной методике, включающей лизис ткани 1% SDS в присутствии протеиназы К (0.2 мг/мл) и депротеинизацию фенолом (Maniatis et al., 1982). Для амплификации в полимеразной цепной реакции и секвенирования ДНК использованы универсальные олигонуклеотидные праймеры, описанные ранее (Радченко и др., 2009; Морева и др., 2017). В программе MEGA 6 (Tamura, 2013) проведено выравнивание нуклеотидных последовательностей и определены показатели изменчивости мтДНК.
Для идентификации гаплотипов и установления их взаимосвязей построена сеть в программе SplitsTree4 версии 4.12.3 (Huson, Bryant, 2006) с помощью метода медианных сетей (median joining) (Bandelt et al., 1999). Генетические расстояния между гаплотипами оценены на основе p-дистанций, вычисленных в программе PAUP 4.0b10 (Swofford, 2002). В программе Modeltest v3.7 (Posada, Crandall, 1998) с использованием критерия Akaike выбраны оптимальные модели нуклеотидных замещений. Филогенетический анализ мтДНК выполнен с помощью метода байесовского анализа в программе MrBayes v3.1.2 (Ronquist, Huelsenbeck, 2003). Из 10001 полученных деревьев первые 1001, характеризующиеся нестабильными параметрами моделей нуклеотидных замещений и правдоподобия, отброшены; на основе остальных получены консенсусные деревья и апостериорные вероятности их ветвления. Узлы ветвления с оценками апостериорной вероятности ≥0.95 приняты как достоверные (Leaché, Reeder, 2002).
РЕЗУЛЬТАТЫ
Секвенированные участки генов 16S рРНК, COI и цитохрома b длиной 613, 1009 и 889 пар нуклеотидов (пн) расположены в пределах 2009–2621, 5578–6586 и 14469–15357 пн согласно нумерации нуклеотидных позиций митохондриального генома Enophrys diceraus (GenBank KF039715).
В последовательностях гена COI (без учета внешних групп) Megalocottus platycephalus обнаружены 11 полиморфных сайтов, среди которых семь филогенетически информативных; из 336 аминокислотных сайтов девять оказались полиморфными, семь информативными. Для гена цитохрома b установлено 28 вариабельных и 17 информативных нуклеотидных позиций; из 296 аминокислотных сайтов – девять полиморфные, в том числе четыре информативные. Фрагмент гена 16S рРНК характеризуется двумя полиморфными сайтами.
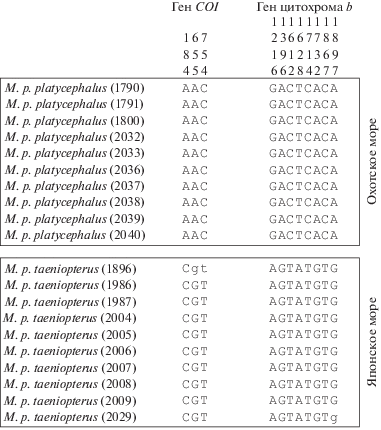
Сравнительный анализ митохондриальных генов (с учетом внешних групп) показал наличие у дальневосточной широколобки идентифицирующих мутаций. Во-первых, выявлены мутационные изменения, объединяющие все изученные экземпляры этого вида: в последовательностях генов COI и цитохрома b – 23 и 28 замен. Во-вторых, обнаружены изменения мтДНК, маркирующие особей M. platycephalus из Охотского и Японского морей: три и восемь нуклеотидных замен в последовательностях генов COI и цитохрома b соответственно (рис. 1).
Рис. 1.
Полиморфные нуклеотидные последовательности генов COI и цитохрома b, специфичные для Megalocottus platycephalus из Охотского и Японского морей. Вверху указана нумерация нуклеотидных позиций.
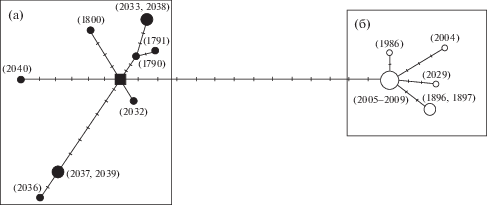
У дальневосточной широколобки выявлено 13 гаплотипов. При построении сети гаплотипов исследованные особи разделились на группы A и Б (рис. 2), которые различаются на 13 нуклеотидных замен. Группу А составляют 8 гаплотипов особей из Охотского моря, группу Б – 5 гаплотипов рыб из Японского моря. Большая часть особей охотоморской группы имеет индивидуальный гаплотип; в япономорской группе один из гаплотипов является общим для пяти особей. Центральный гаплотип группы А – гипотетический (пока не обнаружен, но необходим для соблюдения принципа минимизации числа мутационных событий); гаплотипы различаются 1–12 нуклеотидными заменами. В центре группы Б находится самый распространенный у изученных особей M. platycephalus из Японского моря гаплотип, с которым связаны остальные четыре гаплотипа. В этой группе гаплотипы, занимающие терминальные позиции (1896, 1897, 2004), дифференцированы на пять нуклеотидных замен.
Рис. 2.
Сеть гаплотипов, полученная на основе анализа нуклеотидных последовательностей генов COI, цитохрома b, 16S рРНК. Окружности представляют гаплотипы; размер окружности пропорционален числу особей с данным гаплотипом. В скобках – номера образцов, точки на ветвях – нуклеотидные замены. а – Охотское море, б – Японское море.
В группе особей из Охотского моря средние значения р-дистанций, рассчитанные для комбинированных последовательностей мтДНК, составляют 0.27% и варьируют от 0.04% между особями из б. Шестакова до 0.52% между рыбами из зал. Одян (табл. 2). Экземпляры M. platycephalus из зал. Одян одинаково отличаются как друг от друга, так и от особей из Мотыклейского залива (бухты Шестакова и Токарева) – в среднем на 0.28%. В группе рыб из Японского моря р-дистанции изменяются от 0.04 до 0.2% при средней величине 0.08%. Дальневосточные широколобки из расположенных относительно близко зал. Ольга и б. Джигит не различаются, за исключением образца № 2004. Экземпляр из самой южной точки Японского моря (зал. Восток) отличается от остальных в среднем на 0.11%. Дистанции между M. platycephalus из Охотского и Японского морей составляют 0.67% (разброс значений от 0.56 до 0.84).
Таблица 2.
Значения р-дистанций (в %) по данным о нуклеотидных последовательностях генов COI, цитохрома b, 16S рРНК (ниже диагонали) и участка гена COI (выше диагонали) Megalocottus platycephalus
| Вид (№ образца) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M.p.platycephalus (1790) | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 2 | M.p.platycephalus (1791) | 0.04 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 3 | M.p.platycephalus (1800) | 0.2 | 0.24 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 4 | M.p.platycephalus (2032) | 0.08 | 0.12 | 0.2 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 5 | M.p.platycephalus (2033) | 0.08 | 0.12 | 0.28 | 0.16 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 6 | M.p.platycephalus (2036) | 0.36 | 0.4 | 0.48 | 0.36 | 0.36 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 7 | M.p.platycephalus (2037) | 0.32 | 0.36 | 0.44 | 0.32 | 0.32 | 0.04 | – | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 8 | M.p.platycephalus (2038) | 0.08 | 0.12 | 0.28 | 0.16 | 0.0 | 0.36 | 0.32 | – | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 9 | M.p.platycephalus (2039) | 0.32 | 0.36 | 0.44 | 0.32 | 0.32 | 0.04 | 0.0 | 0.32 | – | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 10 | M.p.platycephalus (2040) | 0.28 | 0.32 | 0.4 | 0.28 | 0.36 | 0.52 | 0.52 | 0.36 | 0.52 | – | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 11 | M.p.taeniopterus (1896) | 0.64 | 0.68 | 0.76 | 0.64 | 0.68 | 0.8 | 0.76 | 0.68 | 0.76 | 0.68 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 12 | M.p.taeniopterus (1897) | 0.64 | 0.68 | 0.76 | 0.64 | 0.68 | 0.8 | 0.76 | 0.68 | 0.76 | 0.68 | 0.0 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 13 | M.p.taeniopterus (1986) | 0.6 | 0.64 | 0.72 | 0.6 | 0.64 | 0.76 | 0.72 | 0.64 | 0.72 | 0.64 | 0.12 | 0.12 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 14 | M.p.taeniopterus (2004) | 0.68 | 0.72 | 0.8 | 0.68 | 0.72 | 0.84 | 0.8 | 0.72 | 0.8 | 0.72 | 0.2 | 0.2 | 0.12 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 15 | M.p.taeniopterus (2005) | 0.56 | 0.6 | 0.68 | 0.56 | 0.6 | 0.72 | 0.68 | 0.6 | 0.68 | 0.6 | 0.08 | 0.08 | 0.04 | 0.12 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 16 | M.p.taeniopterus (2006) | 0.56 | 0.6 | 0.68 | 0.56 | 0.6 | 0.72 | 0.68 | 0.6 | 0.68 | 0.6 | 0.08 | 0.08 | 0.04 | 0.12 | 0.0 | – | 0.0 | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 17 | M.p.taeniopterus (2007) | 0.56 | 0.6 | 0.68 | 0.56 | 0.6 | 0.72 | 0.68 | 0.6 | 0.68 | 0.6 | 0.08 | 0.08 | 0.04 | 0.12 | 0.0 | 0.0 | – | 0.0 | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 18 | M.p.taeniopterus (2008) | 0.56 | 0.6 | 0.68 | 0.56 | 0.6 | 0.72 | 0.68 | 0.6 | 0.68 | 0.6 | 0.08 | 0.08 | 0.04 | 0.12 | 0.0 | 0.0 | 0.0 | – | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 19 | M.p.taeniopterus (2009) | 0.56 | 0.6 | 0.68 | 0.56 | 0.6 | 0.72 | 0.68 | 0.6 | 0.68 | 0.6 | 0.08 | 0.08 | 0.04 | 0.12 | 0.0 | 0.0 | 0.0 | 0.0 | – | 0.0 | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 20 | M.p.taeniopterus (2029) | 0.64 | 0.68 | 0.76 | 0.64 | 0.68 | 0.8 | 0.76 | 0.68 | 0.76 | 0.68 | 0.16 | 0.16 | 0.12 | 0.2 | 0.08 | 0.08 | 0.08 | 0.08 | 0.08 | – | 0.19 | 0.19 | 0.19 | 0.0 | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 21 | M.platycephalus (MGLP42) | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 0.0 | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 22 | M.platycephalus (MGLP27) | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 0.0 | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 23 | M.platycephalus (MGLP32) | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 0.19 | 0.19 | 0.19 | 0.19 | 0.56 | 0.19 |
| 24 | M.platycephalus (KM019355) | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 0.0 | 0.0 | 0.0 | 0.74 | 0.37 |
| 25 | M.platycephalus (UW046303) | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 0.0 | 0.0 | 0.74 | 0.37 |
| 26 | M.p.taeniopterus (bg54) | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 0.0 | 0.74 | 0.37 |
| 27 | M.p.taeniopterus (bg31) | - | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 0.75 | 0.37 |
| 28 | M.platycephalus (UW150203) | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 0.37 |
| 29 | M.platycephalus (UW150204) | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – |
На основе данных о комбинированных нуклеотидных последовательностях общей длиной 2511 пн, включающих гены COI, цитохрома b и 16S рРНК, а также сведений об участке гена COI длиной 537 пн и информации из GenBank и BOLD реконструированы филогенетические деревья (рис. 3, 4). В базальной части деревьев находятся гаплотипы внешних групп. Экземпляры M. platycephalus из Охотского и Японского морей образуют две обособленные группы. На филогенетическом дереве, полученном на основе данных о нуклеотидных последовательностях генов COI, цитохрома b и 16S рРНК (рис. 3), кластер широколобки из Охотского моря имеет четкую дихотомическую структуру; кластер представителей этого вида из Японского моря неразрешен, поскольку от его центрального узла ответвляется несколько линий ДНК (рис. 3). Топология второго филогенетического дерева (рис. 4) свидетельствует о том, что дальневосточная широколобка из Берингова моря дифференцирована от представителей этого вида из других морей, ее гаплотипы формируют отдельный кластер. Основные узлы ветвления деревьев поддержаны достоверными значениями апостериорной вероятности, следовательно, их образование можно считать надежным.
Рис. 3.
Байесовское дерево, реконструированное по данным анализа нуклеотидных последовательностей генов COI, цитохрома b, 16S рРНК. Числа в основаниях кластеров – оценки апостериорной вероятности, в скобках – номера образцов.
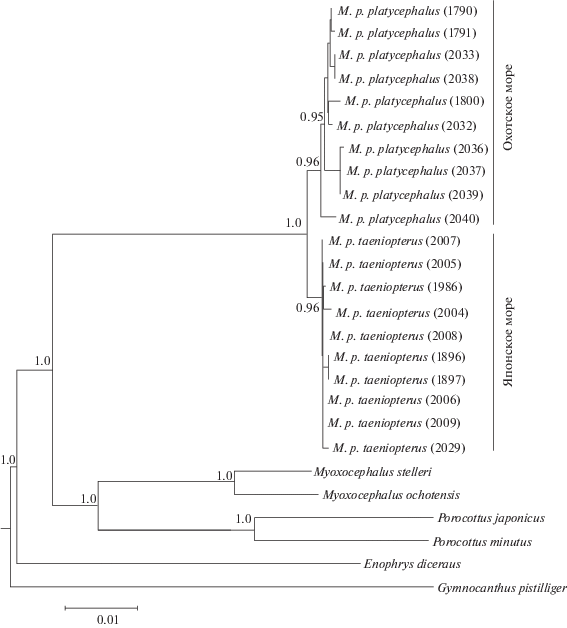
Рис. 4.
Байесовское дерево, реконструированное по данным анализа нуклеотидных последовательностей фрагмента гена COI, в том числе по данным из GenBank. Обозначения, как на рис. 3.

ОБСУЖДЕНИЕ
Результаты проведенного молекулярно-генетического анализа свидетельствуют о неоднородности вида Megalocottus platycephalus. Наблюдаемая изменчивость обусловлена генетическими различиями между экземплярами M. platycephalus, выловленными как в относительно близких (заливы Восток и Ольга, бухты Токарева и Шестакова), так и в очень удаленных районах ареала (Тауйская губа Охотского моря и зал. Петра Великого Японского моря). Однако максимальный вклад в генетическую гетерогенность дальневосточной широколобки вносят различия охотоморской и япономорской групп. В нуклеотидных последовательностях генов цитохрома b и COI обнаружены замены, объединяющие всех особей внутри группы и дифференцирующие группы друг от друга. В одном из самых эволюционно-консервативных в митохондриальном геноме гене 16S рРНК, изменчивость которого могла бы служить доказательством давней и значительной дивергенции, таких нуклеотидных замен не выявлено.
В целом число обнаруженных у M. platycephalus вариабельных сайтов составило 1, 0.3 и 3% для генов COI, 16S рРНК и цитохрома b соответственно. Такие значения являются очень низкими по сравнению с уровнями межвидовой дивергенции в семействе Cottidae, установленными, например, для нуклеотидных последовательностей этих же участков мтДНК у видов рода Gymnocanthus (7.7, 8.4 и 11.9% для генов COI, 12S-16S рРНК и цитохрома b) (Yamazaki et al., 2013).
Ранее по данным анализа участка гена COI показаны разные возрастающие уровни генетической дивергенции в таксонах Scorpaeniformes разного ранга, в частности семейства Cottidae: для популяций одного вида – не более 1%, для видов одного рода – 3.8% (Kartavtsev et al., 2009). Полученные в настоящей работе р-дистанции между последовательностями гена COI охотоморских и япономорских M. platycephalus не превышают внутривидовые значения – 0.19% (табл. 2), в то время как близкородственные виды Myoxocephalus stelleri и M. ochotensis дифференцированы на 2.79%.
Подобная тенденция наблюдается и при анализе комбинированных нуклеотидных последовательностей генов COI, цитохрома b и 16S рРНК. M. platycephalus из Охотского и Японского морей различается незначительно (на 0.67%; табл. 2) по сравнению с видами M. stelleri и M. ochotensis (2.2%), Porocottus minutus и P. japonicus (4.86%).
Для семейства Cottidae известны и другие примеры разных оценок дифференциации на разных таксономических уровнях. Генетическое расстояние между североамериканским Myoxocephalus quadricornis thompsonii и аркто-северо-европейским M. q. quadricornis подвидами на основе изменчивости митохондриальных генов цитохрома b, АТФаз 6 и 8 составляет 0.9% (Kontula, Väinölä, 2003). В то же время дистанции между видами рода Myoxocephalus (M. jaok/M. stelleri) для генов COI и цитохрома b достигают 2.08% (Подлесных, Морева, 2014). Сравнение объединенных последовательностей мтДНК (гены COI и 16S рРНК) видов Blepsias bilobus и B. cirrhosus показывает различие в 2.6–3.6% (собственные данные).
Топология филогенетического дерева, построенного по комбинированным последовательностям мтДНК (рис. 3), подтверждает подразделенность дальневосточной широколобки в соответствии с географической приуроченностью к определенному месту обитания, с одной стороны, и невысокий уровень генетических различий – с другой. В структуре дерева выделяются два кластера M. platycephalus: в первый входят гаплотипы рыб из Охотского моря, во второй – из Японского моря. В пределах каждого кластера наблюдается дифференциация мтДНК. В япономорской группе она несущественная; взаимоотношения гаплотипов неочевидные, поскольку для этого кластера свойственна политомия. В охотоморской группе генетическая дифференциация выше (табл. 2), топология кластера более четкая: в его основании находится гаплотип особи из зал. Одян Тауйской губы, затем обособляется микрокластер, объединяющий экземпляры из этой же локальности. Однако в целом широколобка из зал. Одян отдельной группировки не формирует, ее гаплотипы разбросаны по всему охотоморскому кластеру, а некоторые объединяются с таковыми экземпляров из б. Шестакова, расположенной на значительном расстоянии.
Представители M. platycephalus, выловленные в зал. Одян Охотского моря, характеризуются относительно высокой степенью генетической дифференциации как от особей из других районов обитания, так и друг от друга: в некоторых случаях значения р-дистанций достигают 0.52% (табл. 2). Вероятно, это связано с размерно-возрастными особенностями вида: для популяций дальневосточной широколобки известны тугорослые и быстрорастущие группы особей (Гудков, 2006), возможно, различающиеся и по молекулярно-генетическим признакам.
Большинство исследователей считает, что дальневосточная широколобка M. platycephalus объединяет два подвида: северный M. p. platycephalus и южный M. p. taeniopterus (Андрияшев, 1954; Неелов, 1979; Линдберг, Красюкова, 1987; Никифоров и др., 1997; Гудков, 2004, 2006; Соколовский и др., 2011). Однако значимость морфологических различий между северными и южными представителями данного вида не определена. Для дифференциации подвидов M. p. platycephalus и M. p. taeniopterus Неелов (1979) приводит следующие особенности их внешней морфологии: длина нижней челюсти; степень развития заглазничных и затылочных бугров, а также гребня между ними; форма предкрышечных шипов; расстояние между первым и вторым спинными плавниками; окраска спинных, грудных и брюшных плавников; длина брюшных плавников и концов их свободных лучей. Гудков (2006) отмечает, что некоторые перечисленные морфологические особенности подвержены популяционной, размерной и половой изменчивости, и это ограничивает их использование в таксономии. В качестве значимых признаков для разделения подвидов он предлагает такие, как длина нижней челюсти, степень развития бугров, окраска грудных плавников, форма свободных концов лучей брюшных плавников, длина и окраска брюшных плавников у самок (самцы северного подвида в анализе отсутствуют). При этом состояние перечисленных признаков, разделяющих северный и южный подвиды, также варьирует и перекрывается (Гудков, 2006, см. табл. 1). Например, нижняя челюсть у M. p. taeniopterus выступает незначительно, однако имеются исключения – несколько крупных самок; у M. p. platycephalus, напротив, нижняя челюсть длиннее верхней, но также за редким исключением.
Информация о валидности видов M. platycephalus и M. taeniopterus, опубликованная в последних каталогах и списках (Bogutskaya et al., 2008; Parin et al., 2014; Dyldin, Orlov, 2017), не подкреплена сравнительно-морфологическими данными, доказывающими их видовую самостоятельность, кроме ссылок на исследование Гудкова (2006). Однако в последней работе северная и южная дальневосточные широколобки рассматриваются как подвиды, с уточнением диагностических признаков, пригодных для их идентификации. Представляется маловероятным, что указанные выше морфологические особенности, состояние которых неустойчиво и изменяется в зависимости от размера, пола и возраста рыб, можно считать надежными для подтверждения валидности видов.
Недавно впервые получены данные о кариотипах южной и северной дальневосточных широколобок. Сравнительный анализ M. p. taeniopterus из зал. Восток Японского моря и M. p. platycephalus из зал. Одян Охотского моря показал их сходство по числу и морфологии хромосом, а также по числу хромосомных плеч. Однако обнаружены различия по числу и локализации ядрышковых организаторов, что, по мнению авторов, позволяет дифференцировать подвиды (Морева, Борисенко, 2014, 2015).
Результаты настоящей работы подтверждают, что изученные группы M. platycephalus из Охотского и Японского морей, вероятно, относятся к разным подвидам. Для тестирования этого предположения, основанного на молекулярно-генетическом анализе, была использована информация о нуклеотидных последовательностях участка гена COI мтДНК всех представителей рода Megalocottus, имеющаяся в GenBank и BOLD. Топология филогенетического дерева, реконструированного на основе последовательностей гена COI (рис. 4), в целом повторяет структуру дерева, построенного по комбинированным участкам генов COI, цитохрома b и 16S рРНК (рис. 3): южная и северная M. platycephalus четко дифференцируются на два кластера. Гаплотипы распределяются следующим образом: в кластер южной широколобки попадают особи из заливов Восток (зал. Петра Великого, Японское море) и Анива (южная часть о-ва Сахалин, Охотское море), а в кластер северной широколобки – из зал. Одян (Тауйская губа, Охотское море). Кластер дальневосточной широколобки из Берингова моря занимает внешнюю позицию по отношению к общему кластеру вида.
Информация о нуклеотидных последовательностях гена COI M. platycephalus под номерами UW150203 и UW150204 взята из базы данных BOLD, а экземпляры пойманы в восточной части Берингова моря в зал. Нортон-Саунд (Mecklenburg et al., 2016). Судя по оценкам р-дистанций, дальневосточная широколобка из Берингова моря отличается от особей из Охотского и Японского морей на 0.19–0.75%. При этом один беринговоморский экземпляр (UW150204) дифференцирован от охотоморских особей так же, как последние отличаются от япономорских (на 0.19%), а от рыб из Японского моря – существеннее (на 0.37%). Другой экземпляр (UW150203) отличается значительнее: на 0.37% от дальневосточной широколобки из Берингова моря, на 0.56 и 0.74–0.75% – от широколобки из Японского и Охотского морей соответственно (табл. 2).
Полученные данные позволяют предположить, что M. platycephalus из Берингова моря представляет еще одну хорошо обособленную географическую группу дальневосточной широколобки, которая, возможно, относится к подвиду M. p. laticeps. Этот подвид, названный восточным, в отличие от северного M. p. platycephalus и южного M. p. taeniopterus, распространен в восточной части Берингова моря от побережья п-ва Аляска до Порт-Кларенс (Шмидт, 1950). По мнению Андрияшева (1954), “M. laticeps… может оказаться географическим подвидом, связанным с камчатскими экземплярами постепенными переходными формами из северной части Берингова моря”. Вероятно, именно наличием переходных форм можно объяснить генетические различия, обнаруженные между особями из Берингова моря.
Таким образом, в результате исследования показано, что дальневосточная широколобка генетически неоднородна. Наблюдаемая изменчивость генов мтДНК связана с географическим распространением вида. Представители M. platycephalus из Японского и Охотского морей образуют обособленные группы, охотоморская группа характеризуется более высокой генетической изменчивостью по сравнению с япономорской. Оценки генетических дистанций между япономорской и охотоморской группами M. platycephalus не превышают уровня внутривидовых различий, установленного для таксонов семейства Cottidae. Полученные результаты позволяют предположить, что изученные географические группы дальневосточной широколобки являются разными подвидами: южным M. p. taeniopterus и северным M. p. platycephalus. На основе данных об изменчивости участка гена COI экземпляров M. platycephalus из Берингова моря сделано предположение о существовании еще одной географической группы, которая может относиться к подвиду M. p. laticeps, ранее сведенному в синонимию M. p. platycephalus. По-видимому, географические подвиды связаны постепенными переходными формами.
Для решения вопроса о таксономической структуре M. platycephalus требуется обстоятельный сравнительно-морфологический и остеологический анализ. Чтобы подтвердить выводы и предположения, сделанные на основе молекулярно-генетических данных, необходимо дальнейшее изучение представителей вида из разных районов обитания с расширением объема выборок и увеличением точек сбора материала по всему ареалу.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований (№ 15-29-02416_офи_м) и Программы “Дальний Восток” (проект № 18-4-002).
Список литературы
Андрияшев А.П. Рыбы северных морей СССР. М.; Л.: АН СССР. 1954. 566 с.
Богуцкая Н.Г., Насека А.М. Каталог бесчелюстных и рыб пресных и солоноватых вод России с номенклатурными и таксономическими комментариями. М.: Товарищество науч. изд. КМК. 2004. 389 с.
Гудков П.К. Южная дальневосточная широколобка Megalocottus platycephalus taeniopterus (Kner) из лагун северо-восточного Сахалина (морфология, биология, численность) // Изв. ТИНРО. 2004. Т. 139. С. 145–158.
Гудков П.К. Морфобиологические особенности южной дальневосточной широколобки Megalocottus platycephalus taeniopterus (Kner) (Scorpaeniformes, Cottidae) острова Сахалин // Вопр. ихтиологии. 2006. Т. 46. № 6. С. 766–780.
Линдберг Г.У., Красюкова З.В. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Л.: Наука. 1987. Ч. 5. 526 с.
Максименков В.В., Токранов А.М. Питание северной дальневосточной широколобки в эстуарии реки Большой (западная Камчатка) // Биол. моря. 1992. № 1–2. С. 34–42.
Морева И.Н., Борисенко С.А. Кариотип северной дальневосточной широколобки Megalocottus platycephalus platycephalus (Pallas, 1814) (Pisces: Cottidae) из залива Одян Японского моря // Биол. моря. 2014. Т. 40. № 2. С. 137–142.
Морева И.Н., Борисенко С.А. Кариотип южной дальневосточной широколобки Megalocottus platycephalus taeniopterus (Kner, 1868) (Pisces: Cottidae) из залива Восток Японского моря // Биол. моря. 2015. Т. 41. № 6. С. 425–429.
Морева И.Н., Радченко О.А., Петровская А.В., Борисенко С.А. Молекулярно-генетический и кариологический анализ двурогих бычков группы Enophrys diceraus (Cottidae) // Генетика. 2017. Т. 53. № 9. С. 1086–1097.
Неелов А.В. Сейсмосенсорная система и классификация керчаковых рыб (Cottidae: Myoxocephalinae, Artediellinae). Л.: Наука. 1979. 208 с.
Никифоров С.Н., Гришин А.Ф., Захаров А.В., Шелепаха Г.Н. Состав ихтиофауны и распространение рыб в бассейнах рек Поронай и Тымь // Вопр. ихтиологии. 1997. Т. 37. № 3. С. 327–337.
Подлесных А.В., Морева И.Н. Изменчивость и связи дальневосточных видов керчаков Myoxocephalus и Megalocottus (Cottidae) по маркерам мтДНК и кариологическим данным // Генетика. 2014. Т. 50. № 9. С. 1075–1083.
Радченко О.А., Черешнев И.А., Петровская А.В. Родственные отношения и дивергенция некоторых таксонов рыб подсемейства Lycodinae (Zoarcidae, Pisces) по молекулярно-генетическим и морфологическим данным // Вопр. ихтиологии. 2009. Т. 49. № 5. С. 603–616.
Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. Рыбы залива Петра Великого. Владивосток: Дальнаука. 2011. 431 с.
Таранец А.Я. Краткий определитель рыб советского Дальнего Востока и прилежащих вод // Изв. ТИНРО. 1937. Т. 11. С. 112–115.
Токранов А.М. Размерно-возрастная структура северной дальневосточной широколобки Megalocottus platycephalus platycephalus Pallas (Cottidae, Pisces) в эстуарии реки Большой (Западная Камчатка) // Бюл. Моск. о-ва испыт. природы. 1995. Отд. биол. Т. 100. Вып. 3. С. 40–47.
Федоров В.В. Список рыб Берингова моря // Изв. ТИНРО. 1973. Т. 87. С. 42–71.
Федоров В.В., Черешнев И.А., Назаркин М.В. и др. Каталог морских и пресноводных рыб северной части Охотского моря. Владивосток: Дальнаука. 2003. 206 с.
Черешнев И.А., Волобуев В.В., Хованский И.Е., Шестаков А.В. Прибрежные рыбы северной части Охотского моря. Владивосток: Дальнаука. 2001. 197 с.
Шмидт П.Ю. Рыбы Охотского моря. М.; Л.: АН СССР. 1950. 370 с.
Bandelt H.-J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. P. 37–48.
Bogutskaya N.G., Naseka A.M., Shedko S.V. et al. The fishes of the Amur River: updated checklist and zoogeography // Ichthyol. Explor. Freshwaters. 2008. V. 19. № 4. P. 301–366.
Dyldin Yu.V., Orlov A.M. Ichthyofauna of fresh and brackish waters of Sakhalin Island: an annotated list with taxonomic comments: 3. Gadidae – Cryptacanthodidae families // J. Ichthyol. 2017. V. 57. № 1. P. 53–88.
Huson D.H., Bryant D. Application of phylogenetic networks in evolutionary studies // Mol. Biol. Evol. 2006. V. 23. P. 254–267.
Kartavtsev Y.Ph., Sharina S.N., Goto T. et al. Sequence diversity at cytochrome oxidase 1 (Co-1) gene among sculpins (Scorpaeniformes, Cottidae) and some other Scorpionfish of Russia Far East with phylogenetic and taxonomic insights // Genes Genom. 2009. V. 31. № 2. P. 183–197.
Kontula T., Väinölä R. Relationships of Palearctic and Nearctic ‘glacial relict’ Myoxocephalus sculpins from mitochondrial DNA data // Mol. Ecol. 2003. V. 12. P. 3179–3184.
Leaché A.D., Reeder T.W. Molecular systematics of the Eastern Fence Lizard (Sceloporus undulatus): a comparison of parsimony, likelihood, and Bayesian approaches // Syst. Biol. 2002. V. 51. № 1. P. 44–68.
Maniatis T., Fritsch E.F., Sambrook J. Molecular cloning: A laboratory manual. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory. 1982. 480 p.
Mecklenburg C.W., Mecklenburg T.A., Sheiko B.A., Steinke D. Pacific Arctic marine fishes: Conservation of Arctic Flora and Fauna (CAFF) Monitoring Series. Rep. No. 23. Akureyri, Iceland. 2016. 406 p.
Mecklenburg C.W., Mecklenburg T.A., Thorsteinson L.K. Fishes of Alaska. Bethesda, Maryland: American Fisheries Society. 2002. 1037 p.
Parin N.V., Evseenko S.A., Vasil’eva E.D. Fishes of Russian seas: Annotated catalogue. Moscow: KMK. 2014. 733 p.
Parin N.V., Fedorov V.V., Sheiko B.A. An annotated catalog of fishlike vertebrates and fishes of the seas of Russia and adjacent countries: Part 2. Order Scorpaeniformes // J. Ichthyol. 2002. V. 42. № 1. P. 60–135.
Posada D., Crandall K.A. Modeltest: testing the model of DNA substitution // Bioinformatics. 1998. V. 14. P. 817–818.
Ronquist F., Huelsenbeck J.P. MrBayes 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. P. 1572–1574.
Swofford D.L. PAUP*. Phylogenetic analysis using parsimony (*and other methods). Version 4. Sunderland, Massachusetts: Sinauer Associates. 2002. 144 p.
Tamura K., Stecher G., Peterson D. et al. MEGA 6: Molecular Evolutionary Genetics Analysis version 6.0 // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Yamazaki A., Markevich A., Munehara H. Molecular phylogeny and zoogeography of marine sculpins in the genus Gymnocanthus (Teleostei; Cottidae) based on mitochondrial DNA sequences // Mar. Biol. 2013. V. 160. P. 2581–2589.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря


