Биология моря, 2019, T. 45, № 1, стр. 17-24
Формирование популяционной структуры атлантической трески Gadus morhua Linnaeus, 1758 в четвертичном периоде
А. Н. Строганов 1, *, А. М. Орлов 2, А. В. Семенова 1, С. Ю. Орлова 2
1 Московский государственный университет им. М.В. Ломоносова (МГУ)
119991 Москва, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии (ВНИРО)
107140 Москва, Россия
* E-mail: andrei_str@mail.ru
Поступила в редакцию 06.03.2018
После доработки 11.04.2018
Принята к публикации 31.05.2018
Аннотация
Проведен сравнительный анализ изменчивости генетических характеристик в выборках из крупнейших стад атлантической трески Gadus morhua Linnaeus, 1758 Северо-Восточной (СВА) и Северо-Западной (СЗА) Атлантики. По результатам попарной оценки генетической дифференциации, выполненной по аллозимным и микросателлитным маркерам, треска из акватории шельфа Новой Англии (СЗА) достоверно отличалась от трески исландско-гренландского и норвежско-баренцевоморского стад. При этом выборки трески из акваторий Восточной и Западной Гренландии, а также из Баренцева моря, несмотря на значительную географическую разобщенность, демонстрировали высокий уровень сходства по молекулярно-генетическим маркерам. Рассмотрены особенности формирования популяционной структуры трески в четвертичный период в связи с динамикой глобальных климатоокеанологических процессов.
Атлантическая треска Gadus morhua Linnaeus, 1758 эффективно освоила практически все акватории с глубинами до 800–1000 м и с температурой от 0 до 12–14°С вдоль европейского и американского побережий Северной Атлантики, сформировав высокочисленные далеко мигрирующие стада, а также островные, фиордовые и баночные группировки. Разнообразие условий жизни, высокая биологическая изменчивость и разнообразие форм затрудняют анализ популяционной структуры этого вида, путей его расселения и особенностей формообразования. Ситуация усложняется и изменчивостью глобальных климатоокеанологических условий, особенно выраженных в течение последнего миллиона лет. В наибольшей степени результаты оледенений проявились в бассейнах Атлантического и Северного Ледовитого океанов. В литературе изменение ареалов атлантической трески и некоторых других бореальных североатлантических видов рыб в периоды оледенений и межледниковий обсуждается с середины прошлого века (Шмидт, 1947; Серебряков, 1962; Марти, 1980; Gysels et al., 2004; Bigg et al., 2008; Pampoulie et al., 2008; Stefansson et al., 2009; Kettle et al., 2011). При этом по ряду вопросов до сих пор нет однозначного мнения, например, об уровне взаимодействия прибрежных и морских популяций, о специфике формирования численности и темпоральных особенностях изменения популяционной структуры.
Цель данной работы – исследование (в историческом аспекте с учетом глобальных климатических изменений в плейстоцене) механизмов формирования генетической дифференциации в группировках атлантической трески Северо-Восточной (СВА) и Северо-Западной (СЗА) Атлантики.
МАТЕРИАЛ И МЕТОДИКА
Выборки из группировок атлантической трески были получены в период с 2002 по 2015 г. сотрудниками ВНИРО и кафедры ихтиологии МГУ в собственных экспедициях в регионы Северной Атлантики и Северной Пацифики (2002, 2003, 2005, 2012 гг.), при участии в научно-исследовательских экспедициях Полярного научно-исследовательского института рыбного хозяйства и океанографии, Бергенского института морских исследований (Norwegian Institute of Marine Research, Bergen, Norway) в 2003 г. и Гренландского института природных ресурсов (Greenland Institute of Natural Resources, Nuuk, Greenland) в 2013 г., а также в ходе исследовательского рейса судна Национальной администрации по океанам и атмосфере “Генри Б. Бигелоу” (NOAA Ship “Henry B. Bigelow”, USA) в 2015 г.
Для генетических исследований замораживали пробы белых мышц трески и фиксировали в этиловом спирте фрагменты грудного плавника. Выборки трески (табл. 1, № 1–5) изучали методом электрофореза в крахмальном геле. После разделения белковых фракций по степени подвижности в электрическом поле их окрашивали. При обозначении аллелей исследованных аллозимных локусов руководствовались принятыми номенклатурными правилами (Shaklee et al., 1990). Анализировали унифицированные ферментные системы, применяемые для проведения популяционно-генетических исследований трески (Jorstad, 1984; Mork, Giever, 1999): AGP*, PGI-1*, LDH*, IDH* и PGM*. Дополнительный материал по треске из вод Исландии, Северного моря и зал. Мэн получен из литературных источников (Mork et al., 1985; Gjoseter et al., 1992).
Таблица 1.
Характеристика материала
| № | Выборка | Район | Показатели |
|---|---|---|---|
| Аллозимы | |||
| 1 | Nor1 | Норвежское море, Лофотенские острова, март 2002 г.; 67°24′ с.ш., 12°00′ в.д. | N = 36, Ap = 2.00, HE = 0.171 |
| 2 | Nor2 | Норвежское море, Лофотенские острова, март 2002 г.; 67°29′ с.ш., 12°18′ в.д. | N = 60, Ap = 2.50, HE = 0.179 |
| 3 | Pacif | Охотское море, западная Камчатка, ноябрь 2005 г.; 54°13′ с.ш., 154°42′ в.д. | N = 63, Ap = 2.00, HE = 0.016 |
| 4 | Bar1 | Баренцево море, губа Ура, май 2003 г.; 69°17′ с.ш., 32°48′ в.д. | N = 49, Ap = 2.50, HE = 0.166 |
| 5 | Bar2 | Баренцево море, западный Кильдин, май 2002 г.; 69°20′ с.ш., 34°04′ в.д. | N = 60, Ap = 2.00, HE = 0.169 |
| Микросателлиты | |||
| 6 | EG1 | Восточная Гренландия, август 2013 г.; 65°37′ с.ш., 29°35′ з.д. | N = 48, Ap = 9.37, HE = 0.598 |
| 7 | EG2 | Восточная Гренландия, август 2013 г.; 61°17′ с.ш., 41°35′ з.д. | N = 50, Ap = 9.75, HE = 0.599 |
| 8 | WG1 | Западная Гренландия, август 2013 г.; 62°18′ с.ш., 51°10′ з.д. | N = 52, Ap = 9.37, HE = 0.590 |
| 9 | WG2 | Западная Гренландия, август 2013 г.; 64°16ʹ с.ш., 53°32ʹ з.д. | N = 13, Ap = 6.12, HE = 0.625 |
| 10 | NS1 | Норвежское море, Лофотенские острова, март–апрель 2003 г.; 68°11′ с.ш., 14°23′ в.д. | N =90, Ap = 10.50, HE = 0.582 |
| 11 | NS2 | Норвежское море, о-в Смола, апрель 2003 г.; 63°33′ с.ш., 07°52′ в.д. | N = 50, Ap = 10.25, HE = 0.627 |
| 12 | BS | Баренцево море, восточный Кильдин, апрель 2012 г.; 69°19′ с.ш., 34°21′ в.д. | N = 50, Ap = 8.62, HE = 0.615 |
| 13 | 5Z | Шельф Новой Англии, банка Джорджес, сентябрь 2015 г.; 41°01′ с.ш., 69°01′ з.д. | N = 50, Ap = 9.25, HE = 0.650 |
Анализ микросателлитной ДНК в выборках трески СВА и СЗА (табл. 1, № 6–13) проводили с использованием восьми микросателлитных локусов: Gmo19, Gmo-G12, PGmo32, Gmo8, Gmo-G18, Gmo34, Gmo35 и Gmo3 (Jakobsdottir et al., 2006). Для ПЦР-амплификации использовали наборы Gene Pak PCR Core (ООО “ИзоГен”, Россия). Амплификацию микросателлитных локусов проводили в термоциклере “MJ Research PTC100” по схеме: разрушение ДНК, денатурация ДНК-матрицы, отжиг праймеров, синтез новых цепей. Продукты амплификации разделяли путем электрофореза в 6% неденатурирующем полиакриламидном геле, окрашивали бромистым этидием и фотографировали в ультрафиолетовом свете. Размеры аллелей по каждому локусу определяли с использованием программы “1D Image Analysis Software Version 3.5” (“Codak”) (Афанасьев и др., 2011).
С помощью программного пакета GDA (Lewis, Zaykin, 2001) (аллозимы, микросателлиты) определяли среднее число аллелей на полиморфный локус (Ap), соответствие распределению Харди–Вайнберга, ожидаемую (HE) и наблюдаемую (HO) гетерозиготность, коэффициент генетической дифференциации популяций (θ) (аналог FST) (Weir, 1996) и генетические дистанции Нея (Nei, 1978).
Программный пакет GENEPOP 3.4 (Raymond, Rousset, 1995) (аллозимы, микросателлиты) использовали для оценки попарной дифференциации популяций FST и значимости дифференциации по частотам аллелей с использованием точных тестов Фишера. Все вероятностные тесты были основаны на алгоритме цепей Маркова (Guo, Thompson, 1992). Уровень статистической значимости для множественных вероятностных тестов корректировали с помощью последовательной процедуры Бонферрони (Rice, 1989).
Данные по микросателлитным локусам с помощью программы MICROCHECKER исследовали на возможные ошибки генотипирования, а также на присутствие ноль-аллелей (Van Oosterhout et al., 2004).
Значимость корреляции генетических FST и географических дистанций (по кратчайшему водному пути с учетом биологических особенностей трески и основных направлений поверхностных течений, км) между группировками проверяли с помощью Мантель-теста (Mantel, 1967) в программе GENEPOP on the Web (http://genepop.curtin.edu.au) с использованием 1000 пермутаций (микросателлиты).
Популяционную структуру анализировали с помощью метода Байеса в программе STRUCTURE 2.3.4 (Pritchard et al., 2000) (микросателлиты). Использовали модель, допускающую генетическое смешение и корреляцию аллельных частот среди кластеров, с 400 000 первоначальными (burn-in) и 800 000 MCMC итерациями для К (гипотетического числа популяций) от 1 до 8, по три анализа для каждой величины К. Для оценки наиболее вероятного числа кластеров был применен метод ∆K (Evanno et al., 2005) с использованием Интернет-ресурса Structure Harvester (Earl, von Holdt, 2012). Иерархический анализ проведен с использованием тех же параметров, что и при основной кластеризации. Число возможных кластеров ограничивалось количеством выборок, входящих в состав анализируемого кластера. Число групп (К) определяли на основании ∆K, а также изменения оценок LnP(D).
По частотам аллелей аллозимных локусов в пакете программ PHYLIP, версия 3.68 (Felsenstein, 2004) рассчитывали генетические дистанции Нея. Интенсивность генной миграции Nm – количество мигрантов на поколение (микросателлиты) – вычисляли на основе анализа генетической дифференциации с использованием уравнения Райта (Wright, 1951): Nm = (1/FST – 1)/4.
Время дивергенции (T) группировок атлантической трески СВА и СЗА определяли на основе концепции молекулярных часов (Vawter et al., 1980; Weir, Schulter, 2008; Bigg et al., 2010), используя данные по изменчивости аллозимных локусов. Калибровку молекулярных часов проводили на основе данных по дифференциации атлантической и тихоокеанской трески (Строганов, 2015) с учетом хронологии геологических, климатоокеанологических и биогеографических событий в северном регионе (Клиге и др., 1998; Гладенков, Гладенков, 2004; Uriarte, 2011), а также ранее опубликованных методических материалов (Vawter et al., 1980; Grant, Stahl, 1988).
РЕЗУЛЬТАТЫ
Из проведенных локус-специфичных тестов на соответствие наблюдаемых генотипических распределений теоретическому распределению Харди–Вайнберга статистически значимые отклонения после применения коррекции Бонферрони показаны в двух локусах. Неравновесность обнаружена в локусе Gmo8 в одной выборке трески (NS2) из Норвежского моря (Р = 0.000).
Программа MICROCHECKER не выявила возможных ошибок генотипирования ни в одном из изученных микросателлитных локусов. В выборке BS показана возможность присутствия ноль-аллелей в локусе Gmo-G12. В остальных выборках и локусах ноль-аллелей не обнаружено.
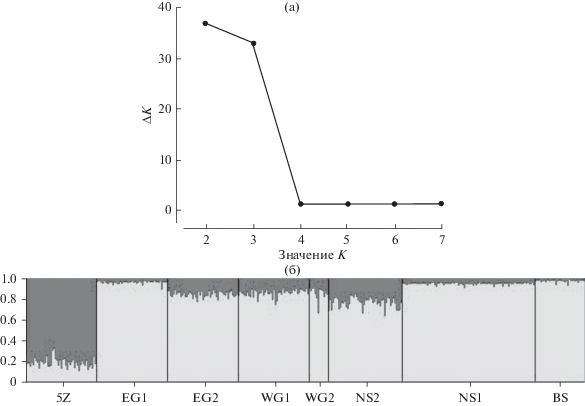
Результаты кластеризации в программе STRUCTURE показали наибольшее значение ∆K для двух кластеров. Один кластер образовала треска шельфа Новой Англии (выборка 5Z), в другой объединились остальные семь выборок (EG1, EG2, WG1, WG2, NS1, NS2, BS) (рис. 1). При исключении выборки 5Z из анализа подразделенности между остальными выборками трески не обнаружено.
Рис. 1.
Оценка методами байесовской кластеризации оптимального количества кластеров (a) и вероятности принадлежности к определенному кластеру (б) в исследуемых образцах трески (обозначения выборок, как в табл. 1).
Сходные результаты получены при анализе генетической дифференциации (θ) на основных уровнях таксономической иерархии (табл. 2). Выявлена дифференция на достоверном уровне между совмещенной группой выборок трески исландско-гренландского и лофотено-баренцевоморского стад против трески шельфа Новой Англии (θ = 2.932%). Дифференциация внутри сравниваемых группировок была гораздо ниже 2%, что предполагает отсутствие в них выраженной генетической подразделенности (Животовский, 1991). Низкий уровень генетической дифференциации трески шельфа Новой Англии, исландско-гренландского и лофотено-баренцевоморского стад, а также объединенной группировки исландско-гренландского и лофотено-баренцевоморского стад сопровождался значительным уровнем генной миграции (табл. 2). Пониженный уровень генной миграции между треской исландско-гренландского и лофотено-баренцевоморского стад и треской шельфа Новой Англии сопровождался достоверным значением генетической дифференциации.
Таблица 2.
Уровень генетической дифференциации между выборками атлантической трески (по восьми микросателлитным локусам)
| Выборка | Уровень генетической дифференциации, % |
|---|---|
| Исландско-гренландское стадо (EG1, EG2, WG1, WG2): Ap = 8.65, HE = 0.603 | 0.035 (–0.400–0.579)*, Nm = 714.03 |
| Лофотено-баренцевоморское стадо (NS1, NS2, BS): Ap = 9.79, HE = 0.608 | 1.556 (0.069–4.290), Nm = 15.81 |
| Шельф Новой Англии (5Z): Ap = 7.75, HE = 0.651 | –0.105 (–1.099–1.187), Nm = 2499.75 |
| Исландско-гренландское стадо + лофотено-баренцевоморское стадо | 0.678 (0.012–1.830), Nm = 36.62 |
| (Исландско-гренландское стадо + лофотено-баренцевоморское стадо) – шельф Новой Англии | 2.932 (1.228–6.070), Nm = 8.27 |
| Исландско-гренландское стадо – шельф Новой Англии | 2.981 (1.011–6.896), Nm = 8.13 |
| Лофотено-баренцевоморское стадо – шельф Новой Англии | 2.722 (1.371–4.914), Nm = 8.93 |
* В скобках – 95%-й доверительный бутстреп-интервал. Примечание. Ар – среднее число аллелей на полиморфный локус; HE – средняя ожидаемая гетерозиготность; Nm – интенсивность генных потоков; обозначения выборок, как в табл. 1.
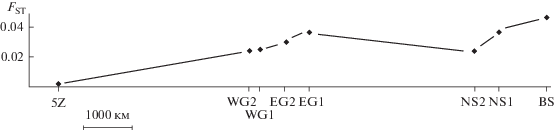
Корреляция между географическими расстояниями между выборками и генетической дифференциацией недостоверна на основании показателей FST (Р = 0.06). Если материал трески шельфа Новой Англии получен на акватории ограниченного размера, то выборки трески исландско-гренландского и лофотено-баренцевоморского стад, напротив, охватывают ареал протяженностью более 5000 км и при этом (вопреки положениям модели изоляции расстоянием) демонстрируют низкий уровень генетической дифференциации (рис. 2).
Рис. 2.
Генетическая дифференциация (попарные значения FST) между выборкой шельфа Новой Англии и остальными выборками (обозначения выборок, как в табл. 1). На оси абсцисс выборки расположены по направлению с востока на запад с увеличением расстояния от шельфа Новой Англии.
Значение времени дивергенции между треской СВА (выборки Норвежского, Баренцева и Северного морей, Исландии) и СЗА (зал. Мэн) (T = 0.25 млн лет назад, SD = 0.002) было получено с учетом калибровки молекулярных часов на основе генетических дистанций Нея (табл. 3) (D при 1.0 = 17.71 млн лет, SD = 0.706).
Таблица 3.
Оценки по пяти аллозимным локусам генетических расстояний (Nei, 1978) (обозначения выборок, как в табл. 1)
| Выборка | Nor1 | Nor2 | Pacif | Bar1 | Bar2 |
|---|---|---|---|---|---|
| Nor1 | – | – | – | – | – |
| Nor2 | –0.0015 | – | – | – | – |
| Pacif | 0.1671 | 0.1765 | – | – | – |
| Bar1 | –0.0015 | 0.0006 | 0.1592 | – | – |
| Bar2 | –0.0021 | –0.0013 | 0.1709 | –0.0002 | – |
ОБСУЖДЕНИЕ
Полученные методом байесовской иерархической кластеризации и с использованием методов анализа генной дифференциации результаты исследования выборок атлантической трески СВА и СЗА выявили две достоверно дифференцированные на близком к подвидовому уровню для рода Gadus (Строганов, 2015) группировки, одна из которых представлена треской шельфа Новой Англии, а другая объединяет выборки трески исландско-гренландского и лофотено-баренцевоморского стад. На основе анализа генетических данных (собственные и полученные из литературных источников) и климатоокеанологических характеристик показана специфика организации группировок атлантической трески с разным уровнем генной дифференциации на акваториях СВА и СЗА. Генофонд атлантической трески в Северной Атлантике представлен двумя основными генетическими пулами. Первый пул формируется треской из шельфовых акваторий Северного, Норвежского и Баренцева морей, прибрежий Исландии, Восточной и Западной Гренландии. Генетическое сходство этих группировок трески в настоящее время поддерживается за счет генной миграции, в том числе, по-видимому, с участием североморских группировок. Таким образом, несмотря на несомненную репродуктивную самостоятельность исландско-гренландского и лофотено-баренцевоморского стад, определенный уровень генной миграции обеспечивает генетическую идентичность атлантической трески на акватории огромной протяженности. Второй пул поддерживается комплексом баночных, прибрежных и фиордовых группировок атлантической трески североамериканских акваторий от Лабрадора до Новой Англии, совершающих продолжительные внутренние зимовальные, нерестовые и нагульные миграции (Постолакий, 1978; Lough, 2004). Значительный уровень генетической дифференциации между этими двумя пулами в настоящее время формируется, очевидно, вследствие пониженного уровня генной миграции. Препятствием для расселения трески являются в основном большие глубины Девисова пролива (более 1000 м) и экстремально низкая для трески температура арктических вод (ниже –1°С), проникающих из моря Баффина с Канадским течением, а также с прибрежной и шельфовой струями Лабрадорского течения (Атлас океанов, 1977; Постолакий, 1978; Berg, 2016).
Поддержанию генной дифференциации между метапопуляциями способствуют не только особенности поверхностных циркуляций в Северной Атлантике. Формирование и динамика климатоокеанологических условий в этом регионе в плейстоцен-голоценовое время, на наш взгляд, также являются причиной генетических различий между группировками атлантической трески. Так, на основе данных по изменчивости ядерной и митохондриальной ДНК (Bigg et al., 2008) высказано предположение, что треска атлантических вод Канады и популяции прибрежья Исландии дивергировали более чем 100 тыс. лет назад в период межледниковья. К аналогичному мнению на основе митохондриальной ДНК пришли Карр и Маршал (Carr, Marshall, 2008). Бигг с соавторами (Bigg et al., 2010), отмечая присутствие атлантической трески по американскому и европейскому прибрежьям атлантического океана по крайней мере в течение последних 100 тыс. лет, высказали предположение о ее дифференциации в более ранний период – около 100–150 тыс. лет назад. Наши данные на основе анализа изменчивости аллозимных и микросателлитных локусов демонстрируют достаточно высокий достоверный уровень генетической дифференциации трески СВА и СЗА (выборки из акваторий Западной Гренландии также отнесены к СВА в связи с принадлежностью к единому исландско-гренландскому стаду) с временем дивергенции около 250 тыс. лет назад, приходящимся на завершение первой – начало второй половины рисского оледенения. Разгар рисского оледенения (0.333–0.144 млн лет назад), сходного по масштабу и даже превышавшего по объему вюрмское оледенение (Svendsen et al., 2004), характеризовался ростом ледников, сильной океанской регрессией, деградацией северных ответвлений Гольфстрима и резким смещением в южном направлении полярного фронта (Ruddiman, McIntyre, 1981; Ruddiman et al., 1989; Rohling et al., 1998; Dyke et al., 2002; LeGrande, Lynch-Stieglitz, 2007; Naafs et al., 2010). Все это, по-видимому, привело к смещению от Лабрадора в сторону Новой Шотландии и Новой Англии границы ареала трески СЗА (Shaw, 2006). Треска СВА исчезла из прибрежий Гренландии, Исландии, а также Баренцева, Норвежского и Северного морей, остатки ее ареала уцелели в прибрежных акваториях Великобритании и Пиренейского полуострова.
В результате воздействия ледниковых условий треска по обеим сторонам Атлантики, разделенная непреодолимыми для нее глубинами центральных акваторий, отрезанная полярным фронтом от Порога Уайвилла Томсона (своего рода мост между Южной Норвегией, Шетландскими и Фарерскими островами, Исландией и Гренландией, по которому молодь и взрослые особи многих видов мигрируют из восточной части Северной Атлантики в западную) (см.: Марти, 1980), потеряла возможность осуществления контактов и обмена генетическим материалом между акваториями СВА и СЗА. Как результат – рост уровня генетической дифференциации трески восточного и западного побережий Атлантики. С достаточно высокой степенью уверенности можно полагать, что именно такое развитие ситуации в Северной Атлантике привело к формированию определенного уровня генетической дифференциации трески СВА и СЗА.
Интересно отметить, что, в отличие от более ранних исследований (Шмидт, 1936, 1947; Марти, 1980), в современных работах сокращенные ареалы называются ледниковыми рефугиумами (Consuegra et al., 2002; Gysels et al., 2004; Maggs et al., 2008; Pampoulie et al., 2008; Kettle et al., 2011). На наш взгляд, применение подобной терминологии для морских пелагических и придонно-пелагических видов не всегда оправдано, так как по сути наблюдается закономерный ответ бореальных видов на глобальные климатоокеанологические явления, имеющие к тому же периодический характер.
Авторы А.М. Орлов и С.Ю. Орлова признательны Гренландскому институту природных ресурсов (Greenland Institute of Natural Resources, Nuuk, Greenland) за участие в рейсе на НИС “Паамиут” (RV “Paamiut”) и за возможность сбора материалов, использованных в данной статье. Мы выражаем благодарность Якубу Киркуну (Jakub Kircun, NOAA Fisheries, Woods Hole, USA) за переданные в наше распоряжение сборы трески из вод Новой Англии и К. Йорстаду (Jorstad K.E., Institute of Marine Research, Bergen, Norway) за многолетнее плодотворное сотрудничество. Данная работа посвящена памяти заслуженного профессора МГУ Г.Г. Новикова – вдохновителя и организатора исследований атлантической трески.
Работа выполнена при частичной финансовой поддержке грантов РФФИ № 15-29-02448 (полевой сбор материала), № 16-05-00317 (камеральная обработка, подготовка сводных таблиц, рукописи) и госбюджетной темы 01 2001 17418. Лабораторный анализ образцов выполнен за счет средств Российского научного фонда (грант “Научные основы создания национального банка-депозитария живых систем” № 14-50-00029).
Список литературы
Атлас океанов. Атлантический и Индийский океаны. М.: ГУНО МО СССР. 1977. 306 с.
Афанасьев К.И., Рубцова Г.А., Шитова М.В. и др. Популяционная структура кеты Oncorhynchus keta российского Дальнего Востока, выявленная по микросателлитным маркерам // Биол. моря. 2011. Т. 37. № 1. С. 39–47.
Гладенков А.Ю., Гладенков Ю.Б. Начало формирования межокеанических связей Пацифики и Арктики через Берингов пролив в неогене // Стратиграфия и геол. корреляция. 2004. Т. 12. № 2. С. 72–89.
Животовский Л.А. Популяционная биометрия. М.: Наука. 1991. 276 с.
Клиге Р.К., Данилов И.Д., Конищев В.Н. История гидросферы. М.: Науч. мир. 1998. 368 с.
Марти Ю.Ю. Миграции морских рыб. М.: Пищ. пром-сть. 1980. 248 с.
Постолакий А.И. Жизненный цикл и промысел лабрадорской трески. Мурманск: Мурманск. кн. изд-во. 1978. 118 с.
Серебряков В.П. К изучению ихтиопланктона района Ньюфаундленда и Лабрадора. ПИНРО–ВНИРО // Советские рыбохозяйственные исследования в северо-западной части Атлантического океана. М.: ВНИРО. 1962. С. 227–233.
Строганов А.Н. Род Gadus (Gadidae): состав, расселение, формообразование // Вопр. ихтиологии. 2015. Т. 55. № 3. С. 268.
Шмидт П.Ю. Миграции рыб и геологическое прошлое // Природа. 1936. № 6. С. 59–73.
Шмидт П.Ю. Миграции рыб. М.; Л.: Изд-во АН СССР. 1947. 362 с.
Berg P.R. Genomic divergence in Atlantic cod populations. PhD dissert. Norway, Oslo: Univ. Oslo. 2016. 59 p.
Bigg G.R., Cunningham C.W., Ottersen G. et al. Ice-age survival of Atlantic cod: agreement between palaeoecology and genetics // Proc. Roy. Soc. B-Biol. Sci. 2008. V. 275. P. 163–172.
Bigg G.R., Cunningham C.W., Ottersen G. et al. Parallel adaptive evolution of Atlantic cod on both sides of the Atlantic Ocean in response to temperature // Proc. Roy. Soc. London B: Biol. Sci. 2010. V. 277. № 1701. P. 3725–3734.
Carr S.M., Marshall H.D. Intraspecific phylogeographic genomics from multiple complete mtDNA genomes in Atlantic cod (Gadus morhua): Origins of the “Codmother”, transatlantic vicariance and midglacial population expansion // Genetics. 2008. V. 180. № 9. P. 381–389.
Consuegra S., Garcıa de Leaniz C., Serdio A. et al. Mitochondrial DNA variation in Pleistocene and modern Atlantic salmon from the Iberian glacial refugium // Mol. Ecol. 2002. V. 11. P. 2037–2048.
Dyke A.S., Andrews J.T., Clark P.U. et al. The Laurentide and Innuitian ice sheets during the Last Glacial Maximum // Quat. Sci. Rev. 2002. V. 21. P. 9–31.
Earl D.A., von Holdt B.M. STRUCTURE HARVESTER: a website and program for visualizing STRUCTURE output and implementing the Evanno method // Conserv. Genet. Resour. 2012. V. 4. P. 359–361.
Evanno G., Regnaut S., Goudet J. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study // Mol. Ecol. 2005. V. 14. P. 2611–2620. doi 10.1111/j.1365-294X.2005.02553.x
Felsenstein J. “PHYLIP”, Phylogeny Inference Pack-age, version 3.6b (beta release). Seattle, WA: Univ.Washington. 2004.
Grant W.S., Stahl G. Evolution of Atlantic and Pacific cod: Loss of genetic variation and gene expression in Pacific cod // Evolution. 1988. V. 42. P. 138–146.
Gjoseter J., Joerstad K., Nevdal G., Thorkildsen S. Genotype distributions of cod from the Norwegian Skagerrak coast // Sarsia. 1992. V. 76. P. 255–259.
Guo S., Thompson E.A. Performing the exact test of Hardy-Weinberg proportion for multiple alleles // Biometrics. 1992. V. 48. P. 361–372.
Gysels E.S., Hellemans B., Pampoulie C., Volckaert F.A.M. Phylogeography of the common goby, Pomatoschistus microps, with particular emphasis on the colonization of the Mediterranean and the North Sea // Mol. Ecol. 2004. V. 13. P. 403–417.
Jakobsdottir K.B., Jorundsdottir D.D., Skirnisdottir S. et al. Nine new polymorphic microsatellite loci for the amplification of archived otolith DNA of Atlantic cod, Gadus morhua L. // Mol. Ecol. Notes. 2006. V. 6. P. 337–339.
Jorstad K.E. Genetic analyses of cod in northern Norway // The propagation of cod Gadus morhua L.: Flodevigen rapportser. Norway, Bergen. 1984. P. 745–760.
Kettle A.J., Morales-Muniz A., Rosello-Izquierdo E. et al. Refugia of marine fish in the northeast Atlantic during the last glacial maximum: concordant assessment from archaeozoology and palaeo temperature reconstructions // Clim. Past. 2011. V. 7. P. 181–201.
LeGrande A.N., Lynch-Stieglitz J. Surface currents in the western North Atlantic during the Last Glacial Maximum // Geochem. Geophys. Geosyst. 2007. V. 8. № 1. P. 1–8.
Lewis P.O., Zaykin D. 2001. Genetic data analysis: computer program for the analysis of allelic data. Version 1.0 (d16c). Free program distributed by the authors over the Internet from http://lewis.eeb.uconn.edu/lewishome/software.html.
Lough R.G. Atlantic Cod, Gadus morhua, life history and habitat characteristics. USA, Massachusetts, Woods Hole: North. Fish. Sci. Center. 2004. 104 p.
Maggs P.A., Castilho R., Foltz D. et al. Evaluating signatures of glacial refugia for North Atlantic benthic marine taxa // Ecology. 2008. V. 89. № 11. P. 108–122.
Mantel N. The detection of disease clustering and a generalized regression approach // Cancer Res. 1967. V. 27. P. 209–220.
Mork J., Giever M. Genetic structure of cod along the coast of Norway: Results from isozyme studies // Sarsia. 1999. V. 84. P. 157–168.
Mork J., Ryman N., Stahl G. et al. Genetic variation in Atlantic cod (Gadus morhua) throughout its range // Can. J. Fish. Aquat. Sci. 1985. V. 42. P. 1580–1587.
Naafs B.D.A., Stein R., Hefter J. et al. Late Pliocene changes in the North Atlantic Current // Earth and Planet. Sci. Lett. 2010. V. 298. P. 434–442.
Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals // Genetics. 1978. V. 89. P. 583–590.
Pampoulie C., Stefansson M.O., Jorundsdottir T.D. et al. Recolonization history and large-scale dispersal in the open sea: the case study of the North Atlantic cod, Gadus morhua L. // Biol. J. Linn. Soc. 2008. V. 94. P. 315–329.
Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. P. 945–959.
Raymond M., Rousset F. GENEPOP (version 1.2): population genetics software for exact tests and ecumenicism // J. Hered. 1995. V. 86. P. 248–249.
Rice W.R. Analyzing tables of statistical tests // Evolution. 1989. V. 43. P. 223–225.
Rohling E.J., Fenton M., Jorissen F.J. et al. Magnitudes of sea-level lowstands of the past 500.000 years // Nature. 1998. V. 394. P. 162–165.
Ruddiman W.F., McIntyre A. The Nort Atlantic Ocean during the last deglaciation // Palaeogeogr., Palaeoclimatol., Palaeoecol. 1981. V. 35. P. 145–214.
Ruddiman W.F., Raymo M.E., Martinson D.G. et al. Pleistocene evolution: Northern Hemisphere ice sheets and North Atlantic Ocean // Paleoceanography. 1989. V. 4. P. 353–412.
Shaw J. Palaeogeography of Atlantic Canadian continental shelves from the Last Glacial Maximum to the present, with an emphasis on Flemish Cap // J. Northw. Atl. Fish. Sci. 2006. V. 37. P. 119–126.
Shaklee J.B., Allendorf F.W., Morizot D.C., Whitt G.S. Gene nomenclature for protein-coding loci in fish // Trans. Amer. Fish. Soc. 1990. V. 119. P. 2–15.
Stefansson M.O., Sigurdsson T., Pampoulie C. et al. Pleistocene genetic legacy suggests incipient species of Sebastes mentella in the Irminger Sea // Heredity. 2009. V. 102. P. 514–524.
Svendsen J.I., Alexanderson H., Astakhov V.I. et al. Late Quaternary ice sheet history of northern Eurasia // Quatern. Sci. Rev. 2004. V. 23. P. 1229–1271.
Uriarte A. Earth’s Climate History. Bilbao, Spain: Gobierno de Vasco. 2011. 314 p.
Van Oosterhout C., Hutchinson W.F., Wills D.P.M., Shipley P. MICROCHECKER: Software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. 2004. V. 4. P. 535–538.
Vawter A.T., Rosenblatt R., Gorman G.C. Genetic divergence among fishes of the eastern Pacific and the Caribbean: support for the molecular clock // Evolution. 1980. V. 34. № 4. P. 705–711.
Weir B.S. Genetic Data Analysis II. Methods for Discrete Population Genetic Data. Sunderland, Massachusets: Sinauer Ass. 1996. 445 p.
Weir J.T., Schulter D. Calibrating the avian molecular clock // Mol. Ecol. 2008. V. 17. P. 2321–2328.
Wright S. The genetical structure of populations // Ann. Eugen. 1951. V. 15. P. 323–354.
Дополнительные материалы отсутствуют.


