Биология моря, 2019, T. 45, № 1, стр. 25-34
Спектральная чувствительность фоторецепторов и экранирующая функция роговицы глаза терпугов семейства Hexagrammidae
С. Л. Кондрашев *
Институт биологии моря им. А.В. Жирмунского, Национальный научный центр морской биологии ДВО РАН
690041 Владивосток, Россия
* E-mail: navodon@rambler.ru
Поступила в редакцию 15.05.2018
После доработки 31.05.2018
Принята к публикации 31.05.2018
Аннотация
Роговица глаза рыб семейства Терпуговых (Hexagrammidae) способна изменять окраску в зависимости от уровня освещения. В основе этого явления лежит перераспределение каротиноидных пигментов в специализированных хроматофорах. Для пяти представителей семейства получены спектральные характеристики роговицы и спектры поглощения зрительных пигментов в фоторецепторах сетчатки. Оценено влияние цветного фильтра роговицы на эффективные спектры поглощения колбочек. Обнаружена положительная корреляция между длинноволновой чувствительностью колбочек и максимальной величиной оптической плотности роговицы в этой же области спектра. Сопоставление литературных данных о спектральных свойствах фоторецепторов и роговицы глаза с суточной и сезонной активностью рыб позволило подтвердить высказанное ранее предположение о важной светозащитной функции роговицы у терпугов.
Большое разнообразие рыб и изменчивость условий их обитания позволяют считать море природной лабораторией для исследования морфофизиологических адаптаций. В зрительной системе рыб наряду с общими чертами организации, характерными для водных позвоночных, обнаружены уникальные структуры и механизмы, регулирующие количество и спектральный состав света, попадающего на сетчатку глаза (Collin, 1997). Среди них изменяющаяся окраска роговицы, впервые описанная у бурого терпуга Нexagrammos octogrammus (см.: Орлов, 1974; Orlov, Gamburtzeva, 1976). Это физиологическое явление, свойственное, по-видимому, большинству видов терпугов, было неоднократно отмечено в видовых описаниях и на фотодокументах (Рутенберг, 1962; Orlov, Kondrashev, 1998). Подобный механизм обнаружен также у десятков видов рыб, большинство которых морские рыбы с дневной активностью, обитающие в умеренных и тропических водах (Гамбурцева и др., 1979; Heinermann, 1984; Kondrashev et al., 1986; Orlov, Kondrashev, 1998; Siebeck et al., 2003).
Описываемое явление, связанное с уровнем освещенности окружающей среды, – результат обратимого перемещения желтых и оранжевых каротиноидных пигментов в специализированных хроматофорах, тела которых расположены по периферии роговицы, а длинные отростки перекрывают ее центральную (зрачковую) зону. Полное перекрашивание роговицы занимает от 1 до 1.5 ч (Orlov, Gamburtzeva, 1976; Kondrashev, Gnyubkin, 1999; Siebeck et al., 2003). При высокой оптической плотности цветного фильтра роговицы в условиях дневного освещения неизбежно снижается яркость света, попадающего на сетчатку, что вносит искажения в эффективные спектры поглощения фоторецепторов и может затруднить использование цветового зрения у обитателей мелководья (Sabbah et al., 2013). Наиболее подробно этот процесс был описан у бурого терпуга, у которого окраска роговицы самая плотная среди всех известных к настоящему времени рыб (Орлов, Гамбурцева, 1976; Kondrashev, 2008). Возможности цветоразличения при наличии фильтров приближенно были оценены у пятнистого терпуга (Гнюбкин, 1989), так как спектральные свойства колбочек сетчатки у этого вида еще не были изучены. Подобные данные для других видов терпугов отсутствуют, хотя и представляют большой интерес как для понимания механизмов цветового зрения, так и для определения функции и значения окрашенных сред оптики глаза у рыб и других позвоночных. С физической точки зрения эффект фильтров в основном проявляется в повышении остроты зрения в мутной водной среде и в снижении дозы световой радиации для сетчатки глаза на мелководье (Walls, Judd, 1933; Орлов, 1974; Douglas, Marshall, 1998; Siebeck, Marshall, 2001). Наличие переменной окраски роговицы по сравнению с постоянной, также связаной с присутствием каротиноидов и характерной для большого числа видов рыб (Фам, Кондрашев, 1989; Siebeck, Marshall, 2000, 2001; Losey et al., 2003), делает эти функции более гибкими при изменении освещения в течение суток или сезона (Орлов, 1978).
Аргументы в поддержку мнения о светозащитной роли окрашенной роговицы и других ее адаптивных возможностях можно получить при сравнительном изучении спектральных свойств роговицы у рыб с разной экологией. Однако распространенность обсуждаемого явления и широкий диапазон его характеристик у разных видов рыб не позволяют сделать однозначные выводы. Предварительные наблюдения (Гамбурцева и др., 1979; Кондрашев, Орлов, 1981) показали, что в каждом семействе имеются виды с наиболее интенсивно окрашенной роговицей. Эти рыбы часто обитают в сходных экологических условиях, но максимальная оптическая плотность и характер распределения окраски роговицы у них различаются. Более того, рядом с ними днем активны рыбы (камбалы, навага, корюшки) с бесцветной роговицей.
Мнение о светозащитной функции фильтров роговицы высказывалось и ранее (Кондрашев, Орлов, 1981; Heinermann, 1984; Siebeck, Marshall, 2001), однако данные о спектральной чувствительности фоторецепторов отсутствовали. Чтобы более объективно оценить возможную роль фильтра роговицы как светозащитного механизма и его влияние на свойства цветового зрения, настоящее исследование ограничено представителями семейства Терпуговых, обитающими в умеренных прибрежных водах Тихого океана. Были определены поглощение окрашенной роговицы, спектральная чувствительность фоторецепторов сетчатки рыб и оценена степень влияния цветной роговицы на результирующие (эффективные) спектральные характеристики сетчатки. Эти свойства зрительной системы сопоставлены со сведениями о суточной и сезонной активности терпугов, а также с другими особенностями их биологии.
МАТЕРИАЛ И МЕТОДИКА
Объектами исследования были рыбы семейства Hexagrammidae: бурый терпуг Hexagrammos octogrammus (Pallas, 1814); пятнистый терпуг H. stelleri Tilesius, 1810; японский терпуг H. otakii Jordan & Starks, 1895 и южный одноперый терпуг Pleurogrammus azonus Jordan & Metz, 1913. Кроме этого исследовано несколько гибридных особей H. otakii × H. octogrammus (Баланов и др., 2001). Рыб отлавливали в мае–июле в зал. Восток (зал. Петра Великого) донными ловушками или ставной сетью. Перед экспериментами терпугов содержали в ваннах с проточной морской водой при температуре 10–15°C.
Оптические свойства роговицы
Для изготовления препарата роговицы рыб обездвиживали и анестезировали в растворе MS222 (Sigma Co., США), затем декапитировали. Глаза энуклеировали; вырезали целиком роговицу, которую максимально очищали от пленок и кожистой роговицы, покрывающей собственно роговицу с внешней стороны. Глаза препарировали в фосфатном буфере pH 7.2 при комнатной температуре. Измерения проводили на свежем материале, помещенном под покровное стекло в нескольких каплях фосфатного буфера. Предварительно несколько часов рыб содержали в емкости с водой и адаптировали к освещению светодиодными осветителями СДО-5 (FATO Group, КНР; цветовая температура 6500°K) до определенного уровня окрашивания роговицы (Орлов, Гамбурцева, 1976; Kondrashev, Gnyubkin, 1999). Освещенность (от полной темноты до 6000 лк) измеряли люксметром Ю-116 (Машприборинторг, Москва).
Спектры пропускания роговицы измеряли с помощью спектрометра USB2000+ (Ocean Optics Co.). Препарат закрепляли на предметном столике микроскопа и освещали вертикальным лучом света из стандартного источника HL-2000 этой же фирмы с галогеновой лампой и присоединенным световодом диаметром 0.6 мм. Свет, прошедший через роговицу, регистрировали через другой аналогичный световод, расположенный соосно. Измерение выполняли в зоне самой высокой плотности окрашенной зоны роговицы вне тел хроматофоров, ориентируясь на максимальные показания спектрометра. Для сравнения спектров пропускания роговиц применяли стандартный метод нормализации при длине волны 700 нм, затем определяли длину волны, при которой регистрировали 50% пропускание (T50) (Douglas, McGuigan, 1989; Siebeck, Marshall, 2001; Losey et al., 2003).
Микроспектрофотометрия
Методика микроспектрофотометрического исследования фоторецепторов сетчатки подробно описана ранее (Govardovskii et al., 2000; Кондрашев, 2010). После темновой адаптации (2–3 ч) и глубокой анестезии у рыб изолировали сетчатку. Взвесь фоторецепторов, выделенных из кусочка сетчатки и помещенных на предметное стекло, переносили под измерительный луч микроспектрофотометра оригинальной конструкции (Говардовский, Зуева, 1988). Во избежание обесцвечивания зрительных пигментов фоторецепторы выделяли при инфракрасном освещении (ИК-светодиоды); на каждой клетке проводили только одно измерение в диапазоне 350–750 нм с отсчетом показаний через 1 нм при скорости cканирования по спектру около 20 нм/с. Регистрировали поперечные спектры поглощения наружных сегментов изолированных фоторецепторов (более 70 рыб, более 400 учтенных спектров). Данные измерений спектров обрабатывали с помощью компьютерной программы MSP-PRO, которая была передана нам ее автором В.И. Говардовским (ИЭФБ РАН, Санкт-Петербург) и принципы работы которой были описаны ранее (Govardovskii et al., 2000; Jokela-Määttä et al., 2007). В результате были определены состав зрительных пигментов (родопсины, порфиропсины или их смесь) и соответствующие параметры спектров поглощения: средние величины положения максимума кривых (λмакс) и абсолютной оптической плотности. Стандартное отклонение λмакс для всех типов фоторецепторов составляло 2–5 нм.
У некоторых видов рыб, в том числе терпугов, состав пигментов и, соответственно, спектральная чувствительность фоторецепторов изменяются при смене условий освещения как в опыте, так и в природе в зависимости от сезона года (Bridges, 1972; Isayama, Makino, 2012; Kondrashev, Lamash, 2017). В связи с этим эксперименты были проведены на рыбах, отловленных летом не позже, чем за неделю до опытов. Все эксперименты выполнены в соответствии с правилами работы с животными, установленными Комитетом по этике Национального научного центра морской биологии им. А.В. Жирмунского ДВО РАН.
РЕЗУЛЬТАТЫ
Спектральные характеристики роговицы
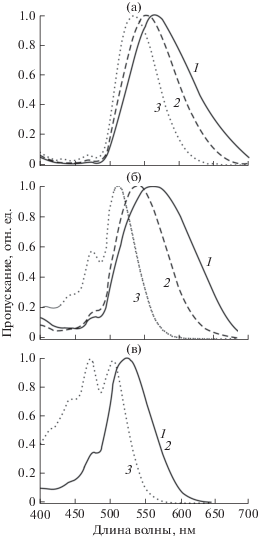
У исследованных рыб окраска роговицы даже в состоянии полной световой адаптации распределяется неравномерно. Это обусловлено тем, что хроматофоры, содержащие цветные пигменты, располагаются группами в дорсальной и вентральной частях роговицы, причем количество клеток в дорсальной части больше (рис. 1а, 1г, 1з, 1л, 1м). Поэтому для сравнения мы выбирали наиболее высокую оптическую плотность в дорсальной части роговицы в пределах зоны зрачка (рис. 1к, 1п). Полностью светоадаптированная роговица бурого терпуга темно-оранжевая или вишнево-красная (рис. 1а, 1б), одноперого, пятнистого и японского терпугов – желтая (рис. 1е–1м, 1р, 1с), а гибридного терпуга – светло-оранжевая (рис. 1н–1п). Кривые пропускания роговиц одноперого и пятнистого терпугов имеют пики, характерные для каротиноидных пигментов (рис. 2. 1, 2). Данные кривые для гибрида и бурого терпуга более широкие и сглажены (рис. 2. 3, 4). Оптическая плотность роговиц при максимуме поглощения варьирует в широких пределах от 0.6 лог. ед. и более; у бурого терпуга она может превышать 3.0 лог. ед., что соответствует пропусканию менее 0.1% света.
Рис. 1.
Особенности морфологии роговицы с изменяющейся окраской у терпугов. а – роговица сеголетка бурого терпуга после завершения метаморфоза (взрослая окраска тела); б – роговица сеголетка бурого терпуга в процессе метаморфоза; в – сеголеток бурого терпуга с ювенильной окраской тела; г – голова сеголетка с развитой окраской роговицы в темноадаптированном состоянии (оконтуренный фрагмент на рис. в); д – сеголеток пятнистого терпуга с неполной взрослой окраской; е – голова сеголетка пятнистого терпуга, вид сверху, на просвет заметны желтые роговицы глаз; ж – хроматофоры в дорсальной части роговицы сеголетка пятнистого терпуга; з–к – роговица взрослого пятнистого терпуга (з – общий вид; и – отростки желтых хроматофоров в центральной части; к – зона, ограниченная зрачком); л – роговица японского терпуга, дорсальная часть; м – роговица японского терпуга, вентральная часть; н–п – роговица гибридного терпуга (н – дорсальная часть, о – отростки оранжевых хроматофоров в зрачковой зоне, п – роговица с ирисовой диафрагмой-зрачком); р – дорсальная часть роговицы одноперого терпуга; с – то же, хроматофоры при большем увеличении. Масштаб: а, б, з, к – 1 мм; в, д – 10 мм; г, е – 5 мм; п – 2 мм; и, о – 20 мкм; ж, н – 200 мкм; л, м, р, с – 100 мкм.
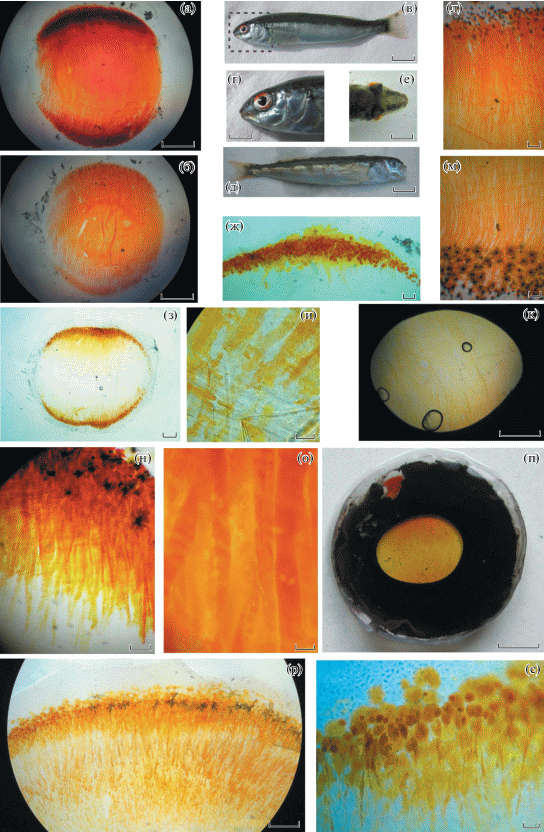
Рис. 2.
Относительное пропускание роговиц терпугов. 1 – южный одноперый терпуг; 2 – пятнистый терпуг; 3 – гибрид Hexagrammos otakii × H. octogrammus; 4 – бурый терпуг (сеголетки после полного метаморфоза).
Пропускание (T50) в длинноволновой части видимого спектра является адекватной характеристикой плотности окраски и широты спектров (табл. 1). Наибольшее значение этого показателя (555 нм), характеризующего самую плотную роговицу, получено для бурого терпуга, меньшее (522 нм) – для гибрида, а наименьшее (496 нм) – для одноперого терпуга, у которого, соответственно, наименее плотная роговица. Значения Т50 у пятнистого (505 нм) и японского терпугов близки (точные данные для последнего вида не приведены из-за ограниченности материала).
Таблица 1.
Максимумы спектров поглощения (Т50, нм) и состав зрительных пигментов фоторецепторов сетчатки терпугов
| Вид | n | Палочки | Одиночные колбочки | Двойные колбочки | T50 | |
|---|---|---|---|---|---|---|
| CВДК | ДВДК | |||||
| Hexagrammos octogrammus* | >50 | 500 + 525 10 : 90 523 |
500 + 525 18 : 22 522–595 |
524 + 562 20 : 80 552–595 |
560 + 625 20 : 80 615–626 |
555 |
| Гибрид Hexagrammos otakii × × H. octogrammus | 4 | 500 + 525 (9) 70 : 30 505 |
500 + 525 (8) 74 : 26 504–536 |
524 + 562 (22) 60 : 40 530–554 |
546 + 600 (19) 66 : 34 566–566 |
522 |
| Hexagrammos otakii | 4 | 502 (12) 502 |
482 + 500 (11) 90 : 10 486 |
505 + 532 (28) 22 : 78 523 |
524 + 562 (19) 28 : 72 545 |
н.о. |
| Нexagrammos stelleri | 5 | 503 + 530 (34) 63 : 37 510 |
482 (27) 482–512 |
532 + 575 (40) 94 : 6 533–540 |
532 + 575 (25) 29 : 71 557–565 |
505 |
| Pleurogrammus azonus | 6 | 504 (8) | 467 (17) 467–487 |
513 (22) 513–523 |
513 (22) 513–523 |
496 |
* Данные по: Kondrashev, 2008; Кондрашев, 2010. Примечание. n – количество изученных рыб; СВДК – средневолновый и ДВДК – длинноволновый компоненты двойных колбочек; T50 – значение длины волны для 50% спектра поглощения роговицы; н.о. – не определено. Сумма двух значений максимума указывает на наличие смеси двух пигментов (родопсина и порфиропсина), процентное соотношение которых приведено ниже; в скобках – количество измеренных клеток. Курсивом выделены максимумы поглощения для смесей пигментов, жирным шрифтом – максимумы расчетного (эффективного) спектра поглощения в присутствии светоадаптированых фильтров роговицы.
Спектральная чувствительность фоторецепторов
У четырех видов и одного межвидового гибрида терпугов обнаружены многочисленные тонкие (диаметром менее 2 мкм) палочки, а также одиночные и двойные колбочки (табл. 1). В настоящей работе получены данные для мальков бурого терпуга (возраст до одного года), которые подтвердили результаты, полученные для взрослых особей (Kondrashev, 2008; Кондрашев, 2010). Наиболее “длинноволновыми” фоторецепторами обладает бурый терпуг (λмакс = 522–615 нм), наименьшими – одноперый терпуг (467–513 нм), остальные виды терпугов занимают промежуточное положение (482–566 нм) (табл. 1).
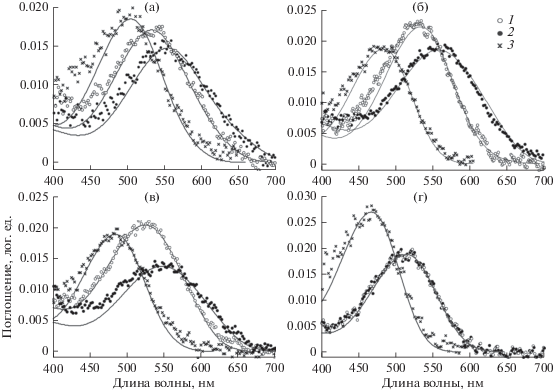
Спектры поглощения в каждом из наружных сегментов палочек и колбочек наилучшим образом аппроксимировались кривыми для смеси двух разных пигментов: одного родопсина и одного порфиропсина, присутствовавших в разных пропорциях (рис. 3, табл. 1). Исключение составили палочки у японского терпуга, одиночные колбочки у пятнистого терпуга и фоторецепторы одноперого терпуга, в которых все пигменты оказались родопсинами.
Рис. 3.
Спектральная чувствительность колбочек сетчатки глаза терпугов. а – гибрид Hexagrammos otakii × H. octogrammus; б – пятнистый терпуг; в – японской терпуг; г – южный одноперый терпуг. Кривые – аппроксимация номограмм для родопсина, порфиропсина и их смесей. Символы – усредненные результаты микроспектрофотометрии: 1 – средневолновые элементы двойных колбочек; 2 – длинноволновые элементы двойных колбочек; 3 – одиночные колбочки. Положение максимумов кривых, состав смесей и количество измерений представлены в табл. 1.
ОБСУЖДЕНИЕ
Спектральная чувствительность фоторецепторов и ее модификация фильтрами роговицы
Поскольку у большинства терпугов зрительные пигменты в фоторецепторах представлены смесями двух пигментов, установленные максимумы спектральной чувствительности могут изменяться в зависимости от условий обитания рыб некоторое время до вылова. Как отмечено ранее, причина этого – присутствие в фоторецепторах смеси двух разных пигментов, пропорции которых варьируют, причем в природных условиях в основном из-за сезонного изменения уровня освещения или солености воды (Bridges, 1972; Кондрашев, 2010; Temple, 2011). В нашем случае эти величины определены в весенне-летний период, когда терпуги активны на небольших глубинах (Gomelyuk, Leunov, 1999; Гомелюк, 2000).
Максимумы спектральной чувствительности зрительных пигментов, входящих в состав смеси, как и их пропорции, можно достаточно точно определить с помощью сочетания хроматографических и молекулярно-генетических методов (Hasegawa, 2005; Iwanicki et al., 2017; Miyazaki et al., 2018). Наличие смеси родопсина и порфиропсина в фоторецепторах всех изученных нами терпугов ранее было подтверждено с помощью хроматографии (Kondrashev, Lamash, 2017). Основываясь только на результатах микроспектрофотометрии, мы не обсуждаем наличие и разнообразие принятых “молекулярных” типов зрительных пигментов – RH, SW, LMW (см.: Yokoyama, 2000; Cortesi et al., 2015), а, указывая на максимумы поглощения пигментов в составе смеси, отмечаем лишь границы, в пределах которых возможно изменение спектральной чувствительности под влиянием условий внешней среды, главным образом, освещения.
По результатам микроспектрофотометрии наиболее “красночувствительными” фоторецепторами обладает бурый терпуг, средние величины максимумов поглощения его колбочек составляют 522, 552 и 615 нм. Летом у отдельных экземпляров были зарегистрированы предельные значения (525, 562, 625 нм), обусловленные накоплением в колбочках исключительно порфиропсина. По величине смещения в длинноволновую область спектра такая чувствительноcть является рекордной среди известной у морских рыб (Kondrashev, 2008). Можно предположить, что в зимний период в условиях сокращения светового дня при миграции рыб на большие глубины (Рутенберг, 1962) в сетчатке бурого терпуга преобладает родопсин, а спектральная чувствительность фоторецепторов сдвигается в коротковолновую сторону. Это было подтверждено в экспериментах, когда бурых терпугов содержали при разных режимах освещения (Kondrashev, Lamash, 2017).
Другие виды рода Hexagrammos можно рассматривать как промежуточную группу по спектральным свойствам фоторецепторов с максимумами поглощения между 482 и 565 нм. Из них наиболее “коротковолновыми” пигментами обладает японский терпуг (рис. 3в), близок к нему пятнистый терпуг (рис. 3б), а пигменты гибрида сходны с таковыми бурого терпуга, особенно по потенциальной возможности достичь максимума поглощения в длинноволновом диапазоне (600 нм) (рис. 3а, табл. 1). Показатели поглощения у гибрида оказались промежуточными по сравнению с таковыми у исходных видов, что характерно и для некоторых морфологических признаков (Баланов и др., 2001). У видов промежуточной группы пропорции родопсина и порфиропсина варьируют в более широких пределах по сравнению с таковыми у бурого терпуга. Так, родопсин преобладает в палочках и одиночных колбочках у всех видов этой группы, а также в одном из элементов двойных колбочек у пятнистого терпуга (табл. 1).
По сравнению с терпугами рода Hexagrammos, спектральная чувствительность южного одноперого терпуга значительно сдвинута в сторону коротких волн: колбочки этого вида максимально поглощают свет при 467 и 513 нм (рис. 3г). Данные величины, очевидно, постоянны в течение всей жизни взрослых рыб, так как зрительные пигменты у этого вида представлены только родопсином. Такие показатели характерны для рыб открытого моря (Bridges, 1972; Collin, 1997), к которым относится южный одноперый терпуг.
Для палочек изученных нами рыб наблюдается сходная, но менее четкая тенденция распределения максимумов поглощения: снижение величины максимума у бурого терпуга по сравнению с таковой у одноперого терпуга с промежуточными значениями у остальных представителей.
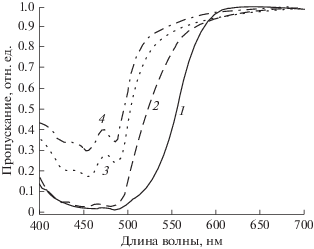
Обнаруженное различие в спектральной чувствительности фоторецепторов и составе смесей зрительных пигментов, вероятно, связано с наличием роговицы как фильтра, частично или полностью отсекающего сине-зеленую часть спектра (рис. 2). Оценить это влияние можно по степени модификации кривых спектральной чувствительности фоторецепторов, на которые попадает свет, прошедший через роговицу максимальной плотности (рис. 4), или по степени уменьшения их возбуждения (Гнюбкин, 1989). Чем больше чувствительность фоторецепторов в длинноволновом диапазоне, тем больше величина T50, т.е. плотность роговицы (табл. 1). Таким образом, развитие более высокой “красночувствительности” фоторецепторов можно считать своеобразной компенсацией возможной потери общей чувствительности глаза из-за наличия фильтра роговицы. При этом происходит сужение диапазона воспринимаемого спектра с ограничением возможностей цветового зрения, что особенно выражено у бурого терпуга (Орлов, Гамбурцева, 1976; Орлов, 1978; Kondrashev, 2008). Подобный заметный эффект можно ожидать у гибрида (рис. 4а), десятилинейного терпуга Hexagrammos decagrammos и зайцеголового терпуга H. lagocephalus c оранжевой или вишнево-красной роговицей (Рутенберг, 1962; Гамбурцева и др., 1979; Kondrashev, Orlov, 2006). Желтые роговицы с оптической плотностью до 1 лог. ед. и c минимальным пропусканием более 10% (у пятнистого, японского и одноперого терпугов), очевидно, незначительно изменяют эффективную спектральную чувствительность фоторецепторов (рис. 4б, 4в).
Переменная окраска роговицы и зрительная экология терпугов
Наличие плотных фильтров роговицы накладывает определенные ограничения на работу зрительной системы в целом, связанные в основном с уменьшением количества света, попадающего на сетчатку. Анализ поведения бурого терпуга в естественных условиях показал, что оно зависит от степени окраски роговицы, так как в переходных условиях освещенности от утренних сумерек до полного дневного освещения и обратно рыбы резко снижали активность и находились в убежищах за 1–2 ч до завершения светозависимых перестроек в роговице (Гомелюк и др., 1989). С одной стороны, почти все виды терпугов ведут дневной образ жизни и летом обитают преимущественно в верхней и средней сублиторали (Рутенберг, 1962) при высокой освещенности, когда даже при полной световой адаптации роговицы для сетчатки сохраняются фотопические условия (Ерлов, 1980; Kondrashev, 2008). С другой стороны, при суточном и сезонном понижении освещенности уменьшение плотности окраски роговицы вплоть до полного обесцвечивания позволяет рыбам сохранять светочувствительность в скотопических условиях.
Несмотря на то, что плотность окраски роговицы определяется уровнем освещения, связать это свойство с глубиной обитания рыб затруднительно. Диапазон годовых изменений глубины обитания рыб достаточно широк, а общим является только то, что в активный весенне-осенний период большинство видов перемещается к берегу и часто на очень малые глубины (Рутенберг, 1962; Гомелюк, 1987). Однако в некоторых случаях можно отметить корреляцию интенсивности окраски роговицы с глубиной обитания рыб. Так, наименьшая плотность окраски роговицы у наиболее глубоководного одноперого терпуга. Сублиторальные бурый и пятнистый терпуги в местах совместного обитания экологически заметно разделены (Гомелюк, 2000), при этом у более глубоководного пятнистого терпуга роговица окрашена слабее (рис. 1а, 1и, 1к; рис. 2). Самцы бурого терпуга в течение нескольких недель охраняют нерестовые гнезда, которые находятся на небольшой глубине – в среднем 2.5 м (Гомелюк, 2000; Маркевич, 2004). Японский терпуг, имеющий роговицу меньшей плотности, обычно держится глубже (10–30 м), а в сентябре перемещается к берегу (3–15 м), где устраивает нерестовые гнезда в среднем на глубине 5.7 м (Маркевич, 2004). Сеголетки бурого и пятнистого терпугов весной подходят к берегу из открытого моря в ювенильной серебристой окраске, но практически с сформировавшимися роговичными фильтрами высокой плотности (рис. 1а–1ж, рис. 2). Из всех терпугов только молодь бурого и, возможно, пятнистого терпугов в возрасте менее года (рис. 1в, 1д) активна днем на литорали, часто у уреза воды. Другие виды рыб эту зону избегают, вероятно, из-за очень высокой освещенности (Маркевич, 1990; Gomelyuk, Leunov, 1999). Таким образом, в определенные периоды жизни особи бурого терпуга длительное время подвергаются действию очень яркого, часто прямого солнечного освещения, достигающего по нашим оценкам десятков тысяч люкс на мелководье. В связи с чем светозащитная функция окрашенной роговицы при высоком уровне естественной освещенности очень вероятна. На это указывают большее число хроматофоров и, соответственно, более высокая плотность окраски дорсальной зоны роговицы, через которую проходит свет, идущий сверху (рис. 1а, 1л, 1м). В условиях снижения освещенности и перехода роговицы в оптически менее плотное состояние (около 1 лог. ед., умеренная и слабая желтая окраска) сохраняются как цветоразличение сетчатки, так и защита от обесцвечивания палочек и одиночных колбочек (Гнюбкин, 1989), максимально чувствительных в области 500 нм (табл. 1, рис. 3).
Можно предположить, что наличие цветных фильтров в роговице может усилить различение определенных зрительных сигналов, используемых терпугами при внутри- и межвидовом общении, особенно в период нереста, который практически у всех видов происходит на мелководье (Рутенберг, 1962; Гомелюк, 2000). Резкий половой диморфизм в окраске тела и плавников некоторых видов терпугов (японский, зайцеголовый, десятилинейный, полосатый терпуг Oxylebius pictus Gill, 1862) проявляется в виде ярких желто-красных и зеленовато-голубых элементов тела и плавников (https://www.centralcoastbiodiversity.org/kelp-greenling-bull-hexagrammos-decagrammus.html). Контрастность такого образа и, следовательно, его заметность усиливаются при наличии желтого или оранжевого фильтра (Маркевич, 2004), что важно при демонстративном поведении.
Автор благодарит сотрудников ННЦМБ ДВО РАН: к. б. н. А.А. Баланова за помощь при определении особей японского и гибридного терпугов, к. б. н. С.Ш. Даутова за предоставление препарата роговицы десятилинейного терпуга и Е.Г. Рейзмана за помощь при отлове и содержании рыб.
Работа частично поддержана проектом РФФИ № 07-04-00068.
Список литературы
Баланов А.А., Маркевич А.И., Антоненко Д.В., Кроу К.Д. Первое обнаружение гибридов Hexagrammos otakii × H. octogrammus и описание H. otakii (Hexagrammidae) из залива Петра Великого (Японское море) // Вопр. ихтиологии. 2001. Т. 41. № 6. С. 766–776.
Гамбурцева А.Г., Гнюбкина В.П., Кондрашев С.Л., Орлов О.Ю. Хроматофоры и окраска роговицы рыб Японского моря // Биол. моря. 1979. № 6. С. 44–51.
Гнюбкин В.Ф. Реакции пигментированной роговицы глаза пятнистого терпуга на изменение освещения // Биол. моря. 1989. № 1. С. 25–32.
Говардовский В.И., Зуева Л.В. Простой высокочувствительный регистрирующий спектрофотометр // Цитология. 1988. Т. 30. № 4. С. 499–502.
Гомелюк В.Е. Нерестовое поведение южного одноперого терпуга Pleurogrammus azonus в заливе Петра Великого // Вопр. ихтиологии. 1987. Т. 27. № 6. С. 991–999.
Гомелюк В.Е. Сравнительный анализ повседневного поведения и образа жизни трех видов терпугов рода Hexagrammos (Hexagrammidae, Scorpaeniformes) в летний период // Вопр. ихтиологии. 2000. Т. 40. № 1. С. 79–90.
Гомелюк В.Е., Гамбурцева А.Г., Сахаров В.Б. Динамика переменных светофильтров роговицы глаза бурого терпуга Hexagrammos octogrammus в течение суток в естественных условиях обитания // Вопр. ихтиологии. 1989. Т. 29. № 3. С. 483–488.
Ерлов Н.Г. Оптика моря. Л.: Гидрометеоиздат. 1980. 250 с.
Кондрашев С.Л. Спектральная чувствительность и зрительные пигменты фоторецепторов сетчатки прибрежных рыб Японского моря // Биол. моря. 2010. Т. 36. № 6. С. 437–444.
Кондрашев С.Л., Орлов О.Ю. Физиологические механизмы и экологическое значение переменной окраски роговицы глаза морских рыб // Физиология и биохимия адаптаций морских животных. Владивосток: ДВО АН СССР. 1981. С. 154–160.
Маркевич А.И. Суточное распределение и плотность населения некоторых рыб в прибрежной зоне залива Петра Великого // Биология шельфовых и проходных рыб. Владивосток: ДВО РАН. 1990. С. 16–19.
Маркевич А.И. Родительское поведение самцов японского Hexagrammos otakii и бурого H. octogrammus терпугов (Hexagrammidae) // Вопр. ихтиологии. 2004. Т. 44. № 4. С. 538–543.
Орлов О.Ю. Цветные очки животных // Природа. 1974. № 8. С. 35–41.
Орлов О.Ю. Зрительная система терпуга // Механизмы зрения животных. М.: Наука. 1978. С. 180–199.
Орлов О.Ю., Гамбурцева А.Г. Динамика окраски роговицы терпуга // Биофизика. 1976. Т. 21. № 2. С. 362–365.
Рутенберг Е.П. Обзор рыб семейства терпуговых (Hexagrammidae) // Терпуговые рыбы и возможности их межокеанской трансплантации: Тр. ИО АН СССР. Т. 59. М.: Изд-во АН СССР. 1962. С. 3–100.
Фам Т.М., Кондрашев С.Л. Структура и функции светофильтров роговицы глаза рыб коралловых рифов // Биология прибрежных вод Вьетнама. Донные беспозвоночные южного Вьетнама. Владивосток: ДВО АН СССР. 1989. С. 100–106.
Bridges C.D.B. The rhodopsin-porphyropsin visual system // Handbook of sensory physiology. V. 7/1. Springer: Berlin, Heidelberg, New York. 1972. P. 417–480.
Collin S.P. Specialisations of the teleost visual system: adaptive diversity from shallow-water to deep-sea // Acta Physiol. Scand. 1997. V. 161. Suppl. 638. P. 5–24.
Cortesi F., Musilova Z., Stieb S.M. et al. Ancestral duplications and highly dynamic opsin gene evolution in percomorph fishes // Proc. Natl. Acad. Sci. U.S.A. 2015. V. 112. P. 1493–1498.
Douglas R.H., Marshall N.J. A review of vertebrate and invertebrate ocular filters // Adaptive Mechanisms in the Ecology of Vision. Kluwer Acad. Publ. 1999. P. 95–162.
Douglas R.H., McGuigan C.M. The spectral transmission of freshwater teleost ocular media – an interspecific comparison and a guide to potential ultraviolet sensitivity // Vision Res. 1989. V. 29. P. 871–879.
Gomelyuk V.E., Leunov V.P. Changes in age-specific behaviour and spatial structure of masked greenling, Hexagrammos octogrammus (Hexagrammidae) // Environ. Biol. Fish. 1999. V. 54. № 3. P. 313–323.
Govardovskii V.I., Fyhrquist N., Reuter T. et al. In search of the visual pigment template // Vis. Neurosci. 2000. V. 17. № 4. P. 509–528.
Hasegawa E.I. Changes in rhodopsin-porphyropsin ratio of chum and pink salmon // Fish. Sci. 2005. V. 71. P. 1091–1097.
Heinermann P.H. Yellow intraocular filters in fishes // Exp. Biol. 1984. V. 43. P. 127–147.
Isayama T., Makino C.L. Pigment mixtures and other determinants of spectral sensitivity of vertebrate retinal photoreceptors // Photoreceptors: Physiology, Types and Abnormalities. Nova Science Publishers. 2012. P. 1–13.
Iwanicki T.W., Novales Flamarique I., Ausiό J. et al. Fine tuning light sensitivity in the starry flounder (Platichthys stellatus) retina: regional variation in photoreceptor cell morphology and opsin gene expression // J. Comp. Neurol. 2017. V. 525. P. 2328–2342.
Jokela-Määttä M., Smura T., Aaltonen A. et al. Visual pigments of Baltic Sea fishes of marine and limnic origin // Vis. Neurosci. 2007. V. 24. P. 389–398.
Kondrashev S.L. Long-wave sensitivity in the masked greenling (Hexagrammos octogrammus), a shallow-water marine fish // Vision Res. 2008. V. 48. P. 2269–2274.
Kondrashev S.L., Gamburtzeva A.G., Gnjubkina V.P. et al. Coloration of corneas in fish. A list of species // Vision Res. 1986. V. 26. P. 287–290.
Kondrashev S.L., Gnyubkin V.F. The effect of temperature on the light-induced pigment movement in fish corneal chromatophores // Pigment Cell Res. 1999. V. 12. P. 193–198.
Kondrashev S.L., Lamash N.E. Two ways of A1/A2-visual pigments conversion during light/dark adaptation in fish // Abstracts of the European Retina Meeting 2017 (ERM 2017), 5–7 October 2017. Paris. P. 225.
Kondrashev S.L., Orlov O.Yu. Changeable coloration of the fish eyes: corneal spectacles. 2006. URL: http://cool.iitp.ru/projects/posters/cornea.
Losey G.S., McFarland W.N., Loew E.R. et al. Visual biology of Hawaiian coral reef fishes. I. Ocular transmission and visual pigments // Copeia. 2003. № 3. P. 433–454.
Miyazaki T., Kondrashev S.L., Tsuchiya T. Visual pigment genes and absorbance spectra in the Japanese sardine Sardinops melanostictus (Teleostei: Clupeiformes) // Comp. Biochem. Physiol., B. 2018. V. 218. P. 54–63.
Orlov O.Y., Gamburtzeva A.G. Changeable coloration of cornea in the fish Hexagrammos octogrammus // Nature. 1976. V. 263. P. 405–406.
Orlov O.Yu., Kondrashev S.L. Changeable coloration of cornea in fishes and its distribution // Iugoslav. Physiol. Pharmacol. Acta. 1998. V. 34. P. 359–369.
Sabbah S., Troje N.F., Gray S.M., Hawryshyn C.W. High complexity of aquatic irradiance may have driven the evolution of four-dimensional colour vision in shallow-water fish // J. Exp. Biol. 2013. V. 216. P. 1670–1682.
Siebeck U.E., Marshall N.J. Transmission of ocular media in labrid fishes // Phil. Trans. Roy. Soc. London, B. 2000. V. 355. P. 1257–1261.
Siebeck U.E., Marshall N.J. Ocular media transmission of coral reef fish – can coral reef fish see ultraviolet light? // Vision Res. 2001. V. 41. P. 133–149.
Siebeck U.E., Collin S.P., Ghoddusi M., Marshall N.J. Occlusable corneas in toadfishes: light transmission, movement and ultrastructure of pigment during light- and dark-adaptation // J. Exp. Biol. 2003. V. 206. P. 2177–2190.
Temple S.E. Why different regions of the retina have different spectral sensitivities: A review of mechanisms and functional significance of intraretinal variability in spectral sensitivity in vertebrates // Vis. Neurosci. 2011. V. 28. P. 281–293.
Walls G.L., Judd H.D. The intraocular colour-filters of vertebrates // British J. Ophthalmol. 1933. V. 17. P. 641–675, 705–725.
Yokoyama S. Molecular evolution of vertebrate visual pigments // Prog. Ret. Eye Res. 2000. V. 19. P. 385–419.
Дополнительные материалы отсутствуют.