Биология моря, 2019, T. 45, № 2, стр. 133-140
Мониторинг загрязнения бухты Рудная (Японское море) по содержанию тяжелых металлов в бурых водорослях
А. Д. Кобзарь 1, *, Н. К. Христофорова 1, 2
1 Дальневосточный федеральный университет
690950 Владивосток, Россия
2 Тихоокеанский институт географии ДВО РАН
690041 Владивосток, Россия
* E-mail: kobzar.ad@dvfu.ru
Поступила в редакцию 29.01.2018
После доработки 14.05.2018
Принята к публикации 31.05.2018
Аннотация
В массовых видах бурых водорослей Scytosiphon lomentaria, Fucus evanescens, Stephanocystis crassipes, Silvetia babingtonii и Saccharina japonica, произрастающих в б. Рудная и сопредельных акваториях, определено содержание Zn, Cu, Fe, Cd и Pb. Полученные сведения позволили оценить современное пространственное распределение этих микроэлементов в водах исследованного региона и видоспецифичность водорослей как индикаторов загрязнения среды тяжелыми металлами. Установлено, что в настоящее время основным источником поступления поллютантов в воды бухты является небольшая гавань в ее южной части, откуда вывозятся доставляемые из горно-обогатительного комбината г. Дальнегорска свинцовый и цинковый концентраты. Проведено сравнение полученных данных по микроэлементному составу водорослей с таковыми 2009 г. − даты последнего подъема и одновременно завершения производственной активности свинцового плавильного завода. Показано, что концентрация свинца в S. lomentaria, собранных у входного в бухту мыса Бринера, к 2016 г. снизилась в 7.4 раза. Менее контрастно снижение содержания в этой водоросли цинка: с 2009 г. к 2016 г. оно уменьшилось в 1.7 раза. В водорослях из б. Лидовка, расположенной севернее б. Рудная, концентрация Zn в 2016 г. по сравнению с таковой в 2010 г. возросла в 1.67 раза что, очевидно, вызвано нарастанием рекреационного пресса на побережье этой бухты.
Бухта Рудная, расположенная на севере Приморского края, открывает к Японскому морю Дальнегорское полиметаллическое рудное поле. В 1897 г. в долине р. Рудная началась разработка первого серебряно-свинцово-цинкового месторождения. В 1914 г. в Дальнегорске (ранее с. Тетюхе) была запущена обогатительная фабрика, производившая два концентрата: свинцовый и цинковый. Цинковый концентрат в регионе не перерабатывали, его вывозили сначала на заводы страны и частично на экспорт, в настоящее время он полностью вывозится на экспорт. Свинцовый концентрат вывозили частично, меньшую его часть направляли на небольшой плавильный завод, который был единственным предприятием по выплавке цветных металлов на Дальнем Востоке России (Христофорова, 2005).
Поскольку рудники в Дальнегорском районе постепенно выработали свой ресурс, завод стал использовать вторичное сырье – свинцовые пластины из аккумуляторных батарей (Христофорова, 2005). Горны были ликвидированы, и свинец выплавляли в закрытой шахтной печи. В ноябре 2008 г. предприятие было остановлено, однако через полгода вновь запущено и проработало еще несколько месяцев. В конце 2009 г. завод был окончательно остановлен, а производственные мощности законсервированы. Изменилось и обустройство б. Рудная. Раньше свинцовые слитки, свинцовые и цинковые концентраты подвозили по узкоколейной железной дороге и грузили на баржи и плашкоуты с эстакады у северного бенча бухты. Теперь вдоль южного бенча бухты отсыпана дорога, по которой в закрытых самосвалах из Дальнегорска привозят измельченные и влажные концентраты; их погрузку осуществляют с пирса, построенного в маленькой гавани (ковше).
Подводя итог краткой исторической справке, необходимо отметить, что за последние 25−30 лет характер хозяйственной деятельности в долине р. Рудная изменялся несколько раз. Расцвет производственной деятельности на плавзаводе и максимальное воздействие на окружающую среду в конце 1980-х годов сменились экономическим кризисом и спадом производства в начале 1990-х годов. Новая технология выплавки свинца и использование вторичного сырья в конце 1990-х годов привели к подъему производства, однако в 2009 г. по экономическим соображениям завод был остановлен и законсервирован. В данной работе исследовали современное загрязнение прибрежно-морских вод б. Рудная такими металлами, как железо, цинк, свинец, медь и кадмий. Концентрация Fe обусловлена преимущественно терригенным стоком, Zn и Cu − добычей и переработкой свинцово-цинковых полиметаллических руд, а медь и кадмий сопутствуют этим рудам, причем Cu частично улавливался при выплавке свинца, а Cd, присутствующий в руде в следовых количествах, в основном улетал с отходящими газами.
Степень загрязнения прибрежных морских вод тяжелыми металлами определяли, анализируя бурые водоросли Scytosiphon lomentaria, Fucus evanescens, Stephanocystis crassipes, Silvetia babingtonii и Saccharina japonica. Данные виды и ранее использовали для индикации и мониторинга состояния среды в б. Рудная (Христофорова, Маслова, 1983; Христофорова, 1989; Коженкова и др., 2000; Шулькин, 2004; Христофорова, Кобзарь, 2012; и др.). Эти водоросли, за исключением арктическо-бореального S. lomentaria и тепловодной S. japonica, относятся к порядку Fucales, так же как Sargassum pallidum и S. miyabei, применяемые для индикации и мониторинга загрязнения морских вод более теплых широт (Khristophorova, Kozhenkova, 2002; Кобзарь, Христофорова, 2015; Христофорова и др., 2015; и др.). Водоросли порядка Fucales изучены как индикаторы качества среды на побережье Атлантики (Bryan, 1980), они широко распространены на побережье западной Пацифики и удобны для сравнительных оценок химической среды жизни в географическом плане (Христофорова, Маслова, 1983; Христофорова и др., 1983; Христофорова, 1989; и др.). Сильвеция S. babingtonii обитает в тепловодных районах, ее распространение ограничено Японским морем и южной частью Охотского моря. Фукус F. evanescens и стефаноцистис (ранее – цистозира) S. crassipes – холодноводные виды, широко распространенные в северном секторе Пацифики (Петров, 1977; Перестенко, 1980), удобны как организмы-мониторы для бореальной зоны. Среди индикаторных видов макрофитов S. lomentaria (сцитосифон коленчатый) не имеет себе равных по широте распространения и может быть достойным конкурентом такому универсальному виду-монитору с практически “всесветным” распространением, как двустворчатый моллюск Mytilus edulis. Сцитосифон коленчатый распространен в субарктических, умеренных и субтропических водах Мирового океана, он встречается в морях Северного Ледовитого океана и в северных частях Атлантики и Пацифики, в Субантарктике и у берегов Австралии; вегетирует при температуре воды не выше 15–18°С (Перестенко, 1980). Сахарина S. japonica не является широко используемым видом-индикатором и привлечена к анализу для морфологического контраста с остальными часто применяемыми для целей мониторинга видами (Христофорова и др., 2015).
Цели настоящей работы − определить современный уровень загрязнения вод б. Рудная и ее сопредельных акваторий тяжелыми металлами по их содержанию в бурых водорослях-макрофитах, провести сравнение видов водорослей как адекватных отражателей условий существования и оценить изменения в микроэлементном составе водорослей после остановки плавильного завода.
МАТЕРИАЛ И МЕТОДИКА
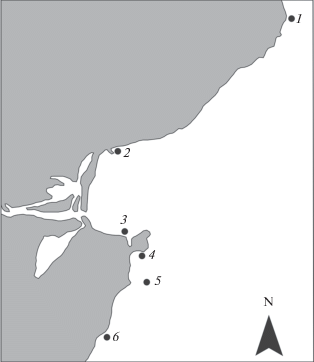
Водоросли в б. Рудная и в смежных акваториях собирали на шести станциях (рис. 1) в июле 2016 г. на литорали и в верхней сублиторали (глубина 0.5–1.5 м). На каждой станции брали по 3–5 экз. водорослей с крупными слоевищами и по 10–20 экз. мелких водорослей. При пробоподготовке к атомно-абсорбционному анализу на спектрофотометре Shimadzu AA-6800 использовали известные подходы и приемы (Христофорова, 1989), предварительно тщательно отмыв со слоевищ макрофитов взвеси и удалив эпибионты. Точность определения концентрации всех металлов контролировали, анализируя стандартные образцы (NIES 9.0 “Sargasso”). Ошибка определения не превышала 15%. Концентрацию металлов выражали в мкг/г сух. массы.
Рис. 1.
Станции сбора водорослей в б. Рудная и в сопредельных акваториях в 2016 г. 1 – б. Лидовка; 2 – б. Рудная, северный бенч; 3 – б. Рудная, рифы у ковша; 4 – б. Рудная, мыс Бринера; 5 – скалы Два Брата; 6 – скала Монастырь.
Среднее и стандартное отклонение рассчитывали в программе Excel. Достоверность сравниваемых различий определяли с использованием критерия Краскела−Уоллиса в программе SPSS Statistics.
РЕЗУЛЬТАТЫ
Модельным видом для изучения пространственного распределения микроэлементов в макрофитах выбран произрастающий на всех станциях наблюдения Scytosiphon lomentaria. Концентрация тяжелых металлов в талломах сцитосифона коленчатого с разных станций статистически значимо различалась по критерию Краскела−Уоллиса: для Zn р = 0.007, для Cu – 0.008, для Pb – 0.005, для Cd – 0.012 и для Fe – 0.005.
Самым высоким содержание цинка (380.8 ± 7.6 мкг/г сух. массы) было в водорослях, собранных на рифах у ковша. Вторая по величине концентрации Zn станция – северный бенч б. Рудная (185.5 ± 15.6 мкг/г). Наиболее низким содержание этого элемента было в сцитосифоне из б. Лидовка (50.3 ± 0.7 мкг/г). Концентрация меди в сцитосифоне (7.8 ± 0.2 мкг/г) также была наибольшей в водорослях, собранных на рифах у ковша, и немного ниже − в районе северного бенча (7.5 ± 0.9 мкг/г). Наименьшее содержание меди выявлено в макрофитах из б. Лидовка (3.2 ± 0.1 мкг/г). Содержание свинца в водорослях, собранных в районе северного бенча б. Рудная, было наибольшим (8.5 мкг/г). В S. lomentaria с рифов у ковша его концентрация составляла 5.9 мкг/г, а у мыса Бринера − 5.4 мкг/г. Наименьшее содержание свинца (2.2 мкг/г) выявлено в водорослях, собранных в б. Лидовка и у скалы Монастырь. Концентрация кадмия так же, как цинка и меди, была выше в водорослях на рифах у ковша – 1.8 ± 0.0 мкг/г. На трех станциях (б. Лидовка, скалы Два Брата, скала Монастырь) содержание этого элемента не различалось и составляло 1.3 ± 0.1 мкг/г. Самое низкое содержание Cd отмечено в сцитосифоне, собранном у мыса Бринера (1.1 ± 0.0 мкг/г). Наибольшей концентрация железа была в водорослях из б. Лидовка (1314 ± 34 мкг/г) и с северного бенча б. Рудная (1825 ± 187 мкг/г). В целом этот элемент присутствовал в водорослях в несравненно большем количестве, чем все другие металлы.
Таким образом, пространственное распределение концентраций меди и цинка в водорослях демонстрировало определенное сходство: наибольшее количество металлов обнаружено в образцах с рифов у ковша, меньшее − в водорослях, собранных в районе северного бенча б. Рудная, а минимальное − в макрофитах из б. Лидовка. В отличие от этих элементов, наибольшее количество свинца обнаружено в водорослях с северного бенча б. Рудная. Распределение кадмия было сходно с таковым меди и цинка, причем содержание Cd − самого минорного из исследованных элементов − изменялось незначительно.
Способность разных видов водорослей к аккумуляции тяжелых металлов целесообразно сравнивать на станциях, где эти виды присутствуют вместе. Все пять изученных видов произрастали у мыса Бринера. Концентрации элементов в талломах разных видов бурых водорослей, отобранных на данной станции, статистически значимо различались по критерию Краскела−Уоллиса: для Zn р = 0.011, для Cu – 0.009, для Cd – 0.009, для Ni – 0.014 и для Fe – 0.009. Согласно полученным данным (табл. 1), S. lomentaria являлся основным накопителем свинца и железа, а F. evanescens выделялся по степени аккумуляции цинка. Способность последнего к накоплению Zn прослеживалась и на других станциях (скалы Два Брата, скала Монастырь). Наибольшую способность к аккумуляции кадмия демонстрировал S. crassipes, меди – S. lomentaria.
Таблица 1.
Содержание тяжелых металлов в талломах водорослей, собранных в б. Рудная и в сопредельных акваториях (m ± σ, мкг/г сух. массы)
| Место сбора | Вид | Год | Cu | Fe | Zn | Cd | Pb |
|---|---|---|---|---|---|---|---|
| Б. Лидовка | Scytosiphon lomentaria | 2009 | 2.6 ± 0.5 | 1400.5 ± 357.6 | 39.8 ± 1.7 | 0.3 ± 0.1 | 12.7 ± 1.8 |
| 2010 | 3.2 ± 0.1 | 520.2 ± 49.2 | 32.1 ± 0.8 | 0.5 ± 0.1 | 11.4 ± 0.1 | ||
| 2016 | 2.0 ± 0.1 | 1313.6 ± 34.1 | 50.3 ± 0.7 | 1.3 ± 0.1 | 2.2 | ||
| Stephanocystis crassipes | 2016 | 1.2 ± 0.0 | 80.3 ± 5.0 | 36.8 ± 4.9 | 1.9 ± 0.3 | − | |
| Б. Рудная, северный бенч | S. lomentaria | 2010 | 7.0 ± 0.3 | 454.8 ± 18.5 | 300.7 ± 3.8 | 0.8 ± 0.1 | 42.6 ± 0.8 |
| 2016 | 7.5 ± 0.9 | 1824.6 ± 186.8 | 185.5 ± 15.6 | 1.7 ± 0.2 | 8.5 | ||
| S. crassipes | 2016 | 6.3 ± 1.2 | 454.4 ± 21.8 | 202.5 ± 2.2 | 1.9 ± 0.1 | − | |
| Б. Рудная, рифы у ковша | S. lomentaria | 2009 | 12.0 ± 0.2 | 1119.9 ± 21.6 | 243.9 ± 3.2 | 0.9 ± 0.0 | 72.3 ± 2.0 |
| 2016 | 7.8 ± 0.2 | 636.7 ± 27.2 | 380.8 ± 7.6 | 1.8 ± 0.0 | 5.9 | ||
| S. crassipes | 2016 | 7.1 ± 0.2 | 249.0 ± 10.5 | 213.6 ± 1.8 | 3.0 ± 0.1 | − | |
| Б. Рудная, мыс Бринера |
S. lomentaria | 2009 | 7.3 ± 0.5 | 592.4 ± 27.5 | 147.1 ± 6.8 | 0.8 ± 0.1 | 40.0 ± 1.3 |
| 2016 | 4.9 ± 0.7 | 255.3 ± 10.1 | 88.5 ± 5.0 | 1.1 ± 0.0 | 5.4 | ||
| S. crassipes | 2009 | 1.8 ± 0.1 | 62.6 ± 1.6 | 71.5 ± 1.2 | 1.8 ± 0.2 | 7.4 ± 0.5 | |
| 2016 | 2.2 ± 0.1 | 25.3 ± 1.3 | 85.2 ± 1.9 | 2.5 ± 0.0 | 4.7 | ||
| Fucus evanescens | 2009 | 4.8 ± 0.3 | 44.3 ± 7.6 | 337.9 ± 18.9 | 1.5 ± 0.1 | 6.5 ± 0.3 | |
| 2016 | 3.0 ± 0.1 | 19.7 ± 0.2 | 271.4 ± 7.2 | 2.3 ± 0.0 | 1.9 | ||
| Silvetia babingtonii | 2009 | 2.5 ± 0.0 | 49.8 ± 1.6 | 123.9 ± 4.3 | 0.9 ± 0.2 | 4.0 ± 1.6 | |
| 2016 | 2.7 ± 0.2 | 12.6 ± 1.3 | 128.3 ± 1.9 | 1.3 ± 0.0 | 0.7 | ||
| Saccharina japonica | 2009 | 2.8 ± 0.2 | 34.1 ± 2.0 | 66.1 ± 1.1 | 0.8 ± 0.1 | 6.3 ± 0.1 | |
| 2016 | 1.9 ± 0.0 | 16.5 ± 0.6 | 36.4 ± 0.5 | 1.1 ± 0.0 | 0.6 | ||
| Скалы Два Брата | S. lomentaria | 2009 | 10.5 ± 1.1 | 1401.6 ± 189.0 | 169.9 ± 21.5 | 0.9 ± 0.0 | 49.1 ± 6.5 |
| 2016 | 4.0 ± 0.2 | 294.6 ± 2.4 | 75.6 ± 14.0 | 1.3 ± 0.0 | 3.0 | ||
| S. crassipes | 2016 | 1.5 ± 0.2 | 30.3 ± 3.0 | 46.3 ± 1.9 | 1.4 ± 0.0 | − | |
| F. evanescens | 2016 | 3.2 ± 0.1 | 45.2 ± 6.1 | 296.2 ± 8.5 | 2.0 ± 0.0 | − | |
| S. japonica | 2009 | 3.8 ± 1.8 | 157.0 ± 38.6 | 70.9 ±1.5 | 0.5 ± 0.1 | 7.9 ± 1.0 | |
| 2016 | 2.5 ± 0.1 | 45.1 ± 3.2 | 46.4 ± 1.2 | 1.5 ± 0.0 | − | ||
| Скала Монастырь | S. lomentaria | 2009 | 5.9 ± 0.7 | 362.5 ± 133.4 | 76.0 ± 6.7 | 0.6 ± 0.1 | 10.3 ± 0.3 |
| 2016 | 4.9 ± 0.3 | 787.9 ± 89.5 | 74.1 ± 3.7 | 1.3 ± 0.1 | 2.2 | ||
| S. crassipes | 2016 | 1.1 ± 0.1 | 17.1 ± 2.3 | 32.7 ± 0.9 | 1.3 ± 0.0 | − | |
| F. evanescens | 2009 | 3.4 ± 0.3 | 61.4 ± 3.3 | 183.0 ± 24.3 | 1.0 ± 0.0 | 6.1 ± 0.5 | |
| 2016 | 2.7 ± 0.0 | 97.4 ± 74.5 | 164.3 ± 2.4 | 1.6 ± 0.0 | − | ||
| S. japonica | 2009 | 4.4 ± 0.2 | 262.6 ± 42.6 | 30.4 ± 1.1 | 1.5 ± 0.6 | 9.0 ± 1.3 | |
| 2016 | 1.9 ± 0.1 | 25.0 ± 4.3 | 42.8 ± 0.6 | 1.0 ± 0.0 | − | ||
| Верхняя пороговая концентрация (по: Чернова, Коженкова, 2016) | |||||||
| Северо-западная часть Японского моря | F. evanescens | 4.1 | 100 | 80.0 | 3.1 | − | |
| S. babingtonii | 3.5 | 54 | 39.0 | 1.6 | − | ||
| S. crassipes | 3.6 | 81 | 42.7 | 3.2 | − | ||
ОБСУЖДЕНИЕ
Известно, что медь и цинк − хорошие мигранты, они существуют в воде в растворенной форме и, вероятно, имеют одни и те же источники. По-видимому, этим определялось сходство их пространственного распределения в водорослях. Однако распределение свинца значительно отличалось от такового перечисленных металлов. Похожим было распределение кадмия.
Ранее на севере б. Рудная располагалась эстакада, с которой проводилась погрузка свинцового и цинкового концентратов и свинцовых слитков. При погрузке материала были и его потери. Кроме этого, именно в данный район бухты поступало атмосферное загрязнение − заводские дымы, переносимые действующим в холодное время западным муссоном. Загрязнение донных отложений бухты является хроническим, и микроэлементы из них еще долго будут поступать в водную толщу, определяя картину распределения тяжелых металлов, в первую очередь свинца, в водорослях. Повышенные концентрации Pb отмечены также в макрофитах, собранных на рифах у ковша и у мыса Бринера (станции 3 и 4). Это обусловлено тем, что у пирса происходят погрузка и транспортировка измельченных и влажных концентратов свинца. Наконец, свинец может поступать с водами р. Рудная, которая дренирует горнорудный район и продолжает поставлять свинец, цинк и сопутствующие их руде элементы в прибрежно-морские воды. К мысу Бринера микроэлементы переносятся вдольбереговым течением. Как отмечено, наименьшее содержание свинца выявлено в макрофитах, собранных у скалы Монастырь и в б. Лидовка. Во время работы свинцово-плавильного завода этот микроэлемент поступал в б. Лидовка в основном благодаря аэральному переносу. В настоящее время предприятие не работает, соответственно, отсутствуют и выбросы свинцовой пыли в атмосферу. Скала Монастырь располагается в 6 км к югу от б. Рудная; металлы попадают сюда с Приморским течением, направленным вдоль побережья с севера на юг (Яричин, 1980; Арзамасцев и др., 2012). Свинец в водной толще находится преимущественно во взвешенном состоянии, слабо мигрирует и поэтому его перемещение в южные районы минимально.
Наибольшая концентрация Zn выявлена в сцитосифоне, собранном на рифах у ковша (станция 3). Цинк является одним из главных элементов свинцово-цинковых руд, и источники его поступления те же, что и свинца. Повышенным содержанием Zn характеризовались водоросли, собранные в районе северного бенча, где находилась эстакада, с которой производилась погрузка не только свинцовой продукции, но и цинкового концентрата, и куда этот металл может приноситься вдольбереговым противотечением от устья р. Рудная. Концентрация цинка в сцитосифоне из б. Лидовка была наименьшей.
Макрофиты, произраставшие на рифах у ковша, характеризовались максимальным содержанием меди. В целом медь повторяла абрис пространственного распределения цинка, так как она является сопутствующим элементом свинцово-цинковой руды и обладает высокой подвижностью. Ее поступление в б. Рудная обусловлено и речным стоком (Коженкова и др., 2000; Шулькин и др., 2014). Минимальное содержание Cu, выявлено в талломах S. lomentaria из б. Лидовка.
Бухта Рудная и сопредельные акватории характеризовались малоизменчивым пространственным распределением кадмия, наибольшая концентрация которого выявлена в водорослях, собранных на рифах у ковша. Кадмий, как и медь, является сопутствующим элементом свинцово-цинковой руды, он может попадать в бухту со стоком реки. Некоторое увеличение концентрации кадмия по мере продвижения к южным станциям может быть связано с высоким сродством элемента к биогенной составляющей взвеси, доля которой возрастает при удалении от побережья (Шулькин, 2004). Ранее отмечали, что содержание кадмия в водорослях открытых участков акваторий сопоставимо или выше, чем в макрофитах из закрытых акваторий (Христофорова и др., 1994; Шулькин, 2004), что подтверждает вышеописанную природу металла.
Максимальной концентрацией железа при высокой изменчивости его содержания характеризовались водоросли, собранные у северного бенча б. Рудная. Повышенная концентрация железа выявлена и в водорослях, собранных в б. Лидовка. Железо поступает в среду из мягких донных отложений, с терригенным стоком и поверхностным смывом, а также при выветривании горных пород и последующем их растворении. Высокое содержание железа в водорослях из б. Лидовка, вероятно, обусловлено наличием мягких грунтов, которыми сложена береговая линия этой бухты.
Концентрация металлов в водорослях зависит от видоспецифических и экологических факторов. К видоспецифическим факторам относятся степень развития таллома водорослей и удельная поверхность контакта со средой, возраст анализируемых тканей, участок слоевища, содержание альгиновых кислот и некоторые другие индивидуальные характеристики. Связывание элемента организмами в большой степени обусловлено формой его существования в среде. Если железо и свинец находятся в морской воде преимущественно во взвешенной форме, то цинк, медь и кадмий мигрируют в растворенном состоянии, находясь в комплексах с неорганическими и органическими лигандами (Гордеев, Лисицын, 1979; Шулькин, 2004). Концентрации железа и свинца были самыми высокими у S. lomentaria. Поскольку у водорослей процессы обмена со средой происходят при контакте всей поверхности таллома с водой, степень развития удельной поверхности является важным фактором, влияющим на микроэлементный состав растения. Находящиеся во взвешенной форме Fe и Pb легко задерживаются волосками, покрывающими тонкий, трубчатый, с полостью внутри таллом S. lomentaria, а также бугорками и другими неровностями, делающими поверхность водоросли еще более шероховатой (Христофорова, 1989; Христофорова, Кобзарь, 2012). Развитой поверхностью контакта со средой, обусловленной необычайной разветвленностью слоевища, обилием веток, веточек, филлоидов, воздушных пузырей и рецептакул, обладает также S. crassipes, который стоит на втором месте после S. lomentaria по накоплению свинца. Однако по аккумуляции железа он иногда уступает фукусу, что, очевидно, связано с большой долей старых частей в общей массе слоевища этого долгоживущего вида (скалы Два Брата, скала Монастырь). Ранее было показано, что стареющие участки талломов макрофитов, удаленные от точки роста, накапливают большее количество металлов (Bryan, 1969, 1971), это подтверждено нами для F. evanescens (Христофорова и др., 1981). В то же время мясистые и слабо разветвленные слоевища S. babingtonii и S. japonica с небольшой удельной поверхностью контакта со средой отличаются низкими концентрациями данных элементов.
Максимальная аккумуляция цинка фукусами обусловлена, скорее всего, не столько развитостью удельной поверхности их слоевищ, сколько содержанием в растениях альгиновых кислот – уникальных полисахаридов, присущих только отделу Phaeophyta. В фукусовых водорослях содержание альгиновых кислот, обладающих высокими сорбционными свойствами, может достигать 36% (Кизеветтер, 1980; Аминина и др., 2007); этим объясняется их выдающаяся способность связывать растворенные микроэлементы. Абсорбции свинца благоприятствует не только наличие слоевища с развитой поверхностью, но и высокое содержание в водорослях альгинатов. Более 50 лет назад скандинавские исследователи А. Хауг и О. Смидсред (Haug, Smidsrod, 1965) показали, что сродство альгиновой кислоты к химическим элементам снижается в ряду: Ba > Pb > Cu > Sr > Cd > Ca > Zn > Ni > Co > Mn > Fe > Mg. В начале нового столетия было подтверждено, что по прочности связи с альгинатами Pb стоит на первом месте, за ним следуют Cu … Zn и Fe (Хотимченко и др., 2001). Концентрация кадмия была наибольшей в S. crassipes и F. evanescens. Известно, что удержание кадмия в организме происходит благодаря его прочной связи с SH-группами белков-металлотионеинов. Металлотионеины и им подобные металлсвязывающие белки присущи всему живому – от высших животных и растений до примитивных синезеленых и простейших (Лукьянова, Евтушенко, 1982). По-видимому, S. crassipes и F. evanescens богаты не только альгинатами, но и серосодержащими белками. Концентрация меди была наибольшей в S. lomentaria. Для меди также характерна прочная связь с белками, особенно с низко- и высокомолекулярными (Христофорова и др., 1994). Биохимия сцитосифона слабо изучена, так как он не является промысловым видом и не образует большой биомассы. Однако можно предположить, что удержанию меди в слоевищах этой водоросли способствуют как связывание с альгиновыми кислотами, так и образование белковых комплексов.
Изменение содержания тяжелых металлов в макрофитах б. Рудная и сопредельных акваторий с 2009 и 2010 гг. к 2016 г. не имело однонаправленного вектора. Так, в талломах сцитосифона повсеместно сильно снизилась концентрация свинца (на северном бенче б. Рудная – от 42.6 ± 0.8 до 8.5 мкг/г, на рифах у ковша – от 72.3 ± 2.0 до 5.9 мкг/г, на мысе Бринера – от 40.0 ± 1.3 до 5.4 мкг/г, у скал Два Брата – от 49.1 ± 6.5 до 3.0 мкг/г, у скалы Монастырь – от 10.3 ± 0.3 до 2.2 мкг/г), что, несомненно, отражает резко снизившееся поступление этого элемента в окружающую среду. В то же время содержание меди, цинка и кадмия изменилось не так значительно и однозначно. В сцитосифоне с северного бенча содержание Cd увеличилось более чем в 2 раза (от 0.8 ± 0.1 до 1.7 ± 0.2 мкг/г), содержание Cu увеличилось на уровне тенденции (от 7.0 ± ± 0.3 до 7.5 ± 0.9 мкг/г), а Zn – снизилось в 1.6 раза (от 300.7 ± 3.8 до 185.5 ± 15.6 мкг/г). На рифах у ковша концентрация Zn в водорослях наоборот возросла в 1.5 раза (от 243.9 ± 3.2 до 380.8 ± 7.6 мкг/г) и более чем в 2 раза увеличилось содержание Сd (от 0.9 ± 0.0 до 1.8 ± 0.0 мкг/г), в то время как содержание Cu снизилось в 1.5 раза (от 12.0 ± 0.2 до 7.8 ± 0.2 мкг/г).
Изменение концентраций металлов в сцитосифоне, собранном в б. Лидовка, где удалось осуществить сборы и в 2010 г., значительно отличалось от такового в б. Рудная. Здесь с 2009 г. к 2010 г. произошло снижение концентрации Zn (от 39.8 ± 1.7 до 32.1 ± 0.8 мкг/г), а содержание Pb и Cu изменилось незначительно (от 12.7 ± 1.8 до 11.4 ± 0.1 мкг/г и от 2.6 ± 0.5 до 3.2 ± 0.1 мкг/г соответственно). К 2016 г. содержание свинца в водорослях резко снизилось до 2.2 мкг/г, а концентрация Zn не только достигла уровня 2009 г., но даже превысила его (50.3 ± 0.7 мкг/г). Концентрация меди несколько снизилась (2.0 ± 0.1 мкг/г).
Динамика концентраций тяжелых металлов в талломах водорослей следовала за изменениями, происходившими в бухте, в том числе вызванными событиями в производственном процессе. Сильное снижение концентрации свинца в S. lomentaria с 2009 г. к 2016 г. отражает резко уменьшившееся поступление элемента в окружающую среду после остановки плавильного завода. Концентрации меди и цинка в водоросли снизились незначительно, очевидно, содержание этих металлов зависит от других источников: от стока р. Рудная и от выноса загрязненных морских вод из ковша (Шулькин и др., 2014).
Характер изменения концентраций металлов в сцитосифоне из б. Рудная значительно отличался от такового водорослей из б. Лидовка, где основным источником загрязнения вод был аэральный перенос дымов плавильного завода. Уже к 2010 г. в водорослях из б. Лидовка отмечено снижение содержания Pb до 11.4 мкг/г (с 12.7 мкг/г в 2009 г.). К 2016 г. прекращение пылевых выбросов из заводской трубы в атмосферу привело к настоящему “обрушению” концентрации свинца (до 2.2 мкг/г). Однако содержание Zn в сцитосифоне из этой бухты с 32.1 ± 0.8 мкг/г в 2010 г. к 2016 г. увеличилось до 50.3 ± 0.7 мкг/г (табл. 1). В то же время концентрация меди, составлявшая в 2010 г. 3.2 ± 0.1 мкг/г, к 2016 г. снизилась до 2.0 ± ± 0.1 мкг/г. Такая же тенденция была отмечена ранее для собранной в этой же бухте цистозиры (Шулькин и др., 2014). Медь и особенно цинк, если они не связаны с добычей и переработкой руд или с работой гальванических цехов машиностроительных и приборостроительных производств, являются трассерами коммунально-бытового воздействия. Бухта Лидовка стала популярным местом отдыха из-за просторного пляжа и впадающей в бухту небольшой чистой реки. Рост рекреационной нагрузки на побережье бухты может привести к увеличению поступления микроэлементов в ее акваторию. Даже при отсутствии каких-либо производств влияние антропогенной нагрузки на водную среду и ее обитателей можно обнаружить по увеличению содержания в них Zn, как, например, в F. evanescens (Христофорова, Маслова, 1983) или в S. miyabei (Кобзарь, Христофорова, 2015). Тем не менее, если ориентироваться на современный уровень фона (Чернова, Коженкова, 2016), эту бухту пока еще можно считать чистой. Так, в S. crassipes из б. Лидовка концентрация Cu составляет 1.2 мкг/г (верхняя пороговая концентрация этого элемента 3.6 мкг/г), а содержание Zn − 36.8 мкг/г (у скалы Монастырь – 32.7 мкг/г, верхнее значение фонового диапазона выше – 42.7 мкг/г).
Таким образом, состояние б. Рудная заметно изменилось к лучшему после остановки свинцово-плавильного завода и прекращения воздействия на среду индустриальных дымов и промышленных стоков, причем особенно резко снизилось поступление свинца. Однако в настоящее время действует другой, хотя и менее сильный, источник загрязнения – погрузочный пирс в гавани (ковш), поставляющий цинковое, свинцовое и в меньшей степени медное загрязнение. Существуют и старые источники загрязнения – место расположения бывшей эстакады с оставшимися на дне свинцовыми слитками, свинцовым и цинковым концентратом, а также накопившиеся в донных отложениях элементы. Определенное влияние оказывает река, дренирующая горно-рудный район. В связи с отсутствием дымов плавильного завода заметно изменился источник воздействия на б. Лидовка. Возможно, поэтому удобная для отдыха бухта в теплое время года начинает испытывать пресс рекреантов.
Авторы выражают благодарность инженерам-аналитикам лаборатории геохимии Тихоокеанского института географии ДВО РАН А.М. Плотниковой и Г.А. Власовой.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 14-50-00034).
Список литературы
Аминина Н.М., Вишневская Т.И., Гурулева О.Н., Ковековдова Л.Т. Состав и возможности использования бурых водорослей дальневосточных морей // Вестн. ДВО РАН. 2007. № 6. С. 123–130.
Арзамасцев И.С., Данченков М.А., Мишуков В.Ф. Поверхностные течения залива Петра Великого // Современное экологическое состояние залива Петра Великого Японского моря [монография]. Владивосток: Изд. Дом ДВФУ. 2012. С. 62–75.
Гордеев В.С., Лисицын А.П. Микроэлементы // Химия океана. Ч. 1. Химия вод океана. М.: Наука. 1979. С. 337–375.
Кизеветтер И.В. Химический состав и народнохозяйственное значение промысловых макрофитов морей // Использование биологических ресурсов Мирового океана. М. 1980. С. 131–150.
Кобзарь А.Д., Христофорова Н.К. Мониторинг загрязнения прибрежных вод Амурского залива (Японское море) тяжелыми металлами с использованием бурой водоросли Sargassum miyabei // Биол. моря. 2015. Т. 41. № 5. С. 361–365.
Коженкова С.И., Христофорова Н.К., Чернова Е.Н. Долговременный мониторинг загрязнения морских вод северного Приморья тяжелыми металлами с помощью бурых водорослей // Экология. 2000. Т. 31. № 3. С. 233–237.
Лукьянова О.Н., Евтушенко З.С. Металлотионеины морских беспозвоночных // Биол. моря. 1982. № 4 С. 3–12.
Перестенко Л.П. Водоросли залива Петра Великого. Л.: Наука. 1980. 232 с.
Петров Ю.Е. Отдел бурые водоросли (Phaeophyta) // Жизнь растений. Т. 3. Водоросли, лишайники. М.: Просвещение. 1977. С. 144−191.
Хотимченко Ю.С., Ковалев В.В., Савченко О.В., Зиганшина О.А. Физико-химические свойства, физиологическая активность и применение альгинатов – полисахаридов бурых водорослей // Биол. моря. 2001. Т. 27. № 3. С. 151–162.
Христофорова Н.К. Биоиндикация и мониторинг загрязнения морских вод тяжелыми металлами. Л.: Наука. 1989. 192 с.
Христофорова Н.К. Экологические проблемы региона: Дальний Восток − Приморье: Учеб. пособие. Владивосток; Хабаровск: Хабаровск. кн. изд-во. 2005. 304 с.
Христофорова Н.К., Богданова Н.Н., Обухов А.И. Использование бурых водорослей фукусов для индикации состояния прибрежно-морских вод // Сихотэ-Алинский биосферный район: принципы и методы экологического мониторинга. Владивосток: ДВНЦ АН СССР. 1981. С. 118–127.
Христофорова Н.К., Богданова Н.Н., Толстова Л.М. Металлы в составе тихоокеанских саргассовых водорослей в связи с проблемой мониторинга загрязнения вод // Океанология. 1983. Т. 23. Вып. 2. С. 270–275.
Христофорова Н.К., Гамаюнова О.А., Афанасьев А.П. Состояние бухт Козьмина и Врангеля (залив Петра Великого, Японское море): динамика загрязнения тяжелыми металлами // Изв. ТИНРО. 2015. Т. 180. С. 179–186.
Христофорова Н.К., Кобзарь А.Д. Бурые водоросли-макрофиты как индикаторы загрязнения вод бухты Рудной тяжелыми металлами // Изв. ТИНРО. 2012. Т. 168. С. 220–231.
Христофорова Н.К., Маслова Л.М. Сравнение загрязнения тяжелыми металлами морских прибрежных вод Атлантики и Пацифики по минеральному составу фукусовых водорослей // Биол. моря. 1983. № 1. С. 3–11.
Христофорова Н.К., Шулькин В.М., Кавун В.Я., Чернова Е.Н. Тяжелые металлы в промысловых и культивируемых моллюсках залива Петра Великого. Владивосток: Дальнаука. 1994. 296 с.
Чернова Е.Н., Коженкова С.И. Определение пороговых концентраций металлов в водорослях – индикаторах прибрежных вод северо-западной части Японского моря // Океанология. 2016. Т. 56. № 3. С. 393–402.
Шулькин В.М. Металлы в экосистемах морских мелководий. Владивосток: Дальнаука. 2004. 279 с.
Шулькин В.М., Чернова Е.Н., Христофорова Н.К., Коженкова С.И. Влияние горно-рудной деятельности на изменение химического состава компонентов водных экосистем // Геоэкология. Инженерная геология. Гидрогеология. Геокриология. 2014. № 6. С. 483–494.
Яричин В.Г. Состояние изученности циркуляции вод Японского моря // Тр. ДВНИГМИ. 1980. № 80. С. 46–61.
Bryan G.W. The absorption of zinc and other metals by the brown seaweed Laminaria digitata // J. Mar. Biol. Assoc. U.K. 1969. V. 49. P. 225–243.
Bryan G.W. The effect of heavy metals (other than mercury) on marine and estuarine organisms // Proc. Roy. Soc. London B. 1971. V. 177. № 1048. P. 389–410.
Bryan G.W. Recent trends in research on heavy-metal contamination in the sea // Helgolander Wiss. Meeresuntersuch. 1980. Bd 33. S. 6−25.
Haug A., Smidsrod O. The effect of divalent metals on the properties of alginate solution // Acta chem. scand. B. 1965. V. 19. P. 341−351.
Khristophorova N.K., Kozhenkova S.I. The use of the brown algae Sargassum spp. in heavy metal monitoring of marine environment near Vladivostok, Russia // Ocean Polar Res. 2002. V. 24. № 4. P. 325–329.
Дополнительные материалы отсутствуют.


