Биология моря, 2019, T. 45, № 2, стр. 125-132
Первое ультраструктурное описание инфицирования аппендикулярий (Chordata: Tunicata) микроспоридиоподобными протистами
А. В. Савельева *
Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
* E-mail: ansavbys29@yandex.ru
Поступила в редакцию 20.03.2018
После доработки 15.10.2018
Принята к публикации 18.10.2018
Аннотация
Впервые выявлен внутриклеточный паразитизм у аппендикулярий. При помощи трансмиссионной электронной микроскопии в пищеварительном эпителии особей аппендикулярии Oikopleura gracilis, внешне не проявляющих признаков заражения, обнаружены клетки микроспоридиоподобных протистов: два морфотипа клеток, интерпретированные как доспоровые стадии, и споры. Клетки первого морфотипа ультраструктурно сходны со споронтами микроспоридий, в их цитоплазме видны везикулы комплекса Гольджи. У клеток второго морфотипа, предположительно споробластов, оболочка заметно толще, а в цитоплазме видны специфические органеллы: три витка полярного филамента и вакуоль. Обнаруженные споры (размером 0.7 × 0.9 мкм), как и споры микроспоридиев, поверх цитоплазматической мембраны покрыты двухслойной оболочкой, имеют полярный филамент и поляропласт. В пищеварительном эпителии аппендикулярий протисты вызывают гипертрофию зараженных энтероцитов, деформацию их ядер и увеличение размеров митохондрий.
Аппендикулярии – группа морских голопланктонных оболочников с экстремально коротким жизненным циклом, составляющим 5–7 сут (Nishida, 2008); это фильтраторы, которые питаются в основном микроводорослями и мелкими частицами органики (Fenaux, 1998; Gorsky et al., 1999). Пищевое поведение и строение пищеварительного канала аппендикулярий исследованы ранее (Burighel et al., 2001; Brena et al., 2003). Известно, что пищеварительный канал аппендикулярий из семейства Oikopleuridae состоит из пищевода, двулопастного желудка, вертикальной, средней и задней кишки. Предполагается, что в желудке происходит переваривание и частичное запасание пищи в виде липидных капель, а в задней кишке – запасание белков и формирование фекальных гранул. Пищеварение у аппендикулярий двух типов – пристеночное и внутриклеточное. Пищевой слизистый шнур, сформированный секретом железистых полей эндостиля, продвигается вдоль пищеварительного канала за счет биения многочисленных ресничек энтероцитов. Апикальная поверхность энтероцитов кроме ресничек несет многочисленные микроворсинки (Burighel et al., 2001). Достоверной информации о заражении аппендикулярий простейшими не найдено. О заражении аппендикулярий грегариной Lankesteria abbotty сообщали Леандер с соавторами (Leander et al., 2006), однако в качестве животных-хозяев были указаны представители другого класса оболочников – асцидии Cnemidocarpa finmarkiensis и Clavelina huntsmani. В связи с отсутствием литературных сведений о паразитарных инвазиях у аппендикулярий выявленное в данном исследовании заражение Oikopleura gracilis простейшим вызывает интерес.
Цель настоящей работы – ультраструктурный анализ зараженных энтероцитов аппендикулярии O. gracilis (Oikopleuridae), а также описание обнаруженных протистов и морфологических признаков их патологического влияния на организм хозяина.
МАТЕРИАЛ И МЕТОДИКА
Объект исследования – массовый вид аппендикулярий Oikopleura gracilis Lohmann, 1896 семейства Oikopleuridae. Животных собирали в летний период 2012 и 2017 годов планктонной сетью Джеди на глубине 10 м в районе Морской биологической станции “Восток” ННЦМБ ДВО РАН (зал. Восток, Японское море). Пробы просматривали под бинокуляром МБС-10 (РФ) при помощи камеры Богорова; обнаруженных аппендикулярий стеклянной пипеткой отсаживали в чашки Петри с фильтрованной морской водой для последующей фиксации.
Для трансмиссионной электронной микроскопии (ТЭМ) половозрелых особей O. gracilis фиксировали 2.5% раствором глутаральдегида на какодилатном буфере (КБ). После отмывки в КБ (0.05 М, pH 7.4) материал дофиксировали 1% водным раствором четырехокиси осмия и дегидратировали в спиртах и ацетоне. Образцы заливали в смолу Spurr Resin (SIGMA-ALDRICH). Полутонкие срезы толщиной 0.5 мкм, изготовленные на ультратоме Reichert-Ultracut E, окрашивали метиленовым синим и фотографировали при помощи светового микроскопа Keyonce Biorevo BZ9000 (Япония). Тонкие срезы толщиной 70 нм после контрастирования в водном растворе уранилацетата и растворе цитрата свинца изучали в трансмиссионных электронных микроскопах Jeol JEM 100S (Япония), Zeiss Libra 120 (Англия) и Zeiss Sigma 300 VI (Англия) в Центре коллективного пользования “Дальневосточный центр электронной микроскопии” ННЦМБ ДВО РАН.
РЕЗУЛЬТАТЫ
Пищеварительный тракт Oikopleura gracilis представлен глоткой, пищеводом и желудком, состоящим из левой и правой долей, а также кишкой, которая подразделяется на вертикальный, средний и задний отделы и открывается наружу анусом, расположенным с вентральной стороны туловища (рис. 1а, б). Пищеварительный эпителий желудка O. gracilis однослойный, как и в других отделах пищеварительного тракта, в нем преобладают энтероциты с многочисленными микроворсинками и длинными ресничками (рис. 1г; рис. 2а, б). Ширина энтероцитов 2 мкм, высота – 2.5 мкм. Крупное, овальное ядро размером около 1.5–2 мкм занимает преимущественно центральную часть энтероцита (рис. 2б). В цитоплазме располагаются округлые митохондрии диаметром 0.4 мкм, везикулы разного диаметра с электронно-светлым содержимым и околоядерный шероховатый эндоплазматический ретикулум; в апикальной части цитоплазмы видны корешки ресничек (рис. 2б).
Рис. 1.
Строение пищеварительного канала аппендикулярии Oikopleura gracilis и локализация в нем инфицированных клеток. а – общий вид животного с дорсальной стороны (световая микроскопия); б – общая анатомия туловища зараженной особи; в – локализация зараженного энтероцита задней кишки; г – локализация зараженного энтероцита правой доли желудка (полутонкие парасагиттальные срезы). Условные обозначения: ap – анальная папилла, ci – реснички энтероцитов, en – эндостиль, es – пищевод, h – часть слизистого домика, hg – гермафродитная гонада, ht – сердце, ll – левая доля желудка, m – рот, oik – ойкопласт, ph – глотка, r – задняя кишка, rep – эпителий задней кишки, rl – правая доля желудка, tl – хвост. *Полость правой доли желудка, **гемоцель; большие черные стрелки указывают на энтероциты со спорами.
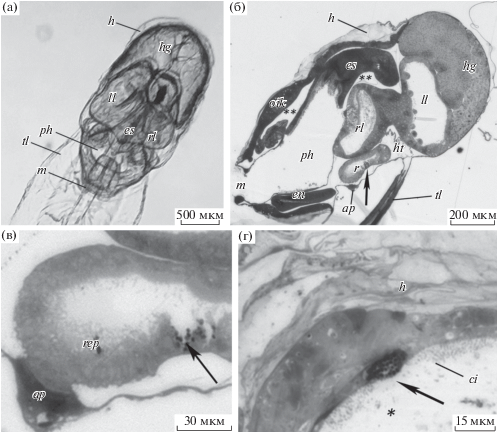
Рис. 2.
Ультраструктура энтероцитов пищеварительного эпителия аппендикулярии Oikopleura gracilis. а – ультраструктура двух зараженных энтероцитов желудка (между ними энтероцит, не содержащий клеток паразита); б – ядро нативного энтероцита; в – зараженный энтероцит эпителия задней кишки. Условные обозначения: bl – базальная пластинка, ci – реснички энтероцитов, dg – разрушенный участок цитоплазмы споры, mt – митохондрия энтероцита, mv – микроворсинки энтероцита, n1 – ядро нормального энтероцита, n2 – ядро зараженного энтероцита, rer – шероховатый эндоплазматический ретикулум, s – спора, s1 – клетки первого морфотипа, v – везикула. *Полость правой доли желудка, **гемоцель, ***полость задней кишки.
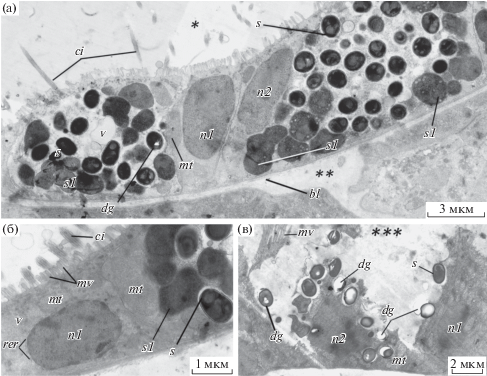
Признаки патологического заражения обнаружены в семи энтероцитах пищеварительного эпителия желудка, один зараженный энтероцит найден в эпителии задней кишки O. gracilis. В других отделах пищеварительного канала энтероциты с подобной патологической ультраструктурой не обнаружены. Зараженные энтероциты не визуализировались у живых особей O. gracilis, однако на гистологических препаратах, окрашенных метиленовым синим, в пищеварительном эпителии они заметно выделялись гипертрофированными размерами (рис. 1б–г). Апикальная поверхность зараженного энтероцита задней кишки O. gracilis разрушена, сохранилась только его базальная часть, в которой кроме спор паразита находятся ядро и митохондрии (рис. 1в; рис. 2в).
Ширина зараженных энтероцитов желудка 10–15 мкм, высота – 8–11 мкм (рис. 1г; рис. 2а; рис. 4а). Апикальная поверхность несет многочисленные короткие микроворсинки и несколько длинных ресничек (рис. 2а). Цитоплазма инфицированных энтероцитов электронно-светлая, в ней расположены крупные митохондрии (около 80 нм) и везикулы с гетерогенным содержимым диаметром около 50 нм (рис. 2а; рис. 3а, б). Ядра зараженных клеток вытянутой или овальной формы, размером 3.5 мкм, с признаками деформации, смещены к апикально-латеральной плазмалемме (рис. 2а). В цитоплазме энтероцита, расположенного между двумя зараженными, клетки паразита не обнаружены, однако он отличается от нормальных энтероцитов большей высотой (5 мкм) и крупным ядром (3.5 мкм по длинной оси). Размер лежащей рядом с ядром митохондрии также больше, чем у нативных энтероцитов аппендикулярии (рис. 2а, б).
Рис. 3.
Ультраструктура доспоровых стадий микроспоридиоподобных протистов в энтероците желудка аппендикулярии Oikopleura gracilis. а – клетки первого морфотипа в процессе деления и цитодифференцировки; б – клетки первого морфотипа рядом со спорами; в – везикулы комплекса Гольджи в клетках первого морфотипа; г – группа из трех клеток второго морфотипа; д – поперечный срез через клетку второго морфотипа. Условные обозначения: bl – базальная пластинка, int – интердигитации; mt – митохондрия энтероцита, mv – микроворсинки, ns2 – ядро клетки второго морфотипа, pf – полярный филамент, pm – цитоплазматическая мембрана энтероцита, pm1 – цитоплазматическая мембрана клетки первого морфотипа, pm2 – цитоплазматическая мембрана клетки второго морфотипа, s – спора, s1 – клетки первого морфотипа, s2 – клетки второго морфотипа, v – везикула, vg – везикула комплекса Гольджи, vl – вакуоль; белые стрелки указывают на цитоплазматические мостики между клетками первого морфотипа.
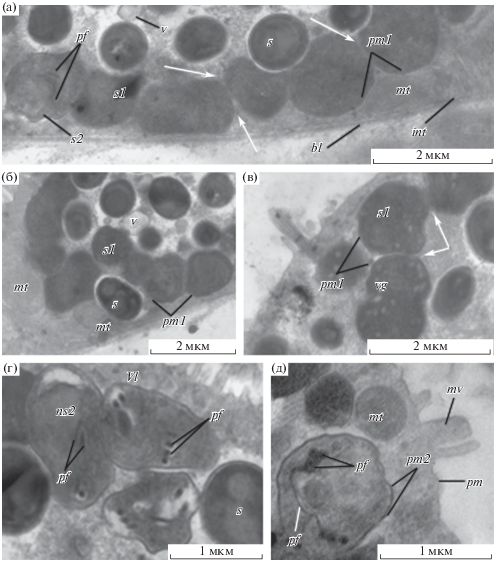
Рис. 4.
Три типа клеток микроспоридиоподобных протистов в энтероцитах желудка аппендикулярии Oikopleura gracilis (а) и специализированные органеллы в цитоплазме спор (б–г). Условные обозначения: bl – базальная пластинка, cs – цитоплазма споры, en – эндоспора, ex – экзоспора, g – электронно-светлый участок цитоплазмы вокруг спор, int – интердигитации; mt – митохондрия энтероцита, pf – полярный филамент, pp – поляропласт, pms – цитоплазматическая мембрана споры, s – спора, s1 – клетки первого морфотипа, s2 – клетки второго морфотипа, v – везикула.
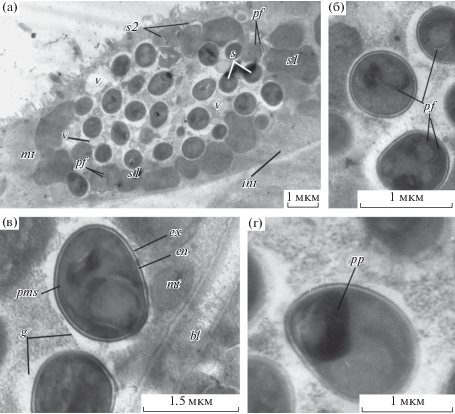
Зараженные и нормальные энтероциты эпителия желудка инфицированных особей O. gracilis располагаются на общей базальной пластинке толщиной 40 нм, образованной коллагеноподобным веществом (рис. 2а, 3а). Плазмалеммы соседних энтероцитов у базальных полюсов формируют взаимные переплетения или интердигитации (рис. 3а; рис. 4а).
В энтероцитах желудка O. gracilis обнаружены споры паразита и клетки двух морфотипов, интерпретированные как доспоровые стадии (рис. 2–4a). Клетки первого морфотипа занимают периферию цитоплазмы энтероцитов хозяина, они вытянутые (3–5 мкм) или округлые (1.5–2.0 мкм) (рис. 2а, б; рис. 3а–в; рис. 4а); часто находятся в тесном контакте друг с другом, соединяясь между собой цитоплазматическими мостиками (рис. 3а–в). Цитоплазма клеток первого морфотипа электронно-плотная, в отдельных клетках отмечены многочисленные светлые овальные везикулы, распределенные по всему объему (рис. 3в). В вытянутых клетках первого морфотипа видны изогнутые элементы полярного филамента (рис. 3а; рис. 4а).
В апикальной части одного из зараженных энтероцитов желудка O. gracilis обнаружены клетки второго морфотипа, тесно контактирующие друг с другом и образующие группы из трех клеток (рис. 3г, д; рис. 4а). Форма клеток неправильная, близкая к прямоугольной, размер – 1.0–1.5 мкм; оболочка заметно толще, чем у клеток первого морфотипа, а цитоплазма помимо ядра содержит специализированную органеллу: полярный филамент, свернутый в 2–3 витка, которые расположены в один ряд, и вакуоль (рис. 3г, д). На поперечном срезе полярный филамент около 10–15 нм в диаметре, он представлен двумя концентрическими слоями: внутренним электронно-светлым и внешним электронно-плотным, в центре находится осевая электронно-плотная структура (рис. 3д). У некоторых клеток на одном из полюсов видна крупная вакуоль с электронно-светлым содержимым (рис. 3г).
Споры паразита находятся в центральной (преимущественно) или в базальной части энтероцитов. Каждая спора окружена электронно-светлым участком цитоплазмы клетки хозяина. На срезе в энтероците насчитывается от 10 до 15 спор округлой или овальной формы размером 0.7 × 0.9 мкм (рис. 2а; рис. 4а). Расположенная поверх цитоплазматической мембраны стенка споры состоит из двух слоев: электронно-светлого внутреннего толщиной 15 нм и электронно-плотного внешнего толщиной 8 нм. Выросты на поверхности внешнего слоя отсутствуют (рис. 4б–г). В гетерогенном содержимом электронно-плотной цитоплазмы различимы элементы полярного филамента (рис. 4б) и поляропласт в виде округлого осмиофильного тела (рис. 4г). Цитоплазма некоторых спор разрушена (рис. 2а, в).
ОБСУЖДЕНИЕ
Тип Microsporidia (Balbiani, 1882) – группа протистов, филогенетически близкая к грибам (Holomycota) (Karpov et al., 2014). Согласно современным представлениям, она относится к супертаксону ARM, который объединяет группы Aphelida, Roselida и Microsporida (Karpov et al., 2014; Keeling, 2014). Микроспоридии – это внутриклеточные паразиты, спектр хозяев которых очень широк (от одноклеточных до позвоночных); внутри клеток животного-хозяина они обычно располагаются свободно, но иногда локализуются внутри паразитофорной вакуоли. Образуют одноклеточные споры, стенка которых состоит из двух слоев: внешнего (экзоспора) и внутреннего (эндоспора), плотно прилегающего к плазматической мембране. Для микроспоридий характерно отсутствие митохондрий и жгутиков, а также наличие своеобразного экструзионного аппарата, состоящего из полярного филамента, поляропласта и задней вакуоли (Vávra, Larsson, 2014).
Общим эффектом микроспоридиоза является гипертрофическое расширение инфицированных клеток хозяина, обусловленное интенсификацией метаболических процессов и/или нарушением клеточного цикла, а также образованием в их цитоплазме большого количества спор паразита (Williams et al., 2014). Увеличение размеров зараженных энтероцитов Oikopleura gracilis позволило обнаружить их на окрашенных полутонких срезах с помощью световой микроскопии. У живых аппендикулярий очаги заражения на световом уровне не визуализировались. У некоторых прозрачных животных, например у креветок Litopenaeus setiferus и Caridina formosae или у циклопа Cyclops sp., симптомом заболевания микроспоридиозом становится появление белых непрозрачных ксеном – образований, в которых локализуются паразиты (Исси, Воронин, 2007; Wang et al., 2013; Sokolova, Hawke, 2016; Sokolova et al., 2016). Аппендикулярия O. gracilis – прозрачное животное, но у инфицированных особей не обнаружено патологических отличий от интактных. Известно об общеорганизменной реакции животных на микроспоридиоз. Так, у насекомых под воздействием этих паразитических простейших изменяются репродуктивное поведение и гормональный фон, влияющий на линьку. При этом гонады, нервы и нейроэндокринные клетки не поражаются микроспоридиями, которые локализуются в других тканях (Исси, Воронин, 2007). Для аппендикулярий подобная реакция на микроспоридиоз неизвестна.
В инфицированных микроспоридиями клетках, как правило, заметны деструктивные изменения (Исси, Воронин, 2007; Ardila-Garcia, Fast, 2012); у O. gracilis на такие изменения косвенно указывает деформация ядер зараженных энтероцитов. Поскольку микроспоридии лишены митохондрий и используют митохондрии клеток хозяина для восполнения своих энергозатрат (Исси, Воронин, 2007), то при микроспоридиозе характерно увеличение числа и размера этих клеточных органелл, отмеченное в инфицированных клетках исследованных аппендикулярий. Интересно, что ультраструктурным изменениям подвергся также энтероцит O. gracilis, расположенный между двумя зараженными. Размеры энтероцита, как и его митохондрий, были больше, чем нативных энтероцитов, но паразит в нем не обнаружен. Возможно, зараженные энтероциты опосредованно оказывают патологическое влияние на находящиеся с ними в тесном контакте близлежащие клетки. Однако протисты могли отсутствовать на срезах, поэтому нельзя исключить, что этот энтероцит также заражен. Неизвестно, происходит ли реинфицирование энтероцитов O. gracilis или из-за короткого онтогенеза аппендикулярии не успевают подвергнуться вторичному заражению.
По способу питания аппендикулярии – фильтраторы (Flood, 1991; Gorsky, Fenaux, 1998), поэтому споры обнаруженных микроспоридиоподобных протистов могли попасть в полость пищеварительного тракта исследованных аппендикулярий перорально вместе с отфильтрованными пищевыми частицами. Паразиты обнаружены только в энтероцитах желудка и задней кишки, т.е. в тех отделах пищеварительного канала, где происходит активное всасывание питательных веществ.
Попав в организм хозяина, клетка микроспоридий претерпевает несколько последовательных мерогониальных делений, в результате которых образуются меронты (Исси, Воронин, 2007). В энтероцитах O. gracilis паразитарные клетки, морфология которых соответствовала бы этой стадии развития, не обнаружены. Следующая стадия – споронты, которые появляются в результате спорогониальных делений. Для споронтов характерно накопление электронно-плотного материала на поверхности цитоплазматической мембраны, приводящее к утолщению оболочки клетки, а также увеличение числа элементов шероховатого эндоплазматического ретикулума и комплекса Гольджи (КГ) (Исси, Воронин, 2007). В клетках паразита из энтероцитов аппендикулярий, отнесенных к первому морфотипу, обнаружены везикулы одного диаметра с электронно-светлым содержимым, которые интерпретированы как элементы КГ. Эта клеточная органелла необходима для формирования полярного филамента микроспоридий, поэтому его гипертрофия указывает на начало цитодифференцировки споронтов в споробласты (Sokolova et al., 2001; Temereva, Sokolova, 2017). Формирующийся полярный филамент отмечен в вытянутых клетках первого морфотипа.
Спорогония микроспоридиев завершается образованием споробласта, в котором специфические органеллы микроспоридий начинают приобретать окончательный вид. Для споробластов и молодых спор типично наличие толстой электронно-плотной оболочки и полярного филамента, скрученного в спираль с разным количеством витков (Исси и др., 1993; Sokolova et al., 2006; Исси, Воронин, 2007; Wang et al., 2013; Toguebay et al., 2014). Появление в цитоплазме клеток второго морфотипа полярного филамента и заметное утолщение оболочки этих клеток позволяют определить их как споробласты или молодые споры. Кроме этого они имеют вакуоль, которая может быть гомологична задней вакуоли микроспоридий. Ультраструктура полярного филамента, выявленного в данных клетках, сходна со строением полярного филамента микроспоридий (Исси, Воронин, 2007).
Развитие микроспоридий завершает стадия споры; для нее характерна поляризация клетки, органеллы в споре распределяются неслучайным образом. Кроме полярного филамента в споре имеется поляропласт – органелла в виде округлого электронно-плотного образования. Однако мембраны поляропласта спор, выявленных в энтероцитах аппендикулярии O. gracilis, не разрешены и на срезах выглядят как единое осмиофильное тело, что характерно для передней части поляропласта многих микроспоридий, например Perezea nelson (Sokolova, Hawke, 2016) и Alfvenia sibirica (Sokolova et al., 2016). Обнаруженные в энтероцитах O. gracilis споры паразита всегда окружены электронно-светлыми участками цитоплазмы, которые отмечены вокруг спор микроспоридий в цитоплазме зараженных клеток животных-хозяев из разных групп Metazoa (Sokolova et al., 2004; Исси, Воронин, 2007; Рязанова, Елисейкина, 2010; Ardila-Garcia, Fast, 2012; Temereva, Sokolova, 2017).
Протокол фиксации для аппендикулярий, примененный в настоящем исследовании, оказался неподходящим для спор протистов, так как плохое прохождение фиксатора через плотные оболочки спор не позволило детально описать их внутреннее строение и привело к разрушению некоторых из них. Однако обнаруженные ультраструктурные особенности морфологии протистов из энтероцитов аппендикулярии O. gracilis указывают на их сходство со споронтами, споробластами и спорами микроспоридий, которые отличаются от других протистов наличием аппарата экструзии, состоящего из поляропласта, якорного диска и полярного филамента (Keeling, 2014). К сожалению, полученных данных недостаточно для определения видовой принадлежности микроспоридиоподобных протистов, обнаруженных в энтероцитах пищеварительного канала аппендикулярии O. gracilis.
Автор выражает искреннюю признательность за обсуждение полученных данных Ю.Я. Соколовой (Институт цитологии РАН) и Т.Г. Симдянову (Биологический факультет МГУ им. М.В. Ломоносова); за помощь в сборе материала С.Ш. Даутову (ННЦМБ ДВО РАН), а в съемке живых аппендикулярий – И.А. Адамейко (Каролинский институт, Швеция, Стокгольм). Особую благодарность автор выражает сотрудникам Центра коллективного пользования “Дальневосточный центр электронной микроскопии” Д.В. Фомину и К.А. Шефферу за помощь в работе с электронными микроскопами.
Исследование выполнено при финансовой поддержке гранта РФФИ в рамках научного проекта № 18-34-00357.
Список литературы
Исси И.В., Воронин В.Н. Тип Microsporidia Микроспоридии // Протисты (Protista): руководство по зоологии. Ч. 2. СПб.: Наука. 2007. Т. 2. С. 994–1045.
Исси И.В., Крылов С.В., Николаева В.М. Строение микроспоридии Nosema meligethi и выделение нового рода Anncaliia // Паразитология. 1993. Т. 27. № 2. С. 127–135.
Рязанова Т.В., Елисейкина М.Г. Микроспоридии родов Thelohania (Thelohaniidae) и Ameson (Pereziidae) у двух видов крабов-литодид Охотского моря // Биол. моря. 2010. Т. 36. № 6. С. 429–436.
Ardila-Garcia A.M., Fast N.M. Microsporidian infection in a free-living marine nematode // Eukaryotic Cell. 2012. V. 11. № 12. P. 1544–1551.
Brena C., Cima F., Burighel P. Alimentary tract of Kowalevskiidae (Appendicularia, Tunicata) and evolutionary implications // J. Morphol. 2003. V. 258. P. 225–238.
Burighel P., Brena C., Martinucci G.B., Cima F. Gut ultrastructure of the appendicularian Oikopleura dioica (Tunicata) // Invertebr. Biol. 2001. V. 120. P. 278–293.
Fenaux R. Life history of the Appendicularia // The Biology of Pelagic Tunicates (Q. Bone ed.). Oxford: Oxford Univ. Press. 1998. P. 151–159.
Flood P.R. Architecture of, and water circulation and flow rate in, the house of the planktonic tunicate Oikopleura labradoriensis // Mar. Biol. 1991. V. 111. P. 95–111.
Gorsky G., Chrétiennot-Dinet M.J., Blanchot J., Palazoli I. Picoplankton and nanoplankton aggregation by appendicularians: Fecal pellet contents of Megalocercus huxleyi in the equatorial Pacific // J. Geophys. Res.: Oceans. 1999. V. 104. № C2. P. 3381–3390.
Gorsky G., Fenaux R. The role of Appendicularia in marine food webs // The Biology of Pelagic Tunicates / Ed. Q. Bone. Oxford: Oxford Univ. Press. 1998. P. 161–169.
Karpov S.A., Mamkaeva M.A., Aleoshin V.V. et al. Morphology, phylogeny, and ecology of the aphelids (Aphelidae, Opisthokonta) and proposal for the new superphylum Opisthosporidia // Front. Microbiol. 2014. V. 5. № 112. P. 1–11.
Keeling P.J. Phylogenetic Place of Microsporidia in the Tree of Eukaryotes // Microsporidia: Pathogens of Opportunity. First Edition / Eds L.M. Weiss, J.J. Becnel. Chichester, UK: Wiley-Blackwell. 2014. P. 195–202.
Leander B.S., Lloyd S.A.J., Marshall W., Landers S.C. Phylogeny of Marine Gregarines (Apicomplexa) – Pterospora, Lithocystis and Lankesteria – and the Origin(s) of Coelomic Parasitism // Protist. 2006. V. 157. P. 46–60.
Nishida H. Development of the appendicularian Oikopleura dioica: Culture, genome, and cell lineages // Dev., Growth Differ. 2008. V. 50. P. S239–S256.
Sokolova Y.Y., Hawke J.P. Perezia nelsoni (Microsporidia) in Agmasoma penaei-infected Atlantic white shrimp Litopenaeus setiferus (Paenaidae, Decapoda) and phylogenetic analysis of Perezia spp. complex // Protistology. 2016. V. 10. № 3. P. 67–78.
Sokolova Y.Y., Lange C.E., Fuxa J.R. Development, ultrastructure, natural occurrence, and molecular characterization of Liebermannia patagonica n. g., n. sp., a microsporidian parasite of the grasshopper Tristira magellanica (Orthoptera: Tristiridae) // J. Invertebr. Pathol. 2006. V. 91. P. 168–182.
Sokolova Y.Y., McNally L.R., Fuxa J.R., Vinson S.B. Spore morphotypes of Thelohania solenopsae (microsporidia) described microscopically and confirmed by PCR of individual spores microdissected from smears by position ablative laser microbeam microscopy // Microbiology. 2004. V. 150. P. 1261–1270.
Sokolova Y.Y., Senderskiy I.V., Tokarev Y.S. Microsporidia Alfvenia sibirica sp. n. and Agglomerata cladocera (Pfeiffer) 1895, from Siberian microcrustaceans and phylogenetic relationships within the “Aquatic outgroup” lineage of fresh water microsporidia // J. Invertebr. Pathol. 2016. V. 136. P. 81–91.
Sokolova Y., Snigirevskaya E., Morzhina E. et al. Visualization of early Golgi compartments at proliferate and sporogenic stages of a microsporidian Nosema grylli // J. Eukaryotic Microbiol. 2001. P. 86S–87S.
Temereva E.N., Sokolova Y.Y. A microsporidian infection in phoronids (Phylum Phoronida): Microsporidium phoronidi sp. from a Phoronis embryolabi // J. Eukaryotic Microbiol. 2017. V. 65. № 3. P. 427–431.
Toguebaye B.S., Quilichini Y., Diagne P.M., Marchand B. Ultrastructure and development of Nosema podocotyloidis n. sp. (Microsporidia), a hyperparasite of Podocotyloides magnatestis (Trematoda), a parasite of Parapristipoma octolineatum (Teleostei) // Parasite. 2014. V. 21. № 44. P. 1–9.
Vávra J., Larsson J.I.R. Structure of Microsporidia // Microsporidia: Pathogens of Opportunity. First Edition. 2014. P. 1–70.
Wang T.-Ch., Nai Yu-Sh., Wang Ch.-Yu. et al. A new microsporidium, Triwangia caridinae gen. nov., sp. nov. parasitizing fresh water shrimp, Caridina formosae (Decapoda: Atyidae) in Taiwan // J. Invertebr. Pathol. 2013. V. 112. P. 281–293.
Williams B.A.P., Dolgikh V.V., Sokolova Y.Y. Microsporidian Biochemistry and Physiology // Microsporidia: Pathogens of Opportunity. First Edition / Eds. L.M. Weiss, J.J. Becnel. Chichester, UK: Wiley-Blackwell. 2014. P. 245–260.
Дополнительные материалы отсутствуют.


