Биология моря, 2019, T. 45, № 2, стр. 75-85
Биологическая характеристика Dendrochirus zebra (Cuvier, 1829) (Scorpaeniformes: Scorpaenidae) из залива Нячанг Южно-Китайского моря
Д. А. Павлов 1, *, Н. Г. Емельянова 1
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: dimi-pavlov@yandex.ru
Поступила в редакцию 26.04.2018
После доработки 03.06.2018
Принята к публикации 31.05.2018
Аннотация
Изучены биологические особенности дендрохира-зебры Dendrochirus zebra (Cuvier, 1829) из зал. Нячанг Южно-Китайского моря, в том числе соотношение полная длина (TL) – масса (W) тела рыб, размер особей при наступлении половой зрелости, рост отолитов, строение гонад и ультраструктура оболочек овулировавших ооцитов. Соотношение TL–W у самцов и самок различалось, что связано с разным темпом их роста. Рыбы наибольшего размера были представлены преимущественно самцами. Самки статистически значимо отличались от самцов по трем из шести индексов формы отолита (сагитты) и по контуру отолита, описанному на основе эллиптического анализа Фурье. В семяпроводах у самцов длиной более 106 мм обнаружены зрелые сперматозоиды; 50% самок достигали половой зрелости при длине тела 113 мм. У самцов отмечена положительная аллометрия между линейным ростом мочевого пузыря и длиной тела. Оболочка овулировавшего ооцита состояла из трехслойной zona radiatа толщиной 0.6–0.9 мкм и слабо выраженного хориона толщиной около 0.2 мкм. Особенности биологии D. zebra обсуждаются в связи с данными, известными для других представителей подотряда Scorpaenoidei и подсемейства Pteroinae.
Представитель подсемейства Pteroinae семейства Scorpaenidae вид Dendrochirus zebra (Cuvier, 1829) (дендрохир-зебра, крылатка-зебра или карликовая львиная скорпена) широко распространен в тропической и субтропической зонах (30° N–30° S, 32° E–16° W) от Южной Африки, Мадагаскара, Красного моря, Индии и Шри-Ланки на западе до Филиппин, Палау, островов Гуам, Фиджи и Самоа на востоке; обычен в прибрежных зонах Австралии и южной Японии (Poss, 1999; FishBase, 2018). Обитает на глубине от 3 до 60 м на кораллах, каменистых мелководных участках вблизи коралловых рифов, а также в лагунах и пещерах с укрытиями (Allen, Steene, 1988). Это одиночный хищник, который питается на акваториях площадью свыше 8000 м2 (данные подводных наблюдений) преимущественно в темное время суток. В состав пищи входят крабы, креветки и молодь рыб. Временные преднерестовые скопления нескольких самок и самцов (rendezvous sites) обнаружены лишь на определенных участках в светлое время суток. Ядовитые колючие лучи на спинном, анальном и брюшных плавниках служат защитой от хищников и используются в борьбе самцов за спаривание с самкой (Moyer, Zaiser, 1981). Максимальная длина рыб (SL) может достигать 250 мм (Myers, 1991), но обычно не превышает 200 мм (Poss, 1999).
Среди представителей семейства Scorpaenidae крылатки родов Pterois и Dendrochirus – наиболее доступные и популярные обитатели морских аквариумов. Большое количество крылаток ежегодно изымается из природы (Farquhar, 2017), a последствия снижения их численности сложно оценить. Рыбы рода Dendrochirus – типичные хищники, которые представляют конечное звено пищевой цепи на коралловых рифах и могут определять плотность и видовой состав фауны (Fishelson, 1975). Инвазия крылаток P. miles и P. volitans в прибрежные зоны северо-западной Атлантики, Карибских островов и Мексиканского залива, наблюдаемая с начала 1990-х годов, и недавняя инвазия P. miles в Средиземное море имеют серьезные экологические последствия (Morris et al., 2009; Rocha et al., 2015; Kletou et al., 2016; Pusack et al., 2016). В настоящее время данные об интродукции дендрохира-зебры в несвойственные ему регионы отсутствуют, однако, учитывая популярность этого вида в аквариумистике, потенциальная угроза инвазии существует.
Несмотря на широкое географическое распространение, важную роль в экосистемах коралловых рифов, а также на интенсивное использование D. zebra в аквариумном бизнесе, сведения о его биологии ограничены данными о гистологическом строении яичников (Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2013) и об ультраструктуре сперматозоидов (Павлов, Емельянова, 2018). Одна статья, основанная на подводных наблюдениях у о-ва Миякедзима (группа островов Идзу в Тихом океане), посвящена социальной организации и нерестовому поведению этого вида (Moyer, Zaiser, 1981).
Цель настоящей работы – изучение некоторых биологических показателей дендрохира-зебры в зал. Нячанг Южно-Китайского моря, включая размерный состав особей, соотношение TL–W, рост и форму отолитов, размер рыб при наступлении полового созревания и морфологию овулировавших ооцитов, в сравнении с таковыми у близкородственных видов.
МАТЕРИАЛ И МЕТОДИКА
Материал собирали в районе базы Приморского отделения Российско-Вьетнамского тропического научно-исследовательского и технологического центра (г. Нячанг, Вьетнам) в декабре–марте в 2012–2016 годах. Рыб отлавливали местные рыбаки в зал. Нячанг в северной и южной прибрежных зонах о-ва Че (Hon Tre: 12°10′–12°14′ N, 109°14′–109°21′ E) c помощью простого водолазного снаряжения (компрессор, установленный на лодке и подсоединенный к шлангу для дыхания) и накидных сетей. Живых рыб доставляли в лабораторию в течение нескольких часов.
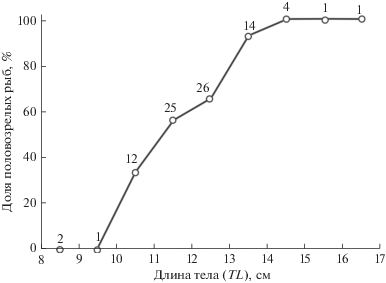
Биологический анализ проводили на наркотизированных (MS-222) особях. Измеряли полную длину тела рыб до окончания самых длинных лучей хвостового плавника (TL) и стандартную длину до конца чешуйного покрова (SL); определяли общую массу тела (W), массу тела без внутренностей (w) и массу гонад (g). Соотношение между W (г) и TL (мм) определяли, используя уравнение степенной зависимости: W = a(TL)b (Sparre, Venema, 1998). Гонадосоматический индекс (ГСИ) рассчитывали по формуле: ГСИ = g/w × 100. Для анализа размерного состава ооцитов использовали фрагменты свежих гонад, помещенные в физиологический раствор. Изображения клеток получали с помощью микроскопа Nikon Eclipse E‑200 и видеокамеры. Диаметр ооцитов измеряли посредством программы ImageJ. При оценке доли половозрелых самок в каждом размерном классе к половозрелым относили особей с яичниками III–IV, IV и IV–V стадий зрелости.
Самцы некоторых видов рыб подотряда Scorpaenoidei обладают гипертрофированным мочевым пузырем, в содержимом которого обнаружены сперматозоиды (Павлов, Емельянова, 2007, 2013; Pavlov, Emel’yanova, 2010). Длину (K) и ширину (k) наполненного мочевого пузыря самцов и самок измеряли с помощью электронного штангенциркуля. Объем мочевого пузыря (V) рассчитывали по формуле для сплюснутого сфероида: V = 1/6πK2k. Концентрацию сперматозоидов в мочевом пузыре определяли в камере Горяева после разведения его содержимого в 10 раз.
Отолиты (сагитты) извлекали с обеих сторон головы каждой особи и помещали в пробирки типа “Эппендорф” с 95% этиловым спиртом. После выдерживания отолитов в 10% растворе гипохлорита натрия в течение 10 мин (Secor et al., 1991) под бинокулярным микроскопом отделяли окружающие ткани. Отолиты ориентировали в положении рострумом влево и sulcus acusticus вверх и фотографировали в проходящем свете под бинокулярным микроскопом Leica MZ6, соединенным с цифровой камерой Leica DFC295 и компьютером. Контрастные изображения отолитов получали с помощью программ Leica DFC Twain 7.7.1 и XnView 2.12. В программе ImageJ изображение каждого отолита калибровали по изображению масштабной линейки; после автоматического поиска порога оттенков серого (Image – Adjust – Threshold) и использования инструмента Wand (tracing) tool получали изображение белого отолита на черном фоне, которое конвертировали в RGB (24-bit) bmp-файл для последующей обработки. Измеряли следующие параметры отолита: максимальную длину вдоль переднезадней оси (L, мм), ширину вдоль дорсовентральной оси (l, мм), периметр (P, мм) и площадь (A, мм2).
Для сравнения формы отолитов самцов и самок рассчитывали следующие индексы: отношение длины к ширине (L/l), отношение квадрата периметра к площади (P/A = P2/A), фактор формы (FF = 4πA/P2), округлость (RO = 4A/πL2), прямоугольность [RE = A/(L × l)] и эллиптичность [EL = = (L – l)/(L + l)]. Биологический смысл этих индексов изложен ранее (Павлов, 2016). Контуры отолитов у рыб разного пола сравнивали, используя эллиптический анализ Фурье и пакет SHAPE 1.3 (Iwata, Ukai, 2002). Контур отолита описывается несколькими гармониками, каждая из которых характеризуется четырьмя коэффициентами (дескрипторами Фурье). Чем больше число гармоник, тем более точно описывается контур (Kuhl, Giardina, 1982). Для описания контуров отолитов использовали 11 гармоник. Три первых коэффициента первой гармоники для анализа не использовали, поскольку они являются константами и применяются для нормализации остальных гармоник, но четвертый коэффициент включен в модель. Таким образом, число дескрипторов Фурье, описывающих контур каждого отолита, составило 41.
Для электронной микроскопии овулировавшие ооциты фиксировали смесью 2.5% глутаральдегида и 2% параформальдегида на фосфатном буфере при pH 7.4 с добавлением NaСl и сахарозы концентрацией соответственно 2.5 и 1.5%. Постфиксацию осуществляли в 1% растворе четырехокиси осмия. Дальнейшую обработку для трансмиссионной и сканирующей электронной микроскопии проводили по общепринятым методикам (Уикли, 1975).
Сравнение прямолинейных зависимостей (в логарифмических координатах) TL–W и L–TL у самцов и самок проводили с помощью критерия Фишера (F) в программе GraphPad Prism 5.03. Индексы формы отолитов у рыб разных полов (в зависимости от характера распределения переменных) сравнивали, используя критерии Стьюдента и Манна–Уитни. Для статистического сравнения контуров отолитов самцов и самок использовали T 2-критерий Хотеллинга в программе PAST 2.17 (Hammer et al., 2001). Данный критерий предполагает нормальное распределение переменных, поэтому дескрипторы Фурье с распределением значений, отличающимся от нормального (критерий Д'Агостино–Пирсона), не использовали для анализа; сравнение проводили по 23 дескрипторам.
РЕЗУЛЬТАТЫ
Размерный состав. Среди 149 отловленных рыб 62 особи были самцами, а 85 особей самками; у двух ювенильных рыб TL 82 и 97 мм определить пол не удалось. Минимальный размер (TL 80 мм, W 8.6 г) имела самка с гонадами II стадии зрелости, а максимальный размер (TL 173 мм, W 101 г) определен у самца с гонадами V стадии зрелости. Соотношение между SL и TL может быть аппроксимировано следующим уравнением: SL = 0.7864TL + + 2.3615 (R2 = 0.95).
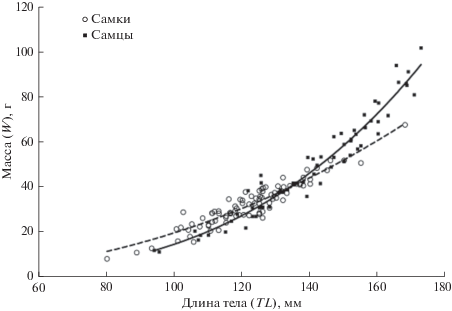
По внешним признакам половой диморфизм не прослеживался, но зависимость TL–W у самцов и самок различалась; особи наибольшего размера были представлены преимущественно самцами (рис. 1). Эти различия статистически значимы: в логарифмических координатах коэффициент b линейного уравнения LN(W) = bLN(TL) + LN(a), характеризующий наклон прямой, различался у рыб разных полов (F = 25.7, p < 0.001). Различие между полами сохранялось и при анализе зависимости TL–w в логарифмических координатах (F = 29.9, p < 0.001), следовательно, оно не связано с особенностями созревания яичников или семенников.
Рис. 1.
Соотношение массы (W) и длины тела (TL) у самок (W = 0.0003838TL2.359, R2 = 0.883, n = 85) и самцов (W = = 0.000002966TL3.353, R2 = 0.945, n = 62) Dendrochirus zebra.
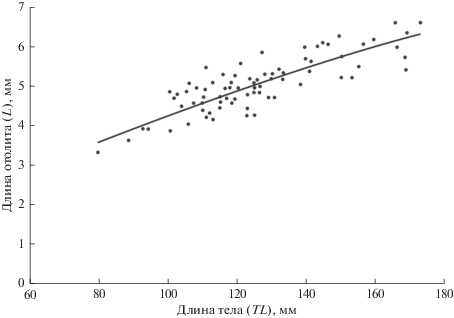
Рост и форма отолитов. Линейный рост отолитов, аппроксимированный степенной зависимостью, характеризовался отрицательной аллометрией по отношению к TL. В логарифмических координатах линейные уравнения LN(L) = cLN(TL) + d у самок и самцов не различались по коэффициентам c (F = 0.1, p = 0.737) и d (F = 3.0, p = 0.088). Поэтому данные по росту отолитов могут быть объединены для особей обоих полов (рис. 2). Коэффициенты линейных уравнений (в логарифмических координатах), характеризующих зависимость ширины, площади и периметра отолита от TL, также статистически значимо не различались у самок и самцов.
Рис. 2.
Соотношение длины правого отолита (L) и длины тела (TL) у Dendrochirus zebra (L = 0.1471TL0.7306, R2 = 0.735, n = 72).
Для сравнения формы отолитов у рыб разных полов анализировали отолиты особей TL от 93 до 151 мм. Статистически значимая регрессия между значениями каждого из шести индексов формы отолита и TL отсутствовала (p > 0.100). Самки значимо отличались от самцов по трем индексам формы отолитов (P/A, FF, RE) из шести (табл. 1). Многофакторный анализ дескрипторов Фурье свидетельствовал о том, что контуры отолитов самок и самцов значимо различались (T 2-критерий Хотеллинга: T 2 = 113.3, F = 3.06, p < 0.001).
Таблица 1.
Индексы формы правого отолита самок (n = 44) и самцов (n = 16) Dendrochirus zebra TL 93–151 мм
| Индекс | Самка | Самец | p | ||||
|---|---|---|---|---|---|---|---|
| min–max | M | δ | min–max | M | δ | ||
| L/l | 1.79–2.31 | 2.06 | 0.11 | 1.91–2.24 | 2.05 | 0.10 | 0.9506* |
| P/A | 18.15–22.95 | 20.10 | 1.00 | 19.56–22.59 | 21.02 | 0.89 | 0.0004** |
| FF | 0.55–0.69 | 0.63 | 0.03 | 0.56–0.64 | 0.60 | 0.035 | 0.0004** |
| RO | 0.28–0.53 | 0.42 | 0.04 | 0.37–0.45 | 0.42 | 0.02 | 0.6194** |
| RE | 0.47–0.76 | 0.68 | 0.04 | 0.64–0.71 | 0.67 | 0.02 | 0.0174** |
| EL | 0.28–0.40 | 0.35 | 0.02 | 0.31–0.38 | 0.34 | 0.02 | 0.9505* |
Примечание. Обозначения индексов: L/l – отношение длины к ширине, P/A – отношение квадрата периметра к площади, FF – фактор формы, RO – округлость, RE – прямоугольность, EL – эллиптичность; min–max – пределы варьирования, M – среднее значение, δ – среднее квадратическое отклонение, p – значение уровня значимости при сравнении индексов самцов и самок по критерию Стьюдента (*) и критерию Манна−Уитни (**). Значения p, свидетельствующие о статистически значимых различиях между самцами и самками, выделены полужирным шрифтом.
Cтроение внутренних органов и половое созревание. В брюшной полости рыбы находится объемный плавательный пузырь конусовидной формы (рис. 3а, б). У самца TL 165 мм длина плавательного пузыря достигала 53 мм. Задняя суженная часть плавательного пузыря составляющая около 1/6 его длины, отделена перетяжкой от его остальной части. Внешняя (extrinsic) мускулатура плавательного пузыря представлена левой и правой мышцами, отходящими от затылочной порции мускулатуры черепа, – тип мускулатуры, близкий к типу II у рыб рода Sebastes (см.: Hallacher, 1974). В передней части плавательного пузыря каждая мышца переходит в сухожилие, которое проходит вдоль плавательного пузыря и прикрепляется к его перетяжке.
Рис. 3.
Внутреннее строение Dendrochirus zebra. а – самец, TL 154 мм, семенники на стадии зрелости V; б – самка, TL 108 мм, яичники на стадии зрелости III. 1 – плавательный пузырь, 2 – кишечник, 3 – семенники, 4 – семяпроводы, 5 – мочевой пузырь, 6 – яичники. Масштаб 10 мм.
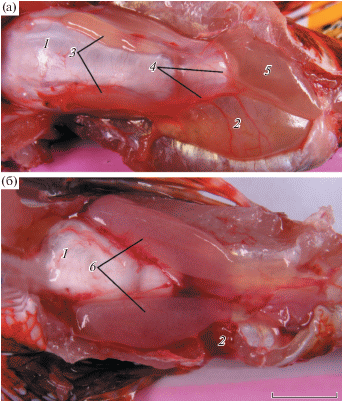
У самцов семенники располагаются на поверхности плавательного пузыря, а удлиненные семяпроводы переходят на дорсальную поверхность мочевого пузыря и лежат вдоль этого органа, сливаясь, очевидно, непосредственно перед половым отверстием. У одного из самцов задняя часть кишечника была значительно расширена (рис. 3а). Гонадосоматический индекс у четырех неполовозрелых самцов TL 94–122 мм c гонадами II стадии зрелости составлял менее 0.01%; значения ГСИ у остальных самцов TL 106–173 мм (n = 57) колебались от 0.02 до 0.73%. В семяпроводах подавляющего большинства этих самцов обнаружены зрелые сперматозоиды. Таким образом, их семенники находились преимущественно на IV или IV–V стадиях зрелости. Единичные самцы, несмотря на развитые семенники, характеризовались менее продвинутыми стадиями зрелости, например, у самца TL 125 мм (ГСИ = 0.08%) обнаружены гонады II–III стадии зрелости.
Длина мочевого пузыря была наименьшей у неполовозрелых самцов (рис. 4). У самцов TL менее 140 мм размер мочевого пузыря не отличался от такового у самок. По мере роста самцов наблюдалась положительная аллометрия между длиной мочевого пузыря и длиной тела. В жидкости мочевого пузыря половозрелых самцов обнаружены зрелые сперматозоиды. У самцов с гонадами IV–V и V стадий зрелости объем мочевого пузыря составлял 0.134–3.066 мл, концентрация сперматозоидов в нем достигала 0.202 × 109 сп/мл (табл. 2).
Рис. 4.
Соотношение длины мочевого пузыря (K) и длины тела (TL) у Dendrochirus zebra. 1 – самки; 2 – самцы с гонадами на стадиях зрелости II и II–III; 3 – самцы с гонадами на стадиях зрелости IV–V и V. Линией аппроксимирована зависимость для самцов: K = 0.00005282TL2.505, R2 = 0.465, n = 17.
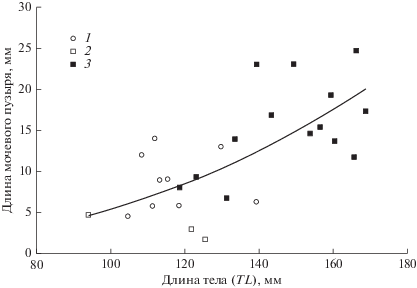
Таблица 2.
Некоторые параметры самцов Dendrochirus zebra (n = 11) с гонадами IV–V и V стадий зрелости
| Параметр | Min | Max | M |
|---|---|---|---|
| TL, мм | 118 | 169 | 153 |
| ГСИ, % | 0.036 | 0.143 | 0.063 |
| Объем мочевого пузыря, мл | 0.134 | 3.066 | 1.251 |
| Концентрация сперматозоидов в мочевом пузыре, сп/мл × 109 | 0.015 | 0.202 | 0.045 |
Примечание. Обозначения, как в табл. 1.
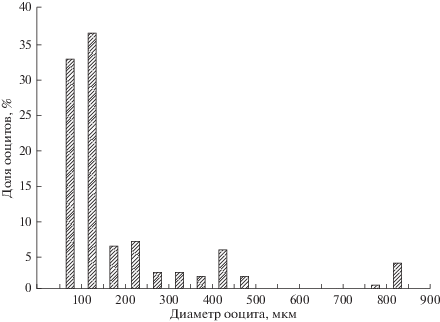
Яичники у самок парные, удлиненные и полностью обособленные на всем протяжении, яйцеводы сливаются лишь непосредственно перед половым отверстием (рис. 3б). Самки впервые достигают половой зрелости при минимальной TL около 105 мм. При достижении длины 113 мм 50% самок становятся половозрелыми (рис. 5). При TL более 145 мм половозрелыми являются все самки. Только у пяти самок (5.9%) с гонадами IV–V стадии зрелости значения ГСИ были выше 8%. В яичниках таких самок присутствовали ооциты периодов превителлогенеза, вителлогенеза и созревания (рис. 6). Непосредственно перед овуляцией ооциты, готовые к вымету, сильно оводняются, их диаметр значительно увеличивается.
Рис. 6.
Распределение ооцитов по диаметру у самки Dendrochirus zebra TL 134 мм на IV–V стадии зрелости (n = 163).
Плодовитость пяти самок TL 130–150 мм, подсчитанная по числу ооцитов, предназначенных для текущего икрометания, составила 1751–10 414 (в среднем 5248) ооцитов.
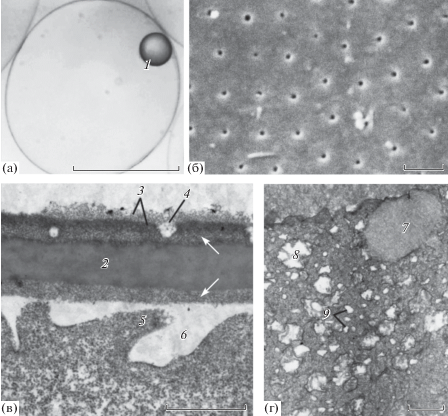
Морфология овулировавшего ооцита и ультра-структура оболочки. Диаметр овулировавшего ооцита в среднем составлял 805 мкм, диаметр жировой капли – 157 мкм (рис. 7а). Поверхность ооцита гладкая, равномерно прободена округлыми порами, образовавшимися после сокращения микро- и макроворсинок в процессе завершающих фаз созревания (рис. 7б). Диаметр пор варьировал от 0.07 до 0.25 мкм (среднее ± среднее квадратическое отклонение – 0.14 ± 0.041 мкм; n = 80). Расстояние между порами составляло 0.56–1.89 мкм (0.99 ± 0.055 мкм; n = 68). Лучистая оболочка (zona radiatа) толщиной 0.6–0.9 мкм состояла из трех слоев и была представлена веществом средней электронной плотности (рис. 7в). Широкий средний слой оболочки имел гомогенную структуру; с внутренней и наружной части к нему прилегали два более узких рыхлых слоя. Над наружным рыхлым слоем был заметен слабо выраженный хорион (шириной около 0.2 мкм), представленный более электронно-плотным веществом с отходящими от него волоконцами. Во внешней части оболочки были видны остатки канальцев, в которых до овуляции располагались микро- и макроворсинки. В цитоплазматическом слое ооцита локализованы многочисленные округлые митохондрии со светлым матриксом, везикулы агранулярной эндоплазматической сети и единичные кортикальные альвеолы (рис. 7г).
Рис. 7.
Морфология овулировавшего ооцита Dendrochirus zebra. а – общий вид ооцита сбоку; б – поверхность овулировавшего ооцита; в, г– фрагменты яйцевых оболочек и цитоплазмы. Обозначения: 1 – жировая капля, 2 – zona radiata (наиболее широкий гомогенный слой), 3 – хорион, 4 – остаток канальца, 5 – фрагмент сократившейся микроворсинки, 6 – периооцитное пространство, 7 – кортикальная альвеола, 8 – митохондрия, 9 – везикулы агранулярной эндоплазматической сети. Стрелками обозначены более рыхлые слои zona radiata. Масштаб: а – 500 мкм, б–г – 1 мкм.
ОБСУЖДЕНИЕ
В зал. Нячанг самцы Dendrochirus zebra крупнее самок. Больший размер самцов по сравнению с самками отмечен также у о-ва Миякедзима, но выраженный половой диморфизм отсутствует: самки могут быть идентифицированы только непосредственно перед нерестом по брачной окраске (Moyer, Zaiser, 1981). Разное соотношение TL–W у самцов и самок, очевидно, обусловлено более высоким темпом роста самцов. Это предположение подтверждается разной формой сагитты у самцов и самок. Как известно, форма отолита определяется как генетической компонентой, так и параметрами среды, причем различия в темпе роста особей и скорости роста их отолитов существенно влияют на форму отолита (Campana, Casselman, 1993). Наши уловы и проведенные ранее подводные наблюдения (Moyer, Zaiser, 1981) свидетельствуют о том, что самцы и самки D. zebra обитают совместно, поэтому выявленные различия в форме отолитов могут быть связаны только с разным темпом роста. Следует отметить, что морфология сагитты D. zebra подробно не описана. Рисунок сагитты особи TL 127 мм приведен в Атласе отолитов рыб Тайваня (Lin, Chang, 2012) и в базе данных AFORO (Lombarte et al., 2006). Нами отмечена отрицательная аллометрия линейного роста сагитты по отношению к TL, что характерно для многих видов костистых рыб.
У самок D. zebra, как и у других представителей семейства Scorpaenidae, а также у видов рода Helicolenus (Sebastidae), яичник с центральным расположением стромы (cystovarian type II-3) (Koya, Muñoz, 2007; Muñoz, 2010; Павлов, Емельянова, 2013). Гистологическое строение яичников D. brachypterus и D. zebra описано ранее (Fishelson, 1978; Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2013).
По наблюдениям за поведением D. brachypterus в аквариуме, у самки непосредственно перед икрометанием расширяется генитальная пора. После периода ухаживания самка выметывает заключенные в желеобразную массу яйца, которые, формируя один или два слоя, образуют две полые трубочки, плавающие у поверхности воды. Сперма попадает во внутренний объем трубочки, и сперматозоиды легко проникают к ооцитам через тонкий слой желеобразной массы. Через 15–20 мин трубочки заполняются водой и превращаются в овальные прозрачные кладки диаметром 2.0–5.0 см. Число яиц в кладках самок разного размера составляет от 2 до 15 тыс. (n = 70) (Fishelson, 1975). Предполагается, что у рыб подсемейства Pteroinae сперматозоиды удерживаются внутри кладки, вследствие чего повышается эффективность оплодотворения (Morris et al., 2011). Такое же нерестовое поведение описано у D. zebra в природе. Показано, что кладки этого вида содержат детерренты, отпугивающие хищников, и спустя 12 ч после икрометания распадаются на отдельные икринки. Кладки самок TL 100 и 140 мм состояли, соответственно, из 2200 и 6000 яиц (Moyer, Zaiser, 1981). По нашим данным, порционная плодовитость D. zebra колеблется в широких пределах и, очевидно, слабо связана с размером самки.
Возможная роль гипертрофированного мочевого пузыря самцов в оплодотворении ооцитов скорпеновидных рыб с внешним осеменением неоднократно обсуждалась (Павлов, Емельянова, 2007, 2013; Pavlov, Emel’yanova, 2010), но все еще остается неясной. Концентрация сперматозоидов в мочевом пузыре D. zebra (табл. 2) близка к таковой в эякуляте рыб с внутренним осеменением. Например, у зубатки Anarhichas lupus (Perciformes: Anarhichadidae) концентрация спермы варьирует от 0.007 × 109 до 0.437 × 109 сп/мл (Pavlov, Moksness, 1994). Остается непонятным путь проникновения сперматозоидов в мочевой пузырь. Несмотря на то, что семяпроводы лежат на поверхности мочевого пузыря, связь между этими органами не прослеживается. В мочеполовую папиллу открываются мочевая и половая поры (наши данные), что соответствует описанию мочеполовой системы у Sebastodes paucispinis (см.: Moser, 1967).
Самки D. zebra с ГСИ, превышающим 8%, и яичниками IV–V стадии зрелости с ооцитами диаметром более 750 мкм встречались редко. Очевидно, это связано с тем, что гидратация ооцитов и переход к овуляции осуществляются очень быстро, возможно, на протяжении нескольких часов. Распределение ооцитов по диаметру свидетельствует о непрерывном типе оогенеза и многопорционном икрометании (Götting, 1961; Овен, 2004). При содержании D. brachypterus в аквариуме каждая самка выметывала две кладки с периодичностью 6–8 сут на протяжении восьми месяцев (Fishelson, 1975).
Овулировавший ооцит D. zebra по диаметру близок к ооцитам у представителей подсемейства Scorpaeninae с внешним осеменением: Scorpaenopsis possi, Sebastapistes cyanostigma (см.: Павлов, Емельянова, 2007) и Scorpaena miostoma (см.: Kimura et al., 1989), но, в отличие от ооцитов этих видов, имеет жировую каплю. Присутствие жировой капли отмечено также в овулировавших ооцитах P. miles и P. volitans и, очевидно, свойственно всем видам подсемейства Pteroinae. Основные особенности ооцитов D. zebra, а также S. possi, S. cyanostigma (Павлов, Емельянова, 2007) и видов рода Scorpaena (Orton, 1955; Kimura et al., 1989; Muñoz et al., 2002a) заключаются в наличии чрезвычайно тонких оболочек (у первых трех видов соответственно 1.0, 1.4 и 0.7 мкм) и в малом количестве кортикальных альвеол (в связи с чем яйца после кортикальной реакции практически не набухают). По нашим данным, диаметр пор на поверхности овулировавшего ооцита D. zebra и расстояние между ними (в среднем 0.14 и 0.99 мкм) близки к таковым у S. cyanostigma – в среднем соответственно 0.16 и 1.0 мкм. Овулировавшие ооциты S. possi и S. сyanostigma имеют однослойную zona radiata, состоящую из гомогенного вещества с чередующимися продольными полосками (ламеллами), различающимися по электронной плотности (Павлов, Емельянова, 2007). В отличие от них zona radiata ооцитов D. zebra включает три слоя. У вида Helicolenus dactylopterus (Scorpaeniformes: Sebastidae) с внутренним оплодотворением и развитием яиц во внешней среде zona radiata ооцитов на стадии миграции ядра к анимальному полюсу также состоит из трех слоев и имеет толщину около 4 мкм (Muñoz et al., 2002b). Перед овуляцией zona radiata может утончаться, а ее слои могут сливаться, как, например, при развитии ооцитов у белоротого крокера Micropogonias furnieri (Perciformes: Sciaenidae) (Berois et al., 2011). Тонкие (около 2 мкм) однослойные лучистые оболочки при наличии слабо выраженного хориона свойственны и другим видам рыб с пелагической икрой, в частности, представителям семейства Mullidae (Емельянова, Павлов, 2012, 2014). У некоторых морских рыб, выметывающих пелагические яйца, zona radiata овулировавших ооцитов состоит из двух слоев (Прохорчик и др., 1988; Muñoz et al., 2001; Fausto et al., 2004; Emel’yanova, Pavlov, 2012). Очевидно, особенности микроструктуры яйцевых оболочек, в том числе расположение пор на поверхности ооцита, могут быть использованы в качестве систематических признаков для пелагических яиц морских рыб (Микодина, 1987; Li et al., 2000; Иванков, 2001; Микодина, Пукова, 2001; Овен, 2004).
Молекулярный анализ свидетельствует о том, что выделение родов Dendrochirus и Pterois не является оправданным: входящие в них виды близки между собой (Kochzius et al., 2003). Поэтому представляет интерес сравнение биологических особенностей D. zebra и видов рода Pterois, жизненный цикл которых достаточно полно исследован в связи с инвазией и последующей акклиматизацией в новых биотопах. Структура яичников у P. miles и P. volitans не различается (Morris et al., 2011) и очень близка к таковой у D. brachypterus (см.: Fishelson, 1978) и D. zebra (Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2013). Виды P. miles и P. volitans размножаются на протяжении всего года, оогенез непрерывный и асинхронный, а частота икрометания во время наиболее интенсивного размножения составляет 2–4 сут (Morris, 2009; Morris et al., 2011; Gardner et al., 2015). Число гидратированных ооцитов в яичнике самок TL 204–332 мм колеблется от 1800 до 41 945 (Gardner et al., 2015). Диаметры овулировавшего ооцита и жировой капли в среднем составляют соответственно 804 и 160 мкм (Morris et al., 2011) и практически не отличаются от таковых у D. zebra. Особи P. miles и P. volitans достигают большего размера, чем таковые D. zebra: максимальная TL самца P. volitans составляет 380 мм (Randall et al., 1990). Как показала основанная на данных по мечению рыб оценка роста P. volitans с помощью модели Берталанфи, в Атлантике рыбы растут быстрее, чем в Индовестпацифике. Так, TL около 20 см они достигают менее чем за один год, а в естественном ареале – за два года (Pusack et al., 2016). У о-ва Малый Кайман (Карибское море) возраст самцов и самок (преимущественно P. volitans), определенный по годовым приростам на отолитах, составлял соответственно от 0 до 5 и от 0 до 3 лет. Траектории роста самцов и самок различались. В возрасте трех лет TL самцов и самок составляла соответственно около 300 и 200 мм. Самцы достигали максимальной асимптотической длины в 1.5 раза медленнее, чем самки (Edwards et al., 2014). Подобный половой диморфизм в темпе роста и продолжительности жизни самцов и самок, очевидно, свойственен и D. zebra. Таким образом, промысел, обычно направленный на изъятие наиболее крупных особей, представленных самцами, по-видимому, не наносит существенного вреда популяции D. zebra, как и популяциям видов рода Pterois. У о-ва Малый Кайман длина тела P. miles/P. volitans, при которой 50% самок становятся половозрелыми (TL50), составляла 189–190 мм (Gardner et al., 2015), а в прибрежной зоне Северной и Южной Каролины и Багамских островов TL50 самцов и самок составляет соответственно около 100 и 175 мм (Morris, 2009). Самки D. zebra становятся половозрелыми при меньшей длине (TL50 = 113 мм) в возрасте, который, как и у видов рода Pterois, по-видимому, не превышает двух лет.
Выражаем признательность Во Тхи Ха и Динь Тхи Хай Йен (Приморское отделение Российско-Вьетнамского тропического научно-исследовательского и технологического центра) за помощь в сборе и обработке материала.
Исследования профинансированы Российско-Вьетнамским тропическим центром.
Список литературы
Емельянова Н.Г., Павлов Д.А. Ультраструктура гамет некоторых видов семейства Mullidae Южно-Китайского моря // Вопр. ихтиологии. 2012. Т. 52. № 6. С. 701–707.
Емельянова Н.Г., Павлов Д.А. Ультраструктура гамет двух видов рода Upeneus (Mullidae) Южно-Китайского моря // Вопр. ихтиологии. 2014. Т. 54. № 3. С. 352–358.
Иванков В.Н. Репродуктивная биология рыб. Владивосток: Изд-во Дальневост. гос. ун-та. ДВГУ. 2001. 223 с.
Микодина Е.В. О структуре поверхности оболочек икринок костистых рыб // Вопр. ихтиологии. 1987. Т. 27. Вып. 1. С. 106–113.
Микодина Е.В., Пукова Н.В. Ихтиопланктон Антарктики // Вопр. рыболовства. Приложение 1. 2001. № 1. С. 164–170.
Овен Л.С. Специфика развития половых клеток морских рыб в период размножения как показатель типа нереста и реакции на условия среды обитания. М.: Изд-во ВНИРО. 2004. 186 с.
Павлов Д.А. Дифференциация трех видов рода Upeneus (Mullidae) по форме отолитов // Вопр. ихтиологии. 2016. Т. 55. № 1. С. 41–55.
Павлов Д.А., Емельянова Н.Г. Особенности биологии размножения двух видов тропических рыб семейства Scorpaenidae // Вопр. ихтиологии. 2007. Т. 47. № 3. С. 347–360.
Павлов Д.А., Емельянова Н.Г. Переход к живорождению в отряде Scorpaeniformes: краткий обзор // Вопр. ихтиологии. 2013. Т. 53. № 1. С. 69–86.
Павлов Д.А., Емельянова Н.Г. Сравнительный анализ морфологии сперматозоидов у трех видов рыб подотряда Scorpaenoidei // Вопр. ихтиологии. 2018. Т. 58. № 2. С. 226–238.
Прохорчик Г.А., Петухов В.Б., Емельянова Н.Г., Макеева А.П. Ультраструктура овулировавших ооцитов европейского угря Anguilla anguilla // Вопр. ихтиологии. 1988. Т. 28. Вып. 6. С. 933–939.
Уикли Б. Электронная микроскопия для начинающих. М.: Мир. 1975. 324 с.
Allen G.R., Steene R.C. Fishes of Christmas Island, Indian Ocean. Christmas Island, Australia: Christmas Isl. Nat. Hist. Assoc. 1988. 197 p.
Berois N., Arezo M.J., Papa N.G. Gamete interactions in teleost fish: the egg envelope. Basic studies and perspectives as environmental biomonitor // Biol. Res. 2011. V. 44. P. 119–124.
Campana S.E., Casselman J.M. Stock discrimination using otolith shape analysis // Can. J. Fish. Aquat. Sci. 1993. V. 50. P. 1062–1083.
Edwards M.A., Frazer T.K., Jacoby C.A. Age and growth of invasive lionfish (Pterois spp.) in the Caribbean Sea, with implications for management // Bull. Mar. Sci. 2014. V. 90. P. 953–966.
Emel’yanova N.G., Pavlov D.A. From oocyte to larva: hormonal induction of oocyte maturation and initial development of coral reef fishes. Moscow: KMK Sci. Press. 2012. 170 p.
Fausto A.M., Picchietti S., Taddei A.R. et al. Formation of the egg envelope of a teleost, Dicentrarchus labrax (L.): immunochemical and cytochemical detection of multiple components // Anat. Embryol. 2004. V. 208. P. 43–53.
Farquhar S.D. Back to the source: lionfish imported into the United States via the ornamental aquarium trade // J. Environ. Ecol. 2017. V. 8. № 2. P. 23–31.
Fishelson L. Ethology and reproduction of pteroid fishes found in the Gulf of Aqaba (Red Sea), especially Dendrochirus brachypterus (Cuvier), (Pteroidae, Teleostei) // Pubbl. Stn. Zool. Napoli. 1975. V. 39. P. 635–656.
Fishelson L. Oogenesis and spawn-formation in the pigmy lion fish Dendrochirus brachypterus (Pteroidae) // Mar. Biol. 1978. V. 46. P. 341–348.
FishBase. World Wide Web electronic publication. 2018. www.fishbase.org, version (10/2018).
Gardner P.G., Frazer T.K., Jacoby C.A., Yanong R.P.E. Reproductive biology of invasive lionfish (Pterois spp.) // Front. Mar. Sci. 2015. V. 2. № 7. P. 1–10.
Götting K.J. Beiträge zur Kenntnis der Grundlagen der Fortpflanzung und zur Fruchtbarkeitsbestimmung bei marinen Teleosteern // Helgol. Wiss. Meeresunters. 1961. Bd. 8. № 1. S. 1–41.
Hallacher L.E. The comparative morphology of the extrinsic gasbladder musculature in the scorpionfish genus Sebastes (Pisces: Scorpaeniformes) // Proc. Calif. Acad. Sci. 1974. V. 15. P. 59–84.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: paleontological statistics software package for education and data analysis // Palaeontol. Electron. 2001. V. 4. № 1. P. 1–9.
Iwata H., Ukai Y. SHAPE: a computer program package for quantitative evaluation of biological shapes based on elliptic Fourier descriptors // J. Hered. 2002. V. 93. P. 384–385.
Kimura S., Tsukamoto Y., Mori K. Early developmental stages of the scorpaenid fish, Scorpaena miostoma, reared in the laboratory // Jpn. J. Ichthyol. 1989. V. 35. P. 434–439.
Kletou D., Hall-Spencer J.M., Kleitou P. A lionfish (Pterois miles) invasion has begun in the Mediterranean Sea // Mar. Biodiversity Rec. 2016. V. 9. № 46. P. 1–7. DOI https://doi.org/10.1186/s41200-016-0065-y
Kochzius M., Söller R., Khalaf M.A., Blohm D. Molecular phylogeny of the lionfish genera Dendrochirus and Pterois (Scorpaenidae, Pteroinae) based on mitochondrial DNA sequences // Mol. Phylog. Evol. 2003. V. 28. P. 396–403.
Koya Y., Muñoz M. Comparative study on ovarian structures in scorpaenids: possible evolutional process of reproductive mode // Ichthyol. Res. 2007. V. 54. P. 221–230.
Kuhl F.P., Giardina C.R. Elliptic Fourier features of a closed contour // Comput. Graphics Image Process. 1982. V. 18. P. 236–258.
Li Y.H., Wu C.C., Yang J.S. Comparative ultrastructural studies of the zona radiata of marine fish eggs in three genera in Perciformes // J. Fish Biol. 2000. V. 56. P. 615–621.
Lin C.-H., Chang C.-W. Otolith atlas of Taiwan fishes. Pingtung, Taiwan: Natl. Mus. Mar. Biol. Aquarium. 2012. 413 p.
Lombarte A., Chic Ò., Parisi-Baradad V. et al. A web-based environment from shape analysis of fish otoliths. The AFORO database // Sci. Mar. 2006. V. 70. P. 147–152.
Morris J.A. Jr. The biology and ecology of the invasive Indo-Pacific lionfish. PhD Diss. Raleigh, N.C.: N. C. State Univ. 2009. 168 p.
Morris J.A. Jr., Akins J.L., Barse A. et al. Biology and ecology of the invasive lionfishes, Pterois miles and Pterois volitans // Proc. 61st Gulf Caribb. Fish. Inst. 2009. P. 409–414.
Morris J.A. Jr., Sullivan C.V., Govoni J.J. Oogenesis and spawn formation in the invasive lionfish, Pterois miles and Pterois volitans // Sci. Mar. 2011. V. 75. P. 147–154.
Moser H.G. Reproduction and development of Sebastodes paucispinis and comparison with other rockfishes off Southern California // Copeia. 1967. № 4. P. 773–797.
Moyer J.T., Zaiser M.J. Social organization and spawning behavior of the pteroine fish Dendrochirus zebra at Miyake-jima, Japan // Jpn. J. Ichthyol. 1981. V. 28. P. 52–69.
Muñoz M. Reproduction in Scorpaeniformes // Reproduction and sexuality in marine fishes: patterns and processes / Ed. K.S. Cole. Berkeley, Calif.: Univ. of Calif. Press. 2010. P. 65–87.
Muñoz M., Casadevall M., Bonet S. Gonadal structure and gametogenesis of Aspitrigla obscura (Pisces, Triglidae) // Ital. J. Zool. 2001. V. 68. № 1. P. 39–46.
Muñoz M., Casadevall M., Bonet S. The ovarian morphology of Scorpaena notata shows a specialized mode of oviparity // J. Fish Biol. 2002a. V. 61. P. 877–887.
Muñoz M., Casadevall M., Bonet S. Gametogenesis of Helicolenus dactylopterus dactylopterus (Teleostei, Scorpaenidae) // Sarsia. 2002b. V. 87. P. 119–127.
Myers R.F. Micronesian reef fishes: a practical guide to the identification of the coral reef fishes of the tropical central and western Pacific. Second ed. Barrigada, Guam: Coral Graphics. 1991. 298 p.
Orton G.L. Early developmental stages of the California scorpionfish, Scorpaena guttata // Copeia. 1955. № 3. P. 210–214.
Pavlov D.A., Emel’yanova N.G. Reproductive biology of species from the family Scorpaenidae and transition from oviparity to viviparity in the southern and northern Percomorpha // Viviparous fishes II / Eds M.C. Uribe, H.J. Grier. Homestead, Fla.: New Life Publ. 2010. P. 89–105.
Pavlov D.A., Moksness E. Reproductive biology, early ontogeny, and effect of temperature on development in wolffish: comparison with salmon // Aquacult. Int. 1994. V. 2. P. 133–153.
Poss S.G. Scorpionfishes (also, lionfishes, rockfishes, stingfishes, stonefishes, and waspfishes) // FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. V. 4. Bony fishes part 2 (Mugilidae to Carangidae) / Eds K.E. Carpenter, V.H. Niem. Rome: FAO. 1999. P. 2291–2352.
Pusack T.J., Benkwitt C.E., Cure K., Kindinger T.L. Invasive Red Lionfish (Pterois volitans) grow faster in the Atlantic Ocean than in their native Pacific range // Environ. Biol. Fishes. 2016. V. 99. P. 571–579.
Randall J.E., Allen G.R., Steene R.C. Fishes of the Great Barrier Reef and Coral Sea. Honolulu, Hawaii: Univ. of Hawaii Press. 1990. 506 p.
Rocha L.A., Rocha C.R., Baldwin C.C. et al. Invasive lionfish preying on critically endangered reef fish // Coral Reefs. 2015. V. 34. P. 803–806.
Secor D.H., Dean J.M., Laban E.H. Manual for otolith removal and preparation for microstructural examination. Columbia, S.C.: Electr. Power Res. Inst. 1991. 87 p.
Sparre P., Venema C.S. Introduction to tropical fish stock assessment. Part. I: Manual // FAO Fish. Tech. Pap. 1998. № 306/1.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря