Биология моря, 2019, T. 45, № 2, стр. 86-96
Грибы в донных грунтах Чукотского моря
Е. Н. Бубнова 1, *, О. П. Коновалова 1
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: katya.bubnova@wsbs-msu.ru
Поступила в редакцию 24.02.2018
После доработки 21.06.2018
Принята к публикации 18.10.2018
Аннотация
Впервые определена численность и изучено таксономическое разнообразие микобиоты в донных грунтах Чукотского моря. В ходе работ по программе “RUSALCA-2012” в конце августа–начале сентября 2012 г. с глубины 44–110 м были отобраны 22 образца грунта. Грибы из образцов выделяли в чистую культуру на агаризованные питательные среды (соленость – 35‰, температура – 6°С). Виды идентифицировали с помощью морфолого-культуральных и молекулярно-генетических методов на основе нуклеотидных последовательностей ITS1-ITS2 рДНК. Всего выделено 128 колоний мицелиальных грибов; из каждого образца объемом 1 см3 получено от 0 до 22 колоний. Общее морфологическое разнообразие составило 48 морфотипов, относящихся к 32 родам из 15 порядков аскомицетов и базидиомицетов. Аскомицеты преобладали как по численности, так и по разнообразию. Многие выделенные виды обнаружены в морских экосистемах впервые. Применение молекулярных методов позволило установить таксономическое положение стерильных изолятов, доля которых составила 13%. Среди них высоким разнообразием отличались порядки Pleosporales и Helotiales из аскомицетов.
В последнее время морская микология довольно активно и быстро развивается, но грибам арктических морей до сих пор уделяется мало внимания. С середины 19 века опубликовано немногим более 30 работ, в которых приведены результаты изучения грибов в морях Северного Ледовитого океана (Rämä et al., 2017). Исследования проводились в основном в европейском секторе Арктики. Для прибрежных морей Сибири известны лишь три работы: в одной опубликованы сведения о грибах в воде арктических морей, в том числе Карского и Лаптевых (Кирцидели и др., 2012), а в двух других – в донных грунтах отдельных районов Баренцева и Карского морей (Bubnova, 2010; Бубнова, Никитин, 2017). Культивируемая микобиота грунтов арктических морей обладает рядом характерных черт: низкой численностью грибных пропагул, большой долей неспороносящих культур, а также видов из родов Tolypocladium, Penicillium и Cladosporium (Bubnova, 2010; Бубнова, Никитин, 2017; Rämä et al., 2017). Доля стерильных изолятов таксономическое положение которых нельзя установить обычными морфолого-культуральными методами, может достигать 30–40%. Для их идентификации необходим молекулярно-генетический анализ, который в работах по исследованию разнообразия микобиоты в донных грунтах арктических морей не использовался.
Цель настоящей работы – изучение разнообразия микобиоты в донных грунтах не исследованного ранее Чукотского моря с применением морфолого-культурального и молекулярно-генетического методов идентификации.
МАТЕРИАЛ И МЕТОДИКА
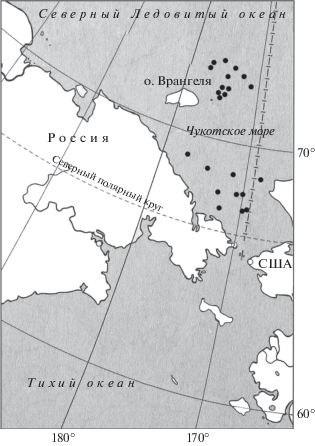
Материалом для исследования послужили 22 образца донных грунтов, отобранных с 30 августа по 13 сентября 2012 г. в Чукотском море в ходе рейса судна “Профессор Хромов” по программе “RUSALCA-2012” (рис. 1). Образцы отбирали на глубине от 44 до 110 м в двух районах: к северо-востоку от островов Врангеля и Геральд, а также в южной части моря ближе к Берингову проливу. Изученные грунты были представлены илами. Чукотское море характеризуется суровостью условий, относительно небольшим пресным стоком и заметным влиянием двух океанов – Северного Ледовитого и Тихого (Зенкевич, 1963; Marchenko, 2012).
Образцы для исследования отбирали из верхнего односантиметрового слоя донного грунта. Стерильным шприцем 3 раза брали по 1 см3 грунта, который помещали в стерильный бумажный пакет; пакеты с образцами подсушивали при комнатной температуре. Посев проводили через 60 сут после заключительного отбора. Для выделения грибов весь грунт в образце перемешивали, затем высевали по 1 см3 грунта от каждого образца. Посевы проводили по методу Варкупа (Carlile et al., 2001) на среду сусло–агар (общее содержание сахаров – 0.2%, соленость – 35‰, ампициллин – 1 г/л). Образцы 2 мес. инкубировали при температуре 6°С, после этого выделяли чистые культуры.
Первоначальную идентификацию проводили по морфолого-культуральным признакам в чистой культуре (Carlile et al., 2001). Кроме идентифицированных таким образом культур в исследованных образцах довольно многочисленными были стерильные и не подходящие под описания известных видов морфотипы.
Для молекулярно-генетического анализа использованы представители всех неидентифицированных по морфолого-культуральным признакам морфотипов. Образцы ДНК выделяли из 40 чистых культур с помощью набора Diatom Pro (Isogen, Moscow). Полимеразную цепную реакцию области ITS1-5.8S-ITS2 проводили с использованием набора ScreenMix (Evrogen, Москва), а также праймеров ITS1-F и ITS4 (http://lutzonilab.org/nuclear-ribosomal-dna/) на термоцикле Verity thermocycler (Applied Biosystems, США). Продукты амплификации секвенировали в двух направлениях по протоколу BigDye с использованием секвенатора ABI Prism 3500 (Applied Biosystems, США). Для обработки результатов секвенирования, выравнивания и построения филогенетических деревьев использовали пакет программ CodonCodAligner (www.codoncod.org). Принадлежность полученных последовательностей определяли с помощью программы BLAST (blast.ncbi.nih.gov). В GenBank депонировано 12 последовательностей ITS1-5.8S-ITS2 изолятов, идентифицированных до уровня вида; им присвоены номера с KP739870 по KP739881. Принадлежность остальных последовательностей определяли с помощью построения филогенетических деревьев: два варианта для области ITS1-ITS2, соответственно для Ascomycota и Basidiomycota, были построены с помощью MUSCLE (Edgar, 2004) со статистической поддержкой методом Neighbor-Joining (Felsenstein, 1985) в программе MEGA 6.0 (Tamura et al., 2004, 2013).
РЕЗУЛЬТАТЫ
Численность выделенных грибов
Всего было выделено 128 колоний мицелиальных грибов (табл. 1). Из одного образца получено от 0 до 22 колоний, из большинства образцов – не более 10 колоний, а из нескольких образцов – по одной колонии.
Таблица 1.
Таксономический состав выделенных грибов
| Морфологическая идентификация | Генетическая идентификация | BLAST | Количество | |
|---|---|---|---|---|
| колоний | образцов | |||
| ASCOMYCOTA | ||||
| PEZIZOMYCOTINA | ||||
| Incertae sedis | ||||
| Mycelia sterilia 14 | Slimacomyces isiolus (R.T. Moore) G.Z. Zhao | 99 | 1 | 1 |
| DOTHIDEOMYCETES | ||||
| Botryosphaeriales | ||||
| Botryosphaeriaceae | ||||
| Ascomycete gen. sp. 3 | Lasiodiplodia pseudotheobromae A.J.L. Phillips | 1 | 1 | |
| Capnodiales | ||||
| Cladosporiaceae | ||||
| Cladosporium cladosporioides (Fresen.) G.A. de Vries | 6 | 4 | ||
| C. macrocarpum Preuss | 6 | 3 | ||
| Pleosporales | ||||
| Mycelia sterilia 5 | Fungal sp. MG20Sn7L3x | 89 | 1 | 1 |
| Phoma cf. eupyrena | Uncultured fungus clone CMH252 | 100 | 1 | 1 |
| Mycelia sterilia 10 | Uncultured fungus clone S238 | 99 | 1 | 1 |
| Mycelia sterilia 11 | Uncultured fungus clone S352 | 100 | 1 | 1 |
| Mycelia sterilia 12 | Uncultured soil fungus clone RS5M5c23P | 94 | 1 | 1 |
| Didymellaceae | ||||
| Phoma sp. | Phoma herbarum Westend. | 100 | 1 | 1 |
| Lophiostomataceae | ||||
| Mycelia sterilia 9 | Lophiostoma cynaroidis Marincowitz, M.J. Wingf. & Crous | 99 | 1 | 1 |
| Pleosporaceae | ||||
| Alternaria cf. alternata | Alternaria alternata (Fr.) Keissl. | 99, 100 | 2 | 2 |
| Dothideomycetes Incertae sedis | ||||
| Pseudoperisporiaceae | ||||
| Mycelia sterilia 3 | Nematostoma parasiticum (R. Hartig) M.E. Barr | 96 | 2 | 1 |
| EUROTIOMYCETES | ||||
| Eurotiales | ||||
| Trichocomaceae | ||||
| Aspergillus flavus Link | 8 | 3 | ||
| Penicillium atramentosum Thom | 1 | 1 | ||
| P. aurantiogriseum Dierckx | 13 | 9 | ||
| P. chermesinum Biourge | 1 | 1 | ||
| P. dierckxii Biourge | 1 | 1 | ||
| P. glabrum (Wehmer) Westling | 21 | 10 | ||
| P. nalgiovense Laxa | 6 | 4 | ||
| P. thomii Maire | 1 | 1 | ||
| LEOTIOMYCETES | ||||
| Thelebolales | ||||
| Thelebolaceae | ||||
| Ascomycete gen. sp. 1 | Thelebolus microsporus (Berk. & Broome) Kimbr. | 1 | 1 | |
| Ascomycete gen. sp. 2 | Thelebolusstercoreus Tode | 98 | 1 | 1 |
| Helotiales | ||||
| Mycelia sterilia 2 | Cadophora sp. | 92 | 1 | 1 |
| Mycelia sterilia 8 | Cyathicula sp. | 94 | 2 | 1 |
| Mycelia sterilia 16 | Hymenoscyphus sp. FC-2727 | 99 | 1 | 1 |
| Mycelia sterilia 13 | Helotiales sp. WMM-2012c isolate 24m | 96 | 1 | 1 |
| Mycelia sterilia 15 | Lachnum sp. FR-F3 | 95, 96 | 5 | 2 |
| Mycelia sterilia 7 | Uncultured Lachnum clone R2_17 | 96 | 1 | 1 |
| Mycelia sterilia 4 | Helotiales sp. MU-2009-3 | 94, 97 | 1 | 1 |
| Leotiomycetes Incertae sedis | ||||
| Myxotrichaceae | ||||
| Pseudogymnoascus pannorum (Link) Minnis & D.L. Linder | 1 | 1 | ||
| Pseudeurotiaceae | ||||
| Pseudeurotium hygrophilum (Sogonov, W. Gams, Summerb. Schroers) Minnis D.L. Linder | 1 | 1 | ||
| SORDARIOMYCETES | ||||
| Coniochaetales | ||||
| Coniochaetaceae | ||||
| Anamorphic gen. sp. 2 | Coniochaetaligniaria (Grev.) Massee | 1 | 1 | |
| Hypocreales | ||||
| Cordycipitaceae | ||||
| Lecanicillium lecanii (Zimm.) Zare & W. Gams | 1 | 1 | ||
| Hypocreaceae | ||||
| Trichodermaviride Pers. | 1 | 1 | ||
| Nectriaceae | ||||
| Fusicollaaquaeductuum (Radlk. & Rabenh.) Gräfenhan, Seifert & Schroers | 1 | 1 | ||
| Ophiocordicipitaceae | ||||
| Tolypocladiumcylindrosporum W. Gams | 2 | 2 | ||
| T. inflatum W. Gams | 1 | 1 | ||
| Microascales | ||||
| Microascaceae | ||||
| Wardomyces sp. 1 | Pseudoscopulariopsishibernica (A. Mangan) Sandoval-Denis, Gené & Cano | 97, 98 | 7 | 3 |
| Hypocreales Incertae sedis | ||||
| Acremonium-like anam. sp. 2 | Acremoniumcharticola (Lindau) W. Gams | 90 | 1 | 1 |
| Sordariales | ||||
| Chaetomiaceae | ||||
| Chaetomium sp. | Chaetomiumglobosum Kunze ex Fr. | 91, 95, 98 | 3 | 3 |
| Ascomycete gen. sp. 4 | Chaetomium sp. E02 | 87, 91, 94 | 3 | 3 |
| Ascomycete gen. sp. 5 | Chaetomium sp. 6/97–55 | 94 | 1 | 1 |
| Xylariales | ||||
| Acremonim-like anam. sp. 1 | Xylariales sp. 1 | 91 | 3 | 2 |
| BASIDIOMYCOTA | ||||
| AGARICOMYCETES | ||||
| Agaricales | ||||
| Mycelia sterilia 6 | Psilocybe sp. KR22 | 95 | 1 | 1 |
| Cantharellales | ||||
| Beauveria-like anam. sp. 1 | Sistotremaraduloides (P. Karst.) Donk | 99 | 1 | 1 |
| Polyporales | ||||
| Mycelia sterilia 1 | Bjerkanderaadusta (Willd.) P. Karst. | 99 | 5 | 3 |
| Anamorphic gen. sp. 1 | Trametesversicolor (L.) Lloyd | 99 | 1 | 1 |
Морфологическое разнообразие
По морфологическим критериям выделено 48 морфотипов (табл. 1). Из них идентифицированы 17: большинство было представлено анаморфными спороношениями аскомицетов из родов Penicillium, Cladosporium, Tolypocladium, Aspergillus, Fusicolla, Pseudogymnoascus, Lecanicillium и Trichoderma; только вид Pseudeurotium hygrophilum образовывал телеоморфное спороношение. К идентифицированным этим методом морфотипам относились 72 выделенных изолята. Самым частым и обильным был род Penicillium – 44 колонии в 19 образцах. Чаще других встречались P. glabrum (21 колония в 10 образцах), P. aurantiogriseum (13 колоний в девяти образцах) и P. nalgiovense (6 колоний в четырех образцах). Видов рода Cladosporium (C. cladosporioides и C. macrocarpum) выделено 12 колоний в шести образцах, вида Aspergillus flavus – 8 колоний в трех образцах. Остальные виды встречались реже, а 11 из них – лишь как единичные колонии в отдельных образцах.
Остальные 56 изолятов относились к 31 неидентифицированному морфотипу (табл. 1). Из них 16 были стерильными; у шести обнаружены половые спороношения аскомицетов, у двух – анаморфные пикнидиальные спороношения и у семи – спороношения, похожие на анаморфы гифомицетного типа. Несмотря на то, что численность неидентифицированных изолятов была ниже, чем известных видов, их морфологическое разнообразие было выше.
Молекулярная идентификация и таксономическое разнообразие
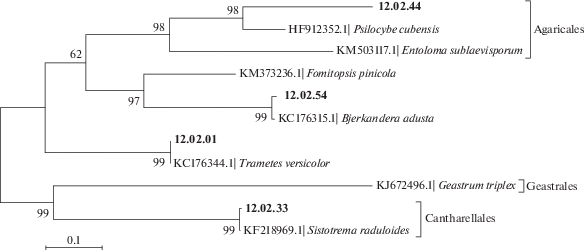
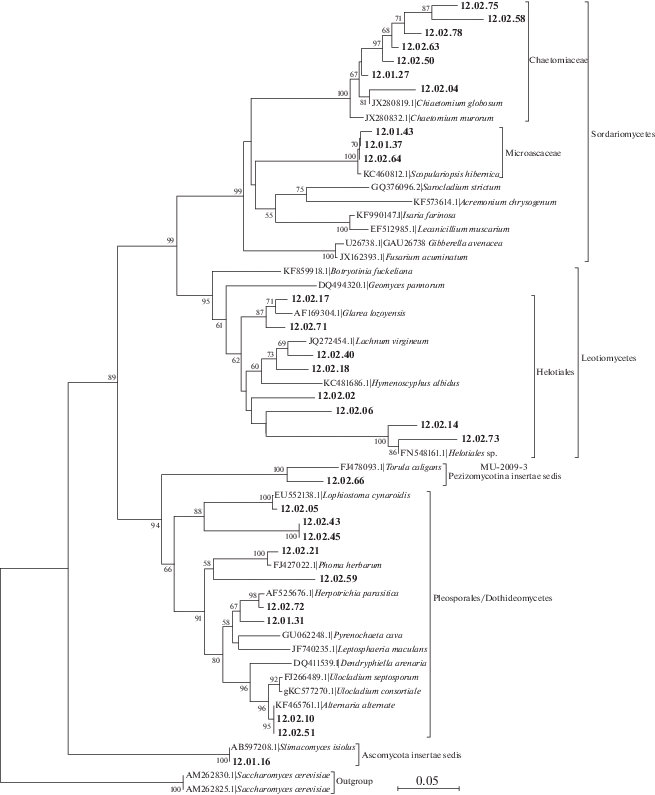
С помощью молекулярно-генетических методов идентифицировано 40 культур, относящихся к 31 сомнительному морфотипу. Соответствия в GenBank на уровне вида были найдены только для 14 (рис. 2, 3). Большинство идентифицированных до вида культур, кроме плеоспорового аскомицета Nematostoma parasiticum (Herpotrichia parasitica) и полипорового базидиомицета Bjerkandera adusta, имели какие-либо спороношения (табл. 1). Для 17 морфотипов соответствие найдено только на уровне рода или даже порядка. В некоторых случаях обнаружены соответствия филотипам, неизвестным ранее в виде морфотипов. Морфологически неидентифицированные морфотипы, как правило, были представлены единичными колониями в отдельных образцах, но иногда – несколькими колониями в 2–3 образцах. Чаще других встречались анаморфный аскомицет Pseudoscopulariopsis hibernica (7 колоний в трех образцах), базидиомицет B. adusta (5 колоний в трех образцах), Lachnum sp. FR-F3 (5 колоний в двух образцах), а также два вида рода Chaetomium (C. globosum и Chaetomium sp. E02) – всего 6 колоний в пяти образцах.
ОБСУЖДЕНИЕ
Численность выделенных грибов
Полученные нами значения численности пропагул грибов приблизительно соответствуют данным, известным для удаленных от берега районов Северного Ледовитого океана (Bubnova, 2010; Бубнова, Никитин, 2017). Ближе к берегу численность пропагул грибов обычно выше (Bubnova, 2010), как и в донных морских грунтах более теплых областей (Согонов, Марфенина, 1999; Худякова и др., 2000; Пивкин и др., 2005; Бубнова, 2009). Большая численность пропагул грибов в океане связана с близостью к берегу и с наличием постоянного пресного стока. Образцы для нашего исследования были отобраны на некотором удалении от берега, а пресный сток в Чукотское море меньше, чем в другие арктические моря. Поэтому низкая численность грибных пропагул была предполагаемой. Неожиданным стало отсутствие заметного градиента численности грибных пропагул в направлении север–юг. Мы полагали, что южный район будет богаче за счет обмена с Тихим океаном через Берингов пролив (Зенкевич, 1963; Johansen, Hytteborn, 2001). Известно, что моря умеренной зоны Тихого океана богаты грибами (Худякова и др., 2000; Пивкин и др., 2005). Но, вероятно, принос материала, в частности спор грибов, в южный район Чукотского моря не столь значителен, как предполагалось. Другим объяснением может служить низкая выживаемость приносимых с юга грибных пропагул в суровых условиях Арктики.
Таксономическое разнообразие микобиоты
В целом картина идентифицированной морфологическими методами микобиоты характерна для донных грунтов северных морей (Согонов, Марфенина, 1999; Бубнова, 2009; Bubnova, 2010; Бубнова, Никитин, 2017), в том числе присутствие большого количества стерильных и сомнительных культур (Rämä et al., 2017).
С помощью морфолого-культуральных и молекулярных методов обнаружено 32 вида грибов. В таксономической структуре выделенной микобиоты присутствовали представители двух отделов: базидиомицеты (3 порядка из одного класса) и аскомицеты (11 порядков из четырех классов), а также одна группа неясного таксономического положения. Аскомицеты преобладали как по числу выделенных изолятов, так и по количеству морфотипов. Наиболее обильными были виды порядка Eurotiales, незначительно уступали им виды порядков Helotiales и Pleosporales. По разнообразию также лидировал порядок Eurotiales, заметное разнообразие демонстрировали порядки Helotiales и Pleosporales, а также Hypocreales и Sordariales. Обнаружение высокого разнообразия плеоспоровых и хелоциевых, к которым относится большое число стерильных и неидентифицированных изолятов, связано с применением молекулярных методов. Вероятно, хелоциевые играют значительную, но пока недооцененную роль в арктических морских экосистемах. Они, как правило, редки в морфолого-культуральных исследованиях, но применение молекулярных методов показывает их относительно высокое таксономическое разнообразие и численность (Zhang et al., 2015; Rämä et al., 2017). Представители отдела Basidiomycota – минорный компонент общего видового комплекса, обнаруженный лишь с помощью молекулярных методов.
Аутэкология выделенных грибов
Все обнаруженные нами грибы можно разделить на две большие группы: это обычные в различных морских экотопах и упоминаемые в многочисленных публикациях по исследованию морской микобиоты виды, а также странные “гости”, впервые найденные в океане. К первой группе относятся в основном обильно спороносящие анаморфы аскомицетов, идентифицированные по морфологическим признакам. Все они типичные обитатели почв и других субстратов (Domsch et al., 1993), часто встречаются и в морских экотопах (Согонов, Марфенина, 1999; Худякова и др., 2000; Пивкин и др., 2005; Бубнова, 2009; Bubnova, 2010; Кирцидели и др., 2012); некоторые из них выявлены молекулярными методами (Nagano et al., 2010; Rämä et al., 2017). Интересно, что большинство этих грибов не имеет явной приуроченности к холодным областям, возможно, их поступление связано не с речным стоком, а с течением из Тихого океана.
Вторая группа – это грибы, выделенные в основном в виде стерильных изолятов и идентифицированные молекулярными методами (табл. 2). Информация о большинстве из них скудна, а география распространения широкая и неоднородная; некоторые ранее были известны только в виде филотипов из молекулярных исследований. Многие из этих грибов связаны с высшими растениями – как ксилотрофы, паразиты или эндофиты (табл. 2). Возможно, именно растительные остатки (от фрагментов древесины до микроскопических обрывков травы и листьев) обеспечивают возможность столь дальних путешествий данных грибов через Тихий океан, от Антарктики и Австралии до Арктики. Скорее всего, именно Тихий океан мог стать источником этих интересных видов. В настоящее время слишком мало информации о биоразнообразии микобиоты в разных географических точках и много изолятов, не соответствующих ни одному из описанных видов, поэтому ареалы обнаруженных грибов кажутся разорванными.
Таблица 2.
Сведения о грибах, идентифицированных с помощью молекулярных методов
| Вид | Распространение | Литература | Номер в GenBank |
|---|---|---|---|
| ASCOMYCOTA | |||
| Slimacomyces isiolus | Растительные остатки (Новая Гвинея, Китай) | Moore, 1957; Zhao et al., 2007 | AB597208 |
| Сосновый опад (Хоккайдо, Япония) | GenBank, не опубликовано (Hirose D., Tokumasu S., Ogawa Y.) | AB620068 | |
| Lasiodiplodia pseudotheobromae | Паразит на различных деревьях: цитрусовые, акация, кофе (Нидерланды, Коста-Рика); Grevillea robusta, Кения | Alves et al., 2008; GenBank, не опубликовано (Njuguna J.W., Barklund P., Ihrmark K., Stenlid J.) | FJ904834 |
| Nematostoma parasiticum | Паразит на хвойных (Северная Африка, Польша, Германия) | Rossman et al., 2002; Kowalski, Andruch, 2010 | AF525676 |
| Lophiostoma cynaroidis | Паразит цветковых в кустарниковых экосистемах типа “финбош” (Южная Африка) | Marincowitz et al., 2008 | EU552138 |
| Fungal sp. MG20Sn7L3x | Эндофит гипсофильных растений | Porras-Alfaro et al., 2011 | KF752699 |
| Uncultured fungus clone CMH252 | Внутренняя среда помещений (Канзас, США) | Rittenour et al., 2014 | KF800343 |
| Uncultured fungus clone S238 | Воздушная пыль | Fröhlich-Nowoisky et al., 2009 | FJ820726 |
| Uncultured fungus clone S352 | Воздушная пыль | Fröhlich-Nowoisky et al., 2009 | FJ820839 |
| Uncultured soil fungus clone RS5M5c23P | Почва полузасушливых лугов | Porras-Alfaro et al., 2011 | EU479983 |
| Cadophora sp. AU_BD06 | Неизвестно | GenBank, не опубликовано (Griffith G.) | JN995648 |
| Cyathicula sp. 34_100A | Озимая пшеница Triticum aestivum | GenBank, не опубликовано (M. Grudzinska-Sterno, A. Djurle, J. Yuen, J. Stenlid) | KC989059 |
| Hymenoscyphus sp. FC-2727 | Неизвестно | GenBank, не опубликовано (Zhao Y.J., Hosoya T., Baral H.O., Hosaka K., Kakishima K.) | AB705232 |
| Helotiales sp. WMM-2012c isolate 24m | Плато Цинхай-Тибет, психрофильные сообщества | GenBank, не опубликовано (Wang M.) | JX001621 |
| Lachnum sp. FR-F3 | Deschampsia flexuosa, субарктические острова | GenBank, не опубликовано (Poosakkannu A., Nissinen R., Kytoviita M.-M.) | KJ529001 |
| Uncultured Lachnum clone R2_17 | Озимая пшеница Triticum aestivum | GenBank, не опубликовано (Grudzinska-Sterno M., Djurle A., Yuen J., Stenlid J.) | KC753434 |
| Helotiales sp. MU-2009-3 | Листья бука Fagus sylvatica | Unterseher, Schnittler, 2010 | FN548161 |
| Thelebolus microsporus | Птичий помет, птичьи базары, вероятно, паразит. Психрофил (Антарктика) | Leotta et al., 2002; De Hoog et al., 2005 | AY942191.1 |
| Thelebolus stercoreus | Птичий помет, птичьи базары. Психрофил (Антарктика) | De Hoog et al., 2005 | AY942194 |
| Scopulariopsis hibernica | Почвы различных регионов | Sandoval-Denis et al., 2016 | FJ946484 |
| Chaetomium sp. E02 | Семена Puccinellia distans | GenBank, не опубликовано | KC867277 |
| Chaetomium sp. 6/97–55 | Корни, стебли, листья обыкновенного тростника Phragmites australis | Wirsel et al., 2001 | AJ279466 |
| Coniochaeta lignaria | Паразит или эндофит древесины | Damm et al., 2010 | AJ496242 |
| BASIDIOMYCOTA | |||
| Psilocybe sp. KR22 | Корни Pinus sylvestris | Menkis, Vasaitis, 2011 | HM036648 |
| Sistotrema raduloides | Сапротроф на древесине (Финляндия) | Kotiranta, Larsson, 2013 | KF218969 |
| Bjerkandera adusta | Обычный в почве и на древесине; обнаружен в антарктических почвах | Thorn et al., 1996; GenBank, не опубликовано (Vasilenko et al.) | MF120203 |
Примечание. Сведения об идентифицированных видах приведены по статьям, ссылка на которые имеется в GenBank. Кроме того, если о распространении вида есть обзорные сведения в литературе, то они также приводятся. Для филотипов, идентифицированных на уровне рода или порядка, приведены сведения только из GenBank.
Таким образом, в результате проведенного исследования установлено, что микобиота донных грунтов сурового арктического Чукотского моря несет в себе черты, характерные для изученных ранее арктических морей. Это крайне низкая численность грибных пропагул, обилие представителей рода Penicillium и неспороносящих изолятов. С помощью молекулярно-генетических методов определено систематическое положение неспороносящих и других сомнительных культур, что существенно расширило представление о таксономической структуре изученной микобиоты. В частности, были обнаружены представители групп Basidiomycota, а также Pleosporales и Helotiales из аскомицетов, которые были весьма разнообразны. Интересно, что заметная часть идентифицированных грибов известна из разных местообитаний от Антарктиды и Австралии до Китая и Японии, но неизвестна из Арктики. Исходя из этого, можно предположить, что течение из Тихого океана оказывает влияние на микобиоту арктических морей, обогащая ее. Некоторые из принесенных видов могут сохраняться и, возможно, развиваться в условиях Арктики.
Авторы выражают глубокую признательность коллегам, собравшим материал для этой работы: к. г. н., н. с. А. Босину и н. с. А. Колеснику из Тихоокеанского океанологического института ДВО РАН (Владивосток), а также д. б. н., с. н. с. К. Кособоковой из Института океанологии РАН (Москва).
Работа выполнена при поддержке РФФИ (грант № 15-04-02722а, морфологическая идентификация культур, частично – молекулярная идентификация и обработка) и РНФ (проект 14-50-00029, частично – молекулярная идентификация и обработка).
Список литературы
Бубнова Е.Н. Грибы донных грунтов Кандалакшского залива Белого моря // Микология и фитопатология. 2009. Т. 43. Вып. 4. С. 4–11.
Бубнова Е.Н., Никитин Д.А. Грибы в донных грунтах Баренцева и Карского морей // Биол. моря. 2017. Т. 43. № 5. С. 366–371.
Зенкевич Л.А. Биология морей СССР. М.: Изд-во АН СССР. 1963. 739 с.
Кирцидели И.Ю., Власов Д.Ю., Баранцевич Е.П. и др. Распространение терригенных микромицетов в водах арктических морей // Микология и фитопатология. 2012. Т. 46. Вып. 5. С. 306–310.
Пивкин М.В., Худякова Ю.В., Кузнецова Т.А. и др. Грибы аквапочв прибрежных акваторий Японского моря в южной части Приморского края // Микология и фитопатология. 2005. Т. 39. Вып. 6. С. 50–61.
Согонов М.В., Марфенина О.Е. Особенности микобиоты приморских маршей Кандалакшского залива Белого моря // Вестн. МГУ. Сер. 16 (Биология). 1999. № 3. С. 42–47.
Худякова Ю.В., Пивкин М.В., Кузнецова Т.А., Светашев В.И. Грибы грунтов Японского моря (российское побережье) и их биологически активные метаболиты // Микробиология. 2000. Т. 69. № 5. С. 722–726.
Alves A., Crous P.W., Correia A., Philips A.J.L. Morphological and molecular data reveal cryptic speciation in Lasiodiplodia theobromae // Fungal Diversity. 2008. V. 28. P. 1–13.
Bubnova E.N. Fungal diversity in bottom sediments of the Kara Sea // Bot. Mar. 2010. V. 53. № 6. P. 595–600.
Carlile M.J., Watkinson S.C., Gooday G.W. The fungi: 2nd ed. Academic Press. 2001. 603 p.
Damm U., Fourie P.H., Crous P.W. Coniochaeta (Lecythophora), Collophora gen. nov. and Phaeomoniella species associated with wood necroses of Prunus trees // Persoonia. 2010. V. 24. P. 60–80.
De Hoog G.S., Göttlich E., Platas G. et al. Evolution, taxonomy and ecology of the genus Thelebolus in Antarctica // Stud. Mycol. 2005. V. 51. P. 33–76.
Domsch K.H., Gams W., Anderson T.-H. Compendium of soil fungi. Eching: IHW-Verlag. 1993. 1007 p.
Edgar R.C. MUSCLE: multiple sequence alignment with high accuracy and high throughput // Nucleic Acids Res. 2004. V. 32. № 5. P. 1792–1797.
Felsenstein J. Confidence limits on phylogenies: an approach using the bootstrap // Evolution. 1985. V. 39. P. 783–791.
Fröhlich-Nowoisky J., Pickersgill D.A., Després V.R., Pöschl U. High diversity of fungi in air particulate matter // Proc. Natl. Acad. Sci. U.S.A. 2009. V. 106. № 31. P. 12 814–12 819.
Johansen S., Hytteborn H. A contribution to the discussion of biota dispersal with drift ice and driftwood in the North Atlantic // J. Biogeogr. 2001. V. 28. P. 105–115.
Kotiranta H., Larsson K.-H. Sistotrema luteoviride sp. nov. (Cantharellales, Basidiomycota) from Finland // Acta Mycol. 2013. V. 48. № 2. P. 219–225.
Kowalski T., Andruch K. Herpotrichia needle browning on Abies alba in the Lesko forest district stands: disease intensity and associated fungi // Phytopathologia. 2010. V. 55. P. 21–34.
Leotta G.A., Paré J.A., Sigler L. et al. Thelebolus microsporus mycelial mats in the trachea of wild brown skua (Catharacta antarctica lonnbergi) and South Polar skua (C. maccormicki) carcasses // J. Wildl. Dis. 2002. V. 38. № 2. P. 443–447.
Marchenko N. Russian arctic seas: navigation conditions and accidents. Berlin; Heidelberg: Springer-Verlag. 2012. 251 p.
Marincowitz S., Crous P.W., Groenewald J.Z., Wingfield M.J. Microfungi occurring in Proteaceae in the fynbos // CBS Biodiversity Ser. Utrecht, The Netherlands. 2008. V. 7. P. 1–166.
Menkis A., Vasaitis R. Fungi in roots of nursery grown Pinus sylvestris: ectomycorrhizal colonisation, genetic diversity and spatial distribution // Microb. Ecol. 2011. V. 61. № 1. P. 52–63.
Moore R.T. Index to the Helicosporae: addenda // Mycologia. 1957. V. 49. № 4. P. 580–587.
Nagano Y., Nagahama T., Hatada Y. et al. Fungal diversity in deep-sea sediments – the presence of novel fungal groups // Fungal Ecol. 2010. V. 3. P. 316–325.
Porras-Alfaro A., Herrera J., Natvig D.O. et al. Diversity and distribution of soil fungal communities in a semiarid grassland // Mycologia. 2011. V. 103. № 1. P. 10–21.
Rämä T., Hassett B.T., Bubnova E. Arctic marine fungi: from filaments and flagella to operational taxonomic units and beyond // Bot. Mar. 2017. V. 60. № 4. P. 433–452.
Rittenour W.R., Ciaccio C.E., Barnes C.S. et al. Internal transcribed spacer rRNA gene sequencing analysis of fungal diversity in Kansas City indoor environments // Environ. Sci.: Processes Impacts. 2014. V. 16. № 1. P. 33–43.
Rossman A.Y., Farr D.F., Castlebury L.A. et al. Setomelanomma holmii (Pleosporales, Phaeosphaeriaceae) on living spruce twigs in Europe and North America // Can. J. Bot. 2002. V. 80. № 11. P. 1209–1215.
Sandoval-Denis M., Gené J., Sutton D.A. et al. Redefining Microascus, Scopulariopsis and allied genera // Persoonia. 2016. V. 36. P. 1–36.
Tamura K., Nei M., Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method // Proc. Natl. Acad. Sci. U.S.A. 2004. V. 101. P. 11 030–11 035.
Tamura K., Stecher G., Peterson D. et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0 // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Thorn R.G., Reddy C.A., Harris D., Paul E.A. Isolation of saprophytic basidiomycetes from soil // Appl. Environ. Microbiol. 1996. V. 62. № 11. P. 4288–4292.
Unterseher M., Schnittler M. Species richness analysis and ITS rDNA phylogeny revealed the majority of cultivable foliar endophytes from beech (Fagus sylvatica) // Fungal Ecol. 2010. V. 3. № 4. P. 366–378.
Wirsel S.G.R., Leibinger W., Ernst M., Mendgen K.W. Genetic diversity of fungi closely associated with common reed // New Phytol. 2001. V. 149. № 3. P. 589–598.
Zhang T., Wang N.F., Zhang Y.Q. et al. Diversity and distribution of fungal communities in the marine sediments of Kongsfjorden, Svalbard (High Arctic) // Sci. Rep. 2015. Vol. 5. № 14524. P. 1–11.
Zhao G.Z., Liu X.Z., Wu W.P. Helicosporous hyphomycetes from China // Fungal Diversity. 2007. V. 26. P. 313–524.
Дополнительные материалы отсутствуют.