Биология моря, 2019, T. 45, № 2, стр. 108-113
Жирные кислоты медуз Aurelia aurita (Linnaeus, 1758) и Rhopilema esculentum (Kishinouye, 1981): присутствие семейств полиеновых кислот c 24 и 26 углеродными атомами
В. И. Светашев *
Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: vsvetashev@mail.ru
Поступила в редакцию 22.05.2018
После доработки 18.10.2018
Принята к публикации 18.10.2018
Аннотация
В липидах сцифоидных медуз из Японского моря Aurelia aurita (Linnaeus, 1758) и Rhopilema esculentum (Kishinouye, 1891) наряду с обычными жирными кислотами (ЖК), характерными для морских организмов, обнаружены высокие концентрации полиненасыщенных ЖК (ПНЖК) с 24 и 26 углеродными атомами. Основными ПНЖК у A. aurita и Rh. esculentum были 20:5(n–3), 22:6(n–3), 24:6(n–3) и 22:5(n–3). Кроме этого, у Rh. esculentum впервые найдено 1.6% таких ПНЖК, как C26:7(n–3), C26:6(n–3) и C26:5(n–3). Несмотря на сходный уровень ПНЖК у A. aurita и Rh. esculentum (соответственно 65.95 и 58.79%), соотношение ЖК (n–3)/(n–6) семейств у первого вида было в 7 раз выше, чем у второго. Насыщенные кислоты (26.57% – у A. aurita и 31.75% – у Rh. esculentum) были представлены пальмитиновой и стеариновой кислотами. Содержание мононенасыщенных ЖК, включавших компоненты С16 и С18, у обоих видов было низким и не превышало 10%. Наиболее интересны данные о присутствии необычных семейств ПНЖК с 24 и 26 углеродными атомами и о различии содержания ЖК (n–3) и (n–6) у видов, обитающих в близких условиях.
Сцифоидные медузы по ряду характеристик сильно отличаются от большинства других беспозвоночных. В первую очередь, это высокое содержание воды (>95%), а также низкое содержание органического углерода и азота в организме (Larson, 1986). Ранее считалось, что медузы являются тупиком в пищевой цепи, но в настоящее время известно более ста видов рыб и других животных, которые иногда или постоянно питаются медузами (Pauly et al., 2009). У медуз короткий жизненный цикл, обычно менее года, но при этом они могут достигать размера 2 м и массы 200 кг. При вспышке численности медузы наносят заметный вред ихтиофауне морей, поедая личинок и молодь рыб. Массовая гибель медуз осенью приводит к органическому заражению прибрежных вод. В Юго-Восточной Азии существует многовековая традиция использования некоторых видов медуз в пищу (Hsieh et al., 2001).
Медузы – интересный объект для изучения биохимии липидов. В составе их фосфолипидов (ФЛ) содержится необычный фосфолипид церамидаминоэтилфосфонат, в котором фосфор присутствует в виде фосфоната, а не фосфата. Этот ФЛ ранее был обнаружен и у некоторых других беспозвоночных (Mochidis, 1985). Сведения о составе жирных кислот (ЖК) медуз немногочисленны и противоречивы. В первых работах, систематизированых Дж. Джозеф (Joseph, 1979), было показано, что у обычных североатлантических видов Aurelia aurita и Rhopilema esculentum они представлены преимущественно полиненасыщенными ЖК (ПНЖК): эйкозапентаеновой (ЭПК), докозагексаеновой (ДГК) и арахидоновой (АК). Позднее стало известно (Nichols et al., 2003) об обнаружении у A. аurita высокой концентрации тетракозагексаеновой кислоты (ТГК) 24:6(n–3). Однако эти сведения не были подтверждены (Holland et al., 1990; Fukuda, Naganuma, 2001; Mortillaro et al., 2009). Опубликованы экспериментальные данные о том, что в клеточной культуре ТГК сильнее подавляла синтез триглицеридов и эфиров стеринов, чем ЭПК, ДГК и докозапентаеновая кислота (Nagao et al., 2014). В настоящей работе приведены данные о высоком уровне ТГК в липидах двух видов сцифоидных медуз, а также о нахождении в них других ПНЖК с 24 и 26 углеродными атомами.
МАТЕРИАЛ И МЕТОДИКА
В работе использованы по три экземпляра медуз Aurelia aurita (Linnaeus, 1758) и Rhopilema esculentum (Kishinouye, 1891) с диаметром купола соответственно 15–20 и 30–35 см. Животных собирали в прибрежной части Амурского залива (Японское море) 1 октября 2013 г. при температуре воды 10°С. Собранных медуз гомогенизировали в блендере; на экстракцию брали 35 г гомогената; липиды выделяли по методу Блайя и Дайера (Bligh, Dyer, 1959). Содержание липидов в образце определяли после упаривания экстракта до постоянной массы в вакууме. Липиды растворяли в хлороформе и хранили для анализа под аргоном при температуре –18°С. Метиловые эфиры жирных кислот (МЭЖК) получали переэтерификацией в 1% (об/об) серной кислоте в метаноле при 90°С в течение 90 мин. МЭЖК экстрагировали гексаном, очищали методом тонкослойной хроматографии (ТСХ) в бензоле и анализировали на хроматографе GC 2010 (Shimadzu, Japan) с колонками Supelcowax 10 и Equity-5 (обе колонки 30 м, внутренний диаметр 0.25 мм, толщина фазы 0.25 мкм; Supelco, USA). Количественный анализ выполняли на колонке Equity-5 в следующей температурной программе: 160–260°C, 2 град/мин; 25 мин при 260°С. Идентификацию ЖК проводили по стандартам (MEFA 37, Supelco, USA), “углеродным числам” (Stransky et al., 1997), а также с использованием ГХ–МС метиловых эфиров и диметилоксазолиновых (ДМОКC) производных ЖК (Svetashev, 2011). Условия анализа ДМОКС-производных ЖК опубликованы ранее (Svetashev, Kharlamenko, 2015). Масс-спектры сравнивали со спектрами, приведенными в NIST library 2.0, на интернет-сайте The LipidWeb (2016) и в указанной выше работе (Svetashev, Kharlamenko, 2015). Результаты анализа жирных кислот и общих липидов представлены как среднее значение ± стандартное отклонение (n = 3).
РЕЗУЛЬТАТЫ
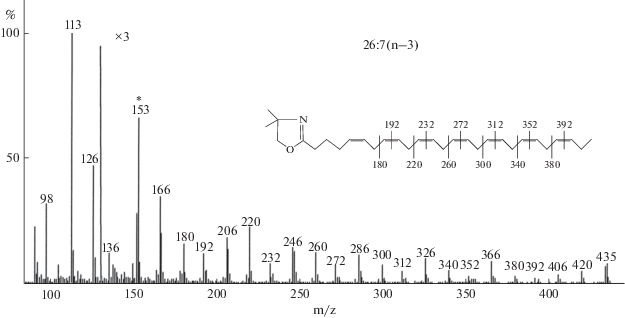
Согласно полученным данным (табл. 1), в медузах Aurelia aurita и Rhopilema esculentum общее содержание липидов (ОЛ) было низким и составляло соответственно 0.13 и 0.14% на сырую массу. Содержание насыщенных (НЖК), мононенасыщенных (МНЖК) и полиненасыщенных (ПНЖК) жирных кислот у обоих видов оказалось сходным: 26.57–31.75, 7.48–9.46 и 65.95–58.79% соответственно. Главными насыщенными ЖК были 16:0 и 18:0, содержание каждой составляло около 10–12.5%. Мононенасыщенные ЖК были представлены кислотами 16:1(n–10) и 16:1(n–7), а также изомерами 18:1(n–9), 18:1(n–7) и 18:1(n–5). Концентрация МНЖК варьировала от 0.2 до 3.3%, а доля кислот 20:1 и 22:1 не превышала 0.4%. В липидах A. aurita ПНЖК были представлены преимущественно ЭПК (33.3%), ДГК (11.2%), 22:5(n–3) (5.0%) и АК (1.8%). В липидах Rh. esculentum главными ПНЖК были ЭПК – 13.1%, ДГК – 12.6%, АК – 8.4%, 22:5(n–3) – 5.0% и 22:4(n–6) – 2.4%. Содержание ПНЖК у обоих видов было сходным (соответственно 65.95 и 58.79%), но соотношение ЖК (n–3)/(n–6) семейств у A. aurita в 7 раз превышало таковое у Rh. esculentum. Содержание отдельных С18 ПНЖК в обеих медузах было невысоким – 0.9–2.4%, но в сумме составляло 3.12–5.48%. Кроме перечисленных ПНЖК, обычных для морских организмов, липиды A. aurita и Rh. esculentum отличались высокой концентрацией редкой кислоты 24:6(n–3) – 9.5 и 6.0% соответственно. Наряду с ТГК у Rh. esculentum было обнаружено несколько новых для медуз компонентов c очень большим временем удерживания (рис. 1: пики А, Б, В). Данные масс-спектрометрии метиловых эфиров ЖК показали наличие молекулярных ионов при m/z 396, 398 и 400, соответствующих МЭЖК 26:7, 26:6 и 26:5. В спектрах также присутствовал ион с m/z 108, характерный для кислот серии (n–3). Основная информация по структурам получена с помощью ГХ–МС диметилоксазолиновых производных ЖК. Так, для пика А наличие иона М+ при m/z 435, характерного иона с m/z 153 и присутствие в спектре интервалов в 12 единиц массы (180–192, 220–232, 260–272, 300–312, 340–352, 380–392) указывало на положение двойных связей при 5, 8, 11, 14, 17, 20 и 23 атомах углерода, т.е. структура была определена как Δ5,8,11,14,17,20,23–26:7 (рис. 2). Аналогично для пика Б кислота 26:6(n–3) имела М+ при m/z 437 и интервалы при m/z 182–194, 222–234, 262–274, 302–314, 342–354, 382–394. Кислота 26:5(n–3) (пик В) имела М+ при m/z 439 и соответствующие интервалы при m/z 224–236, 264–276, 304–316, 344–356, 384–396. Таким образом, нами найдены три представителя С26 кислот (n–3) серии. В качестве примера приведен спектр ДМОКС производного кислоты 26:7(n–3) (рис. 2).
Таблица 1.
Жирные кислоты (% от общих ЖК) и содержание липидов (% на сырую массу) в медузах Aurelia aurita (1) и Rhopilema esculentum (2)
| № | ЖК | 1 | 2 |
|---|---|---|---|
| 1 | 14:0 | 1.48 ± 0.33 | 1.49 ± 0.25 |
| 2 | i-15:0 | 0.18 ± 0.02 | 0.36 ± 0.08 |
| 3 | 15:0 | 0.41 ± 0.05 | 0.48 ± 0.07 |
| 4 | 16:1(n–10) | 3.26 ± 0.37 | 1.33 ± 0.20 |
| 5 | 16:1(n–5) | 0.24 ± 0.00 | 2.00 ± 1.21 |
| 6 | 16:0 | 12.02 ± 0.78 | 12.47 ± 2.12 |
| 7 | 7-Me-16:1(n–10) | 0.12 ± 0.02 | 0.77 ± 0.17 |
| 8 | i-17:0 | 0.26 ± 0.02 | 0.40 ± 0.09 |
| 9 | a-17:0 | 0.13 ± 0.03 | 0.29 ± 0.14 |
| 10 | 17:0 | 1.10 ± 0.22 | 1.32 ± 0.12 |
| 11 | Фитановая | – | 0.50 ± 0.18 |
| 12 | 18:4(n–3) | 1.26 ± 0.13 | 2.38 ± 0.80 |
| 13 | 18:2(n–6) | 0.88 ± 0.10 | 1.77 ± 0.12 |
| 14 | 18:3(n–3) | 0.98 ± 0.14 | 1.43 ± 0.26 |
| 15 | 18:1(n–9) | 0.91 ± 0.16 | 2.02 ± 0.29 |
| 16 | 18:1(n–7) | 1.76 ± 0.13 | 2.70 ± 0.09 |
| 17 | 18:2(n–4) | 0.20 ± 0.02 | 0.24 ± 0.03 |
| 18 | 18:1(n–5) | 0.26 ± 0.03 | 0.15 ± 0.03 |
| 19 | 18:0 | 9.95 ± 0.75 | 12.63 ± 3.06 |
| 20 | 19:0 | 0.21 ± 0.03 | 0.59 ± 0.13 |
| 21 | 20:4(n–6) | 1.84 ± 0.06 | 8.39 ± 3.85 |
| 22 | 20:5(n–3) | 33.28 ± 0.80 | 13.05 ± 3.90 |
| 23 | 20:2(n–6) | – | 0.41 ± 0.06 |
| 24 | 20:3(n–3) | – | 0.59 ± 0.07 |
| 25 | 20:4(n–3) | 0.89 ± 0.18 | – |
| 26 | 20:1(n–9) | 0.38 ± 0.03 | 0.26 ± 0.07 |
| 27 | 20:1(n–7) | 0.15 ± 0.03 | 0.22 ± 0.09 |
| 28 | 20:0 | 0.13 ± 0.02 | 0.52 ± 0.12 |
| 29 | 21:5(n–3) | 0.45 ± 0.03 | 0.26 ± 0.01 |
| 30 | 22:5(n–6) | 0.11 ± 0.02 | 1.04 ± 0.91 |
| 31 | 22:6(n–3) | 11.20 ± 1.25 | 12.29 ± 1.97 |
| 32 | 22:4(n–6) | 0.26 ± 0.02 | 2.35 ± 1.96 |
| 33 | 22:5(n–3) | 5.03 ± 0.41 | 5.07 ± 1.54 |
| 34 | 22:1(n–11) | 0.40 ± 0.09 | – |
| 35 | 22:0 | 0.19 ± 0.01 | 0.24 ± 0.09 |
| 36 | 24:5(n–6) | 0.00 ± 0.00 | 0.44 ± 0.24 |
| 37 | 24:6(n–3) | 9.48 ± 1.00 | 6.00 ± 1.96 |
| 38 | 24:4(n–6) | 0.00 ± 0.00 | 0.69 ± 0.62 |
| 39 | 24:5(n–3) | 0.10 ± 0.01 | 0.31 ± 0.06 |
| 40 | 24:4(n–3) | 0.00 ± 0.00 | 0.47 ± 0.17 |
| 41 | 24:0 | 0.50 ± 0.11 | 0.48 ± 0.20 |
| 42 | 26:7(n–3) | – | 0.55 ± 0.27 |
| 43 | 26:6(n–3) | – | 0.44 ± 0.16 |
| 44 | 26:5(n–3) | – | 0.63 ± 0.39 |
| НЖК | 26.57 | 31.75 | |
| МНЖК | 7.48 | 9.46 | |
| ПНЖК | 65.95 | 58.79 | |
| (n–3)/(n–6) | 20.29 | 2.88 | |
| ∑C24 ПНЖК | 9.58 | 7.90 | |
| ∑C26 ПНЖК | 0.00 | 1.62 | |
| Липиды, % | 0.13 ± 0.011 | 0.14 ± 0.012 |
Рис. 1.
Часть хроматограммы МЭЖК медузы Rhopilema esculentum, показывающая присутствие ПНЖК с 24 и 26 углеродными атомами. Буквами А, Б и В обозначены кислоты 26:7(n–3), 26:6(n–3) и 26:5(n–3) соответственно. Условия анализа приведены в экспериментальной части.
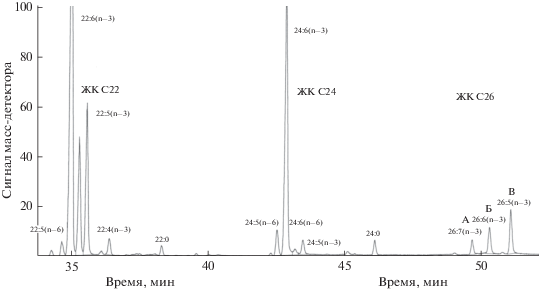
Рис. 2.
Масс-спектр ДМОКС производного кислоты 26:7(n–3) (пик А на рис. 1). Характеристический пик с m/z 153, а также наличие пар пиков 180–192, 220–232, 260–272, 300–312, 340–352 и 380–392 соответствуют структуре ∆5,8,11,14,17,20,23–26:7.
ОБСУЖДЕНИЕ
Исследования состава ЖК сцифоидных медуз (Sipos, Ackman, 1968; Hooper et al., 1973; Holland et al., 1990; Nelson, et al., 2000; Fukuda, Naganuma, 2001; Nichols et al., 2003; Morais et al., 2009, Mortillaro et al., 2009; Ying et al., 2012; Leone et al., 2015; Zhu et al., 2015) связаны, главным образом, с изучением роли медуз в пищевых цепях. В составе липидов медуз обнаружен ряд специфических ЖК. Маркерными ЖК медуз можно назвать кислоты 7-метил-16:1(n–10) и 16:1(n–10); для этих животных может быть типичным высокий уровень ЖК 22:5(n–3). Из ПНЖК главными являются ЭПК, ДГК и АК. Наши данные по составу основных компонентов сходны с известными для A. aurita и Cyanea lamarcki (Holland et al., 1990; Nichols et al., 2003; Ying et al., 2012).
Среди работ, посвященных изучению ЖК медуз, только в двух статьях упоминается присутствие ТГК 24:6(n–3). Впервые эту ЖК в медузе A. aurita обнаружили австралийские ученые (Nichols et al., 2003), они же установили ее строение. Позднее ТГК была найдена в медузе Catostylus tagi (Morais et al., 2009). Показано, что ТГК локализована в фосфатидилсерине и фосфатидилинозите (Zhu et al., 2015). Очевидно, главной причиной столь редкого обнаружения является очень долгое время выхода ТГК на полярных колонках на основе карбовакса (Carbowax). Так, при анализе МЭЖК A. aurita на полярной колонке Supelcowax при температуре 205оС кислота 22:6(n–3) выходит на 49-й мин, а кислота 24:6(n–3) – на 86-й мин. Соответственно, для обнаружения кислоты 26:7(n–3) потребуется несколько часов. Выходом может быть использование для анализа неполярных колонок и программирование температуры.
ПНЖК с очень большой длиной цепи (С24, С26 и более длинные) распространены в морских организмах (Suo et al., 2015). Наиболее известны примеры Cnidaria и Echinodermata. У всех представителей восьмилучевых кораллов обнаружены тетракозаполиеновые кислоты, причем их концентрация в общих липидах у некоторых видов достигала 22% (Svetashev, Vysotskii, 1998). У иглокожих от 4 до 9.5% ТГК было найдено в липидах представителей Crinoidea и Ophiuroidea (Takagi et al., 1986). Семейство С26 ПНЖК ранее было обнаружено в глубоководных офиурах (Svetashev, Kharlamenko, 2015). Таким образом, ЖК с длиной цепи С24 и С26, вероятно, имеют более широкое распространение, чем известно в настоящее время.
Список литературы
Bligh E.G., Dyer W.J. A rapid method of total lipid extraction and purification // Can. J. Biochem. Physiol. 1959. V. 37. P. 911–917.
Fukuda Y., Naganuma T. Potential dietary effects on the fatty acid composition of the common jellyfish Aurelia aurita // Mar. Biol. 2001. V. 138. P. 1029–1035.
Holland D.L., Davenport J., East J. The fatty acid composition of the leatherback turtle Dermochelys coriacea and its jellyfish prey // J. Mar. Biol. Assoc. U.K. 1990. V. 70. P. 761–770.
Hooper S.N., Paradis M., Ackman R.G. Distribution of trans-6-hexadecenoic acid, 7-methyl-7-hexadecenoic acid and common fatty acids in lipids of the ocean sunfish Mola mola // Lipids. 1973. V. 8. P. 509–516.
Hsieh Y.-H.P., Leong F.M., Rudloe J. Jellyfish as food // Hydrobiologia. 2001. V. 451. P. 11–17.
Joseph J.D. Lipid composition of marine and estuarine invertebrates: Porifera and Cnidaria // Prog. Lipid Res. 1979. V. 18. P. 1–30.
Larson R.J. Water content, organic content, and carbon and nitrogen composition of medusae from the northeast Pacific // J. Exp. Mar. Biol. Ecol. 1986. V. 99. P. 107–120.
Leone A., Lecci R.M., Durante M. et al. The bright side of gelatinous blooms: nutraceutical value and antioxidant properties of three Mediterranean jellyfish (Scyphozoa) // Mar. Drugs. 2015. V. 13. P. 4654–4681.
Mochidis M.C. Phosphonolipids // Prog. Lipid Res. 1985. V. 23. P. 223–246.
Morais Z.B., Pintão A.M., Costa I.M. et al. Composition and in vitro antioxidant effects of jellyfish Catostylus tagi from Sado Estuary (SW Portugal) // J. Aquat. Food Prod. Technol. 2009. V. 18. P. 90–107.
Mortillaro J.M., Pitt K.A., Lee S.Y., Meziane T. Light intensity influences the production and translocation of fatty acids by zooxanthellae in the jellyfish Cassiopea sp. // J. Exp. Mar. Biol. Ecol. 2009. V. 378. P. 22–30.
Nagao K., Nakamitsu K., Ishida H. et al. Comparison of the lipid-lowering effects of four different n–3 highly unsaturated fatty acids in HepG2 cells // J. Oleo Sci. 2014. V. 63. P. 979–985.
Nelson M.M., Phleger C.F., Mooney B.D., Nichols P.D. Lipids of gelatinous Antarctic zooplankton: Cnidaria and Ctenophora // Lipids. 2000. V. 35. P. 551–559.
Nichols P.D., Danaher K.T., Koslow J.A. Occurrence of high levels of tetracosahexaenoic acid in the jellyfish Aurelia sp. // Lipids. 2003. V. 38. P. 1207–1210.
Pauly D., Graham W., Libralato S. et al. Jellyfish in ecosystems, online databases, and ecosystem models // Hydrobiologia. 2009. V. 616. P. 67–85.
Sipos J.C., Ackman R.G. Jellyfish (Cyanea capillata) lipids: fatty acid composition // J. Fish. Res. Board Can. 1968. V. 25. P. 1561–1569.
Stránsky K., Jursik T., Vitek A. Standard equivalent chain length values of monoenic and polyenic (methylene interrupted) fatty acids // J. High Resolut. Chromatogr. 1997. V. 20. P. 143–158.
Suo R., Li H., Yoshinaga K., Nagai T. et al. Generation of tetracosahexaenoic acid in benthic marine organisms // J. Oleo Sci. 2015. V. 64. P. 721–727.
Svetashev V.I. Mild method for preparation of 4,4-dimethyloxazoline derivatives of polyunsaturated fatty acids for GC–MS // Lipids. 2011. V. 46. P. 463–467.
Svetashev V., Kharlamenko V. Occurrence of hexacosapolyenoic acids 26:7(n–3), 26:6(n–3), 26:6(n–6) and 26:5(n–3) in deep-sea brittle stars from near the Kuril Islands // Lipids. 2015. V. 50. P. 691–696.
Svetashev V.I., Vysotskii M.V. Fatty acids of Heliopora coerulea and chemotaxonomic significance of tetracosapolyenoic acids in Coelenterates // Comp. Biochem. Physiol. Part B: Biochem. Mol. Biol. 1998. V. 119. P. 73–75.
Takagi T., Kaneniwa M., Itabashi Y. Fatty acids in Crinoidea and Ophiuroidea: occurrence of all-cis-6,9,12,15,18,21-tetracosahexaenoic acid // Lipids. 1986. V. 21. P. 430–433.
The LipidWeb. http://lipidhome.co.uk/ms/masspec.html. Accessed 22 Nov. 2016.
Ying C., Ying W., Jing Z., Na W. Potential dietary influence on the stable isotopes and fatty acid compositions of jellyfishes in the Yellow Sea // J. Mar. Biol. Assoc. U.K. 2012. V. 92. P. 1325–1333.
Zhu S., Ye M., Xu J. et al. Lipid profile in different parts of edible jellyfish Rhopilema esculentum // J. Agric. Food Chem. 2015. V. 63. P. 8283–8291.
Дополнительные материалы отсутствуют.


